Method Article
تسلسل إدراج الإرسال والاستقبال كأداة لتوضيح عوامل الاستعمار البكتيرية في بيركهولدريا غلاديولي سيمبيونت من خنافس لاغريا فيلوسا
In This Article
Summary
هذه طريقة مكيفة لتحديد عوامل استعمار الحشرات المرشحة في سيمبيونت مفيد Burkholderia. يتم إصابة مضيف الخنفساء بمكتبة متحولة عشوائية تم إنشاؤها عبر تولد الإرسال والاستقبال ، ويتم مقارنة تعقيد المكتبة بعد الاستعمار بعنصر تحكم ينمو في المختبر.
Abstract
والاستدلال على وظيفة الجينات عن طريق التلاعب بنشاطها أداة أساسية لفهم الأسس الوراثية لمعظم العمليات البيولوجية. وقد شهدت التطورات في علم الأحياء المجهرية الجزيئية ظهور تقنيات متنوعة للطفرات للتلاعب بالجينات. ومن بينها، فإن تسلسل إدخال الإرسال والاستقبال (Tn-seq) هو أداة قيمة لتقييم وظائف العديد من الجينات المرشحة بطريقة غير مستهدفة في وقت واحد. وكانت هذه التقنية أساسية لتحديد الآليات الجزيئية لاستعمار المضيفين eukaryotic في العديد من الميكروبات المسببة للأمراض وعدد قليل من symbionts مفيدة.
هنا ، يتم تأسيس Tn-seq كطريقة لتحديد عوامل الاستعمار في سيمبيونت Burkholderia gladioli المتبادل من خنفساء لاغريا فيلوسا. عن طريق اقتران, Tn5 يتم إدخال الإرسال والاستقبال بوساطة من كاسيت مقاومة للمضادات الحيوية في مواقع الجينوم عشوائي في B. gladioli. لتحديد تأثير اضطرابات الجينات على قدرة البكتيريا على استعمار مضيف الخنفساء ، يتم تلقيح مكتبة B. gladioli transposon-mutant المولدة على بيض الخنفساء ، في حين يتم زراعة عنصر التحكم في المختبر في وسط الثقافة السائلة. بعد إتاحة الوقت الكافي للاستعمار ، يتم استخراج الحمض النووي من المكتبات المزروعة في الجسم الحي وفي المختبر. بعد بروتوكول إعداد مكتبة الحمض النووي، يتم إعداد عينات الحمض النووي لتسلسل إدخال الإرسال والاستقبال. يتم اختيار شظايا الحمض النووي التي تحتوي على حافة إدراج الإرسال والاستقبال والحمض النووي البكتيري المحيط ، ويتم تحديد مواقع الطفرات عن طريق التسلسل بعيدا عن حافة إدراج الإرسال والاستقبال. وأخيرا ، من خلال تحليل ومقارنة ترددات كل متحولة بين المكتبات في الجسم الحي وفي المختبر ، يمكن التنبؤ بأهمية جينات سيمبيونت محددة أثناء استعمار الخنفساء.
Introduction
Burkholderia gladioli يمكن أن تشارك في ارتباط تكافلي مع الخنافس لاغريا villosa، ولعب دورا هاما في الدفاع ضد الخصوم الميكروبية من الحشراتالمضيفة 4،5،6. الخنافس الإناث منزل عدة سلالات من B. gladioli في الغدد المتخصصة التبعي للجهاز التناسلي. عند وضع البيض، الإناث تشويه B. خلايا غلاديولي على سطح البيض حيث مركبات مضادة للميكروبات التي تنتجها B. gladioli تمنع العدوى عن طريق الفطريات entomopathogenic4،6. خلال التطور الجنيني المتأخر أو في وقت مبكر بعد فقس اليرقات ، تستعمر البكتيريا الشقوق البطينية على السطح الظهري لليرقات. على الرغم من هذا التعريب المتخصصة وطريق النقل الرأسي من symbionts، L. villosa يمكن أن يفترض أيضا الحصول على B. gladioli أفقيا من البيئة4. وعلاوة على ذلك، تم العثور على ما لا يقل عن ثلاث سلالات من B. gladioli بالاشتراك مع L. villosa4،6. من بين هذه، B. غلاديولي لف-StA هو الوحيد الذي هو قابل للزراعة في المختبر.
ب. غلاديولي Lv-StA لديها حجم الجينوم من 8.56 ميغابايت6 ويحتوي على 7468 الجينات. أي من هذه الجينات مهمة لبكتيريا B. gladioli لاستعمار مضيف الخنفساء؟ للإجابة على هذا السؤال، استخدمنا تسلسل إدراج الإرسال والاستقبال (Tn-seq)، وهي طريقة استكشافية لتحديد الجينات الميكروبية الأساسيةالمشروطة 1و2و3. تم إنشاء مكتبة متحولة من B. gladioli Lv-StA باستخدام جهاز الإرسال والاستقبال Tn5. من خلال اقتران من الخلايا المانحة الإشريكية القولونية إلى B. gladioli Lv-StA، تم نقل بلازميد pRL27 يحمل جهاز الإرسال والاستقبال Tn5 وكاسيت مقاومة المضادات الحيوية محاط بتكرار مقلوب(الشكل 1). وبالتالي، تم إنشاء مجموعة من المسوخ التي تحمل بشكل فردي اضطرابات من 3736 جينات سيمبيونت(الشكل 2).
أصيب حمام السباحة المتحول على بيض الخنفساء لتحديد عوامل الاستعمار ، وكعنصر تحكم ، تم زراعته أيضا في المختبر في وسط King's B (KB). بعد إتاحة الوقت الكافي للاستعمار ، تم جمع اليرقات المفقسة وتجميعها لاستخراج الحمض النووي. تم اختيار أجزاء من الحمض النووي تحتوي على إدراج الإرسال والاستقبال والمنطقة الجينومية المحيطة ب B. gladioli Lv-StA باستخدام بروتوكول إعداد مكتبة الحمض النووي المعدل للتسلسل. تم إجراء معالجة جودة القراءة تليها تحليل مع DESeq2 لتحديد جينات محددة حاسمة بالنسبة ل B. gladioli Lv-StA لاستعمار يرقات L. villosa عند انتقالها عبر سطح البيض.
Protocol
1. وسائل الإعلام وإعداد العازلة
- إعداد كيلوبايت وLB وسائل الإعلام ولوحات أجار على النحو الوارد في الجدول 1، وautclave في 121 درجة مئوية ، 15 psi ، 20 دقيقة.
- إضافة 50 ميكروغرام / مل مرشح معقم kanamycin و 300 ميكرومتر مرشح معقمة 2,6-diaminopimelic حمض (DAP) إلى المتوسط LB autoclaved قبل زراعة E.coli WM3064 + pRL27.
- إضافة 50 ميكروغرام / مل مرشح المعقمة kanamycin إلى أجار KB autoclaved لصب لوحات اللازمة لاختيار ناجحة B. gladioli Lv-StA transconjugants.
- إعداد المالحة العازلة بالفوسفات (PBS) بمقدار 1x عن طريق خلط المكونات التالية: NaCl 8 g/L، KCl 0.201 g/L، Na2HPO4 1.42 g/L، وKH2PO4 0.272 g/L. حل الأملاح في الماء المقطر وautclave الخليط في 121 درجة مئوية، 15 psi، 20 دقيقة قبل الاستخدام. تخزين في درجة حرارة الغرفة.
- إعداد العازلة 2x ربط وغسل عن طريق حل المكونات التالية: 10 mM تريس-HCl (درجة الحموضة 7.5), 1 م إيثيلينديامين حمض رباعي الأسيتيك (EDTA), و 2 M NaCl في الماء المقطر. تصفية تعقيم الخليط قبل الاستخدام. تخزين في درجة حرارة الغرفة.
- إعداد 1x منخفضة TE عن طريق حل 10 mM تريس-HCl (درجة الحموضة 8.0) و 0.1 mM EDTA في الماء المقطر المزدوج. تعقيم عن طريق الالاستعباد التلقائي في 121 درجة مئوية، 15 psi، 20 دقيقة. تخزين في درجة حرارة الغرفة.
2. اقتران لتوليد مكتبة متحولة transposon
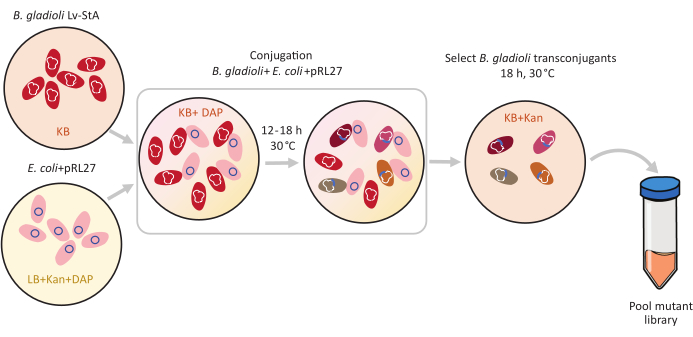
الشكل 1: خطوات بروتوكول اقتران. ويزرع المتلقي اقتران Burkholderia غلاديولي لف-StA (الأحمر) والمتبرع Escherichia القولونية التي تحتوي على pRL27 plasmid (الوردي) في أجار KB وLB, على التوالي, تستكمل مع kanamycin وDAP. بعد نقل اقتراني من البلازميد لمدة 12-18 ساعة في 30 درجة مئوية، يتم اختيار الخلايا العابرة للمتحولين B. غلاديولي على KB تحتوي على كاناميسين وتجمع معا. المختصرات: DAP = 2,6-حمض ديامينوبيميليك; كان = كاناميسين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تحت غطاء محرك السيارة العقيم، تلقيح ثقافة المانحين جديدة من الإشريكية القولونية WM3064 + pRL27 في 10 مل من LB المتوسطة تكملها kanamycin وDAP. تلقيح الخلايا المتلقية Burkholderia غلاديولي Lv-StA في 5 مل من كيلوبايت المتوسطة. احتضان الثقافات في 30 درجة مئوية بين عشية وضحاها على شاكر في 250 دورة في الدقيقة.
- بعد النمو بين عشية وضحاها، والطرد المركزي 4 مل من كل من الثقافات في 9600 × غرام لمدة 6 دقائق لبيليه الخلايا. تجاهل الناتنات الفائق.
- تحت غطاء محرك السيارة العقيم، اغسل ثقافات الخلايا الحبيبية في وسيط KB الذي يحتوي على DAP وأخيرا إعادة إنفاق الثقافات بشكل منفصل في 4 مل من كيلوبايت + DAP المتوسطة.
- في أنبوب جديد 15 مل، مزيج 250 ميكرولتر من خلايا E. القولونية المانحة غسلها مع 1 مل من غسلها B. غلاديولي لف-StA الخلايا المتلقية.
- بقعة 10 ميكرولتر من هذا الخليط الخلية اقتران على لوحات أجار كيلوبايت التي تحتوي على DAP. السماح للوح للراحة دون عائق في غطاء محرك السيارة العقيمة في درجة حرارة الغرفة لمدة 1 ساعة. ثم، احتضان لوحات مع البقع اقتران في 30 درجة مئوية لمدة 12-18 ساعة.
ملاحظة: يمكن تعديل فترة التوازم وفقا للأنواع المستهدفة. ومع ذلك، تزيد فترة اقتران طويلة من خطر الإدراج المزدوج أو دمج البلازميد في الجينوم. بالنسبة للبكتيريا البطيئة النمو، اسمح لفترات اقتران أطول. - بعد الحضانة، إضافة 2-4 مل من برنامج تلفزيوني 1x في لوحات تحت غطاء محرك السيارة العقيم واستخدام مكشطة الخلية للافراج عن البقع التضمين البكتيرية نمت من أجار. ماصة مزيج الخلية المترافقة في أنابيب الميكروفون 2 مل.
- بيليه الخلايا عن طريق الطرد المركزي في 9600 × غرام لمدة 2 دقيقة. تجاهل supernatant وغسل بيليه مرتين في 1 مل من برنامج تلفزيوني 1x عن طريق pipetting صعودا وهبوطا. Resuspend بيليه النهائي في 1200 ميكرولتر من برنامج تلفزيوني 1x. جعل التخفيفات قبل الطلاء إذا كان عدد الخلايا في الخليط هو فوق 1 × 104.
- تخلط جيدا وتنتشر 200 ميكرولتر من خليط الخلية على لوحات كبيرة كيلوبايت أجار (6 أو أكثر، إذا لزم الأمر) تكملها kanamycin واحتضان في 30 درجة مئوية بين عشية وضحاها.
ملاحظة: تظهر المستعمرات المتحولة المستهدفة في غضون 30 ساعة على لوحات أجار انتقائية. بسبب علامة مقاومة المضادات الحيوية ، تظهر المستعمرات المتحولة فقط على لوحة أجار انتقائية. لذلك، من المتوقع أن تكون جميع المستعمرات محولات ناجحة. - عد العدد الإجمالي للمستعمرات العابرة على ثلاث لوحات واستقراء لحساب العدد التقريبي للمسوخ التي تم الحصول عليها في جميع اللوحات. لزيادة فرص الحصول على مكتبة تمثيلية، تأكد من أن العدد الإجمالي للمستعمرات أعلى بعدة أضعاف من العدد الإجمالي للجينات في الجينوم. لتأكيد نجاح اقتران، قم بإجراء PCR استهداف كاسيت الإدراج باستخدام مستعمرات عينة 10-20، كما هو موضح في القسم 3.
ملاحظة: الهدف هو التأكد من أن عدد المستعمرات هو على الأقل 10 أضعاف عدد الجينات في الجينوم كله، في هذه الحالة، >75،000 المسوخ. ومع ذلك، من الصعب بشكل عام تقدير عدد المستعمرات التي تتوافق مع مكتبة تمثيلية بالكامل بدقة. عدد الجينات الفريدة التي تحورت ليس واضحا في هذه المرحلة، بالنظر إلى أن الاضطرابات في الجينات الأساسية لا يتم التقاطها، وغالبا ما تكون هناك مواقع طفرات مختلفة متعددة لنفس الجين، والطفرات المتولدة عن أجهزة الإرسال والاستقبال Tn5 ليست عشوائية تماما. - تحت غطاء محرك السيارة العقيم، كشط المستعمرات من لوحات بإضافة 1-2 مل من برنامج تلفزيوني 1x على أجار. تجمع خليط الخلية كشط قبالة من لوحات في أنابيب 50 مل. دوامة المكتبة لخلط جيدا ومن ثم تقسيم 4 مل من مكتبة متحولة مجمعة في العديد من cryotubes. إضافة 1 مل من 70٪ الجلسرين إلى أنابيب وتخزينها في -80 درجة مئوية.
3. PCR وهلام الكهربائي لتأكيد الإدراج الناجح في B. غلاديولي لف-StA
- لتأكيد وجود الإدراج، اختر مستعمرات متحولة فردية من لوحات التحديد في الخطوة 2.9 وقم بإجراء PCR يستهدف كاسيت الإدراج باستخدام المبرمجين المذكورين في الجدول 2. إعداد مزيج PCR الرئيسي وفقا للجدول 3 ووضع الشروط في دورة الحرارية كما هو موضح في الجدول 4.
- تشغيل منتجات PCR على هلام agarose 1.6٪ عن طريق الكهربائي (250 V، 40 دقيقة) للتحقق مما إذا كانت شظايا الحمض النووي تضخيمها هي من الطول المتوقع من 1580 نقطة أساس.
4. متحولة تجمع العدوى على بيض الخنفساء
- خطوات غسل المكتبة
- تذوب aliquot من مكتبة متحولة أعدت على الجليد. جهاز الطرد المركزي في 2,683 × غرام لمدة 10 دقائق وإزالة supernatant. تحت غطاء محرك السيارة العقيم، اغسل الخلايا ب 4 مل من برنامج تلفزيوني 1x لإزالة أي وسيط متبقي من الخلايا. إعادة إنفاق الخلايا في 4 مل من برنامج تلفزيوني 1x.
- عد عدد الخلايا في aliquot من المكتبة باستخدام غرفة عد الخلايا. تمييع جزء من المكتبة إلى 2 × 106 خلايا / μL في برنامج تلفزيوني 1x.
- دوامة عليكوت المكتبة بدقة لخلط المكتبة بأكملها بشكل متجانس قبل اتخاذ حجم المطلوبة.
- تعقيم مخلب البيض والعدوى في الجسم الحي
- حدد مخلب البيض L. villosa. عد عدد البيض ومتابعة إذا كان القابض يحتوي على أكثر من 100 بيضة.
- تعقيم مخلب البيض بأكمله.
- أضف 200 ميكرولتر من الإيثانول بنسبة 70٪ واغسل البيض برفق لمدة 5 دقائق. إزالة الإيثانول وغسل البيض مرتين مع الماء autoclaved.
- أضف 200 ميكرولتر من التبييض بنسبة 12٪ (NaOCl) واغسل البيض برفق لمدة 30 ثانية. إزالة التبييض فورا وغسل البيض مرة أخرى ثلاث مرات مع 200 ميكرولتر من الماء autoclaved.
- تصيب 2 × 106 خلايا / μL من مكتبة متحولة غسلها على مخلب البيض المعقم (2.5 ميكرولتر لكل بيضة).
- بعد يومين من فتحة يرقات الخنفساء المصابة ، اجمع 100يرقات نجمة 2 لكل أنبوب ميكروفوغ 1.5 مل وتخزينها عند -80 درجة مئوية.
-
في المختبر متحولة مراقبة المكتبة
- تحت غطاء معقم، تلقيح 250 ميكرولتر من 2 × 106 خلايا / ميكرولتر من مكتبة متحولة غسلها في 10 مل من المتوسط كيلو بايت تحتوي على الكاناميسين.
- احتضان ثقافة المتحولة في المختبر عند 30 درجة مئوية لمدة 20 ساعة.
ملاحظة: حساب مدة الحضانة لتتناسب مع العدد التقريبي للأجيال من WT B. gladioli Lv-StA في الجسم الحي أثناء الاستعمار. - بعد حضانة 20 ساعة، إضافة حجم متساو من 70٪ الجلسرين لثقافة متحولة في المختبر وتخزينها في -80 درجة مئوية.
5. الخنافس المصابة وفي المختبر متحولة مكتبة استخراج الحمض النووي
ملاحظة: تم إجراء عمليات استخراج الحمض النووي باستخدام مجموعة تنقية الحمض النووي والجيش الملكي النيبالي وفقا لبروتوكول الشركة المصنعة المبينة بإيجاز أدناه.
- تجانس اليرقات المجمعة (بحد أقصى 4 ملغ لكل أنبوب ميكروفوج) عن طريق إضافة 1-2 مل من النيتروجين السائل وسحقها مع الحشرات.
- إذابة الثقافات المتحولة المزروعة في المختبر من مخزونات الجلسرين على الجليد. بيليه الخلايا عن طريق الطرد المركزي في 9600 × غرام لمدة 10 دقيقة قبل تحلل الخلية.
- إضافة 300 ميكرولتر من محلول تحلل الأنسجة والخلايا إلى عينات المختبر وفي الجسم الحي. إضافة 5 ميكرولتر من 10 ملغم / مل بروتيناز K، واحتضان المزيج في 60 درجة مئوية لمدة 15 دقيقة، ومن ثم وضعها على الجليد لمدة 3-5 دقائق.
- إضافة 150 ميكرولتر من البروتين هطول الأمطار الكاشف إلى lysates ودوامة جيدا. بيليه حطام البروتين عن طريق الطرد المركزي في 9600 × غرام لمدة 10 دقائق.
- نقل supernatant إلى أنبوب 1.5 مل microfuge. إضافة 500 ميكرولتر من الايزوبروبانول إلى supernatant وعكس بلطف الأنابيب 40 مرة على الأقل قبل احتضان في -20 درجة مئوية لمدة 1 ساعة أو بين عشية وضحاها.
- بيليه الحمض النووي عجلت عن طريق الطرد المركزي في 9600 × غرام لمدة 10 دقيقة. تجاهل supernatant وإضافة الجليد الباردة 70٪ الإيثانول إلى بيليه الحمض النووي.
- جهاز طرد مركزي في ≥10،000 × غرام لمدة 5 دقائق. تجاهل supernatant وترك العينات لتجف الهواء لمدة ساعة واحدة على الأقل.
- Resuspend الحمض النووي من المختبر وفي عينات الجسم الحي في 100 ميكرولتر من العازلة منخفضة TE.
- تخزين العينات في -20 درجة مئوية.
6. تسلسل إعداد المكتبة
ملاحظة: يتم تكييف البروتوكول والكواشف لإعداد مكتبة الحمض النووي وتعديلها من التعليمات المقدمة من قبل الشركة المصنعة لمجموعة إعداد مكتبة الحمض النووي.
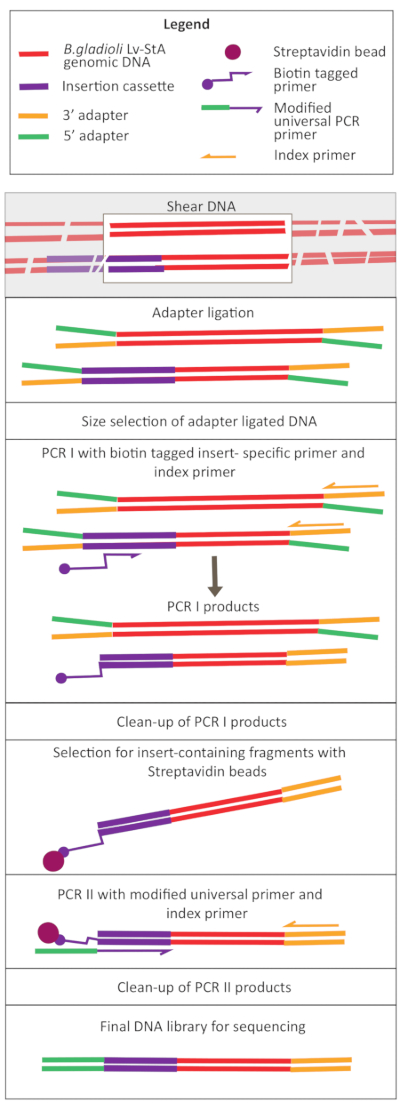
الشكل 2: تخطيطي لخطوات إعداد مكتبة الحمض النووي. بعد القص وربط المحول، يتضمن البروتوكول المعدل خطوة اختيار حبة ستريبتافيدين لإثراء شظايا الحمض النووي التي تحتوي على كاسيت الإدراج. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تمييع العينات إلى تركيز 20 نانوغرام / ميكرولتر وحجم 100 ميكرولتر وإبقائها على الجليد.
- القص في الجسم الحي وفي المختبر عينة الحمض النووي باستخدام ultrasonicator. تعيين ultrasonicator في 70٪ السلطة. دوامة العينات لفترة وجيزة والقص لمدة 1 دقيقة 30 ق.
ملاحظة: سوف تختلف إعدادات ل ultrasonicator بين الأدوات. في هذه الحالة، كان حجم الجزء 200-400 نقطة أساس، وهو ما يتناسب مع هذا النهج التسلسل من 150 نقطة أساس، ونهاية مقترنة (انظر الخطوة 9.1). يمكن تعديل معلمات القص وفقا لمتطلبات المجرب. - تحقق مما إذا كان الحمض النووي قد تم قصه إلى نطاق الحجم المطلوب (في هذه الحالة ، 200-400 bp). تحميل 5 ميكرولتر من الحمض النووي غير المقص وغير المقص بعد خلط مع هلام تحميل صبغة في نسبة 1:1 على هلام agarose 1.6٪ تشغيل في 250 V لمدة 40 دقيقة (الشكل 3A، B).
- إعداد نهايات الأجزاء المطلوبة ربط المحول
- إلى 50 ميكرولتر من الحمض النووي المقص، أضف كواشف التحضير النهائية المعطاة في مجموعة إعداد المكتبة: 3 ميكرولتر من مزيج الإنزيم و7 ميكرولتر من عازل التفاعل واخلط جيدا عن طريق الأنابيب. تعيين دورة الحرارية مع غطاء ساخن في ≥ 75 درجة مئوية واحتضان العينات لمدة 30 دقيقة في 20 درجة مئوية و 30 دقيقة في 65 درجة مئوية. عقد في 4 °C.
- ربط المحول
- لإضافة الكواشف التالية إلى منتجات خطوة الإعداد النهائية: 30 μL ربط ماستر ميكس، 1 ميكرولتر ربط محسن، و 2.5 ميكرولتر محول المخفف. تخلط جيدا عن طريق pipetting واحتضان العينة لمدة 15 دقيقة في 20 درجة مئوية في دورة الحرارية مع غطاء ساخنة قبالة.
- بعد 15 دقيقة، إضافة 3 ميكرولتر من الانزيم (uracil DNA glycosylase + DNA glycosylase-lyase Endonuclease الثامن) (انظر جدول المواد). تخلط جيدا عن طريق الأنابيب واحتضان العينة لمدة 15 دقيقة في 37 درجة مئوية في دورة الحرارية مع غطاء ساخنة في ≥47 درجة مئوية.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا عند هذه الخطوة، ويمكن تخزين العينات عند -20 درجة مئوية.
- اختيار حجم الحمض النووي محول ربط استهداف شظايا من 250 نقطة أساس
- دوامة حل حبة المغناطيسي (انظر جدول المواد)ووضعه في درجة حرارة الغرفة لمدة 30 دقيقة قبل الاستخدام.
- إضافة 0.3x من الخرز إلى 96.5 ميكرولتر من خليط الحمض النووي ليغاند ومزيج عن طريق pipetting جيدا. احتضان خليط الخرز لمدة 5 دقائق.
ملاحظة: وجود الأملاح والبولي ايثيلين غليكول في خليط الخرز يسهل هطول شظايا الحمض النووي على الخرز. نسبة منخفضة من الخرز إلى جزيئات الحمض النووي يؤدي إلى ربط شظايا الحمض النووي أكبر فقط إلى الخرز. في هذه الحالة، ترتبط شظايا الحمض النووي فوق 250 نقطة أساس في الطول بالخرز. - ضع الأنابيب على حامل مغناطيسي لسحب الخرز وإزالة شظايا الحمض النووي من الحجم غير المرغوب فيه. دع الخرز يستقر لمدة 5 دقائق ثم نقل النافورة الواضحة إلى أنبوب ميكروفوغ جديد (احتفظ بالناتور).
- إضافة 0.15x من الخرز الطازج إلى supernatant وتخلط عن طريق pipetting جيدا. احتضان خليط حبة لمدة 5 دقائق ومن ثم وضع الأنابيب على موقف المغناطيسي لسحب أسفل الخرز ملزمة الحمض النووي الهدف. انتظر لمدة 5 دقائق ثم تجاهل supernatant (الحفاظ على الخرز).
ملاحظة: هذه النسبة من الخرز إلى DNA يؤدي إلى ربط أجزاء من حجم 250 نقطة أساس المطلوب. - مع الخرز على المنصة المغناطيسية، إضافة 200 ميكرولتر من الإيثانول 80٪ (أعدت حديثا) وانتظر لمدة 30 ثانية. ماصة بها والتخلص من غسل الإيثانول بعناية دون إزعاج الخرز على المنصة المغناطيسية. كرر هذه الخطوة.
- بعد الغسيل الأخير ، قم بإزالة آثار الإيثانول من الخرز ثم جفف الخرز لمدة دقيقتين حتى تظهر لامعة ولكن لم تجف تماما. لا تفرط في تجفيف الخرز.
- قم بإزالة الأنابيب من الحامل المغناطيسي وأضف 17 ميكرولتر من 10 mM Tris-HCl أو TE 0.1x (Low-TE). مزيج عن طريق pipetting ~ 10 مرات واحتضان الخليط في درجة حرارة الغرفة لمدة 2 دقيقة.
- ضع الأنابيب مرة أخرى على الحامل المغناطيسي وانتظر لمدة 5 دقائق. بمجرد أن تستقر الخرز، نقل الحمض النووي إلى أنبوب جديد.
- PCR I لإضافة علامة البيوتين إلى شظايا الحمض النووي التي تحتوي على كاسيت الإدراج
- إضافة علامة التمهيدي البيوتينية إلى شظايا الحمض النووي التي تحتوي على شريط Tn5-الإدراج باستخدام التمهيدي البيوتينية محددة الإرسال والاستقبال(الجدول 5)والتمهيدي مؤشر. إعداد مزيج PCR الرئيسي وفقا للجدول 6 واتبع شروط PCR للدورة الحرارية المدرجة في الجدول 7.
- تنظيف PCR I بدون تحديد الحجم
- دوامة 0.9x الخرز ووضعها في درجة حرارة الغرفة لمدة 30 دقيقة على الأقل قبل التنظيف.
- إضافة 0.9x حبات لمنتجات PCR وتخلط جيدا.
- ضع الخرز على حامل مغناطيسي لسحب الخرز.
- إزالة supernatant واضحة وغسل حبة ملزمة الحمض النووي مع 200 ميكروغرام من الإيثانول الطازجة 80٪ مرتين.
- إزالة الإيثانول بعد خطوات الغسيل والهواء الجاف الخرز حتى تبدو لامعة ولكن ليس جافة جدا.
- أضف 32 ميكرولتر من 10 mM Tris-HCl أو 0.1X TE (Low-TE) واحتضان الخرز لمدة 5 دقائق. ضع الخليط مرة أخرى على الحامل المغناطيسي ونقل النافورة إلى أنبوب ميكروفوغ طازج.
- ربط شظايا الحمض النووي البيوتينية إلى حبات ستريبتافيدين
- Resuspend 32 ميكرولتر من حبات ستريبتافيدين في 1x ربط وغسل العازلة. غسل الخرز مع العازلة ثلاث مرات في حين وضعت على موقف المغناطيسي.
- إضافة 32 ميكرولتر من العازلة 2x ربط وغسل وإعادة إنفاق الخرز. لهذا، أضف 32 ميكرولتر من منتجات PCR 1 التي تم تنظيفها. تخلط جيدا واحتضان في درجة حرارة الغرفة لمدة 30 دقيقة.
- ضع خليط الخرز والحمض النووي على حامل مغناطيسي لمدة دقيقتين. ماصة من supernatant كما الحمض النووي البيوتين الموسومة التي تحتوي على حافة الإدراج يربط إلى streptavidin على الخرز.
- غسل الخرز مع 500 ميكرولتر من العازلة 1x ربط وغسل ثم غسل الخرز مع 200 ميكروغرام من منخفضة TE. إعادة إنفاق الخرز المرتبط بالحمض النووي في 17 ميكرولتر من LOW-TE.
- PCR II لإضافة محولات إلى الأجزاء التي تحتوي على حافة كاسيت الإدراج
- إعداد مزيج رئيسي، كما هو موضح في الجدول 8،باستخدام التمهيديات الفهرسة ومبرمجات PCR العالمية المعدلة المدرجة في الجدول 5. إضافة 15 ميكرولتر من حبات ستريبتافيدين المرتبطة بالحمض النووي من الخطوة السابقة إلى مزيج PCR. انظر الجدول 7 للاطلاع على ظروف الدورة الحرارية.
- تنظيف منتجات PCR دون تحديد الحجم كما هو معطى في الخطوة 6.8 من هذا البروتوكول. Elute منتجات الحمض النووي النهائي في 30 ميكرولتر من المياه الجزيئية الصف.
- تخزين العينات في -20 درجة مئوية واستخدامها للتسلسل.
7. التسلسل والتحليل
- تسلسل المكتبة باستخدام تقنية تسلسل الإنتاجية العالية. ضبط عمق التسلسل اعتمادا على حجم مكتبة الإرسال والاستقبال، كما هو مذكور أدناه. تقييم جودة القراءة مع FastQC7. حدد القراءات التي تحتوي على حافة الإدراج Tn5 على نهاية 5 'من القراءة وإزالة تسلسل حافة الإدراج باستخدام Cutadapt8 و / أو Trimmomatic9.
ملاحظة: هنا، تم استخدام نهج تسلسل نهاية المقترنة لاستهداف 150 نقطة أساس لكل قراءة و يقرأ Mio 8. للحصول على مجموعة بيانات تمثيلية، تأكد من أن العدد الإجمالي للرواية المتسلسلة يتجاوز الحد الأقصى الممكن لعدد المسوخ في المكتبة، أي العدد الإجمالي المقدر للمستعمرات من الخطوة 2.9. كمرجع، يهدف هذا البروتوكول إلى 40 ضعفا من الحد الأقصى لحجم المكتبة الممكن. دراسات ناجحة أخرى باستخدام Tn-seq لغرض مماثل تسلسل عدد إجمالي من القراءات قريبة من 25 أضعاف العدد الفعلي للإدراج فريدة من نوعها في مكتبة متحولة المقابلة22,23. - وبالنظر إلى أن الطفرات في نهايات الجينات ليست مدمرة وظيفيا، تقليم 5٪ قبالة طرفي الشروح الجينية من ملف GFF الجينوم المرجعي. خريطة يقرأ قلصت إلى الجينوم المرجعي باستخدام Bowtie210.
- حساب عدد عمليات الإدراج من عدد المواضع 5 'فريدة في ملف BAM المحاذاة.
- باستخدام FeatureCounts11، والحصول على عدد من الجينات ضرب لكل عينة تكرار.
- باستخدام حزمة DESeq212 في RStudio ، احسب الفرق في وفرة المتحولة بين الظروف المختلفة.
النتائج
يمكن للبكتيريا المرتبطة بالمضيف استخدام عدة عوامل لإنشاء جمعية ، بما في ذلك تلك التي تتوسط في الالتصاق ، أو الحركة ، أو chemotaxis ، أو استجابات الإجهاد ، أو ناقلات محددة. في حين تم الإبلاغ عن عوامل مهمة للتفاعلات بين مسببات الأمراض والمضيف لعدةبكتيريا 13،14،15،16،17،18، بما في ذلك أعضاء جنس Burkholderia19،20، فقد استكشفت دراسات أقل الآليات الجزيئية المستخدمة من قبل symbionts مفيدة للاستعمار21،22،23 . باستخدام تسلسل إدراج الإرسال والاستقبال ، كان الهدف هو تحديد العوامل الجزيئية التي تمكن B. gladioli من استعمار خنافس L. villosa.
تم تنفيذ تولد الأوعية بوساطة Transposon باستخدام pRL27 plasmid ، الذي يحمل جهاز الإرسال والاستقبال Tn5 وكاسيت مقاومة كاناميسين محاط بمواقع تكرار مقلوبة. تم إدخال البلازميد إلى الهدف B. غلاديولي لف-StA الخلايا عن طريق اقتران مع المتبرع البلازميد E. coli WM3064 سلالة (كما هو مبين في الشكل 1). بعد اقتران, مزيج اقتران تحتوي على B. gladioli المتلقي وE. كولاي الخلايا المانحة كانت مطلية على لوحات أجار انتقائية تحتوي على kanamycin. غياب DAP على لوحات القضاء على الخلايا E. القولونية المانحة، ووجود kanamycin مختارة لنجاح B. gladioli Lv-StA المتحولين. تم إعداد مكتبة B. gladioli Lv-StA المتحولة المجمعة التي تم الحصول عليها من حصاد المستعمرات العابرة البالغ عددها 100,000 لاستعمار للتسلسل باستخدام مجموعة إعداد معدلة لمكتبة الحمض النووي ومبرمجين مخصصين. ويبرز الشكل 2 خطوات إعداد مكتبة الحمض النووي. وأسفر التسلسل عن 4 قراءات مقترنة ب Mio؛ 3,736 الجينات من أصل 7,468 الجينات في B. غلاديولي Lv-StA تعطلت.
لتحديد المسوخ التي كانت معيبة الاستعمار في المضيف، أصيبت مكتبة B. gladioli Lv-StA متحولة على بيض الخنفساء ونمت في المختبر في KB المتوسطة كعنصر تحكم. تم حساب حجم عنق الزجاجة في استعمار الجسم الحي قبل التجربة. أصيب عدد معروف من خلايا B. gladioli Lv-StA على بيض الخنفساء ، وتم الحصول على عدد الخلايا المستعمرة في يرقات النجوم الأولى الطازجة عن طريق طلاء تعليق من كل يرقة وحساب وحدات تشكيل المستعمرة لكل فرد. وقد أجريت هذه الحسابات لضمان أن عدد الخلايا المستعمرة يكفي لتقييم كل أو نسبة عالية من المسوخ في المكتبة لقدرتها على استعمار المضيف. بالإضافة إلى ذلك ، تم تطبيع وقت النمو بين ظروف المختبر وفي الجسم الحي على أساس عدد الأجيال البكتيرية لجعل هذه العينات قابلة للمقارنة.
بعد فقس البيض ، تم جمع 1296 يرقة في 13 بركة. نمت الثقافات المتحولة في المختبر المقابلة وتخزينها كمخزونات الجلسرين. تم استخراج الحمض النووي للمكتبات المتحولة في الجسم الحي وفي المختبر نمت ومجزأة في ultrasonicator. ويبين الشكل 3 حجم توزيع الحمض النووي المقص، حيث تتراوح غالبية الشظايا بين 100 و 400 نقطة أساس، كما هو متوقع. وأعقب هذه الخطوة بروتوكول إعداد مكتبة الحمض النووي المعدل للتسلسل. وفي كل خطوة من خطوات البروتوكول، تم فحص تركيز الحمض النووي المتبقي لضمان تنفيذ الخطوات بشكل صحيح وتتبع خسائر الحمض النووي. كشف فحص الجودة (انظر جدول المواد)قبل التسلسل أن مكتبات الحمض النووي تحتوي على شظايا الحمض النووي الكبيرة بشكل غير متوقع (>800 bp) ، وكان هذا أكثر وضوحا في مكتبات vivo. وبالنظر إلى صعوبة تحسين تجميع الشظايا في ممرات التسلسل، كان من الضروري زيادة عمق التسلسل إلى 10 قراءات مقترنة ب Mio في مكتبات vivo لتحقيق العدد المطلوب من القراءات. وكشف تحليل نتائج التسلسل أن ما متوسطه 4 قراءات ميو في مكتبات في الجسم الحي و 3.1 يقرأ ميو في المكتبات في المختبر تحتوي على حافة Transposon في نهاية 5 'من القراءة -1 ( الجدول 9 )، الذي كان مرضيالهذهالتجربة. يظهر توزيع 24,224 إدخال فريد عبر جينوم B. gladioli في المكتبة الأصلية في الشكل 4. وكشف تحليل أجري باستخدام DESeq2 أن وفرة 271 متحولة كانت مختلفة بشكل كبير بين الظروف في الجسم الحي وفي المختبر.
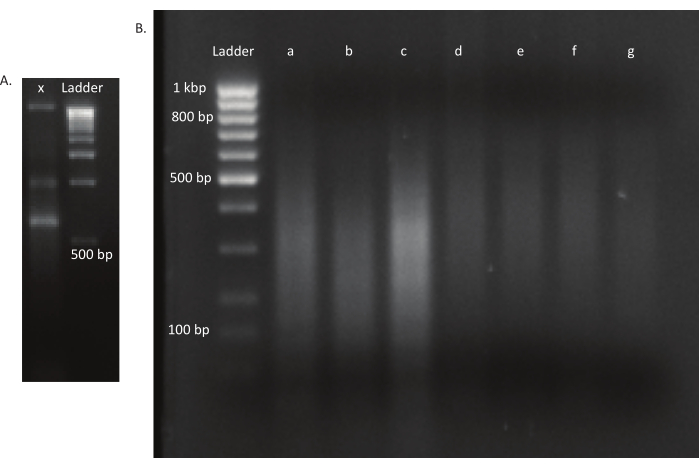
الشكل 3: Agarose المواد الهلامية من مكتبات متحولة والحمض النووي. (أ) هلام Agarose مع الحمض النووي غير المفروش من متحولة في حارة x وسلم 1 كيلوبايت للمقياس. (ب) جل مع مكتبة الحمض النووي مقص. يشار إلى أحجام الفرقة من سلم في الممر الأول على الجانب الأيسر. تحتوي الممرات الثلاثة الأولى A و b و c على أجزاء الحمض النووي المقصة لمكتبات vivo. تحتوي الممرات d و e و f و g على شظايا الحمض النووي المقصة لمكتبات المختبر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
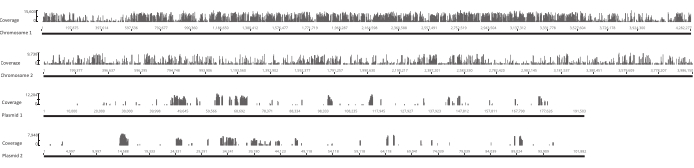
الشكل 4: موقع مواقع الإدراج فريدة من نوعها في المكتبة الأصلية عبر replicons الأربعة في الجينوم Burkholderia غلاديولي Lv-StA. يقع كل شريط على طول المحور س في موقع الإدراج. ارتفاع شريط على طول المحور ص يتوافق مع عدد القراءات المقترنة بهذا الموقع. لاحظ أن الكروموسومين واثنين من البلازميدات تظهر في الطول الكامل وبالتالي لها جداول مختلفة على المحور س. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الملك باء المتوسطة / أجار | |
| بيبتون (فول الصويا) | 20 جم/لتر |
| K2HPO4 | 1.5 غرام/لتر |
| مغسو4.7H2O | 1.5 غرام/لتر |
| اجار | 15 جم/لتر |
| يذوب في الماء المقطر | |
| LB المتوسطة / أجار | |
| تريبتون | 10 جم/لتر |
| استخراج الخميرة | 5 جم/لتر |
| ناكل | 10 جم/لتر |
| يذوب في الماء المقطر | |
الجدول 1: مكونات الوسائط.
| لا. | الاشعال | تسلسل | درجة الحرارة لتمين PCR (°C) | |
| 1 | tpnRL17-1RC | 5'-CGTTACATCCCTGGCTTGTT-3' | 58.2 | |
| 2 | tpnRL13-2RC | 5'-TCGTGAGGGGCTG-3' | ||
الجدول 2: التهيئة لتأكيد نجاح التوازم.
| مكون | حجم الصوت (ميكرولتر) |
| المياه النقية من HPLC | 4.92 |
| 10x المخزن المؤقت S (خصوصية عالية) | 1 |
| مجكل2 (25 م م) | 0.2 |
| dNTPs (2 متر) | 1.2 |
| التمهيدي 1 (10 pmol / μL) | 0.8 |
| التمهيدي 2 (10 pmol / ميكرولتر) | 0.8 |
| تقي (5 U/μL) | 0.08 |
| مجموع مادميكس | 9 |
| قالب | 1 |
الجدول 3: مزيج PCR الرئيسي لتأكيد نجاح التوازم. الاختصارات: HPLC = الكروماتوغرافيا السائلة عالية الأداء؛ dNTPs = ثلاثي الفوسفات ثنائي الأكسجين.
| الخطوات | درجة الحرارة °C | الوقت | دورات |
| التسخين الأولي | 95 | 3 دقائق | 1 |
| التشبع | 95 | 40 ق | |
| الصلب | 58.2 | 40 ق | من 30 إلى 35 |
| امتداد | 72 | 1-2 دقيقة | |
| التمديد النهائي | 72 | 4 دقائق | 1 |
| مسك | 4 | ∞ | |
الجدول 4: شروط ال PCR لتأكيد نجاح التوازم.
| الاشعال | تسلسل | TM °C | استخدام | مصدر | |
| التمهيدي البيوتينية الخاصة ب Transposon | 5'-البيوتين-أجاجاكاكتاتاكتاككتاغاكتاتغ -3' | 63.5 | 6.7.1. PCR I | تقليد | |
| التمهيدي العالمي المعدل PCR | 5'- أاتغاتاكجغاكاغاغاتك تاكاككتكتتكتاكاكجاكغاكتك TTCCجاتCTGAATTCجاتغات GGTTGAGGTGT – 3' | 62 | 6.10.1. PCR الثاني | تقليد | |
| التمهيدي للفهرس | الرجوع إلى دليل الشركة المصنعة | 6.7.1. PCR I و 6.10.1. PCR الثاني | NEBNext متعددة أوليغوس لإلومينا (مؤشر التمهيديات تعيين 1) | ||
| محول | الرجوع إلى دليل الشركة المصنعة | 6.5. ربط المحول | NEBNext الترا الثاني مجموعة الإعدادية مكتبة الحمض النووي لIllumina | ||
الجدول 5: التمهيديات والمحول ل PCR الأول والثاني أثناء إعداد مكتبة الحمض النووي.
| مزيج PCR | (ميكرولتر) |
| شظايا الحمض النووي ذات الربط المحول | 15 |
| NEBNext الترا الثاني Q5 مزيج رئيسي | 25 |
| التمهيدي مؤشر (10 pmol / μL) | 5 |
| جهاز الإرسال والاستقبال التمهيدي البيوتينية محددة (10 pmol / μL) | 5 |
| إجمالي حجم الصوت | 50 |
الجدول 6: إعداد مكتبة الحمض النووي -PCR I مزيج رئيسي.
| الخطوات | درجة الحرارة | الوقت | دورات |
| التسخين الأولي | 98 درجة مئوية | 30 ق | 1 |
| التشبع | 98 درجة مئوية | 10 ق | من 6 إلى 12 |
| الصلب | 65 درجة مئوية | 30 ق | |
| امتداد | 72 درجة مئوية | 30 ق | |
| التمديد النهائي | 72 درجة مئوية | دقيقتان | 1 |
| مسك | 16 درجة مئوية | ∞ | |
الجدول 7: إعداد مكتبة الحمض النووي -شروط PCR I و II.
| مزيج PCR | (ميكرولتر) |
| الحمض النووي المختار من قبل الخرز | 15 |
| NEBNext الترا الثاني Q5 مزيج رئيسي | 25 |
| التمهيدي للفهرس | 5 |
| التمهيدي العالمي المعدل ل PCR | 5 |
| إجمالي حجم الصوت | 50 |
الجدول 8: إعداد مكتبة الحمض النووي -مزيج رئيسي PCR II.
| مكتبات | إنفيفو-1 | إنفيفو-2 | إنفيفو-3 | إنفيترو-1 | إنفيترو-2 | إنفيترو-3 | المكتبة الأصلية | |
| لا. من يقرأ (PE) | 56,57,710 | 39,19,051 | 30,65,849 | 35,73,494 | 28,83,440 | 36,61,956 | 46,09,410 | |
| لا. من القراءات التي تحتوي على Tn – حافة على 5 'نهاية القراءة-1 | 54,15,880 | 37,31,169 | 29,36,247 | 33,00,499 | 27,35,705 | 33,50,402 | 41,53,270 | |
| Bowtie2 معدل المحاذاة الإجمالي (٪) (القراءة-1 فقط) | 95.53% | 83.71% | 89.87% | 80.79% | 78.00% | 73.06% | 74.92% | |
| عدد عمليات الإدراج الفريدة | 8,539 | 4,134 | 7,183 | 18,930 | 18,421 | 20,438 | 24,224 | |
| عدد الجينات التي ضربت | 1575 | 993 | 1450 | 2793 | 2597 | 3037 | 3736 | |
الجدول 9: موجز للتسلسل الناتج وتكرار إدراج الإرسال والاستقبال لكل مكتبة. اختصار: PE = نهاية مقترنة.
Discussion
تم إنشاء مكتبة متحولة ب. غلاديولي transposon لتحديد عوامل الاستعمار المضيف الهامة في التفاعل التكافلي بين خنافس L. villosa وبكتيريا B. gladioli. وكانت الخطوات الرئيسية في البروتوكول هي التوازم، والعدوى المضيفة، وإعداد مكتبة الحمض النووي، والتسلسل.
كما العديد من سلالات بوركهولدريا قابلة للتعديل الوراثي عن طريق اقتران24،25، تم اقتران البلازميد الذي يحمل جهاز الإرسال والاستقبال وكاسيت إدخال المضادات الحيوية بنجاح في سلالة B. gladioli Lv-StA المستهدفة من E. coli. المحاولات السابقة للتحول عن طريق الكهربوكربوهات أسفرت عن انخفاض كبير إلى ما يقرب من أي محولات B. gladioli. من المستحسن تحسين تقنية التحويل للكائن المستهدف لتحقيق عدد كبير من المحولات بكفاءة.
جولة واحدة من اقتران و 40 بقعة اقتران تعطلت 3736 الجينات في B. gladioli Lv-StA. وبعد فوات الأوان، ستكون هناك ضرورة لجولات متعددة من التلازم لتعطيل معظم الجينات ال 468 7 والحصول على مكتبة مشبعة. وتجدر الإشارة إلى أن وقت الحضانة أثناء التضمين لم يسمح له بأن يتجاوز 12-18 ساعة، وهي نهاية مرحلة النمو الأسي ل B. gladioli. السماح اقتران ما بعد مرحلة النمو الأسي للخلايا البكتيرية يقلل من فرص نجاح الحصول على محولات26. لذلك ، يجب تعديل فترة التوازم وفقا لنمو الأنواع البكتيرية.
لتنفيذ تجربة ناجحة تنطوي على عدوى المكتبات المتحولة في مضيف ، من المهم تقييم حجم عنق الزجاجة البكتيري أثناء الاستعمار وتنوع المسوخ في المكتبة قبل العدوى1و2و27. استعدادا للتجربة ، قدرنا الحد الأدنى لعدد الخنافس التي يجب أن تصاب بفرصة كبيرة أن يتم أخذ عينات من كل متحول في المكتبة والسماح له بالاستعمار. كما تم حساب التقريبي في وقت توليد البكتيريا الحية وعدد الأجيال لمدة التجربة. ثم نمت الثقافة في المختبر حتى عدد مماثل من الأجيال عن طريق تعديل وقت الحضانة. وبالنسبة لتجربة عدوى مماثلة في مضيفين آخرين غير نموذجيين، من المستحسن القدرة على الحفاظ على ثقافة مختبرية ومصدر دائم للكائنات المضيفة.
وبعد نمو المكتبة المتحولة في الجسم الحي وفي المختبر وجمع العينات، تم تنفيذ بروتوكول معدل لإعداد مكتبة الحمض النووي لتسلسل إدخال الإرسال والاستقبال. تضمن التعديل في البروتوكول تصميم مبرمجات PCR مخصصة وإضافة خطوات PCR لتحديد شظايا الحمض النووي التي تحتوي على كاسيت الإدراج. لأنه تم تخصيص البروتوكول، دورات PCR إضافية في البروتوكول زيادة خطر التضخيم الزائد والحصول على أجزاء محول محول مختلطة في المكتبات النهائية. وبالتالي، خطوة تنظيف النهائي (بدون تحديد حجم) بعد PCRs اثنين مستحسن، كما أنه يساعد في إزالة هذه الأجزاء. وكان حجم توزيع مكتبات الحمض النووي لا يزال أوسع مما كان متوقعا. غير أن زيادة عمق التسلسل وفرت بيانات كافية تمت تصفيتها أثناء تحليل المعلوماتية الأحيائية، وتوصلت إلى نتائج مرضية.
وبما أن الطفرات بوساطة الإرسال والاستقبال تولد الآلاف من عمليات الإدراج العشوائي في تجربة واحدة، فمن الممكن توليد مكتبة مشبعة من المسوخ التي تحتوي على جميع المسوخ باستثناء تلك التي تعطلت فيها الجينات الضرورية للنمو البكتيري. نحن على الأرجح لم نعمل مع مكتبة متحولة مشبعة ، بالنظر إلى تقديرات الجينات الأساسية في دراسات أخرى على Burkholderia sp. 28،29. ومع ذلك، تساعد المكتبة غير المشبعة في استكشاف جينات مرشحة مختلفة لمزيد من الدراسات باستخدام الطفرات المستهدفة. قبل التجارب ، من المهم أيضا أن نتذكر أن بعض الإرسال والاستقبال لديها مواقع محددة هدف الإدراج التي تزيد من وفرة المسوخ في بعض loci في الجينوم30. ومن المعروف أن مرسلات الرافنبوزونات مارينر تستهدف مواقع AT للإدراج31، و Tn5 transposons لها تحيز GC32،33. وسيساعد إدراج خطوات أثناء تحليل المعلوماتية الحيوية للتعرف على النقاط الساخنة لإدراج الإرسال والاستقبال في تقييم أي تحيز في التوزيع.
على الرغم من عرضة للانتكاسات، يمكن أن تكون تجربة تسلسل إدراج الإرسال والاستقبال المصممة تصميما جيدا أداة قوية لتحديد العديد من الجينات المهمة المشروطة في البكتيريا ضمن تجربة واحدة. على سبيل المثال، تم تحديد اثنتي عشرة جينة في بوركهولدريا seminalis مهمة لقمع نخر أوراق السحلية من خلال الجمع بين موتاجينيسيس الإرسال والاستقبال وعلم الجينوم34. وراء Burkholderia, وقد تم تحديد العديد من الجينات الالتصاق والحركية والنقل كعوامل استعمار هامة في Snodgrassella alvi symbionts من أبيس mellifera (نحل العسل)22, وفي symbionts Vibrio fischerii من scolopes Euprymna (الحبار ذيل هاواي)23 باستخدام نهج تولد الإرسال والادخال transposon.
وكنهج بديل، يمكن أن يتبع تكوين الإرسال والاستقبال فحص للمسوخ الفردية باستخدام وسائط انتقائية بدلا من التسلسل. الفحص الظاهري أو الفحوصات الحيوية لتحديد أوجه القصور، مثل الحركة، وإنتاج الأيض الثانوي النشط بيولوجيا، أو الأوكستروفيات المحددة، ممكنة. على سبيل المثال ، كان فحص مكتبة Burkholderia insecticola (أعيد تعيينها إلى جنس Caballeronia35)مكتبة متحولة الإرسال والاستقبال مفتاحا في تحديد أن symbionts تستخدم جينات الحركة لاستعمار ريبتورتوس باديستريس، مضيفها الحشري36. وعلاوة على ذلك، باستخدام موتاجينيسيس الإرسال والاستقبال والفحص الظاهري، تم تحديد الكتلة الجينية التركيب الحيوي للكاريونينينين المستقلب الثانوي النشط بيولوجيا في بوركهولديريا كاريوفيلي37. تم التعرف على متحولة أوكستروفيك من pseudomallei Burkholderia بعد موتاسيس transposon والفحص وهو مرشح لقاح مخفف ممكن ضد melioidosis، وهو مرض خطير في البشر والحيوانات38. وهكذا، فإن تولد وتسلسل الإرسال والاستقبال هو نهج قيم في دراسة الصفات الجزيئية للبكتيريا التي تعتبر مهمة للتفاعلات مع مضيفيهم في الجمعيات المسببة للأمراض أو المتبادلة.
Disclosures
يعلن المؤلفون أنه ليس لديهم تضارب في المصالح فيما يتعلق بالدراسة.
Acknowledgements
نحن ممتنون لجونبوم لي لتوفير سلالة E. coli WM3064 + pRL27 للتقتران والتوجيه في الإجراء ، كاثرين هوفماير للمساعدة في استكشاف الأخطاء وإصلاحها خلال توليد مكتبة متحولة ، والبروفيسور أندريه رودريغز لدعم جمع الحشرات والحصول على تصريح. كما نشكر ريبيكا جانكي وداغمار كليبش على دعمهما في جمع وتربية الحشرات. نعترف بالسلطات البرازيلية لمنح التصاريح التالية للوصول إلى عينات الحشرات وجمعها وتصديرها: تصريح SISBIO Nr. 45742-1، 45742-7 و45742-10، عملية CNPq nº 01300.004320/2014-21 و01300.0013848/2017-33، IBAMA Nr. 14BR016151DF و20BR035212/DF). تم دعم هذا البحث بتمويل من مؤسسة العلوم الألمانية (DFG) منح البحوث FL1051/1-1 وKA2846/6-1.
Materials
| Name | Company | Catalog Number | Comments |
| 2,6- Diaminopimelic Acid | Alfa Aesar | B22391 | For E.coli WM3064+ pRL27 |
| Agar - Agar | Roth | 5210 | |
| Agarose | Biozym | 840004 | |
| AMPure beads XP (magentic beads + polyethylene glycol + salts) | Beckman Coulter | A63880 | Size selection in step 6.6 |
| Bleach (NaOCl) 12% | Roth | 9062 | |
| Bowtie2 v.2.4.2 | Bioinfromatic tool for read mapping. Reference 10 in main manuscript. | ||
| Buffer-S | Peqlab | PEQL01-1020 | For PCRs |
| Cell scraper | Sarstedt | 83.1830 | |
| Cutadapt v.2.10 | Bioinformatic tool for removing specific adapter sequences from the reads. Reference 8 in main manuscript. | ||
| DESeq2 | RStudio package for assessing differential mutant abundance. Usually used for RNAseq analysis. Reference 12 in main manuscript. | ||
| DNA ladder 100 bp | Roth | T834.1 | |
| dNTPs | Life Technology | R0182 | PCR for confirming success of conjugation |
| EDTA, Di-Sodium salt | Roth | 8043 | |
| Epicentre MasterPure Complete DNA and RNA Purification Kit | Lucigen | MC85200 | |
| Ethidium bromide | Roth | 2218.1 | |
| FastQC v.0.11.8 | Bioinformatic tool for assessing the quality of sequencing data. Reference 7 in main manuscript. | ||
| FeatureCounts v.2.0.1 | Bioinformatic tool to obtain read counts per genomic feature. Reference 11 in main manuscript. | ||
| Glycerol | Roth | 7530 | |
| K2HPO4 | Roth | P749 | |
| Kanamycin sulfate | Serva | 26899 | |
| KCl | Merck | 4936 | |
| KH2PO4 | Roth | 3904 | |
| MgSO4.7H2O | Roth | PO27 | |
| Na2HPO4 | Roth | P030 | |
| NaCl | Merck | 6404 | |
| NEBNext Multiplex Oligos for Illumina (Index primers set 1) | New England Biolabs | E7335S | |
| NEBNext Ultra II DNA library prep kit for Illumina | New England Biolabs | E7645S | |
| Peptone (soybean) | Roth | 2365 | For Burkholderia gladioli Lv-StA KB-medium |
| peqGOLD 'Hot' Taq- DNA Polymerase | VWR | PEQL01-1020 | PCR for confirming success of conjugation |
| Petri plates - 145 x 20 mm | Roth | XH90.1 | For selecting transconjugants |
| Petri plates - 90 x 16 mm | Roth | N221.2 | |
| Qiaxcel (StarSEQ GmbH, Germany) | Quality check after DNA library preparation | ||
| Streptavidin beads | Roth | HP57.1 | |
| Taq DNA polymerase | VWR | 01-1020 | |
| Trimmomatic v.0.36 | Bioinformatic tool for trimming low quality reads and also adapter sequences. Reference 9 in main manuscript. | ||
| Tris -HCl | Roth | 9090.1 | |
| Tryptone | Roth | 2366 | For Escherichia coli WM3064+pRL27 LB medium |
| Ultrasonicator | Bandelin | GM 70 HD | For shearing |
| USER enzyme (uracil DNA glycosylase + DNA glycosylase- lyase Endonuclease VIII) | New England Biolabs | E7645S | Ligation step 6.5.2 |
| Yeast extract | Roth | 2363 |
References
- Cain, A. K., et al. A decade of advances in transposon-insertion sequencing. Nature Reviews Genetics. 21 (9), 526-540 (2020).
- Chao, M. C., Abel, S., Davis, B. M., Waldor, M. K. The design and analysis of transposon insertion sequencing experiments. Nature Reviews Microbiology. 14 (2), 119-128 (2016).
- Barquist, L., Boinett, C. J., Cain, A. K. Approaches to querying bacterial genomes with transposon-insertion sequencing. RNA Biology. 10 (7), 1161-1169 (2013).
- Flórez, L. V., et al. Antibiotic-producing symbionts dynamically transition between plant pathogenicity and insect-defensive mutualism. Nature Communications. 8 (1), 15172(2017).
- Flórez, L. V., Kaltenpoth, M. Symbiont dynamics and strain diversity in the defensive mutualism between Lagria beetles and Burkholderia. Environmental Microbiology. 19 (9), 3674-3688 (2017).
- Flórez, L. V., et al. An antifungal polyketide associated with horizontally acquired genes supports symbiont-mediated defense in Lagria villosa beetles. Nature Communications. 9 (1), 2478(2018).
- Andrews, S. FastQC A quality control tool for high throughput sequence data. , Available from: https://www.bioinformatics.babraham.ac.uk/projects/fastqc/ (2012).
- Martin, M. Cutadapt removes adapter sequences from high-throughput sequencing reads. EMBnet.journal. 17 (1), 10-12 (2011).
- Bolger, A. M., Lohse, M., Usadel, B. Trimmomatic: A flexible trimmer for Illumina sequence data. Bioinformatics. 30 (15), 2114-2120 (2014).
- Langmead, B., Salzberg, S. L. Fast gapped-read alignment with Bowtie 2. Nature Methods. 9 (4), 357-359 (2012).
- Liao, Y., Smyth, G. K., Shi, W. FeatureCounts: An efficient general purpose program for assigning sequence reads to genomic features. Bioinformatics. 30 (7), 923-930 (2014).
- Love, M. I., Huber, W., Anders, S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2. Genome Biology. 15 (12), 550(2014).
- Gaytán, M. O., Martínez-Santos, V. I., Soto, E., González-Pedrajo, B. Type three secretion system in attaching and effacing pathogens. Frontiers in Cellular and Infection Microbiology. 6, 129(2016).
- Hachani, A., Wood, T. E., Filloux, A. Type VI secretion and anti-host effectors. Current Opinion in Microbiology. 29, 81-93 (2016).
- Deep, A., Chaudhary, U., Gupta, V. Quorum sensing and bacterial pathogenicity: From molecules to disease. Journal of Laboratory Physicians. 3 (1), 4-11 (2011).
- Silva, A. J., Benitez, J. A. Vibrio cholerae biofilms and cholera pathogenesis. PLOS Neglected Tropical Diseases. 10 (2), 0004330(2016).
- Navarro-Garcia, F., Ruiz-Perez, F., Cataldi, Á, Larzábal, M. Type VI secretion system in pathogenic Escherichia coli: structure, role in virulence, and acquisition. Frontiers in Microbiology. 10, 1965(2019).
- Ribet, D., Cossart, P. How bacterial pathogens colonize their hosts and invade deeper tissues. Microbes and Infection. 17 (3), 173-183 (2015).
- Schwarz, S., et al. Burkholderia Type VI secretion systems have distinct roles in eukaryotic and bacterial cell interactions. PLoS Pathogens. 6 (8), 1001068(2010).
- Jones, C., et al. Kill and cure: genomic phylogeny and bioactivity of Burkholderia gladioli bacteria capable of pathogenic and beneficial lifestyles. Microbial Genomics. 7 (1), 000515(2021).
- Takeshita, K., Kikuchi, Y. Riptortuspedestris and Burkholderia symbiont: an ideal model system for insect-microbe symbiotic associations. Research in Microbiology. 168 (3), 175-187 (2017).
- Powell, J. E., et al. Genome-wide screen identifies host colonization determinants in a bacterial gut symbiont. Proceedings of the National Academy of Sciences of the United States of America. 113 (48), 13887-13892 (2016).
- Brooks, J. F., et al. Global discovery of colonization determinants in the squid symbiont Vibrio fischeri. Proceedings of the National Academy of Sciences of the United States of America. 111 (48), 17284-17289 (2014).
- Somprasong, N., McMillan, I., Karkhoff-Schweizer, R. R., Mongkolsuk, S., Schweizer, H. P. Methods for genetic manipulation of Burkholderia gladioli pathovar cocovenenans. BMC Research Notes. 3 (308), (2010).
- Garcia, E. C. Burkholderia thailandensis: Genetic manipulation. Current Protocols in Microbiology. 45, 1-15 (2017).
- Headd, B., Bradford, S. A. The conjugation window in an Escherichia coli K-12 strain with an IncFII plasmid. Applied and Environmental Microbiology. 86 (17), 00948(2020).
- Van Opijnen, T., Camilli, A. Transposon insertion sequencing: A new tool for systems-level analysis of microorganisms. Nature Reviews Microbiology. 11 (7), 435-442 (2013).
- Gallagher, L. A., Ramage, E., Patrapuvich, R., Weiss, E., Brittnacher, M., Manoil, C. Sequence-defined transposon mutant library of Burkholderia thailandensis. mBio. 4 (6), 00604-00613 (2013).
- Wong, Y. -C., et al. Candidate essential genes in Burkholderia cenocepacia J2315 identified by genome-wide TraDIS. Frontiers in Microbiology. 7, 1288(2016).
- Moule, M. G., et al. Genome-wide saturation mutagenesis of Burkholderia pseudomallei K96243 predicts essential genes and novel targets for antimicrobial development. mBio. 5 (1), 00926(2014).
- Ding, Q., Tan, K. S. Himar1 transposon for efficient random mutagenesis in Aggregatibacter actinomycetemcomitans. Frontiers in Microbiology. 8, 1842(2017).
- Green, B., Bouchier, C., Fairhead, C., Craig, N. L., Cormack, B. P. Insertion site preference of Mu, Tn5, and Tn7 transposons. Mobile DNA. 3, 3(2012).
- Lodge, J. K., Weston-Hafer, K., Berg, D. E. Transposon Tn5 target specificity: Preference for insertion at G/C pairs. Genetics. 120 (3), 645-650 (1988).
- Ará Ujo, W. L., et al. Genome sequencing and transposon mutagenesis of Burkholderia seminalis TC3.4.2R3 identify genes contributing to suppression of orchid necrosis caused by B. gladioli. Molecular Plant-microbe Interactions: MPMI. 29 (6), 435-446 (2016).
- Dobritsa, A. P., Samadpour, M. Reclassification of Burkholderiainsecticola as Caballeroniainsecticola comb. nov. and reliability of conserved signature indels as molecular synapomorphies. International Journal of Systematic and Evolutionary Microbiology. 69 (7), 2057-2063 (2019).
- Ohbayashi, T., et al. Insect's intestinal organ for symbiont sorting. Proceedings of the National Academy of Sciences of the United States of America. 112 (37), 5179-5188 (2015).
- Ross, C., Scherlach, K., Kloss, F., Hertweck, C. The molecular basis of conjugated polyyne biosynthesis in phytopathogenic bacteria. Angewandte Chemie International Edition. 53 (30), 7794-7798 (2014).
- Atkins, T., et al. A mutant of Burkholderia pseudomallei, auxotrophic in the branched chain amino acid biosynthetic pathway, is attenuated and protective in a murine model of melioidosis. Infection and Immunity. 70 (9), 5290-5294 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved