Method Article
توحيد وصيانة 3D الكلاب الكبد والثقافات العضوية المعوية للاستخدام في البحوث الطبية الحيوية
In This Article
Summary
يتم وصف الطرق التجريبية لحصاد الخلايا الجذعية البالغة من الأنسجة المعوية والكبدية للكلاب لإنشاء ثقافات عضوية 3D. علاوة على ذلك ، تتم مناقشة التقنيات المختبرية لضمان النمو المتسق وتوفير إجراءات تشغيل قياسية للحصاد والبنك الحيوي وإحياء مزارع الكلاب المعوية والكبدية.
Abstract
تصاب الكلاب بأمراض معقدة متعددة العوامل مماثلة للبشر ، بما في ذلك الأمراض الالتهابية وأمراض التمثيل الغذائي والسرطان. لذلك ، فإنها تمثل نماذج حيوانية كبيرة ذات صلة مع إمكانات انتقالية للطب البشري. المواد العضوية هي 3 أبعاد (3D) ، وهي هياكل ذاتية التجميع مشتقة من الخلايا الجذعية التي تحاكي التشريح الدقيق وعلم وظائف الأعضاء لجهازها الأصلي. يمكن استخدام هذه النماذج الانتقالية في المختبر لنفاذية الأدوية وتطبيقات الاكتشاف ، وتقييم السموم ، وتوفير فهم ميكانيكي للفيزيولوجيا المرضية للأمراض المزمنة متعددة العوامل. علاوة على ذلك ، يمكن للكلاب العضوية تحسين حياة الكلاب المرافقة ، وتوفير مدخلات في مختلف مجالات البحوث البيطرية وتسهيل تطبيقات العلاج الشخصية في الطب البيطري. يمكن لمجموعة صغيرة من المتبرعين إنشاء بنك حيوي من العينات العضوية ، مما يقلل من الحاجة إلى حصاد الأنسجة المستمر ، حيث يمكن زراعة خطوط الخلايا العضوية إلى أجل غير مسمى. هنا ، يتم تقديم ثلاثة بروتوكولات تركز على ثقافة عضويات الكلاب المعوية والكبدية المشتقة من الخلايا الجذعية البالغة. يحدد بروتوكول عزل الكلاب العضوي طرقا لمعالجة الأنسجة وتضمين عزل الخلية في مصفوفة داعمة (مصفوفة غشاء خارج الخلية قابلة للذوبان). يصف بروتوكول صيانة الكلاب العضوية نمو العضوية وصيانتها ، بما في ذلك التنظيف والمرور جنبا إلى جنب مع التوقيت المناسب للتوسع. يصف بروتوكول الحصاد العضوي والبنوك الحيوية طرقا لاستخراج المواد العضوية وتجميدها والحفاظ عليها لمزيد من التحليل.
Introduction
القوارض هي النموذج الحيواني الأكثر استخداما للبحوث الطبية الحيوية والانتقالية1. وهي مفيدة بشكل استثنائي للتحقيق في التسبب الجزيئي الأساسي للأمراض، على الرغم من أن أهميتها السريرية للأمراض المزمنة متعددة العوامل قد تم التشكيك فيها مؤخرا2. يظهر نموذج الكلاب العديد من المزايا مقارنة بالقوارض3,4. تشترك الكلاب والبشر في أوجه التشابه في الأيض والميكروبيوم المعوي الذي تطور بسبب استهلاك النظام الغذائي البشري طوال فترات مختلفة من تدجينها5،6،7. أوجه التشابه بين الكلاب وتشريح الجهاز الهضمي البشري وعلم وظائف الأعضاء هي مثال آخر من الأمثلة 8.
بالإضافة إلى ذلك ، غالبا ما تشارك الكلاب بيئات وأنماط حياة مماثلة مع أصحابها9. يسمح العمر الأطول للكلاب مقارنة بالقوارض بالتطور الطبيعي للعديد من الحالات المزمنة10. مرض التهاب الأمعاء أو متلازمة التمثيل الغذائي هي أمثلة على الأمراض المزمنة متعددة العوامل التي تشترك في أوجه تشابه مهمة بين البشر والكلاب11،12. يمكن للتجارب قبل السريرية للكلاب التي تشمل الكلاب المصابة بأمراض تحدث بشكل طبيعي أن تولد بيانات أكثر موثوقية من تلك المكتسبة من نماذج القوارض13. ومع ذلك ، لتقليل استخدام أبحاث الحيوانات الحية والامتثال لمبادئ 3Rs (تقليل ، صقل ، استبدال) 14 ، ظهرت بدائل للاختبار في الجسم الحي باستخدام عضويات الكلاب ثلاثية الأبعاد في المختبر 15.
Organoids هي هياكل مشتقة من الخلايا الجذعية ثلاثية الأبعاد ذاتية التجميع تلخص علم وظائف الأعضاء والتشريح الدقيق لأعضائها الأصلية16,17. تم وصف هذه التقنية لأول مرة من قبل ساتو وآخرون في عام 200917 وسمحت بإجراء دراسات أكثر قابلية للترجمة في المختبر في خطوط الخلايا الظهارية مما كان ممكنا في السابق باستخدام مزارع الخلايا السرطانية ثنائية الأبعاد18،19،20. المواد العضوية مفيدة في النماذج المختبرية في العديد من التخصصات الطبية الحيوية مثل السمية قبل السريرية 21،22،23 ، أو الامتصاص ، أو دراسات التمثيل الغذائي24،25،26،27،28 ، وكذلك في النهج الطبية الشخصية29،30،31 . تم وصف الثقافة الناجحة للعضويات المعوية للكلاب لأول مرة في عام 201912 ، في حين تم الإبلاغ عن المواد العضوية الكبدية المشتقة من لأول مرة من قبل Nantasanti et al. في عام 201532. ومنذ ذلك الحين تم استخدام عضويات الكلاب بنجاح في الدراسات التي تبحث في الاعتلالات المعوية المزمنة للكلاب ، وأورام اللحمية المعدية المعوية ، وسرطان القولون والمستقيم الغدي 12 ، ومرض ويلسون33،34.
في حين يمكن حصاد الخلايا الجذعية البالغة عن طريق الاستئصال ، فإن التكنولوجيا العضوية لا تتطلب دائما التضحية بالحيوانات. الخزعات بالمنظار والمنظار، أو حتى شفط الأعضاء بالإبرة الدقيقة35، هي مصدر قابل للتطبيق للخلايا الجذعية البالغة للعزل العضوي الظهاري12. ويسهل الاستخدام الواسع النطاق لهذه التقنيات غير الغازية في الممارسة البيطرية خيارات البحوث الانتقالية العكسية (ترجمة المعلومات من الممارسة السريرية البيطرية إلى الممارسة السريرية البشرية والعكس صحيح)15. يمكن ضمان المزيد من التقدم في التكنولوجيا العضوية من خلال توحيد ثقافة العضوية وطرق الصيانة. يعتمد البروتوكول العضوي المعروض هنا جزئيا على العمل المنشور سابقا ل Saxena et al. من عام 201536 ، وتم تكييف الطرق لتناسب تفاصيل ثقافة الكلاب المعوية والكبدية. ويبين الشكل 1 سير العمل العام لبروتوكولات الكلاب العضوية.
يقدم بروتوكول عزل الكلاب العضوي طرقا للحصول على عينات من الخزعات بالمنظار والمنظار والجراحة ، بالإضافة إلى النخر. وهو يحدد المعالجة الأولية المسبقة لعينات الأنسجة والمنهجيات المستخدمة للنقل إلى المختبر. يتم تلخيص المواد والكواشف اللازمة للعزل العضوي في قسم "التحضير للعزلة". يتم وصف عملية عزل الخلايا الجذعية البالغة من عينات الأنسجة بمزيد من التفصيل. أخيرا ، تتم مناقشة عملية طلاء المواد العضوية في هياكل تشبه القبة باستخدام مصفوفة غشاء خارج الخلية قابلة للذوبان.
البروتوكول الثاني ، بروتوكول صيانة الكلاب العضوية ، يصف طرق توثيق وزراعة المواد العضوية. تتم مناقشة تغييرات الوسائط وتواترها في هذا القسم. علاوة على ذلك ، يتم وصف الإجراءات المختبرية مثل تمرير وتنظيف مزارع الخلايا ، والتي تعد ضرورية لضمان الصيانة الناجحة للعضويات الكلاب 3D. يعد التمرير المناسب خطوة حاسمة في البروتوكول ، ويتم مناقشة التعديلات المحتملة واستكشاف الأخطاء وإصلاحها لهذه الخطوة بشكل أكبر في المخطوطة.
البروتوكول الأخير هو حصاد الكلاب العضوي وبروتوكول البنوك الحيوية الذي يحتوي على طرق لإعداد المواد العضوية الكاملة النمو لتضمين البارافين والحفاظ على الحمض النووي الريبي. كما يتم وصف طرق عينات العضوية من البنوك الحيوية في تخزين النيتروجين السائل هنا. وأخيرا، تتم مناقشة طرق إذابة العينات المجمدة ودعم نموها.
في الختام ، تهدف هذه المقالة إلى توفير إجراءات متسقة للاستزراع العضوي للكلاب من خلال توحيد البروتوكولات بين المختبرات. ومن خلال القيام بذلك، تهدف المخطوطة إلى تسهيل تكرار البيانات المستمدة من النماذج العضوية للكلاب لزيادة أهميتها في البحوث الطبية الحيوية الانتقالية.

الشكل 1: سير عمل بروتوكولات الكلاب العضوية. يصف بروتوكول عزل الكلاب العضوي إعداد المواد اللازمة للعزل العضوي ، وحصاد عينة من الأنسجة (من خلال وسائل النخر ، والمنظار ، والمنظار ، والخزعات الجراحية) ، والتوجيه بشأن تفكك الخلايا وطلاء السكان الخلويين. يناقش بروتوكول صيانة الكلاب العضوية تنظيف وتمرير ثقافة العضوي. يناقش بروتوكول الحصاد العضوي والبنوك الحيوية إعداد عينات عضوية لتضمين البارافين والمزيد من التوصيف العضوي. كما تناقش طرق المزارع العضوية للبنوك الحيوية وإحيائها من التخزين في النيتروجين السائل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
تمت الموافقة على البحث وتنفيذه وفقا للجنة المؤسسية لرعاية الحيوانات واستخدامها بجامعة ولاية أيوا (IACUC-19-337; IACUC-18-065; IACUC-19-017).
ملاحظة: يصف القسم التالي (الخطوات من 1 إلى 3) بروتوكول عزل الكلاب العضوية.
1. التحضير للعزل
- أنابيب النقل: قبل العزل العضوي (عادة قبل 24 ساعة) ، املأ أنبوبا مخروطيا سعة 50 مل ب 10 مل من خليط Dulbecco المعدل من النسر المتوسط / المغذيات F-12 (Advanced DMEM / F12) المخصب ب 0.2 مل من Pen Strep.
- بالنسبة للخزعات بالمنظار أو الشق أو الاستئصالي ، قم بإعداد ثلاثة أنابيب مخروطية إضافية بسعة 50 مل. املأ هذه الأنابيب ب 10 مل من محلول مخلب كامل (1x CCS ؛ انظر الجدول 1).
ملاحظة: بالنسبة للخطوة 1.2 ، يمكن أيضا استخدام 2 mM N-Acetylcysteine (NAC) في محلول ملحي مخزنة مؤقتا بالفوسفات (PBS) كحل تقليدي يستخدم لحصاد الخلايا الجذعية. لم تكن هناك اختلافات لوحظت عند استخدام 1x CCS أو NAC في PBS. تتم إضافة كلا الحلين لإطلاق الخلايا في المحلول. - حافظ على الأنابيب عند 4 درجات مئوية بين عشية وضحاها وانقل الأنابيب على الجليد لبقية البروتوكول.
- قم بإعداد خمسة أنابيب طرد مركزي سعة 15 مل مع 5 مل من 1x CCS ، وأنبوب طرد مركزي واحد 15 مل مع 3 مل من 1x CCS ، وأنبوب طرد مركزي فارغ 15 مل (أنبوب فائق) ، وأنبوب طرد مركزي واحد 15 مل مع 5 مل من 1x CCS و 2 مل من مصل البقر الجنيني (FBS).
ملاحظة: يمكن إعداد ما سبق قبل يوم العزل إذا تمت معالجة عينات متعددة. للتوضيح، راجع تخطيط أنبوب العزل في الشكل 2. - في يوم العزل ، قم بإعداد طبق بتري ومشرط ودلو ثلج و DMEM / F12 متقدم بارد في خزانة السلامة الأحيائية. ضع العدد المطلوب من لوحات زراعة الخلايا المكونة من 24 بئرا في الحاضنة (37 درجة مئوية ؛ 5٪ من الغلاف الجوي CO2 ) للتسخين المسبق.
- ضع مصفوفة الغشاء خارج الخلية المذابة (ECM ؛ انظر جدول المواد) على الجليد لبدء الذوبان.
ملاحظة: الغمر في الجليد يحمي من الذوبان السريع ويساعد على تجنب التصلب. يمكن وضع صندوق من أطراف الماصة في الفريزر للمساعدة في طلاء ECM القابل للذوبان. - قم بتبريد جهاز الطرد المركزي إلى 4 درجات مئوية.
- انقل الوسائط الكاملة مع عوامل النمو "CMGF+" أو "الوسائط العضوية" (انظر الجدول 1 للتركيب) من الفريزر / الثلاجة إلى حمام مائي 37 درجة مئوية. تجنب التعرض المباشر للضوء عندما يكون ذلك ممكنا.
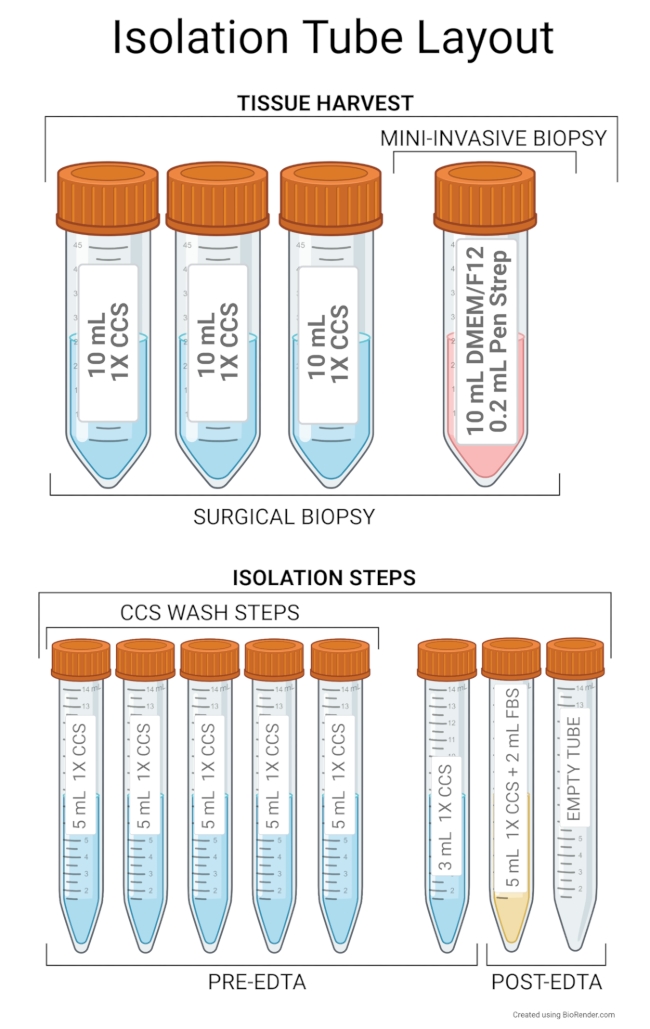
الشكل 2: تخطيط أنبوب العزل. يتضمن الإعداد الموصى به لحصاد الأنسجة 10 مل من DMEM / F12 المتقدم و 0.2 مل من Pen Strep في أنبوب طرد مركزي سعة 50 مل. بالإضافة إلى ذلك ، هناك حاجة إلى ثلاثة أنابيب سعة 50 مل مملوءة ب 10 مل من 1x CCS للخزعات الجراحية أو النخر. يتضمن تخطيط الأنبوب الموصى به لخطوات العزل خمسة أنابيب تحتوي على 5 مل من 1x CCS لاستخدامها أثناء خطوات غسيل CCS. يستخدم الأنبوب الأول كأنبوب عينة يحتوي على الأنسجة المفرومة ، وتعمل الأنابيب المتبقية كخزانات من 1x CCS لإضافتها إلى الأنبوب الأول. يحتوي الأنبوب السادس على 3 مل من 1x CCS لتنظيف الأنسجة المتبقية من أنبوب العينة عند نقلها إلى لوحة من 6 آبار. سيتم استخدام هذه الأنابيب الستة قبل خطوة حضانة EDTA. أنبوب يحتوي على 5 مل من 1x CCS و 2 مل من FBS بمثابة أنبوب عينة بعد حضانة EDTA ، ويتم نقل supernatant من هذا الأنبوب مع الخلايا الجذعية إلى أنبوب فارغ لبقية العزل. حافظ على الأنابيب عند 4 درجات مئوية قبل البدء في العزل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. حصاد الأنسجة
- يمكن الحصول على خزعات بالمنظار المعوي والمنظار (قطرها 2.8 مم) باستخدام ملقط خزعة كبير. حصاد ما لا يقل عن ثماني عينات بالمنظار لكل موقع معوي.
- جمع العينات مباشرة في أنابيب النقل ووضعها على الجليد.
- بالنسبة للخزعات الجراحية والنخر ، قم بحصاد قطع الأنسجة بحجم 0.5 سم × 0.5 سم ووضعها في أول أنبوب CCS 1x.
ملاحظة: بالنسبة للخزعات المعوية ، قم بإزالة أي محتوى معوي متبقي وكشط الطبقة المخاطية باستخدام مشرط لإزالة الزغب. إذا كانت العينات وفيرة ، فيمكن جمع خزعات إضافية في كريوفيات تحتوي على كاشف تخزين الحمض النووي الريبي (1 مل) أو البارافين المضمن للمقارنة المستقبلية بين المواد العضوية وأنسجتها الأصلية. في حالة أخذ الخزعات لتحليل TEM ، لا تكشط الزغب وتخزن العينة في المواد الحافظة (3٪ paraformaldehyde و 3٪ glutaraldehyde في محلول ملحي مخزن بالفوسفات (PBS)) وتخزينها عند 4 درجات مئوية. - هز أنبوب CCS 1x بقوة لمدة ~ 30 ثانية ، ثم انقل العينة إلى أنبوب CCS 1x جديد باستخدام ملقط. كرر هذه العملية مرتين.
- انقل العينة من آخر أنبوب CCS 1x إلى أنبوب النقل (Advanced DMEM / F12 + Pen Strep) وأعد العينة إلى المختبر.
ملاحظة: يمكن أيضا شحن العينات المعالجة مسبقا بهذه الطريقة بين عشية وضحاها على الجليد (لا تشحن على الثلج الجاف).
3. العزل العضوي
ملاحظة: إجراء العزل باستخدام تقنيات التعقيم في خزانة السلامة الأحيائية. انظر الشكل 3 لسير عمل عزل الكلاب العضوية.
- هز عينة الأنسجة في أنبوب النقل لمدة ~ 30 ثانية وإزالة supernatant المفرط حتى يكون هناك 0.5 مل اليسار في الأنبوب عن طريق السحب البطيء بالقرب من سطح السائل. تأكد من عدم التخلص من أي أنسجة.
- انقل الأنسجة وبقايا السوبرنات إلى طبق بتري معقم. باستخدام مشرط يمكن التخلص منه (أو ملقط ومقص معقم) ، قم بتقطيع الأنسجة وفرمها إلى قطع أصغر (بحجم 1 مم 2) تشبه قوام الهريس لمدة 5 دقائق تقريبا.
- ضع الأنسجة المفرومة مع السائل من طبق بتري إلى أنبوب CCS الأول. أضف 2 مل من DMEM / F12 المتقدم إلى طبق بتري ، واغسل الأنسجة المتبقية ، وانقلها إلى أنبوب CCS الأول.
- دوامة أنبوب CCS 1x لمدة 5 ثانية تقريبا خمس مرات. اسمح للخزعات بالاستقرار في قاع أنبوب 15 مل (حوالي 1 دقيقة) وقم بإزالة supernatant حتى يتبقى 5 مل في الأنبوب. نقل CCS 1x من الأنبوب الجديد إلى أنبوب العينة.
- كرر الخطوة السابقة للأنبوبين التاليين. في الغسولين الأخيرين ، قم بإزالة supernatant حتى 3 مل المتبقية في الأنبوب.
- انقل الخزعات و 1x CCS من أنبوب العينة إلى بئر واحد من لوحة 6 آبار. ثم ، أضف 3 مل من 1x CCS إلى أنبوب العينة ، وقم بالدوران بلطف لجمع أي أنسجة متبقية ، ونقلها إلى نفس بئر اللوحة.
- أضف 150 ميكرولتر من 0.5 M EDTA (لتحقيق حجم إجمالي قدره 6.15 مل في بئر). ضع الصفيحة المكونة من 6 آبار على خلاط/هزاز مجعد بزاوية 20 درجة و24 دورة في الدقيقة عند 4 درجات مئوية. احتضان عينات الكبد لمدة 10 دقائق والعينات المعوية لمدة 1 ساعة على الروك المتحرك.
- انقل اللوحة المكونة من 6 آبار مرة أخرى إلى خزانة السلامة الأحيائية. انقل الأنسجة المفرومة والسائل إلى أنبوب 1x CCS / FBS واسمح للأنسجة بالاستقرار. انقل السوبرناتانت (يتضمن هذا الجزء الآن الخلايا الجذعية الحرة) وحوالي 0.2 مل من الجزء العلوي من الأنسجة إلى الأنبوب الفارغ.
- قم بتدوير الأنبوب الذي يحتوي على العينة (700 × g لمدة 5 دقائق عند 4 درجات مئوية). يتم الآن تكوير الخلايا الجذعية جنبا إلى جنب مع الأنسجة المفرومة. قم بإزالة والتخلص من supernatant بعناية حتى لا تزعج الكرية.
- أعد تعليق الكريات في Advanced DMEM/F12 وقم بتدوير الأنبوب مرة أخرى (700 × جم لمدة 5 دقائق عند 4 درجات مئوية). استنشاق supernatant ولا تزعج الكرية.
- احسب حجم ECM القابل للذوبان اللازم لبذر الخلايا والأنسجة المنفصلة. استخدم 30 ميكرولتر من ECM المذاب لكل بئر من صفيحة 24 بئرا لتحقيق كثافة البذر المناسبة.
ملاحظة: قم بتضمين عينة بعد العزل في 4 إلى 6 آبار من صفيحة مكونة من 24 بئرا (أي بناء على كمية الأنسجة المفرومة في العينة). - أضف الحجم المحسوب ل ECM القابل للذوبان إلى أنبوب العينة وقم بماصة ببطء لأعلى ولأسفل لتجنب تكوين فقاعات. زرع التعليق في منتصف الآبار بحيث يمكن ل ECM المذاب أن يشكل بنية تشبه القبة.
ملاحظة: يساعد استخدام أطراف الماصة من الفريزر -20 درجة مئوية في طلاء ECM القابل للذوبان. إذا كانت قطع الأنسجة أكبر من طرف الماصة P200، فاستخدم أطراف باردة عريضة أو قطع أطراف P1000 الباردة للمساعدة في الطلاء. احتفظ بالعينة مع ECM المذاب على الجليد كلما أمكن ذلك. - انقل اللوحة إلى حاضنة (37 درجة مئوية ؛ 5٪ من الغلاف الجوي CO2 ) واسمح ل ECM المذاب بالتصلب لمدة 30 دقيقة تقريبا.
- امزج مثبط ROCK و GSK3β في CMGF + (التركيزات في الجدول 1). أضف 500 ميكرولتر من هذا الحل (CMGF + R / G) إلى كل بئر. ضع اللوحة في الحاضنة (37 درجة مئوية ؛ 5٪ من الغلاف الجوي CO2 ).

الشكل 3: سير عمل عزل الكلاب العضوية. يتم نقل عينة الأنسجة التي تم حصادها إلى طبق بتري وفرمها بشكل صحيح. ثم يتم نقل العينة إلى أنبوب CCS 1x ، ويتم تنفيذ خطوات الغسيل. بالنسبة لحضانة EDTA في صفيحة من 6 آبار ، يتم نقل العينة بعد ذلك إلى أنبوب يحتوي على 1x CCS و FBS. بعد أن يستقر النسيج ، يتم نقل supernatant مع كمية صغيرة من الأنسجة إلى أنبوب فارغ. وبالتالي يتم نسج العينة ، وإزالة supernatant ، وإعادة تعليق الكريات في Advanced DMEM / F12. يتم نسج الأنبوب مرة أخرى ، ويتم شفط supernatant والتخلص منه. يضاف ECM المذاب إلى الأنبوب ، ويخلط ، ويتم طلاء العينة في لوحة من 24 بئرا. وبالتالي يتم احتضان اللوحة (37 درجة مئوية ؛ 5٪ من الغلاف الجوي CO2 ) لمدة 30 دقيقة ، ثم تضاف الوسائط. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
ملاحظة: يصف القسم التالي (الخطوتان 4 و 5) بروتوكول صيانة الكلاب العضوية. قم بتغيير الوسائط وفقا للجدول 2 وتحقق من المواد العضوية يوميا بحثا عن علامات موت الخلايا المبرمج والتلوث والاكتظاظ وانفصال ECM القابل للذوبان. يجب تدوين الملاحظات اليومية وفقا للشكل 4 لرصد الظروف والآثار التجريبية على الثقافات بدقة. انظر الجدول التكميلي 1 للحصول على نموذج يسمح بتدوين ملاحظات دقيقة وقابلة للتكرار تتعلق بالثقافة العضوية. بالنسبة للعضويات الكبدية، استخدم CMGF+ المحسن بمثبط ROCK وGSK3β.

الشكل 4: دليل الحجم العضوي والكثافة . (أ) مخطط حجم العضوية لتتبع دقيق لنمو العضوي. يتضمن دليل التحجيم فئات صغيرة جدا (XS) وصغيرة (S) ومتوسطة (M) وكبيرة (L) وكبيرة جدا (XL). (ب) يتكون دليل الكثافة من فئات منخفضة الكثافة جدا (VLD) ، وكثافة منخفضة (LD) ، وكثافة متوسطة (MD) ، وكثافة عالية (HD) ، وفئات عالية الكثافة (VHD). (ج) صور تمثيلية للتلوث البكتيري والفطري للعينة العضوية. (د) صور تمثيلية للاكتظاظ العضوي وموت الخلايا المبرمج. يشار إلى التكبير الموضوعي في كل لوحة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| توصية بتغيير وسائل الإعلام | ||||||
| الاثنين | الثلاثاء | الأربعاء | الخميس | الجمعة | السبت | الأحد |
| 500 ميكرولتر | غير متوفر | 500 ميكرولتر | غير متوفر | 750 ميكرولتر | غير متوفر | غير متوفر |
الجدول 2: توصية بتغيير وسائط الإعلام. جدول زمني موصى به لتغيير الوسائط الأسبوعية. يوصى بتغيير الوسائط (500 ميكرولتر من CMGF + للعضويات المعوية ، أو 500 ميكرولتر من CMGF + R / G للعضويات الكبدية) كل يوم. لحساب الساعات الإضافية في عطلة نهاية الأسبوع ، تتم إضافة 750 ميكرولتر من الوسائط بعد ظهر يوم الجمعة ، مع تحديث وسائل الإعلام صباح يوم الاثنين.
4. التنظيف العضوي
ملاحظة: يجب إجراء التنظيف العضوي أو المرور بانتظام للحفاظ على صحة الثقافة العضوية. قم بإجراء التنظيف كلما لوحظ موت الخلايا المبرمج في الثقافة ، أو وجود حطام ، أو اكتظاظ المواد العضوية ، أو انفصال ECM القابل للذوبان. ارجع إلى الشكل 4D.
- قم بإزالة الوسائط من الآبار أثناء إمالة اللوحة لتجنب تدمير ECM القابل للذوبان.
ملاحظة: إذا كانت مفرزة ECM القابلة للذوبان كبيرة، ينصح بنقل الوسائط إلى أنبوب 15 مل لتجنب فقدان شظايا ECM القابلة للذوبان التي تحتوي على العينة. - أضف 0.5 مل من DMEM / F12 المتقدم المبرد مسبقا إلى كل بئر لإذابة قباب المصفوفة عن طريق السحب المتكرر باستخدام طرف P1000 (تجنب إنشاء فقاعات مفرطة). انقل المصفوفة المذابة المحتوية على عضويات إلى أنبوب طرد مركزي سعة 15 مل. احتفظ بالأنبوب على الجليد وإذا كان الحجم أقل من 6 مل ، فقم بملء الأنبوب ببطء باستخدام DMEM / F12 المتقدم للوصول إلى حجم إجمالي يبلغ 6 مل.
- قم بتدوير الأنبوب (700 × جم لمدة 5 دقائق عند 4 درجات مئوية) وقم بإزالة كل السوبرناتانت مع التأكد من عدم إزعاج الكريات.
- أضف الحجم المطلوب من ECM القابل للذوبان (30 ميكرولتر لكل بئر لتحقيق كثافة البذر المناسبة) وأعد تعليق الكريات ببطء عن طريق خلط الماصة. لوحة التعليق في منتصف لوحة 24 بئر لتشكيل قبة.
- ضع اللوحة في حاضنة (37 درجة مئوية ؛ 5٪ جو CO2 ) لمدة ~ 30 دقيقة ، ثم أضف الحجم المناسب من الوسائط (الجدول 2).
5. تمرير العضوية
ملاحظة: عادة ما يتم إجراء عملية المرور بعد 5-7 أيام من الزراعة الأولية لتوسيع خط الخلايا العضوية. يمكن عادة توسيع الثقافات العضوية بنسبة 1: 3. يمكن رؤية صور الثقافات الصحية الجاهزة للمرور في الشكل 4. يجب أن تكون المواد العضوية متوسطة الحجم على الأقل.
- نفذ الخطوات من 4.1 إلى 4.3.
- قم بإزالة السوبرناتانت تاركا 0.5 مل في الأنبوب. تأكد من عدم إزعاج الكريات.
- أضف 0.5 مل من البروتياز الشبيه بالتريبسين (انظر جدول المواد) ، واخلطه بشكل صحيح عن طريق الشفط باستخدام ماصة واحتضنه في حمام مائي 37 درجة مئوية (احتضن المواد العضوية المعوية لمدة 8 دقائق أو المواد العضوية الكبدية لمدة 10 دقائق). استمر في خلط المحلول عن طريق تحريك الأنبوب عدة مرات في نقطة نصف الوقت من الحضانة.
- حرك الأنبوب الذي يحتوي على العينة مرة أخرى إلى خزانة السلامة الأحيائية وأضف ببطء 6 مل من DMEM / F12 المتقدم المبرد مسبقا لتعطيل البروتياز الشبيه بالتريبسين ووقف تفكك الخلايا.
- قم بتدوير الأنبوب (700 × جم لمدة 5 دقائق عند 4 درجات مئوية) وقم بإزالة السوبرناتانت. تأكد من عدم إزعاج الكريات.
- نفذ الخطوات 4.4. و 4.5.
ملاحظة: يصف القسم التالي (الخطوات من 6 إلى 9) بروتوكول الحصاد العضوي والبنوك الحيوية. يجب أن تكون الثقافات العضوية خالية من الأنسجة التي تمت إزالتها خلال المقاطع السابقة. يجب أن تكون الثقافات صحية أيضا ، على الأقل كبيرة الحجم ، ومتوسطة إلى عالية الكثافة. يمكن رؤية صور الثقافات الصحية الجاهزة للتطبيقات النهائية في الشكل 4. يمكن أن يؤثر الانتقال إلى اتجاه المصب مع الحفاظ على الثقافات العضوية دون المستوى الأمثل وحصادها سلبا على نتائج التوصيف وجدوى البنك الحيوي. راجع تخطيط لوحة 24 بئرا الموصى به في الشكل 5.
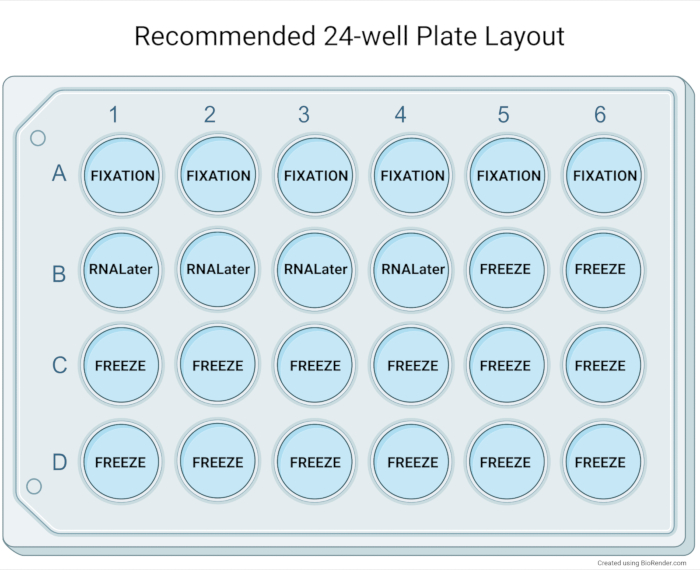
الشكل 5: تخطيط لوحة 24 بئر الموصى به. التخطيط الموصى به للوحة 24 بئرا للتوصيف الأساسي بعد توسيع الثقافة العضوية. عادة ما يسمح تضمين البارافين لستة آبار (عضويات متوسطة إلى كبيرة متوسطة إلى عالية الكثافة) بتركيز عال من المواد العضوية في كتلة الأنسجة. يمكن تجميع أربعة آبار من المواد العضوية في واحد مبرد مع كاشف تخزين الحمض النووي الريبي للتطبيقات النهائية. وتستخدم أربعة عشر بئرا في مجال البنوك الحيوية للعينات العضوية وتوفر المواد اللازمة لما يصل إلى سبع قوارير محفوظة بالتبريد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. تثبيت المواد العضوية
- قم بإزالة الوسائط من البئر وتأكد من عدم إزعاج قبة ECM القابلة للذوبان.
- أضف 500 ميكرولتر من محلول حمض الخليك والكحول الفورمالين الذي يعمل كمثبت (FAA ؛ التركيب في الجدول 1).
- تخزين المواد العضوية في درجة حرارة الغرفة. بعد 24 ساعة ، استنشق FAA واملأ البئر بنسبة 70٪ من الإيثانول. لف الألواح بشريط فيلم مرن مختبريا (انظر جدول المواد) لتجنب التبخر السريع. المواد العضوية جاهزة الآن لتضمين البارافين. يتم تنفيذ تضمين البارافين للثقافة العضوية في قوالب القاعدة المعدنية التقليدية.
7. الحفاظ على الحمض النووي الريبي
- قم بإزالة الوسائط من الآبار وتأكد من عدم إزعاج قبة ECM القابلة للذوبان.
- استخدم 0.5 مل من DMEM / F12 المتقدم المبرد مسبقا لكل بئر لإذابة قباب ECM القابلة للذوبان عن طريق السحب المتكرر لأعلى ولأسفل (تجنب إنشاء فقاعات مفرطة). نقل المواد العضوية إلى أنبوب طرد مركزي 15 مل. احتفظ بالأنبوب على الجليد وإذا كان الحجم أقل من 6 مل ، فقم بملء الأنبوب ببطء باستخدام DMEM / F12 المتقدم للوصول إلى 6 مل من الحجم الكلي.
- قم بتدوير الأنبوب (700 × جم لمدة 5 دقائق عند 4 درجات مئوية) وقم بإزالة جميع المواد الفائقة. تأكد من عدم إزعاج الكريات.
- أضف 100 ميكرولتر من PBS إلى أنبوب العينة وأعد تعليق الكريات عن طريق السحب اللطيف. انقل محتويات أنبوب العينة إلى قناة مبردة.
- أضف 900 ميكرولتر من كاشف تخزين الحمض النووي الريبي (انظر جدول المواد) إلى أنبوب العينة واخلطه لجمع أي عضويات متبقية. نقل هذه المواد العضوية المتبقية إلى المبرد وتخزينها عند -80 درجة مئوية (عادة ما تكون أربعة آبار مجمعة في واحدة مبردة كافية للتطبيقات النهائية ، بما في ذلك تسلسل qPCR و RNA).
ملاحظة: ينتج أحد المبردات عادة ما مجموعه 4000 نانوغرام من الحمض النووي الريبي (يتم قياسه عن طريق تحليل مقياس الطيف الضوئي).
8. البنوك الحيوية العضوية
ملاحظة: عادة ما تحدث البنوك الحيوية بعد 3-4 أيام من المرور. لا ينبغي أن تكون علامات موت الخلايا المبرمج موجودة في الثقافة لأداء هذه الطريقة. ارجع إلى الشكل 4 للإشارة إلى الحجم والكثافة المناسبين للتجميد. البنك الحيوي المواد العضوية المتوسطة إلى الكبيرة جدا في كثافات متوسطة إلى عالية جدا. يمكن اتباع خطوة تجميد طارئة إذا كان خط الخلايا العضوية نادرا بشكل خاص أو إذا لم يتم ضمان المزيد من الجدوى. اتبع نفس الخطوات للبنوك الحيوية العضوية العادية (الخطوات من 8.1 إلى 8.4). يتم التجميد في حالات الطوارئ مع ثقافات أصغر وأقل كثافة. قم بتجميع أكبر عدد ممكن من الآبار العضوية المتنامية في تبريد واحد باتباع الخطوات من 8.1 إلى 8.4. ضع في اعتبارك أنه يجب إبقاء عدد كاف من المواد العضوية على قيد الحياة في محاولة لتوسيع الثقافة (التجميد في حالات الطوارئ هو ببساطة إجراء احتياطي للحماية من فقدان محتمل للثقافة عن طريق التلوث أو غيرها من الأحداث غير المتوقعة).
- اتبع الخطوات من 7.1 إلى 7.3.
- أضف 1 مل من وسائط التجميد لكل تبريد (التركيب في الجدول 1) إلى أنبوب العينة وأعد تعليق الكريات بلطف عن طريق السحب لأعلى ولأسفل.
- نقل 1 مل من المحلول إلى واحد مبرد (نسبة بئرين / مبرد) والحفاظ على الكريوفيالات على الجليد.
- انقل الكريوفيالات من الجليد إلى حاوية تجميد (أعد ملء الخزان بانتظام بالأيزوبروبانول) وانقلها على الفور إلى -80 درجة مئوية. انقل العينات إلى النيتروجين السائل (-196 درجة مئوية) للتخزين على المدى الطويل بعد 24 ساعة.
ملاحظة: يمكن أيضا استخدام حاوية تجميد الخلايا الخالية من الكحول بدلا من الحاوية التقليدية. تأكد من عدم ذوبان العينات أثناء النقل من -80 درجة مئوية إلى تخزين النيتروجين السائل على المدى الطويل. الذوبان المتكرر يقلل من صلاحية ثقافة الخلايا.
9. إحياء من تخزين النيتروجين السائل
ملاحظة: عند اختيار إذابة خط عضوي ، يجب إعادة تجميد مجموعة فرعية من المواد العضوية التي تم إحياؤها واستبدالها في البنك الحيوي في أسرع وقت ممكن بواحد على الأقل (يفضل أن يكون أكثر) من الكريوفيالات.
- ضع ECM المذاب على الجليد لإذابته ببطء ، وضع صفيحة من 24 بئرا في الحاضنة (37 درجة مئوية ؛ 5٪ جو CO2) ، وإعداد الكواشف المطلوبة مثل أنبوب 15 مل و DMEM / F12 المتقدم.
- استرجع مادة مبردة تحتوي على عينة عضوية من تخزين النيتروجين السائل وانقلها على الفور إلى حمام حراري (37 درجة مئوية) لمدة 2 دقيقة.
- نقل محتويات التصريف المبرد إلى أنبوب طرد مركزي سعة 15 مل في خزانة السلامة الأحيائية. أضف ببطء DMEM/F12 المتقدم المبرد مسبقا للوصول إلى حجم إجمالي يبلغ 6 مل.
- قم بتدوير الأنبوب (700 × جم لمدة 5 دقائق عند 4 درجات مئوية). قم بإزالة السوبرناتانت وتأكد من عدم إزعاج الكرية.
- أضف 180 ميكرولتر (30 ميكرولتر لكل بئر) من ECM المذاب إلى الكريات وقم بلوحة هذا التعليق في لوحة 24 بئرا المسخنة مسبقا. يمكن طلاء أحد المبردة بستة آبار من صفيحة من 24 بئرا.
- ضع الصفيحة المكونة من 24 بئرا في الحاضنة (37 درجة مئوية ؛ 5٪ من الغلاف الجوي CO2 ) لمدة 30 دقيقة تقريبا وأضف CMGF + R / G (بالنسبة للعضويات المعوية ، قم بالتبديل إلى CMGF + في 24 إلى 48 ساعة).
ملاحظة: عندما تكون العينة مطلية وتنمو في صفيحة 24 بئرا ، يجب السماح لها بالتعافي لمدة يومين على الأقل قبل المرور لزيادة قابلية البقاء.
النتائج
عادة ما يولد بروتوكول الكلاب العضوي ~ 50,000 إلى ~ 150,000 خلية معوية أو كبدية لكل بئر من صفيحة 24 بئرا. يمكن رؤية المواد العضوية التمثيلية في الشكل 6.
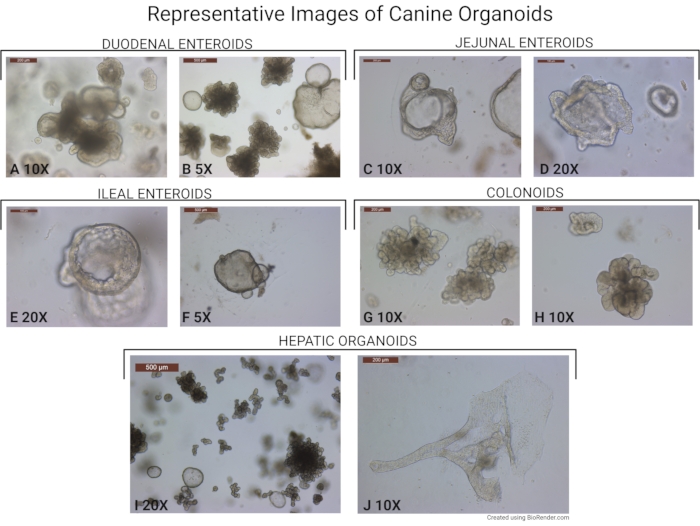
الشكل 6: صور تمثيلية للكلاب العضوية. يتم تصوير صور المواد العضوية المعزولة باستخدام هذا البروتوكول. (أ، ب) المواد العضوية المعوية المشتقة من الاثني عشر (تؤخذ في التكبير الموضوعي 10x و 5x). لاحظ وجود المواد العضوية الأكبر سنا والكروية الأصغر سنا. (ج، د) معوية الكلاب من الجزء السفلي من الصائم (تؤخذ في 10x و 20x التكبير الموضوعي). (E,F) الأمعاء اللفائفية (تؤخذ عند التكبير الموضوعي 20x و 5x) ، والقولون (G ، H) (تؤخذ عند التكبير الموضوعي 10x). (I) صورة تمثيلية للعضويات الكبدية المأخوذة عند تكبير موضوعي 20x. معظم المواد العضوية في شكلها الناشئ. يمكن أيضا رؤية كرويات كبدية أصغر سنا في الصورة. (ي) صورة تمثيلية تظهر عضويا كبديا نادرا يشكل بنية تشبه القناة (مأخوذة عند تكبير موضوعي 10x). شريط المقياس (500 ميكرومتر) موجود في الزاوية العلوية اليسرى من كل صورة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تم تمييز الأمعاء والقولون المشتقة باستخدام هذا البروتوكول سابقا من قبل تشاندرا وآخرون في عام 201912. تتكون العضويات المعوية للكلاب من مجموعة خلوية منتظمة من الظهارة المعوية. باستخدام تهجين الحمض النووي الريبي في الموقع ، والتعبير عن المؤشرات الحيوية للخلايا الجذعية (تكرار غني بالليوسين يحتوي على مستقبلات G المرتبطة بالبروتين 5 - LGR5 وعامل النسخ SRY-Box 9 - SOX9) ، والعلامة الحيوية لخلية Paneth (مستقبلات Ephrin type-B 2 - EPHB2) ، وعلامات الخلايا الظهارية الاستيعابية (الفوسفاتيز القلوي - ALP) وعلامة الغدد الصماء المعوية (Neurogenin-3 - Neuro G3)12 تم تأكيده. تم إجراء تلطيخ Alcian Blue على شرائح مدمجة بالبارافين لتأكيد وجود خلايا الكأس. بالإضافة إلى ذلك ، تم إجراء اختبارات وظيفية مثل التصوير الأيضي البصري (OMI) أو فحص تورم منظم التوصيل عبر الغشاء للتليف الكيسي (CFTR) لتأكيد النشاط الأيضي للعضويات. كما تم عزل الكلاب العضوية من الكلاب التي تم تشخيصها بمرض التهاب الأمعاء أو أورام اللحمية المعدية المعوية (GIST) أو سرطان القولون والمستقيم الغدي باستخدام هذا البروتوكول12.
بعد عزل الخلايا الجذعية ، تبدأ عضويات الكلاب الكبدية دورة حياتها ككرويات متوسعة ، وبعد حوالي 7 أيام ، تتحول إلى عضويات ناشئة ومميزة. تم قياس كرويات الكلاب الكبدية المعزولة والمستزرعة وفقا لهذا البروتوكول لتحديد نموها وتحديد الوقت المثالي للمرور. تم قياس الكرويات المشتقة من خزعات الكبد بالمنظار للكلاب البالغة السليمة (n = 7) خلال أول 7 أيام من الثقافة. تم التقاط صور تمثيلية ، وتم قياس نصف القطر الطولي (أ) والقطري (ب) للكرويات (n = 845) في جميع أنحاء الثقافة. تم حساب الحجم (V) ومساحة السطح (P) ومنطقة القطع الناقص 2D (A) ومحيط (C) من الكرويات. يتم تلخيص حسابات ونتائج التجربة في الشكل 7. تم استخدام منطقة القطع الناقص 2D ومحيطها لتقييم صحة الثقافة العضوية باستخدام المجهر الضوئي. يمكن أن تكون هذه القيم بمثابة دليل لقرارات صيانة الثقافة.
باختصار ، توسعت الكرويات بسرعة في الحجم ومساحة السطح ومنطقة القطع الناقص 2D والمحيط. تم حساب متوسط بيانات القياس من البيجل السبعة للحسابات التالية. ارتفع الحجم بنسبة 479٪ (±6٪) من اليوم 2 إلى 3. في نفس الوقت ، زادت مساحة السطح الكروي ومنطقة القطع الناقص ثنائية الأبعاد بنسبة 211٪ (±208٪) و 209٪ (±198٪) ، على التوالي. زاد محيط القطع الناقص ثنائي الأبعاد من اليوم 2 إلى 3 بنسبة 73٪ (±57٪). كانت الزيادة في الحجم الإجمالي للعضويات الكبدية من الأيام 2-7 أكثر من 365 مرة ، وزادت مساحة السطح ومنطقة القطع الناقص 2D 49 مرة ، وزاد محيط القطع الناقص 2D ست مرات.
بعد ذلك ، تم زراعة الكرويات المشتقة من عينتين من الكلاب البالغة بعد المرور وجمعها كل يوم (اليوم 2-7) لتهجين الحمض النووي الريبي في الموقع (RNA ISH). تم تصميم مجسات الكلاب (يتم توفير قائمة المسبار كجدول تكميلي 2) ، وتم تقييم تعبير mRNA لعلامات الخلايا الجذعية (LGR5) ، وعلامات خاصة بخلايا الأقنية الصفراوية (السيتوكيراتين 7 - KRT-7 ، و aquaporin 1 - AQP1) ، وكذلك علامات خلايا الكبد (بروتين صندوق الرأس الشوكي A1 - FOXA1 ؛ والسيتوكروم P450 3A12 - CYP3A12). تم تقييم التعبير عن العلامات بطريقة شبه كمية (الصور التمثيلية في الشكل 8). عبرت الكرويات بشكل تفضيلي عن علامة الخلايا الصفراوية KRT-7 التي تتراوح من 1٪ إلى 26٪ في منطقة الإشارة / المساحة الكلية للخلايا. لم يتم التعبير عن AQP1 في العينات العضوية ، ويمكن القول إن وجوده في عينات الكلاب الكبدية ضئيل. تراوح تعبير علامة الخلايا الجذعية (LGR5) بين 0.17٪ و 0.78٪ ، في حين تم التعبير عن علامات خلايا الكبد إلى حد أقل عند 0.05٪ -0.34٪ ل FOXA1 و 0.03٪ -0.28٪ ل CYP3A12.
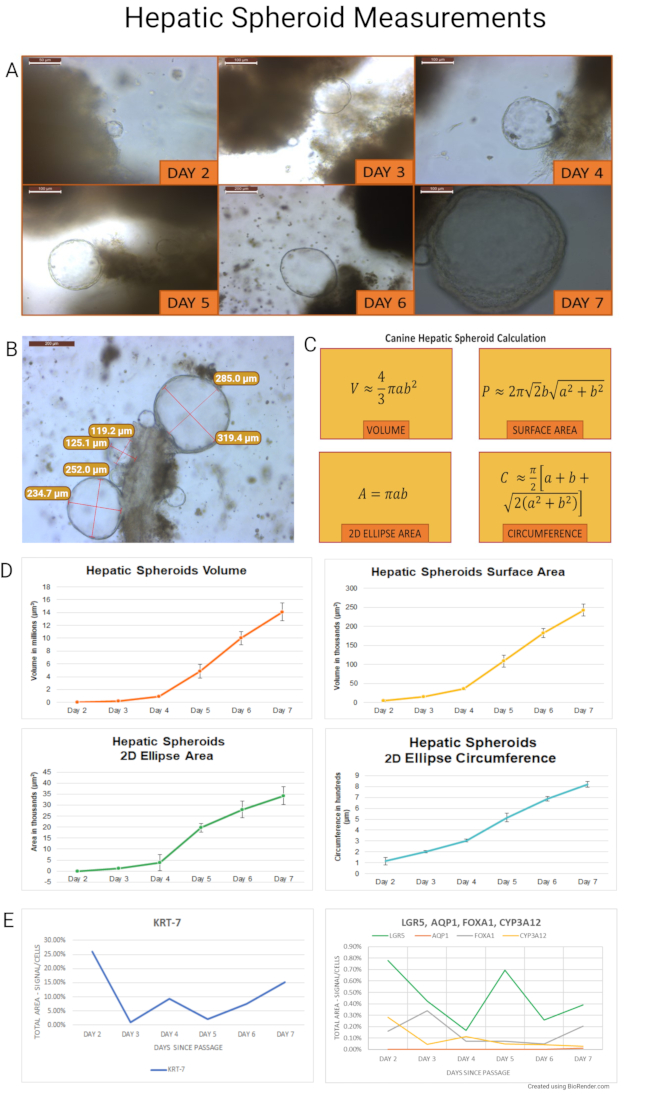
الشكل 7: قياسات كروية كبدية. (أ) لوحظ نمو كروي كبدي كل يوم من الثقافات من اليوم 2-7. تشكلت الكرويات لأول مرة في اليوم 2 ، وبدأت الكرويات الأخيرة عملية مهدها في اليوم 7. استخدمت تجربة لاحقة خطين عضويين للكلاب بعد المرور لحصاد الكرويات كل يوم لتضمين البارافين لأداء RNA ISH (تم التقاط صورة اليوم 2 عند 40x ، وصورة اليوم 6 عند 10x ، وتم التقاط بقية الصور عند تكبير 20x). (ب) تظهر مجموعة كروية كبدية متصلة بقطعة نسيج مضمنة في ECM المذاب بعد 4 أيام من العزل. تم قياس نصف القطر الطولي والقطري للكرويات (الصورة الملتقطة عند 10x). يصور الجزء (C) الصيغة المستخدمة في الحسابات لاشتقاق الحجم (V) ومساحة السطح (P) ومنطقة القطع الناقص 2D (A) والمحيط (C). بالنسبة لهذه الحسابات ، كان من المفترض أن الكلاب الكروية الكبدية هي كرويات مثالية. يتم تصوير نتائج قياسات حجم الكرويات الكبدية ، ومساحة السطح ، ومنطقة القطع الناقص 2D ، ومحيط القطع الناقص 2D لأيام النمو الفردية في اللوحة (D). تمثل أشرطة الخطأ الخطأ القياسي للمتوسط (SEM). (ه) تم قياس تعبير mRNA ل KRT-7 و LGR5 و FOXA1 و CYP3A12 في عينات من الكرويات الكبدية للكلاب بعد مرور اليوم 2 إلى اليوم 7. لم يتم التعبير عن AQP1 في هذه العينات. يوجد شريط مقياس (5x: 500 ميكرومتر؛ 10x: 200 ميكرومتر؛ 20x: 100 ميكرومتر؛ 40x: 50 ميكرومتر) في أعلى يسار كل صورة. لاحظ التكبير الموضوعي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
نادرا ما لا تتفكك المواد العضوية أثناء عملية المرور باتباع هذه التقنية الموحدة. إذا لم يحدث الانفصال ، يمكن ضبط أوقات المرور لتحقيق التفكك الأمثل لعنقود الخلايا. ومع ذلك ، فإن التعرض لفترات طويلة للبروتياز الشبيه بالتريبسين يمكن أن يؤثر سلبا على نمو المواد العضوية. تم استخدام المواد العضوية الكبدية في تجربة لاحقة للتحقيق في وقت التفكك الأمثل وإنشاء طريقة تمرير مناسبة. باختصار ، تم تمرير المواد العضوية الكبدية من كلبين أصحاء (6 نسخ جيدة لكل منهما) مع البروتياز الشبيه بالتريبسين لمدة 12 دقيقة و 24 دقيقة. تم تحريك العينات كل 6 دقائق. في نهاية نقطة التفكك ، تمت إضافة 6 مل من DMEM / F12 المتقدم البارد إلى المحلول ، وتم نسج العينات (700 × g لمدة 5 دقائق عند 4 درجات مئوية). تمت إزالة المادة الفائقة (Advanced DMEM / F12 مع البروتياز المخفف الشبيه بالتريبسين) ، وتم تضمين الكريات في ECM المذاب كما هو موضح أعلاه (الخطوات 4.4-4.5). بعد 12 ساعة من الاستزراع في ECM المذاب و CMGF + R / G ، لوحظت اختلافات في كلتا العينتين. لم تمنع الحضانة لمدة 12 دقيقة مع البروتياز الشبيه بالتريبسين نمو الأعضاء العضوية. ومع ذلك ، تأثر نمو المواد العضوية سلبا (انظر الشكل 9) باستخدام حضانة لمدة 24 دقيقة.

الشكل 9: تجربة مرور الكلاب العضوية الكبدية. صور تمثيلية للعضويات المستمدة من كلبين (D_1 و D_2) تم تمريرها باستخدام طريقة حضانة البروتياز الشبيهة بالتريبسين لمدة 12 دقيقة أو 24 دقيقة. تم تمرير عينات التحكم باستخدام البروتياز الشبيه بالتريبسين لمدة 10 دقائق. يوجد شريط مقياس (μm) في أعلى يسار كل صورة ويمثل 500 ميكرومتر (تكبير موضوعي 5x). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
بعد ذلك ، تم إجراء التحقيق في بقاء الأعضاء العضوية الكبدية للكلاب المشتقة من هذا البروتوكول في بيئة غير مواتية (الحرمان من الدعم الهيكلي والتغذية). ركز التحقيق على تحديد حجم الوسائط العضوية ومصفوفة الطابق السفلي اللازمة للنمو الناجح للعضوي الكبدي وبقائه على قيد الحياة وأيضا تحديد تأثير هذه الظروف على الثقافة العضوية. تم قياس البقاء على قيد الحياة في صفيحة 96 بئرا مع عدد محدود من المواد العضوية. تم تمرير المواد العضوية من كلبين كما هو موضح أعلاه وتضمينها (12 نسخة متماثلة) في أحجام مختلفة من ECM المذاب (10 ميكرولتر أو 15 ميكرولتر). تم طلاء الخلايا بتركيز 400 خلية / بئر 10 ميكرولتر و 600 خلية / 15 ميكرولتر بئر يتوافق مع 40000 خلية / مل. تمت إضافة نوعين من الوسائط (CMGF + أو CMGF + R / G) في أحجام مختلفة (25 ميكرولتر أو 30 ميكرولتر أو 35 ميكرولتر). ولم تتغير وسائط الإعلام قط، ولم تجر أي إجراءات صيانة. تمت مراقبة بقاء المواد العضوية كل يوم. تم تعريف الموت العضوي على أنه ذوبان أكثر من 50٪ من الهياكل العضوية. وتراوح معدل بقاء المواد العضوية في هذه الظروف بين 12.9 (±2.3) يوما و18 (±1.5) يوما، ويرد موجز للنتائج في الجدول 3. العينتان اللتان نجتا من أطول فترة كانتا عضويتين مشتقتين من الكلاب المضمنة في 15 ميكرولتر من ECM المذاب و 30 ميكرولتر من وسائط CMGF +. تم تضمين كلتا العينتين في ECM القابل للذوبان (30 ميكرولتر) والوسائط الطازجة (500 ميكرولتر) في صفيحة قياسية من 24 بئرا بعد 18 يوما من الحرمان لضمان استمرار التوسع العضوي (الشكل 10).
| نوع الوسائط | المتوسط (الأيام التي نجت فيها) | متوسط | السيرة الذاتية٪ | المتوسط (الأيام التي نجت فيها) | متوسط | السيرة الذاتية٪ | المتوسط (الأيام التي نجت فيها) | متوسط | السيرة الذاتية٪ | المتوسط (الأيام التي نجت فيها) | متوسط | السيرة الذاتية٪ | |
| وسائل الإعلام (ميكرولتر) | 30 | 25 | 35 | 30 | |||||||||
| ECM (ميكرولتر) | 10 | 10 | 10 | 15 | |||||||||
| D_1 | CMGF + R / G | 12.50 | 13 | 11.57 | 12.83 | 13 | 4.50 | 11.83 | 11.5 | 12.91 | 12.08 | 13 | 12.46 |
| CMGF+ | 17.08 | 17 | 16.26 | 18.50 | 19 | 4.89 | 18.42 | 19 | 14.54 | 17.82 | 19 | 8.99 | |
| D_2 | CMGF + R / G | 13.67 | 14 | 13.36 | 13.00 | 13 | 12.70 | 14.00 | 14.5 | 17.23 | 13.08 | 13 | 8.90 |
| CMGF+ | 15.50 | 15 | 18.56 | 17.50 | 18 | 10.48 | 17.50 | 19 | 20.89 | 17.00 | 17 | 14.41 | |
| مجموع | CMGF + R / G | 13.08 | 13 | 13.13 | 12.92 | 13 | 9.39 | 12.92 | 13 | 17.52 | 12.58 | 13 | 11.22 |
| CMGF+ | 16.29 | 16.5 | 17.69 | 18.00 | 18.5 | 8.35 | 17.96 | 19 | 17.65 | 17.43 | 17 | 11.70 | |
| الموت = أكثر من 50٪ من الكتلة العضوية غير قابلة للحياة | |||||||||||||
الجدول 3: نتائج تجربة البقاء على قيد الحياة. استندت التجربة إلى الحرمان من الدعم الهيكلي أو التغذية لثقافتين عضويتين. وتشمل النتائج المتوسط والوسيط والانحراف المعياري (CV٪) للتركيزات الفردية من ECM المذابة والوسائط في الكلاب الفردية.
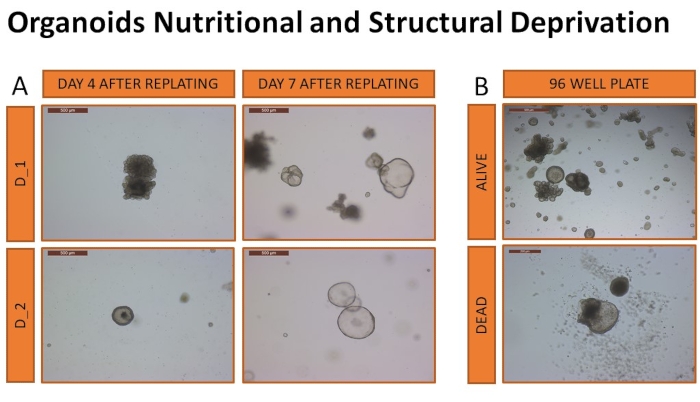
الشكل 10: الحرمان الغذائي والهيكلي من المواد العضوية. تم طلاء المواد العضوية في لوحات 24 بئر لتأكيد القدرة على التوسع بعد الحرمان (A). تظهر الصور التمثيلية من اليوم 4 واليوم 7 بعد إعادة الطلاء توسع المواد العضوية ، مما يؤكد القدرة على تحديد المواد العضوية القابلة للحياة بصريا (يتم التقاط الصور عند التكبير الموضوعي 5x). تظهر الصور التمثيلية للعضويات التي تعتبر حية أو ميتة في (B). يتم التقاط الصور بتكبير الهدف 5x. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8: الكروية الكبدية الحمض النووي الريبي في الصور التمثيلية التهجين في الموقع . تم التقاط صور تمثيلية لعلامات LGR5 و KRT7 و FOXA1 و CYP3A12 عند تكبير موضوعي 60x للعينات من اليوم 2-7 بعد المرور. جزيئات الحمض النووي الريبوزي المرسال إيجابية وصمة عار حمراء. لم يتم التعبير عن AQP1 في العينات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| تركيبة محلول مخلب غير مكتمل (ICS) | التركيز النهائي |
| 500 مل H2O | غير متوفر |
| 2.49 غ Na2HPO4-2H2O | 4.98 ملغم/مل |
| 2.7 غ KH2PO4 | 5.4 ملغم/مل |
| 14 غرام كلوريد الصوديوم | 28 ملغم/مل |
| 0.3 غرام كيلو لتر | 0.6 ملغم/مل |
| 37.5 غ سكروز | 75 ملغم/مل |
| 25 غرام د-سوربيتول | 50 ملغم/مل |
| تركيبة محلول مخلب كاملة (CCS) | V / V ٪ أو التركيز النهائي |
| حل مخلب غير مكتمل | 20% |
| H2O معقمة | 80% |
| دي تي تي | 520 ميكرومتر |
| القلم العقدي | القلم: 196 U / mL; بكتيريا 196 ميكروغرام/مل |
| تكوين الوسائط العضوية | التركيز النهائي |
| DMEM / F12 المتقدم | غير متوفر |
| FBS | 8% |
| جلوتاماكس | 2 مللي متر |
| هيبس | 10 مللي متر |
| بريموسين | 100 ميكروغرام/مل |
| ملحق B27 | 1x |
| ملحق N2 | 1x |
| N-أسيتيل-L-السيستين | 1 مللي متر |
| مورين EGF | 50 نانوغرام/مل |
| مورين نوجين | 100 نانوغرام/مل |
| الإنسان R-Spondin-1 | 500 نانوغرام/مل |
| مورين Wnt-3a | 100 نانوغرام/مل |
| [Leu15]-غاسترين الأول الإنسان | 10 نانومتر |
| نيكوتيناميد | 10 مللي متر |
| أ-83-01 | 500 نانومتر |
| SB202190 (مثبط P38) | 10 ميكرومتر |
| TMS (تريميثوبريم سلفاميثوكسازول) | 10 ميكروغرام/مل |
| مكونات إضافية | التركيز النهائي |
| مثبط الصخور (Y-27632) | 10 ميكرومتر |
| ستيموليكول CHIR99021 (GSK3β) | 2.5 ميكرومتر |
| تجميد تكوين الوسائط | V / V النسبة المئوية |
| الوسائط العضوية ومثبطات ROCK | 50% |
| FBS | 40% |
| ثنائي ميثيل سلفوكسيد (DMSO) | 10% |
| تكوين FAA | V / V النسبة المئوية |
| الإيثانول (100٪) | 50% |
| حمض الخليك ، الجليدية | 5% |
| الفورمالديهايد (37٪) | 10% |
| ماء مقطر | 35% |
الجدول 1: تكوين الحلول والوسائط. قائمة بمكونات وتركيزات المحاليل المخلبية غير المكتملة والكاملة ، CMGF + (الوسائط العضوية) ، وسائط التجميد ، و FAA.
الجدول التكميلي 1: قالب الرعاية العضوية. يسمح هذا القالب بتدوين ملاحظات عضوية دقيقة وقابلة للتكرار لكل يوم. يرجى النقر هنا لتنزيل هذا الجدول.
الجدول التكميلي 2: مجسات التهجين في الموقع للحمض النووي الريبي. قائمة المجسات المصممة خصيصا لأهداف mRNA الكلاب من قبل الشركة المصنعة للتكنولوجيا لأداء تقنية التهجين RNA في الموقع. يتم سرد المعلومات حول أهمية العلامات الفردية واسم المسبار ورقمه المرجعي والمنطقة المستهدفة. يرجى النقر هنا لتنزيل هذا الجدول.
Discussion
يوجد حاليا نقص في البروتوكولات الموحدة المتاحة لعزل وصيانة الكلاب العضوية الكبدية والمعوية. إن وضع إجراءات تشغيل موحدة للمزارع العضوية له ما يبرره لكي يكون هذا النموذج قابلا للتطبيق في بيئات مختبرية مختلفة. على وجه التحديد ، يعد توفير بروتوكولات تشغيل موحدة لزراعة نماذج الكلاب العضوية هذه أمرا أساسيا لتوصيف النمو الطبيعي للعضويات أثناء الزراعة والمرور لاشتقاق نقاط زمنية مثالية للتوسع والصيانة. وقد سبق أن تميزت الكلاب العضوية المعوية المستزرعة باستخدام البروتوكول من قبل تشاندرا وآخرون 12.
واحدة من أهم خطوات البروتوكول هي تمرير المواد العضوية. تم تحديد الوقت الأمثل للمرور الأول من الكرويات الكبدية ليكون في اليوم 7 بعد العزل بناء على قياسات كروية كبدية. تم تحقيق الحد الأقصى لحجم الكرويات بحلول اليوم 7 ، وفي الوقت نفسه ، بدأت الكرويات في البرعم وشكلت عضويات كبدية. كانت الزيادة في الحجم الكلي للعضويات من اليوم 2-7 بعد العزل أكثر من 365 مرة ، مما يشير إلى أن وقت المرور الأمثل أطول من ثقافة الكلاب العضوية المعوية. بعد 7 أيام في الثقافة ، لم تلاحظ أي علامات إجمالية على موت الخلايا المبرمج الخلوي في الكروية الكبدية ، حتى بدون تنظيف أو مرور (الشكل 7). يمكن أن يكون تمرير المواد العضوية المعوية والكبدية أمرا صعبا لأن الإجراء يمكن أن يؤدي إلى فقدان الخلايا وتغيير قابلية البقاء. تشير النتائج إلى أن الحضانة المطولة للعضويات الكبدية مع البروتياز الشبيه بالتريبسين (حتى 12 دقيقة) لا تؤثر سلبا على الثقافة الفرعية. احتضان المواد العضوية في البروتياز الشبيه بالتريبسين لفترة أطول من 24 دقيقة يمكن أن يكون ضارا بالثقافة الفرعية اللاحقة للعضويات.
في حالة الكسر دون المستوى الأمثل في مجموعات الخلايا مع الممر العضوي ، قد يكون التفكك الميكانيكي بدلا من الحضانة المطولة مع البروتياز الشبيه بالتريبسين أكثر فائدة. إذا واجهت مشاكل في الانفصال السليم للعضويات ، فقد تتم محاولة دوامة قصيرة للعينات لتعزيز عائد المرور. من ناحية أخرى ، فإن الدوامة لديها القدرة على تدمير الثقافة وإتلاف الخلايا ، لذلك يجب استخدامها فقط عندما تفشل الإجراءات الأخرى بشكل متكرر. إن كسر المواد العضوية الكبدية إلى خلايا مفردة يقلل من معدل نمو المواد العضوية ، في حين أن تقسيمها إلى مجموعات من الخلايا يمكن أن يحسن بشكل كبير من قدرتها على البقاء. تم اختيار عشر دقائق كوقت حضانة للبروتوكول العضوي. واعتبرت نقطة الحضانة التي تبلغ مدتها 12 دقيقة غير سامة للخلايا مقارنة بحضانة مدتها 24 دقيقة في تجربة البروتياز الشبيهة بالتريبسين.
أكدت تجربة البقاء على قيد الحياة أن الخلايا العضوية الكبدية للكلاب يمكن أن تعيش لمدة تصل إلى 19.5 يوما في ظروف غير مواتية (استنزاف هيكلي وتغذوي). تم استزراع المواد العضوية التي نجت من هذه الظروف لفترة أطول باستخدام وسائط CMGF +. قد تكون هذه الملاحظة ناتجة عن النمو البطيء للعضويات الكبدية في الوسائط غير المكملة بمثبطات الصخور و GSK3β. نمت الثقافات العضوية مع CMGF + R / G بشكل أسرع وربما استنفدت مواردها بشكل أسرع. تفتح هذه التجربة إمكانيات تصغير ثقافة الكلاب العضوية لتحقيق تحويل نظام عالي الإنتاجية. وتظهر هذه التكنولوجيا إمكانية تسهيل اكتشاف الأدوية أو دراسات علم السموم بتكلفة مخفضة إلى حد كبير.
بعض المشاكل الشائعة التي تواجهها أثناء صيانة تربية الكلاب العضوية هي تصلب العينات غير السليم عند الطلاء ، وتلوث الثقافة ، وتحديد الكثافة والحجم المناسبين للعضويات. إذا تصلب ECM القابل للذوبان قبل الأوان أثناء الطلاء ، فضعه على الفور على الجليد لمدة 10 دقائق. إذا لم يشكل ECM القابل للذوبان هياكل تشبه القبة ، فمن المحتمل أنه لم تتم إزالة وسائط كافية من العينة. إذا كان هذا هو الحال ، فقم بتخفيف العينة باستخدام ECM أكثر قابلية للذوبان حتى تتشكل القباب.
عندما يتم العثور على تلوث فطري أو بكتيري في لوحة كاملة (انظر الشكل 4) ، فإن أفضل حل هو التخلص من اللوحة. يمكن محاولة العلاج بالأدوية المضادة للفطريات أو المضادات الحيوية ، ولكن نجاح هذه المحاولة منخفض للغاية. إذا كانت بئر واحدة ملوثة في صفيحة، يمكن تنظيف الآبار القابلة للحياة وغير المتأثرة (اتبع الخطوات من 4.1 إلى 4.5) إلى صفيحة جديدة ومراقبتها عن كثب. إذا كانت العينة قد تم تجميدها بالفعل في حالات الطوارئ ، فمن المستحسن التخلص من العينة بأكملها ، لأن ذوبان العينة يعرض الحاضنة لخطر تلوث إضافي.
يجب أن تكون الثقافة العضوية الصحية على الأقل في فئة متوسطة الحجم ومتوسطة الكثافة أو أكبر. الكثافة المثلى أمر بالغ الأهمية لنمو الثقافة العضوية. يجب تصحيح الكثافة المنخفضة عن طريق تنظيف المواد العضوية إلى متوسطة الكثافة. إذا حدثت حالة الكثافة القصوى (الاكتظاظ) ، فيجب توسيع المواد العضوية إلى المزيد من الآبار. غالبا ما تصاحب العلامات الإجمالية لموت الخلايا المبرمج كلا من الاكتظاظ والكثافة المنخفضة للثقافة العضوية. إذا لم يتم تصحيح هذه المشكلات في الوقت المناسب ، فستتحول الثقافة العضوية بأكملها إلى استماتة في غضون أيام. إذا حققت المواد العضوية حجما كبيرا جدا أو كثافة عالية جدا ، فيجب استخدام الثقافة لإجراء تجربة أو تجميد أو تثبيت.
تحتوي الوسائط العضوية حاليا على 17 مكونا ، وبالتالي فإن إضافة عوامل النمو اللازمة لصيانة العضوية وتوسيعها يمكن أن تكون مكلفة. يمكن حل هذه المشكلة عن طريق زراعة مزارع الخلايا 2D التي تجمع عوامل النمو لإنتاج CMGF + مشروطة. تنتج زراعة الخلايا L-WRN عوامل نمو Wnt-3a و R-Spondin-3 و Noggin 37. تستخدم مستعمرة الخلية 90٪ DMEM / F12 و 10٪ وسائط ثقافة FBS. عندما تحقق الثقافة 90 في المئة من الالتقاء ، يتم حصاد وسائل الإعلام كل يوم لمدة 1 أسبوع. ثم يتم خلط الوسائط التي يتم حصادها مع 2x CMGF + (بدون عوامل النمو هذه). في حين أن الثقافات 2D يمكن أن تنتج عوامل النمو اللازمة في جزء صغير من التكلفة، يجب توقع الوقت الإضافي والاستعداد لإنتاج وسائل الإعلام. يمكن أن تختلف تركيزات عوامل النمو بين دفعات الوسائط المشروطة أيضا37,38.
تعد مزارع الكلاب العضوية المشتقة من الخلايا الجذعية للبالغين نموذجا طبيا حيويا فريدا يمكن أن يساعد في تحقيق أهداف مبادرة الصحة الواحدة39. يمكن استخدام التكنولوجيا العضوية في العديد من مجالات البحوث الأساسية والطبية الحيوية ، والتي تمتد من البيولوجيا التنموية ، والفيزيولوجيا المرضية ، واكتشاف الأدوية واختبارها ، وعلم السموم إلى دراسة الأمراض المعدية والطب التجديدي 40. البحوث الانتقالية والعكسية هي المجالات التي تنطبق فيها عضويات الكلاب 15. تم استخدام الكلاب لعدة قرون في إعدادات تجريبية متعدية ، كما أن وضعها الحيواني المصاحب لها قد سهل مكانتها كواحدة من أكثر الأنواع استكشافا في الطب البيطري.
في الختام ، توفر هذه المخطوطة بروتوكولات تشغيل موحدة لعزل وصيانة وحصاد وبنوك حيوية للكلاب العضوية الكبدية والمعوية لتسهيل تطبيق هذا النموذج في مختلف المجالات الطبية الحيوية. هذا النموذج مناسب بشكل فريد لتعزيز البحوث الانتقالية العكسية كأداة لمبادرة الصحة الواحدة لتعزيز تبادل المعرفة بين التخصصات وداخلها.
Disclosures
K. Allenspach هو المؤسس المشارك ل LifEngine Animal Health و 3D Health Solutions. وهي تعمل كمستشارة ل Ceva Animal Health و Bioiberica و LifeDiagnostics و Antech Diagnostics و Deerland Probiotics و Mars. J. P. Mochel هو المؤسس المشارك لشركة LifEngine Animal Health و 3D Health Solutions. يعمل الدكتور موشيل كمستشار ل Ceva Animal Health و Ethos Animal Health. المؤلفون الآخرون ليس لديهم أي تضارب في المصالح للإعلان.
Acknowledgements
يريد المؤلفون التعبير عن امتنانهم لموظفي مختبر التشخيص البيطري التابع لجامعة ولاية أيوا ، وهم هالي م. لامبرت ، وإميلي راهي ، وروزالين م. برانامان ، وفيكتوريا ج. غرين ، وجنيفر م. غرولتز ثراش ، على معالجة العينات المقدمة في الوقت المناسب. يرغب المؤلفون في الاعتراف بالدعم المقدم من بدء تشغيل أعضاء هيئة التدريس ، وجائزة ISU VPR Miller ، وجائزة ISU VPR Miller ، والجائزة الفرعية NSF SBIR إلى ISU # 1912948.
Materials
| Name | Company | Catalog Number | Comments |
| Chelating solution | |||
| D-Sorbitol | Fisher Chemical | BP439-500 | |
| DTT | Promega | V3151 | |
| KCl | Fisher Chemical | P217-500 | |
| KH2PO4 | Sigma | P5655-100G | |
| Na2HPO4-2H2O | Sigma | S5136-100G | |
| NaCl | Fisher Chemical | S271-500 | |
| Pen Strep | Gibco | 15140-122 | |
| Sucrose | Fisher Chemical | S5-500 | |
| Organoid media | |||
| [Leu15]-Gastrin I human | Sigma | G9145-.5MG | |
| A-83-01 | PeproTech | 9094360 | |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| B27 supplement | Gibco | 17504-044 | |
| FBS | Corning | 35-010-CV | |
| Glutamax | Gibco | 35050-061 | |
| HEPES | VWR Life Science | J848-500ML | |
| Human R-Spondin-1 | PeproTech | 120-38-500UG | |
| Murine EGF | PeproTech | 315-09-1MG | |
| Murine Noggin | PeproTech | 250-38-250UG | |
| Murine Wnt-3a | PeproTech | 315-20-10UG | |
| N2 supplement | Gibco | 17502-048 | |
| N-Acetyl-L-cysteine | Sigma | A9165-25G | |
| Nicotinamide | Sigma | N0636-100G | |
| Primocin | InvivoGen | ant-pm-1 | |
| ROCK inhibitor (Y-27632) | EMD Millipore Corp. | SCM 075 | |
| SB202190 (P38 inhibitor) | Sigma | S7067-25MG | |
| Stemolecule CHIR99021 (GSK3β) | Reprocell | 04-0004-base | |
| Trimethoprim | Sigma | T7883-5G | |
| Sulfamethoxazole | Sigma-Aldrich | S7507-10G | |
| Reagents | |||
| Acetic Acid, Glacial | Fisher Chemical | A38-500 | |
| Dimethyl Sulfoxide (DMSO) | Fisher Chemicals | D128-500 | |
| EDTA, pH 8.0, 0.5 M | Invitrogen | 15575-038 | |
| Formaldehyde (37%) | Fisher Chemical | F79P-4 | |
| Glutaraldehyde solution | Sigma | G5882 | |
| Matrigel Matrix For Organoid Culture | Corning | 356255 | Extracellular Membrane Matrix |
| Paraformaldehyde, 97% | Alfa Aesar | A11313 | |
| PBS, 1X (Phosphate-Buffered Saline) | Corning | 21-040-CM | |
| PBS, 1X (Phosphate-Buffered Saline) | Corning | 21-040-CM | |
| RNAlater Soln. | Invitrogen | AM7021 | RNA Storage Reagent |
| TrypLE Express | Gibco | 12604-021 | Trypsin-like Protease |
| Other | |||
| 6 Well Cell Culture Plate | Corning | 3516 | |
| ACD Hybez II Hybridization System | ACD a biotechne brand | 321710 | |
| Centrifuge Tube, 15 mL | Corning | 430766 | |
| CoolCell LX | Corning | BCS-405MC | |
| Cryogenic Vials | Corning | 430488 | |
| Disposable Centrifuge Tube (50 mL) | Fisherbrand | 05-539-13 | |
| GyroMini Nutating mixer (Rocker) | Labnet | S0500-230V-EU | |
| Heat Bath | Lab-Line Instruments | 3000 | |
| Mr. Frosty Freezing Container | ThermoFisher Scientific | 5100-0001 | |
| NanoDrop 2000 | ThermoFisher Scientific | ND2000CLAPTOP | SpectrophotometerAnalysis |
| Panasonic incubator | Panasonic | MCO-170ML-PA | |
| Parafilm M Wrapping Film | Bemis Company Inc | PM996/EMD | Laboratory Flexible Film Tape |
| Protected Disposable Scalpels | Bard-Parker | 239844 | |
| RNAscope 2.5 HD Assay – RED | ACD a biotechne brand | 322350 | |
| RNAscope H2O2 & Protease Plus Reagents | ACD a biotechne brand | 322330 | |
| RNAscope Target Retrieval Reagents | ACD a biotechne brand | 322000 | |
| RNAscope Wash Buffer Reagents | ACD a biotechne brand | 310091 | |
| Tissue Culture Dish | Dot Scientific | 6676621 | |
| Tissue Culture Plate 24 wells | Fisherbrand | FB012929 |
References
- Hickman, D. L., Johnson, J., Vemulapalli, T. H., Crisler, J. R., Shepherd, R. Commonly used animal models. Principles of Animal Research for Graduate and Undergraduate Students. , 117-175 (2017).
- De Jong, M., Maina, T. Of mice and humans: Are they the same? - Implications in cancer translational research. Journal of Nuclear Medicine. 51 (4), 501-504 (2010).
- Cannarozzi, G., Schneider, A., Gonnet, G. A phylogenomic study of human, dog, and mouse. PLoS Computational Biology. 3 (1), 0009-0014 (2007).
- Jacob, J. A. Researchers turn to canine clinical trials to advance cancer therapies. JAMA - Journal of the American Medical Association. 315 (15), 1550-1552 (2016).
- Ziegler, A., Gonzalez, L., Blikslager, A. Large animal models: The key to translational discovery in digestive disease research. Cellular and Molecular Gastroenterology and Hepatology. 2 (6), 716-724 (2016).
- Swanson, K. S., et al. Phylogenetic and gene-centric metagenomics of the canine intestinal microbiome reveals similarities with humans and mice. ISME Journal. 5 (4), 639-649 (2011).
- Coelho, L. P., et al. Similarity of the dog and human gut microbiomes in gene content and response to diet. Microbiome. 6 (1), 72 (2018).
- Nguyen, T. L. A., Vieira-Silva, S., Liston, A., Raes, J. How informative is the mouse for human gut microbiota research. DMM Disease Models and Mechanisms. 8 (1), 1-16 (2015).
- Bontempo, V. Nutrition and health of dogs and cats: Evolution of petfood. Veterinary Research Communications. 29, 45-50 (2005).
- Allenspach, K., Gaschen, F. Canine chronic enteropathies: A review. Schweizer Archiv fur Tierheilkunde. 145 (5), 209-222 (2003).
- Tribuddharatana, T., Kongpiromchean, Y., Sribhen, K., Sribhen, C. Biochemical alterations and their relationships with the metabolic syndrome components in canine obesity. Kasetsart Journal - Natural Science. 45 (4), 622-628 (2011).
- Chandra, L., et al. Derivation of adult canine intestinal organoids for translational research in gastroenterology. BMC Biology. 17 (1), 33 (2019).
- Schaefer, K., Rensing, S., Hillen, H., Burkhardt, J. E., Germann, P. G. Is Science the only driver in species selection? An internal study to evaluate compound requirements in the minipig compared to the dog in preclinical studies. Toxicologic Pathology. 44 (3), 474-479 (2016).
- MacArthur Clark, J. The 3Rs in research: A contemporary approach to replacement, reduction and refinement. British Journal of Nutrition. 120, 1-7 (2018).
- Schneider, B., et al. Model-based reverse translation between veterinary and human medicine: The one health initiative. CPT: Pharmacometrics and Systems Pharmacology. 7 (2), 65-68 (2018).
- Lehmann, R., et al. Human organoids: A new dimension in cell biology. Molecular Biology of the Cell. 30 (10), 1129-1137 (2019).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Kim, J., Koo, B. K., Knoblich, J. A. Human organoids: model systems for human biology and medicine. Nature Reviews Molecular Cell Biology. 21 (10), 571-584 (2020).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Ho, B. X., Pek, N. M. Q., Soh, B. S. Disease modeling using 3D organoids derived from human induced pluripotent stem cells. International Journal of Molecular Sciences. 19 (4), 936 (2018).
- Truskey, G. A. Human microphysiological systems and organoids as in vitro models for toxicological studies. Frontiers in Public Health. 6, 185 (2018).
- Caipa Garcia, A. L., Arlt, V. M., Phillips, D. H. Organoids for toxicology and genetic toxicology: applications with drugs and prospects for environmental carcinogenesis. Mutagenesis. , (2021).
- Augustyniak, J., et al. Organoids are promising tools for species-specific in vitro toxicological studies. Journal of Applied Toxicology. 39 (12), 1610-1622 (2019).
- Zietek, T., et al. Organoids to study intestinal nutrient transport, drug uptake and metabolism - Update to the human model and expansion of applications. Frontiers in Bioengineering and Biotechnology. 8, 577656 (2020).
- Zietek, T., Rath, E., Haller, D., Daniel, H. Intestinal organoids for assessing nutrient transport, sensing and incretin secretion. Scientific Reports. 5 (1), 1-10 (2015).
- Kar, S. K., et al. Organoids: a promising new in vitro platform in livestock and veterinary research. Veterinary Research. 52 (1), 1-17 (2021).
- Borcherding, D. C., et al. Sa1976 polyphenols reverse the pathologic effects of palmitic acid and high fat diet in canine enteroids. Gastroenterology. 158 (6), 486 (2020).
- Ambrosini, Y. M., et al. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS ONE. 15 (4), 0231423 (2020).
- Zdyrski, C., et al. Su124 homology directed repair in canine duodenal enteroids to mimic the wild-type P-glycoprotein mutation. Gastroenterology. 160 (6), 625 (2021).
- Li, Y., Tang, P., Cai, S., Peng, J., Hua, G. Organoid based personalized medicine: from bench to bedside. Cell Regeneration. 9 (1), 21 (2020).
- Kurr, L. A., Allenspach, K., Jergens, A., Mochel, J. P. Harnessing the biology of intestinal organoids to accelerate drug discovery in inflammatory bowel disease: A one health approach. The FASEB Journal. 34, 1 (2020).
- Nantasanti, S., et al. Disease modeling and gene therapy of copper storage disease in canine hepatic organoids. Stem Cell Reports. 5 (5), 895-907 (2015).
- Favier, R. P., et al. COMMD1-Deficient dogs accumulate copper in hepatocytes and provide a good model for chronic hepatitis and fibrosis. PLoS ONE. 7 (8), 42158 (2012).
- Kruitwagen, H. S., et al. Long-term survival of transplanted autologous canine liver organoids in a COMMD1-deficient dog model of metabolic liver disease. Cells. 9 (2), 410 (2020).
- Vilgelm, A. E., et al. Fine-needle aspiration-based patient-derived cancer organoids. iScience. 23 (8), 101408 (2020).
- Saxena, K., et al. Human intestinal enteroids: A new model to study human rotavirus infection, host restriction, and pathophysiology. Journal of Virology. 90 (1), 43-56 (2016).
- VanDussen, K. L., Sonnek, N. M., Stappenbeck, T. S. L-WRN conditioned medium for gastrointestinal epithelial stem cell culture shows replicable batch-to-batch activity levels across multiple research teams. Stem Cell Research. 37, 101430 (2019).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Mackenzie, J. S., Jeggo, M. The one health approach-why is it so important. Tropical Medicine and Infectious Disease. 4 (2), 88 (2019).
- Artegiani, B., Clevers, H. Use and application of 3D-organoid technology. Human Molecular Genetics. 27 (2), 99-107 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved