Method Article
Biyomedikal Araştırmalarda Kullanılmak Üzere 3D Köpek Hepatik ve Bağırsak Organoid Kültürlerinin Standardizasyonu ve Bakımı
Bu Makalede
Özet
3D organoid kültürler oluşturmak için köpek bağırsak ve hepatik dokularından yetişkin kök hücrelerin toplanması için deneysel yöntemler açıklanmaktadır. Ayrıca, tutarlı büyümeyi sağlamak ve köpek bağırsak ve hepatik organoid kültürlerini toplamak, biyobanka yapmak ve canlandırmak için standart çalışma prosedürleri sağlamak için laboratuvar teknikleri tartışılmaktadır.
Özet
Köpekler, enflamatuar hastalıklar, metabolik hastalıklar ve kanser dahil olmak üzere insanlara benzer karmaşık multifaktöriyel hastalıklar geliştirir. Bu nedenle, insan tıbbına çeviri potansiyeline sahip ilgili büyük hayvan modellerini temsil ederler. Organoidler, menşe organlarının mikroanatomisini ve fizyolojisini taklit eden kök hücrelerden türetilen 3 boyutlu (3D), kendiliğinden monte edilmiş yapılardır. Bu translasyonel in vitro modeller, ilaç geçirgenliği ve keşif uygulamaları, toksikoloji değerlendirmesi ve multifaktöriyel kronik hastalıkların patofizyolojisinin mekanik bir şekilde anlaşılmasını sağlamak için kullanılabilir. Ayrıca, köpek organoidleri refakatçi köpeklerin yaşamlarını iyileştirebilir, veterinerlik araştırmalarının çeşitli alanlarında girdi sağlayabilir ve veteriner hekimlikte kişiselleştirilmiş tedavi uygulamalarını kolaylaştırabilir. Küçük bir donör grubu, organoid hücre hatları süresiz olarak alt kültürlenebildiğinden, sürekli doku toplama ihtiyacını azaltan bir organoid numune biyobankası oluşturabilir. Burada, yetişkin kök hücrelerden elde edilen bağırsak ve hepatik köpek organoidlerinin kültürüne odaklanan üç protokol sunulmaktadır. Köpek Organoid İzolasyon Protokolü, dokuyu işlemek ve hücre izolatının destekleyici bir matrise (çözünmüş hücre dışı membran matrisi) gömülmesi için yöntemleri özetlemektedir. Köpek Organoid Bakım Protokolü, genişleme için uygun zamanlama ile birlikte temizlik ve pasaj dahil olmak üzere organoid büyüme ve bakımı tanımlar. Organoid Hasat ve Biyobankacılık Protokolü, daha fazla analiz için organoidleri çıkarmanın, dondurmanın ve korumanın yollarını açıklar.
Giriş
Kemirgenler, biyomedikal ve translasyonel araştırmalar için en yaygın kullanılan hayvan modelidir1. Kronik multifaktöriyel hastalıklarla klinik ilgileri son zamanlarda sorgulanmasına rağmen, hastalıkların temel moleküler patogenezini araştırmak için son derece yararlıdırlar2. Köpek modeli, kemirgenlere kıyasla çeşitli avantajlar sergiler3,4. Köpekler ve insanlar, evcilleştirmelerinin çeşitli dönemlerinde insan diyetinin tüketilmesi nedeniyle gelişen metabolomikler ve bağırsak mikrobiyomundaki benzerlikleri paylaşırlar5,6,7. Köpek ve insan gastrointestinal anatomisi ve fizyolojisi arasındaki benzerlikler örneklerden bir diğeridir8.
Ek olarak, köpekler genellikle sahipleriyle benzer ortamları ve yaşam tarzlarını paylaşırlar9. Kemirgenlere kıyasla köpeklerin daha uzun ömrü, çok sayıda kronik durumun doğal gelişimine izin verir10. İnflamatuar bağırsak hastalığı veya metabolik sendrom, insanlar ve köpekler arasında önemli benzerlikler paylaşan multifaktöriyel kronik hastalıklara örnektir11,12. Doğal olarak ortaya çıkan hastalıkları olan köpekleri içeren köpek preklinik çalışmaları, kemirgen modellerinden elde edilenlerden daha güvenilir veriler üretebilir13. Bununla birlikte, canlı hayvan araştırmalarının kullanımını en aza indirmek ve 3R'lerin (Azalt, Rafine Et, Değiştir)14 ilkelerine uymak için, 3D in vitro köpek organoidleri kullanılarak yapılan in vivo testlere alternatifler ortaya çıkmıştır15.
Organoidler, orijinal organlarının fizyolojisini ve mikroanatomisini özetleyen, kendi kendine monte edilmiş 3D kök hücre türevi yapılardır16,17. Bu teknoloji ilk olarak 200917 yılında Sato ve ark. tarafından tanımlanmış ve epitel hücre hatlarında 2D kanser hücre kültürleri kullanılarak daha önce mümkün olandan daha fazla translaable in vitro çalışmalara izin vermiştir18,19,20. Organoidler, klinik öncesi toksikolojik21,22,23, emilim veya metabolizma çalışmaları24,25,26,27,28 gibi birçok biyomedikal disiplinde ve kişiselleştirilmiş tıbbi yaklaşımlarda29,30,31 gibi birçok biyomedikal disiplinde in vitro modellerde yararlıdır. . Köpek bağırsak organoidlerinin başarılı kültürü ilk kez 201912'de tanımlanmışken, bir köpekten türetilen hepatik organoidler ilk olarak Nantasanti ve ark. tarafından 201532'de bildirilmiştir. Köpek organoidleri o zamandan beri köpek kronik enteropatilerini, gastrointestinal stromal tümörleri, kolorektal adenokarsinom12 ve Wilson Hastalığını33,34 araştıran çalışmalarda başarıyla kullanılmaktadır.
Yetişkin kök hücreler nekropsiler yoluyla toplanabilirken, organoid teknoloji her zaman hayvanların kurban edilmesini gerektirmez. Endoskopik ve laparoskopik biyopsiler, hatta organların ince iğneli aspiratları35, epitelyal organoid izolasyonu için uygun bir yetişkin kök hücre kaynağıdır12. Bu tür invaziv olmayan tekniklerin veterinerlik pratiğinde yaygın kullanımı, tersine translasyonel araştırma seçeneklerini kolaylaştırır (bilgilerin veteriner klinik uygulamasından insan klinik uygulamasına çevirisi ve bunun tersi de geçerlidir)15. Organoid kültürünün ve bakım yöntemlerinin standardizasyonu ile organoid teknolojisinin daha da ilerlemesi sağlanabilir. Burada sunulan organoid protokol kısmen Saxena ve ark.'nın 201536'dan itibaren daha önce yayınlanmış çalışmalarına dayanmaktadır ve yöntemler köpek bağırsak ve hepatik organoid kültürünün özelliklerine uyacak şekilde uyarlanmıştır. Köpek organoid protokollerinin genel iş akışı Şekil 1'de gösterilmiştir.
Köpek Organoid İzolasyon Protokolü, endoskopik, laparoskopik ve cerrahi biyopsilerin yanı sıra nekropsilerden örnekler elde etme yöntemlerini sunar. Doku örneklerinin ilk ön muamelesini ve laboratuvara nakli için kullanılan metodolojileri özetlemektedir. Organoid izolasyonu için gerekli malzeme ve reaktifler 'İzolasyona Hazırlık' bölümünde özetlenmiştir. Doku örneklerinden yetişkin kök hücre izolasyonu süreci ayrıntılı olarak açıklanmaktadır. Son olarak, organoidlerin çözünür bir hücre dışı membran matrisi kullanılarak kubbe benzeri yapılara kaplanması işlemi tartışılmıştır.
İkinci protokol olan Köpek Organoid Bakım Protokolü, organoidleri belgeleme ve kültürleme yöntemlerini açıklar. Medya değişiklikleri ve sıklıkları bu bölümde tartışılmıştır. Ayrıca, 3D köpek organoidlerinin başarılı bir şekilde bakımını sağlamak için gerekli olan hücre kültürlerinin geçiştirilmesi ve temizlenmesi gibi laboratuvar prosedürleri açıklanmaktadır. Uygun pasaj, protokolün kritik bir adımıdır ve bu adımın olası ayarlamaları ve sorun giderme işlemleri makalede daha ayrıntılı olarak tartışılmıştır.
Son protokol, parafin gömme ve RNA koruması için tam yetişkin organoidleri hazırlama yöntemlerini içeren Köpek Organoid Toplama ve Biyobankacılık Protokolüdür. Sıvı azot depolamadaki biyobankacılık organoid numunelerinin yöntemleri de burada açıklanmaktadır. Son olarak, dondurulmuş numuneleri çözmenin ve büyümelerini desteklemenin yolları tartışılmaktadır.
Sonuç olarak, bu makale laboratuvarlar arası protokollerin standardizasyonu yoluyla tutarlı köpek organoid kültürü prosedürleri sağlamayı amaçlamaktadır. Bunu yaparken, makale, köpek organoid modellerinden türetilen verilerin çoğaltılabilirliğini kolaylaştırmayı ve translasyonel biyomedikal araştırmalardaki alaka düzeylerini arttırmayı amaçlamaktadır.

Şekil 1: Köpek organoid protokollerinin iş akışı. Köpek Organoid İzolasyon Protokolü, organoid izolasyon için gerekli malzemelerin hazırlanmasını, bir doku örneğinin toplanmasını (nekropsiler, endoskopik, laparoskopik ve cerrahi biyopsiler yoluyla) ve hücre ayrışması ve hücresel popülasyonun kaplanması konusunda rehberliği açıklar. Köpek Organoid Bakım Protokolü, organoid kültürünün temizlenmesini ve geçirilmesini tartışır. Organoid Hasat ve Biyobankacılık Protokolü, parafin gömme ve daha ileri organoid karakterizasyonu için organoid numunelerin hazırlanmasını tartışmaktadır. Organoid kültürleri biyobankaya yatırma ve sıvı azotta depolamadan canlandırma yöntemleri de tartışılmaktadır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protokol
Araştırma, Iowa Eyalet Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC-19-337; IACUC-18-065; IACUC-19-017).
NOT: Aşağıdaki bölümde (adım 1-3) Köpek Organoid İzolasyon Protokolü açıklanmaktadır.
1. İzolasyon için hazırlık
- Taşıma tüpleri: Organoid izolasyondan önce (tipik olarak 24 saat önce), 50 mL'lik bir konik tüpü, 0,2 mL Kalem Strep ile zenginleştirilmiş 10 mL Dulbecco'nun Modifiye Kartal Orta / Besin Karışımı F-12 (Gelişmiş DMEM / F12) ile doldurun.
- Laparoskopik, insizyonel veya eksizyonel biyopsiler için, üç ek 50 mL konik tüp hazırlayın. Bu tüpleri 10 mL komple şelatlama çözeltisi ile doldurun (1x CCS; bakınız Tablo 1).
NOT: Adım 1.2 için, Fosfat Tamponlu Salin (PBS) içindeki 2 mM N-Asetilsistein (NAC), kök hücre hasadı için kullanılan geleneksel bir çözelti olarak da kullanılabilir. PBS'de 1x CCS veya NAC kullanırken hiçbir fark gözlenmedi. Her iki çözüm de çözeltideki hücreleri serbest bırakmak için eklenir. - Tüpleri gece boyunca 4 ° C'de tutun ve protokolün geri kalanı boyunca tüpleri buz üzerinde taşıyın.
- 5 mL 1x CCS ile beş adet 15 mL santrifüj tüpü, 3 mL 1x CCS içeren bir adet 15 mL santrifüj tüpü, bir adet boş 15 mL santrifüj tüpü (süpernatant tüp) ve 5 mL 1x CCS ve 2 mL fetal sığır serumu (FBS) içeren bir adet 15 mL santrifüj tüpü hazırlayın.
NOT: Yukarıdakiler, birden fazla numune işlenecekse, izolasyon gününden önce hazırlanabilir. Örnek olarak, Şekil 2'deki yalıtım tüpü düzenine bakın. - İzolasyon gününde, biyogüvenlik kabininde bir Petri kabı, neşter, buz kovası ve soğuk Advanced DMEM / F12 hazırlayın. Ön ısıtmak için gerekli sayıda 24 kuyucuklu hücre kültürü plakasını inkübatöre (37 ° C; % 5 CO2 atmosferi) yerleştirin.
- Çözünmeye başlamak için çözünür hücre dışı membran matrisini (ECM; bakınız Malzeme Tablosu) buz üzerine yerleştirin.
NOT: Buzun içine daldırma hızlı çözülmeye karşı korur ve katılaşmanın önlenmesine yardımcı olur. Çözünür ECM'nin kaplanmasına yardımcı olmak için dondurucuya bir kutu pipet ucu yerleştirilebilir. - Bir santrifüjü 4 °C'ye kadar önceden soğutun.
- Büyüme faktörleri "CMGF+" veya "organoid ortam" olan Tam medyayı (kompozisyon için Tablo 1'e bakınız) dondurucudan/buzdolabından 37 °C'lik bir su banyosuna taşıyın. Mümkün olduğunda doğrudan ışığa maruz kalmaktan kaçının.
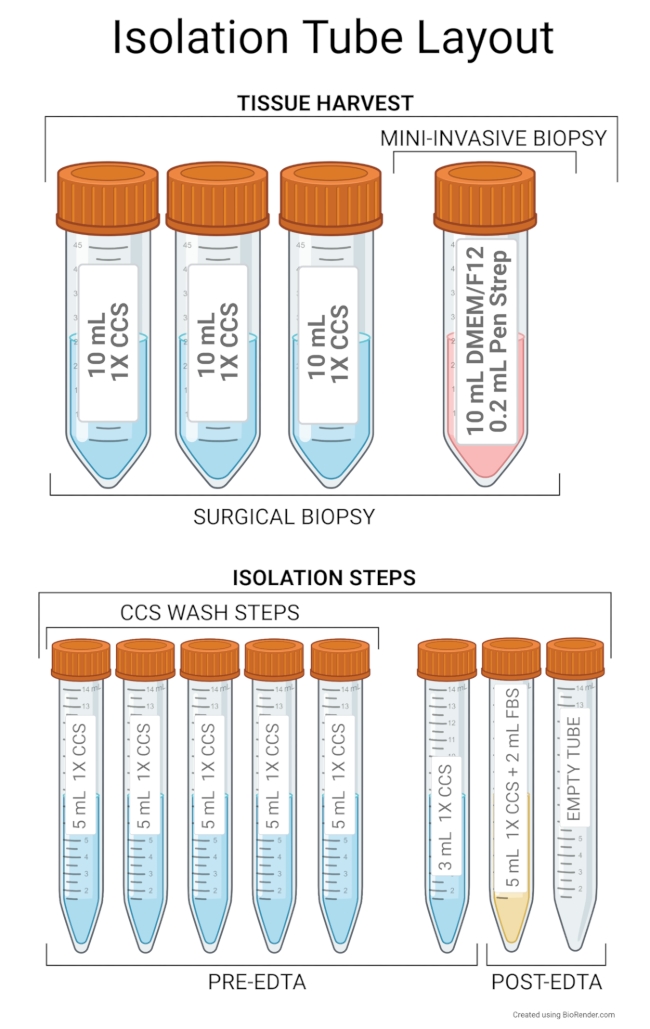
Şekil 2: İzolasyon tüpü düzeni. Doku hasadı için önerilen kurulum, 50 mL'lik bir santrifüj tüpünde 10 mL Gelişmiş DMEM/F12 ve 0,2 mL Kalem Strep içerir. Ek olarak, cerrahi biyopsiler veya nekropsiler için 10 mL 1x CCS ile doldurulmuş üç adet 50 mL tüp gereklidir. İzolasyon adımları için önerilen tüp düzeni, CCS yıkama adımları sırasında kullanılmak üzere 5 mL 1x CCS içeren beş tüp içerir. İlk tüp, kıyılmış dokuyu içeren bir numune tüpü olarak kullanılır ve kalan tüpler, ilk tüpe eklenecek 1x CCS'lik rezervuarlar olarak işlev görür. Altıncı tüp, 6 delikli bir plakaya aktarılırken kalan dokuyu numune tüpünden yıkamak için 3 mL 1x CCS içerir. Bu altı tüp EDTA inkübasyon adımından önce kullanılacaktır. 5 mL 1x CCS ve 2 mL FBS içeren bir tüp, EDTA inkübasyonundan sonra bir numune tüpü görevi görür ve bu tüpten süpernatant, izolasyonun geri kalanı için kök hücrelerle boş bir tüpe aktarılır. İzolasyona başlamadan önce tüpleri 4 ° C'de tutun. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
2. Doku hasadı
- İntestinal endoskopik ve laparoskopik biyopsiler (çap 2.8 mm) büyük biyopsi forsepsleri kullanılarak elde edilebilir. Bağırsak bölgesi başına en az sekiz endoskopik örnek toplayın.
- Örnekleri doğrudan taşıma tüplerine toplayın ve buzun üzerine yerleştirin.
- Cerrahi biyopsiler ve nekropsiler için, 0,5 cm x 0,5 cm boyutlarında doku parçalarını toplayın ve ilk 1x CCS tüpüne yerleştirin.
NOT: Bağırsak biyopsileri için, kalan bağırsak içeriğini çıkarın ve villusları çıkarmak için mukozal tabakayı bir neşterle kazıyın. Örnekler bol ise, organoidler ve menşe dokuları arasında gelecekte karşılaştırma yapmak için RNA depolama reaktifi (1 mL) içeren kriyovyallerde veya parafin gömülü olarak ek biyopsiler toplanabilir. TEM analizi için biyopsi alınması durumunda, villusları kazımayın ve numuneyi koruyucu olarak saklamayın (fosfat tamponlu salin (PBS)% 3 paraformaldehit ve% 3 glutaraldehit) ve 4 ° C'de saklayın. - 1x CCS tüpünü ~ 30 s boyunca kuvvetlice çalkalayın ve ardından forseps kullanarak numuneyi yeni bir 1x CCS tüpüne aktarın. Bu işlemi iki kez tekrarlayın.
- Numuneyi son 1x CCS tüpünden taşıma tüpüne (Gelişmiş DMEM/F12 + Pen Strep) aktarın ve numuneyi laboratuvara geri getirin.
NOT: Bu şekilde önceden işlenmiş numuneler bir gecede buz üzerinde de gönderilebilir (kuru buz üzerinde göndermeyin).
3. Organoid izolasyon
NOT: Bir biyogüvenlik kabininde aseptik teknikler kullanarak izolasyon yapın. Köpek organoid izolasyon iş akışı için Şekil 3'e bakın.
- Doku örneğini taşıma tüpünde ~ 30 s çalkalayın ve sıvı yüzeyine yakın yavaş pipetleme ile tüpte 0,5 mL kalana kadar aşırı süpernatantı çıkarın. Herhangi bir doku atmadığınızdan emin olun.
- Dokuyu ve kalan süpernatantı steril bir Petri kabına aktarın. Tek kullanımlık bir neşter (veya sterilize forseps ve makas) kullanarak, dokuyu yaklaşık 5 dakika boyunca püre kıvamına benzeyen daha küçük parçalara (1 mm2 boyutunda) kesin ve doğrayın.
- Kıyılmış dokuyu Petri kabından ilk CCS tüpüne sıvı ile pipetin. Petri kabına 2 mL Gelişmiş DMEM / F12 ekleyin, kalan dokuyu yıkayın ve ilk CCS tüpüne aktarın.
- 1x CCS tüpünü 5 s için yaklaşık beş kez vorteksleyin. Biyopsilerin 15 mL tüpün dibine (yaklaşık 1 dakika) yerleşmesine izin verin ve tüpte 5 mL kalana kadar süpernatantı çıkarın. 1x CCS'yi yeni tüpten numune tüpüne aktarın.
- Sonraki iki tüp için önceki adımı tekrarlayın. Son iki yıkamada, süpernatantı tüpte kalan 3 mL'ye kadar çıkarın.
- Biyopsileri ve 1x CCS'yi numune tüpünden 6 delikli bir plakanın bir kuyucuğuna aktarın. Daha sonra, numune tüpüne 3 mL 1x CCS ekleyin, kalan dokuları toplamak için hafifçe döndürün ve plakanın aynı kuyucuğuna aktarın.
- 150 μL 0,5 M EDTA ekleyin (bir kuyuda toplam 6,15 mL hacim elde etmek için). 6 delikli plakayı 4 °C'de 20°, 24 rpm somun karıştırıcı/rocker üzerine yerleştirin. Karaciğer örneklerini 10 dakika ve bağırsak örneklerini hareketli rocker üzerinde 1 saat boyunca inkübe edin.
- 6 delikli plakayı biyogüvenlik kabinine geri taşıyın. Kıyılmış doku ve sıvıyı 1x CCS / FBS tüpüne aktarın ve dokuların yerleşmesine izin verin. Süpernatantı (bu kısım şimdi serbest kök hücreleri içerir) ve dokunun üst kısmının yaklaşık 0.2 mL'sini boş tüpe taşıyın.
- Numuneyi içeren tüpü aşağı doğru döndürün (4 ° C'de 5 dakika boyunca 700 x g). Kök hücreler artık kıyılmış doku ile birlikte peletlenmektedir. Pelet'i rahatsız etmemek için süpernatantı dikkatlice çıkarın ve atın.
- Peleti Gelişmiş DMEM / F12'de yeniden askıya alın ve tüpü tekrar döndürün (4 ° C'de 5 dakika boyunca 700 x g). Süpernatantı aspire edin ve peleti rahatsız etmeyin.
- Ayrışmış hücrelerin ve dokunun tohumlanması için gereken çözünür ECM hacmini hesaplayın. Uygun tohumlama yoğunluğunu elde etmek için 24 delikli bir plakanın kuyucuğu başına 30 μL çözünür ECM kullanın.
NOT: Bir numuneyi izolasyon sonrası 24 delikli bir plakanın 4 ila 6 kuyucuğuna gömün (yani, numunedeki kıyılmış doku miktarına bağlı olarak). - Hesaplanan çözünür ECM hacmini numune tüpüne ekleyin ve kabarcıkların oluşmasını önlemek için yavaşça yukarı ve aşağı pipet uygulayın. Süspansiyonu kuyuların ortasına tohumlayın, böylece çözünür ECM kubbe benzeri bir yapı oluşturabilir.
NOT: -20 °C'lik bir dondurucudan pipet uçlarının kullanılması, çözünür ECM'nin kaplanmasına yardımcı olur. Doku parçaları P200 pipet ucundan daha büyükse, kaplamaya yardımcı olması için geniş soğuk uçlar kullanın veya soğuk P1000 uçlarını kesin. Numuneyi mümkün olduğunca çözünür ECM ile buz üzerinde tutun. - Plakayı bir inkübatöre (37 °C; %5 CO2 atmosferi) taşıyın ve çözünür ECM'nin ~ 30 dakika boyunca katılaşmasına izin verin.
- CMGF + 'da ROCK inhibitörü ve GSK3β'yi karıştırın ( Tablo 1'deki konsantrasyonlar). Bu çözeltiden 500 μL'yi (CMGF + R / G) her kuyucuğa ekleyin. Plakayı inkübatöre yerleştirin (37 °C; % 5 CO2 atmosferi).

Şekil 3: Köpek organoid izolasyon iş akışı. Toplanan doku örneği bir Petri kabına aktarılır ve uygun şekilde kıyılır. Numune daha sonra 1x CCS tüpüne aktarılır ve yıkama adımları gerçekleştirilir. 6 delikli bir plakada EDTA inkübasyonu için, numune daha sonra 1x CCS ve FBS içeren bir tüpe aktarılır. Doku yerleştikten sonra, az miktarda doku içeren süpernatant boş bir tüpe aktarılır. Sonuç olarak numune döndürülür, süpernatant çıkarılır ve pelet Gelişmiş DMEM / F12'de yeniden askıya alınır. Tüp tekrar döndürülür ve süpernatant aspire edilir ve atılır. Çözünür ECM tüpe eklenir, karıştırılır ve numune 24 delikli bir plaka içinde kaplanır. Sonuç olarak plaka 30 dakika boyunca inkübe edilir (37 ° C; % 5 CO2 atmosferi) ve daha sonra ortam eklenir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
NOT: Aşağıdaki bölümde (adım 4 ve 5) Köpek Organoid Bakım Protokolü açıklanmaktadır. Tablo 2'ye göre ortamı değiştirin ve organoidleri apoptoz, kontaminasyon, aşırı kalabalık ve çözünür ECM'nin ayrılması belirtileri açısından günlük olarak kontrol edin. Koşulları ve kültürler üzerindeki deneysel etkileri doğru bir şekilde izlemek için Şekil 4'e göre günlük notlar alınmalıdır. Doğru ve tekrarlanabilir organoid kültürle ilgili not almaya izin veren bir şablon için Ek Tablo 1'e bakın. Hepatik organoidler için, ROCK inhibitörü ve GSK3β ile güçlendirilmiş CMGF + kullanın.

Şekil 4: Organoid boyutlandırma ve yoğunluk kılavuzu. (A) Organoid büyümenin doğru izlenmesi için organoid boyut çizelgesi. Boyutlandırma Kılavuzu ekstra küçük (XS), küçük (S), orta (M), büyük (L) ve ekstra büyük (XL) kategorileri içerir. (B) Yoğunluk Kılavuzu çok düşük yoğunluklu (VLD), düşük yoğunluklu (LD), orta yoğunluklu (MD), yüksek yoğunluklu (HD) ve çok yüksek yoğunluklu kategorilerden (VHD) oluşur. (C) Organoid numunenin bakteriyel ve fungal kontaminasyonunun temsili görüntüleri. (D) Organoid aşırı kalabalık ve apoptozun temsili görüntüleri. Objektif büyütme her panelde belirtilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Medya değişikliği önerisi | ||||||
| Pazartesi | Salı | Çarşamba | Perşembe | Cuma | Cumartesi | Pazar |
| 500 μL | YOK | 500 μL | YOK | 750 μL | YOK | YOK |
Tablo 2: Medya değişikliği önerisi. Haftalık medya değişikliği için önerilen bir zaman çizelgesi. Ortamın (bağırsak organoidleri için 500 μL CMGF + veya hepatik organoidler için 500 μL CMGF + R / G) her gün değiştirilmesi önerilir. Bir hafta sonundaki ekstra saatleri hesaba katmak için, Cuma öğleden sonraları 750 μL medya eklenir ve medya Pazartesi sabahları yenilenir.
4. Organoid temizleme
NOT: Organoid kültürün sağlığını korumak için organoid temizleme veya pasajlama düzenli olarak yapılmalıdır. Kültürde apoptoz, enkaz varlığı, organoidlerin aşırı kalabalıklaşması veya çözünür ECM'nin ayrılması fark edildiğinde temizleme prosedürünü uygulayın. Şekil 4B'ye bakın.
- Çözünür ECM'nin tahrip olmasını önlemek için plakayı eğerken ortamı kuyucuklardan çıkarın.
NOT: Çözünür ECM dekolmanı önemli ise, numuneyi içeren çözünür ECM parçalarını kaybetmemek için ortamın 15 mL tüpe aktarılması önerilir. - P1000 ucu kullanarak tekrarlanan pipetleme ile matris kubbelerini çözmek için her bir kuyucuğa 0,5 mL önceden soğutulmuş Gelişmiş DMEM/F12 ekleyin (aşırı kabarcıklar oluşturmaktan kaçının). Organoid içeren çözünmüş matrisi 15 mL'lik bir santrifüj tüpüne aktarın. Tüpü buz üzerinde tutun ve hacim 6 mL'den düşükse, toplam 6 mL'lik bir hacme ulaşmak için tüpü yavaşça Gelişmiş DMEM / F12 ile doldurun.
- Tüpü döndürün (4 ° C'de 5 dakika boyunca 700 x g) ve peleti rahatsız etmediğinizden emin olurken tüm süpernatantı çıkarın.
- Gerekli miktarda çözünür ECM ekleyin (uygun tohumlama yoğunluğunu elde etmek için kuyucuk başına 30 μL) ve pipet karıştırma ile peleti yavaşça askıya alın. Bir kubbe oluşturmak için süspansiyonu 24 delikli plakanın ortasına yerleştirin.
- Plakayı ~ 30 dakika boyunca bir inkübatöre (37 °C; % 5 CO2 atmosferi) yerleştirin ve ardından uygun ortam hacmini ekleyin (Tablo 2).
5. Organoid pasaj
NOT: Passaging tipik olarak organoid hücre hattını genişletmek için ilk kültürden 5-7 gün sonra gerçekleştirilir. Organoid kültürler tipik olarak 1: 3 oranında genişletilebilir. Geçişe hazır sağlıklı kültürlerin görüntüleri Şekil 4'te görülebilir. Organoidler en az orta büyüklükte olmalıdır.
- 4.1 ile 4.3 arasındaki adımları gerçekleştirin.
- Tüpte 0,5 mL bırakarak süpernatantı çıkarın. Pelet'i rahatsız etmediğinizden emin olun.
- 0,5 mL tripsin benzeri proteaz ekleyin ( Malzeme Tablosuna bakınız), bir pipetle aspire ederek düzgün bir şekilde karıştırın ve 37 °C su banyosunda inkübe edin (8 dakika boyunca bağırsak organoidlerini veya 10 dakika boyunca hepatik organoidleri inkübe edin). Tüpü inkübasyonun yarı zaman noktasında birkaç kez hafifçe vurarak çözeltiyi karıştırmaya devam edin.
- Numuneyi içeren tüpü bir biyogüvenlik kabinine geri taşıyın ve tripsin benzeri proteazı inaktive etmek ve hücrelerin ayrışmasını durdurmak için yavaşça 6 mL önceden soğutulmuş Gelişmiş DMEM / F12 ekleyin.
- Tüpü döndürün (4 ° C'de 5 dakika boyunca 700 x g) ve süpernatanı çıkarın. Pelet'i rahatsız etmediğinizden emin olun.
- 4.4 adımlarını gerçekleştirin. ve 4.5.
NOT: Aşağıdaki bölümde (adım 6-9) Organoid Toplama ve Biyobankacılık Protokolü açıklanmaktadır. Organoid kültürler, önceki pasajlar sırasında çıkarılan dokudan arındırılmış olmalıdır. Kültürler ayrıca sağlıklı, en azından büyük boyutlu ve orta ila yüksek yoğunlukta olmalıdır. Aşağı akış uygulamaları için hazır sağlıklı kültürlerin görüntüleri Şekil 4'te görülebilir. Optimal olmayan organoid kültürlerin korunması ve toplanması ile aşağı yönde hareket etmek, karakterizasyon sonuçlarını ve biyobankanın yaşayabilirliğini olumsuz yönde etkileyebilir. Şekil 5'te önerilen 24 delikli plaka düzenini gözden geçirin.
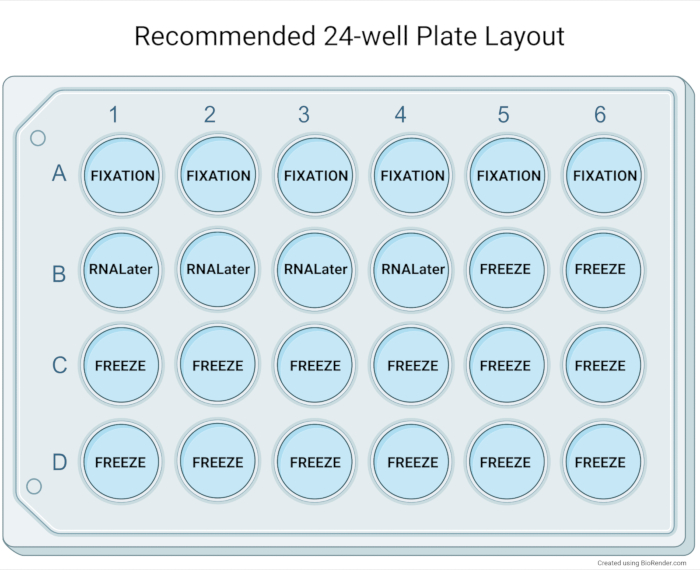
Şekil 5: Önerilen 24 delikli plaka düzeni. Organoid kültürün genişlemesinden sonra temel karakterizasyon için 24 delikli plakanın önerilen düzeni. Altı kuyucuğun parafin gömülmesi (orta ila yüksek yoğunluklu orta ila büyük organoidler) tipik olarak bir histoloji bloğunda yüksek konsantrasyonda organoidlere izin verecektir. Dört organoid kuyucuğu, aşağı akış uygulamaları için RNA depolama reaktifi ile bir kriyovalde toplanabilir. Organoid numunelerin biyobankacılığı için on dört kuyu kullanılır ve yedi kriyokorunmuş şişeye kadar malzeme sağlar. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
6. Organoidlerin sabitlenmesi
- Ortamları kuyudan çıkarın ve çözünür ECM kubbesini rahatsız etmediğinizden emin olun.
- Fiksatif olarak işlev gören 500 μL Formalin-Asetik Asit-Alkol çözeltisi ekleyin (FAA; Tablo 1'deki bileşim).
- Organoidleri oda sıcaklığında saklayın. 24 saat sonra, FAA'yı aspire edin ve% 70 etanol ile doldurun. Hızlı buharlaşmayı önlemek için plakaları laboratuvar esnek film bandı ile sarın (bkz. Malzeme Tablosu). Organoidler artık parafin gömmeye hazırdır. Organoid kültürün parafin gömülmesi, geleneksel metal bazlı kalıplarda gerçekleştirilir.
7. RNA koruması
- Ortamları kuyucuklardan çıkarın ve çözünür ECM kubbesini rahatsız etmediğinizden emin olun.
- Çözünür ECM kubbelerini tekrar tekrar yukarı ve aşağı pipetleyerek çözmek için kuyu başına 0,5 mL önceden soğutulmuş Gelişmiş DMEM/F12 kullanın (aşırı kabarcıklar oluşturmaktan kaçının). Organoidleri 15 mL'lik bir santrifüj tüpüne aktarın. Tüpü buz üzerinde tutun ve hacim 6 mL'den düşükse, toplam hacmin 6 mL'sine ulaşmak için tüpü yavaşça Gelişmiş DMEM / F12 ile doldurun.
- Tüpü döndürün (4 ° C'de 5 dakika boyunca 700 x g) ve tüm süpernatanı çıkarın. Pelet'i rahatsız etmediğinizden emin olun.
- Numune tüpüne 100 μL PBS ekleyin ve nazik pipetleme ile peleti yeniden askıya alın. Numune tüpünün içeriğini bir kriyovale aktarın.
- Numune tüpüne 900 μL RNA depolama reaktifi ekleyin (bakınız Malzeme Tablosu) ve kalan organoidleri toplamak için karıştırın. Bu artık organoidleri kriyovale aktarın ve -80 ° C'de saklayın (tipik olarak bir kriyovyalde toplanan dört kuyucuk, qPCR ve RNA dizilimi de dahil olmak üzere aşağı akış uygulamaları için yeterli olacaktır).
NOT: Bir kriyovyal tipik olarak toplam 4.000 ng RNA üretir (spektrofotometre analizi ile ölçülür).
8. Organoid biyobankacılık
NOT: Biyobankacılık genellikle geçişten 3-4 gün sonra ortaya çıkar. Bu yöntemi uygulamak için kültürde apoptoz belirtileri bulunmamalıdır. Donmaya uygun boyut ve yoğunluğa referans vermek için Şekil 4'e bakın. Biyobank orta ila ekstra büyük organoidler orta ila çok yüksek yoğunluklarda. Bir organoid hücre hattının özellikle nadir olması veya daha fazla canlılığın garanti edilmemesi durumunda acil bir dondurma adımı izlenebilir. Normal organoid biyobankacılık için aynı adımları izleyin (adım 8.1 ila 8.4). Acil dondurma daha küçük ve daha az yoğun kültürlerle yapılır. Büyüyen organoidlerin birçok kuyusunu 8.1 ila 8.4 arasındaki adımları izleyerek bir kriyovyalde toplayın. Kültürü genişletmek için yeterli sayıda organoidin canlı tutulması gerektiğini unutmayın (acil dondurma, kontaminasyon veya diğer beklenmedik olaylar yoluyla olası kültür kaybına karşı korunmak için sadece bir yedek prosedürdür).
- 7.1 ile 7.3 arasındaki adımları izleyin.
- Numune tüpüne kriyovial başına 1 mL dondurma ortamı ( Tablo 1'deki bileşim) ekleyin ve yukarı ve aşağı pipetleyerek peleti nazikçe yeniden askıya alın.
- Çözeltinin 1 mL'sini bir kriyovale aktarın (iki kuyucuk / kriyovyal oranı) ve kriyovyalleri buz üzerinde tutun.
- Kriyovalleri buzdan dondurucu bir kaba aktarın (rezervuarı düzenli olarak izopropanol ile doldurun) ve hemen -80 ° C'ye aktarın. 24 saat sonra uzun süreli depolama için numuneleri sıvı nitrojene (-196 °C) taşıyın.
NOT: Geleneksel bir kap yerine alkolsüz bir hücre dondurma kabı da kullanılabilir. -80 °C'den uzun süreli sıvı azot depolamaya taşıma sırasında numunelerin çözülmediğinden emin olun. Tekrarlanan çözülme, hücre kültürünün canlılığını azaltır.
9. Sıvı azot depolamadan canlanma
NOT: Bir organoid hattını çözmeyi seçerken, yeniden canlanan organoidlerin bir alt kümesi yeniden dondurulmalı ve biyobankada mümkün olduğunca çabuk en az bir (tercihen daha fazla) kriyovyal ile değiştirilmelidir.
- Çözünür ECM'yi yavaşça çözülmesi için buzun üzerine yerleştirin, inkübatöre 24 kuyucuklu bir plaka koyun (37 ° C; % 5 CO2 atmosferi) ve 15 mL tüp ve Gelişmiş DMEM / F12 gibi gerekli reaktifleri hazırlayın.
- Sıvı azot deposundan organoid numune içeren bir kriyovalı geri kazanın ve hemen 2 dakika boyunca bir ısı banyosuna (37 ° C) aktarın.
- Kriyovalin içeriğini bir biyogüvenlik kabinindeki 15 mL'lik bir santrifüj tüpüne aktarın. Toplam 6 mL hacme ulaşmak için önceden soğutulmuş Gelişmiş DMEM/F12'yi yavaşça ekleyin.
- Tüpü döndürün (4 ° C'de 5 dakika boyunca 700 x g). Süpernatantı çıkarın ve peleti rahatsız etmediğinizden emin olun.
- Pelet ve plakaya 180 μL (kuyu başına 30 μL) çözünür ECM ekleyin ve bu süspansiyonu önceden ısıtılmış 24 delikli plakaya yerleştirin. Bir kriyovyal, 24 kuyucuklu bir plakanın altı kuyucuğuna kaplanabilir.
- 24 delikli plakayı ~ 30 dakika boyunca inkübatöre (37 ° C; % 5 CO2 atmosferi) yerleştirin ve CMGF + R / G ekleyin (bağırsak organoidleri için 24 ila 48 saat içinde CMGF + 'ya geçin).
NOT: Bir numune kaplandığında ve 24 delikli plakada büyüdüğünde, canlılığı artırmak için pasajdan önce en az 2 gün boyunca iyileşmesine izin verilmelidir.
Sonuçlar
Köpek organoid protokolü tipik olarak 24 kuyucuklu bir plakanın kuyusu başına ~ 50.000 ila ~ 150.000 bağırsak veya hepatik hücre üretir. Temsili organoidler Şekil 6'da görülebilir.
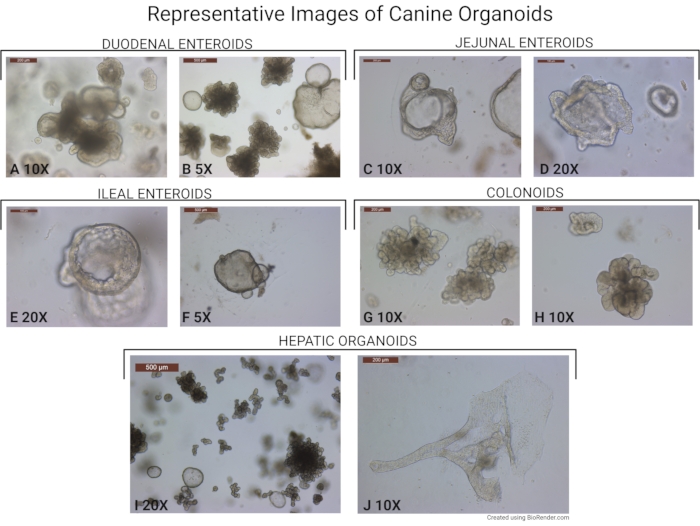
Şekil 6: Köpek organoidlerinin temsili görüntüleri. Bu protokol kullanılarak izole edilen organoidlerin görüntüleri tasvir edilmiştir. (A,B) Duodenumdan türetilen bağırsak organoidleri (10x ve 5x objektif büyütmede alınır). Yaşlı tomurcuklanmış organoidlerin ve genç sferoidlerin varlığına dikkat edin. (C,D) Jejunumun alt kısmından köpek enteroidleri (10x ve 20x objektif büyütmede alınır). (E,F) İleal enteroidler (20x ve 5x objektif büyütmede alınır) ve (G, H) kolonoidler (10x objektif büyütmede alınır). (I) Hepatik organoidlerin 20x objektif büyütmede çekilmiş temsili bir görüntüsü. Organoidlerin çoğu tomurcuklanan formlarındadır. Resimde daha genç hepatik sferoidler de görülebilir. (J) Kanal benzeri bir yapı oluşturan nadirhepatik bir organoidi gösteren temsili görüntü (10x objektif büyütmede çekilmiş). Ölçek çubuğu (500 μm) her görüntünün sol üst köşesinde bulunur. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Bu protokol kullanılarak türetilen enteroidler ve kolonoidler daha önce Chandra ve ark. tarafından 201912'de karakterize edildi. Köpek bağırsak organoidleri, bağırsak epitelinin düzenli bir hücresel popülasyonundan oluşur. RNA in situ hibridizasyonu kullanılarak, kök hücre biyobelirteçlerinin ekspresyonu (G Proteini Eşleşmiş Reseptör 5 - LGR5 ve SRY-Box Transkripsiyon Faktörü 9 - SOX9), Paneth Hücre Biyobelirteci (Efrin tipi-B reseptörü 2 - EPHB2), emici epitel hücre belirteçleri (Alkalen fosfataz - ALP) ve enteroendokrin belirteçlerinin (Nörogenin-3 - Neuro G3)12 onaylandı. Alcian Blue boyaması, kadeh hücrelerinin varlığını doğrulamak için parafin gömülü slaytlarda gerçekleştirildi. Ek olarak, organoidlerin metabolik aktivitesini doğrulamak için optik metabolik görüntüleme (OMI) veya kistik fibroz transmembran iletkenlik regülatörü (CFTR) şişlik testi gibi fonksiyonel testler yapıldı. İnflamatuar bağırsak hastalığı, gastrointestinal stromal tümörler (GİST) veya kolorektal adenokarsinom tanısı alan köpeklerden elde edilen köpek organoidleri de bu protokol kullanılarak izole edildi12.
Kök hücre izolasyonundan sonra, hepatik köpek organoidleri yaşam döngülerine genişleyen sferoidler olarak başlar ve ~ 7 gün sonra tomurcuklanan ve farklılaşan organoidlere dönüşürler. Bu protokole göre izole edilen ve kültürlenen köpek hepatik sferoidleri, büyümelerini ölçmek ve geçiş için ideal zamanı belirlemek için ölçüldü. Sağlıklı yetişkin köpeklerin laparoskopik hepatik biyopsilerinden elde edilen sferoidler (n = 7) ilk 7 günlük kültürlerinde ölçüldü. Temsili görüntüler çekildi ve sferoidlerin (n = 845) uzunlamasına (a) ve çapraz (b) yarıçapı kültür boyunca ölçüldü. Sferoidlerin hacmi (V), yüzey alanı (P), 2D elips alanı (A) ve çevresi (C) hesaplandı. Deneyin hesaplamaları ve sonuçları Şekil 7'de özetlenmiştir. Işık mikroskobu kullanılarak organoid kültürün sağlığını değerlendirmek için 2D elips alanı ve çevresi kullanıldı. Bu değerler, kültür bakım kararları için bir rehber görevi görebilir.
Kısaca, sferoidler hacim, yüzey alanı, 2D elips alanı ve çevre bakımından hızla genişledi. Yedi beagle'dan elde edilen ölçüm verilerinin ortalaması aşağıdaki hesaplamalar için alınmıştır. Hacim 2. günden 3. güne kadar %479 (±%6) arttı. Aynı zamanda, küresel yüzey alanı ve 2D elips alanı sırasıyla% 211 (±% 208) ve% 209 (±% 198) oranında artmıştır. 2D elips çevresi 2. günden 3. güne %73 (%±57) artmıştır. Hepatik organoidlerin toplam hacmindeki 2-7 gün arasındaki artış 365 kattan fazla, yüzey alanı ve 2D elips alanı 49 kat arttı ve 2D elips çevresi altı kat arttı.
Daha sonra, iki yetişkin köpek örneğinden türetilen sferoidler, geçiş sonrası daha da büyütüldü ve RNA in situ hibridizasyonu (RNA ISH) için her gün (2-7. gün) toplandı. Köpek probları tasarlandı (prob listesi Ek Tablo 2 olarak verilmiştir) ve kök hücre belirteçleri (LGR5), kolanjiyositlere özgü belirteçler (sitokeratin 7 - KRT-7 ve aquaporin 1 - AQP1) ve hepatosit belirteçleri (çatal kafası kutusu proteini A1 - FOXA1; ve sitokrom P450 3A12 - CYP3A12) için mRNA ekspresyonu değerlendirildi. Belirteçlerin ekspresyonu yarı nicel olarak değerlendirilmiştir ( Şekil 8'deki temsili resimler). Sferoidler tercihen hücrelerin sinyal alanında / toplam alanında% 1 ila% 26 arasında değişen kolanjiyosit belirteci KRT-7'yi eksprese ettiler. AQP1, organoid örneklerde ifade edilmemiştir, çünkü muhtemelen köpek hepatik örneklerinde varlığı seyrektir. Kök hücre belirteci ekspresyonu (LGR5) %0.17 ila %0.78 arasında değişirken, hepatosit belirteçleri FOXA1 için %0.05-%0.34 ve CYP3A12 için %0.03-%0.28 arasında daha düşük bir oranda eksprese edildi.
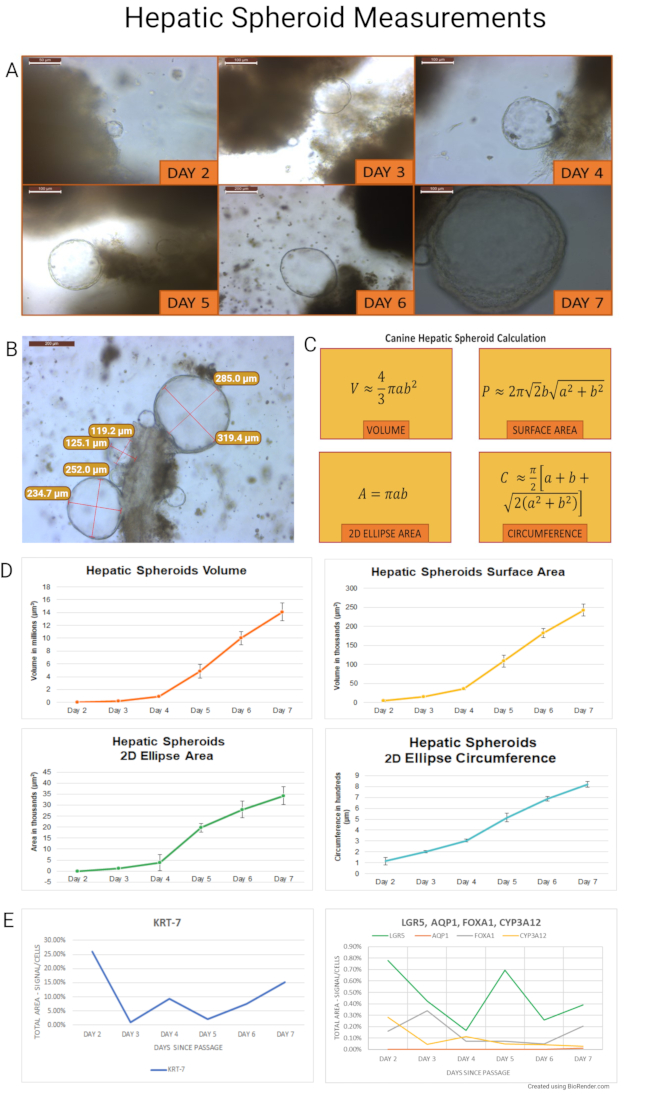
Şekil 7: Hepatik sferoid ölçümleri. (A) Hepatik sferoid büyümesi kültürlerin her günü 2-7. günlerden itibaren gözlendi. Sferoidler ilk olarak 2. günde oluştu ve son sferoidler 7. günde tomurcuklanma sürecine başladı. Daha sonraki bir deneyde, RNA ISH gerçekleştirmek için parafin gömme işlemi için her gün sferoidleri toplamak için geçişten sonra iki köpek organoid çizgisi kullanıldı (2. gün görüntüsü 40x'te, 6. gün görüntüsü 10x'te çekildi ve görüntülerin geri kalanı 20x büyütmede çekildi). (B) İzolasyondan 4 gün sonra çözünür ECM'ye gömülü bir doku parçasına bağlı bir hepatik sferoid küme gösterilmiştir. Sferoidlerin uzunlamasına ve çapraz yarıçapları ölçüldü (görüntü 10x'te çekildi). Panel (C), hacim (V), yüzey alanı (P), 2B elips alanı (A) ve çevre (C) türetmek üzere hesaplamalar için kullanılan formülü gösterir. Bu hesaplamalar için, köpek hepatik sferoidlerinin ideal sferoidler olduğu varsayılmıştır. Bireysel büyüme günleri için hepatik sferoidlerin hacmi, yüzey alanı, 2D elips alanı ve 2D elips çevresi ölçümlerinin sonuçları panelde (D) gösterilmiştir. Hata çubukları, ortalamanın (SEM) standart hatasını temsil eder. (E) KRT-7, LGR5, FOXA1 ve CYP3A12'nin mRNA ekspresyonu, 2. günden 7. güne geçtikten sonra köpek hepatik sferoid örneklerinde ölçülmüştür. Bu örneklerde AQP1 ifade edilmemiştir. Her görüntünün sol üst köşesinde bir ölçek çubuğu (5x: 500 μm; 10x: 200 μm; 20x: 100 μm; 40x: 50 μm) bulunur. Objektif büyütme not edildi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Organoidler, bu standartlaştırılmış tekniği takip eden pasaj sürecinde nadiren parçalanmazlar. Ayrışma gerçekleşmezse, optimal hücre kümesi parçalanması elde etmek için geçiş süreleri ayarlanabilir. Bununla birlikte, tripsin benzeri proteaza uzun süre maruz kalmak, organoidlerin büyümesini olumsuz yönde etkileyebilir. Hepatik organoidler, optimal ayrışma süresini araştırmak ve uygun bir pasaj yöntemi oluşturmak için sonraki bir deneyde kullanıldı. Kısaca, iki sağlıklı köpeğin hepatik organoidleri (her biri 6 iyi kopyalar) 12 dakika ve 24 dakika boyunca tripsin benzeri proteaz ile geçirildi. Örnekler her 6 dakikada bir çalkalandı. Ayrışma zaman noktasının sonunda, çözeltiye 6 mL buz gibi soğuk Gelişmiş DMEM / F12 eklendi ve numuneler döndürüldü (4 ° C'de 5 dakika boyunca 700 x g). Süpernatant (seyreltilmiş tripsin benzeri proteaz içeren Gelişmiş DMEM / F12) çıkarıldı ve peletler yukarıda tarif edildiği gibi çözünür ECM'ye gömüldü (adım 4.4-4.5). Çözünür ECM ve CMGF+ R/G'de 12 saatlik kültürden sonra her iki örnekte de farklılıklar gözlendi. Tripsin benzeri proteaz ile 12 dakikalık bir inkübasyon organoid büyümesini inhibe etmedi. Bununla birlikte, organoidlerin büyümesi 24 dakikalık bir inkübasyon kullanılarak olumsuz etkilenmiştir (bkz. Şekil 9).

Şekil 9: Köpek hepatik organoid pasaj deneyi. İki köpekten (D_1 ve D_2) türetilen organoidlerin temsili görüntüleri, tripsin benzeri proteaz inkübasyon yöntemi kullanılarak 12 dakika veya 24 dakika boyunca geçmiştir. Kontrol örnekleri tripsin benzeri proteaz ile 10 dakika süreyle geçirildi. Her görüntünün sol üst köşesinde bir ölçek çubuğu (μm) bulunur ve 500 μm'yi (5x objektif büyütme) temsil eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Daha sonra, bu protokolden türetilen köpek hepatik organoidlerinin elverişsiz bir ortamda (yapısal destek ve beslenmeden yoksunluk) hayatta kalabilirliği üzerine araştırma yapılmıştır. Araştırma, hepatik organoidin başarılı büyümesi ve hayatta kalması için gerekli organoid ortam ve bodrum matriksinin hacmini belirlemeye ve ayrıca bu koşulların organoid kültür üzerindeki etkisini belirlemeye odaklanmıştır. Hayatta kalma kabiliyeti, sınırlı sayıda organoid içeren 96 kuyucuklu bir plakada ölçüldü. İki köpekten elde edilen organoidler yukarıda tarif edildiği gibi pasajlandı ve farklı hacimlerde çözünür ECM'ye (10 μL veya 15 μL) gömüldü (12 replikasyon). Hücreler, 400 hücre / 10 μL kuyu ve 40.000 hücre / mL'ye karşılık gelen 600 hücre / 15 μL kuyu konsantrasyonunda kaplandı. Farklı birimlere (25 μL, 30 μL veya 35 μL) iki ortam türü (CMGF+ veya CMGF+ R/G) eklenmiştir. Medya hiçbir zaman değiştirilmedi ve bakım prosedürleri uygulanmadı. Organoidlerin hayatta kalma kabiliyeti her gün izlendi. Organoid ölüm, organoid yapıların %50'den fazlasının çözünmesi olarak tanımlandı. Bu koşullarda organoidlerin sağkalım oranları 12.9 (±2.3) gün ile 18 (±1.5) gün arasında değişmekte olup sonuçlar Tablo 3'te özetlenmiştir. En uzun süre hayatta kalan iki örnek, 15 μL çözünür ECM ve 30 μL CMGF + ortamına gömülü köpeklerden türetilen organoidlerdi. Her iki örnek de organik genişlemenin hala mümkün olduğundan emin olmak için 18 günlük yoksunluktan sonra standart bir 24 delikli plakada çözünür ECM (30 μL) ve taze ortama (500 μL) gömüldü (Şekil 10).
| Medya Türü | Ortalama (hayatta kalan günler) | Medyan | Özgeçmiş | Ortalama (hayatta kalan günler) | Medyan | Özgeçmiş | Ortalama (hayatta kalan günler) | Medyan | Özgeçmiş | Ortalama (hayatta kalan günler) | Medyan | Özgeçmiş | |
| Medya (μL) | 30 | 25 | 35 | 30 | |||||||||
| ECM (μL) | 10 | 10 | 10 | 15 | |||||||||
| D_1 | CMGF+ R/G | 12.50 | 13 | 11.57 | 12.83 | 13 | 4.50 | 11.83 | 11.5 | 12.91 | 12.08 | 13 | 12.46 |
| CMGF+ | 17.08 | 17 | 16.26 | 18.50 | 19 | 4.89 | 18.42 | 19 | 14.54 | 17.82 | 19 | 8.99 | |
| D_2 | CMGF+ R/G | 13.67 | 14 | 13.36 | 13.00 | 13 | 12.70 | 14.00 | 14.5 | 17.23 | 13.08 | 13 | 8.90 |
| CMGF+ | 15.50 | 15 | 18.56 | 17.50 | 18 | 10.48 | 17.50 | 19 | 20.89 | 17.00 | 17 | 14.41 | |
| TOPLAM | CMGF+ R/G | 13.08 | 13 | 13.13 | 12.92 | 13 | 9.39 | 12.92 | 13 | 17.52 | 12.58 | 13 | 11.22 |
| CMGF+ | 16.29 | 16.5 | 17.69 | 18.00 | 18.5 | 8.35 | 17.96 | 19 | 17.65 | 17.43 | 17 | 11.70 | |
| ölüm = organoid kitlenin% 50'sinden fazlası dayanamaz | |||||||||||||
Tablo 3: Hayatta kalma deneyi sonuçları. Deney, yapısal destekten yoksun bırakılmaya veya iki organoid kültürün beslenmesine dayanıyordu. Sonuçlar, bireysel köpeklerde çözünür ECM ve ortamın bireysel konsantrasyonlarının ortalama, medyan ve standart sapmasını (CV%) içerir.
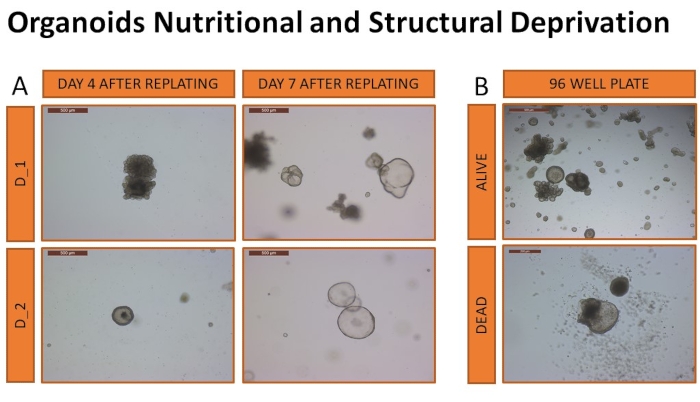
Şekil 10: Organoidlerin beslenme ve yapısal yoksunluk. Organoidler, yoksunluk sonrası genişleme yeteneğini doğrulamak için 24 delikli plakalarda yeniden kaplandı (A). Replatingden sonraki 4. ve 7. günlerden itibaren temsili görüntüler, organoidlerin genişlemesini göstererek, canlı organoidleri görsel olarak tanımlama yeteneğini doğrular (görüntüler 5x objektif büyütmede çekilir). Canlı veya ölü olarak kabul edilen organoidlerin temsili görüntüleri (B) de görülür. Görüntüler 5x objektif büyütmede çekilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 8: Hepatik sferoidler RNA in situ hibridizasyon temsili görüntüleri. LGR5, KRT7, FOXA1 ve CYP3A12 belirteçlerinin temsili görüntüleri, geçiş sonrası 2-7. günlerden örneklerin 60x objektif büyütmesinde alınmıştır. Pozitif mRNA molekülleri kırmızıya boyanır. AQP1 örneklerde ifade edilmedi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Tamamlanmamış şelatlama çözeltisi (ICS) bileşimi | Son konsantrasyon |
| 500 mL H2O | NA |
| 2.49 g Na2HPO4-2H2O | 4.98 mg/mL |
| 2,7 g KH2PO4 | 5.4 mg/mL |
| 14 g NaCl | 28 mg/mL |
| 0,3 g KCl | 0.6 mg/mL |
| 37.5 g Sakkaroz | 75 mg/mL |
| 25 g D-Sorbitol | 50 mg/mL |
| Komple şelatlama çözeltisi (CCS) bileşimi | V/V % veya nihai konsantrasyon |
| Tamamlanmamış şelasyon çözeltisi | 20% |
| Steril H2O | 80% |
| cesaret | 520 μM |
| Kalem Strep | Kalem: 196 U/mL; Strep 196 ug/mL |
| Organoid medya bileşimi | Son konsantrasyon |
| Gelişmiş DMEM/F12 | NA |
| FBS (Serbest Dolaşım | 8% |
| Glutamax | 2 mM |
| HEPES | 10 mM |
| Primosin | 100 μg/mL |
| B27 takviyesi | 1 adet |
| N2 takviyesi | 1 adet |
| N-Asetil-L-sistein | 1 mM |
| Murine EGF | 50 ng/mL |
| Murine Noggin | 100 ng/mL |
| İnsan R-Spondin-1 | 500 ng/mL |
| Murine Wnt-3a | 100 ng/mL |
| [Leu15]-Gastrin I insan | 10 nM |
| Nikotinamid | 10 mM |
| A-83-01 | 500 nM |
| SB202190 (P38 inhibitörü) | 10 μM |
| TMS (trimetoprim sülfametoksazol) | 10 μg/mL |
| Ek bileşenler | Son konsantrasyon |
| ROCK inhibitörü (Y-27632) | 10 μM |
| Stemolekül CHIR99021 (GSK3β) | 2,5 μM |
| Dondurucu ortam bileşimi | V/V yüzdesi |
| Organoid medya ve ROCK inhibitörü | 50% |
| FBS (Serbest Dolaşım | 40% |
| Dimetil Sülfoksit (DMSO) | 10% |
| FAA bileşimi | V/V yüzdesi |
| Etanol (%100) | 50% |
| Asetik Asit, Buzul | 5% |
| Formaldehit (%37) | 10% |
| Damıtılmış su | 35% |
Tablo 1: Çözeltilerin ve ortamların bileşimi. Tamamlanmamış ve tamamlanmış şelatlama çözeltilerinin, CMGF + (organoid ortam), dondurucu ortamın ve FAA'nın bileşenlerinin ve konsantrasyonlarının bir listesi.
Ek Tablo 1: Organoid bakım şablonu. Bu şablon, her gün için doğru ve tekrarlanabilir organoid not almayı sağlar. Bu tabloyu indirmek için lütfen tıklayınız.
Ek Tablo 2: RNA in situ hibridizasyon probları. RNA in situ hibridizasyon tekniğini gerçekleştirmek için teknolojinin bir üreticisi tarafından köpek mRNA hedefleri için özel olarak tasarlanmış probların listesi. Tek tek belirteçlerin önemi, bir probun adı, referans numarası ve hedef bölge hakkında bilgiler listelenir. Bu tabloyu indirmek için lütfen tıklayınız.
Tartışmalar
Şu anda köpek hepatik ve bağırsak organoidlerinin izolasyonu ve bakımı için standartlaştırılmış protokollerin eksikliği vardır. Bu modelin farklı laboratuvar ortamlarında uygulanabilmesi için organoid kültürler için standart çalışma prosedürlerinin oluşturulması gerekmektedir. Spesifik olarak, bu köpek organoid modellerinin kültürü için standartlaştırılmış çalışma protokolleri sağlamak, organoidlerin kültür sırasında normal büyümesini karakterize etmenin ve genişleme ve bakım için en uygun zaman noktalarını elde etmek için pasajın anahtarıdır. Protokol kullanılarak kültürlenen köpek bağırsak organoidleri daha önce Chandra ve ark.12 ile karakterize edilmiştir.
Protokolün en kritik adımlarından biri organoidlerin geçişidir. Hepatik sferoidlerin ilk geçişi için en uygun zaman, hepatik sferoid ölçümlerine dayanarak izolasyondan sonraki 7. günde olarak belirlenmiştir. Maksimum sferoidlerin hacmine 7. günde ulaşıldı ve aynı zamanda sferoidler tomurcuklanmaya başladı ve hepatik organoidler oluşturdu. İzolasyondan sonraki 2-7. günden itibaren genel organoid hacmindeki artış 365 kattan fazlaydı, bu da optimal geçiş süresinin köpek bağırsak organoid kültüründen daha uzun olduğunu düşündürmektedir. Kültürde 7 gün sonra, hepatik sferoidde brüt hücresel apoptoz bulguları, temizlik veya pasaj olmadan bile gözlenmedi (Şekil 7). Bağırsak ve hepatik organoidlerin paslanması zor olabilir, çünkü prosedür hücre kaybına ve canlılığın değişmesine neden olabilir. Sonuçlar, hepatik organoidlerin tripsin benzeri proteaz (12 dakikaya kadar) ile uzun süreli inkübasyonunun alt kültürü olumsuz yönde etkilemediğini göstermektedir. Organoidlerin tripsin benzeri proteazda 24 dakikadan daha uzun süre inkübe edilmesi, organoidlerin sonraki alt kültürüne zararlı olabilir.
Organoid geçişli hücre kümelerinde suboptimal kırılma durumunda, tripsin benzeri proteaz ile uzun süreli inkübasyon yerine mekanik ayrışma daha faydalı olabilir. Organoidlerin uygun şekilde ayrışması ile ilgili sorunlarla karşılaşılırsa, geçiş verimini arttırmak için numunelerin kısa girdabı denenebilir. Öte yandan, vorteksleme bir kültürü mahvetme ve hücrelere zarar verme potansiyeline sahiptir, bu nedenle yalnızca diğer prosedürler tekrar tekrar başarısız olduğunda kullanılmalıdır. Hepatik organoidleri tek hücrelere ayırmak, organoidlerin büyüme hızını düşürürken, onları hücre kümelerine bölmek canlılıklarını büyük ölçüde artırabilir. Organoid protokol için kuluçka süresi olarak on dakika seçildi. 12 dakikalık bir inkübasyon zaman noktası, tripsin benzeri proteaz deneyinde 24 dakikalık bir inkübasyona kıyasla sitotoksik olarak kabul edilmedi.
Hayatta kalma deneyi, köpek hepatik organoidlerinin olumsuz koşullarda (yapısal ve beslenme tükenmesi) 19.5 güne kadar hayatta kalabileceğini doğruladı. Bu koşullardan en uzun süre kurtulan organoidler CMGF + ortamı ile kültürlendi. Bu gözlem, Kaya inhibitörü ve GSK3β ile desteklenmeyen ortamlarda hepatik organoidlerin daha yavaş büyümesinden kaynaklanmış olabilir. CMGF + R / G ile organoid kültürler daha hızlı büyüdü ve kaynaklarını daha hızlı tüketmiş olabilir. Bu deney, yüksek verimli bir sistem dönüşümü elde etmek için köpek organoid kültürünü minyatürleştirme olanaklarını ortaya çıkarmaktadır. Böyle bir teknoloji, ilaç keşfini veya toksikoloji çalışmalarını önemli ölçüde azaltılmış bir maliyetle kolaylaştırma potansiyelini göstermektedir.
Köpek organoid kültürünün bakımı sırasında karşılaşılan bazı yaygın sorunlar, kaplama sırasında yanlış numune katılaşması, kültür kontaminasyonu ve organoidlerin uygun yoğunluğunu ve boyutunu belirlemektir. Çözünür ECM, kaplama sırasında erken katılaşarsa, derhal 10 dakika boyunca buzun üzerine yerleştirin. Çözünür ECM kubbe benzeri yapılar oluşturmuyorsa, numuneden yeterli ortamın çıkarılmamış olması muhtemeldir. Bu durumda, kubbeler oluşana kadar numuneyi daha çözünür bir ECM ile seyreltin.
Bir plakanın tamamında mantar veya bakteriyel kontaminasyon bulunduğunda (bkz. Şekil 4), en iyi çözüm plakayı atmaktır. Antifungal veya antibiyotik ilaçlarla tedavi denenebilir, ancak böyle bir girişimin başarısı son derece düşüktür. Tek bir kuyu bir plakada kirlenmişse, canlı ve etkilenmemiş kuyular yeni bir plakaya temizlenebilir (4.1 ila 4.5 arasındaki adımları izleyin) ve yakından izlenebilir. Numune zaten Acil Durum Dondurulmuşsa, numunenin çözülmesi inkübatörü ek kontaminasyon riskine maruz bıraktığından, numunenin tamamının atılması önerilir.
Sağlıklı organoid kültür en azından orta büyüklükte ve orta yoğunluklu kategoride veya daha büyük olmalıdır. Optimal yoğunluk, organoid kültür büyümesi için çok önemlidir. Düşük yoğunluk, organoidleri orta yoğunluğa kadar temizleyerek düzeltilmelidir. Aşırı yoğunluk durumu ortaya çıkarsa (aşırı kalabalık), organoidler daha fazla kuyuya genişletilmelidir. Hücresel apoptozun brüt belirtileri genellikle organoid kültürün hem aşırı kalabalıklaşmasına hem de düşük yoğunluğuna eşlik eder. Bu sorunlar zamanla düzeltilmezse, tüm organoid kültür birkaç gün içinde apoptotik hale gelecektir. Organoidler ekstra büyük boyuta veya çok yüksek yoğunluğa ulaşırsa, kültür bir deney, donma veya sabitleme için kullanılmalıdır.
Organoid ortam şu anda 17 bileşen içermektedir ve bu nedenle organoid bakım ve genişleme için gereken büyüme faktörlerinin eklenmesi pahalı olabilir. Bu problem, şartlandırılmış CMGF + üretmek için büyüme faktörlerini sentezleyen 2D hücre kültürlerinin büyütülmesiyle çözülebilir. Hücre kültürü L-WRN, Wnt-3a, R-Spondin-3 ve Noggin büyüme faktörlerini37 üretir. Hücre kolonisi% 90 DMEM / F12 ve% 10 FBS kültür medyası kullanır. Kültür yüzde 90 akıcılığa ulaştığında, medya 1 hafta boyunca her gün hasat edilir. Hasat edilen ortam daha sonra 2x CMGF + ile karıştırılır (bu büyüme faktörleri olmadan). 2D kültürler gerekli büyüme faktörlerini maliyetin bir kısmıyla üretebilirken, medyayı üretmek için eklenen zaman ve hazırlık beklenmelidir. Şartlandırılmış ortam partileri arasındaki büyüme faktörlerinin konsantrasyonları da farklılık gösterebilir37,38.
Köpek yetişkin kök hücre kaynaklı organoid kültürleri, Tek Sağlık Girişimi'nin hedeflerine ulaşmaya yardımcı olabilecek benzersiz bir biyomedikal modeldir39. Organoid teknolojisi, gelişim biyolojisi, patofizyoloji, ilaç keşfi ve testi, toksikolojiden bulaşıcı hastalıkların ve rejeneratif tıbbın incelenmesine kadar birçok temel ve biyomedikal araştırma alanında kullanılabilir40. Translasyonel ve ters translasyonel araştırma, köpek organoidlerinin uygulanabilir olduğu alanlardır15. Köpekler yüzyıllardır translasyonel deneysel ortamlarda kullanılmıştır ve eşlik eden hayvan statüleri de veteriner hekimlikte en çok araştırılan türlerden biri olarak konumlarını kolaylaştırmıştır.
Sonuç olarak, bu makale bu modelin çeşitli biyomedikal alanlarda uygulanmasını kolaylaştırmak için köpek hepatik ve intestinal organoidlerinin izolasyonu, bakımı, toplanması ve biyobankacılığı için standartlaştırılmış çalışma protokolleri sunmaktadır. Bu model, bilginin disiplinler arası ve disiplinler arası paylaşımını teşvik etmek için Tek Sağlık Girişimi'nin bir aracı olarak ters çeviri araştırmasını teşvik etmek için benzersiz bir şekilde uygundur.
Açıklamalar
K. Allensach, LifEngine Hayvan Sağlığı ve 3D Sağlık Çözümleri'nin kurucu ortağıdır. Ceva Animal Health, Bioiberica, LifeDiagnostics, Antech Diagnostics, Deerland Probiotics ve Mars için danışman olarak hizmet vermektedir. J. P. Mochel, LifEngine Hayvan Sağlığı ve 3D Sağlık Çözümleri'nin kurucu ortağıdır. Dr. Mochel, Ceva Hayvan Sağlığı ve Ethos Hayvan Sağlığı için danışman olarak hizmet vermektedir. Diğer yazarların beyan edecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar, Iowa Eyalet Üniversitesi çalışanlarının Veteriner Teşhis Laboratuvarı'na, yani Haley M. Lambert, Emily Rahe, Rosalyn M. Branaman, Victoria J. Green ve Jennifer M. Groeltz-Pamukçuk'a, sağlanan örneklerin zamanında işlenmesi için şükranlarını ifade etmek istiyorlar. Yazarlar, Fakülte Başlangıcı, ISU VPR Miller Ödülü, ISU VPR Miller Ödülü ve ISU # 1912948'ye NSF SBIR alt ödülünün desteğini kabul etmek istiyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Chelating solution | |||
| D-Sorbitol | Fisher Chemical | BP439-500 | |
| DTT | Promega | V3151 | |
| KCl | Fisher Chemical | P217-500 | |
| KH2PO4 | Sigma | P5655-100G | |
| Na2HPO4-2H2O | Sigma | S5136-100G | |
| NaCl | Fisher Chemical | S271-500 | |
| Pen Strep | Gibco | 15140-122 | |
| Sucrose | Fisher Chemical | S5-500 | |
| Organoid media | |||
| [Leu15]-Gastrin I human | Sigma | G9145-.5MG | |
| A-83-01 | PeproTech | 9094360 | |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| B27 supplement | Gibco | 17504-044 | |
| FBS | Corning | 35-010-CV | |
| Glutamax | Gibco | 35050-061 | |
| HEPES | VWR Life Science | J848-500ML | |
| Human R-Spondin-1 | PeproTech | 120-38-500UG | |
| Murine EGF | PeproTech | 315-09-1MG | |
| Murine Noggin | PeproTech | 250-38-250UG | |
| Murine Wnt-3a | PeproTech | 315-20-10UG | |
| N2 supplement | Gibco | 17502-048 | |
| N-Acetyl-L-cysteine | Sigma | A9165-25G | |
| Nicotinamide | Sigma | N0636-100G | |
| Primocin | InvivoGen | ant-pm-1 | |
| ROCK inhibitor (Y-27632) | EMD Millipore Corp. | SCM 075 | |
| SB202190 (P38 inhibitor) | Sigma | S7067-25MG | |
| Stemolecule CHIR99021 (GSK3β) | Reprocell | 04-0004-base | |
| Trimethoprim | Sigma | T7883-5G | |
| Sulfamethoxazole | Sigma-Aldrich | S7507-10G | |
| Reagents | |||
| Acetic Acid, Glacial | Fisher Chemical | A38-500 | |
| Dimethyl Sulfoxide (DMSO) | Fisher Chemicals | D128-500 | |
| EDTA, pH 8.0, 0.5 M | Invitrogen | 15575-038 | |
| Formaldehyde (37%) | Fisher Chemical | F79P-4 | |
| Glutaraldehyde solution | Sigma | G5882 | |
| Matrigel Matrix For Organoid Culture | Corning | 356255 | Extracellular Membrane Matrix |
| Paraformaldehyde, 97% | Alfa Aesar | A11313 | |
| PBS, 1X (Phosphate-Buffered Saline) | Corning | 21-040-CM | |
| PBS, 1X (Phosphate-Buffered Saline) | Corning | 21-040-CM | |
| RNAlater Soln. | Invitrogen | AM7021 | RNA Storage Reagent |
| TrypLE Express | Gibco | 12604-021 | Trypsin-like Protease |
| Other | |||
| 6 Well Cell Culture Plate | Corning | 3516 | |
| ACD Hybez II Hybridization System | ACD a biotechne brand | 321710 | |
| Centrifuge Tube, 15 mL | Corning | 430766 | |
| CoolCell LX | Corning | BCS-405MC | |
| Cryogenic Vials | Corning | 430488 | |
| Disposable Centrifuge Tube (50 mL) | Fisherbrand | 05-539-13 | |
| GyroMini Nutating mixer (Rocker) | Labnet | S0500-230V-EU | |
| Heat Bath | Lab-Line Instruments | 3000 | |
| Mr. Frosty Freezing Container | ThermoFisher Scientific | 5100-0001 | |
| NanoDrop 2000 | ThermoFisher Scientific | ND2000CLAPTOP | SpectrophotometerAnalysis |
| Panasonic incubator | Panasonic | MCO-170ML-PA | |
| Parafilm M Wrapping Film | Bemis Company Inc | PM996/EMD | Laboratory Flexible Film Tape |
| Protected Disposable Scalpels | Bard-Parker | 239844 | |
| RNAscope 2.5 HD Assay – RED | ACD a biotechne brand | 322350 | |
| RNAscope H2O2 & Protease Plus Reagents | ACD a biotechne brand | 322330 | |
| RNAscope Target Retrieval Reagents | ACD a biotechne brand | 322000 | |
| RNAscope Wash Buffer Reagents | ACD a biotechne brand | 310091 | |
| Tissue Culture Dish | Dot Scientific | 6676621 | |
| Tissue Culture Plate 24 wells | Fisherbrand | FB012929 |
Referanslar
- Hickman, D. L., Johnson, J., Vemulapalli, T. H., Crisler, J. R., Shepherd, R. Commonly used animal models. Principles of Animal Research for Graduate and Undergraduate Students. , 117-175 (2017).
- De Jong, M., Maina, T. Of mice and humans: Are they the same? - Implications in cancer translational research. Journal of Nuclear Medicine. 51 (4), 501-504 (2010).
- Cannarozzi, G., Schneider, A., Gonnet, G. A phylogenomic study of human, dog, and mouse. PLoS Computational Biology. 3 (1), 0009-0014 (2007).
- Jacob, J. A. Researchers turn to canine clinical trials to advance cancer therapies. JAMA - Journal of the American Medical Association. 315 (15), 1550-1552 (2016).
- Ziegler, A., Gonzalez, L., Blikslager, A. Large animal models: The key to translational discovery in digestive disease research. Cellular and Molecular Gastroenterology and Hepatology. 2 (6), 716-724 (2016).
- Swanson, K. S., et al. Phylogenetic and gene-centric metagenomics of the canine intestinal microbiome reveals similarities with humans and mice. ISME Journal. 5 (4), 639-649 (2011).
- Coelho, L. P., et al. Similarity of the dog and human gut microbiomes in gene content and response to diet. Microbiome. 6 (1), 72 (2018).
- Nguyen, T. L. A., Vieira-Silva, S., Liston, A., Raes, J. How informative is the mouse for human gut microbiota research. DMM Disease Models and Mechanisms. 8 (1), 1-16 (2015).
- Bontempo, V. Nutrition and health of dogs and cats: Evolution of petfood. Veterinary Research Communications. 29, 45-50 (2005).
- Allenspach, K., Gaschen, F. Canine chronic enteropathies: A review. Schweizer Archiv fur Tierheilkunde. 145 (5), 209-222 (2003).
- Tribuddharatana, T., Kongpiromchean, Y., Sribhen, K., Sribhen, C. Biochemical alterations and their relationships with the metabolic syndrome components in canine obesity. Kasetsart Journal - Natural Science. 45 (4), 622-628 (2011).
- Chandra, L., et al. Derivation of adult canine intestinal organoids for translational research in gastroenterology. BMC Biology. 17 (1), 33 (2019).
- Schaefer, K., Rensing, S., Hillen, H., Burkhardt, J. E., Germann, P. G. Is Science the only driver in species selection? An internal study to evaluate compound requirements in the minipig compared to the dog in preclinical studies. Toxicologic Pathology. 44 (3), 474-479 (2016).
- MacArthur Clark, J. The 3Rs in research: A contemporary approach to replacement, reduction and refinement. British Journal of Nutrition. 120, 1-7 (2018).
- Schneider, B., et al. Model-based reverse translation between veterinary and human medicine: The one health initiative. CPT: Pharmacometrics and Systems Pharmacology. 7 (2), 65-68 (2018).
- Lehmann, R., et al. Human organoids: A new dimension in cell biology. Molecular Biology of the Cell. 30 (10), 1129-1137 (2019).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Kim, J., Koo, B. K., Knoblich, J. A. Human organoids: model systems for human biology and medicine. Nature Reviews Molecular Cell Biology. 21 (10), 571-584 (2020).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Ho, B. X., Pek, N. M. Q., Soh, B. S. Disease modeling using 3D organoids derived from human induced pluripotent stem cells. International Journal of Molecular Sciences. 19 (4), 936 (2018).
- Truskey, G. A. Human microphysiological systems and organoids as in vitro models for toxicological studies. Frontiers in Public Health. 6, 185 (2018).
- Caipa Garcia, A. L., Arlt, V. M., Phillips, D. H. Organoids for toxicology and genetic toxicology: applications with drugs and prospects for environmental carcinogenesis. Mutagenesis. , (2021).
- Augustyniak, J., et al. Organoids are promising tools for species-specific in vitro toxicological studies. Journal of Applied Toxicology. 39 (12), 1610-1622 (2019).
- Zietek, T., et al. Organoids to study intestinal nutrient transport, drug uptake and metabolism - Update to the human model and expansion of applications. Frontiers in Bioengineering and Biotechnology. 8, 577656 (2020).
- Zietek, T., Rath, E., Haller, D., Daniel, H. Intestinal organoids for assessing nutrient transport, sensing and incretin secretion. Scientific Reports. 5 (1), 1-10 (2015).
- Kar, S. K., et al. Organoids: a promising new in vitro platform in livestock and veterinary research. Veterinary Research. 52 (1), 1-17 (2021).
- Borcherding, D. C., et al. Sa1976 polyphenols reverse the pathologic effects of palmitic acid and high fat diet in canine enteroids. Gastroenterology. 158 (6), 486 (2020).
- Ambrosini, Y. M., et al. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS ONE. 15 (4), 0231423 (2020).
- Zdyrski, C., et al. Su124 homology directed repair in canine duodenal enteroids to mimic the wild-type P-glycoprotein mutation. Gastroenterology. 160 (6), 625 (2021).
- Li, Y., Tang, P., Cai, S., Peng, J., Hua, G. Organoid based personalized medicine: from bench to bedside. Cell Regeneration. 9 (1), 21 (2020).
- Kurr, L. A., Allenspach, K., Jergens, A., Mochel, J. P. Harnessing the biology of intestinal organoids to accelerate drug discovery in inflammatory bowel disease: A one health approach. The FASEB Journal. 34, 1 (2020).
- Nantasanti, S., et al. Disease modeling and gene therapy of copper storage disease in canine hepatic organoids. Stem Cell Reports. 5 (5), 895-907 (2015).
- Favier, R. P., et al. COMMD1-Deficient dogs accumulate copper in hepatocytes and provide a good model for chronic hepatitis and fibrosis. PLoS ONE. 7 (8), 42158 (2012).
- Kruitwagen, H. S., et al. Long-term survival of transplanted autologous canine liver organoids in a COMMD1-deficient dog model of metabolic liver disease. Cells. 9 (2), 410 (2020).
- Vilgelm, A. E., et al. Fine-needle aspiration-based patient-derived cancer organoids. iScience. 23 (8), 101408 (2020).
- Saxena, K., et al. Human intestinal enteroids: A new model to study human rotavirus infection, host restriction, and pathophysiology. Journal of Virology. 90 (1), 43-56 (2016).
- VanDussen, K. L., Sonnek, N. M., Stappenbeck, T. S. L-WRN conditioned medium for gastrointestinal epithelial stem cell culture shows replicable batch-to-batch activity levels across multiple research teams. Stem Cell Research. 37, 101430 (2019).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Mackenzie, J. S., Jeggo, M. The one health approach-why is it so important. Tropical Medicine and Infectious Disease. 4 (2), 88 (2019).
- Artegiani, B., Clevers, H. Use and application of 3D-organoid technology. Human Molecular Genetics. 27 (2), 99-107 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır