Method Article
Standardisierung und Pflege von 3D-Organoidkulturen bei Hunden für den Einsatz in der biomedizinischen Forschung
In diesem Artikel
Zusammenfassung
Experimentelle Methoden zur Gewinnung adulter Stammzellen aus dem Darm- und Lebergewebe von Hunden zur Etablierung von 3D-Organoidkulturen werden beschrieben. Darüber hinaus werden die Labortechniken diskutiert, um ein konsistentes Wachstum zu gewährleisten und Standardarbeitsanweisungen für die Ernte, Biobank und Wiederbelebung von Darm- und Leberorganoidkulturen bei Hunden bereitzustellen.
Zusammenfassung
Hunde entwickeln komplexe multifaktorielle Krankheiten analog zum Menschen, einschließlich entzündlicher Erkrankungen, Stoffwechselerkrankungen und Krebs. Daher stellen sie relevante Großtiermodelle mit dem translationalen Potenzial für die Humanmedizin dar. Organoide sind 3-dimensionale (3D), selbstzusammengesetzte Strukturen, die aus Stammzellen gewonnen werden und die Mikroanatomie und Physiologie ihres Ursprungsorgans nachahmen. Diese translationalen In-vitro-Modelle können für Anwendungen der Arzneimittelpermeabilität und -entdeckung, zur toxikologischen Bewertung und zur Bereitstellung eines mechanistischen Verständnisses der Pathophysiologie multifaktorieller chronischer Erkrankungen verwendet werden. Darüber hinaus können Hundeorganoide das Leben von Begleithunden verbessern, indem sie Input in verschiedenen Bereichen der veterinärmedizinischen Forschung liefern und personalisierte Behandlungsanwendungen in der Veterinärmedizin erleichtern. Eine kleine Gruppe von Spendern kann eine Biobank von Organoidproben erstellen, wodurch die Notwendigkeit einer kontinuierlichen Gewebeentnahme reduziert wird, da Organoidzelllinien unbegrenzt subkultiviert werden können. Hierin werden drei Protokolle vorgestellt, die sich auf die Kultur von Darm- und Leberkrebs-Organoiden aus adulten Stammzellen konzentrieren. Das Canine Organoid Isolation Protocol beschreibt Methoden zur Verarbeitung von Gewebe und zur Einbettung des Zellisolats in eine unterstützende Matrix (solubilisierte extrazelluläre Membranmatrix). Das Canine Organoid Maintenance Protocol beschreibt das Wachstum und die Wartung von Organoiden, einschließlich Reinigung und Passieren zusammen mit einem geeigneten Zeitpunkt für die Expansion. Das Organoid Harvesting and Biobanking Protocol beschreibt Möglichkeiten, Organoide für weitere Analysen zu extrahieren, einzufrieren und zu konservieren.
Einleitung
Nagetiere sind das am häufigsten verwendete Tiermodell für die biomedizinische und translationale Forschung1. Sie sind außerordentlich nützlich für die Untersuchung der grundlegenden molekularen Pathogenese der Krankheiten, obwohl ihre klinische Relevanz für chronische multifaktorielle Erkrankungen kürzlich in Frage gestellt wurde2. Das Hundemodell weist im Vergleich zu Nagetieren mehrere Vorteile auf3,4. Hunde und Menschen teilen Ähnlichkeiten in der Metabolomik und im Darmmikrobiom, die sich aufgrund des Verzehrs der menschlichen Ernährung während verschiedener Perioden ihrer Domestizierung entwickelt haben5,6,7. Ähnlichkeiten zwischen der Anatomie und Physiologie des Hundes und des menschlichen Magen-Darm-Trakts sind ein weiteres Beispiel8.
Darüber hinaus teilen Hunde oft ähnliche Umgebungen und Lebensstile mit ihren Besitzern9. Die längere Lebensdauer von Hunden im Vergleich zu Nagetieren ermöglicht die natürliche Entwicklung zahlreicher chronischer Erkrankungen10. Entzündliche Darmerkrankungen oder metabolisches Syndrom sind Beispiele für multifaktorielle chronische Erkrankungen, die wichtige Ähnlichkeiten zwischen Mensch und Hund aufweisen11,12. Präklinische Studien von Hunden, an denen Hunde mit natürlich vorkommenden Krankheiten beteiligt sind, können zuverlässigere Daten generieren als solche, die aus Nagetiermodellen gewonnen wurden13. Um jedoch den Einsatz von Lebendtierversuchen zu minimieren und den Prinzipien der 3R (Reduce, Refine, Replace)14 zu entsprechen, haben sich Alternativen zu In-vivo-Tests mit 3D-In-vitro-Organoiden für Hunde ergeben15.
Organoide sind selbstorganisierte 3D-Stammzellstrukturen, die die Physiologie und Mikroanatomie ihrer ursprünglichen Organe rekapitulieren16,17. Diese Technologie wurde erstmals 200917 von Sato et al. beschrieben und ermöglichte mehr übersetzbare In-vitro-Studien in Epithelzelllinien als bisher mit 2D-Krebszellkulturen18,19,20. Organoide sind in vitro-Modellen in vielen biomedizinischen Disziplinen nützlich, z. B. in präklinischen toxikologischen21,22,23-, Absorptions- oder Metabolismusstudien24,25,26,27,28 sowie in personalisierten medizinischen Ansätzen29,30,31 . Die erfolgreiche Kultur der Darmorganoide von Hunden wurde erstmals 201912 beschrieben, während Leberorganoide, die von einem Hund stammen, erstmals 201532 von Nantasanti et al. berichtet wurden. Canine Organoide wurden seitdem erfolgreich in Studien zur Untersuchung von chronischen Enteropathien bei Hunden, gastrointestinalen Stromatumoren, kolorektalen Adenokarzinomen12 und Morbus Wilson33,34 eingesetzt.
Während adulte Stammzellen über Nekropsien geerntet werden können, erfordert die Organoidtechnologie nicht immer die Opferung der Tiere. Endoskopische und laparoskopische Biopsien oder sogar Feinnadelaspirate von Organen35 sind eine lebensfähige Quelle für adulte Stammzellen zur epithelialen Organoidisolierung12. Der weit verbreitete Einsatz solcher nicht-invasiven Techniken in der tierärztlichen Praxis erleichtert Optionen für die reverse translationale Forschung (Übersetzung von Informationen aus der veterinärmedizinischen klinischen Praxis in die klinische Praxis am Menschen und umgekehrt)15. Die Weiterentwicklung der Organoidtechnologie kann durch die Standardisierung der Organoidkultur und der Wartungsmethoden sichergestellt werden. Das hier vorgestellte Organoidprotokoll basiert teilweise auf zuvor veröffentlichten Arbeiten von Saxena et al. aus dem Jahr 201536, und die Methoden wurden an die Besonderheiten der intestinalen und hepatischen Organoidkultur von Hunden angepasst. Der Gesamtablauf der Organoidprotokolle für Hunde ist in Abbildung 1 dargestellt.
Das Canine Organoid Isolation Protocol führt Methoden zur Gewinnung von Proben aus endoskopischen, laparoskopischen und chirurgischen Biopsien sowie Nekropsien ein. Es skizziert die anfängliche Vorbehandlung von Gewebeproben und Methoden für den Transport zum Labor. Materialien und Reagenzien, die für die Organoidisolierung benötigt werden, sind im Abschnitt "Vorbereitung zur Isolierung" zusammengefasst. Der Prozess der adulten Stammzellisolierung aus Gewebeproben wird ausführlicher beschrieben. Schließlich wird der Prozess der Beschichtung von Organoiden in kuppelartige Strukturen unter Verwendung einer solubilisierten extrazellulären Membranmatrix diskutiert.
Das zweite Protokoll, Canine Organoid Maintenance Protocol, beschreibt Methoden zur Dokumentation und Kultivierung von Organoiden. Medienwechsel und deren Häufigkeit werden in diesem Abschnitt behandelt. Weiterhin werden die Laborverfahren wie das Passieren und Reinigen der Zellkulturen beschrieben, die für die erfolgreiche Aufrechterhaltung von 3D-Canin-Organoiden unerlässlich sind. Die angemessene Weitergabe ist ein kritischer Schritt des Protokolls, und mögliche Anpassungen und Fehlerbehebungen dieses Schritts werden im Manuskript weiter diskutiert.
Das letzte Protokoll ist das Canine Organoid Harvesting and Biobanking Protocol, das Methoden zur Herstellung ausgewachsener Organoide für die Paraffineinbettung und RNA-Konservierung enthält. Auch Verfahren des Biobankings von Organoidproben in der Lagerung von flüssigem Stickstoff werden hier beschrieben. Schließlich werden die Möglichkeiten diskutiert, gefrorene Proben aufzutauen und ihr Wachstum zu unterstützen.
Zusammenfassend zielt dieser Artikel darauf ab, konsistente Organoidkulturverfahren für Hunde durch die Standardisierung von Ringprotokollen bereitzustellen. Auf diese Weise zielt das Manuskript darauf ab, die Reproduzierbarkeit von Daten aus Organoidmodellen von Hunden zu erleichtern, um ihre Relevanz in der translationalen biomedizinischen Forschung zu erhöhen.

Abbildung 1: Workflow von Organoidprotokollen für Hunde. Das Canine Organoid Isolation Protocol beschreibt die Vorbereitung der Materialien, die für die Organoidisolierung benötigt werden, die Entnahme einer Gewebeprobe (durch Nekropsie, endoskopische, laparoskopische und chirurgische Biopsien) und die Anleitung zur Zelldissoziation und -plattierung der Zellpopulation. Das Canine Organoid Maintenance Protocol behandelt die Reinigung und den Übergang der Organoidkultur. Das Organoid Harvesting and Biobanking Protocol diskutiert die Vorbereitung von Organoidproben für die Paraffineinbettung und die weitere Organoidcharakterisierung. Methoden zur Biobank-Organoidkultur und deren Wiederbelebung aus der Speicherung in flüssigem Stickstoff werden ebenfalls diskutiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protokoll
Die Forschung wurde in Übereinstimmung mit dem Institutional Animal Care and Use Committee der Iowa State University (IACUC-19-337; IACUC-18-065; IACUC-19-017).
HINWEIS: Im folgenden Abschnitt (Schritte 1-3) wird das Organoid-Isolationsprotokoll für Hunde beschrieben.
1. Vorbereitung auf die Isolierung
- Transportröhrchen: Füllen Sie vor der organoiden Isolierung (typischerweise 24 h vorher) ein konisches 50-ml-Rohr mit 10 ml Dulbeccos modifizierter Eagle Medium / Nährstoffmischung F-12 (Advanced DMEM / F12), angereichert mit 0,2 ml Pen Strep.
- Für laparoskopische, inzisionale oder exzisionale Biopsien bereiten Sie drei zusätzliche konische Röhrchen mit 50 ml vor. Füllen Sie diese Röhrchen mit 10 ml kompletter Chelatlösung (1x CCS; siehe Tabelle 1).
HINWEIS: Für Schritt 1.2 können 2 mM N-Acetylcystein (NAC) in phosphatgepufferter Kochsalzlösung (PBS) auch als herkömmliche Lösung für die Stammzellgewinnung verwendet werden. Es wurden keine Unterschiede bei der Verwendung von 1x CCS oder NAC in PBS beobachtet. Beide Lösungen werden hinzugefügt, um Zellen in der Lösung freizusetzen. - Halten Sie die Röhren über Nacht bei 4 °C und transportieren Sie die Röhren für den Rest des Protokolls auf Eis.
- Bereiten Sie fünf 15-ml-Zentrifugenröhrchen mit 5 ml 1x CCS, ein 15-ml-Zentrifugenröhrchen mit 3 ml 1x CCS, ein leeres 15-ml-Zentrifugenröhrchen (Überstandsröhrchen) und ein 15-ml-Zentrifugenröhrchen mit 5 ml 1x CCS und 2 ml fetalem Rinderserum (FBS) vor.
HINWEIS: Das Obige kann vor dem Tag der Isolierung vorbereitet werden, wenn mehrere Proben verarbeitet werden. Zur Veranschaulichung siehe das Trennrohrlayout in Abbildung 2. - Bereiten Sie am Tag der Isolation in der Biosicherheitskabine eine Petrischale, ein Skalpell, einen Eiskübel und ein kaltes Advanced DMEM/F12 zu. Legen Sie die erforderliche Anzahl von 24-Well-Zellkulturplatten in den Inkubator (37 °C; 5% CO2-Atmosphäre ), um sie vorzuwärmen.
- Legen Sie die solubilisierte extrazelluläre Membranmatrix (ECM; siehe Materialtabelle) auf Eis, um mit dem Auftauen zu beginnen.
HINWEIS: Das Eintauchen in Eis schützt vor schnellem Auftauen und hilft, Erstarrung zu vermeiden. Eine Schachtel Pipettenspitzen kann in den Gefrierschrank gelegt werden, um die Beschichtung des gelösten ECM zu unterstützen. - Eine Zentrifuge auf 4 °C vorkühlen.
- Vollständige Medien mit den Wachstumsfaktoren "CMGF+" oder "Organoidmedien" (Zusammensetzung siehe Tabelle 1) aus dem Gefrierschrank/Kühlschrank in ein 37 °C warmes Wasserbad verschieben. Vermeiden Sie nach Möglichkeit direkte Lichteinwirkung.
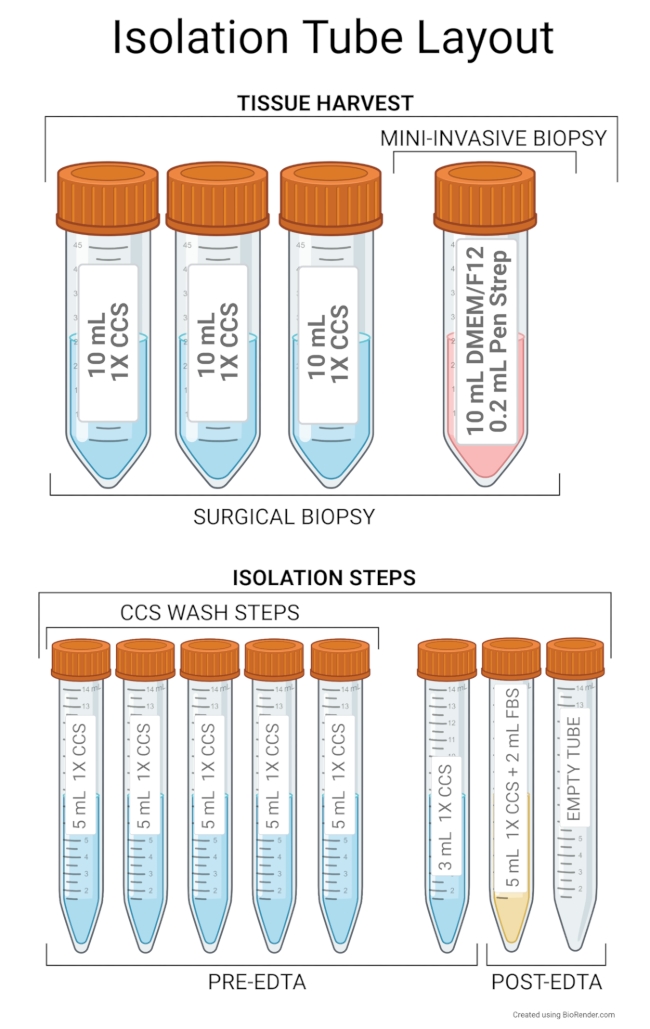
Abbildung 2: Layout des Isolationsrohrs Das empfohlene Setup für die Gewebeentnahme umfasst 10 ml Advanced DMEM / F12 und 0,2 ml Pen Strep in einem 50 ml Zentrifugenröhrchen. Zusätzlich werden drei 50-ml-Röhrchen, die mit 10 ml 1x CCS gefüllt sind, für chirurgische Biopsien oder Nekropsien benötigt. Das empfohlene Röhrchenlayout für Isolationsschritte umfasst fünf Röhrchen mit 5 ml 1x CCS, die während der CCS-Waschschritte verwendet werden können. Das erste Röhrchen wird als Probenröhrchen verwendet, das das gehackte Gewebe enthält, und die restlichen Röhrchen dienen als Reservoirs von 1x CCS, die dem ersten Röhrchen hinzugefügt werden. Das sechste Röhrchen enthält 3 ml 1x CCS zum Spülen des verbleibenden Gewebes aus dem Probenröhrchen beim Transfer auf eine 6-Well-Platte. Diese sechs Röhrchen werden vor dem EDTA-Inkubationsschritt verwendet. Ein Röhrchen mit 5 ml 1x CCS und 2 mL FBS dient nach der EDTA-Inkubation als Probenröhrchen, und der Überstand aus diesem Röhrchen wird mit Stammzellen für den Rest der Isolierung in ein leeres Röhrchen überführt. Halten Sie die Rohre bei 4 ° C, bevor Sie mit der Isolierung beginnen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
2. Gewebeentnahme
- Darmendoskopische und laparoskopische Biopsien (Durchmesser 2,8 mm) können mit einer großen Biopsiezange erfasst werden. Ernten Sie mindestens acht endoskopische Proben pro Darmstelle.
- Proben direkt in Transportröhrchen sammeln und auf Eis legen.
- Für chirurgische Biopsien und Nekropsien Gewebestücke mit einer Größe von 0,5 cm x 0,5 cm entnehmen und in das erste 1x CCS-Rohr legen.
HINWEIS: Entfernen Sie bei Darmbiopsien den verbleibenden Darminhalt und kratzen Sie die Schleimhautschicht mit einem Skalpell, um Zotten zu entfernen. Wenn Proben reichlich vorhanden sind, können zusätzliche Biopsien in Kryovialen gesammelt werden, die RNA-Speicherreagenz (1 ml) enthalten, oder paraffineingebettet für zukünftige Vergleiche zwischen Organoiden und ihrem Ursprungsgewebe. Bei der Entnahme von Biopsien für die TEM-Analyse die Zotten nicht abkratzen und die Probe in Konservierungsmittel (3% Paraformaldehyd und 3% Glutaraldehyd in phosphatgepufferter Kochsalzlösung (PBS)) lagern und bei 4 °C lagern. - Schütteln Sie das 1x CCS-Röhrchen kräftig für ~ 30 s und übertragen Sie die Probe dann mit einer Pinzette in ein neues 1x CCS-Röhrchen. Wiederholen Sie diesen Vorgang zweimal.
- Übertragen Sie die Probe aus dem letzten 1x CCS-Röhrchen in das Transportröhrchen (Advanced DMEM/F12 + Pen Strep) und bringen Sie die Probe zurück ins Labor.
HINWEIS: Auf diese Weise vorbehandelte Proben können auch über Nacht auf Eis versendet werden (nicht auf Trockeneis versenden).
3. Organoid-Isolierung
HINWEIS: Führen Sie die Isolierung mit aseptischen Techniken in einer Biosicherheitskabine durch. Siehe Abbildung 3 für den Organoid-Isolierungs-Workflow bei Hunden.
- Schütteln Sie die Gewebeprobe im Transportröhrchen für ~ 30 s und entfernen Sie überschüssigen Überstand, bis 0,5 ml im Rohr verbleiben, indem Sie langsam in der Nähe der Flüssigkeitsoberfläche pipettieren. Achten Sie darauf, kein Taschentuch zu entsorgen.
- Gewebe und Restgut in eine sterile Petrischale überführen. Schneiden und zerkleinern Sie das Gewebe mit einem Einwegskalpell (oder einer sterilisierten Pinzette und einer Schere) und zerkleinern Sie es in kleinere Stücke (Größe von 1 mm2), die einer Maischekonsistenz für ca. 5 min ähneln.
- Das gehackte Gewebe mit Flüssigkeit aus der Petrischale in die erste CCS-Tube pipettieren. Geben Sie 2 ml Advanced DMEM/F12 in die Petrischale, spülen Sie das restliche Gewebe und geben Sie es in die erste CCS-Röhre.
- Wirbeln Sie die 1x CCS-Röhre für 5 s ungefähr fünfmal um. Lassen Sie die Biopsien am Boden der 15-ml-Röhre (ca. 1 min) absetzen und entfernen Sie den Überstand, bis noch 5 ml in der Röhre vorhanden sind. Übertragen Sie das 1x CCS vom neuen Röhrchen auf das Probenröhrchen.
- Wiederholen Sie den vorherigen Schritt für die nächsten beiden Röhren. Entfernen Sie bei den letzten beiden Wäschen den Überstand bis zu 3 ml, die im Rohr verbleiben.
- Übertragen Sie die Biopsien und 1x CCS vom Probenröhrchen auf eine Vertiefung einer 6-Well-Platte. Fügen Sie dann 3 ml 1x CCS in das Probenröhrchen hinzu, wirbeln Sie vorsichtig, um das verbleibende Gewebe zu sammeln, und übertragen Sie es in die gleiche Vertiefung der Platte.
- Fügen Sie 150 μL 0,5 m EDTA hinzu (um ein Gesamtvolumen von 6,15 ml in einer Vertiefung zu erreichen). Legen Sie die 6-Well-Platte auf einen 20 ° , 24 U / min Nutmischer / Wippe bei 4 ° C. Die Leberproben für 10 min und die Darmproben für 1 h auf der beweglichen Wippe inkubieren.
- Transportieren Sie die 6-Well-Platte zurück zur Biosicherheitswerkbank. Übertragen Sie gehacktes Gewebe und Flüssigkeit in eine 1x CCS / FBS-Röhre und lassen Sie die Gewebe absetzen. Transportieren Sie den Überstand (dieser Teil enthält jetzt freie Stammzellen) und etwa 0,2 ml des oberen Teils des Gewebes zum leeren Röhrchen.
- Drehen Sie das Röhrchen mit der Probe nach unten (700 x g für 5 min bei 4 °C). Stammzellen werden nun zusammen mit dem gehackten Gewebe pelletiert. Entfernen und entsorgen Sie den Überstand vorsichtig, um das Pellet nicht zu stören.
- Schwebe das Pellet in Advanced DMEM/F12 und drehe das Rohr erneut (700 x g für 5 min bei 4 °C). Saugen Sie den Überstand ab und stören Sie das Pellet nicht.
- Berechnen Sie das Volumen des gelösten ECM, das für die Aussaat der dissoziierten Zellen und des Gewebes benötigt wird. Verwenden Sie 30 μL solubilisiertes ECM pro Vertiefung einer 24-Well-Platte, um die richtige Seeding-Dichte zu erreichen.
HINWEIS: Betten Sie eine Probe nach der Isolierung in 4 bis 6 Vertiefungen einer 24-Well-Platte ein (d. h. basierend auf der Menge an gehacktem Gewebe in der Probe). - Fügen Sie das berechnete Volumen der gelösten ECM zum Probenröhrchen hinzu und pipettieren Sie langsam auf und ab, um die Bildung von Blasen zu vermeiden. Säen Sie die Suspension in der Mitte der Vertiefungen, so dass das solubilisierte ECM eine kuppelartige Struktur bilden kann.
HINWEIS: Die Verwendung von Pipettenspitzen aus einem Gefrierschrank von -20 °C hilft bei der Beschichtung von gelöstem ECM. Wenn Gewebebrocken größer als die P200-Pipettenspitze sind, verwenden Sie breite kalte Spitzen oder schneiden Sie kalte P1000-Spitzen, um die Beschichtung zu unterstützen. Bewahren Sie die Probe mit dem gelösten ECM wann immer möglich auf Eis auf. - Transportieren Sie die Platte zu einem Inkubator (37 °C; 5% CO2-Atmosphäre ) und lassen Sie das gelöste ECM für ~30 min erstarren.
- Mischen Sie ROCK-Inhibitor und GSK3β in CMGF+ (Konzentrationen in Tabelle 1). Fügen Sie 500 μL dieser Lösung (CMGF+ R/G) zu jeder Vertiefung hinzu. Legen Sie die Platte in den Inkubator (37 °C; 5% CO2-Atmosphäre ).

Abbildung 3: Organoid-Isolations-Workflow für Hunde. Die entnommene Gewebeprobe wird in eine Petrischale überführt und richtig gehackt. Die Probe wird dann in ein 1x-CCS-Röhrchen überführt und Waschschritte werden durchgeführt. Für die EDTA-Inkubation in einer 6-Well-Platte wird die Probe dann in ein Röhrchen mit 1x CCS und FBS überführt. Nachdem sich das Gewebe abgesetzt hat, wird der Überstand mit einer kleinen Menge Gewebe in eine leere Röhre übertragen. Die Probe wird konsequent gesponnen, der Überstand entfernt und das Pellet wird in Advanced DMEM/F12 resuspendiert. Die Röhre wird erneut gedreht und der Überstand angesaugt und verworfen. Solubilisiertes ECM wird dem Röhrchen hinzugefügt, gemischt, und die Probe wird in einer 24-Well-Platte plattiert. Die Platte wird konsequent für 30 min inkubiert (37 °C; 5% CO2-Atmosphäre ) und anschließend Medien zugegeben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
HINWEIS: Im folgenden Abschnitt (Schritte 4 und 5) wird das Canine Organoid Maintenance Protocol beschrieben. Wechseln Sie das Medium gemäß Tabelle 2 und überprüfen Sie die Organoide täglich auf Anzeichen von Apoptose, Kontamination, Überfüllung und Ablösung von gelöstem ECM. Tägliche Notizen müssen gemäß Abbildung 4 gemacht werden, um die Bedingungen und experimentellen Auswirkungen auf die Kulturen genau zu überwachen. Siehe Ergänzende Tabelle 1 für eine Vorlage, die eine genaue und reproduzierbare Organoidkultur-bezogene Notiz ermöglicht. Für hepatische Organoide verwenden Sie CMGF+, angereichert mit ROCK-Inhibitor und GSK3β.

Abbildung 4: Organoid-Größen- und Dichte-Guide . (A) Organoid-Größentabelle zur genauen Verfolgung des Organoidwachstums. Das Größenverzeichnis umfasst die Kategorien extraklein (XS), klein (S), mittel (M), groß (L) und extragroß (XL). (B) Der Dichteleitfaden besteht aus Kategorien mit sehr niedriger Dichte (VLD), niedriger Dichte (LD), mittlerer Dichte (MD), hoher Dichte (HD) und sehr hoher Dichte (VHD). (C) Repräsentative Bilder der bakteriellen und pilzlichen Kontamination der Organoidprobe. (D) Repräsentative Bilder von organoider Überfüllung und Apoptose. Die objektive Vergrößerung ist in jedem Panel angegeben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Empfehlung zum Medienwechsel | ||||||
| Montag | Dienstag | Mittwoch | Donnerstag | Freitag | Samstag | Sonntag |
| 500 μL | N/A | 500 μL | N/A | 750 μL | N/A | N/A |
Tabelle 2: Empfehlung für Medienwechsel Eine empfohlene Zeitleiste des wöchentlichen Medienwechsels. Es wird empfohlen, die Medien (500 μL CMGF+ für Darmorganoide oder 500 μL CMGF+ R/G für Leberorganoide) jeden zweiten Tag zu wechseln. Um den zusätzlichen Stunden an einem Wochenende Rechnung zu tragen, werden am Freitagnachmittag 750 μL Medien hinzugefügt, während die Medien am Montagmorgen aktualisiert werden.
4. Organoid-Reinigung
HINWEIS: Organoidreinigung oder -passage müssen regelmäßig durchgeführt werden, um die Gesundheit der Organoidkultur zu erhalten. Führen Sie den Reinigungsvorgang durch, wenn Apoptose in der Kultur, Vorhandensein von Ablagerungen, Überfüllung der Organoide oder Ablösung von gelöstem ECM bemerkt wird. Siehe Abbildung 4D.
- Entfernen Sie das Medium aus den Vertiefungen, während Sie die Platte kippen, um eine Zerstörung des gelösten ECM zu vermeiden.
HINWEIS: Wenn die gelöste ECM-Ablösung erheblich ist, wird empfohlen, das Medium in das 15-ml-Röhrchen zu übertragen, um zu vermeiden, dass Fragmente von gelöstem ECM, die die Probe enthalten, verloren gehen. - Fügen Sie 0,5 ml vorgekühltes Advanced DMEM/F12 zu jeder Vertiefung hinzu, um die Matrixkuppeln durch wiederholtes Pipettieren mit einer P1000-Spitze aufzulösen (vermeiden Sie übermäßige Blasen). Die organoidhaltige gelöste Matrix in ein 15 ml Zentrifugenröhrchen überführen. Halten Sie die Röhre auf Eis und wenn das Volumen niedriger als 6 ml ist, füllen Sie die Röhre langsam mit Advanced DMEM / F12, um ein Gesamtvolumen von 6 ml zu erreichen.
- Drehen Sie das Rohr (700 x g für 5 min bei 4 °C) und entfernen Sie den gesamten Überstand, während Sie darauf achten, das Pellet nicht zu stören.
- Fügen Sie das erforderliche Volumen an solubilisiertem ECM hinzu (30 μL pro Well, um die richtige Aussaatdichte zu erreichen) und resuspendieren Sie das Pellet langsam durch Pipettenmischen. Beschichten Sie die Aufhängung in der Mitte der 24-Well-Platte, um eine Kuppel zu bilden.
- Legen Sie die Platte für ~30 min in einen Inkubator (37 °C; 5 % CO2-Atmosphäre ) und fügen Sie dann das entsprechende Medienvolumen hinzu (Tabelle 2).
5. Organoid-Passaging
HINWEIS: Das Passaging wird typischerweise 5-7 Tage nach der ersten Kultur durchgeführt, um die Organoid-Zelllinie zu erweitern. Organoidkulturen können typischerweise im Verhältnis 1:3 erweitert werden. Bilder von gesunden Kulturen, die für die Passage bereit sind, sind in Abbildung 4 zu sehen. Organoide müssen mindestens mittelgroß sein.
- Führen Sie die Schritte 4.1 bis 4.3 aus.
- Entfernen Sie den Überstand, der 0,5 ml in der Röhre verbleibt. Achten Sie darauf, das Pellet nicht zu stören.
- 0,5 ml Trypsin-ähnliche Protease hinzufügen (siehe Materialtabelle), durch Absaugen mit einer Pipette richtig mischen und im 37 °C warmen Wasserbad inkubieren (Darmorganoide für 8 min oder Leberorganoide für 10 min inkubieren). Mischen Sie die Lösung weiter, indem Sie das Rohr zur Halbzeit der Inkubation mehrmals durchdrehen.
- Bewegen Sie das Röhrchen, das die Probe enthält, zurück in eine Biosicherheitskabine und fügen Sie langsam 6 ml vorgekühltes Advanced DMEM/F12 hinzu, um Trypsin-ähnliche Protease zu inaktivieren und die Dissoziation der Zellen zu stoppen.
- Drehen Sie den Schlauch (700 x g für 5 min bei 4 °C) und entfernen Sie den Überstand. Achten Sie darauf, das Pellet nicht zu stören.
- Führen Sie die Schritte 4.4 aus. und 4.5.
HINWEIS: Der folgende Abschnitt (Schritte 6-9) beschreibt das Organoid-Harvesting- und Biobanking-Protokoll. Organoide Kulturen müssen frei von Gewebe sein, das während früherer Passagen entfernt wurde. Kulturen sollten auch gesund sein, zumindest groß in der Größe und mittel bis hoch in der Dichte. Bilder von gesunden Kulturen, die für nachgelagerte Anwendungen bereit sind, sind in Abbildung 4 dargestellt. Der Transport stromabwärts mit der Konservierung und Ernte suboptimaler Organoidkulturen kann sich negativ auf die Charakterisierungsergebnisse und die Lebensfähigkeit der Biobank auswirken. Überprüfen Sie das empfohlene Plattenlayout mit 24 Vertiefungen in Abbildung 5.
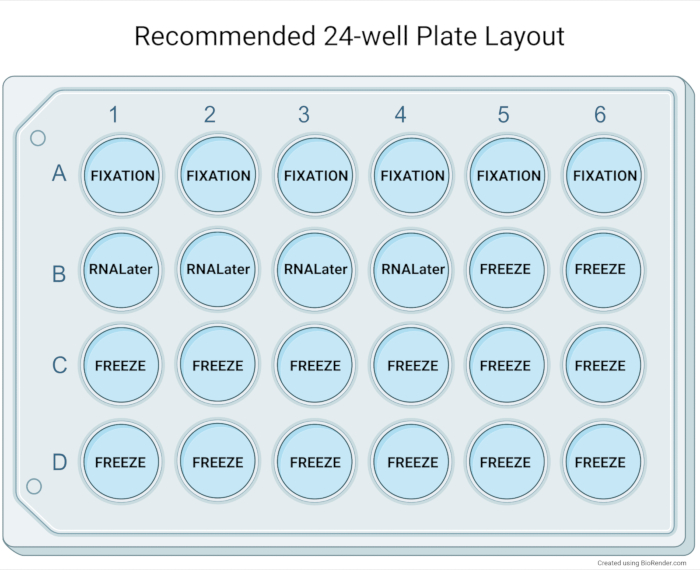
Abbildung 5: Empfohlenes 24-Well-Plattenlayout. Das empfohlene Layout der 24-Well-Platte zur grundlegenden Charakterisierung nach Expansion der Organoidkultur. Die Paraffin-Einbettung von sechs Vertiefungen (mittlere bis große Organoide mittlerer bis hoher Dichte) ermöglicht typischerweise eine hohe Konzentration von Organoiden in einem histologischen Block. Vier Vertiefungen von Organoiden können zu einem Kryotiv mit RNA-Speicherreagenz für nachgeschaltete Anwendungen gepoolt werden. Vierzehn Vertiefungen werden für das Biobanking der Organoidproben verwendet und liefern Material für bis zu sieben kryokonservierte Fläschchen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
6. Fixierung von Organoiden
- Entfernen Sie Medien aus dem Brunnen und achten Sie darauf, die gelöste ECM-Kuppel nicht zu stören.
- 500 μL Formalin-Essigsäure-Alkohol-Lösung, die als Fixiermittel dient (FAA; Zusammensetzung in Tabelle 1).
- Organoide bei Raumtemperatur lagern. Nach 24 h FAA abraten und das Bohrloch mit 70% Ethanol füllen. Umwickeln Sie die Platten mit einem flexiblen Laborfolienband (siehe Materialtabelle), um eine schnelle Verdunstung zu vermeiden. Die Organoide sind nun bereit für die Paraffin-Einbettung. Die Paraffin-Einbettung der Organoidkultur erfolgt in traditionellen Metallgrundformen.
7. RNA-Konservierung
- Entfernen Sie Medien aus den Brunnen und achten Sie darauf, die gelöste ECM-Kuppel nicht zu stören.
- Verwenden Sie 0,5 ml vorgekühltes Advanced DMEM/F12 pro Well, um gelöste ECM-Domes durch wiederholtes Auf- und Abperpipettieren aufzulösen (vermeiden Sie übermäßige Blasen). Überführen Sie die Organoide in ein 15-ml-Zentrifugenröhrchen. Halten Sie die Röhre auf Eis und wenn das Volumen niedriger als 6 ml ist, füllen Sie die Röhre langsam mit Advanced DMEM / F12, um 6 ml Gesamtvolumen zu erreichen.
- Drehen Sie den Schlauch (700 x g für 5 min bei 4 °C) und entfernen Sie den gesamten Überstand. Achten Sie darauf, das Pellet nicht zu stören.
- 100 μL PBS in das Probenröhrchen geben und das Pellet durch sanftes Pipettieren resuspendieren. Übertragen Sie den Inhalt des Probenröhrchens in ein Kryovial.
- Geben Sie 900 μL RNA-Speicherreagenz (siehe Materialtabelle) in das Probenröhrchen und mischen Sie, um alle verbleibenden Organoide zu sammeln. Übertragen Sie diese verbleibenden Organoide in das Kryovial und lagern Sie sie bei -80 ° C (typischerweise sind vier zu einem Kryovial gepoolte Vertiefungen für nachgelagerte Anwendungen, einschließlich qPCR und RNA-Sequenzierung, ausreichend).
HINWEIS: Ein Kryovial produziert typischerweise insgesamt 4.000 ng RNA (gemessen durch Spektralphotometeranalyse).
8. Organoides Biobanking
HINWEIS: Biobanking findet normalerweise 3-4 Tage nach der Passage statt. Die Anzeichen einer Apoptose sollten in der Kultur, um diese Methode durchzuführen, nicht vorhanden sein. In Abbildung 4 finden Sie Informationen zur Referenzierung von Größe und Dichte, die für das Einfrieren geeignet sind. Biobank mittlere bis extragroße Organoide bei mittleren bis sehr hohen Dichten. Ein Notfall-Freeze-Schritt kann befolgt werden, wenn eine organoide Zelllinie besonders selten ist oder die weitere Lebensfähigkeit nicht garantiert ist. Befolgen Sie die gleichen Schritte für normales Organoid-Biobanking (Schritte 8.1 bis 8.4). Das Einfrieren im Notfall erfolgt mit kleineren und weniger dichten Kulturen. Fassen Sie so viele Brunnen von wachsenden Organoiden in einem Kryovital zusammen, indem Sie die Schritte 8.1 bis 8.4 ausführen. Denken Sie daran, dass eine ausreichende Anzahl von Organoiden am Leben erhalten werden muss, um die Kultur zu erweitern (das Einfrieren im Notfall ist einfach ein Backup-Verfahren zum Schutz vor möglichem Kulturverlust durch Kontamination oder andere unerwartete Ereignisse).
- Führen Sie die Schritte 7.1 bis 7.3 aus.
- 1 ml Gefriermedium pro Kryovial (Zusammensetzung in Tabelle 1) in das Probenröhrchen geben und das Pellet durch Auf- und Abpipettieren vorsichtig resuspendieren.
- Übertragen Sie 1 ml der Lösung auf ein Kryo (Verhältnis von zwei Wells/Kryovialen) und halten Sie die Kryoviale auf Eis.
- Die Kryofrüchte aus dem Eis in einen Gefrierbehälter geben (füllen Sie das Reservoir regelmäßig mit Isopropanol auf) und sofort auf -80 °C um. Bewegen Sie die Proben nach 24 h zur Langzeitlagerung in flüssigen Stickstoff (-196 °C).
HINWEIS: Ein alkoholfreier Zellgefrierbehälter kann auch anstelle eines herkömmlichen verwendet werden. Stellen Sie sicher, dass die Proben während des Transports von -80 °C zur Langzeitlagerung von flüssigem Stickstoff nicht auftauen. Wiederholtes Auftauen verringert die Lebensfähigkeit der Zellkultur.
9. Wiederbelebung der Speicherung von flüssigem Stickstoff
HINWEIS: Bei der Entscheidung, eine Organoidlinie aufzutauen, muss eine Teilmenge der wiederbelebten Organoide so schnell wie möglich wieder eingefroren und in der Biobank durch mindestens ein (vorzugsweise mehr) Kryo ersetzt werden.
- Legen Sie solubilisiertes ECM auf Eis, um langsam aufzutauen, legen Sie eine 24-Well-Platte in den Inkubator (37 ° C; 5% CO2-Atmosphäre) und bereiten Sie die erforderlichen Reagenzien wie ein 15-ml-Röhrchen und Advanced DMEM / F12 vor.
- Eine Kryoviale, die eine Organoidprobe enthält, wird aus der Lagerung von flüssigem Stickstoff gewonnen und sofort für 2 min in ein Wärmebad (37 °C) überführt.
- Überführung des Inhalts des Kryotivs in ein 15 ml Zentrifugenröhrchen in einer Biosicherheitswerkbank. Fügen Sie langsam vorgekühltes Advanced DMEM/F12 hinzu, um ein Gesamtvolumen von 6 ml zu erreichen.
- Drehen Sie das Rohr (700 x g für 5 min bei 4 °C). Entfernen Sie den Überstand und achten Sie darauf, das Pellet nicht zu stören.
- Geben Sie 180 μL (30 μL pro Well) gelöstes ECM in das Pellet und plattieren Sie diese Suspension in der vorgewärmten 24-Well-Platte. Ein Kryovial kann auf sechs Vertiefungen einer 24-Well-Platte plattiert werden.
- Legen Sie die 24-Well-Platte für ~30 min in den Inkubator (37 °C; 5% CO2-Atmosphäre ) und fügen Sie CMGF+ R/G hinzu (für Darmorganoide in 24 bis 48 h auf CMGF+ umstellen).
HINWEIS: Wenn eine Probe plattiert ist und in der 24-Well-Platte wächst, muss sie sich vor dem Passieren mindestens 2 Tage lang erholen können, um die Lebensfähigkeit zu erhöhen.
Ergebnisse
Das Organoidprotokoll des Hundes erzeugt typischerweise ~ 50.000 bis ~ 150.000 Darm- oder Leberzellen pro Vertiefung einer 24-Well-Platte. Repräsentative Organoide sind in Abbildung 6 zu sehen.
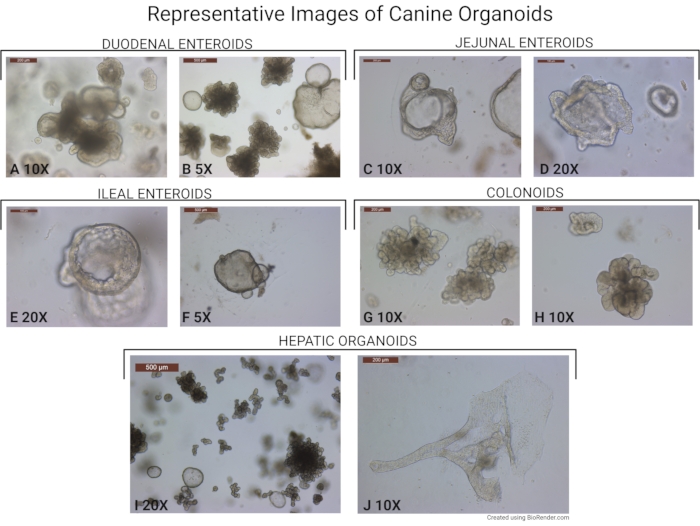
Abbildung 6: Repräsentative Bilder von Hundeorganoiden. Es werden Bilder von Organoiden dargestellt, die mit diesem Protokoll isoliert wurden. (A,B) Darmorganoide, die aus dem Zwölffingerdarm gewonnen werden (aufgenommen bei 10-facher und 5-facher objektiver Vergrößerung). Beachten Sie das Vorhandensein älterer Knospenorganoide und jüngerer Sphäroide. (C,D) Hundeenteroide aus dem unteren Teil des Jejunums (aufgenommen bei 10-facher und 20-facher objektiver Vergrößerung). (E,F) Ileale Enteroide (aufgenommen bei 20-facher und 5-facher objektiver Vergrößerung) und (G, H) -Kolonoiden (bei 10-facher objektiver Vergrößerung). (I) Ein repräsentatives Bild von Leberorganoiden, aufgenommen mit 20-facher objektiver Vergrößerung. Die meisten Organoide sind in ihrer knospenden Form. Jüngere Lebersphäroide sind ebenfalls auf dem Bild zu sehen. (J) Repräsentatives Bild, das ein seltenes hepatisches Organoid zeigt, das eine kanalartige Struktur bildet (aufgenommen bei 10-facher objektiver Vergrößerung). Der Maßstabsbalken (500 μm) befindet sich in der oberen linken Ecke jedes Bildes. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Enteroide und Kolonoide, die mit diesem Protokoll abgeleitet wurden, wurden zuvor von Chandra et al. im Jahr 201912 charakterisiert. Canine Darmorganoide bestehen aus einer regelmäßigen zellulären Population des Darmepithels. Unter Verwendung der RNA-in-situ-Hybridisierung, der Expression von Stammzell-Biomarkern (Leucine-Rich Repeat Containing G Protein-Coupled Receptor 5 - LGR5 und SRY-Box Transcription Factor 9 - SOX9), Paneth-Zell-Biomarker (Ephrin-Typ-B-Rezeptor 2 - EPHB2), absorptiven Epithelzellmarkern (alkalische Phosphatase - ALP) und enteroendokrinen Markern (Neurogenin-3 - Neuro G3)12 wurde bestätigt. Die Alcian Blue-Färbung wurde auf in Paraffin eingebetteten Objektträgern durchgeführt, um das Vorhandensein von Kelchzellen zu bestätigen. Darüber hinaus wurden funktionelle Assays wie optisches metabolisches Bildgebungsverfahren (OMI) oder Mukoviszidose-Transmembran-Leitwertregulator (CFTR) durchgeführt, um die metabolische Aktivität der Organoide zu bestätigen. Hundeorganoide von Hunden, bei denen entzündliche Darmerkrankungen, gastrointestinale Stromatumoren (GIST) oder ein kolorektales Adenokarzinom diagnostiziert wurden, wurden ebenfalls mit diesem Protokoll isoliert12.
Nach der Isolation von Stammzellen beginnen hepatische Hundeorganoide ihren Lebenszyklus als expandierende Sphäroide, und nach ~ 7 Tagen verwandeln sie sich in knospende und differenzierende Organoide. Hundehepatische Sphäroide, die nach diesem Protokoll isoliert und kultiviert wurden, wurden gemessen, um ihr Wachstum zu quantifizieren und den idealen Zeitpunkt für die Passage zu bestimmen. Sphäroide, die aus laparoskopischen Leberbiopsien gesunder erwachsener Hunde (n = 7) stammen, wurden während ihrer ersten 7 Tage der Kultur gemessen. Es wurden repräsentative Bilder aufgenommen, und der Längsradius (a) und der diagonale (b) der Sphäroide (n = 845) wurden in der gesamten Kultur gemessen. Das Volumen (V), die Oberfläche (P), die 2D-Ellipsenfläche (A) und der Umfang (C) der Sphäroide wurden berechnet. Die Berechnungen und Ergebnisse des Experiments sind in Abbildung 7 zusammengefasst. 2D-Ellipsenfläche und -umfang wurden verwendet, um die Gesundheit der Organoidkultur mittels Lichtmikroskopie zu beurteilen. Diese Werte können als Leitfaden für Entscheidungen zur Kulturpflege dienen.
Kurz gesagt, Sphäroide dehnten sich schnell in Volumen, Oberfläche, 2D-Ellipsenfläche und Umfang aus. Die Messdaten der sieben Beagles wurden für die folgenden Berechnungen gemittelt. Das Volumen stieg von Tag 2 auf 3 um 479% (±6%). Gleichzeitig nahmen die Sphäroidoberfläche und die 2D-Ellipsenfläche um 211 % (±208 %) bzw. 209 % (±198 %) zu. Der 2D-Ellipsenumfang stieg von Tag 2 auf 3 um 73% (±57%). Die Zunahme des Gesamtvolumens der Leberorganoide von den Tagen 2-7 war mehr als das 365-fache, die Oberfläche und die 2D-Ellipsenfläche stiegen um das 49-fache und der 2D-Ellipsenumfang um das Sechsfache.
Als nächstes wurden Sphäroide, die aus zwei erwachsenen Hundeproben gewonnen wurden, nach der Passage weiter gezüchtet und jeden Tag (Tag 2-7) für die RNA-in-situ-Hybridisierung (RNA ISH) gesammelt. Canine Sonden wurden entworfen (Sondenliste wird als ergänzende Tabelle 2 zur Verfügung gestellt), und die mRNA-Expression wurde für Stammzellmarker (LGR5), Marker spezifisch für Cholangiozyten (Cytokeratin 7 - KRT-7 und Aquaporin 1 - AQP1) sowie Hepatozytenmarker (Gabelkopfkastenprotein A1 - FOXA1; und Cytochrom P450 3A12 - CYP3A12) bewertet. Die Ausprägung der Marker wurde semi-quantitativ bewertet (repräsentative Bilder in Abbildung 8). Sphäroide exprimierten bevorzugt den Cholangiozytenmarker KRT-7 im Bereich von 1% bis 26% in der Signalfläche / Gesamtfläche der Zellen. AQP1 wurde in den Organoidproben nicht exprimiert, wohl weil sein Vorhandensein in Leberproben von Hunden spärlich ist. Die Stammzellmarkerexpression (LGR5) lag zwischen 0,17% und 0,78%, während Hepatozytenmarker in geringerem Maße mit 0,05%-0,34% für FOXA1 und 0,03%-0,28% für CYP3A12 exprimiert wurden.
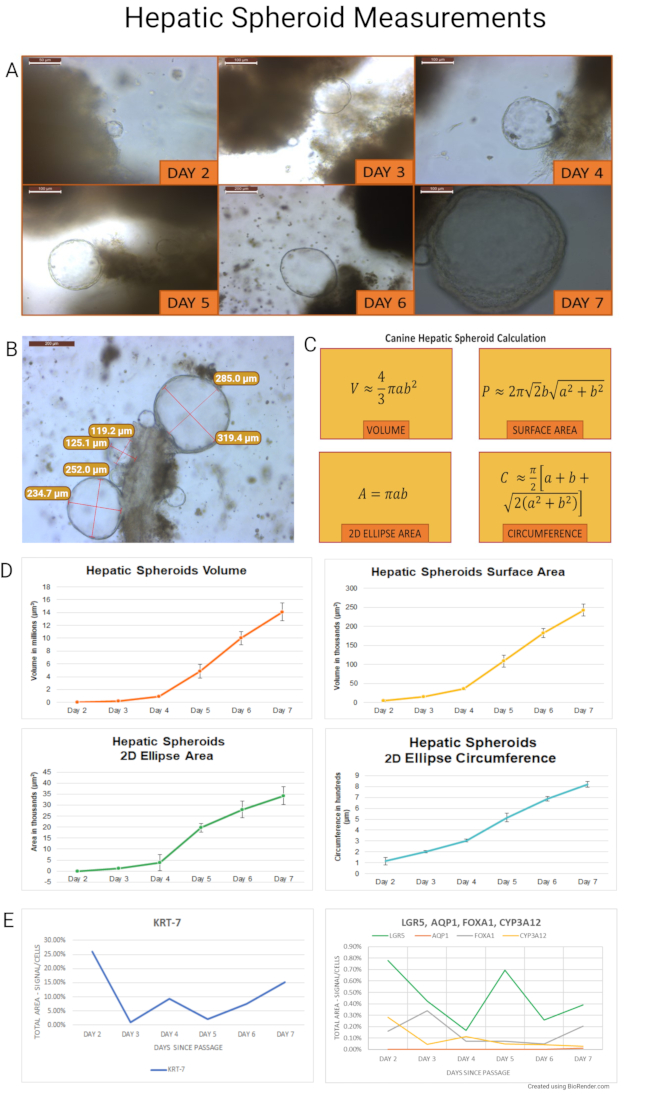
Abbildung 7: Lebersphäroidmessungen. (A) Das Wachstum der hepatischen Sphäroide wurde jeden Tag von Kulturen vom 2. bis 7. Tag beobachtet. Sphäroide bildeten sich zuerst an Tag 2, und die letzten Sphäroide begannen am Tag 7 mit dem Knospenprozess. Ein nachfolgendes Experiment verwendete zwei Hundeorganoidlinien nach der Passage, um täglich Sphäroide für die Paraffineinbettung zu ernten, um RNA ISH durchzuführen (Tag 2 Bild wurde bei 40x, Tag 6 Bild bei 10x aufgenommen und der Rest der Bilder wurde mit 20-facher Vergrößerung aufgenommen). (B) Ein hepatischer Sphäroidcluster ist 4 Tage nach der Isolierung an einen Gewebebrocken gebunden, der in ein solubilisiertes ECM eingebettet ist. Längs- und Diagonalradien der Sphäroide wurden gemessen (Bild aufgenommen bei 10x). Panel (C) zeigt die Formel, die für Berechnungen zur Ableitung von Volumen (V), Oberfläche (P), 2D-Ellipsenfläche (A) und Umfang (C) verwendet wird. Für diese Berechnungen wurde angenommen, dass hundeförmige Lebersphäroide ideale Sphäroide sind. Die Ergebnisse der Messungen des Volumens, der Oberfläche, der 2D-Ellipsenfläche und des 2D-Ellipsenumfangs der Lebersphäroide für einzelne Wachstumstage sind in Panel (D) dargestellt. Fehlerbalken stellen den Standardfehler des Mittelwerts (SEM) dar. (E) Die mRNA-Expression von KRT-7, LGR5, FOXA1 und CYP3A12 wurde in Proben von hundeförmigen Lebersphäroiden nach der Passage von Tag 2 bis Tag 7 gemessen. AQP1 wurde in diesen Proben nicht exprimiert. Ein Skalenbalken (5x: 500 μm; 10x: 200 μm; 20x: 100 μm; 40x: 50 μm) ist oben links in jedem Bild vorhanden. Objektive Vergrößerung festgestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Organoide würden während des Passaging-Prozesses nach dieser standardisierten Technik selten nicht zerbrechen. Wenn keine Dissoziation auftritt, können die Durchgangszeiten angepasst werden, um einen optimalen Zerfall des Zellhaufens zu erreichen. Eine längere Exposition gegenüber trypsinartiger Protease kann sich jedoch negativ auf das Wachstum der Organoide auswirken. Hepatische Organoide wurden in einem anschließenden Experiment verwendet, um die optimale Dissoziationszeit zu untersuchen und eine geeignete Passaging-Methode zu etablieren. Kurz gesagt, hepatische Organoide von zwei gesunden Hunden (jeweils 6 gut repliziert) wurden mit Trypsin-ähnlicher Protease für 12 min und 24 min durchgelassen. Die Proben wurden alle 6 Minuten gerührt. Am Ende des Dissoziationszeitpunkts wurden 6 ml eiskaltes Advanced DMEM/F12 in die Lösung gegeben und Proben gesponnen (700 x g für 5 min bei 4 °C). Der Überstand (Advanced DMEM/F12 mit verdünnter trypsinartiger Protease) wurde entfernt und die Pellets wurden wie oben beschrieben in solubilisiertes ECM eingebettet (Schritte 4.4-4.5). Nach 12 h Kultur in solubilisiertem ECM und CMGF+ R/G wurden in beiden Proben Unterschiede beobachtet. Eine 12-minütige Inkubation mit Trypsin-ähnlicher Protease hemmte das Organoidwachstum nicht. Das Wachstum von Organoiden wurde jedoch durch eine 24-minütige Inkubation negativ beeinflusst (siehe Abbildung 9).

Abbildung 9: Hunde-Leberorganoid-Passage-Experiment. Repräsentative Bilder von Organoiden, die von zwei Hunden (D_1 und D_2) abgeleitet wurden, wurden mit der Trypsin-ähnlichen Protease-Inkubationsmethode für 12 min oder 24 min durchlaufen. Kontrollproben wurden 10 min lang mit Trypsin-ähnlicher Protease durchgelassen. Ein Maßstabsbalken (μm) befindet sich oben links in jedem Bild und stellt 500 μm (5-fache Objektivvergrößerung) dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Als nächstes wurde die Untersuchung der Überlebensfähigkeit von Hunde-Leberorganoiden, die aus diesem Protokoll abgeleitet wurden, in einer ungünstigen Umgebung (Entzug der strukturellen Unterstützung und Ernährung) durchgeführt. Die Untersuchung konzentrierte sich auf die Bestimmung des Volumens der Organoidmedien und der Basalmatrix, die für das erfolgreiche Wachstum und Überleben des Leberorganoids benötigt werden, sowie auf die Feststellung des Einflusses solcher Bedingungen auf die Organoidkultur. Die Überlebensfähigkeit wurde in einer 96-Well-Platte mit einer begrenzten Anzahl von Organoiden gemessen. Organoide von zwei Hunden wurden wie oben beschrieben durchgelassen und (12 Replikate) in verschiedene Volumina von solubilisierter ECM (10 μL oder 15 μL) eingebettet. Die Zellen wurden in einer Konzentration von 400 Zellen/10 μL Well und 600 Cells/15 μL Well plattiert, was 40.000 Cells/ml entspricht. Zwei Medientypen (CMGF+ oder CMGF+ R/G) wurden in unterschiedlichen Volumina (25 μL, 30 μL oder 35 μL) hinzugefügt. Das Medium wurde nie gewechselt und es wurden keine Wartungsverfahren durchgeführt. Die Überlebensfähigkeit der Organoide wurde täglich überwacht. Der organoide Tod wurde als die Auflösung von mehr als 50% der organoiden Strukturen definiert. Die Überlebensrate von Organoiden unter diesen Bedingungen reichte von 12,9 (±2,3) Tagen bis 18 (±1,5) Tagen, und die Ergebnisse sind in Tabelle 3 zusammengefasst. Die beiden Proben, die am längsten überlebten, waren Organoide, die von Hunden stammten, die in 15 μL solubilisierte ECM und 30 μL CMGF+-Medien eingebettet waren. Beide Proben wurden nach 18 Tagen Deprivation in solubilisierte ECM (30 μL) und frische Medien (500 μL) in eine Standard-24-Well-Platte eingebettet, um sicherzustellen, dass eine Organoidexpansion weiterhin möglich war (Abbildung 10).
| Medientyp | Mittelwert (überlebte Tage) | Median | CV% | Mittelwert (überlebte Tage) | Median | CV% | Mittelwert (überlebte Tage) | Median | CV% | Mittelwert (überlebte Tage) | Median | CV% | |
| Medien (μL) | 30 | 25 | 35 | 30 | |||||||||
| ECM (μL) | 10 | 10 | 10 | 15 | |||||||||
| D_1 | CMGF+ R/G | 12.50 | 13 | 11.57 | 12.83 | 13 | 4.50 | 11.83 | 11.5 | 12.91 | 12.08 | 13 | 12.46 |
| CMGF+ | 17.08 | 17 | 16.26 | 18.50 | 19 | 4.89 | 18.42 | 19 | 14.54 | 17.82 | 19 | 8.99 | |
| D_2 | CMGF+ R/G | 13.67 | 14 | 13.36 | 13.00 | 13 | 12.70 | 14.00 | 14.5 | 17.23 | 13.08 | 13 | 8.90 |
| CMGF+ | 15.50 | 15 | 18.56 | 17.50 | 18 | 10.48 | 17.50 | 19 | 20.89 | 17.00 | 17 | 14.41 | |
| GESAMT | CMGF+ R/G | 13.08 | 13 | 13.13 | 12.92 | 13 | 9.39 | 12.92 | 13 | 17.52 | 12.58 | 13 | 11.22 |
| CMGF+ | 16.29 | 16.5 | 17.69 | 18.00 | 18.5 | 8.35 | 17.96 | 19 | 17.65 | 17.43 | 17 | 11.70 | |
| Tod = mehr als 50% der Organoidmasse sind nicht lebensfähig | |||||||||||||
Tabelle 3: Ergebnisse des Überlebensfähigkeitsexperiments. Das Experiment basierte auf dem Entzug der strukturellen Unterstützung oder Ernährung von zwei Organoidkulturen. Die Ergebnisse umfassen den Mittelwert, den Median und die Standardabweichung (CV%) der individuellen Konzentrationen von gelöstem ECM und Medien bei einzelnen Hunden.
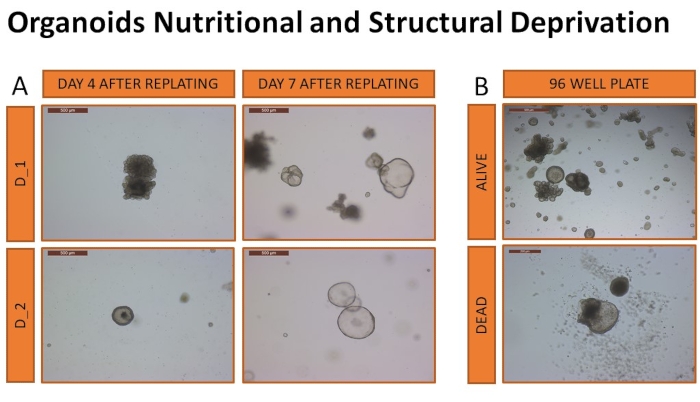
Abbildung 10: Organoide ernährungsphysiologische und strukturelle Entbehrungen. Organoide wurden in 24-Well-Platten neu plattiert, um die Fähigkeit zur Expansion nach der Deprivation zu bestätigen (A). Repräsentative Bilder von Tag 4 und Tag 7 nach der Neubeschichtung zeigen die Ausdehnung der Organoide und bestätigen die Fähigkeit, lebensfähige Organoide visuell zu identifizieren (Bilder werden mit 5-facher objektiver Vergrößerung aufgenommen). Repräsentative Bilder von Organoiden, die als lebendig oder tot gelten, sind in (B) zu sehen. Die Bilder werden mit 5-facher Objektivvergrößerung aufgenommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 8: Hepatische Sphäroide RNA in situ Hybridisierung repräsentative Bilder. Repräsentative Bilder von LGR5-, KRT7-, FOXA1- und CYP3A12-Markern wurden bei 60-facher objektiver Vergrößerung der Proben von Tag 2-7 nach der Passage aufgenommen. Positive mRNA-Moleküle färben sich rot. AQP1 wurde in den Proben nicht exprimiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Zusammensetzung unvollständiger Chelatisierungslösung (ICS) | Endkonzentration |
| 500 mL H2O | NA |
| 2,49 g Na2HPO4-2H2O | 4,98 mg/ml |
| 2,7 g KH2PO4 | 5,4 mg/ml |
| 14 g NaCl | 28 mg/ml |
| 0,3 g KCl | 0,6 mg/ml |
| 37,5 g Saccharose | 75 mg/ml |
| 25 g D-Sorbit | 50 mg/ml |
| Komplette Chelatlösung (CCS) Zusammensetzung | V/V % oder Endkonzentration |
| Unvollständige Chelatlösung | 20% |
| Steriles H2O | 80% |
| DVB-T | 520 μM |
| Stift Streptokokken | Stift: 196 U/ml; Streptokokken 196 μg/ml |
| Zusammensetzung der organoiden Medien | Endkonzentration |
| Erweitertes DMEM/F12 | NA |
| FBS | 8% |
| Glutamax | 2 mM |
| HEPES | 10 mM |
| Primocin | 100 μg/ml |
| B27 Zuschlag | 1x |
| N2 Ergänzung | 1x |
| N-Acetyl-L-Cystein | 1 mM |
| Murine EGF | 50 ng/ml |
| Murine Noggin | 100 ng/ml |
| Mensch R-Spondin-1 | 500 ng/ml |
| Murine Wnt-3a | 100 ng/ml |
| [Leu15]-Gastrin I Mensch | 10 nM |
| Nicotinamid | 10 mM |
| A-83-01 | 500 nM |
| SB202190 (P38-Hemmer) | 10 μM |
| TMS (Trimethoprimsulfamethoxazol) | 10 μg/ml |
| Zusätzliche Komponenten | Endkonzentration |
| ROCK-Inhibitor (Y-27632) | 10 μM |
| Stemolecule CHIR99021 (GSK3β) | 2,5 μM |
| Zusammensetzung der Gefriermedien | V/V Prozent |
| Organoide Medien und ROCK-Inhibitor | 50% |
| FBS | 40% |
| Dimethylsulfoxid (DMSO) | 10% |
| FAA-Zusammensetzung | V/V Prozent |
| Ethanol (100%) | 50% |
| Essigsäure, Gletschersäure | 5% |
| Formaldehyd (37%) | 10% |
| Destilliertes Wasser | 35% |
Tabelle 1: Zusammensetzung von Lösungen und Medien. Eine Liste der Komponenten und Konzentrationen unvollständiger und vollständiger Chelatlösungen, CMGF+ (organoide Medien), Gefriermedien und FAA.
Ergänzende Tabelle 1: Organoide Pflegevorlage. Diese Vorlage ermöglicht eine genaue und reproduzierbare Organoid-Notiz für jeden Tag. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Tabelle 2: RNA-in-situ-Hybridisierungssonden . Liste der Sonden, die von einem Hersteller der Technologie zur Durchführung der RNA-In-situ-Hybridisierungstechnik speziell für Hunde-mRNA-Targets entwickelt wurden. Informationen über die Bedeutung einzelner Markierungen, den Namen einer Sonde, ihre Referenznummer und Zielregion werden aufgelistet. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Derzeit fehlen standardisierte Protokolle für die Isolierung und Aufrechterhaltung von Leber- und Darmorganoiden bei Hunden. Die Festlegung von Standardarbeitsanweisungen für Organoidkulturen ist gerechtfertigt, damit dieses Modell in verschiedenen Laborumgebungen anwendbar ist. Insbesondere die Bereitstellung standardisierter Betriebsprotokolle für die Kultur dieser kaninen Organoidmodelle ist der Schlüssel zur Charakterisierung des normalen Wachstums von Organoiden während der Kultur und des Passagings, um optimale Zeitpunkte für Expansion und Wartung abzuleiten. Canine Darmorganoide, die mit dem Protokoll kultiviert wurden, wurden zuvor von Chandra et al.12 charakterisiert.
Einer der kritischsten Schritte des Protokolls ist die Übertragung von Organoiden. Der optimale Zeitpunkt für die erste Passage von Lebersphäroiden wurde auf der Grundlage der Lebersphäroidmessungen am Tag 7 nach der Isolierung bestimmt. Das maximale Volumen der Sphäroide wurde am Tag 7 erreicht, und gleichzeitig begannen die Sphäroide zu knospen und bildeten hepatische Organoide. Der Anstieg des gesamten Organoidvolumens von Tag 2-7 nach der Isolierung betrug mehr als das 365-fache, was darauf hindeutet, dass die optimale Durchgangszeit länger ist als die der Organoidkultur des Hundedarms. Nach 7 Tagen in Kultur wurden keine groben Anzeichen einer zellulären Apoptose im Lebersphäroid beobachtet, auch ohne Reinigung oder Verlauf (Abbildung 7). Das Passieren der Darm- und Leberorganoide kann eine Herausforderung sein, da das Verfahren zum Verlust von Zellen und einer veränderten Lebensfähigkeit führen kann. Die Ergebnisse deuten darauf hin, dass eine längere Inkubation von Leberorganoiden mit trypsinähnlicher Protease (bis zu 12 min) die Subkultur nicht negativ beeinflusst. Die Inkubation der Organoide in trypsinartiger Protease für länger als 24 min kann der nachfolgenden Subkultur der Organoide abträglich sein.
Im Falle eines suboptimalen Bruchs in den Zellclustern mit der Organoidpassage könnte eine mechanische Dissoziation anstelle einer längeren Inkubation mit trypsinartiger Protease vorteilhafter sein. Wenn Probleme mit der ordnungsgemäßen Dissoziation der Organoide auftreten, kann versucht werden, die Durchgangsausbeute kurz zu wirbeln, um die Durchgangsausbeute zu erhöhen. Auf der anderen Seite hat das Vortexing das Potenzial, eine Kultur zu ruinieren und Zellen zu schädigen, so dass es nur verwendet werden sollte, wenn andere Verfahren wiederholt fehlgeschlagen sind. Das Aufbrechen hepatischer Organoide in einzelne Zellen senkt die Wachstumsrate der Organoide, während das Aufbrechen in Zellcluster ihre Lebensfähigkeit erheblich verbessern kann. Als Inkubationszeit für das Organoidprotokoll wurden zehn Minuten gewählt. Ein 12-minütiger Inkubationszeitpunkt wurde im Vergleich zu einer 24-minütigen Inkubation im Trypsin-ähnlichen Protease-Experiment als nicht zytotoxisch eingestuft.
Das Überlebensfähigkeitsexperiment bestätigte, dass hepatische Organoide von Hunden unter ungünstigen Bedingungen (strukturelle und ernährungsphysiologische Erschöpfung) bis zu 19,5 Tage überleben können. Organoide, die diese Bedingungen am längsten überlebten, wurden mit CMGF+-Medien kultiviert. Diese Beobachtung könnte durch das langsamere Wachstum von Leberorganoiden in Medien verursacht worden sein, die nicht mit Rock-Inhibitor und GSK3β ergänzt wurden. Organoide Kulturen mit CMGF+ R/G wuchsen schneller und haben ihre Ressourcen möglicherweise schneller erschöpft. Dieses Experiment eröffnet Möglichkeiten der Miniaturisierung der Organoidkultur bei Hunden, um eine Hochdurchsatz-Systemumwandlung zu erreichen. Eine solche Technologie zeigt das Potenzial, die Arzneimittelforschung oder toxikologische Studien zu wesentlich reduzierten Kosten zu erleichtern.
Einige häufige Probleme, die während der Aufrechterhaltung der Organoidkultur bei Hunden auftreten, sind eine unsachgemäße Probenerstarrung beim Plattieren, eine Kulturkontamination und die Bestimmung der richtigen Dichte und Größe der Organoide. Wenn sich das gelöste ECM während der Beschichtung vorzeitig verfestigt, legen Sie es sofort für 10 min auf Eis. Wenn solubilisiertes ECM keine kuppelartigen Strukturen bildet, ist es wahrscheinlich, dass nicht genügend Medien aus der Probe entfernt wurden. Wenn dies der Fall ist, verdünnen Sie die Probe mit einem stärker gelösten ECM, bis sich Kuppeln bilden.
Wenn eine pilzliche oder bakterielle Kontamination in einer ganzen Platte gefunden wird (siehe Abbildung 4), besteht die beste Lösung darin, die Platte zu entsorgen. Die Behandlung mit antimykotischen oder antibiotischen Medikamenten kann versucht werden, aber der Erfolg eines solchen Versuchs ist extrem gering. Wenn ein einzelnes Bohrloch in einer Platte kontaminiert ist, können lebensfähige und nicht betroffene Bohrlöcher (Schritte 4.1 bis 4.5) zu einer neuen Platte gereinigt und genau überwacht werden. Wenn die Probe bereits im Notfall eingefroren wurde, ist es ratsam, die gesamte Probe zu entsorgen, da das Auftauen der Probe den Inkubator einem zusätzlichen Kontaminationsrisiko aussetzt.
Eine gesunde Organoidkultur sollte mindestens in der Kategorie mittlerer Größe und mittlerer Dichte oder größer sein. Eine optimale Dichte ist entscheidend für das Wachstum der Organoidkultur. Eine geringere Dichte muss korrigiert werden, indem die Organoide auf mittlere Dichte gereinigt werden. Wenn die Situation der extremen Dichte auftritt (Überfüllung), sollten die Organoide auf weitere Brunnen ausgedehnt werden. Grobe Anzeichen einer zellulären Apoptose begleiten oft sowohl die Überfüllung als auch die geringe Dichte der Organoidkultur. Wenn diese Probleme nicht rechtzeitig behoben werden, wird die gesamte Organoidkultur innerhalb weniger Tage apoptotisch. Wenn Organoide eine besonders große Größe oder eine sehr hohe Dichte erreichen, sollte die Kultur für ein Experiment, Einfrieren oder Fixieren verwendet werden.
Das Organoidmedium enthält derzeit 17 Komponenten, und die Zugabe von Wachstumsfaktoren, die für die Erhaltung und Expansion von Organoiden benötigt werden, kann daher teuer sein. Dieses Problem kann durch das Züchten von 2D-Zellkulturen gelöst werden, die die Wachstumsfaktoren synthetisieren, um konditioniertes CMGF+ zu erzeugen. Zellkultur L-WRN produziert Wnt-3a, R-Spondin-3 und Noggin Wachstumsfaktoren37. Die Zellkolonie verwendet 90% DMEM/F12 und 10% FBS Kulturmedien. Wenn die Kultur 90 Prozent Konfluenz erreicht, werden Medien 1 Woche lang jeden Tag geerntet. Die geernteten Medien werden dann mit 2x CMGF+ (ohne diese Wachstumsfaktoren) gemischt. Während 2D-Kulturen die erforderlichen Wachstumsfaktoren zu einem Bruchteil der Kosten erzeugen können, muss mit der zusätzlichen Zeit und Vorbereitung zur Herstellung der Medien gerechnet werden. Die Konzentrationen von Wachstumsfaktoren zwischen konditionierten Medienchargen können ebenfalls unterschiedlich sein37,38.
Aus adulten Stammzellen gewonnene Organoidkulturen von Hunden sind ein einzigartiges biomedizinisches Modell, das dazu beitragen kann, die Ziele der One Health Initiative39 zu erreichen. Die Organoidtechnologie kann in vielen grundlegenden und biomedizinischen Forschungsbereichen eingesetzt werden, von der Entwicklungsbiologie, Pathophysiologie, Wirkstoffforschung und -prüfung, Toxikologie bis hin zur Erforschung von Infektionskrankheiten und regenerativer Medizin40. Translationale und umgekehrte translationale Forschung sind beide Bereiche, in denen Hundeorganoide anwendbar sind15. Hunde werden seit Jahrhunderten in translationalen experimentellen Umgebungen eingesetzt, und ihr Status als Haustier hat auch ihre Position als eine der am meisten erforschten Arten in der Veterinärmedizin erleichtert.
Zusammenfassend lässt sich sagen, dass dieses Manuskript standardisierte Betriebsprotokolle für die Isolierung, Wartung, Ernte und das Biobanking von Leber- und Darmorganoiden bei Hunden bereitstellt, um die Anwendung dieses Modells in verschiedenen biomedizinischen Bereichen zu erleichtern. Dieses Modell eignet sich in einzigartiger Weise, um die reverse translationale Forschung als Instrument der One Health Initiative zur Förderung des inter- und intradisziplinären Wissensaustauschs zu fördern.
Offenlegungen
K. Allenspach ist Mitbegründer von LifEngine Animal Health und 3D Health Solutions. Sie ist als Beraterin für Ceva Animal Health, Bioiberica, LifeDiagnostics, Antech Diagnostics, Deerland Probiotics und Mars tätig. J. P. Mochel ist Mitbegründer von LifEngine Animal Health und 3D Health Solutions. Dr. Mochel ist als Berater für Ceva Animal Health und Ethos Animal Health tätig. Andere Autoren haben keine Interessenkonflikte zu erklären.
Danksagungen
Die Autoren möchten den Mitarbeitern des Veterinary Diagnostic Laboratory der Iowa State University, nämlich Haley M. Lambert, Emily Rahe, Rosalyn M. Branaman, Victoria J. Green und Jennifer M. Groeltz-Thrush, für die rechtzeitige Verarbeitung der zur Verfügung gestellten Proben danken. Die Autoren möchten die Unterstützung des Faculty Startup, des ISU VPR Miller Award, des ISU VPR Miller Award und des NSF SBIR Sub-Award für ISU # 1912948 anerkennen.
Materialien
| Name | Company | Catalog Number | Comments |
| Chelating solution | |||
| D-Sorbitol | Fisher Chemical | BP439-500 | |
| DTT | Promega | V3151 | |
| KCl | Fisher Chemical | P217-500 | |
| KH2PO4 | Sigma | P5655-100G | |
| Na2HPO4-2H2O | Sigma | S5136-100G | |
| NaCl | Fisher Chemical | S271-500 | |
| Pen Strep | Gibco | 15140-122 | |
| Sucrose | Fisher Chemical | S5-500 | |
| Organoid media | |||
| [Leu15]-Gastrin I human | Sigma | G9145-.5MG | |
| A-83-01 | PeproTech | 9094360 | |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| B27 supplement | Gibco | 17504-044 | |
| FBS | Corning | 35-010-CV | |
| Glutamax | Gibco | 35050-061 | |
| HEPES | VWR Life Science | J848-500ML | |
| Human R-Spondin-1 | PeproTech | 120-38-500UG | |
| Murine EGF | PeproTech | 315-09-1MG | |
| Murine Noggin | PeproTech | 250-38-250UG | |
| Murine Wnt-3a | PeproTech | 315-20-10UG | |
| N2 supplement | Gibco | 17502-048 | |
| N-Acetyl-L-cysteine | Sigma | A9165-25G | |
| Nicotinamide | Sigma | N0636-100G | |
| Primocin | InvivoGen | ant-pm-1 | |
| ROCK inhibitor (Y-27632) | EMD Millipore Corp. | SCM 075 | |
| SB202190 (P38 inhibitor) | Sigma | S7067-25MG | |
| Stemolecule CHIR99021 (GSK3β) | Reprocell | 04-0004-base | |
| Trimethoprim | Sigma | T7883-5G | |
| Sulfamethoxazole | Sigma-Aldrich | S7507-10G | |
| Reagents | |||
| Acetic Acid, Glacial | Fisher Chemical | A38-500 | |
| Dimethyl Sulfoxide (DMSO) | Fisher Chemicals | D128-500 | |
| EDTA, pH 8.0, 0.5 M | Invitrogen | 15575-038 | |
| Formaldehyde (37%) | Fisher Chemical | F79P-4 | |
| Glutaraldehyde solution | Sigma | G5882 | |
| Matrigel Matrix For Organoid Culture | Corning | 356255 | Extracellular Membrane Matrix |
| Paraformaldehyde, 97% | Alfa Aesar | A11313 | |
| PBS, 1X (Phosphate-Buffered Saline) | Corning | 21-040-CM | |
| PBS, 1X (Phosphate-Buffered Saline) | Corning | 21-040-CM | |
| RNAlater Soln. | Invitrogen | AM7021 | RNA Storage Reagent |
| TrypLE Express | Gibco | 12604-021 | Trypsin-like Protease |
| Other | |||
| 6 Well Cell Culture Plate | Corning | 3516 | |
| ACD Hybez II Hybridization System | ACD a biotechne brand | 321710 | |
| Centrifuge Tube, 15 mL | Corning | 430766 | |
| CoolCell LX | Corning | BCS-405MC | |
| Cryogenic Vials | Corning | 430488 | |
| Disposable Centrifuge Tube (50 mL) | Fisherbrand | 05-539-13 | |
| GyroMini Nutating mixer (Rocker) | Labnet | S0500-230V-EU | |
| Heat Bath | Lab-Line Instruments | 3000 | |
| Mr. Frosty Freezing Container | ThermoFisher Scientific | 5100-0001 | |
| NanoDrop 2000 | ThermoFisher Scientific | ND2000CLAPTOP | SpectrophotometerAnalysis |
| Panasonic incubator | Panasonic | MCO-170ML-PA | |
| Parafilm M Wrapping Film | Bemis Company Inc | PM996/EMD | Laboratory Flexible Film Tape |
| Protected Disposable Scalpels | Bard-Parker | 239844 | |
| RNAscope 2.5 HD Assay – RED | ACD a biotechne brand | 322350 | |
| RNAscope H2O2 & Protease Plus Reagents | ACD a biotechne brand | 322330 | |
| RNAscope Target Retrieval Reagents | ACD a biotechne brand | 322000 | |
| RNAscope Wash Buffer Reagents | ACD a biotechne brand | 310091 | |
| Tissue Culture Dish | Dot Scientific | 6676621 | |
| Tissue Culture Plate 24 wells | Fisherbrand | FB012929 |
Referenzen
- Hickman, D. L., Johnson, J., Vemulapalli, T. H., Crisler, J. R., Shepherd, R. Commonly used animal models. Principles of Animal Research for Graduate and Undergraduate Students. , 117-175 (2017).
- De Jong, M., Maina, T. Of mice and humans: Are they the same? - Implications in cancer translational research. Journal of Nuclear Medicine. 51 (4), 501-504 (2010).
- Cannarozzi, G., Schneider, A., Gonnet, G. A phylogenomic study of human, dog, and mouse. PLoS Computational Biology. 3 (1), 0009-0014 (2007).
- Jacob, J. A. Researchers turn to canine clinical trials to advance cancer therapies. JAMA - Journal of the American Medical Association. 315 (15), 1550-1552 (2016).
- Ziegler, A., Gonzalez, L., Blikslager, A. Large animal models: The key to translational discovery in digestive disease research. Cellular and Molecular Gastroenterology and Hepatology. 2 (6), 716-724 (2016).
- Swanson, K. S., et al. Phylogenetic and gene-centric metagenomics of the canine intestinal microbiome reveals similarities with humans and mice. ISME Journal. 5 (4), 639-649 (2011).
- Coelho, L. P., et al. Similarity of the dog and human gut microbiomes in gene content and response to diet. Microbiome. 6 (1), 72 (2018).
- Nguyen, T. L. A., Vieira-Silva, S., Liston, A., Raes, J. How informative is the mouse for human gut microbiota research. DMM Disease Models and Mechanisms. 8 (1), 1-16 (2015).
- Bontempo, V. Nutrition and health of dogs and cats: Evolution of petfood. Veterinary Research Communications. 29, 45-50 (2005).
- Allenspach, K., Gaschen, F. Canine chronic enteropathies: A review. Schweizer Archiv fur Tierheilkunde. 145 (5), 209-222 (2003).
- Tribuddharatana, T., Kongpiromchean, Y., Sribhen, K., Sribhen, C. Biochemical alterations and their relationships with the metabolic syndrome components in canine obesity. Kasetsart Journal - Natural Science. 45 (4), 622-628 (2011).
- Chandra, L., et al. Derivation of adult canine intestinal organoids for translational research in gastroenterology. BMC Biology. 17 (1), 33 (2019).
- Schaefer, K., Rensing, S., Hillen, H., Burkhardt, J. E., Germann, P. G. Is Science the only driver in species selection? An internal study to evaluate compound requirements in the minipig compared to the dog in preclinical studies. Toxicologic Pathology. 44 (3), 474-479 (2016).
- MacArthur Clark, J. The 3Rs in research: A contemporary approach to replacement, reduction and refinement. British Journal of Nutrition. 120, 1-7 (2018).
- Schneider, B., et al. Model-based reverse translation between veterinary and human medicine: The one health initiative. CPT: Pharmacometrics and Systems Pharmacology. 7 (2), 65-68 (2018).
- Lehmann, R., et al. Human organoids: A new dimension in cell biology. Molecular Biology of the Cell. 30 (10), 1129-1137 (2019).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Kim, J., Koo, B. K., Knoblich, J. A. Human organoids: model systems for human biology and medicine. Nature Reviews Molecular Cell Biology. 21 (10), 571-584 (2020).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Ho, B. X., Pek, N. M. Q., Soh, B. S. Disease modeling using 3D organoids derived from human induced pluripotent stem cells. International Journal of Molecular Sciences. 19 (4), 936 (2018).
- Truskey, G. A. Human microphysiological systems and organoids as in vitro models for toxicological studies. Frontiers in Public Health. 6, 185 (2018).
- Caipa Garcia, A. L., Arlt, V. M., Phillips, D. H. Organoids for toxicology and genetic toxicology: applications with drugs and prospects for environmental carcinogenesis. Mutagenesis. , (2021).
- Augustyniak, J., et al. Organoids are promising tools for species-specific in vitro toxicological studies. Journal of Applied Toxicology. 39 (12), 1610-1622 (2019).
- Zietek, T., et al. Organoids to study intestinal nutrient transport, drug uptake and metabolism - Update to the human model and expansion of applications. Frontiers in Bioengineering and Biotechnology. 8, 577656 (2020).
- Zietek, T., Rath, E., Haller, D., Daniel, H. Intestinal organoids for assessing nutrient transport, sensing and incretin secretion. Scientific Reports. 5 (1), 1-10 (2015).
- Kar, S. K., et al. Organoids: a promising new in vitro platform in livestock and veterinary research. Veterinary Research. 52 (1), 1-17 (2021).
- Borcherding, D. C., et al. Sa1976 polyphenols reverse the pathologic effects of palmitic acid and high fat diet in canine enteroids. Gastroenterology. 158 (6), 486 (2020).
- Ambrosini, Y. M., et al. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS ONE. 15 (4), 0231423 (2020).
- Zdyrski, C., et al. Su124 homology directed repair in canine duodenal enteroids to mimic the wild-type P-glycoprotein mutation. Gastroenterology. 160 (6), 625 (2021).
- Li, Y., Tang, P., Cai, S., Peng, J., Hua, G. Organoid based personalized medicine: from bench to bedside. Cell Regeneration. 9 (1), 21 (2020).
- Kurr, L. A., Allenspach, K., Jergens, A., Mochel, J. P. Harnessing the biology of intestinal organoids to accelerate drug discovery in inflammatory bowel disease: A one health approach. The FASEB Journal. 34, 1 (2020).
- Nantasanti, S., et al. Disease modeling and gene therapy of copper storage disease in canine hepatic organoids. Stem Cell Reports. 5 (5), 895-907 (2015).
- Favier, R. P., et al. COMMD1-Deficient dogs accumulate copper in hepatocytes and provide a good model for chronic hepatitis and fibrosis. PLoS ONE. 7 (8), 42158 (2012).
- Kruitwagen, H. S., et al. Long-term survival of transplanted autologous canine liver organoids in a COMMD1-deficient dog model of metabolic liver disease. Cells. 9 (2), 410 (2020).
- Vilgelm, A. E., et al. Fine-needle aspiration-based patient-derived cancer organoids. iScience. 23 (8), 101408 (2020).
- Saxena, K., et al. Human intestinal enteroids: A new model to study human rotavirus infection, host restriction, and pathophysiology. Journal of Virology. 90 (1), 43-56 (2016).
- VanDussen, K. L., Sonnek, N. M., Stappenbeck, T. S. L-WRN conditioned medium for gastrointestinal epithelial stem cell culture shows replicable batch-to-batch activity levels across multiple research teams. Stem Cell Research. 37, 101430 (2019).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Mackenzie, J. S., Jeggo, M. The one health approach-why is it so important. Tropical Medicine and Infectious Disease. 4 (2), 88 (2019).
- Artegiani, B., Clevers, H. Use and application of 3D-organoid technology. Human Molecular Genetics. 27 (2), 99-107 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten