A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التشريح المجهري للطبقة من وريقات الصمام ثلاثي الشرف للتوصيف الميكانيكي ثنائي المحور والتكميم الهيكلي الدقيق
In This Article
Summary
يصف هذا البروتوكول التوصيف الميكانيكي ثنائي المحور، وتحديد كمية الكولاجين القائمة على التصوير في مجال التردد المكاني المستقطب، والتشريح المجهري لمنشورات الصمام ثلاثي الشرف. توضح الطريقة المقدمة كيف تساهم طبقات النشرة في سلوكيات النشرة الشاملة.
Abstract
ينظم الصمام ثلاثي الشرف (TV) التدفق أحادي الاتجاه للدم غير المؤكسج من الأذين الأيمن إلى البطين الأيمن. يتكون التلفزيون من ثلاث منشورات ، لكل منها سلوكيات ميكانيكية فريدة. يمكن فهم هذه الاختلافات بين المنشورات التلفزيونية الثلاث بشكل أكبر من خلال فحص طبقاتها التشريحية الأربعة ، وهي الأذينية (A) والإسفنجية (S) والتليف (F) والبطين (V). في حين أن هذه الطبقات موجودة في جميع المنشورات التلفزيونية الثلاثة ، إلا أن هناك اختلافات في سمكها ومكوناتها الهيكلية الدقيقة التي تؤثر بشكل أكبر على سلوكياتها الميكانيكية.
يتضمن هذا البروتوكول أربع خطوات لتوضيح الاختلافات الخاصة بالطبقات: (i) توصيف السلوكيات المعمارية الميكانيكية وألياف الكولاجين للنشرة التلفزيونية السليمة ، (ii) فصل الطبقات المركبة (A / S و F / V) من النشرة التلفزيونية ، (iii) تنفيذ نفس التوصيفات للطبقات المركبة ، و (iv) أداء ما بعد التخصيص تقييم الأنسجة. يسمح هذا الإطار التجريبي بشكل فريد بالمقارنة المباشرة لأنسجة التلفزيون السليمة مع كل طبقة من طبقاتها المركبة. ونتيجة لذلك ، يمكن جمع معلومات مفصلة بشأن البنية المجهرية والوظيفة الميكانيكية الحيوية للمنشورات التلفزيونية باستخدام هذا البروتوكول. يمكن استخدام هذه المعلومات لتطوير نماذج حسابية تلفزيونية تسعى إلى توفير إرشادات للعلاج السريري لمرض التلفزيون.
Introduction
يقع التلفزيون بين الأذين الأيمن والبطين الأيمن للقلب. طوال الدورة القلبية ، ينظم التلفزيون تدفق الدم أحادي الاتجاه عن طريق الفتح والإغلاق الدوري للنشرة الأمامية للتلفزيون (TVAL) ، والنشرة الخلفية التلفزيونية (TVPL) ، ونشرة الحاجز التلفزيوني (TVSL). هذه المنشورات معقدة ولها أربع طبقات تشريحية متميزة - الأذينية (A) ، والإسفنج (S) ، والليفية (F) ، والبطينين (V) - مع مكونات بنية دقيقة فريدة. تساعد ألياف الإيلاستين في الأذينين والبطين على استعادة الأنسجة إلى هندستها غير المشوهة بعد التحميل الميكانيكي1. في المقابل ، يحتوي التليف على شبكة كثيفة من ألياف الكولاجين المتموجة التي تساهم في القدرة الحاملة للمنشورات2. تتكون الإسفنجية بشكل رئيسي من الجليكوسامينوغليكان ، وقد تم افتراضها لتمكين القص بين طبقات الريقة أثناء وظيفة صمام القلب3. في حين أن جميع أنواع المنشورات الثلاثة لها نفس الطبقات التشريحية ، إلا أن هناك اختلافات في سمك الطبقات والنسب المكونة التي لها آثار على السلوكيات الميكانيكية الخاصة بالمنشورات.
استكشف الباحثون خصائص المنشورات التلفزيونية باستخدام التوصيفات الميكانيكية المستوية ، والتقييمات النسيجية ، والتوصيفات البصرية لبنية ألياف الكولاجين. على سبيل المثال ، تسعى التوصيفات الميكانيكية ثنائية المحور المستوية إلى محاكاة الحمل الفسيولوجي عن طريق تطبيق الإزاحات العمودية على الأنسجة وتسجيل القوى المرتبطة بها. كشفت ملاحظات إزاحة القوة الناتجة (أو تمدد الإجهاد) أن جميع المنشورات التلفزيونية الثلاث تظهر سلوكيات ميكانيكية غير خطية خاصة بالاتجاه مع استجابات أكثر وضوحا خاصة بالنشرة في اتجاه الأنسجة الشعاعية4،5،6. ويعتقد أن هذه السلوكيات الخاصة بالمنشورات تنبع من الاختلافات في الخصائص الهيكلية الدقيقة التي لوحظت باستخدام التقنيات النسيجية القياسية 6,7. علاوة على ذلك ، يهدف تصوير الجيل التوافقي الثاني6 ، وتشتت الضوء بزاوية صغيرة8 ، وتصوير مجال التردد المكاني المستقطب7 (pSFDI) إلى فهم هذه الخصائص الهيكلية الدقيقة وقد أظهروا اختلافات خاصة بالنشرة في اتجاه ألياف الكولاجين وتجعيد الألياف التي لها آثار على السلوكيات الميكانيكية على مستوى الأنسجة المرصودة. وقد عززت هذه الدراسات بشكل كبير فهمنا للبنية المجهرية للأنسجة ودورها في السلوكيات على مستوى الأنسجة. ومع ذلك ، لا يزال هناك الكثير مما يجب معالجته في الربط التجريبي بين ميكانيكا الأنسجة والبنية المجهرية الأساسية.
وفي الآونة الأخيرة، أجرى هذا المختبر توصيفات ميكانيكية لطبقات نشرة التلفزيون مفصولة إلى طبقتين مركبتين (A/S وF/V) باستخدام تقنية التشريح المجهري9. سلط هذا العمل السابق الضوء على الاختلافات في الخواص الميكانيكية للطبقات وساعد في توفير نظرة ثاقبة حول كيفية مساهمة البنية المجهرية ذات الطبقات في السلوكيات الميكانيكية للأنسجة. على الرغم من أن هذا التحقيق حسن فهمنا للبنية المجهرية للنشرة التلفزيونية ، إلا أن هذه التقنية كان لها العديد من القيود. أولا ، لم تتم مقارنة خصائص الطبقات المركبة مباشرة بالأنسجة السليمة ، مما أدى إلى عدم وجود فهم كامل للعلاقة بين الميكانيكا والبنية المجهرية. ثانيا ، لم يتم فحص بنية ألياف الكولاجين للطبقات المركبة. ثالثا ، تم التحقيق فقط في طبقات TVAL بسبب صعوبات في جمع الطبقات المركبة من النشرتين التلفزيونيتين الأخريين. توفر الطريقة الموضحة هنا إطارا شاملا للتوصيف يتغلب على هذه القيود ويوفر توصيفات كاملة للمنشورات التلفزيونية وطبقاتها المركبة.
تصف هذه الورقة تقنية التشريح المجهري التي تفصل المنشورات التلفزيونية الثلاث إلى طبقاتها المركبة (A / S و F / V) للتوصيفات الميكانيكية والهيكلية الدقيقة ثنائية المحور 10،11،12. يتضمن هذا البروتوكول التكراري (i) الاختبار الميكانيكي ثنائي المحور وتوصيف pSFDI للنشرة السليمة ، (ii) تقنية تشريح مجهري جديدة وقابلة للتكرار للحصول بشكل موثوق على طبقات التلفزيون المركبة ، و (iii) الاختبار الميكانيكي ثنائي المحور وتوصيف pSFDI لطبقات التلفزيون المركبة. تعرض النسيج لتحميل الشد ثنائي المحور بنسب قوة مختلفة للاختبار الميكانيكي. بعد ذلك ، تم استخدام pSFDI لتحديد اتجاه ألياف الكولاجين ومحاذاتها في مختلف التكوينات المحملة. يحافظ pSFDI على بنية ألياف الكولاجين الأصلية ، ويسمح بالتحليل المعتمد على الحمل ، ويتحايل على الحاجة النموذجية لإصلاح أو مسح الأنسجة لتحليل بنية ألياف الكولاجين ، كما هو الحال في تصوير الجيل التوافقي الثاني أو تشتت الضوء بزاوية صغيرة. وأخيرا، تم إعداد الأنسجة باستخدام تقنيات الأنسجة القياسية لتصور البنية المجهرية للأنسجة. يسمح هذا الإطار التكراري والشامل بإجراء مقارنة مباشرة للخصائص الميكانيكية والهيكلية الدقيقة للنشرة التلفزيونية بطبقاتها المركبة.
Access restricted. Please log in or start a trial to view this content.
Protocol
تمت الموافقة على جميع الطرق الموضحة هنا من قبل اللجنة المؤسسية لرعاية الحيوانات واستخدامها في جامعة أوكلاهوما. تم الحصول على الأنسجة الحيوانية من مسلخ معتمد من وزارة الزراعة الأمريكية.
1. التوصيف الميكانيكي ثنائي المحور
- تحضير الأنسجة
- استرجع نشرة تلفزيونية من الفريزر وشفرات الحلاقة وقلم جراحي وملقط وماصة بماء منزوع الأيونات (DI) وحصيرة قطع. قم بإذابة نشرة التلفزيون باستخدام 2-3 قطرات من ماء DI في درجة حرارة الغرفة.
ملاحظة: يتم استخدام مياه DI بدلا من المياه المالحة العازلة بالفوسفات (PBS) لتجنب أي صعوبات ناجمة عن PBS للتشريح المجهري للطبقة. - ضع العينة بشكل مسطح على حصيرة القطع مع طبقة البطين (أي السطح مع إدخالات الحبل) متجهة لأعلى. ضع العينة بحيث يتماشى الاتجاه الشعاعي مع الاتجاه Y ويتماشى الاتجاه المحيطي مع الاتجاه X.
ملاحظة: يتم توجيه الاتجاه المحيطي على طول محيط الصمام. - افحص مواقع إدخال الحبال في الأنسجة. حدد منطقة ، من الناحية المثالية ~ 12 × 12 مم ، مع أقل قدر من إدخالات الحبال الكبيرة مع تجنب المناطق الرقيقة للغاية (أي الشفافة) (الشكل 1).
- اقلب العينة بحيث يكون السطح الأذيني (أي السطح بدون إدخالات وترية) متجها لأعلى. تأكد من أن اتجاهات النشرة المحيطية والشعاعية تظل محاذاة مع المحورين X و Y، على التوالي.
- قم بقص عينة مربعة 12 × 12 مم من نسيج النشرة الذي يتجنب إدخالات الحبال الكبيرة أو المناطق الرقيقة المحددة في الخطوة 1.1.3. قم بإزالة الأجزاء المشذبة من أنسجة النشرة باستخدام الملقط وضعها في حاوية نفايات.
- إذا لم يكن من الممكن تجنب إدخالات الحبال الكبيرة تماما ، فقم بقطع الأنسجة بحيث تكون على طول حافة العينة المربعة. يعد تجنب إدخال الحبال أمرا مهما لأنه يساعد على منع حدوث مشكلات في التشريح المجهري اللاحق.
- استخدم قلما جراحيا لوضع نقطة صغيرة في الزاوية العلوية اليمنى لتتبع اتجاه العينة. اترك الحبر حتى يجف لمدة 30 ثانية تقريبا.
- اقلب العينة مع السطح البطيني (أي السطح ذو الإدخالات الحبلية) متجها لأعلى. قم بقص الملحقات الوترية الموجودة على الجزء الخلفي من الأنسجة عن طريق تمديد الوتر من النشرة واستخدام شفرة حلاقة للقطع بالقرب من موقع إدخالها. اقلب العينة مرة أخرى بحيث يكون السطح الأذيني (أي السطح الأملس) متجها لأعلى.
- استرجع نشرة تلفزيونية من الفريزر وشفرات الحلاقة وقلم جراحي وملقط وماصة بماء منزوع الأيونات (DI) وحصيرة قطع. قم بإذابة نشرة التلفزيون باستخدام 2-3 قطرات من ماء DI في درجة حرارة الغرفة.
- قياس السماكة
- استرجع مستشعر إزاحة ليزر غير تلامس. قم بتصفير مستشعر الإزاحة على جزء مسطح من حصيرة القطع بالقرب من الأنسجة المشذبة.
تحذير: لا تضيء الليزر مباشرة في العينين. - ضع الليزر فوق المنطقة الوسطى من العينة. قم بإزالة الهواء المحبوس تحت سطح النشرة لأنه يمكن أن يسبب أخطاء في القياس. لإطلاق الهواء المحاصر ، إما استخدام ملاقط لدفع الفقاعة إلى حافة الأنسجة أو رفع زاوية واحدة من الأنسجة.
- سجل السماكة الموضحة على شاشة مستشعر الإزاحة. كرر قياسين آخرين في مواقع أخرى من العينة.
- احسب متوسط سمك النشرة باستخدام القياسات الثلاثة المسجلة في الخطوة السابقة. استخدم هذه القيمة عند إنشاء بروتوكولات التوصيف الميكانيكية ثنائية المحور.
- استرجع مستشعر إزاحة ليزر غير تلامس. قم بتصفير مستشعر الإزاحة على جزء مسطح من حصيرة القطع بالقرب من الأنسجة المشذبة.
- إعداد اختبار ثنائي المحور وتركيب الأنسجة
- قم بإعداد حمام مائي DI عند 37 درجة مئوية ، باتباع إرشادات نظام الاختبار ، لضمان درجة الحرارة تحت الظروف الفسيولوجية في الجسم الحي .
- استرجع الملقط ، وعينة الأنسجة ، وأجهزة التركيب ، وأداة ذات رأس رفيع ، وغراء سيانوكريليت سائل ، وخرز زجاجي مطلي باللون الأسود (قطر: 300-500 ميكرومتر).
ملاحظة: تتضمن أجهزة التركيب السنون وجسر التركيب ومطاط التركيب. - قم بتركيب عينة الأنسجة على نظام الاختبار. تأكد من محاذاة الاتجاه المحيطي للنسيج مع الاتجاه X، والذي يمكن مساعدته من خلال النقطة الموضوعة مسبقا في الخطوة 1.1.6.
ملاحظة: يجب أن تكون السنون المستخدمة هنا متباعدة بالتساوي عبر طول حافة الأنسجة بالكامل. تم تعيين طول الحافة الفعال ليكون 10 مم للأنسجة السليمة و >3.3 مم للطبقات المركبة.
- وضع علامة ائتمانية
- حدد المنطقة المركزية الثلث المربع من الأنسجة المثبتة. استخدم الزوايا التقريبية لهذه المنطقة لوضع العلامة الائتمانية.
- ضع الخرز الزجاجي في قارب وزن مفتوح الوجه وقم بإنشاء مجموعة صغيرة من غراء سيانو أكريليت السائل في قارب وزن منفصل. قم بتغطية الجزء العلوي من الأداة ذات الرؤوس الدقيقة بكمية صغيرة من الغراء. ربت الغراء الزائد على جانب قارب الوزن.
- قم بإنشاء زاوية واحدة من الصفيف المركزي المربع الثالث عن طريق الضغط برفق على الطرف المغطى بالغراء على الأنسجة. باستخدام ملقط ، أمسك بخرزة زجاجية وضعها بعناية فوق نقطة الغراء. استخدم كاميرا جهاز الاختبار ثنائي المحور للمساعدة في وضع الخرزة.
- كرر الخطوتين 1.4.2 و1.4.3 لثلاث حبات إضافية حتى يكتمل الصفيف المربع. تأكد من أن الخرز متصل بإحكام ، وأن نقاط الغراء الخاصة بها لا تلمس أو تلتصق ببعضها البعض. جفف الغراء قبل خفض الأنسجة في الحمام المائي.
- إذا كانت الخرز عالقة معا ، فانتظر حتى يجف الغراء ، ثم استخدم الملقط للإمساك بلطف بالخرزة أو الغراء وسحبها من الأنسجة.
ملاحظة: يجب أن يخرج الغراء والخرزة (الخرزات) ، مما يسمح بإعادة محاولة وضع الخرزة.
- إذا كانت الخرز عالقة معا ، فانتظر حتى يجف الغراء ، ثم استخدم الملقط للإمساك بلطف بالخرزة أو الغراء وسحبها من الأنسجة.
- التكييف المسبق
- قم بإنشاء بروتوكول تكييف مسبق يتم التحكم فيه بالقوة ، حيث سيخضع النسيج ذو طول الحافة وسمكها لستة تكرارات للتحميل متساوي المحور إلى ذروة توتر الغشاء T ذروة 40 نيوتن / م مع تحميل مسبق بنسبة 3٪ × Tذروة10 وأوقات التمدد والاسترداد من 30 ثانية لكل منهما.
- إنشاء دليل اختبار تعسفي من شأنه تخزين البيانات مؤقتا للحسابات المستقبلية. اضبط معدل التحميل ليكون 4.42 نيوتن/م.
- إنشاء مجموعة معلمات اختبار جديدة باسم Preconditioning0. اضبط وضعي التحكم في المحور X والمحور Y لفرض وظائف التحكم وتعيينها على الخطوة. حدد حجم الحمل ليكون القوة المرتبطة بذروة T ، أي f peak = T peak · L. حدد مقدار التحميل المسبق على أنه 3٪ من ذروة f للتكرار الأول فقط وحدد كل من مدة التمدد ومدة الاسترداد على أنها 30 ثانية. حدد عدد مرات التكرار على أنها 10.
ملاحظة: الذروة المحسوبة الأولى لإجهاد بيولا-كيرشوف ، أي ذروة P = Tpeak / t ، قد تتجاوز 200 كيلو باسكال للأنسجة الأرق ، مما قد يؤدي إلى تمزق الأنسجة أثناء الاختبار. في هذه السيناريوهات ، تم تعديل توتر الغشاء الأقصى إلى أقصى إجهاد Piola-Kirchhoff يبلغ 200 كيلو باسكال.
- تنفيذ بروتوكول التكييف المسبق. بعد التكييف المسبق ، سجل الأبعاد الحالية X و Y للعينة لاستخدامها في بروتوكولات الاختبار ثنائية المحور.
- قم بإنشاء بروتوكول تكييف مسبق يتم التحكم فيه بالقوة ، حيث سيخضع النسيج ذو طول الحافة وسمكها لستة تكرارات للتحميل متساوي المحور إلى ذروة توتر الغشاء T ذروة 40 نيوتن / م مع تحميل مسبق بنسبة 3٪ × Tذروة10 وأوقات التمدد والاسترداد من 30 ثانية لكل منهما.
- إنشاء وتنفيذ بروتوكولات الاختبار ثنائية المحور
- حدد الوقت اللازم لتحقيق ذروة التكوين المتساوي المحور من التكوين بعد التكييف المسبق بمعدل الإزاحة المطلوب. بالنظر إلى معدل الإزاحة الثابت، احسب أوقات التحميل لنسب التحميل المتبقية (أي T XX:T YY = 1:0.5 وTXX:TYY = 0.5:1).
- قم بالركض يدويا على المحركات الخطية لمطابقة القوى المستهدفة لنسبة تحميل معينة. كرر هذه العملية وسجل أبعاد النشرة لجميع نسب التحميل.
- قم بإعداد بروتوكول اختبار يتم التحكم فيه بالإزاحة والذي يحل محل الأنسجة ثنائية المحور من التكوين المشروط مسبقا إلى التكوينات المسجلة في الخطوة 1.6.2 (أي T XX:TYY = 1:1، 1:0.5، 0.5:1) ضمن الأوقات المحددة في الخطوة 1.6.1. تأكد من أن كل بروتوكول يحتوي على ثلاث دورات تحميل / تفريغ لتكرار السلوك الميكانيكي.
- إنشاء دليل اختبار من شأنه تخزين البيانات للحسابات المستقبلية. تأكد من تطابق اسم الدليل مع العينة الحالية.
- قم بإنشاء مجموعة معلمات اختبار جديدة بالاسم 1: 1 ، واضبط أوضاع التحكم في المحور X والمحور Y على الإزاحة ، واضبط وظائف التحكم على المنحدر. حدد مقدار الامتداد ليكون التكوين المسجل في الخطوة 1.6.1. حدد مقدار التحميل المسبق على أنه 3٪ من ذروة f للتكرار الأول فقط، وحدد مدة التمدد ومدة الاسترداد كوقت مسجل في الخطوة 1.6.1. حدد عدد التكرارات على أنه 3.
- كرر الخطوة 1.6.3.2 لنسب التحميل المتبقية (أي T XX:T YY = 1:0.5 وTXX:TYY = 0.5:1)، باستثناء تحديد حجم التحميل المسبق على أنه غير مطبق. تأكد من أن حجم التمدد ومدة التمدد ومدة الاسترداد تتطابق مع تلك المسجلة في الخطوة 1.6.2.
ملاحظة: سيتم استخدام البيانات من الدورة النهائية (الثالثة) فقط لتحليل الإجهاد والإجهاد.
- تنفيذ البروتوكولات التي يتم التحكم فيها بالإزاحة. بعد الانتهاء من الاختبار ثنائي المحور، أعد الأنسجة إلى أبعادها المشروطة مسبقا.
ملاحظة: يجب إجهاض الاختبار على الفور إذا بدأ النسيج في التمزق.
- مزيد من التوصيفات
- اترك الأنسجة مغمورة في ماء DI ومثبتة على نظام الاختبار ثنائي المحور. قم بإجراء تصوير pSFDI كما هو موضح في الخطوات 2.1-2.3.
- قم بفك الأنسجة. إذا كان نسيجا سليما ، فانتقل إلى التشريح المجهري الموضح في الخطوات 3.1-3.7. إذا لم يكن الأمر كذلك ، فقم بجمع الأنسجة باتباع الخطوة 3.7.
ملاحظة: يمكن استخدام حمام DI المائي للتوصيفات اللاحقة في نفس اليوم. - كرر الخطوات من 1.2 إلى 1.7 مع طبقات A/S وF/V التي تم الحصول عليها بعد التشريح المجهري (الخطوات 3.1-3.6).
ملاحظة: يسمح تكرار بروتوكول الاختبار للطبقات بإجراء مقارنة مباشرة للأنسجة السليمة بطبقاتها الخاصة.
- إجراءات معالجة بيانات الاختبار ثنائي المحور
- قم بإجراء ارتباط صورة رقمية لصور الاختبار ثنائية المحور المكتسبة لتحديد مواضع العلامات المعتمدة على الوقت. حساب إزاحات العلامة الائتمانية عبر Eq (1). 5
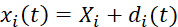 (1)
(1)
هنا ، x i (t) ، X i ، و d i (t) هي الموقع المعتمد على الوقت ، والموقع الأولي (المرجعي) ، وإزاحة العلامة i. - حساب تدرج التشوه F من خلال اعتبار العلامات الائتمانية كعنصر محدود خطي رباعي العقد ، كما هو موضح في Eq (2)5
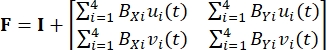 (2)
(2)
حيث B Xi و BYi هما مشتقات دوال الشكل للعقدة i في الاتجاهين X و Y ، على التوالي ، و u i(t) و v i(t) هما مكونان d i(t): d i(t) = [u i(t) ، v i(t)]T. - احسب إجهاد بيولا-كيرشوف P الأول المطبق باستخدام القوى المسجلة، كما في Eq (3)5
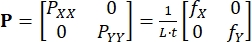 (3)
(3)
P XX و P YY هما المكونان X و Y ل P ؛ L و t هما طول حافة الأنسجة وسمكها. f X و f Y هي القوى المسجلة في الاتجاهين X و Y. - حدد مقاييس الإجهاد والإجهاد الأخرى حسب الحاجة،13 والتي تشمل تشوه كوشي-أخضر C = F T/F، وسلالة غرين-لاغرانج E = (C - I)/2، σ إجهاد كوشي = J-1 PFT، وإجهاد بيولا-كيرشوف الثاني S = F-1P.
ملاحظة: هنا ، أنا موتر هوية من الدرجة الثانية ، و J = det(F) هو يعقوبي من التدرج التشوه F.
- قم بإجراء ارتباط صورة رقمية لصور الاختبار ثنائية المحور المكتسبة لتحديد مواضع العلامات المعتمدة على الوقت. حساب إزاحات العلامة الائتمانية عبر Eq (1). 5
2. تصوير مجال التردد المكاني المستقطب
- إعداد النظام
ملاحظة: إذا رغبت في ذلك، يمكن إزالة العلامات الائتمانية من الأنسجة قبل الخطوات التالية.- قم بتوسيط جهاز pSFDI فوق العينة (الشكل 2). قم بتشغيل جهاز العرض وإضاءة العينة بضوء 490 نانومتر (سماوي).
- افتح برنامج الكاميرا وافحص مجال رؤية الكاميرا. تأكد من أن العينة متمركزة في الإطار ومحتواة بالكامل داخل مجال الرؤية.
- إذا كانت العينة المثبتة عبارة عن نشرة سليمة، فاضبط سطوع جهاز العرض الرقمي لمعالجة الضوء (DLP) لضمان إضاءة الأنسجة بالكامل دون وجود وهج على سطح الأنسجة. لا تضبط السطوع إذا كانت العينة إحدى الطبقات المركبة.
- قم بتدوير المستقطب عبر نطاق حركته الكامل للكشف عن الوهج أو الأوساخ المحتملة على عدسة المستقطب. نظف عدسة المستقطب بعناية بقطعة قماش من الألياف الدقيقة حسب الضرورة.
- جمع البيانات
ملاحظة: يمكن أتمتة عملية جمع البيانات التالية باستخدام برامج، مثل LabVIEW أو Python.- حرك المستقطب إلى موضعه الأصلي - محاذاة بشكل مثالي مع أحد محاور الاختبار ثنائية المحور. التقط صورة واحدة ذات تدرج رمادي واحفظها على الكمبيوتر باستخدام موقع المستقطب (أي 0 درجة).
- قم بتدوير المستقطب 5 درجات والتقاط صورة أخرى ذات تدرج رمادي. كرر هذه العملية للحصول على 37 صورة تتراوح من 0 درجة إلى 180 درجة مع زيادة 5 درجات.
ملاحظة: يمكن تحليل الصور من تسلسل التصوير pSFDI الأول بشكل مبدئي لضمان الاستجابة البصرية المطلوبة من الأنسجة. راجع الخطوة 2.3 للحصول على الإرشادات. - كرر تسلسل تصوير pSFDI لتكوينات الأنسجة المرغوبة الأخرى ، على سبيل المثال ، تكوينات الذروة لبروتوكولات التحميل التي تم النظر فيها للاختبار الميكانيكي ثنائي المحور.
- إجراءات المعالجة اللاحقة لبيانات pSFDI
ملاحظة: تتضمن الطريقة التالية خطوات للغة برنامج MATLAB. ومع ذلك ، يمكن استخدام أي لغة مفضلة (على سبيل المثال ، Python و C ++) بدلا من ذلك.- استخدم الدالة imread() MATLAB لإنشاء صفائف تحتوي على كثافة البكسل للصور ال 37 التي تم الحصول عليها. للراحة ، قم بترتيبها على أنها n × m × 37 صفيفا ثلاثي الأبعاد ، حيث n و m هما عددان البكسل على طول المحورين.
- حدد منطقة اهتمام الأنسجة (ROI) باستخدام وظيفة grabit() المعرفة من قبل المستخدم.
- تناسب بيانات زاوية الكثافة مقابل المستقطب لكل بكسل عائد استثمار باستخدام سلسلة فورييه المكونة من 3 أطقم ، كما هو الحال في Eq (4):
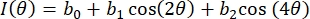 (4)
(4)
هنا ، I(θ) هي كثافة البكسل كدالة لزاوية المستقطب ، و bi هي ثوابت فورييه. استخدم الانحدار الخطي القياسي للمربعات الصغرى لتحديد bi. - أوجد اتجاه الألياف الحكيمة للبكسل كزاوية المستقطب المرتبطة بالقيمة القصوى ل I(θ). حساب درجة التباين البصري (DOA) عبر Eq (5).
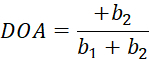 (5)
(5) - استخدم plot () والرسم البياني () لتصور اتجاه الألياف المكتسبة وقيم DOA. احفظ النتائج التي تمت معالجتها لاستخدامها لاحقا.
3. التشريح المجهري للطبقات المركبة لمنشور الصمام ثلاثي الشرف
- ربط الأنسجة بلوح الشمع
- اجمع المواد المطلوبة: لوح الشمع ، ماء DI ، الماصة ، المشرط ، المقص الصغير ، الملقط الرقيق ، الملقط المنحني ، الملقط السميك ، والدبابيس.
ملاحظة: استخدم الملقط فقط بدون أسنان أو مقابض ، حيث يمكن للملقط من هذا النوع بسهولة شديدة تمزيق الأنسجة الرقيقة لطبقة A / S عند إجراء التشريح. - قم بفك تركيب الأنسجة من جهاز الاختبار ثنائي المحور وقياس سمكها باستخدام مستشعر إزاحة الليزر الموضح في الخطوة 1.2. ضع المنديل على لوح الشمع.
- افحص الجانب البطيني من الأنسجة بحثا عن إدخالات الحبال الكبيرة. لاحظ موضع هذه الإدخالات لتجنبها أثناء التشريح (الشكل التكميلي S1). التقط صورة فوتوغرافية للرجوع إليها.
- انشر الأنسجة بشكل مسطح على لوح الشمع مع توجيه الأذينيين لأعلى. قم بلصق الأنسجة على اللوحة باستخدام المسامير:
- في كل ركن من أركان الأنسجة، ضع دبوسا واحدا بزاوية بعيدة عن النسيج (لمشاهدة أفضل) واسحب الأنسجة مشدودة قليلا (الشكل 3A). قم بذلك بترتيب عقارب الساعة أو عكس اتجاه عقارب الساعة. تأكد من أن المسامير خارج الثقوب التي أنشأتها السنون عند تركيب الأنسجة.
- اضبط موضع الدبوس قليلا للتأكد من أن الأنسجة مشدودة وفي تكوين مربع (الشكل 3B) بحيث يكون النسيج مسطحا ولا يتحول أثناء التشريح الدقيق للطبقة.
- إذا لزم الأمر ، ضع دبابيس على طول جانب الأنسجة أثناء التشريح لتمديد الأنسجة أكثر. ضع في اعتبارك عند وضع وصيد دبابيس إضافية أنه يجب العمل حولها أثناء التشريح.
- قم بإزالة العلامات الائتمانية للخرزة الزجاجية.
ملاحظة: الخطوة التالية اختيارية. يساعد ماء DI المضاف في الحفاظ على ترطيب الأنسجة ويمنع الأنسجة من الالتصاق بنفسها طوال عملية التشريح المجهري. - باستخدام ماصة ، ضع ماء DI على سطح الأنسجة بحيث يغطي الأنسجة بالكامل بطريقة تشبه الفقاعة. قم بتجديد مياه DI حسب الحاجة طوال فترة التشريح.
- اجمع المواد المطلوبة: لوح الشمع ، ماء DI ، الماصة ، المشرط ، المقص الصغير ، الملقط الرقيق ، الملقط المنحني ، الملقط السميك ، والدبابيس.
- اجعل الزاوية الأولية.
- حدد زاوية من العينة المثبتة لبدء التشريح. تجنب إدخال الحبال الكبيرة والمناطق الرقيقة للغاية.
- قم بإجراء قطع في طبقة A / S عن طريق سحب المشرط برفق فوق سطح الأنسجة على طول ثقوب التركيب من الاختبارات الميكانيكية (الشكل 3C). تأكد من أن طول القطع لا يقل عن 5 مم ، وتبدأ حواف القطع في التفكك ، مما يكشف عن طبقة F / V تحتها.
- استخدم الملقط الرقيق (بدون طرف حاد) لفرك القطع بإحكام على طول القطع وسحب حواف القطع (الشكل التكميلي S2).
- إذا لم يبدأ القطع في طبقة A / S في التفكك ، فقم بتتبع نفس القطع برفق مرة أخرى باستخدام المشرط حتى يبدأ في القيام بذلك. احرص على عدم القطع بعمق في الأنسجة (بعد الطبقة المركبة A / S) لأنها تجعل من الصعب فصل الطبقات بشكل نظيف.
- كرر الخطوتين 3.2 و3.2.3 لجعل القطع الثاني عموديا على القطع الأول (الشكل 3D). تأكد من توصيل القطعتين وتشكيل زاوية.
- إذا لم يكن القطعان متصلين ، فقم بتشغيل الملقط الرقيق تحت المساحة الصغيرة من الأنسجة التي تفصل بين القطعتين (الشكل التكميلي S3). ثم ، استخدم المقص بعناية لقطع الأنسجة.
- قشر الأنسجة من الزاوية.
- افركي الجروح باستخدام الملقط الرقيق حتى يبدأ النسيج في الانفصال عن طبقة F / V. بمجرد فصل قطعة صغيرة من الأنسجة ، أمسكها بالملقط واسحبها برفق لزيادة فصل الطبقات المركبة.
ملاحظة: ضع دائما طرف الملقط الرقيق بعد حافة الأنسجة عند الإمساك بها. خلاف ذلك ، يمكنهم عن طريق الخطأ كزة ثقب في الطبقة المركبة A / S. - استمر في تقشير الأنسجة وفرك التماس حتى يصل إلى نهاية القطعتين اللتان تم إجراؤهما للزاوية. خلال هذه العملية ، قم بالتبديل إلى ملاقط أكبر للإمساك بالأنسجة لعملية التقشير لمنع التمزيق والتمزق غير المرغوب فيه للطبقة المركبة A / S.
- إذا كانت المحاولة الأولى تحتوي على مشكلات كبيرة في الفصل، فجرب زاوية مختلفة كنقطة بداية (ارجع إلى الخطوة 3.2).
- افركي الجروح باستخدام الملقط الرقيق حتى يبدأ النسيج في الانفصال عن طبقة F / V. بمجرد فصل قطعة صغيرة من الأنسجة ، أمسكها بالملقط واسحبها برفق لزيادة فصل الطبقات المركبة.
- تمديد الجروح ، وتقشير الأنسجة ، وجعل زاوية ثانية.
- قم بتمديد القطعتين اللتان تم إجراؤهما للزاوية الأولى عن طريق وضع طرف المشرط في أسفل كل قطعة وسحبه برفق على طول سطح الأنسجة (الشكل 4A). تأكد من أن جميع قطع التمديد لا تقل عن 5 مم وأن ملحقات القطع تتصل بالقطع الأصلية وتستمر في اتباع ثقوب السنون أو الخياطة.
ملاحظة: إذا كان قطع الامتداد عميقا جدا ، فيجب مراقبة التقشير القادم عن كثب لضمان عدم فصل أجزاء من التليف بالطبقة المركبة A / S (الشكل 5A). - استمر في تمديد الجروح وقشر طبقة A / S المركبة العلوية للخلف أثناء فرك التماس حتى يتم الانتهاء من جانب واحد. لاحظ أنه سيتم فصل الأنسجة تماما على طول قطع واحد ؛ تأكد من أن التماس بين الطبقات المركبة A / S و F / V مستقيم (الشكل 4B).
- كرر الإرشادات الواردة في الخطوة 3.2 والخطوة 3.3 لإنشاء زاوية ثانية عمودية على نهاية الجانب المقشر بالكامل (الشكل 4C).
- قم بتمديد القطعتين اللتان تم إجراؤهما للزاوية الأولى عن طريق وضع طرف المشرط في أسفل كل قطعة وسحبه برفق على طول سطح الأنسجة (الشكل 4A). تأكد من أن جميع قطع التمديد لا تقل عن 5 مم وأن ملحقات القطع تتصل بالقطع الأصلية وتستمر في اتباع ثقوب السنون أو الخياطة.
- افصل طبقة A / S تماما.
- قم بتمديد التخفيضات المتبقية مع تجنب إدخالات الحبال الكبيرة. استمر في فصل طبقات A/S وF/V باستخدام تقنيات الفرك والسحب المستخدمة في الزاوية الأولى. دون العديد من الاعتبارات أو المشاكل التي قد تنشأ أثناء هذه العملية:
- استبعاد إدخالات الحبال من منطقة الفصل A / S (الشكل 5B) فقط عندما يسمح هذا الاستبعاد بعينة A / S كبيرة بما يكفي للتوصيفات التجريبية (>3.3 مم).
- إذا تمزق النسيج أو تشكل ثقب ، فتوقف عن فصل الأنسجة على الفور. لمنع التقاط الملقط ، ضع المقص في أي ثقب يتشكل واقطع الأنسجة بعيدا عن المركز. إذا تشكل العيب على طول خط التماس الانفصالي ، فابدأ في فصل الأنسجة على طول حافة أخرى لمنع المزيد من التمزق (الشكل 5C).
- ابحث عن الوصلات بين الطبقات التي قد تظهر أثناء فصل الأنسجة ومنع المزيد من فصل الأنسجة دون التعرض لخطر كبير من التمزق (الشكل 5D). لاحظ أن هذه خيوط رقيقة ولكنها قوية يجب قطعها بعناية باستخدام المقص. تجنب إنشاء ثقب في طبقة A / S أو القطع لأسفل في طبقة F / V ، لأن هذا من شأنه أن يسبب فصلا غير متساو.
- استمر في هذه العملية حتى يتم فصل أكبر عينة ممكنة من طبقة A / S. حدد اتجاه العينة باستخدام القلم الجراحي (الشكل 6A).
- قم بتمديد التخفيضات المتبقية مع تجنب إدخالات الحبال الكبيرة. استمر في فصل طبقات A/S وF/V باستخدام تقنيات الفرك والسحب المستخدمة في الزاوية الأولى. دون العديد من الاعتبارات أو المشاكل التي قد تنشأ أثناء هذه العملية:
- الانتهاء من التشريح.
- استخدم المقص لقطع التماس الفاصل لحافة الأنسجة المتبقية (الشكل 6B). تأكد من أن هذا القطع قريب من التماس الفصل قدر الإمكان.
- ضع الطبقة المركبة A / S المنفصلة بشكل مسطح على حصيرة القطع. إذا لزم الأمر ، استخدم المشرط لتصويب حواف الأنسجة وإنشاء شكل نسيج مربع مناسب للاختبار الميكانيكي ثنائي المحور. ضع طبقة A / S في ماء DI حتى تصبح جاهزة للاختبار.
- ضع علامة على اتجاه طبقة F/V التي تبقى على لوح الشمع. اقطع أكبر مربع ممكن من المنطقة التي تمت فيها إزالة طبقة A / S (الشكل 6C) ، ثم ضعها في ماء DI.
- علم الأنسجة
- اقتطع شريطين من الأنسجة - محاذاة مع الاتجاهين المحيطي والشعاعي - للاستخدام في علم الأنسجة. استخدم بروتوكولات مختلفة للطبقات السليمة والمركبة (أي A / S و F / V).
- بالنسبة للطبقة السليمة ، خذ العينات من الأنسجة التي تظل مثبتة على لوح الشمع. استخدم الأنسجة خارج ثقوب السنين / الخياطة ، حيث لم يتم تشريح هذا الجزء من الأنسجة وسيمثل النشرة السليمة.
- بالنسبة للطبقات المركبة A / S و F / V ، لا تجمع عينات الأنسجة إلا بعد الانتهاء من اختبارها وتصويرها بالكامل. قم بفك العينة من نظام الاختبار ثنائي المحور ، ووضع الأنسجة مسطحة على حصيرة قطع ، واستئصال الشرائط المحيطية والشعاعية باستخدام شفرة حلاقة.
- ضع الشرائط المقتطعة في أشرطة الأنسجة واغمر الكاسيت في الفورمالين بنسبة 10٪.
- تخلص من الأنسجة المتبقية. تنظيف أدوات التشريح باستخدام مركب التنظيف (انظر جدول المواد).
- بعد 24-48 ساعة من التثبيت ، انقل الكاسيت إلى الإيثانول ، حيث يمكن تخزينها إلى أجل غير مسمى حتى معالجة الأنسجة وتلطيخها.
ملاحظة: يمكن لهذا التحليل النسيجي أن يؤكد نجاح التشريح المجهري. تحذير: 10٪ الفورمالين يسبب تهيج الجلد وتلف العين الخطير. قد يسبب أيضا رد فعل تحسسي أو سرطان من خلال الاستنشاق. عند التعامل ، ارتد معدات الحماية الشخصية المناسبة ، مثل القفازات والنظارات الواقية ومعطف المختبر ، ولا تستخدم إلا في الأماكن جيدة التهوية ، مثل غطاء الدخان. عندما لا تكون قيد الاستخدام ، تأكد من إغلاق حاوية التخزين بإحكام.
- اقتطع شريطين من الأنسجة - محاذاة مع الاتجاهين المحيطي والشعاعي - للاستخدام في علم الأنسجة. استخدم بروتوكولات مختلفة للطبقات السليمة والمركبة (أي A / S و F / V).
Access restricted. Please log in or start a trial to view this content.
النتائج
سينتج عن التشريح المجهري عينات A / S و F / V بسماكات موحدة نسبيا يمكن تركيبها على جهاز اختبار ثنائي المحور (تجاري). سيتحقق تحليل الأنسجة للنشرة السليمة والطبقتين التشريحيتين مما إذا كان النسيج قد تم فصله بشكل صحيح على طول الحدود بين الإسفنج والتليف (الشكل 7). بالإضافة إلى ذلك ، ي...
Access restricted. Please log in or start a trial to view this content.
Discussion
تشمل الخطوات الحاسمة للبروتوكول ما يلي: (i) التشريح المجهري للطبقة ، (ii) تركيب الأنسجة ، (iii) وضع العلامة الائتمانية ، و (iv) إعداد pSFDI. التشريح المجهري للطبقة المناسبة هو الجانب الأكثر أهمية وصعوبة في الطريقة الموضحة هنا. قبل بدء تحقيق باستخدام هذه التقنية ، يجب أن يكون لدى التفكيك (التشريح) مما...
Access restricted. Please log in or start a trial to view this content.
Disclosures
وليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم دعم هذا العمل من قبل منحة تطوير العلماء التابعة لجمعية القلب الأمريكية (16SDG27760143) ومؤسسة الصحة المشيخية. تم دعم KMC جزئيا من قبل برنامج فرص البحث الجامعي بجامعة أوكلاهوما (OU) وبرنامج التدريب المهني البحثي مع مرتبة الشرف. تم دعم DWL جزئيا من قبل زمالة أبحاث الدراسات العليا التابعة للمؤسسة الوطنية للعلوم (GRF 2019254233) وزمالة ما قبل الدكتوراه لجمعية القلب الأمريكية / مؤسسة قلب الأطفال (الجائزة رقم 821298). ويعترف بكل هذا الدعم بامتنان.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 10% Formalin Solution, Neutral Buffered | Sigma-Aldrich | HT501128-4L | |
| Alconox Detergent | Alconox | cleaning compound | |
| BioTester - Biaxial Tester | CellScale Biomaterials Testing | 1.5 N Load Cell Capacity | |
| Cutting Mat | Dahle | B0027RS8DU | |
| Deionized Water | N/A | ||
| Fine-Tipped Tool | HTI INSTRUMENTS | NSPLS-12 | |
| Forceps - Curved | Scientific Labwares | 16122 | |
| Forceps - Thick | Scientific Labwares | 161001078 | |
| Forceps - Thin | Scientific Labwares | 16127 | |
| LabJoy | CellScale Biomaterials Testing | Version 10.66 | |
| Laser Displacement Sensor | Keyence | IL-030 | |
| Liquid Cyanoacrylate Glue | Loctite | 2436365 | |
| MATLAB | MathWorks | Version 2020a | |
| Micro Scissors | HTI Instruments | CAS55C | |
| Pipette | Belmaks | 360758081051Y4 | |
| Polarized Spatial Frequency Domain Imaging Device | N/A | Made in-house using a digital light projector, linear polarizer, rotating polarizer mount, and charge-coupled device camera. See doi.org/10.1016/j.actbio.2019.11.028 (PMCID: PMC8101699) for more details. | |
| Scalpel | THINKPRICE | TP-SCALPEL-3010 | |
| Single Edge Industrial Razor Blades (Surgical Carbon Steel) | VWR International | H3515541105024 | |
| Surgical Pen | LabAider | LAB-Skin-6 | |
| T-Pins | Business Source | BSN32351 | |
| Wax Board | N/A | Made in-house using modeling wax and baking tray | |
| Weigh Boat | Pure Ponta | mdo-azoc-1030 |
References
- Vesely, I. The role of elastin in aortic valve mechanics. Journal of Biomechanics. 31 (2), 115-123 (1998).
- Zhang, W., Ayoub, S., Liao, J., Sacks, M. S. A meso-scale layer-specific structural constitutive model of the mitral heart valve leaflets. Acta Biomaterialia. 32, 238-255 (2016).
- Stella, J. A., Sacks, M. S. On the biaxial mechanical properties of the layers of the aortic valve leaflet. Journal of Biomechanical Engineering. 129 (5), 757-766 (2007).
- Khoiy, K. A., Amini, R. On the biaxial mechanical response of porcine tricuspid valve leaflets. Journal of Biomechanical Engineering. 138 (10), 104504(2016).
- Jett, S. V., et al. An investigation of the anisotropic mechanical properties and anatomical structure of porcine atrioventricular heart valves. Journal of the Mechanical Behavior of Biomedical Materials. 87, 155-171 (2018).
- Meador, W. D., et al. A detailed mechanical and microstructural analysis of ovine tricuspid valve leaflets. Acta Biomaterialia. 102, 100-113 (2020).
- Hudson, L. T., et al. A pilot study on linking tissue mechanics with load-dependent collagen microstructures in porcine tricuspid valve leaflets. Bioengineering. 7 (2), 60(2020).
- Pant, A. D., et al. Pressure-induced microstructural changes in porcine tricuspid valve leaflets. Acta Biomaterialia. 67, 248-258 (2018).
- Kramer, K. E., et al. An investigation of layer-specific tissue biomechanics of porcine atrioventricular heart valve leaflets. Acta Biomaterialia. 96, 368-384 (2019).
- Ross, C. J., Laurence, D. W., Wu, Y., Lee, C. -H. Biaxial mechanical characterizations of atrioventricular heart valves. Journal of Visualized Experiments: JoVE. (146), e59170(2019).
- Goth, W., Lesicko, J., Sacks, M. S., Tunnell, J. W. Optical-based analysis of soft tissue structures. Annual Review of Biomedical Engineering. 18, 357-385 (2016).
- Jett, S. V., et al. Integration of polarized spatial frequency domain imaging (pSFDI) with a biaxial mechanical testing system for quantification of load-dependent collagen architecture in soft collagenous tissues. Acta Biomaterialia. 102, 149-168 (2020).
- Reddy, J. N. An Introduction to Continuum Mechanics. , Cambridge University Press. (2013).
- Duginski, G. A., Ross, C. J., Laurence, D. W., Johns, C. H., Lee, C. -H. An investigation of the effect of freezing storage on the biaxial mechanical properties of excised porcine tricuspid valve anterior leaflets. Journal of the Mechanical Behavior of Biomedical Materials. 101, 103438(2020).
- Salinas, S. D., Clark, M. M., Amini, R. Mechanical response changes in porcine tricuspid valve anterior leaflet under osmotic-induced swelling. Bioengineering. 6 (3), 70(2019).
- Pokutta-Paskaleva, A., Sulejmani, F., DelRocini, M., Sun, W. Comparative mechanical, morphological, and microstructural characterization of porcine mitral and tricuspid leaflets and chordae tendineae. Acta Biomaterialia. 85, 241-252 (2019).
- Ross, C. J., et al. An investigation of the glycosaminoglycan contribution to biaxial mechanical behaviors of porcine atrioventricular heart valve leaflets. Journal of the Royal Society Interface. 16 (156), 0069(2019).
- Sommer, G., Regitnig, P., Költringer, L., Holzapfel, G. A. Biaxial mechanical properties of intact and layer-dissected human carotid arteries at physiological and supraphysiological loadings. American Journal of Physiology-Heart and Circulatory Physiology. 298 (3), 898-912 (2009).
- Holzapfel, G. A., Sommer, G., Gasser, C., Regitnig, P. Determination of the layer-specific mechanical properties ofhuman coronary arteries with intimal thickening, and related constitutive modelling. American Journal of Physiology-Heart and Circulatory Physiology. 289 (5), 2048-2058 (2005).
- Sommer, G., et al. Multiaxial mechanical response and constitutive modeling of esophageal tissues: Impact on esophageal tissue engineering. Acta Biomaterialia. 9 (12), 9379-9391 (2013).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved