Method Article
مجسات حبل مقياس التوتر لقياس ميكانيكا إنجرين بوساطة عامل النمو والتصاق
In This Article
Summary
سطح TGT هو منصة مبتكرة لدراسة عامل النمو - integrin عبر الحديث. يسمح تصميم المسبار المرن وخصوصية رباط الالتصاق والتشكيل الدقيق لظروف التحفيز بإجراء تقييمات كمية قوية للتفاعل بين EGFR-integrin. تسلط النتائج الضوء على EGFR باعتباره "منظما ميكانيكيا" لضبط ميكانيكا الإنجرين ، مما يؤثر على تجميع الالتصاق البؤري وانتشار الخلايا.
Abstract
تعتمد الكائنات الحية متعددة الخلايا على التفاعلات بين مستقبلات الغشاء والأربطة المتشابهة في المصفوفة خارج الخلية المحيطة (ECM) لتنسيق وظائف متعددة ، بما في ذلك الالتصاق والانتشار والهجرة والتمايز. يمكن أن تنتقل القوى الميكانيكية من الخلية عبر مستقبل الالتصاق integrin إلى الأربطة في ECM. يمكن تعديل كمية هذه القوى المتولدة عن الخلايا وتنظيمها المكاني بواسطة مستقبلات عامل النمو ، بما في ذلك مستقبلات عامل نمو البشرة (EGFR). الأدوات المتاحة حاليا لقياس التغيرات بوساطة المحادثة المتقاطعة في ميكانيكا الخلايا وربطها بالالتصاقات البؤرية والمورفولوجيا الخلوية والإشارات محدودة. تم استخدام مستشعرات القوة الجزيئية القائمة على الحمض النووي والمعروفة باسم حبال مقياس التوتر (TGTs) لتحديد هذه التغييرات. تعتبر مجسات TGT فريدة من نوعها في قدرتها على تعديل عتبة القوة الأساسية والإبلاغ عن قوى مستقبلات مقياس بيكونوتون عبر سطح الخلية الملتصقة بالكامل بدقة مكانية محدودة الحيود . تعتمد مجسات TGT المستخدمة هنا على التفكك الذي لا رجعة فيه لدوبلكس الحمض النووي بواسطة قوى مستقبلات الروابط التي تولد إشارة فلورسنت. هذا يسمح بالقياس الكمي لتوتر الإنتغرين التراكمي (تاريخ القوة) للخلية. توضح هذه المقالة بروتوكولا يستخدم TGTs لدراسة تأثير EGFR على ميكانيكا الإنتغرين وتشكيل الالتصاق. يتم تفصيل تجميع منصة الاستشعار الميكانيكية TGT بشكل منهجي ويتم تحديد الإجراء الخاص بقوى الصورة والالتصاقات البؤرية وانتشار الخلايا. بشكل عام ، فإن القدرة على تعديل عتبة القوة الأساسية للمسبار ، ورباط الالتصاق ، ونوع وتركيز عامل النمو المستخدم في التحفيز تجعل من هذا منصة قوية لدراسة تفاعل مستقبلات الغشاء المتنوعة في تنظيم القوى بوساطة التكامل.
Introduction
تتمتع الخلايا بالقدرة الجوهرية على استشعار القوى الميكانيكية وتوليدها والاستجابة لها ، مما يؤدي إلى تغييرات في النمط الظاهري الخلوي وإعادة تشكيل البيئة الدقيقة المحلية 1,2. تلعب القوى دورا حاسما في تنظيم العديد من جوانب سلوك الخلايا ، بما في ذلك الالتصاق والهجرة والانتشار والتمايز والتئام الجروح 3,4. يمكن أن تؤدي الانحرافات في التبادل الميكانيكي ثنائي الاتجاه بين الخلية والبيئة الدقيقة إلى حالات مرضية ، بما في ذلك السرطان5. تشارك العديد من مستقبلات الغشاء في الحفاظ على توازن مصفوفة الخلايا. من هذه ، فإن الإنتينجينات ومستقبلات عامل نمو البشرة (EGFR) لها تآزر قوي 6,7. تقليديا ، تنشئ integrins الرابط الميكانيكي بين البيئة الدقيقة والهيكل الخلوي داخل الخلايا بينما ينظم EGFR نمو الخلايا وانتشارها وبقائها على قيد الحياة 8,9. EGFR هو هدف علاجي مدروس للغاية ، يركز على التنظيم الخارجي لتسهيل الإشارات داخل الخلايا. تم إنشاء EGFR-integrin crosstalk وراثيا وكيميائيا حيويا لتنظيم تطور أمراض متعددة ، بما في ذلك السرطان10,11. في حين تشير الدراسات إلى وجود تفاعل EGFR-integrin ، تعزى النتائج إلى مسارات الإشارات بعيدا عن غشاء البلازما7،12،13،14. لا يزال تأثير EGFR ، أو عوامل النمو الأخرى ، على ميكانيكا الخلايا غير مستكشف إلى حد كبير ويرجع ذلك جزئيا إلى نقص الأدوات اللازمة لقياس القوى الخلوية ونتائج الإشارات. يكمن التحدي في تحديد الأدوات المناسبة لدراسة الاتصال بين نماذج الإشارات المتوازية هذه وتحديد مساهماتها المحددة في ميكانيكا الخلايا.
تم تطوير العديد من الأساليب لقياس القوى الناتجة عن مستقبلات التصاق الخلايا ، ويتم توجيه القارئ إلى مراجعات متعمقة لهذه التقنيات15,16. باختصار ، يعتمد الفحص المجهري لقوة الجر والكشف عن صفيف الأعمدة الدقيقة على تشوه الركيزة الأساسية لاستنتاج قوى نانونيوتن (nN) ، وهو ترتيب من حيث الحجم أكثر من قوى المستقبلات الفردية17,18. تقنيات الجزيء الواحد ، بما في ذلك AFM والملقط البصري ، حساسة لقوى البيكونوتون البروتين الواحد (pN) ولكنها تقيس مستقبلا واحدا فقط في كل مرة ولا تقدم دقة مكانية جيدة (أو أي). توفر مجسات التوتر الجزيئي القائمة على الحمض النووي ومجسات حبل مقياس التوتر (TGT) دقة قوة pN بدقة مكانية محدودة الحيود (أو أفضل) ، مما يمنحها دورا فريدا في دراسة قوى الخلية الواحدة19,20 من أنواع الخلايا المتنوعة ، بما في ذلك الخلايا الليفية والخلايا السرطانية والصفائح الدموية والخلايا المناعية21,22,23,24 . في حين أن مجسات التوتر الجزيئي تحتوي على عنصر "نابض" قابل للتمديد ، وهو مثالي للتصوير في الوقت الفعلي ، فإن تحقيقات TGT تتمزق بشكل لا رجعة فيه ، تاركة وراءها "تاريخ قوة" الفلورسنت. بالإضافة إلى ذلك ، تقوم TGTs بتعديل عتبة التوتر للركيزة الأساسية ؛ يمكن استخدام سلسلة من المجسات ذات التركيبات الكيميائية المماثلة ولكن قوى تمزق مختلفة ، أو تحمل التوتر (Ttol) ، لتحديد الحد الأدنى من التوتر المطلوب لتشكيل الالتصاق البؤري وانتشار الخلايا. تتكون مجسات TGT من شريطين متكاملين للحمض النووي ، أحدهما مثبت على السطح والآخر يقدم رابطا للخلية. إذا ربط مستقبل الرباط ومارس قوة أكبر من Ttol للمسبار ، فصل الخيوط. يتم تعريف Ttol على أنه القوة الثابتة اللازمة لتمزيق 50٪ من المجسات في فترة 2 ثانية في ظل ظروف مثالية. في تحقيقات TGT "الدورانية" ، يمكن فصل المبرد الموجود على الشريط العلوي عن الفلوروفور الموجود على الخيط السفلي. فقط عندما تمزق مسبار TGT ، على الأرجح بواسطة قوى أكبر من أو تساوي Ttol ، سيتم إنشاء إشارة فلورسنت. يمكن أيضا إصلاح مجسات TGT ، مما يسمح بسهولة التلاعب بالأنظمة البيولوجية واختبار ظروف متعددة. لهذه الأسباب ، تم استخدام تحقيقات TGT في هذا العمل.
تم استخدام مجسات TGT لدراسة كيفية تعديل التصاق الخلايا المعتمدة على التكامل والقوى الميكانيكية بواسطة EGFR21 المنشط. أسس هذا العمل EGFR ك "منظم ميكانيكي" ، وضبط منظمة الالتصاق البؤري وتوليد التوتر. بالإضافة إلى ذلك ، وجد أن تحفيز EGF أثر على توزيع ونضج الالتصاقات البؤرية وتعزيز انتشار الخلايا. يمكن استخدام هذا النهج في الدراسات المستقبلية للتحقيق في كيفية تأثير عوامل النمو على القوى الميكانيكية في تطور الورم وديناميكياته. في حين تم تأسيس دور EGFR-integrin crosstalk في تنظيم الانتقال الظهاري إلى الوسيط ، فإن دور القوى الميكانيكية في هذه العملية لا يزال غير مستكشف10.
هنا ، يتم تقديم بروتوكول مفصل لهذه التجارب يغطي توليف وتجميع 56 مسبارا من pN TGT ، وتوليد أسطح TGT على أغطية زجاجية ، وتطبيق خلايا Cos-7 على سطح TGT والتحفيز باستخدام EGF ، والتثبيت ، وتلطيخ الخلايا بالفيلويدين ، والجسم المضاد المضاد للباكسيلين ، وتألق الانعكاس الداخلي الكلي عالي الدقة (TIRF) والتصوير المجهري لتباين تداخل الانعكاس (RICM) ، وقياس كمية الصورة. هذا البروتوكول ، على الرغم من أنه مكتوب للتحقيق في تحفيز EGF لخلايا Cos-7 ، إلا أنه قابل للتكيف بسهولة مع العديد من التجارب القائمة على TGT. يمكن استبدال الأربطة المختلفة ، و Ttol ، وأنواع الخلايا ، ومعلمات التحفيز ، والبروتينات التي تحمل علامة التثبيت التالية ، والتحليل الكمي بسهولة ، مما يجعل هذا البروتوكول قويا ومفيدا على نطاق واسع.
Protocol
1. TGT أوليغونوكليوتيد إعداد
ملاحظة: تفاصيل تخليق مسبار أوليغونوكليوتيد موضحة هنا. يرجى ملاحظة أنه يمكن الاستعانة بمصادر خارجية لإجراء بعض التعديلات وخطوات التنقية من أجل التوليف المخصص.
- قم بتنشيط الأمين الأساسي للببتيد الحلقي [Arg-Gly-Asp-D-Phe-Lys(PEG-PEG)] مع رابط azide-NHS كما هو موضح من قبل Zhang et al22 عن طريق الخلط بنسبة 1: 1.5 (100: 150 nmoles) في حجم نهائي من 10 ميكرولتر ثنائي ميثيل فورماميد. أضف 0.1 ميكرولتر من قاعدة ثلاثي إيثيلامين العضوية واحتضنها لمدة 12 ساعة عند 4 درجات مئوية.
- قم بتنقية المنتج عن طريق HPLC ذو الطور العكسي باستخدام 0.1 M TEAA (المذيب A) و 100٪ acetonitrile (المذيب B) بمعدل تدفق 1 مل / دقيقة والحالة الأولية للمذيب B بنسبة 10٪ عند تدرج 0.5٪ / دقيقة. الجمع بين القمم المنبعثة (الامتصاص عند 203 نانومتر) والتحقق من ذلك عن طريق قياس الطيف الكتلي MALDI-TOF. المنتج هو cRGDfK-azide.
- لتوليد الخيط العلوي TGT ، اجمع بين cRGDfK-azide و alkyne-21-BHQ2 oligonucleotide (الخيط العلوي TGT: 5Hexynyl / GTGAAATACCGCAGGAGGGGG / 3BHQ_2) بنسبة 2: 1 ( ̂200 μM: 100 μM) في 100 ميكرولتر من 1x Phosphate Buffered Saline (PBS) مع 5 mM ascorbate الصوديوم و 0.1 μM Cu-THPTA مسبقة التشكيل. اسمح للتفاعل بالمتابعة لمدة لا تقل عن 4 ساعات في درجة حرارة الغرفة (RT) أو بين عشية وضحاها عند 4 درجات مئوية.
- قم بمعالجة الخليط من خلال جل التحلية P2 لإزالة الصبغة الزائدة والمنتجات الثانوية والمذيبات العضوية والكواشف غير المتفاعلة. قم بإعداد عمود جهاز الطرد المركزي مع 650 ميكرولتر من هلام P2 الرطب مسبقا عن طريق تدويره عند 18000 × g لمدة دقيقة واحدة. تخلص من السائل المتدفق وأضف خليط التفاعل. تدور مرة أخرى في 18000 × غرام لمدة 1 دقيقة وجمع التدفق من خلال. أحضر خليط التفاعل إلى حجم نهائي قدره 300 ميكرولتر بماء فائق النقاء.
ملاحظة: قم بترطيب جل P2 مسبقا بالماء لمدة 6 ساعات. - تنقية خليط التفاعل المملح عن طريق HPLC الطور العكسي. تشمل المذيبات العضوية المستخدمة في هذا التنقية 0.1 M TEAA في H2O (المذيب A) و 100٪ MeCN (المذيب B ، أو المرحلة المتنقلة).
- قبل حقن الخليط ، قم بموازنة العمود بحالة أولية من 10٪ من المذيب B مع تدرج 1٪ / دقيقة. اضبط معدل التدفق على 1 مل / دقيقة. حقن خليط التفاعل في حلقة HPLC بإبرة حقن 500 ميكرولتر.
- اجمع المنتج عن طريق تصور ذروة الامتصاص عند 260 نانومتر للحمض النووي و 560 نانومتر لكوينشر BHQ2. جفف المنتج المطفأ طوال الليل في مكثف طرد مركزي فراغي.
- استخدم الاستبدال النووي لزوج من الشريط السفلي TGT إلى استر Cy3B-NHS كما هو موضح في Ma et. ال25. امزج 100 ميكرومتر من الشريط السفلي 56 pN TGT (5Biosg / TTTTTT / iUniAmM / CGCATCTGTGCGTATTTCACTTT) مع 50 ميكروغرام من استر Cy3B-NHS المذاب مسبقا في 10 ميكرولتر من DMSO. اضبط الرقم الهيدروجيني لهذا الخليط إلى 9 مع 0.1 M بيكربونات الصوديوم واجعل الحجم النهائي إلى 100 ميكرولتر مع 1x PBS. احتضان خليط التفاعل بين عشية وضحاها في RT.
- قم بتنقية الخليط بالتتابع باستخدام ترشيح هلام P2 و HPLC للمرحلة العكسية لفصل الكواشف والأملاح والمذيبات العضوية غير المتفاعلة (الموضحة في الخطوتين 1.4 و 1.5).
- تقدير تركيز مترافقات صبغة الأوليغنوكليوتيدات النقية عن طريق تسجيل امتصاصها عند 260 نانومتر باستخدام مقياس الطيف الضوئي.
- توصيف المنتجات النقية بواسطة مطياف الكتلة MALDI-TOF. قم بإذابة حمض 3-hydroxypicolinic الزائد في مذيب TA50 (50:50 v / v acetonitrile و 0.1٪ TFA في ddH2O) لإعداد مصفوفة MALDI الطازجة. الأوزان الجزيئية المقدرة والمقاسة للمنتجات الموسومة هي: cRGDfK-1-BHQ2 - 8157.9 (محسوبة) ، 8160.1 (تم العثور عليها) ؛ Cy3B المسمى 56 pN TGT - 10272.7 (محسوب) ، 10295.8 (تم العثور عليه).
- قم بإذابة الخيوط العلوية والسفلية بشكل منفصل في الماء الخالي من النوكليز بتركيز يتراوح بين 30-50 ميكرومتر. يخزن عند 4 درجات مئوية للتطبيقات قصيرة الأجل أو -20 درجة مئوية للتطبيقات طويلة الأجل. لا يتأثر استقرار الأوليغنوكليوتيدات بدورات التجميد والذوبان المتكررة.
2. إعداد السطح
اليوم 1:
- ضع أغطية زجاجية مقاس 25 مم (حتى 8) في حامل متعدد التترافلورو إيثيلين. ضع الرف في كوب بورسليكات سعة 50 مل يحتوي على 40 مل من 200 إيثانول مقاوم. قم بتغطية الكأس بفيلم البارافين لتجنب دخول الماء وصوتنة بتردد تشغيل 35 كيلو هرتز لمدة 10-15 دقيقة في RT (الشكل 1A).
- املأ دورقا سعة 50 مل ب 40 مل من محلول البيرانا المحضر حديثا عن طريق خلط حمض الكبريتيك وبيروكسيد الهيدروجين بنسبة 3: 1 في كوب بايركس. يحرك المزيج بماصة زجاجية. انقل رف الغطاء إلى الكأس واحتضنه لمدة 30 دقيقة في RT في غطاء الدخان لحفر سطح الغطاء (الشكل 1B).
ملاحظة: ارتد معدات الوقاية الشخصية الكاملة، بما في ذلك معطف المختبر والقفازات والنظارات الواقية، واعمل في غطاء الدخان الكيميائي. أضف بيروكسيد الهيدروجين إلى الحمض ببطء لمنع ارتفاع درجة حرارة المحلول. - بعد الحفر ، استخدم الملقط لنقل رف الغطاء إلى كوب بماء فائق النقاء. كرر هذه الخطوة ست مرات على فترات 15 ثانية لتحييد الحمض تماما (الشكل 1C).
ملاحظة: اترك محلول البيرانا في غطاء الدخان الكيميائي طوال الليل قبل التخلص منه في حاوية النفايات الحمضية. - افحص الأغطية بصريا للتأكد من أن الأسطح تبدو نظيفة بدون أنماط أو جزيئات غبار على السطح الزجاجي. كرر الخطوات من 2.1 إلى 2.4 في حالة اكتشاف أنماط أو غبار.
ملاحظة: اختبر المحبة للماء السطحي عن طريق غمس الأغطية المعالجة في الماء وإزالتها عموديا. تنحسر المياه الموجودة على الأغطية المعالجة كورقة موحدة لتشكيل حلقات يونغ مقارنة بأغطية الغطاء غير المعالجة التي تشكل بقع. - انقل رف الغطاء إلى كوب به 200 إيثانول مقاوم للإيثانول واغسله مرتين لمدة 15 ثانية لموازنة الأسطح مع المذيبات العضوية. انقل رف الغطاء إلى محلول إيثانول مقاوم ل 200 مع APTES بنسبة 3٪ لمدة 1 ساعة في RT لإضفاء الطابع الصيني على الأغطية (الشكل 1D). تغطية الكأس مع فيلم البارافين.
ملاحظة: تختلف معلمات ترسيب APTES اعتمادا على طريقة تنظيف السطح ومحتوى الماء المذيب وتركيز APTES وأوقات الحضانة ودرجة حرارة التلدين. - اغمر الرف في كوب نظيف مع محلول إيثانول مقاوم ل 200. كرر هذا الغسيل ثلاث مرات لمدة 15 ثانية لكل منهما (الشكل 1E).
- جفف الأغطية باستخدام غاز النيتروجين (N2) مع ضغط خروج منخفض. ضع الأغطية في طبق بوليسترين 10 سم مع قطعة من فيلم البارافين موضوعة بشكل مسطح بداخله. تأكد من أن الأغطية جافة ومفصولة (الشكل 1F).
- أضف 100 ميكرولتر من محلول NHS-biotin 2 mg / mL في DMSO إلى أربعة أغطية موضوعة على فيلم البارافين. ضع "ساندويتش" مع الأغطية الأربعة الأخرى في الأعلى (اثنان من أغطية الغطاء يواجهان بعضهما البعض مع حل التشغيل بينهما) واحتضن الطبق بين عشية وضحاها عند 4 درجات مئوية (الشكل 1G).
ملاحظة: عند 4 درجات مئوية ، يكون كاشف NHS أكثر استقرارا ، مما يسهل تشغيل السطح الموحد. بالإضافة إلى ذلك ، يحافظ الساندويتش على الكواشف. تجنب إضافة محلول زائد في الساندويتش لأنه قد يتسرب ويتسبب في انزلاق الغطاء.
اليوم 2:
- أخرج الطبق من 4 درجات مئوية وافصل الأغطية المنحوتة. قم بتوجيه الانزلاقات في الحامل بحيث يواجه السطح المطلي بعضها البعض كما هو موضح في الشكل 2A. اغسلها بمحلول الإيثانول 200 ثلاث مرات لمدة 15 ثانية لكل منهما. تجف مع غاز N2 ووضعها في طبق جديد مع فيلم البارافين داخله.
ملاحظة: يساعد توجيه الأغطية كما هو موضح في تحديد السطح الوظيفي. - اغسل الأغطية ب 1 مل من 1x PBS ثلاث مرات لموازنتها مرة أخرى إلى المرحلة المائية. أضف 800 ميكرولتر من ألبومين مصل البقر بنسبة 0.1٪ (BSA) في 1x PBS (w / v) إلى كل من الأغطية واحتضنها في RT لمدة 30 دقيقة لتخميل السطح ومنع الارتباط غير المحدد لكواشف الوظيفية اللاحقة (الشكل 2B).
- بعد الحضانة ، اغسل الغطاء ثلاث مرات باستخدام 1 مل من 1x PBS. أضف 800 ميكرولتر من 1 ميكروغرام / مل من الستربتافيدين في 1x PBS في RT لمدة 45-60 دقيقة لتشغيل الأغطية (الشكل 2C).
ملاحظة: احتفظ بغطاء واحد بدون ستربتافيدين للتحقق من كفاءة التخميل (اختياري). إضافة 10 نانومتر جزيئات البيوتينيل والصورة باستخدام الظروف التجريبية. يجب أن تكون كثافة السطح هذه قريبة من الضوضاء المظلمة للكاميرا. - بالتزامن مع الخطوة 2.11 ، قم بتجميع مجسات TGT (أعلى: الخيط السفلي بنسبة مولية 1: 1) بتركيز نهائي قدره 50 نانومتر في 100 ميكرولتر من 1 M NaCl في أنبوب PCR باستخدام جهاز تدوير حراري. افصل الخيوط عند 95 درجة مئوية لمدة 5 دقائق ، وصلب تدريجيا عن طريق خفض درجة الحرارة إلى 25 درجة مئوية والحفاظ عليها لمدة 25 دقيقة (الشكل 2D). تجنب التعرض المطول لمجسات TGT للضوء.
- بعد حضانة الستربتافيدين ، استخدم 1x PBS لغسل الغطاء ثلاث مرات. أضف 100 ميكرولتر من مجسات TGT المجمعة مسبقا إلى أربعة من أغطية الغطاء واصنع السندويشات باستخدام 4 أغطية متبقية مع الجانب الوظيفي الذي يواجه المجسات (تتطلب ثمانية أسطح أربعة أنابيب من مجسات TGT الهجينة). قم بتغطيتها بورق الألومنيوم واحتضنها لمدة 1 ساعة في RT للسماح بربط المسبار بالسطح (الشكل 2E).
- بعد الحضانة ، افصل السندويشات واغسل الأغطية باستخدام 1x PBS ثلاث مرات. أسطح TGT جاهزة الآن للتصوير. قم بتجميع أغطية الغطاء بعناية في غرف تصوير نظيفة مسبقا وأضف 1x PBS للحفاظ على رطوبة الأسطح (الشكل 2F).
ملاحظة: الإفراط في تشديد الغرف سيؤدي إلى تكسير السطح. منع تجفيف الأسطح.
3. إعداد الخلايا وتلطيخ
- للتحقيق في تأثير تحفيز عامل نمو البشرة (EGF) على ميكانيكا Cos-7 ، والالتصاق ، وانتشار الخلايا ، التربسين Cos-7 مع 0.05 ٪ Trypsin-EDTA لمدة 2 دقيقة. قم بتحييد التربسين عن طريق الغسيل باستخدام HBSS والطرد المركزي عند 800 × g لمدة 5 دقائق. كرر خطوة التحييد مرة أخرى.
- خلايا صفيحة بكثافة 4 × 104 خلايا على أسطح TGT المجمعة في وسط النسر المعدل (DMEM) من Dulbecco مع 50 نانوغرام / مل EGF أو DMEM بدون EGF. اسمح للخلايا بالانتشار لمدة 60 دقيقة عند 37 درجة مئوية مع 5٪ CO2 في حاضنة زراعة الخلايا (الشكل 3A).
ملاحظة: يتم احتضان الخلايا في DMEM بدون مصل لتجنب التحفيز من عوامل النمو. يتم تخفيف EGF في 10 mM حمض الخليك لجعل مخزون من 1 ملغ / مل. يتم استخدامه عند 50 نانوغرام / مل في DMEM لتجارب التصوير. - بعد الحضانة ، اغسل الخلايا ثلاث مرات باستخدام 1x PBS وقم بإصلاحها ب 2 مل من 4٪ paraformaldehyde لمدة 12 دقيقة في RT (الشكل 3B).
ملاحظة: يتم تنفيذ جميع خطوات الحضانة على شاكر دوار عند ~ 35 دورة في الدقيقة لنشر موحد للحلول. قم بحماية أسطح TGT من الضوء عن طريق تغطيتها حتى تصبح جاهزة للتصوير. - قم بشفط المثبت واغسل الأغطية خمس مرات باستخدام 1x PBS على فترات 5 دقائق في RT. اختياريا ، احتضن الأغطية مع 50 mM NH4Cl في 1x PBS لمدة 30 دقيقة عند 37 درجة مئوية لإخماد التألق الذاتي المرتبط بالبارافورمالديهايد وغسله ثلاث مرات باستخدام 1x PBS على فترات زمنية مدتها 5 دقائق (الشكل 3B).
- أضف المخزن المؤقت A (1x PBS ، مصل الحصان العادي 5٪ ، مصل الماعز العادي 5٪ ، 1٪ BSA ، 0.025٪ Triton X-100) واحتضن لمدة 30 دقيقة عند 37 درجة مئوية لمنع الخلايا واختراقها. يغسل ثلاث مرات باستخدام 1x PBS على فترات 5 دقائق (الشكل 3B).
- ضع غرف التصوير مع أغطية في حاوية الرطوبة. قم بتخفيف الجسم المضاد الأساسي المضاد للباكسيلين (علامة الالتصاق البؤري) في الساعة 1:250 في المخزن المؤقت المانع (1x PBS ، مصل الحصان العادي 5٪ ، مصل الماعز الطبيعي 5٪ ، 1٪ BSA ، 0.005٪ Triton x-100). احتضان مع 200 ميكرولتر من محلول الأجسام المضادة الأولية لكل غطاء لمدة 2 ساعة عند 37 درجة مئوية (الشكل 3B).
ملاحظة: لا تدع الأسطح تجف. - اغسل أغطية الغطاء خمس مرات باستخدام 1x PBS على فترات 5 دقائق وأعدها إلى حاوية الرطوبة. خلايا التسمية في وقت واحد مع مزيج من صبغة الماعز المترافقة المضادة للأرانب الأجسام المضادة الثانوية في 1:800 تخفيف وصبغ phalloidin المترافق (الأكتين) في 1:400 تخفيف في 200 ميكرولتر من المخزن المؤقت منع لكل غطاء. احتضان في 37 درجة مئوية لمدة 60 دقيقة (الشكل 3B).
- اغسل الأسطح خمس مرات باستخدام 1x PBS على فترات زمنية مدتها 5 دقائق وخزنها على درجة حرارة 4 درجات مئوية حتى تصبح جاهزة للتصوير (الشكل 3B).
ملاحظة: عينات الصور في غضون 3 أيام من إعداد السطح لتجنب تدهور الإشارة.
4. الحصول على الصور
- استخدم هدف غمر الزيت 60x مع فتحة عدسة رقمية عالية (1.49) على مجهر مقلوب مع إثارة 488 و 561 و 647 TIRF وإثارة RICM ونظام تركيز بؤري مثالي وكاميرا رقمية.
- أضف الزيت إلى الهدف ، ونظف الجزء السفلي من غرفة العينة ، وضع العينة على المسرح. ركز على الخلية وشارك في التركيز المثالي.
- ضع المجهر في وضع التصوير RICM مع إثارة التألق ومكعب مرشح GFP مع إزالة مرشح الانبعاثات. قم بمحاذاة RICM عن طريق إغلاق وتوسيط الحجاب الحاجز لفتحة الإضاءة الفوقية.
- ضع المجهر في وضع TIRF مع إثارة الليزر ومكعب مرشح TIRF رباعي التمرير. ركز ليزر 488 نانومتر على بقعة صغيرة على سقف الغرفة وقم بزيادة زاوية الحدوث حتى تجاوز الزاوية الحرجة أثناء مراقبة التألق على الكاميرا في الوضع المباشر. لاحظ انخفاضا حادا في التألق في الخلفية ومستوى تركيز بؤري واحد عند تجاوز الزاوية الحرجة.
ملاحظة: يثير TIRF منطقة رقيقة (~ 100 نانومتر) أقرب إلى واجهة غطاء العينة التي تسلط الضوء على مجسات TGT المفتوحة والالتصاقات البؤرية مع القضاء على التألق خارج التركيز البؤري من داخل الخلية. إذا لم يكن TIRF متاحا ، يمكن استخدام التألق epi-fluorescence ؛ ومع ذلك ، ستكون نسب الإشارة إلى الضوضاء أقل. - حدد الخلايا للتصوير باستخدام الوضع "المباشر" للكاميرا باستخدام RICM.
- احصل على صورة RICM وصور TIRF للأكتين (640 نانومتر سابقا) ، وتوتر الإنتيغرين (561 نانومتر سابقا) ، والباكسيلين (488 نانومتر سابقا). احصل على الصور بالتتابع باستخدام وقت تعريض ضوئي يبلغ 200 مللي ثانية.
ملاحظة: يعتمد وقت التعرض للضوء على العديد من العوامل، بما في ذلك الهدف وطاقة الليزر ومرشحات الانبعاثات وحساسية الكاميرا. يجب أن تكون الإشارة أكبر 2 مرة على الأقل من الخلفية. الخلفية حوالي 1000 وحدة فلكية لذلك يجب أن تكون الإشارة 2000-3000 وحدة فلكية على الأقل. - كرر 4.4-4.5 لمدة 30 خلية على الأقل. تغيير الأغطية والتركيز البؤري والتكرار 4.4-4.5.
5. تحليل البيانات
ملاحظة: إجراء تحليل كمي للصور باستخدام برنامج فيجي والتحليل باستخدام برنامج الإحصاءات.
- افتح مجموعة الصور لخلية واحدة.
- قم بإنشاء قناع لمنطقة الخلية (قناع RICM) عن طريق تتبع حدود الخلية في صورة RICM باستخدام أداة التحديد ImageJ Freehand. احفظ المنطقة ذات الأهمية (ROI) لمدير عائد الاستثمار (تحليل أدوات > > مدير عائد الاستثمار) (الشكل 4A1,2).
- اختر منطقة تمثيلية خارج الخلية في صورة توتر integrin وارسم عائد استثمار لا يقل عن 200 × 200 بكسل. استبعاد أي خلايا أخرى أو حطام الفلورسنت من عائد الاستثمار. قم بقياس التألق الأساسي في عائد الاستثمار باستخدام أداة القياس (تحليل > القياس) (الشكل 4A3).
- اطرح متوسط تألق الخلفية الذي تم الحصول عليه في الخطوة 5.2 من صورة التوتر (عملية > الرياضيات > طرح) (الشكل 4A4).
- استخدم قناع RICM الذي تم إنشاؤه في الخطوة 5.2 لتحديد إشارة التوتر داخل بصمة الخلية (مدير عائد الاستثمار > حدد > تطبيق القناع > تحرير > مسح خارجي) (الشكل 4A5).
- قم بإنشاء قناع عتبة لصورة التوتر باستخدام طريقة هوانغ للعتبة التلقائية (الصورة > ضبط عتبة >) (الشكل 4A6). تأكد من أن قناع العتبة يمثل المنطقة بشكل أفضل لتوتر الإنتينجين المتولد. كقاعدة عامة ، اضبط العتبة على 2x متوسط تألق الخلفية.
- قم بإنشاء مجموعة مختارة من قناع التوتر العتبي (تحرير > تحديد > إنشاء) (الشكل 4A7).
- انقل القناع المحدد إلى صورة التوتر التي تم إنشاؤها في الخطوة 5.4 وقم بقياس الكثافة المتكاملة للمجسات المفتوحة (مدير عائد الاستثمار > Select (قناع التوتر) > تحليل > قياس > RawIntDen) (الشكل 4C).
- قم بقياس مساحة الخصائص المورفومترية للخلية ودائريتها ونسبة العرض إلى الارتفاع من قناع RICM (مدير عائد الاستثمار > حدد (قناع RICM) > تطبيق القناع > تحليل > القياس) (الشكل 4B).
- قم بقياس كثافة التمزق الميكانيكي ، والتي تعرف بأنها النسبة المئوية لبصمة الخلية مع المجسات الممزقة عن طريق تحديد صورة قناع التوتر وتطبيق قناع RICM (مدير عائد الاستثمار > Select (قناع RICM) > تحليل > قياس > ٪ مساحة) (الشكل 4C).
- تصدير القياسات لمزيد من التحليل والتصور إلى برامج الإحصاءات.
- كرر 5.1-5.11 لكل خلية.
النتائج
تم استخدام مجسات TGT الدوارة للتحقيق في تأثير مستقبلات عامل نمو البشرة المنشطة بالليغاند (EGFR) على ميكانيكا الخلايا بوساطة التكاملين وتكوين الالتصاق في خلايا Cos-721. تقدم المجسات الدورية Arg-Gly-Asp-Phe-Lys (cRGDfK)21,23,25,26 ، وهي انتقائية ل integrin heterodimer αVβ3 مع تقارب صغير فقط ل α5β1 integrins27,28,29,30. يتكون مسبار TGT من حمض نووي مزدوج يعمل على سطح زجاجي عبر الشريط السفلي باستخدام ربط البيوتين-ستربتافيدين. يعرض الشريط العلوي رباط الإنتغرين وهو متاح للارتباط بمستقبل إنتغرين المتماثل على غشاء الخلية (الشكل 5A). يتم وضع علامة على الشريط السفلي بفلوروفور والخيط العلوي بكوينشر ، مما يؤدي إلى الحد الأدنى من التألق في الخلفية عندما يكون TGT المزدوج سليما. إذا ربط الإنتينجين الرباط وطبق قوة ذات حجم أكبر من Ttol للمسبار ، فسوف ينفصل الحمض النووي المزدوج مما يؤدي إلى التألق (الشكل 5A). أي مسبار TGT لم يتم تمزيقه بواسطة قوة ميكانيكية سيبقى غير فلورسنت. يسمح هذا التألق الانتقائي للدوران برسم خرائط منهجية وكمية للقوى المتولدة عن التكامل على نطاق pN بدقة محدودة الحيود . بالإضافة إلى ذلك ، تقوم تحقيقات TGT بتعديل عتبة التوتر للركيزة.
يظهر هنا مثال تمثيلي لسطح TGTمع تول T من 56 pN. تم طلاء خلايا Cos-7 على سطح TGT هذا مع أو بدون تحفيز EGF لدراسة تأثير تنشيط EGFR مع تحفيز الليغاند على التصاق الخلايا وميكانيكا الإنتغرين (الشكل 5A ، B). تم احتضان الخلايا مع أو بدون EGF على أسطح TGT لمدة 60 دقيقة ، ثابتة ، وملطخة بالمناعة لعرض توزيع الالتصاق البؤري (paxillin) وتنظيم الهيكل الخلوي (F-actin) (الشكل 5B). ثم تم تصوير الخلايا باستخدام المجهر RICM و TIRF. كما رأينا بوضوح في صورة RICM ، تم تعزيز خلية Cos-7 المنتشرة على سطح 56 pN TGT بشكل كبير مع تحفيز EGF مقارنة بدون تحفيز. وقد تم تحديد ذلك كميا ل 50 خلية في كل حالة عن طريق قياس حجم منطقة ملامسة الركيزة الخلوية من صورة RICM (الشكل 5C). أدى التحفيز باستخدام EGF إلى مورفولوجيا أكثر دائرية ، تمثل خلايا Cos-7 تنتشر وتنمو في بيئتها الفسيولوجية الطبيعية (الشكل 5D). التألق من المجسات المفتوحة أعلى أيضا مع تحفيز EGF كما لوحظ في صورة التألق التوتر. كانت الكثافة المتكاملة للمجسات المفتوحة ، والتي تتناسب مع عدد المجسات المفتوحة ، أعلى بكثير مع تحفيز EGF مقارنة بدونها (الشكل 5B ، E). هذا هو تمثيل لجميع ارتباطات المستقبلات والروابط حيث تطبق التكاملات قوة أكبر من Ttol (56 pN).
أظهر التلطيخ بالباكسيلين أن توزيع وعدد ونضج (حجم) وتنظيم الالتصاقات البؤرية قد تأثرت أيضا بتحفيز EGF. بدت الالتصاقات البؤرية في الخلايا المحفزة EGF أكثر نضجا وموجهة شعاعيا مقارنة بعدم وجود ضوابط EGF. كما تم تعزيز تنظيم الهيكل الخلوي F-actin بتحفيز EGF ، كما تم تقييمه بواسطة تلطيخ الفيلويدين (الشكل 5B). تم إجراء هذه التقييمات النوعية من خلال المقارنة البصرية للصور من كلتا المجموعتين العلاجيتين. يمكن إجراء التحليل الكمي للالتصاق البؤري ولكنه خارج نطاق هذا البروتوكول. في هذه التجربة ، وفر سطح TGT منصة لتفصيل تأثير تنشيط EGFR بشكل منهجي على انتشار الخلايا ، وميكانيكا الإنتغرين ، وتكوين الالتصاق البؤري.
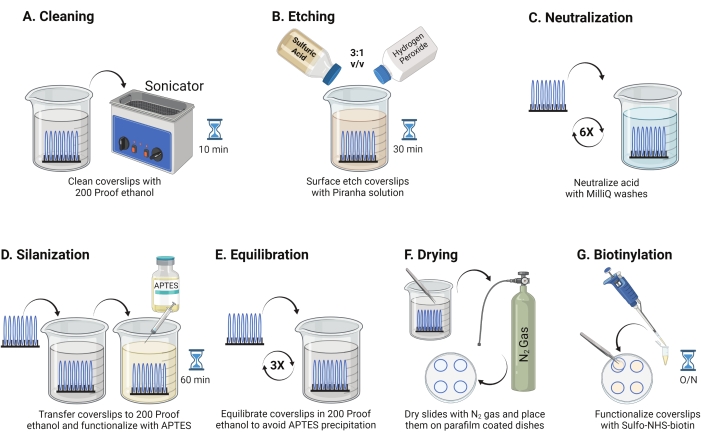
الشكل 1: مخطط لليوم 1 من إعداد سطح TGT. (أ) تنظيف الأغطية. (ب) حفر سطح الغطاء. (ج) تحييد حل البيرانا. (د) تسييل السطح لصنع مجموعات أمين تفاعلية. (ه) موازنة الأغطية مع المرحلة العضوية. (و) تجفيف الأغطية بغاز خامل. (ز) بيوتاينيلات مجموعات الأمين السطحية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
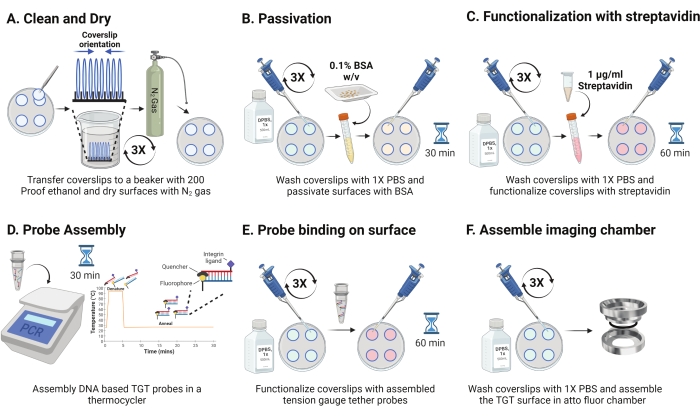
الشكل 2: مخطط لليوم 2 من إعداد سطح TGT. (أ) تنظيف وتجفيف الأغطية لإزالة أي بيوتين متبقي من اليوم السابق. (ب) التخميل مع BSA لمنع الربط غير المحدد للكاشف في الخطوات اللاحقة. (ج) تشغيل الأغطية باستخدام الستربتافيدين. (د) تهجين المجسات في دورة حرارية. (ه) تطبيق المجسات المركبة على الأغطية (F) تجميع الغطاء في غرفة تصوير الخلية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
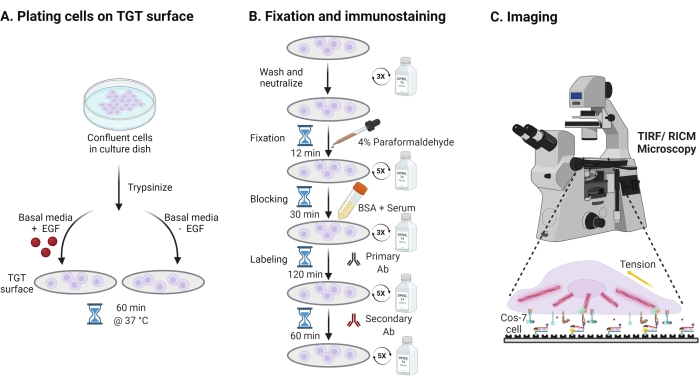
الشكل 3: سير عمل عام يسلط الضوء على الخطوات الواسعة عبر الإعداد التجريبي بأكمله . (أ) عملية انفصال الخلايا والطلاء على سطح TGT في الوسائط القاعدية (DMEM) مع أو بدون تحفيز EGF. (ب) مخطط انسيابي للخطوات التي ينطوي عليها التثبيت والتلطيخ المناعي بعد التعلق والانتشار على سطح TGT. (ج) بعد التلطيخ ، يتم تصوير الخلايا على مجهر فلوري مقلوب باستخدام مجهر RICM و TIRF. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
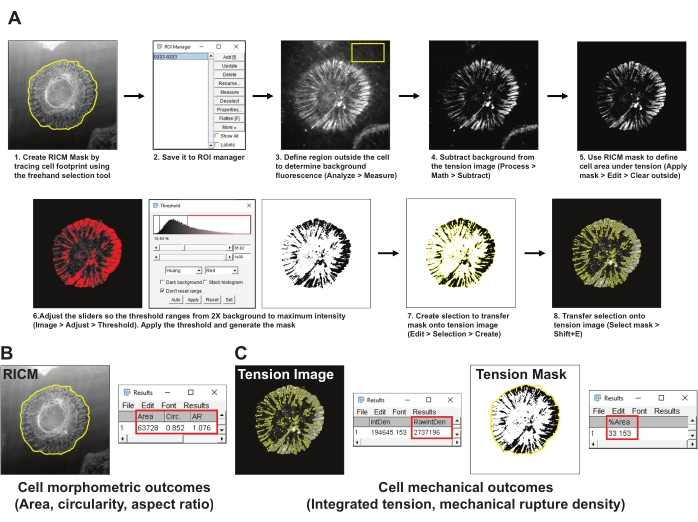
الشكل 4: مثال على معالجة البيانات والتحليل الكمي . (أ) التقسيم التدريجي لخط أنابيب التحليل المستخدم في فيجي (ImageJ) لقياس كمية صور التوتر و RICM. (ب) مثال تمثيلي للنتائج المورفومترية الخلوية التي تم تحليلها باستخدام خط الأنابيب أعلاه. (ج) أمثلة تمثيلية للنتائج الميكانيكية للخلايا التي تم تحليلها باستخدام خط الأنابيب المذكور أعلاه. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
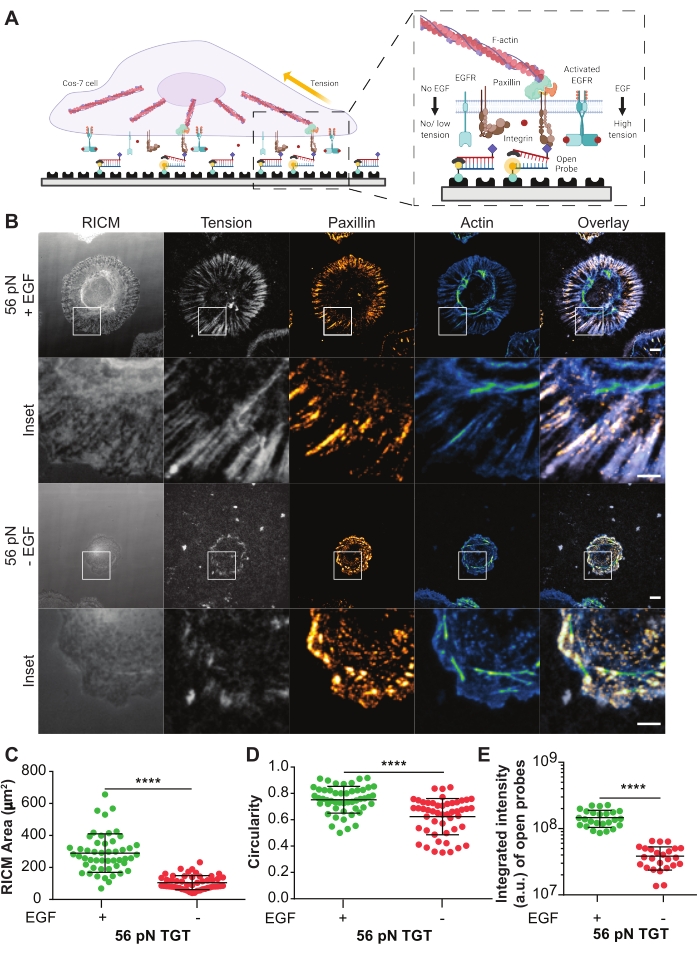
الشكل 5: مثال على البيانات من تجربة TGT. (A) رسم بياني يسلط الضوء على منطقة التلامس في واجهة سطح غشاء الخلية - TGT. تتكامل المشاريع الداخلية مع الدمج مع cRGDfK المرتبط ب cognate مع تحفيز EGF (يمين) أو بدون (يسار). (ب) صور RICM و TIRF لخلايا Cos-7 المنتشرة على سطح 56 pN TGT. يتم الحصول على الصور بعد 60 دقيقة من الطلاء مع أو بدون تحفيز EGF. يتم عرض صور RICM الفردية (كما تم الحصول عليها) ، وتوتر integrin (تدرج رمادي) ، و paxillin (برتقالي ساخن) ، و F-actin (أزرق-أخضر) مع تراكبات لكلا الحالتين التحفيزيتين. شريط المقياس: 10 ميكرومتر. يسلط الجزء الداخلي الضوء على عائد استثمار مكبر (منطقة الاهتمام) يوضح بالتفصيل التوطين المشترك لتوتر الإنتيغرين المتولد في مواقع تكوين الالتصاق التي تتميز بالباكسيلين ، والتنظيم الخلوي الهيكلي تحت الخلوي الأساسي الذي يتميز بالأكتين. شريط المقياس: 5 ميكرومتر. (ج-هاء) مخططات مبعثرة لمنطقة الانتشار (بصمة خلية RICM) (C) ، والدورة الدموية (D) ، والتوتر المتكامل (E) لخلايا Cos-7 مع أو بدون تحفيز EGF. تشير الأشرطة إلى متوسط ± s.d. تم تقييم الاختلافات بين المجموعات إحصائيا باستخدام اختبار t للطالب. P < 0.0001. n = 50 خلية عبر ثلاث تجارب مستقلة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
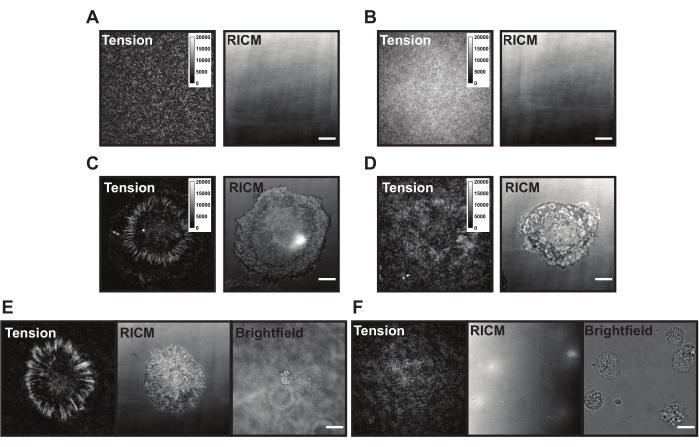
الشكل 6: مثال على أسطح TGT ذات المشاكل المحتملة المختلفة. (أ) صور التوتر و RICM لسطح TGT مثالي مع مسبار مجمع يتم إخماده قبل التصاق الخلية. (ب) صور التوتر و RICM لسطح TGT حيث يفتقر مسبار TGT إلى الشريط العلوي (quencher). تظهر صورة التوتر تألقا موحدا من الفلوروفور المفتوح في الشريط السفلي. (ج) صور التوتر و RICM للخلايا المنتشرة على سطح TGT مثالي. (د) صور التوتر و RICM للخلايا المنتشرة على سطح TGT ضعيف الصنع مع تخميل محدود أو مسبار متدهور. (ه) تعد صور التوتر و RICM و brightfield للخلايا المطلية على سطح مثالي مع رباط cRGDfK الذي يشير إلى تفاعلات cRGDfK-integrin أمرا حيويا لربط الخلايا وتوليد التوتر. (F) صور التوتر و RICM و brightfield للخلايا المطلية على سطح بدون رباط cRGDfK على TGT. في حين أن الخلايا مرئية في الصورة الساطعة ، لا يلاحظ أي مرفق خلية أو توتر integrin المتولد. شريط المقياس: 10 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
من خلال الإجراء التفصيلي خطوة بخطوة الموضح أعلاه ، يمكن للمرء إعداد أسطح TGT لقياس مورفولوجيا الخلية وتوتر الإنتينجين الناتج عن الخلايا الملتصقة أثناء تعلق الخلية وانتشارها بعد العلاج باستخدام EGF. وفر تصميم المسبار المباشر وتوليفه وإعداده السطحي إلى جانب الإعداد التجريبي البسيط منصة مستقرة لدراسة تفاعل EGFR و integrins. بشكل عام ، تؤكد النتائج أن التنشيط المعتمد على الرباط ل EGFR يعزز انتشار الخلايا ، ويضبط الخصائص الحاملة للقوة لمستقبلات الإنتينجين ، ويعزز تنظيم الالتصاق البؤري والنضج. تدعم النتائج التي تم الحصول عليها باستخدام مجسات TGT الفرضية الشاملة القائلة بأن عوامل النمو ، مثل EGFR ، تعمل ك "منظمي ميكانيكي" ، مما يزيد من كمية توتر الإنتينجين وتنظيمه المكاني وينظم اتجاه وميكانيكا الالتصاقات البؤرية.
عند التطبيق على سطح TGT ، تهبط الخلايا وتعلق وتنتشر مع استشعار مستقبلات الإنتينجين (αVβ3) وارتباطها برباط cRGDfK. وبذلك يمكن تمزيق مجسات TGT ميكانيكيا، مما يولد تألقا في موقع اشتباك الليغاند. القراءة هي "تاريخ القوة" التراكمي للخلية المتفاعلة مع السطح. هناك بعض المشكلات الشائعة في أسطح TGT التي يمكن أن تكون موجودة أثناء هذه التجارب. قد يكون التألق العالي في الخلفية السطحية (الشكل 6A ، B) ، والمظهر السطحي غير المكتمل ، وفشل الخلايا في توليد إشارة التوتر (الشكل 6C ، D) ، وفشل الخلايا في الانتشار (الشكل 6E ، F) بسبب أوجه القصور التقنية في مسبار TGT أو التوليف السطحي. وترد في الجدول 1 حلول لهذه المسائل المشتركة.
يوفر التصميم المباشر لمجسات TGT لعلماء الأحياء الخلوية أداة قوية لدراسة نتائج إشارات محددة لعامل النمو بمعزل عن غيرها دون تدخل من مستقبلات سطح الخلية الأخرى من خلال توفير روابط ومحفزات محددة فقط. بالإضافة إلى ذلك ، تسمح تحقيقات TGT بالتحقيق في عتبة التوتر التي تؤكد على مستقبلات الإنتغرين الفردية أثناء التصاق الخلايا عند حساسية pN. تفشل النهج البديلة في الإبلاغ عن القوى التي تمارسها المستقبلات الفردية ذات الدقة المكانية العالية في العينات الثابتة31. الفحص المجهري لقوة الجر حساس فقط لقوى nN ، وهو ترتيب من حيث الحجم أعلى من القوى التي تطبقها مستقبلات integrin الفردية15 ، وتقوم مجسات التوتر الجزيئي بقياس قوى pN ، ولكن لأنها قابلة للانعكاس ، فإنها لا تتحمل التثبيت بقوة. لهذه الأسباب ، تعد مجسات TGT أداة جذابة لدراسة آليات تفاعلات عامل النمو و integrin.
هناك العديد من الفروق الدقيقة التقنية المرتبطة بتحقيقات TGT التي يجب مراعاتها قبل تصميم التجربة. صورة التوتر هي لقطة في الوقت المناسب ، تمثل تاريخ القوة وليست مؤشرا على اشتباكات مستقبلات الرباط في أي وقت من الأوقات. نظرا لأن توليد الإشارة يعتمد على فصل المسبار ، فإن التألق TGT ينتج عن مجسات مفتوحة لا تتعرض للتوتر النشط من تفاعل مستقبلات الرباط. وهذا يعني أن قراءة توتر الإنتينجين الذي تم الحصول عليه على سطح TGT تاريخية وتراكمية بطبيعتها تمثل المكان الذي كانت فيه قوى أكبر من Ttol. لم يتم الإبلاغ عن مواقع قوى رباط المستقبلات الحالية الأقل من Ttol 19,32. نظرا لأن تمزق TGT يؤدي إلى إنهاء ارتباط رباط المستقبلات ، فإن انتشار الخلايا يرجع إلى تفاعلات integrin-ligand التي تواجه قوى أقل من Ttol. لذلك يجب على المستخدم توخي الحذر عند تحديد وقت ما بعد الطلاء لتقدير النتائج الميكانيكية المرتبطة بالالتصاقات القائمة على التكامل. أخيرا ، يجب النظر في معنى Ttol. تحتوي مجسات TGT المستخدمة هنا على T tol من 56 pN ، حيث Ttol هي القوة الثابتة اللازمة لتمزيق 50٪ من المجسات عند تطبيقها على 2 s. عند النظر في الأنظمة البيولوجية المعقدة ، من المحتمل أن تواجه TGTs تدرجا غير متجانس ومتنوع للقوة مع تبعيات زمنية متفاوتة. إذا تم تمزيق TGTs بواسطة قوى أكبر من Ttol ، فإن التألق سيكون أقل من شأن التوتر الكلي. بدلا من ذلك ، يمكن للقوى الأقل من Ttol المطبقة لفترات أطول أن تمزق عددا مشابها من المسابير مثل قوى العتبة العالية المطبقة لأوقات أقصر. قد يؤدي كلا السيناريوهين إلى نفس قراءة شدة التألق ، مما يجعل من الصعب حل حجم التوتر الدقيق أو الديناميكيات باستخدام تحقيقات TGT33,34.
بشكل عام ، يجب إجراء تقييمات لتوتر الإنتينجين مع تحفيز عامل النمو بعناية من خلال تصميم تجارب مع الضوابط الداخلية ، ومقارنة ملامح الانتشار على الأسطح الأخرى المغلفة بالمصفوفة ، وإجراء تقييمات متوازية لتألق TGT في الخلايا في وجود أو عدم وجود تحفيز عامل النمو ، واستخدام TGTs مع مختلف Ttol . تسمح TGTs بتحديد حجم دور إشارات عامل النمو في تنظيم ميكانيكا مستقبلات الإنتغرين ، وديناميكيات الالتصاق البؤري ، وانتشار الخلايا. يمكن استخدام هذا البروتوكول كقالب للعديد من التجارب المستندة إلى TGT باستخدام مجساتذات تول T مختلفة أو روابط مختلفة أو أنواع خلايا مختلفة أو ظروف تحفيز مختلفة. يمكن تصنيف أي بروتينات ذات أهمية بعد التثبيت ، ويمكن تنفيذ أي نوع من التحليل الكمي للصور. على هذا النحو ، نقدم نموذجا للعديد من تجارب TGT.
لا يقتصر استخدام مجسات TGT على دراسة الإنتيجينز ولكن يمكن توسيعه إلى مجموعة متنوعة من مستقبلات غشاء الخلايا عبر أنواع مختلفة من الخلايا عن طريق تعديل الليكاند. تم استخدام مجسات TGT للتحقيق في دور القوى في تنظيم سلاسل إشارات المستقبلات المختلفة ، بما في ذلك تحديد الدور الميكانيكي لميكانيكا مستقبلات Notch في التطور الجنيني وتكوين الخلايا العصبية35 ، والقوى التي تتوسط في تحديد واستيعاب المستضدات بواسطة مستقبلات الخلايا البائية 36 ، والقدرة الميكانيكية على التدقيق اللغوي لمستقبلات سطح الخلايا التائية للكشف عن التغيرات في القوى لتعزيز قوة وخصوصية نقل الإشارة37 . معا ، تسلط هذه النتائج الضوء على الإمكانات الهائلة لتحقيقات TGT في مجموعة متنوعة من الإعدادات التجريبية.
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
يود المؤلفون أن يعربوا عن تقديرهم لأعضاء مختبر Mattheyses للمناقشات والانتقادات المثمرة. نحن نقر بتمويل A.L.M. من NSF CAREER 1832100 و NIH R01GM131099.
Materials
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl)triethoxysilane | Millipore Sigma | 440140 | Surface Preparation |
| 3-hydroxypicolinic acid (3-HPA) | Millipore Sigma | 56197 | Maldi-TOF-MS matrix |
| Acetic Acid, Glacial | Fisher Scientific | A38S | Diluting EGF |
| Acetonitrile (HPLC) | Fisher Scientific | A998SK | Oligonucleotide Preparation |
| Alexa Fluor 488 Phalloidin | Cell Signaling Technology | 8878S | Immunocytochemistry |
| Ammonium Chloride | Fisher Scientific | A687 | Immunocytochemistry |
| Anti-Paxillin antibody [Y113] | Abcam | ab32084 | Immunocytochemistry |
| BD Syringes only with Luer-Lok | BD bioscience | 309657 | Surface Preparation |
| Bio-Gel P-2 | Bio-Rad | 1504118 | Oligonucleotide Preparation |
| Bovine Serum Albumin (BSA) Protease-free Powder | Fisher Scientific | BP9703100 | Surface Preparation |
| Cos-7 cells | ATCC | CRL-1651 | Cell Culture, Passage numbers 11-20 |
| Coverslip Mini-Rack, for 8 coverslips | Fisher Scientific | C14784 | Surface Preparation |
| c(RGDfK(PEG-PEG)), PEG=8-amino-3,6-dioxaoctanoic acid | Vivitide | PCI-3696-PI | Oligonucleotide Preparation |
| Cy3B NHS ester | GE Healthcare | PA63101 | Oligonucleotide Preparation |
| Dimethylformamide | Millipore Sigma | PHR1553 | Oligonucleotide Preparation |
| DMEM with L-Glutamine, 4.5g/L Glucose and Sodium Pyruvate | Fisher Scientific | MT10013C | Cell Culture |
| Epidermal Growth Factor human EGF | Millipore Sigma | E9644 | Cell Culture |
| Ethanol, 200 proof (100%) | Fisher Scientific | 22032601 | Surface Preparation |
| Falcon Standard Tissue Culture Dishes | Fisher Scientific | 08-772E | Surface Preparation |
| Fetal Bovine Serum | Fisher Scientific | 10-438-026 | Cell Culture |
| Flurobrite DMEM | Fisher Scientific | A1896701 | Cell Culture |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 647 | Invitrogen | A-21244 | Immunocytochemistry |
| Goat Serum | Fisher Scientific | 16-210-064 | Immunocytochemistry |
| Hank’s balanced salts (HBSS) | Fisher Scientific | 14-170-161 | Cell Culture |
| Horse Serum | Fisher Scientific | 16050130 | Immunocytochemistry |
| Hydrogen Peroxide | Fisher Scientific | H325-500 | Surface Preparation |
| Nanosep MF centrifugal devices | Pall laboratory | ODM02C35 | Oligonucleotide Preparation |
| NHS-azide | Fisher Scientific | 88902 | Oligonucleotide Preparation |
| Nitrogen Gas Cylinder | Airgas | Surface Preparation | |
| No. 2 round glass coverslips - 25 mm | VWR | 48382-085 | Surface Preparation |
| Parafilm M Laboratory Film | Fisher Scientific | 13-374-10 | Surface Preparation |
| Paraformaldehyde 16% | Fisher Scientific | 50-980-487 | Immunocytochemistry |
| PBS, 1X | Fisher Scientific | 21-030-CV | Surface Preparation/Immunocytochemistry |
| Penicillin-Streptomycin (5,000 U/mL) | Fisher Scientific | 15-070-063 | Cell Culture |
| PYREX Low Form Griffin Beakers | Fisher Scientific | 02-540G | Surface Preparation |
| Sodium Ascorbate | Fisher Scientific | 18-606-310 | Oligonucleotide Preparation |
| Sodium Bicarbonate | Fisher Scientific | S233 | Oligonucleotide Preparation |
| Sodium Chloride | Fisher Scientific | BP358 | Surface Preparation |
| Streptavidin | Fisher Scientific | 434301 | Surface Preparation |
| Sulfo-NHS-LC-Biotin | Fisher Scientific | 21335 | Surface Preparation |
| Sulfuric Acid | Fisher Scientific | A300-500 | Surface Preparation |
| TEAA | Fisher Scientific | NC0322726 | Oligonucleotide Preparation |
| Triethylamine | Millipore Sigma | 471283 | Oligonucleotide Preparation |
| Trifluoroacetic Acid (TFA) | Fisher Scientific | PI28901 | Oligonucleotide Preparation |
| THPTA | Fisher Scientific | NC1296293 | Oligonucleotide Preparation |
| Triton X 100 Detergent Surfact Ams Solution | Fisher Scientific | 85111 | Immunocytochemistry |
| Water, DNA Grade, DNASE, Protease free | Fisher Scientific | BP24701 | Oligonucleotide Preparation |
| Equipment | |||
| Agilent AdvanceBio Oligonucleotide C18 column, 4.6 x 150 mm, 2.7 μm | Agilent | 653950-702 | Oligonucleotide Preparation |
| High-performance liquid chromatography | Agilent | 1100 | Oligonucleotide Preparation |
| Low Speed Orbital Shaker | Fisher Scientific | 10-320-813 | Immunocytochemistry |
| Matrix-assisted laser desorption/ ionization time-of-flight mass spectrometer (MALDI-TOF-MS) | Voyager STR | Oligonucleotide Preparation | |
| Molecular Probes Attofluor Cell Chamber | Fisher Scientific | A7816 | Surface Preparation |
| Nanodrop 2000 UV-Vis Spectrophotometer | Thermo Fisher | Oligonucleotide Preparation | |
| Nikon Eclipse Ti inverted microscope | pe Nikon | Microscopy | |
| Nikon Perfect Focus System | Nikon | Microscopy | |
| NIS Elements software | Nikon | Microscopy | |
| ORCA-Flash4.0 V3 Digital CMOS camera | Hamamatsu | Microscopy | |
| Quad band TIRF 405/488/561/647 cube | CHROMA | Microscopy | |
| RICM Cube | CHROMA | Microscopy | |
| SOLA v-nIR Light Engine | Lumencor | Microscopy | |
| Thermo Forma Steri Cycle 370 CO2 Incubator | Fisher Scientific | Cell Culture | |
| VWR 75D Ultrasonic Cleaner | VWR | 13710 | Surface Preparation |
| Data Analysis | Use | ||
| Fiji (Image J) | https://imagej.net/software/fiji/downloads | Quantitative Analysis | |
| Graph Pad Prism | Graph Pad | Statistical Analysis | |
| Oligo name | 5'modification/ 3' modification | Sequence (5' to 3') | Use |
| Alkyne-21-BHQ2 | 5' Hexynyl/ 3' BHQ_2 | GTGAAATACCGCACAGATGCG | Top strand TGT probe |
| 56 pN TGT | 5' Biosg/TTTTTT/iUniAmM | CGCATCTGTGCGGTATTTCACTTT | Bottom strand TGT probe |
| 12 pN TGT | 5' AmMC6/ 3' BioTEG | CGCATCTGTGCGGTATTTCACTTT | Bottom strand TGT probe |
References
- Lim, C. -. G., Jang, J., Kim, C. Cellular machinery for sensing mechanical force. BMB Reports. 51 (12), 623-629 (2018).
- Moraes, C., Sun, Y., Simmons, C. A. (Micro)managing the mechanical microenvironment. Integrative Biology. 3 (10), 959-971 (2011).
- Vogel, V., Sheetz, M. P. Mechanical forces matter in health and disease. From Cancer to Tissue Engineering. Nanotechnology. , 233-303 (2010).
- Wang, J. H. C., Li, B. Mechanics rules cell biology. BMC Sports Science, Medicine and Rehabilitation. 2 (1), 16 (2010).
- Moeendarbary, E., Harris, A. R. Cell mechanics: principles, practices, and prospects. Wiley Interdisciplinary Reviews: Systems Biology and Medicine. 6 (5), 371-388 (2014).
- Streuli, C. H., Akhtar, N. Signal co-operation between integrins and other receptor systems. Biochemical Journal. 418 (3), 491-506 (2009).
- Chiasson-MacKenzie, C., McClatchey, A. I. EGFR-induced cytoskeletal changes drive complex cell behaviors: The tip of the iceberg. Science Signaling. 11 (515), (2018).
- Kechagia, J. Z., Ivaska, J., Roca-Cusachs, P. Integrins as biomechanical sensors of the microenvironment. Nature Reviews Molecular Cell Biology. 20 (8), 457-473 (2019).
- De Luca, A., et al. The role of the EGFR signaling in tumor microenvironment. Journal of Cellular Physiology. 214 (3), 559-567 (2008).
- Javadi, S., Zhiani, M., Mousavi, M. A., Fathi, M. Crosstalk between Epidermal Growth Factor Receptors (EGFR) and integrins in resistance to EGFR tyrosine kinase inhibitors (TKIs) in solid tumors. European Journal of Cell Biology. 99 (4), 151083 (2020).
- Eliceiri, B. P. Integrin and growth factor receptor crosstalk. Circulation Research. 89 (12), 1104-1110 (2001).
- Dan, L., Jian, D., Na, L., Xiaozhong, W. Crosstalk between EGFR and integrin affects invasion and proliferation of gastric cancer cell line, SGC7901. OncoTargets and Therapy. 5, 271-277 (2012).
- Giancotti, F. G., Tarone, G. Positional control of cell fate through joint integrin/receptor protein kinase signaling. Annual Reviews: Cell and Developmental Biology. 19, 173-206 (2003).
- Ricono, J. M., et al. Specific cross-talk between epidermal growth factor receptor and integrin alphavbeta5 promotes carcinoma cell invasion and metastasis. Cancer Research. 69 (4), 1383-1391 (2009).
- Polacheck, W. J., Chen, C. S. Measuring cell-generated forces: a guide to the available tools. Nature Methods. 13 (5), 415-423 (2016).
- Hang, X., et al. Nanosensors for single cell mechanical interrogation. Biosensors and Bioelectronics. 179, 113086 (2021).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Schoen, I., Hu, W., Klotzsch, E., Vogel, V. Probing cellular traction forces by micropillar arrays: contribution of substrate warping to pillar deflection. Nano Letters. 10 (5), 1823-1830 (2010).
- Ma, V. P. -. Y., Salaita, K. DNA Nanotechnology as an Emerging Tool to Study Mechanotransduction in Living Systems. Small. 15 (26), 1900961 (2019).
- Kim, Y., Kim, K. A., Kim, B. C. Double-stranded DNA force sensors to study the molecular level forces required to activate signaling pathways. Journal of the Korean Physical Society. 78 (5), 386-392 (2021).
- Rao, T. C., et al. EGFR activation attenuates the mechanical threshold for integrin tension and focal adhesion formation. Journal of Cell Sciences. 133 (13), (2020).
- Zhang, Y., Ge, C., Zhu, C., Salaita, K. DNA-based digital tension probes reveal integrin forces during early cell adhesion. Nature Communications. 5, 5167 (2014).
- Liu, Y., et al. DNA-based nanoparticle tension sensors reveal that T-cell receptors transmit defined pN forces to their antigens for enhanced fidelity. Proceedings of the National Academy of Sciences of the United States of America. 113 (20), 5610-5615 (2016).
- Zhang, Y., et al. Platelet integrins exhibit anisotropic mechanosensing and harness piconewton forces to mediate platelet aggregation. Proceedings of the National Academy of Sciences of the United States of America. 115 (2), 325-330 (2018).
- Ma, V. P. -. Y., et al. Mechanically induced catalytic amplification reaction for readout of receptor-mediated cellular forces. Angewandte Chemie International Edition. 55 (18), 5488-5492 (2016).
- Wang, X., Ha, T. Defining single molecular forces required to activate integrin and notch signaling. Science. 340 (6135), 991-994 (2013).
- Chen, Y., Lee, H., Tong, H., Schwartz, M., Zhu, C. Force regulated conformational change of integrin αVβ3. Matrix Biology. 60-61, 70-85 (2017).
- Kantlehner, M., et al. Surface coating with cyclic RGD peptides stimulates osteoblast adhesion and proliferation as well as bone formation. ChemBioChem. 1 (2), 107-114 (2000).
- Kapp, T. G., et al. A comprehensive evaluation of the activity and selectivity profile of ligands for RGD-binding integrins. Scientific Reports. 7, 39805 (2017).
- Kok, R. J., et al. Preparation and functional evaluation of RGD-modified proteins as alpha(v)beta(3) integrin directed therapeutics. Bioconjugate Chemistry. 13 (3), 128-135 (2002).
- Li, I. T. S., Ha, T., Chemla, Y. R. Mapping cell surface adhesion by rotation tracking and adhesion footprinting. Scientific Reports. 7 (1), 44502 (2017).
- Wang, Y., et al. Force-activatable biosensor enables single platelet force mapping directly by fluorescence imaging. Biosensors and Bioelectronics. 100, 192-200 (2018).
- Murad, Y., Li, I. T. S. Quantifying molecular forces with serially connected force sensors. Biophysical Journal. 116 (7), 1282-1291 (2019).
- Yasunaga, A., Murad, Y., Li, I. T. S. Quantifying molecular tension-classifications, interpretations and limitations of force sensors. Physical Biology. 17 (1), 011001 (2019).
- Luca, V. C., et al. Notch-Jagged complex structure implicates a catch bond in tuning ligand sensitivity. Science. 355 (6331), 1320-1324 (2017).
- Spillane, K. M., Tolar, P. B cell antigen extraction is regulated by physical properties of antigen-presenting cells. The Journal of Cell Biology. 216 (1), 217-230 (2017).
- Brockman, J. M., Salaita, K. Mechanical proofreading: a general mechanism to enhance the fidelity of information transfer between cells. Frontiers in Physics. 7, 14 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved