Method Article
성장 인자 매개 인테그린 역학 및 접착력을 정량화하기 위한 장력 게이지 테더 프로브
요약
TGT 표면은 성장 인자 - 인테그린 누화를 연구하는 혁신적인 플랫폼입니다. 유연한 프로브 설계, 부착 리간드의 특이성, 자극 조건의 정밀한 조절은 EGFR-인테그린 인터플레이의 강력한 정량적 평가를 가능하게 한다. 결과는 EGFR을 '메카노-조직자' 튜닝 인테그린 역학으로 강조하여 초점 접착 어셈블리 및 세포 확산에 영향을 미칩니다.
초록
다세포 유기체는 부착, 증식, 이동 및 분화를 포함한 여러 기능을 조율하기 위해 주변 세포외 기질 (ECM)에서 막 수용체와 동족 리간드 간의 상호 작용에 의존합니다. 기계적 힘은 부착 수용체 인테그린을 통해 세포로부터 ECM 내의 리간드로 전달될 수 있다. 이들 세포-생성 힘의 양 및 공간 조직은 표피 성장 인자 수용체 (EGFR)를 포함하는 성장 인자 수용체에 의해 조절될 수 있다. 세포 역학의 누화 매개 변화를 정량화하고 초점 접착, 세포 형태 및 신호 전달과 관련시키는 데 현재 사용할 수있는 도구는 제한적입니다. 텐션 게이지 테더(TGT)로 알려진 DNA 기반 분자력 센서는 이러한 변화를 정량화하기 위해 사용되었습니다. TGT 프로브는 기저 힘 역치를 조절하고 회절 제한 공간 분해능에서 전체 부착성 세포 표면에 걸쳐 피코네왈톤 스케일 수용체 힘을 보고하는 능력에서 독특합니다. 여기에 사용된 TGT 프로브는 형광 신호를 생성하는 수용체-리간드 힘에 의한 DNA 듀플렉스의 비가역적 해리에 의존한다. 이것은 세포의 누적 인테그린 장력 (힘 역사)의 정량화를 허용한다. 이 기사는 인테그린 역학 및 접착 형성에 대한 EGFR의 영향을 연구하기 위해 TGT를 사용하는 프로토콜을 설명합니다. TGT 기계식 감지 플랫폼의 조립은 체계적으로 상세하며 힘, 초점 접착 및 셀 확산을 이미지화하는 절차가 간략하게 설명되어 있습니다. 전반적으로, 프로브의 근본적인 힘 역치, 부착 리간드 및 자극에 사용되는 성장 인자의 유형 및 농도를 조절하는 능력은 인테그린 매개 힘을 조절하는 다양한 막 수용체의 상호 작용을 연구하기위한 강력한 플랫폼이됩니다.
서문
세포는 기계적 힘을 감지, 생성 및 반응하는 고유 한 능력을 가지고있어 세포 표현형의 변화와 국소 미세 환경 1,2의 리모델링을 유도합니다. 힘은 유착, 이동, 증식, 분화 및 상처 치유를 포함한 세포 행동의 많은 측면을 조절하는 데 중요한 역할을합니다 3,4. 세포와 미세 환경 사이의 양방향 기계적 교환에서의 수차는 암을 포함한 병든 상태로 이어질 수 있습니다5. 수많은 막 수용체가 세포-매트릭스 항상성 유지에 관여한다; 이들 중, 인테그린 및 표피 성장 인자 수용체 (EGFR)는 강력한 시너지 효과 6,7을 갖는다. 고전적으로, 인테그린은 미세 환경과 세포 내 세포 골격 사이의 기계적 연결을 확립하는 반면, EGFR은 세포 성장, 증식 및 생존을 조절합니다 8,9. EGFR은 고도로 연구된 치료 표적으로, 세포내 신호전달을 촉진하는 외부-인 조절에 초점을 맞춘다. EGFR-인테그린 크로스토크는 암10,11을 포함한 다수의 질환의 진행을 조절하기 위해 유전적으로 및 생화학적으로 확립되었다. 연구는 EGFR-인테그린 인터플레이의 존재를 나타내지만, 그 결과는 원형질막7,12,13,14로부터 떨어진 신호전달 경로에 기인한다. EGFR 또는 다른 성장 인자가 세포 역학에 미치는 영향은 세포력과 신호 전달 결과를 측정하는 도구가 부족하기 때문에 부분적으로 탐구되지 않은 채로 남아 있습니다. 과제는 이러한 병렬 신호 패러다임 간의 통신을 연구하고 세포 역학에 대한 특정 기여도를 정량화하는 데 적절한 도구를 식별하는 데 있습니다.
세포 부착 수용체에 의해 생성된 힘을 측정하기 위해 몇 가지 접근법이 개발되었으며, 독자는 이러한 기술(15,16)에 대한 심층적인 검토로 향한다. 간략하게, 견인력 현미경 및 마이크로필라 어레이 검출은 개별 수용체 힘(17,18)보다 더 큰 크기인 나노뉴턴(nN) 힘을 추론하기 위해 하부 기질의 변형에 의존한다. AFM 및 광학 핀셋을 포함한 단일 분자 기술은 단일 단백질 피코네톤(pN) 힘에 민감하지만 한 번에 하나의 수용체만 측정하며 양호한(또는 임의) 공간 분해능을 제공하지 않습니다. DNA 기반 분자 장력 프로브 및 텐션 게이지 테더 (TGT) 프로브는 회절 제한 (또는 그 이상) 공간 분해능으로 pN 힘 분해능을 제공하여 섬유 아세포, 암 세포, 혈소판 및 면역 세포를 포함한 다양한 세포 유형에서 단일 세포 힘19,20을 연구하는 데 고유 한 역할을 제공합니다21,22,23,24 . 분자 장력 프로브는 실시간 이미징에 이상적인 확장 가능한 "스프링"요소를 가지고 있지만 TGT 프로브는 돌이킬 수 없게 파열되어 형광 "힘 역사"를 남깁니다. TGT는 하부 기판의 장력 임계치를 추가로 변조한다; 유사한 화학적 조성을 갖지만 파열력, 또는 장력 내성(Ttol)을 갖는 일련의 프로브는 초점 접착 형성 및 세포 확산에 필요한 최소 장력을 정량화하는데 사용될 수 있다. TGT 프로브는 두 개의 상보적인 DNA 가닥으로 구성되며, 하나는 표면에 고정되고 다른 하나는 세포에 리간드를 제시합니다. 수용체가 리간드에 결합하고 프로브의Ttol보다 큰 힘을 가하면 가닥이 분리됩니다. Ttol은 이상적인 조건 하에서 2s 간격으로 프로브의 50%를 파열시키는 데 필요한 일정한 힘으로 정의됩니다. "턴온" TGT 프로브에서, 상부 가닥 상의 소광기는 하부 가닥의 형광단으로부터 분리될 수 있다. TGT 프로브가Ttol보다 크거나 같은 힘에 의해 파열된 경우에만 형광 신호가 생성될 것이다. TGT 프로브도 고정할 수 있어 생물학적 시스템을 쉽게 조작하고 여러 조건을 테스트할 수 있습니다. 이러한 이유로 TGT 프로브가이 작업에 사용되었습니다.
TGT 프로브는 인테그린 의존성 세포 부착 및 기계적 힘이 활성화된 EGFR21에 의해 어떻게 조절되는지를 연구하기 위해 사용되었다. 이 연구는 EGFR을 '메카노 주최자'로 확립하여 초점 접착 조직과 긴장 생성을 조정했습니다. 추가적으로, EGF 자극이 초점 부착 및 강화된 세포 확산의 분포 및 성숙에 영향을 미친다는 것이 발견되었다. 이 접근법은 성장 인자가 종양 진행 및 역학의 기계적 힘에 어떻게 영향을 미치는지 조사하기 위해 향후 연구에 사용될 수 있습니다. 상피를 중간엽 전이로 조절하는 데 EGFR-인테그린 크로스토크의 역할이 확립되어 있지만, 이 과정에서 기계적 힘의 역할은 아직 미숙한 연구로 남아 있다10.
여기에서, 56 pN TGT 프로브의 합성 및 조립, 유리 커버슬립 상의 TGT 표면 생성, TGT 표면 상의 Cos-7 세포의 적용 및 EGF로 자극, 팔로이딘으로 세포의 고정 및 염색, 및 항-팍실린 항체, 고분해능 총 내부 반사 형광(TIRF) 및 반사 간섭 대조 현미경(RICM) 이미징을 포괄하는 이러한 실험에 대한 상세한 프로토콜이 제시되며, 및 이미지 정량화. 이 프로토콜은 Cos-7 세포의 EGF 자극을 조사하기 위해 작성되었지만 많은 TGT 기반 실험에 쉽게 적응할 수 있습니다. 상이한 리간드,Ttol, 세포 유형, 자극 파라미터, 고정에 따라 표지된 단백질 및 정량 분석이 용이하게 치환될 수 있어서, 이 프로토콜은 견고하고 널리 이용된다.
프로토콜
1. TGT 올리고뉴클레오티드 제제
참고: 올리고뉴클레오티드 프로브 합성의 세부사항은 여기에 요약되어 있다. 일부 수정 및 정제 단계는 사용자 정의 합성을 위해 아웃소싱 될 수 있습니다.
- Zhang et al.22 에 의해 기재된 아지드-NHS 링커와 사이클로[Arg-Gly-Asp-D-Phe-Lys(PEG-PEG)] 펩티드의 1차 아민을 10 μL 디메틸포름아미드의 최종 부피에서 1:1.5 비(100:150 nmoles)로 혼합함으로써 활성화시킨다. 유기 염기 트리에틸아민 0.1μL를 첨가하고 4°C에서 12시간 동안 인큐베이션한다.
- 생성물을 0.5%/min의 구배로 설정된 1mL/min의 유속 및 10% 용매 B의 초기 조건으로 0.1 M TEAA (용매 A) 및 100% 아세토니트릴 (용매 B)을 사용하여 역상 HPLC에 의해 생성물을 정제한다. 용출된 피크(203nm에서의 흡광도)를 결합하고 MALDI-TOF 질량분석기로 검증한다. 제품은 cRGDfK-azide입니다.
- TGT 상부 가닥을 생성하려면, cRGDfK-아지드 및 알킨-21-BHQ2 올리고뉴클레오티드(TGT 상부 가닥: 5Hexynyl/GTGAAATACCGACAGATGGG/3BHQ_2)를 1x 인산완충식염수(PBS)의 100μL에 5mM 소듐 아스코르베이트 및 0.1μM 미리 형성된 Cu-THPTA와 함께 2:1 비율(͂200 μM: 100 μM)로 결합한다. 반응이 실온 (RT)에서 최소 4 h 동안 또는 4°C에서 하룻밤 동안 진행되도록 허용한다.
- 혼합물을 P2 탈염 겔을 통해 처리하여 과량의 염료, 부산물, 유기 용매 및 미반응 시약을 제거한다. 650 μL의 미리 수화된 P2 겔로 원심분리 컬럼을 1분 동안 18,000 x g 에서 아래로 방사하여 제조하였다. 유동 관통 액체를 버리고 반응 혼합물을 첨가한다. 1분 동안 18,000 x g 에서 다시 회전하고 유동을 수집합니다. 반응 혼합물을 초순수로 300 μL의 최종 부피로 가져온다.
참고 : P2 젤을 6 시간 동안 물로 미리 수화하십시오. - 탈염된 반응 혼합물을 역상 HPLC에 의해 정제한다. 이 정제에 사용되는 유기 용매는H2O(용매 A) 및 100% MeCN (용매 B, 또는 이동상) 중 0.1 M TEAA를 포함한다.
- 혼합물을 주입하기 전에, 컬럼을 10% 용매 B의 초기 조건과 1%/분의 구배로 평형화시킨다. 유속을 1 mL/분으로 조정하십시오. 반응 혼합물을 500 μL 주입 바늘로 HPLC 루프에 주입한다.
- DNA에 대해 260 nm에서의 피크 흡수를 시각화하고 BHQ2 소광기에 대해 560 nm에서 피크 흡수를 시각화하여 생성물을 수집한다. 용출된 생성물을 진공 원심 농축기에서 하룻밤 동안 건조시킨다.
- Ma et에 기재된 바와 같이 TGT 바닥 가닥을 Cy3B-NHS 에스테르에 결합시키기 위해 친핵성 치환을 사용한다. 알25. 100 μM의 56 pN TGT 바닥 가닥 (5Biosg/TTTTTT/iUniAmM/CGCATCTGTGCGGTATTTCACTTT)을 10 μL의 DMSO에 미리 용해된 50 μg의 Cy3B-NHS 에스테르와 혼합한다. 이 혼합물의 pH를 0.1 M 중탄산나트륨으로 9로 조정하고 1x PBS로 최종 부피를 100 μL로 가져온다. 반응 혼합물을 RT에서 밤새 인큐베이션한다.
- P2 겔 여과 및 역상 HPLC를 사용하여 혼합물을 순차적으로 정제하여 미반응 시약, 염 및 유기 용매를 분리한다(단계 1.4 및 1.5에 기재됨).
- 정제된 올리고뉴클레오티드-염료 접합체의 농도를 분광광도계를 사용하여 260 nm에서 이들의 흡광도를 기록함으로써 추정한다.
- 정제된 생성물을 MALDI-TOF 질량 분광법으로 특성화한다. 과량의 3-하이드록시피콜린산을 TA50 용매(50:50 v/v 아세토니트릴 및ddH2O에 0.1% TFA)에 녹여 신선한 MALDI 매트릭스를 제조하였다. 표지된 생성물에 대한 추정 및 측정된 분자량은 다음과 같다: cRGDfK-1-BHQ2 - 8157.9 (계산됨), 8160.1 (발견됨); Cy3B 표지된 56 pN TGT - 10272.7 (계산됨), 10295.8 (발견됨).
- 상단과 하단 가닥을 30-50 μM 사이의 농도로 뉴클레아제가 없는 물에 따로 녹입니다. 스톡 오염을 방지하려면 DNase가 없는 피펫 팁을 사용하십시오. 단기 적용의 경우 4°C, 장기 적용의 경우 -20°C에서 보관하십시오. 올리고뉴클레오티드의 안정성은 반복된 동결-해동 사이클에 의해 영향을 받지 않는다.
2. 표면 준비
1일차:
- 25mm 유리 커버슬립(최대 8개)을 폴리테트라플루오로에틸렌 랙에 넣습니다. 랙을 200 프루프 에탄올 40 mL를 함유하는 50 mL 보로실리케이트 비이커에 넣는다. 비커를 파라핀 필름으로 덮어 물이 들어가지 않도록 하고 RT에서 10-15분 동안 35kHz의 작동 주파수에서 초음파 처리합니다(그림 1A).
- 50 mL 비이커를 파이렉스 비이커에 황산과 과산화수소를 3:1 비율로 혼합하여 갓 제조한 피라냐 용액 40 mL로 채운다. 유리 피펫으로 저어주세요. 커버슬립 랙을 비커로 옮기고 흄 후드의 RT에서 30분 동안 인큐베이션하여 커버슬립 표면을 에칭합니다(그림 1B).
참고 : 실험실 코트, 장갑 및 고글을 포함한 전체 PPE를 착용하고 화학 흄 후드에서 작업하십시오. 용액의 과열을 방지하기 위해 산에 과산화수소를 천천히 첨가하십시오. - 에칭 후 핀셋을 사용하여 커버슬립 랙을 초순수가 있는 비이커로 옮깁니다. 이 단계를 15초 간격으로 여섯 번 반복하여 산을 완전히 중화시킨다(그림 1C).
참고 : Piranha 용액을 산성 폐기물 용기에 버리기 전에 화학 흄 후드에 밤새 두십시오. - 커버슬립을 육안으로 검사하여 유리 표면에 패턴이나 먼지 입자가 없어 표면이 깨끗하게 보이는지 확인합니다. 패턴이나 먼지가 감지되면 2.1-2.4단계를 반복합니다.
참고: 처리된 커버슬립을 물에 담그고 수직으로 제거하여 표면 친수성을 테스트합니다. 처리 된 커버 슬립의 물은 패치를 형성하는 처리되지 않은 커버 슬립에 비해 영의 고리를 형성하기 위해 균일 한 시트로 물러납니다. - 커버슬립 랙을 200 프루프 에탄올로 비이커로 옮기고 15초 동안 두 번 세척하여 표면을 유기 용매와 평형화시킵니다. 커버슬립 랙을 RT에서 1시간 동안 3% APTES가 있는 200 프루프 에탄올 용액으로 옮겨 커버슬립을 실란화합니다(그림 1D). 비커를 파라핀 필름으로 덮으십시오.
참고: APTES 증착 파라미터는 표면 세정 방법, 용매 수분 함량, APTES 농도, 배양 시간 및 어닐링 온도에 따라 달라집니다. - 랙을 200 프루프 에탄올 용액으로 깨끗한 비이커에 담그십시오. 이 세척을 각각 15초에 대해 세 번 반복하십시오(그림 1E).
- 커버슬립을 낮은 출구 압력의 질소(N2) 가스를 사용하여 건조시킵니다. 커버 슬립을 10cm 폴리스티렌 접시에 넣고 파라핀 필름 조각을 평평하게 놓습니다. 커버슬립이 건조하고 분리되어 있는지 확인합니다(그림 1F).
- DMSO 중의 2 mg/mL NHS-비오틴 용액 100 μL를 파라핀 필름 위에 놓인 네 개의 커버슬립에 첨가한다. 다른 4개의 커버슬립을 위에 놓고 (두 개의 커버슬립이 그 사이에 기능화 용액과 함께 서로 향하도록 향함) 4°C에서 하룻밤 동안 접시를 인큐베이션한다(그림 1G).
참고 : 4 °C에서 NHS 시약은보다 안정적이어서 균일 한 표면 기능화를 용이하게합니다. 또한 샌드위치는 시약을 보존합니다. 샌드위치에 과도한 용액을 넣으면 샌드위치가 새어 나와 커버 슬립이 미끄러 질 수 있으므로 피하십시오.
2일차:
- 접시를 4°C에서 분리하고 샌드위치된 커버슬립을 분리합니다. 그림 2A와 같이 코팅된 표면이 서로 마주보도록 랙의 슬립 방향을 조정합니다. 200 프루프 에탄올 용액으로 각각 15 초 동안 세 번 씻으십시오. N2 가스로 말리고 그 안에 파라핀 필름이있는 새 접시에 넣으십시오.
참고: 표시된 대로 커버슬립의 방향을 지정하면 기능화된 서피스를 식별하는 데 도움이 됩니다. - 커버슬립을 1 mL의 1x PBS로 세 번 세척하여 이들을 다시 수성상으로 평형화시킨다. 800 μL의 0.1% 소 혈청 알부민(BSA)을 1x PBS(w/v)에 첨가하고, 30분 동안 RT에서 인큐베이션하여 표면을 패시베이트하고 후속 기능화 시약의 비특이적 결합을 차단한다(그림 2B).
- 인큐베이션 후, 커버슬립을 1 mL의 1x PBS로 세 번 세척하였다. 1μg/mL의 스트렙타비딘 800μL를 RT의 1x PBS에 45-60분 동안 첨가하여 커버슬립을 작동화합니다(그림 2C).
참고: 패시베이션 효율을 확인하기 위해 스트렙타비딘 없이 커버슬립 하나를 보관하십시오(선택 사항). Add10 nM 비오티닐화 분자 및 실험 조건을 이용한 이미지. 이 표면 강도는 카메라의 어두운 노이즈에 근접해야 합니다. - 단계 2.11과 동시에, 열순환기를 사용하여 PCR 튜브에서 1 M NaCl의 100 μL 중 50 nM의 최종 농도로 TGT 프로브 (상부: 1:1 몰비에서 하단 가닥)를 조립한다. 가닥을 95°C에서 5분 동안 해리시키고, 온도를 25°C로 감소시키고 25분 동안 유지함으로써 점진적으로 어닐링한다(도 2D). TGT 프로브가 빛에 장시간 노출되지 않도록 하십시오.
- 스트렙타비딘 인큐베이션 후, 1x PBS를 사용하여 커버슬립을 세 번 세척한다. 미리 조립된 TGT 프로브 100μL를 4개의 커버슬립에 추가하고 기능화된 면이 프로브를 향하도록 나머지 4개의 커버슬립을 사용하여 샌드위치를 만듭니다(여덟 개의 표면에는 4개의 하이브리드 TGT 프로브 튜브가 필요함). 알루미늄 호일로 덮고 RT에서 1시간 동안 인큐베이션하여 프로브가 표면에 결합할 수 있도록 합니다(그림 2E).
- 인큐베이션 후, 샌드위치를 분리하고 커버슬립을 1x PBS로 세 번 세척한다. 이제 TGT 표면을 이미징할 준비가 되었습니다. 커버슬립을 미리 세척된 이미징 챔버에 조심스럽게 조립하고 1x PBS를 첨가하여 표면이 수화되도록 합니다(그림 2F).
참고: 챔버를 과도하게 조이면 표면이 깨집니다. 표면의 건조를 방지하십시오.
3. 세포 준비 및 염색
- Cos-7 역학, 부착 및 세포 확산에 대한 표피 성장 인자 (EGF) 자극의 효과를 조사하기 위해, 2 분 동안 0.05 % 트립신-EDTA로 Cos-7 세포를 트립신화한다. HBSS로 세척하고 5분 동안 800 x g 에서 원심분리하여 트립신을 중화시킨다. 중화 단계를 한 번 더 반복하십시오.
- 두개골 세포는 50 ng/mL EGF 또는 EGF가 없는 DMEM으로 보충된 둘베코의 변형 이글 배지(DMEM)에서 조립된 TGT 표면 상의 4 x 104 세포의 밀도로 플레이트 세포. 세포를 세포 배양 인큐베이터에서 5%CO2 로 37°C에서 60분 동안 확산시키십시오 (도 3A).
참고: 세포는 성장 인자로부터의 자극을 피하기 위해 혈청 없이 DMEM에서 배양된다. EGF는 10 mM 아세트산에 희석되어 1 mg / mL의 스톡을 만듭니다. 이미징 실험을 위해 DMEM에서 50ng/mL로 사용됩니다. - 인큐베이션 후, 세포를 1x PBS로 3회 세척하고 RT에서 12분 동안 2 mL의 4% 파라포름알데히드로 고정시켰다(도 3B).
참고: 모든 인큐베이션 단계는 용액의 균일한 확산을 위해 ~35rpm의 회전식 쉐이커에서 수행됩니다. TGT 표면이 이미징 준비가 될 때까지 덮음으로써 빛으로부터 보호합니다. - 고정제를 흡인하고 커버슬립을 RT에서 5분 간격으로 1x PBS로 5회 세척한다. 임의로, 커버슬립을 37°C에서 30분 동안 1x PBS 중의 50 mMNH4Cl로 인큐베이션하여 파라포름알데히드-관련 자가형광을 켄칭하고, 5분 간격으로 1x PBS로 3회 세척한다(도 3B).
- 완충액 A(1x PBS, 5% 정상 말 혈청, 5% 정상 염소 혈청, 1% BSA, 0.025% 트리톤 X-100)를 첨가하고, 세포를 차단하고 투과시키기 위해 37°C에서 30분 동안 인큐베이션한다. 5분 간격으로 1x PBS로 3회 세척한다(도 3B).
- 커버 슬립이있는 이미징 챔버를 습도 용기에 넣으십시오. 1차 항-팍실린 항체(초점 부착 마커)를 블로킹 완충액(1x PBS, 5% 정상 말 혈청, 5% 정상 염소 혈청, 1% BSA, 0.005% 트리톤 x-100)에 1:250으로 희석한다. 커버슬립 당 200 μL의 일차 항체 용액과 함께 37°C에서 2시간 동안 인큐베이션한다(도 3B).
참고: 표면이 마르지 않도록 하십시오. - 커버슬립을 5분 간격으로 1x PBS로 5회 세척하고 습도 용기로 되돌립니다. 표지 세포는 염료 접합된 염소 항-토끼 이차 항체의 혼합물과 동시에 1:800에서 희석하고, 염료 접합된 팔로이드인(액틴)을 커버슬립당 블로킹 완충액 200 μL에서 1:400 희석하였다. 37°C에서 60분 동안 인큐베이션한다(도 3B).
- 표면을 5분 간격으로 1x PBS로 5회 세척하고 이미징이 준비될 때까지 4°C에서 보관한다(도 3B).
참고: 신호 열화를 방지하기 위해 표면 준비 후 3일 이내에 이미지 샘플.
4. 이미지 획득
- 488, 561 및 647 TIRF 여기, RICM 여기, 완벽한 초점 시스템 및 디지털 카메라가 있는 거꾸로 된 현미경에 높은 수치 조리개(1.49)가 있는 오일 침지 60x 목표를 사용하십시오.
- 목표에 오일을 넣고 샘플 챔버의 커버 슬립 바닥을 청소하고 샘플을 무대에 놓습니다. 세포에 집중하고 완벽한 초점을 맞춥니다.
- 현미경을 부형광 여기와 함께 RICM 이미징 모드에 넣고 방출 필터가 제거된 GFP 필터 큐브를 넣는다. 에피 조명 조리개 다이어프램을 닫고 가운데에 배치하여 RICM을 정렬합니다.
- 현미경을 레이저 여기 및 쿼드 패스 TIRF 필터 큐브로 TIRF 모드로 전환합니다. 488nm 레이저를 실내의 천장에 있는 작은 지점에 초점을 맞추고 라이브 모드에서 카메라의 형광을 모니터링하면서 임계 각도를 지나갈 때까지 입사각을 높입니다. 임계 각도를 초과할 때 배경 형광의 급격한 감소와 단일 초점 평면을 관찰하십시오.
참고: TIRF는 샘플 커버슬립 인터페이스에 가장 가까운 얇은 영역(~100nm)을 여기시켜 개방된 TGT 프로브와 초점 접착을 강조하면서 세포 내에서 초점이 맞지 않는 형광을 제거합니다. TIRF가 이용가능하지 않은 경우, 에피-형광이 사용될 수 있고; 그러나 신호 대 잡음비는 더 낮습니다. - RICM을 사용하여 카메라의 "라이브" 모드를 사용하여 이미징할 세포를 식별합니다.
- 액틴 (640 nm ex), 인테그린 텐션 (561 nm ex), 및 팍실린 (488 nm ex)의 RICM 이미지 및 TIRF 이미지를 획득한다. 200ms의 노출 시간을 사용하여 순차적으로 이미지를 가져옵니다.
참고: 노출 시간은 목표, 레이저 출력, 방출 필터 및 카메라 감도를 포함한 여러 요인에 따라 달라집니다. 신호는 배경보다 2배 이상 커야 합니다. 배경은 약 1000 AU이므로 신호는 적어도 2000-3000 AU이어야합니다. - 적어도 30 개의 세포에 대해 4.4-4.5를 반복하십시오. 커버슬립, 포커스를 변경하고 4.4-4.5를 반복합니다.
5. 데이터 분석
참고: 피지 소프트웨어를 사용하여 정량적 이미지 분석을 수행하고 통계 소프트웨어를 사용하여 분석하십시오.
- 한 셀에 대한 이미지 세트를 엽니다.
- ImageJ 자유형 선택 도구를 사용하여 RICM 이미지에서 셀의 경계를 추적하여 셀 영역의 마스크(RICM 마스크)를 생성합니다. ROI 관리자(ROI 관리자를 > 도구 분석)에 관심 영역(ROI)> 저장합니다(그림 4A1,2).
- 인테그린 장력 이미지에서 셀 외부의 대표 영역을 선택하고 최소 200 x 200픽셀의 ROI를 그립니다. ROI에서 다른 세포 또는 형광 파편을 제외하십시오. 측정 도구(분석 > 측정)를 사용하여 ROI의 배경 형광을 측정합니다(그림 4A3).
- 장력 이미지에서 단계 5.2에서 얻은 평균 배경 형광을 뺍니다(공정 > 수학 > 뺄셈)(도 4A4).
- 5.2단계에서 설정된 RICM 마스크를 사용하여 셀 풋프린트 내의 장력 신호를 정의합니다(ROI 관리자 > 마스크 적용 선택 > 외부 편집 > 지우기)>(그림 4A5).
- Huang의 자동 임계값 조정 방법(이미지 > 임계값 조정)을 사용하여 장력 이미지> 임계값 마스크를 만듭니다(그림 4A6). 임계값 마스크가 생성된 인테그린 장력의 영역을 가장 잘 나타내는지 확인하십시오. 일반적으로 임계 값을 평균 배경 형광의 2x로 설정하십시오.
- 임계값 장력 마스크를 선택합니다(선택 > 편집 > 만들기)(그림 4A7).
- 단계 5.4에서 생성된 텐션 이미지 상으로 선택된 마스크를 전송하고 개방 프로브의 통합 강도를 측정한다(ROI 매니저 > RawIntDen을 > 분석> 측정(Tension Mask)을 선택(Tension Mask)> 선택한다(도 4C).
- RICM 마스크에서 셀 형태 특성 영역, 원형도 및 종횡비를 측정합니다(ROI 관리자 > 선택 (RICM 마스크) > 마스크 적용 > 분석 > 측정)(그림 4B).
- 장력 마스크 이미지를 선택하고 RICM 마스크(ROI 관리자, > Select(RICM Mask) > 분석 > 측정>%Area)을 적용하여 파열 프로브를 사용한 셀 발자국의 백분율로 정의되는 기계적 파열 밀도를 측정합니다(그림 4C).
- 추가 분석 및 시각화를 위한 측정값을 통계 소프트웨어로 내보냅니다.
- 모든 셀에 대해 5.1-5.11을 반복합니다.
결과
턴-온 TGT 프로브는 Cos-7 세포21에서 인테그린 매개 세포 역학 및 부착 형성에 대한 리간드 활성화 표피 성장 인자 수용체 (EGFR)의 효과를 조사하기 위해 사용되었다. 프로브는 리간드 사이클릭 Arg-Gly-Asp-Phe-Lys (cRGDfK)21,23,25,26을 제시하며, 이는 α5β1 인테그린 27,28,29,30에 대해 단지 작은 친화도를 갖는 인테그린 헤테로다이머 αVβ3에 대해 선택적이다. TGT 프로브는 비오틴-스트렙타비딘 결합을 사용하여 바닥 가닥을 통해 유리 커버슬립 표면 상에 기능화된 이중 DNA를 포함한다. 상부 가닥은 인테그린 리간드를 표시하고, 세포막 상의 동족 인테그린 수용체에 결합할 수 있다(도 5A). 하단 가닥은 형광단으로 표지되고 상단 가닥은 담금질로 표지되어 이중 TGT가 손상되지 않은 경우 최소한의 배경 형광을 유도합니다. 인테그린이 리간드에 결합하고 프로브의Ttol보다 큰 크기를 갖는 힘을 가하면, DNA 듀플렉스는 분리되어 형광을 유도한다(도 5A). 기계적 힘에 의해 파열되지 않은 TGT 프로브는 형광이 아닌 상태로 유지됩니다. 이러한 힘 선택적 턴온 형광은 회절-제한된 분해능에서 pN 스케일 인테그린-생성 힘의 체계적이고 정량적 매핑을 허용한다. TGT 프로브는 기판의 장력 임계값을 추가로 변조합니다.
여기에 나타낸 것은 56 pN의Ttol을 갖는 TGT 표면의 대표적인 예이다. Cos-7 세포를 EGF 자극 유무에 관계없이 이 TGT 표면에 플레이팅하여 리간드 자극을 통한 EGFR 활성화가 세포 부착 및 인테그린 역학에 미치는 영향을 연구하였다(도 5A, B). 세포를 60분 동안 TGT 표면 상에서 EGF와 함께 또는 없이 인큐베이션하고, 고정시키고, 면역-부착 분포(팍실린) 및 세포골격(F-actin)의 조직을 표시하기 위해 면역염색하였다(도 5B). 이어서, 세포를 RICM 및 TIRF 현미경을 사용하여 영상화하였다. RICM 이미지에서 명확하게 보이는 바와 같이, 56 pN TGT 표면 상의 Cos-7 세포 확산은 자극 없이 비하여 EGF 자극으로 유의하게 향상되었다. 이를 RICM 이미지로부터 세포-기판 접촉 영역의 크기를 측정함으로써 각 조건에서 50개의 세포에 대해 정량화하였다(도 5C). EGF를 이용한 자극은 Cos-7 세포가 그들의 자연적인 생리학적 환경에서 확산 및 성장한다는 것을 대표하는보다 원형 형태를 가져왔다 (도 5D). 개방 프로브로부터의 형광은 또한 장력 형광 이미지에서 관찰된 바와 같이 EGF 자극과 함께 더 높다. 개방 프로브의 수에 비례하는 개방 프로브의 통합 강도는 EGF 자극이 없는 것에 비해 훨씬 높았다(도 5B,E). 이것은 인테그린이Ttol (56pN)보다 큰 힘을 가한 모든 수용체-리간드 결합의 표현이다.
팍실린으로 염색한 결과, 초점 유착의 분포, 수, 성숙(크기) 및 조직이 또한 EGF 자극에 의해 영향을 받았다는 것을 보여주었다. EGF 자극된 세포에서의 초점 부착은 EGF 대조군이 없는 것에 비해 더 성숙하고 방사상 지향적인 것으로 나타났다. F-액틴 시토골격 조직은 또한 팔로이드인 염색에 의해 평가된 바와 같이 EGF 자극으로 강화되었다(도 5B). 이러한 정성적 평가는 두 치료 그룹의 이미지를 시각적으로 비교함으로써 이루어졌습니다. 초점 접착력의 정량적 분석은 수행 할 수 있지만이 프로토콜의 범위를 벗어납니다. 이 실험에서, TGT 표면은 세포 확산, 인테그린 역학 및 초점 부착 형성에 대한 EGFR 활성화의 효과를 체계적으로 상세히 기술하는 플랫폼을 제공하였다.
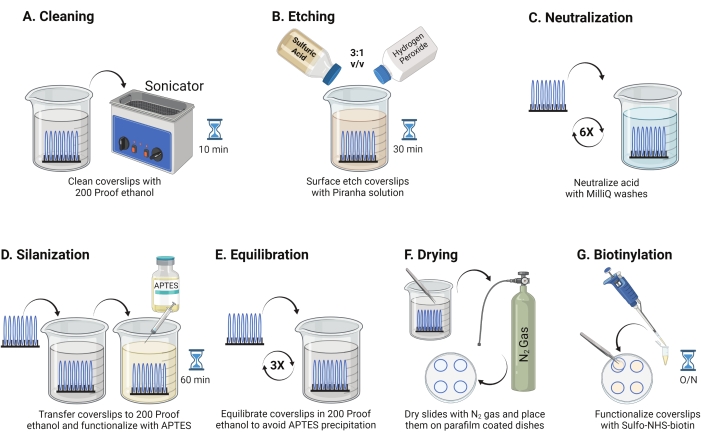
그림 1: TGT 표면 준비의 1일째에 대한 개략도 . (A) 커버슬립을 청소하십시오. (B) 커버슬립 표면을 에칭한다. (C) 피라냐 용액을 중화시킨다. (d) 반응성 아민기를 만들기 위해 표면을 실란화한다. (E) 커버슬립을 유기상으로 평형화시킨다. (F) 커버슬립을 불활성 가스로 건조시킵니다. (g) 표면 아민기의 비오티닐레이트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
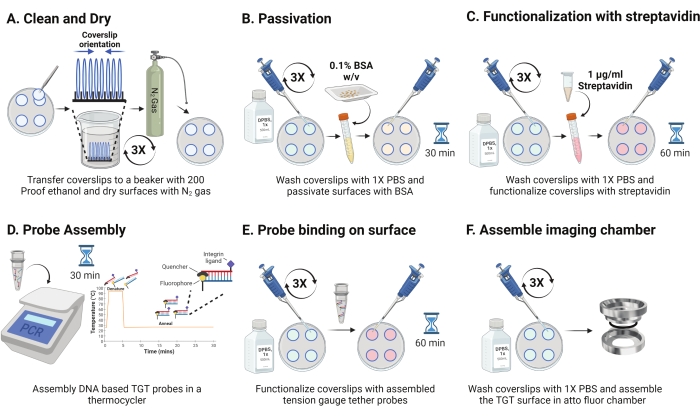
도 2: TGT 표면 제제의 제2일에 대한 개략도. (A) 커버슬립을 세척하고 건조시켜 전날로부터 잔류 비오틴을 제거한다. (b) 후속 단계에서 시약의 비특이적 결합을 방지하기 위해 BSA를 사용한 패시베이트. (C) 스트렙타비딘으로 커버슬립을 기능화한다. (d) 프로브를 써모 사이클러에서 혼성화한다. (e) 합성된 프로브를 커버슬립(F)에 적용하고 커버슬립을 세포 이미징 챔버에 조립한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
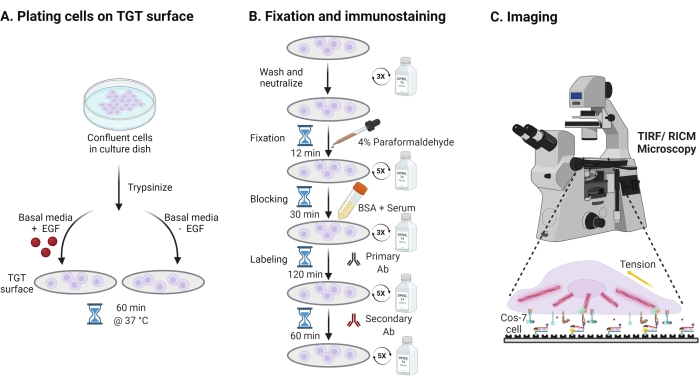
그림 3: 전체 실험 설정에 걸친 광범위한 단계를 강조하는 일반적인 워크플로우 . (A) EGF 자극 유무에 관계없이 기초 배지(DMEM)에서 TGT 표면에 세포 분리 및 도금을 위한 프로세스. (b) TGT 표면 상의 부착 및 확산 후 고정 및 면역염색에 관여하는 단계의 흐름도. (c) 염색 후, 세포는 RICM 및 TIRF 현미경으로 거꾸로 된 형광 현미경 상에서 이미지화된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
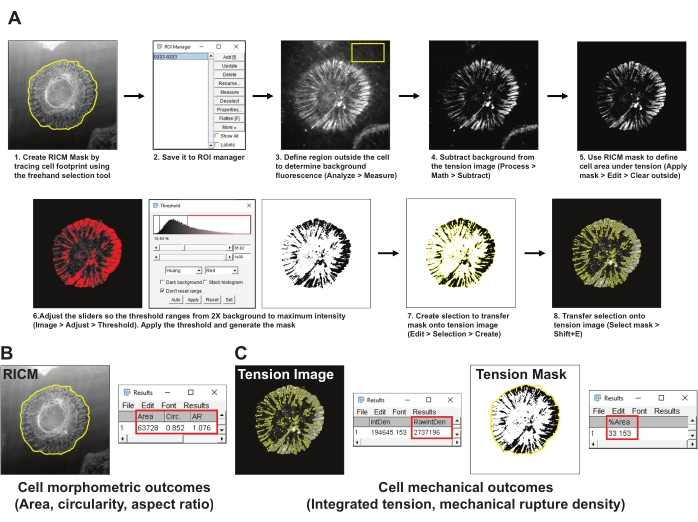
그림 4: 데이터 처리 및 정량 분석의 예. (A) RICM 및 장력 이미지 정량화를 위해 피지(ImageJ)에 사용된 분석 파이프라인의 단계별 분석. (b) 상기 파이프라인을 이용하여 분석된 세포 형태학적 결과에 대한 대표적인 예. (c) 상기 언급된 파이프라인을 사용하여 분석된 세포 기계적 결과에 대한 대표적인 예. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
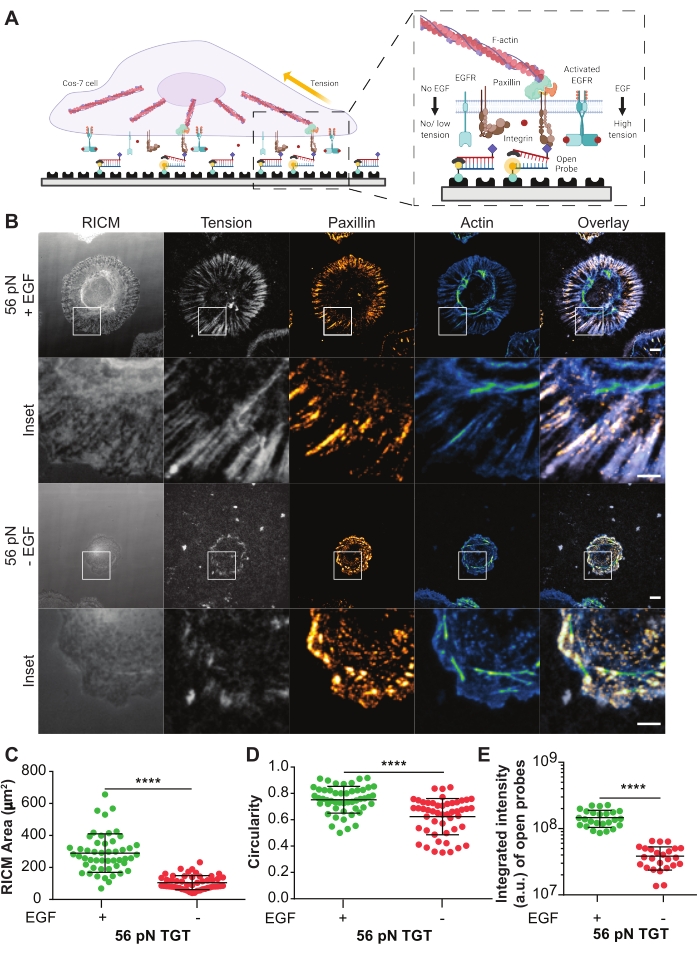
도 5: TGT 실험으로부터의 예시 데이터. (A) 세포막-TGT 표면 계면에서의 접촉 영역을 강조하는 도면. 인셋 프로젝트는 EGF 자극 없이 (오른쪽) 또는 (왼쪽) 동족 리간드 cRGDfK와 상호작용하는 것을 통합한다. (b) 56 pN TGT 표면 상에 확산된 Cos-7 세포의 RICM 및 TIRF 이미지. 이미지는 EGF 자극 유무에 관계없이 60분 후 도금 후 얻어진다. 개별 RICM(획득된 대로), 인테그린 장력(그레이스케일), 팍실린(오렌지색 핫) 및 F-액틴(청록색) 이미지가 두 자극 조건 모두에 대한 오버레이로 표시됩니다. 스케일 바: 10 μm. 인셋은 팍실린으로 표시된 부착 형성 부위에서 생성된 인테그린 장력의 공동 국소화와 액틴으로 표시된 기본 세포골격 조직의 공동 국소화를 자세히 설명하는 확대된 ROI(관심 영역)를 강조합니다. 스케일 바: 5 μm. (C-E) EGF 자극이 있거나 없는 Cos-7 세포에 대한 확산 영역(RICM 세포 발자국)(C), 원형도(D), 및 통합 장력(E)에 대한 산점도. 막대는 평균 ± s.d.를 나타냅니다. 그룹 간의 차이는 스튜던트 t-검정으로 통계적으로 평가되었다. P < 0.0001. n = 세 개의 독립적인 실험에 걸쳐 50개의 세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
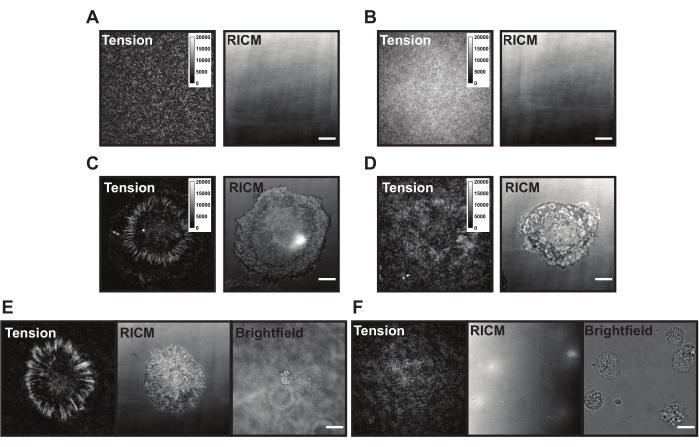
그림 6: 서로 다른 가능한 문제가 있는 TGT 표면 예제. (A) 세포 부착 전에 담금질된 조립된 프로브와 함께 이상적인 TGT 표면의 장력 및 RICM 이미지. (b) TGT 프로브가 상부 가닥(quencher)이 결여된 TGT 표면의 장력 및 RICM 이미지. 장력 이미지는 바닥 가닥에서 열린 형광단으로부터의 균일한 형광을 보여준다. (c) 이상적인 TGT 표면 상에 확산된 세포에 대한 장력 및 RICM 이미지. (d) 제한된 패시베이션 또는 분해된 프로브를 갖는 저조하게 만들어진 TGT 표면 상에 확산된 세포에 대한 장력 및 RICM 이미지. (e) cRGDfK-인테그린 상호작용을 나타내는 cRGDfK 리간드로 이상적인 표면에 플레이팅된 세포에 대한 장력, RICM 및 브라이트필드 이미지는 세포 부착 및 장력 생성에 필수적이다. (f) TGT 상에 cRGDfK 리간드가 없는 표면 상에 플레이팅된 세포에 대한 장력, RICM, 및 브라이트필드 이미지. 세포가 밝은 필드 이미지에서 보이는 동안, 세포 부착 또는 생성 된 인테그린 장력은 관찰되지 않습니다. 스케일 바: 10 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
위에서 설명한 상세한 단계별 절차를 통해 TGT 표면을 준비하여 EGF 처리 후 세포 부착 및 확산 동안 부착 세포에 의해 생성 된 세포 형태 및 인테그린 장력을 정량화 할 수 있습니다. 간단한 실험 설정과 함께 간단한 프로브 설계 및 합성 및 표면 준비는 EGFR과 인테그린의 상호 작용을 연구 할 수있는 안정적인 플랫폼을 제공했습니다. 전반적으로, 결과는 EGFR의 리간드 의존성 활성화가 세포 확산을 향상시키고, 인테그린 수용체의 힘 보유 특성을 조정하며, 초점 부착 조직 및 성숙을 촉진한다는 것을 검증한다. TGT 프로브를 사용하여 얻은 결과는 EGFR과 같은 성장 인자가 '메카노 조직자'로 작용하여 인테그린 장력의 양과 공간 조직을 증가시키고 초점 접착의 방향과 역학을 조절한다는 중요한 가설을 뒷받침합니다.
TGT 표면 상으로의 적용시, 세포는 인테그린 (αVβ3) 수용체가 감지됨에 따라 착륙, 부착 및 확산되고 cRGDfK 리간드에 결합한다. 이렇게 함으로써 TGT 프로브는 기계적으로 파열될 수 있고, 리간드 결합 부위에서 형광을 생성할 수 있다. 판독은 표면과 상호 작용하는 세포의 누적 "힘 역사"입니다. 이러한 실험 중에 존재할 수 있는 TGT 표면에는 몇 가지 일반적인 문제가 있습니다. 높은 표면 배경 형광 (그림 6A, B), 패치 표면 외관, 장력 신호를 생성하는 세포의 실패 (그림 6C, D) 및 세포의 확산 실패 (그림 6E, F)는 TGT 프로브 또는 표면 합성의 기술적 단점 때문일 수 있습니다. 이러한 일반적인 문제에 대한 해결책은 표 1에 제시되어 있다.
TGT 프로브의 간단한 설계는 세포 생물학자에게 특정 리간드 및 자극만을 제공함으로써 다른 세포 표면 수용체로부터의 간섭 없이 격리된 특이적 성장 인자-인테그린 신호전달 결과를 연구할 수 있는 강력한 도구를 제공한다. 추가적으로, TGT 프로브는 pN 감도에서 세포 부착 동안 개별 인테그린 수용체를 밑줄로 하는 장력 역치의 조사를 허용한다. 대안적인 접근법은 고정된 샘플(31)에서 높은 공간 분해능을 갖는 개별 수용체에 의해 가해지는 힘을 보고하지 못한다. 견인력 현미경은 개별 인테그린 수용체(15)에 의해 가해지는 힘보다 더 높은 크기 순서인 nN 힘에만 민감하며, 분자 장력 프로브는 pN 힘을 측정하지만, 가역적이기 때문에, 그들은 견고하게 고정을 견디지 못한다. 이러한 이유로 TGT 프로브는 성장 인자-인테그린 상호작용의 역학을 연구하는 매력적인 도구입니다.
TGT 프로브와 관련된 몇 가지 기술적 뉘앙스가 있으며 실험을 설계하기 전에 고려해야 합니다. 장력 이미지는 시간의 스냅 샷으로, 주어진 시점에서 수용체 - 리간드 결합의 지표가 아닌 힘 역사를 나타냅니다. 신호 생성은 프로브 분리에 의존하기 때문에, TGT 형광은 수용체-리간드 결합으로부터 활성 장력 하에 있지 않은 개방 프로브로부터 초래된다. 이는 TGT 표면에서 얻어진 인테그린 장력에 대한 판독값이 역사적이며Ttol보다 큰 힘이 있었던 곳을 나타내는 자연에서 누적된다는 것을 의미합니다. Ttol 미만의 현재 수용체-리간드 힘의 위치는19,32로 보고되지 않는다. TGT 파열은 수용체-리간드 결합의 종결을 초래하기 때문에, 세포 확산은Ttol보다 낮은 힘을 경험하는 인테그린-리간드 상호작용에 기인한다. 따라서 사용자는 인테그린 기반 접착과 관련된 기계적 결과를 추정하기 위해 도금 후 시간을 정의할 때 주의해야 합니다. 마지막으로,Ttol의 의미를 고려해야 한다. 여기에 사용된 TGT 프로브는 56pN의 Ttol을 가지며, 여기서Ttol은 2초 동안 적용될 때 프로브의 50%를 파열시키는 데 필요한 일정한 힘입니다. 복잡한 생물학적 시스템을 고려할 때, TGT는 다양한 시간 의존성을 가진 이질적이고 다양한 힘 그라데이션을 경험할 가능성이 큽니다. TGT가Ttol보다 큰 힘에 의해 파열된다면, 형광은 전체 장력의 과소 평가가 될 것입니다. 대안으로, 더 긴 지속 시간 동안 적용된Ttol 이하의 힘은 더 짧은 시간 동안 적용된 높은 역치력과 유사한 수의 프로브를 파열시킬 수 있다. 이 두 시나리오 모두 동일한 형광 강도 판독을 초래할 수 있으며, TGT 프로브33,34를 사용하여 정확한 장력 크기 또는 역학을 해결하기가 어렵습니다.
전반적으로, 성장 인자 자극에 따른 인테그린 장력의 평가는 내부 대조군과의 실험을 설계하고, 다른 매트릭스 코팅 표면의 확산 프로파일을 비교하고, 성장 인자 자극의 유무에 따라 세포에서 TGT 형광을 병렬로 평가하고, 다른Ttol을 가진 TGT를 사용하여 신중하게 이루어져야합니다. . TGT는 인테그린 수용체의 역학, 초점 부착 역학 및 세포 확산을 조절하는 성장 인자 신호 전달의 역할을 정량화 할 수 있습니다. 이 프로토콜은 상이한Ttol, 상이한 리간드, 상이한 세포 유형, 또는 상이한 자극 조건을 갖는 프로브를 사용하는 많은 TGT 기반 실험을 위한 주형으로서 사용될 수 있다. 관심있는 임의의 단백질은 고정 후 표지될 수 있고, 임의의 유형의 정량적 이미지 분석이 구현될 수 있다. 따라서 우리는 수많은 TGT 실험을위한 템플릿을 제시합니다.
TGT 프로브의 사용은 인테그린을 연구하는 것에 국한되지 않고 리간드를 변형시킴으로써 상이한 세포 유형에 걸쳐 세포막 수용체의 다양한 어레이로 확장될 수 있다. TGT 프로브는 배아 발달 및 신경 발생에서 노치 수용체 역학의 기계적 역할 확인(35), B 세포 수용체에 의한 항원의 확인 및 내재화를 매개하는 힘(36), 신호 전달의 강도와 특이성을 높이기 위한 힘의 변화를 검출하는 T 세포 표면 수용체의 기계적 교정 능력 등 다양한 수용체 신호전달 캐스케이드를 조절하는 힘의 역할을 조사하는 데 사용되어 왔다(37) . 함께, 이러한 발견은 다양한 실험 환경에서 TGT 프로브의 엄청난 잠재력을 강조합니다.
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
저자는 유익한 토론과 비판을 위해 Mattheyses 연구소의 구성원을 인정하고 싶습니다. 우리는 NSF CAREER 1832100 및 NIH R01GM131099에서 A.L.M.에 자금을 지원한다는 것을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl)triethoxysilane | Millipore Sigma | 440140 | Surface Preparation |
| 3-hydroxypicolinic acid (3-HPA) | Millipore Sigma | 56197 | Maldi-TOF-MS matrix |
| Acetic Acid, Glacial | Fisher Scientific | A38S | Diluting EGF |
| Acetonitrile (HPLC) | Fisher Scientific | A998SK | Oligonucleotide Preparation |
| Alexa Fluor 488 Phalloidin | Cell Signaling Technology | 8878S | Immunocytochemistry |
| Ammonium Chloride | Fisher Scientific | A687 | Immunocytochemistry |
| Anti-Paxillin antibody [Y113] | Abcam | ab32084 | Immunocytochemistry |
| BD Syringes only with Luer-Lok | BD bioscience | 309657 | Surface Preparation |
| Bio-Gel P-2 | Bio-Rad | 1504118 | Oligonucleotide Preparation |
| Bovine Serum Albumin (BSA) Protease-free Powder | Fisher Scientific | BP9703100 | Surface Preparation |
| Cos-7 cells | ATCC | CRL-1651 | Cell Culture, Passage numbers 11-20 |
| Coverslip Mini-Rack, for 8 coverslips | Fisher Scientific | C14784 | Surface Preparation |
| c(RGDfK(PEG-PEG)), PEG=8-amino-3,6-dioxaoctanoic acid | Vivitide | PCI-3696-PI | Oligonucleotide Preparation |
| Cy3B NHS ester | GE Healthcare | PA63101 | Oligonucleotide Preparation |
| Dimethylformamide | Millipore Sigma | PHR1553 | Oligonucleotide Preparation |
| DMEM with L-Glutamine, 4.5g/L Glucose and Sodium Pyruvate | Fisher Scientific | MT10013C | Cell Culture |
| Epidermal Growth Factor human EGF | Millipore Sigma | E9644 | Cell Culture |
| Ethanol, 200 proof (100%) | Fisher Scientific | 22032601 | Surface Preparation |
| Falcon Standard Tissue Culture Dishes | Fisher Scientific | 08-772E | Surface Preparation |
| Fetal Bovine Serum | Fisher Scientific | 10-438-026 | Cell Culture |
| Flurobrite DMEM | Fisher Scientific | A1896701 | Cell Culture |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 647 | Invitrogen | A-21244 | Immunocytochemistry |
| Goat Serum | Fisher Scientific | 16-210-064 | Immunocytochemistry |
| Hank’s balanced salts (HBSS) | Fisher Scientific | 14-170-161 | Cell Culture |
| Horse Serum | Fisher Scientific | 16050130 | Immunocytochemistry |
| Hydrogen Peroxide | Fisher Scientific | H325-500 | Surface Preparation |
| Nanosep MF centrifugal devices | Pall laboratory | ODM02C35 | Oligonucleotide Preparation |
| NHS-azide | Fisher Scientific | 88902 | Oligonucleotide Preparation |
| Nitrogen Gas Cylinder | Airgas | Surface Preparation | |
| No. 2 round glass coverslips - 25 mm | VWR | 48382-085 | Surface Preparation |
| Parafilm M Laboratory Film | Fisher Scientific | 13-374-10 | Surface Preparation |
| Paraformaldehyde 16% | Fisher Scientific | 50-980-487 | Immunocytochemistry |
| PBS, 1X | Fisher Scientific | 21-030-CV | Surface Preparation/Immunocytochemistry |
| Penicillin-Streptomycin (5,000 U/mL) | Fisher Scientific | 15-070-063 | Cell Culture |
| PYREX Low Form Griffin Beakers | Fisher Scientific | 02-540G | Surface Preparation |
| Sodium Ascorbate | Fisher Scientific | 18-606-310 | Oligonucleotide Preparation |
| Sodium Bicarbonate | Fisher Scientific | S233 | Oligonucleotide Preparation |
| Sodium Chloride | Fisher Scientific | BP358 | Surface Preparation |
| Streptavidin | Fisher Scientific | 434301 | Surface Preparation |
| Sulfo-NHS-LC-Biotin | Fisher Scientific | 21335 | Surface Preparation |
| Sulfuric Acid | Fisher Scientific | A300-500 | Surface Preparation |
| TEAA | Fisher Scientific | NC0322726 | Oligonucleotide Preparation |
| Triethylamine | Millipore Sigma | 471283 | Oligonucleotide Preparation |
| Trifluoroacetic Acid (TFA) | Fisher Scientific | PI28901 | Oligonucleotide Preparation |
| THPTA | Fisher Scientific | NC1296293 | Oligonucleotide Preparation |
| Triton X 100 Detergent Surfact Ams Solution | Fisher Scientific | 85111 | Immunocytochemistry |
| Water, DNA Grade, DNASE, Protease free | Fisher Scientific | BP24701 | Oligonucleotide Preparation |
| Equipment | |||
| Agilent AdvanceBio Oligonucleotide C18 column, 4.6 x 150 mm, 2.7 μm | Agilent | 653950-702 | Oligonucleotide Preparation |
| High-performance liquid chromatography | Agilent | 1100 | Oligonucleotide Preparation |
| Low Speed Orbital Shaker | Fisher Scientific | 10-320-813 | Immunocytochemistry |
| Matrix-assisted laser desorption/ ionization time-of-flight mass spectrometer (MALDI-TOF-MS) | Voyager STR | Oligonucleotide Preparation | |
| Molecular Probes Attofluor Cell Chamber | Fisher Scientific | A7816 | Surface Preparation |
| Nanodrop 2000 UV-Vis Spectrophotometer | Thermo Fisher | Oligonucleotide Preparation | |
| Nikon Eclipse Ti inverted microscope | pe Nikon | Microscopy | |
| Nikon Perfect Focus System | Nikon | Microscopy | |
| NIS Elements software | Nikon | Microscopy | |
| ORCA-Flash4.0 V3 Digital CMOS camera | Hamamatsu | Microscopy | |
| Quad band TIRF 405/488/561/647 cube | CHROMA | Microscopy | |
| RICM Cube | CHROMA | Microscopy | |
| SOLA v-nIR Light Engine | Lumencor | Microscopy | |
| Thermo Forma Steri Cycle 370 CO2 Incubator | Fisher Scientific | Cell Culture | |
| VWR 75D Ultrasonic Cleaner | VWR | 13710 | Surface Preparation |
| Data Analysis | Use | ||
| Fiji (Image J) | https://imagej.net/software/fiji/downloads | Quantitative Analysis | |
| Graph Pad Prism | Graph Pad | Statistical Analysis | |
| Oligo name | 5'modification/ 3' modification | Sequence (5' to 3') | Use |
| Alkyne-21-BHQ2 | 5' Hexynyl/ 3' BHQ_2 | GTGAAATACCGCACAGATGCG | Top strand TGT probe |
| 56 pN TGT | 5' Biosg/TTTTTT/iUniAmM | CGCATCTGTGCGGTATTTCACTTT | Bottom strand TGT probe |
| 12 pN TGT | 5' AmMC6/ 3' BioTEG | CGCATCTGTGCGGTATTTCACTTT | Bottom strand TGT probe |
참고문헌
- Lim, C. -. G., Jang, J., Kim, C. Cellular machinery for sensing mechanical force. BMB Reports. 51 (12), 623-629 (2018).
- Moraes, C., Sun, Y., Simmons, C. A. (Micro)managing the mechanical microenvironment. Integrative Biology. 3 (10), 959-971 (2011).
- Vogel, V., Sheetz, M. P. Mechanical forces matter in health and disease. From Cancer to Tissue Engineering. Nanotechnology. , 233-303 (2010).
- Wang, J. H. C., Li, B. Mechanics rules cell biology. BMC Sports Science, Medicine and Rehabilitation. 2 (1), 16 (2010).
- Moeendarbary, E., Harris, A. R. Cell mechanics: principles, practices, and prospects. Wiley Interdisciplinary Reviews: Systems Biology and Medicine. 6 (5), 371-388 (2014).
- Streuli, C. H., Akhtar, N. Signal co-operation between integrins and other receptor systems. Biochemical Journal. 418 (3), 491-506 (2009).
- Chiasson-MacKenzie, C., McClatchey, A. I. EGFR-induced cytoskeletal changes drive complex cell behaviors: The tip of the iceberg. Science Signaling. 11 (515), (2018).
- Kechagia, J. Z., Ivaska, J., Roca-Cusachs, P. Integrins as biomechanical sensors of the microenvironment. Nature Reviews Molecular Cell Biology. 20 (8), 457-473 (2019).
- De Luca, A., et al. The role of the EGFR signaling in tumor microenvironment. Journal of Cellular Physiology. 214 (3), 559-567 (2008).
- Javadi, S., Zhiani, M., Mousavi, M. A., Fathi, M. Crosstalk between Epidermal Growth Factor Receptors (EGFR) and integrins in resistance to EGFR tyrosine kinase inhibitors (TKIs) in solid tumors. European Journal of Cell Biology. 99 (4), 151083 (2020).
- Eliceiri, B. P. Integrin and growth factor receptor crosstalk. Circulation Research. 89 (12), 1104-1110 (2001).
- Dan, L., Jian, D., Na, L., Xiaozhong, W. Crosstalk between EGFR and integrin affects invasion and proliferation of gastric cancer cell line, SGC7901. OncoTargets and Therapy. 5, 271-277 (2012).
- Giancotti, F. G., Tarone, G. Positional control of cell fate through joint integrin/receptor protein kinase signaling. Annual Reviews: Cell and Developmental Biology. 19, 173-206 (2003).
- Ricono, J. M., et al. Specific cross-talk between epidermal growth factor receptor and integrin alphavbeta5 promotes carcinoma cell invasion and metastasis. Cancer Research. 69 (4), 1383-1391 (2009).
- Polacheck, W. J., Chen, C. S. Measuring cell-generated forces: a guide to the available tools. Nature Methods. 13 (5), 415-423 (2016).
- Hang, X., et al. Nanosensors for single cell mechanical interrogation. Biosensors and Bioelectronics. 179, 113086 (2021).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Schoen, I., Hu, W., Klotzsch, E., Vogel, V. Probing cellular traction forces by micropillar arrays: contribution of substrate warping to pillar deflection. Nano Letters. 10 (5), 1823-1830 (2010).
- Ma, V. P. -. Y., Salaita, K. DNA Nanotechnology as an Emerging Tool to Study Mechanotransduction in Living Systems. Small. 15 (26), 1900961 (2019).
- Kim, Y., Kim, K. A., Kim, B. C. Double-stranded DNA force sensors to study the molecular level forces required to activate signaling pathways. Journal of the Korean Physical Society. 78 (5), 386-392 (2021).
- Rao, T. C., et al. EGFR activation attenuates the mechanical threshold for integrin tension and focal adhesion formation. Journal of Cell Sciences. 133 (13), (2020).
- Zhang, Y., Ge, C., Zhu, C., Salaita, K. DNA-based digital tension probes reveal integrin forces during early cell adhesion. Nature Communications. 5, 5167 (2014).
- Liu, Y., et al. DNA-based nanoparticle tension sensors reveal that T-cell receptors transmit defined pN forces to their antigens for enhanced fidelity. Proceedings of the National Academy of Sciences of the United States of America. 113 (20), 5610-5615 (2016).
- Zhang, Y., et al. Platelet integrins exhibit anisotropic mechanosensing and harness piconewton forces to mediate platelet aggregation. Proceedings of the National Academy of Sciences of the United States of America. 115 (2), 325-330 (2018).
- Ma, V. P. -. Y., et al. Mechanically induced catalytic amplification reaction for readout of receptor-mediated cellular forces. Angewandte Chemie International Edition. 55 (18), 5488-5492 (2016).
- Wang, X., Ha, T. Defining single molecular forces required to activate integrin and notch signaling. Science. 340 (6135), 991-994 (2013).
- Chen, Y., Lee, H., Tong, H., Schwartz, M., Zhu, C. Force regulated conformational change of integrin αVβ3. Matrix Biology. 60-61, 70-85 (2017).
- Kantlehner, M., et al. Surface coating with cyclic RGD peptides stimulates osteoblast adhesion and proliferation as well as bone formation. ChemBioChem. 1 (2), 107-114 (2000).
- Kapp, T. G., et al. A comprehensive evaluation of the activity and selectivity profile of ligands for RGD-binding integrins. Scientific Reports. 7, 39805 (2017).
- Kok, R. J., et al. Preparation and functional evaluation of RGD-modified proteins as alpha(v)beta(3) integrin directed therapeutics. Bioconjugate Chemistry. 13 (3), 128-135 (2002).
- Li, I. T. S., Ha, T., Chemla, Y. R. Mapping cell surface adhesion by rotation tracking and adhesion footprinting. Scientific Reports. 7 (1), 44502 (2017).
- Wang, Y., et al. Force-activatable biosensor enables single platelet force mapping directly by fluorescence imaging. Biosensors and Bioelectronics. 100, 192-200 (2018).
- Murad, Y., Li, I. T. S. Quantifying molecular forces with serially connected force sensors. Biophysical Journal. 116 (7), 1282-1291 (2019).
- Yasunaga, A., Murad, Y., Li, I. T. S. Quantifying molecular tension-classifications, interpretations and limitations of force sensors. Physical Biology. 17 (1), 011001 (2019).
- Luca, V. C., et al. Notch-Jagged complex structure implicates a catch bond in tuning ligand sensitivity. Science. 355 (6331), 1320-1324 (2017).
- Spillane, K. M., Tolar, P. B cell antigen extraction is regulated by physical properties of antigen-presenting cells. The Journal of Cell Biology. 216 (1), 217-230 (2017).
- Brockman, J. M., Salaita, K. Mechanical proofreading: a general mechanism to enhance the fidelity of information transfer between cells. Frontiers in Physics. 7, 14 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유