Method Article
Sondas de tether medidor de tensão para quantificar fator de crescimento mediado mecânica integrin e adesão
Neste Artigo
Resumo
A superfície TGT é uma plataforma inovadora para estudar o crosstalk fator de crescimento integrin. O design flexível da sonda, a especificidade do ligante de adesão e a modulação precisa das condições de estimulação permitem avaliações quantitativas robustas da interação EGFR-integrin. Os resultados destacam a EGFR como uma mecânica integrin de ajuste 'mecano-organizador', influenciando a montagem de adesão focal e a disseminação celular.
Resumo
Organismos multicelulares dependem de interações entre receptores de membrana e ligantes cognatos na matriz extracelular circundante (ECM) para orquestrar múltiplas funções, incluindo adesão, proliferação, migração e diferenciação. Forças mecânicas podem ser transmitidas da célula através do receptor de adesão integrin para ligantes no ECM. A quantidade e a organização espacial dessas forças geradas por células podem ser moduladas por receptores de fator de crescimento, incluindo o receptor do fator de crescimento epidérmico (EGFR). As ferramentas disponíveis atualmente para quantificar as alterações mediadas pelo crosstalk na mecânica celular e relacioná-las a aderências focais, morfologia celular e sinalização são limitadas. Sensores de força molecular baseados em DNA conhecidos como amarras de medidor de tensão (TGTs) foram empregados para quantificar essas alterações. As sondas TGT são únicas em sua capacidade de modular o limiar de força subjacente e relatar as forças do receptor da escala piconewton em toda a superfície celular aderente em resolução espacial limitada à difração. As sondas TGT usadas aqui dependem da dissociação irreversível de um duplex de DNA por forças receptor-ligantes que geram um sinal fluorescente. Isso permite quantificação da tensão integrin cumulativa (história da força) da célula. Este artigo descreve um protocolo que emprega TGTs para estudar o impacto do EGFR na mecânica integrin e na formação de adesão. A montagem da plataforma de sensoriamento mecânico TGT é sistematicamente detalhada e o procedimento para forças de imagem, aderências focais e disseminação celular é delineado. No geral, a capacidade de modular o limiar de força subjacente da sonda, o ligante de adesão e o tipo e concentração de fator de crescimento empregado para a estimulação fazem deste uma plataforma robusta para estudar a interação de diversos receptores de membrana na regulação de forças mediadas pela integrin.
Introdução
As células têm a capacidade intrínseca de sentir, gerar e responder às forças mecânicas, levando a mudanças no fenótipo celular e remodelação do microambiente local 1,2. As forças desempenham um papel crucial na regulação de muitos aspectos do comportamento celular, incluindo adesão, migração, proliferação, diferenciação e cicatrizaçãode feridas 3,4. Aberrações na troca mecânica bidirecional entre uma célula e o microambiente podem levar a estados doentes, incluindo câncer5. Inúmeros receptores de membrana estão envolvidos na manutenção da homeostase da matriz celular; destes, integrins e receptor de fator de crescimento epidérmico (EGFR) têm sinergia robusta 6,7. Classicamente, os integrinos estabelecem a ligação mecânica entre o microambiente e o citoesqueleto intracelular, enquanto o EGFR regula o crescimento celular, a proliferação e a sobrevivência 8,9. O EGFR é um alvo terapêutico altamente estudado, focado na regulação externa facilitando a sinalização intracelular. O crosstalk EGFR-integrin foi estabelecido geneticamente e bioquimicamente para regular a progressão de múltiplas doenças, incluindo o câncer10,11. Embora estudos indiquem a existência de interação EGFR-integrin, os desfechos são atribuídos à sinalização de caminhos longe da membrana plasmática 7,12,13,14. O impacto do EGFR, ou outros fatores de crescimento, na mecânica celular permanece em grande parte inexplorado em parte devido à falta de ferramentas para medir forças celulares e resultados de sinalização. O desafio está na identificação de ferramentas adequadas para estudar a comunicação entre esses paradigmas de sinalização paralela e quantificar suas contribuições específicas para a mecânica celular.
Várias abordagens foram desenvolvidas para medir forças geradas por receptores de adesão celular, e o leitor é direcionado para revisões aprofundadas dessas técnicas15,16. Resumidamente, a microscopia de força de tração e a detecção de matriz de micro-pilares dependem da deformação de um substrato subjacente para inferir forças nanonovton (nN), uma ordem de magnitude mais do que as forças individuais do receptor17,18. Técnicas de molécula única, incluindo AFM e pinça óptica, são sensíveis a forças de piconewton de proteína única (pN), mas medem apenas um receptor de cada vez e não oferecem uma boa (ou qualquer) resolução espacial. Sondas de tensão molecular baseadas em DNA e sondas de medidor de tensão (TGT) oferecem resolução de força pN com resolução espacial limitada (ou melhor) baseada em difração, dando-lhes um papel único no estudo de forças unicelulares19,20 de diversos tipos de células, incluindo fibroblastos, células cancerosas, plaquetas e células imunes 21,22,23,24 . Enquanto as sondas de tensão molecular têm um elemento "mola" extensível, ideal para imagens em tempo real, as sondas TGT se rompem irreversivelmente, deixando para trás uma "história de força" fluorescente. TGTs também modulam o limiar de tensão do substrato subjacente; uma série de sondas com composições químicas semelhantes, mas diferentes forças de ruptura, ou tolerâncias de tensão (Ttol), podem ser usadas para quantificar a tensão mínima necessária para a formação de adesão focal e a disseminação celular. As sondas TGT consistem em dois fios complementares de DNA, um ancorado na superfície e o outro apresentando um ligante à célula. Se um receptor ligar o ligante e exercer uma força maior que otol T da sonda, os fios serão separados. Otol T é definido como a força constante necessária para romper 50% das sondas em um intervalo de 2 s em condições ideais. Em sondas TGT "turn-on", uma saciador no fio superior pode ser separada de um fluoróforo no fio inferior. Somente quando a sonda TGT tiver sido rompida, presumivelmente por forças maiores ou iguais a Ttol, será gerado um sinal fluorescente. As sondas TGT também podem ser corrigidas, permitindo fácil manipulação de sistemas biológicos e testes de múltiplas condições. Por essas razões, foram utilizadas sondas TGT neste trabalho.
As sondas TGT foram empregadas para estudar como a adesão celular dependente da integrin e as forças mecânicas são moduladas pelo EGFR21 ativado. Este trabalho estabeleceu a EGFR como uma "mecano-organizadora", afinando a organização de adesão focal e a geração de tensão. Além disso, verificou-se que a estimulação do EGF influenciou a distribuição e a maturidade das aderências focais e a maior disseminação celular. Essa abordagem poderia ser usada em estudos futuros para investigar como fatores de crescimento influenciam as forças mecânicas na progressão e dinâmica do tumor. Embora o papel do crosstalk EGFR-integrin na regulação da transição epitelial para a transição mesenquimal seja estabelecido, o papel das forças mecânicas neste processo permanece sub-explorado10.
Aqui, um protocolo detalhado é apresentado para esses experimentos que abrangem a síntese e montagem de 56 sondas PN TGT, geração de superfícies TGT em tampas de vidro, aplicação de células Cos-7 na superfície TGT e estimulação com EGF, fixação e coloração de células com fhalloidina, e um anticorpo anti-paxillin, fluorescência de reflexão interna total de alta resolução (TIRF) e imagens de microscopia de contraste de interferência reflexiva (RICM), e quantificação de imagem. Este protocolo, embora escrito para investigar a estimulação EGF das células Cos-7, é prontamente adaptável para muitos experimentos baseados em TGT. Diferentes ligantes,tol T, tipos de células, parâmetros de estimulação, proteínas rotuladas após a fixação e análise quantitativa podem ser facilmente substituídas, tornando este protocolo robusto e amplamente útil.
Protocolo
1. Preparação de oligonucleotídeos TGT
NOTA: Os detalhes da síntese da sonda oligonucleotídeo estão descritos aqui. Por favor, note que algumas modificações e etapas de purificação podem ser terceirizadas para síntese personalizada.
- Ative a amina primária do peptídeo cyclo[Arg-Gly-Asp-D-Phe-Lys(PEG-PEG)] com o linker azide-NHS, conforme descrito por Zhang et al22 , misturando-se em uma proporção de 1:1.5 (100:150 nmoles) em um volume final de 10 μL dimetilamformida. Adicione 0,1 μL da trietilamina base orgânica e incubar por 12 h a 4° C.
- Purifique o produto por fase inversa HPLC utilizando 0,1 M TEAA (solvente A) e 100% acetonitrilo (solvente B) com uma taxa de fluxo de 1mL/min e a condição inicial de 10% de solvente B fixado em um gradiente de 0,5%/min. Combine os picos elucidos (absorvância a 203 nm) e verifique pela espectrometria de massa MALDI-TOF. O produto é cRGDFK-azide.
- Para gerar o fio superior TGT, combine cRGDfK-azide e oligonucleotídeo alkyne-21-BHQ2 (fio superior TGT: 5Hexynyl/GTGAAATACCGCACAGATGG/3BHQ_2) em uma proporção de 2:1 ( ͂ 200 μM: 100 μM) em 100 μL de 1x Salina Tamponada fosfato (PBS) com ascorbate de sódio de 5 mM e 0,1 μM de-THPTA pré-formado. Deixe a reação proceder por uma mínima de 4h à temperatura ambiente (RT) ou durante a noite a 4 °C.
- Processe a mistura através do gel de desalagem P2 para remover o excesso de corante, subprodutos, solvente orgânico e reagentes não redigidos. Prepare a coluna centrífuga com 650 μL de gel P2 pré-hidratado girando-a a 18.000 x g por 1 min. Descarte o líquido de fluxo e adicione a mistura de reação. Gire novamente a 18.000 x g por 1 min e colete o fluxo-through. Leve a mistura de reação a um volume final de 300 μL com água ultrapura.
NOTA: Pré-hidrate o gel P2 com água por 6h. - Purifique a mistura de reação desaltada pelo HPLC de fase inversa. Os solventes orgânicos utilizados para esta purificação incluem 0,1 M TEAA em H2O (solvente A) e 100% MeCN (solvente B, ou a fase móvel).
- Antes de injetar a mistura, equilibre a coluna com uma condição inicial de 10% solvente B com um gradiente de 1%/min. Ajuste a vazão para 1 mL/min. Injete a mistura de reação no laço HPLC com uma agulha de injeção de 500 μL.
- Colete o produto visualizando o pico de absorção em 260 nm para o DNA e 560 nm para o quencher BHQ2. Seque o produto elucido durante a noite em um concentrador centrífugo a vácuo.
- Empregue a substituição nucleofílica para acoplar o fio inferior TGT ao éster Cy3B-NHS, conforme descrito em Ma et. al25. Misture 100 μM do fio inferior TGT de 56 pN (5Biosg/TTTTTT/iUniAmM/CGCATCTGTGGGGTATTTCACTTT) com 50 μg de Cy3B-NHS ester pré-dissolvido em 10 μL de DMSO. Ajuste o pH desta mistura para 9 com bicarbonato de sódio de 0,1 M e leve o volume final a 100 μL com 1x PBS. Incubar a mistura de reação durante a noite no RT.
- Purifique a mistura sequencialmente usando filtragem de gel P2 e HPLC de fase inversa para separar reagentes, sais e solventes orgânicos não redigidos (descritos nas etapas 1.4 e 1.5).
- Estime a concentração dos conjugados purificados de oligonucleotídeo-corante registrando sua absorvência a 260 nm usando um espectotógrafo.
- Caracterize os produtos purificados pela espectrometria de massa MALDI-TOF. Dissolva o excesso de ácido 3-hidroxipicónico em solvente TA50 (50:50 v/v acetonitrila e 0,1% TFA em ddH2O) para preparar a nova matriz MALDI. Os pesos moleculares estimados e medidos para os produtos rotulados são: cRGDfK-1-BHQ2 - 8157,9 (calculados), 8160,1 (encontrados); Cy3B rotulado 56 pN TGT - 10272,7 (calculado), 10295,8 (encontrado).
- Dissolva os fios superior e inferior separadamente em água sem nuclease em uma concentração entre 30-50 μM. Use pontas de pipeta sem DNase para evitar contaminação do estoque. Armazene a 4 °C para aplicações de curto prazo ou -20 °C para aplicações de longo prazo. A estabilidade dos oligonucleotídeos não é afetada por ciclos repetidos de congelamento.
2. Preparação da superfície
Dia 1º:
- Coloque tampas de vidro de 25 mm (até 8) em um rack de politetrafluoroetileno. Coloque o rack em um béquer borossilicato de 50 mL contendo 40 mL de 200 etanol à prova. Cubra o béquer com filme de parafina para evitar que a água entre e sonicar a uma frequência operacional de 35 kHz por 10-15 min na RT (Figura 1A).
- Encha um béquer de 50 mL com 40 mL de solução piranha recém-preparada misturando ácido sulfúrico e peróxido de hidrogênio em uma proporção de 3:1 em um béquer pyrex. Mexa com uma pipeta de vidro. Transfira o rack de deslizamento de tampa para o béquer e incubar por 30 minutos no RT no capô da fumaça para gravar a superfície do deslizamento de tampa (Figura 1B).
NOTA: Use EPI completo, incluindo um jaleco, luvas e óculos, e trabalhe no capô da fumaça química. Adicione peróxido de hidrogênio ao ácido lentamente para evitar o superaquecimento da solução. - Após a gravação, use pinças para transferir o rack de deslizamento de tampas para um béquer com água ultrapura. Repita esta etapa seis vezes em intervalos de 15 s para neutralizar completamente o ácido (Figura 1C).
NOTA: Deixe a solução piranha no capô da fumaça química durante a noite antes de descartá-la no recipiente de resíduos ácidos. - Inspecione visualmente as tampas para garantir que as superfícies pareçam limpas sem padrões ou partículas de poeira na superfície do vidro. Repita as etapas 2.1-2.4 se forem detectados padrões ou poeira.
NOTA: Teste a hidrofilidade superficial mergulhando tampas tratadas na água e removendo-as verticalmente. A água em tampas tratadas recua como uma folha uniforme para formar os anéis de Young em comparação com deslizamentos não tratados que formam manchas. - Transfira o rack de tampas para um béquer com 200 etanol à prova e lave duas vezes por 15 s para equilibrar superfícies para solvente orgânico. Transfira o rack de deslizamento de cobertura para a solução de etanol à prova de 200 com 3% de APTES por 1h no RT para silanizar as tampas (Figura 1D). Cubra o béquer com filme de parafina.
NOTA: Os parâmetros de deposição APTES variam dependendo do método de limpeza da superfície, teor de água solvente, concentração de APTES, tempos de incubação e temperatura para ressardiação. - Mergulhe o rack em um béquer limpo com 200 soluções à prova de etanol. Repita esta lavagem três vezes por 15 s cada (Figura 1E).
- Seque as tampas usando gás nitrogênio (N2) com baixa pressão de saída. Coloque as tampas em um prato de poliestireno de 10 cm com um pedaço de filme de parafina colocado no fundo. Certifique-se de que as tampas estão secas e separadas (Figura 1F).
- Adicione 100 μL de solução NHS-biotina de 2 mg/mL em DMSO a quatro tampas colocadas em filme de parafina. Coloque um "sanduíche" com as outras quatro tampas por cima (duas tampas voltadas para o outro com a solução de funcionalização no meio) e incubar o prato durante a noite a 4 °C (Figura 1G).
NOTA: A 4 °C, o reagente NHS é mais estável, o que facilita a funcionalidade uniforme da superfície. Além disso, o sanduíche conserva reagentes. Evite adicionar excesso de solução no sanduíche, pois pode vazar e fazer com que as manchas deslizem.
Dia 2:
- Retire o prato a partir de 4 °C e separe as tampas sanduíches. Oriente os deslizes no rack com a superfície revestida voltada uma para a outra, como mostrado na Figura 2A. Lave-os com 200 soluções à prova de etanol três vezes por 15 s cada. Seque com gás N2 e coloque-os em um novo prato com um filme de parafina dentro dele.
NOTA: Orientar as tampas conforme indicado ajuda a identificar a superfície funcionalizada. - Lave as tampas com 1 mL de 1x PBS três vezes para equilibrá-las de volta à fase aquosa. Adicione 800 μL de 0,1% de albumina de soro bovino (BSA) em 1x PBS (c/v) a cada um dos coverlips e incubar em RT por 30 minutos para passivar a superfície e bloquear a ligação não específica dos reagentes de funcionalização subsequentes (Figura 2B).
- Após a incubação, lave as tampas três vezes com 1 mL de 1x PBS. Adicione 800 μL de 1 μg/mL de streptavidina em 1x PBS em RT por 45-60 min para funcionalizar as tampas (Figura 2C).
NOTA: Retenha uma mancha de cobertura sem streptavidin para verificar a eficiência de passivação (opcional). Moléculas biotiniladas adicionais nM e imagem usando condições experimentais. Esta intensidade de superfície deve estar próxima do ruído escuro da câmera. - Simultaneamente com a etapa 2.11, monte as sondas TGT (superior: fio inferior na relação molar de 1:1) em uma concentração final de 50 nM em 100 μL de 1 M NaCl em um tubo PCR usando um termociclador. Dissociar os fios a 95 °C por 5 min, e gradualmente ressar reduzindo a temperatura para 25 °C e mantendo-a por 25 min (Figura 2D). Evite a exposição prolongada das sondas TGT à luz.
- Após a incubação de streptavidin, use 1x PBS para lavar as tampas três vezes. Adicione 100 μL das sondas TGT pré-montadas a quatro das tampas e faça sanduíches usando as 4 tampas restantes com o lado funcionalizado voltado para as sondas (oito superfícies requerem quatro tubos de sondas TGT hibridizadas). Cubra com papel alumínio e incubar por 1 h no RT para permitir a ligação da sonda à superfície (Figura 2E).
- Após a incubação, separe os sanduíches e lave as tampas com 1x PBS três vezes. As superfícies TGT estão prontas para imagens. Monte cuidadosamente as tampas em câmaras de imagem pré-limpas e adicione 1x PBS para manter as superfícies hidratadas (Figura 2F).
NOTA: Apertar demais as câmaras vai quebrar a superfície. Evite a secagem das superfícies.
3. Preparação e coloração celular
- Para investigar o efeito da estimulação do fator de crescimento epidérmico (EGF) na mecânica Cos-7, adesão e disseminação celular, as células Cos-7 trypsinize com 0,05% de Trypsin-EDTA por 2 min. Neutralize a trippsina lavando com HBSS e centrifugando a 800 x g por 5 min. Repita o passo de neutralização mais uma vez.
- Células de placa a uma densidade de 4 x 104 células nas superfícies TGT montadas no DMEM (Modified Eagle Medium, meio de águia modificada) de Dulbecco( DMEM) suplementadas com 50 ng/mL EGF ou DMEM sem EGF. Permita que as células se espalhem por 60 min a 37 °C com 5% de CO2 em uma incubadora de cultura celular (Figura 3A).
NOTA: As células são incubadas no DMEM sem soro para evitar estímulos de fatores de crescimento. O EGF é diluído em ácido acético de 10 mM para fazer um estoque de 1 mg/mL. É usado a 50 ng/mL em DMEM para experimentos de imagem. - Após a incubação, lave as células três vezes com 1x PBS e fixe com 2 mL de 4% de paraformaldeído por 12 min em RT (Figura 3B).
NOTA: Todas as etapas de incubação são realizadas em um shaker rotativo a ~35 rpm para disseminação uniforme das soluções. Proteja as superfícies TGT da luz cobrindo-as até que estejam prontas para a imagem. - Aspire o fixador e lave as tampas cinco vezes com 1x PBS em intervalos de 5 minutos no RT. Opcionalmente, incubar as tampas com 50 mM NH4Cl em 1x PBS por 30 min a 37 °C para saciar a autofluorescência associada ao paraformaldeído e lavar três vezes com 1x PBS em intervalos de 5 min (Figura 3B).
- Adicione buffer A (1x PBS, 5% soro normal de cavalo, 5% soro normal de cabra, 1% BSA, 0,025% Triton X-100) e incubar por 30 min a 37 °C para bloquear e permeabiliizar as células. Lave três vezes com 1x PBS em intervalos de 5 minutos (Figura 3B).
- Coloque as câmaras de imagem com tampas em um recipiente de umidade. Diluir o anticorpo anti-paxillin primário (marcador de adesão focal) em 1:250 no tampão de bloqueio (1x PBS, 5% de soro normal de cavalo, 5% soro normal de cabra, 1% BSA, 0,005% Triton x-100). Incubar com 200 μL de solução de anticorpos primários por deslizamento de cobertura por 2h a 37 °C (Figura 3B).
NOTA: Não deixe as superfícies secarem. - Lave as tampas cinco vezes com 1x PBS em intervalos de 5 minutos e devolva-as ao recipiente de umidade. Células de rotulagem simultaneamente com uma mistura de corante conjugado anticorpo anti-coelho secundário a 1:800 diluição e corante phalloidina conjugada (actina) a 1:400 diluição em 200 μL de bloqueio tampão por deslizamento de cobertura. Incubar a 37 °C por 60 min (Figura 3B).
- Lave as superfícies cinco vezes com 1x PBS em intervalos de 5 minutos e armazene a 4 °C até estar pronto para a imagem (Figura 3B).
NOTA: Amostras de imagem dentro de 3 dias após a preparação da superfície para evitar a degradação do sinal.
4. Aquisição de imagens
- Use um objetivo de imersão em óleo 60x com uma alta abertura numérica (1,49) em um microscópio invertido com excitação 488, 561 e 647 TIRF, excitação RICM, um sistema de foco perfeito e uma câmera digital.
- Adicione óleo ao objetivo, limpe o fundo da colher de cobertura da câmara de amostra e coloque a amostra no palco. Concentre-se em uma célula e engaje o foco perfeito.
- Coloque o microscópio no modo de imagem RICM com excitação de epifluorescência e um cubo de filtro GFP com o filtro de emissão removido. Alinhe o RICM fechando e centralizando o diafragma de abertura epi-iluminação.
- Coloque o microscópio no modo TIRF com excitação a laser e um cubo de filtro TIRF quádruplo. Concentre o laser de 488 nm em um pequeno ponto no teto da sala e aumente o ângulo de incidência até além do ângulo crítico enquanto monitora a fluorescência na câmera no modo ao vivo. Observe uma redução acentuada da fluorescência de fundo e um único plano em foco quando o ângulo crítico for superado.
NOTA: O TIRF excita uma região fina (~100 nm) mais próxima da interface de deslizamento de amostra, destacando sondas TGT abertas e aderências focais, eliminando fluorescência fora de foco de dentro da célula. Se o TIRF não estiver disponível, pode-se utilizar epi-fluorescência; no entanto, as relações sinal-ruído serão menores. - Identifique células para imagens usando o modo "ao vivo" da câmera usando RICM.
- Adquirir a imagem RICM e imagens TIRF de actin (640 nm ex), tensão integrin (561 nm ex) e paxillin (488 nm ex). Obtenha imagens sequencialmente usando um tempo de exposição de 200 ms.
NOTA: O tempo de exposição depende de muitos fatores, incluindo o objetivo, a potência do laser, filtros de emissão e a sensibilidade da câmera. O sinal deve ser pelo menos 2x maior que o fundo. O fundo é de cerca de 1000 UA, então o sinal deve ser pelo menos 2000-3000 UA. - Repita 4.4-4.5 para pelo menos 30 células. Alterar tampas, focar e repetir 4.4-4.5.
5. Análise de dados
NOTA: Realize análises quantitativas de imagens usando o software Fiji e a análise usando software estatístico.
- Abra o conjunto de imagens para uma célula.
- Crie uma máscara da área celular (máscara RICM) traçando o limite da célula na imagem RICM usando a ferramenta de seleção ImageJ Freehand. Salve a região de interesse (ROI) para o gerente do ROI (Analyze > Tools > gerente de ROI) (Figura 4A1,2).
- Escolha uma área representativa fora da célula na imagem de tensão integrin e desenhe um ROI de pelo menos 200 x 200 pixels. Exclua quaisquer outras células ou detritos fluorescentes do ROI. Meça a fluorescência de fundo no ROI utilizando a ferramenta de medida (Analisar > Medida) (Figura 4A3).
- Subtraia a fluorescência de fundo média obtida na etapa 5.2 da imagem de tensão (Process > Math > Subtract) (Figura 4A4).
- Use a máscara RICM estabelecida na etapa 5.2 para definir o sinal de tensão dentro da pegada celular (o gerente do ROI > Selecionar > Aplicar máscara > Editar > Limpar fora) (Figura 4A5).
- Crie uma máscara de limiar para a imagem de tensão usando o método de Huang para limiar automático (Imagem > Ajuste > Limiar) (Figura 4A6). Certifique-se de que a máscara de limiar representa melhor a área para a tensão integrin gerada. Como regra geral, defina o limiar para 2x a fluorescência média de fundo.
- Crie uma seleção da máscara de tensão limiar (Editar > Seleção > Criar) (Figura 4A7).
- Transfira a máscara selecionada para a imagem de tensão gerada na etapa 5.4 e meça a intensidade integrada dos testes abertos (o gerente do ROI > Select (Tension Mask) > Analyze > Measure > RawIntDen) (Figura 4C).
- Meça a área de propriedades morfométricas da célula, a circularidade e a razão de aspecto da máscara RICM (gerente do ROI > Select (máscara RICM) > Aplicar máscara > Analisar > Medida) (Figura 4B).
- Meça a densidade de ruptura mecânica, definida como a porcentagem da pegada celular com sondas rompidas, selecionando a imagem da máscara de tensão e aplicando a máscara RICM (gerente do ROI > Select (Máscara RICM) > Analisar > Medida > % Área) (Figura 4C).
- Exporte as medições para análise e visualização posteriores em software estatístico.
- Repita 5.1-5.11 para cada célula.
Resultados
Sondas TGT ativadas foram usadas para investigar o efeito do receptor de fator de crescimento epidérmico ativado por ligante (EGFR) na mecânica celular mediada pela integrin e na formação de adesão nas células Cos-721. As sondas apresentam o ligante cíclico Arg-Gly-Asp-Phe-Lys (cRGDfK)21,23,25,26, que é seletivo para o heterodimer integrin αVβ3 com apenas uma pequena afinidade para α5β1 integrins 27,28,29,30. A sonda TGT compreende um DNA duplex funcionalizado em uma superfície de deslizamento de vidro através da cadeia inferior usando a ligação biotina-streptavidina. A cadeia superior exibe o ligante integrino e está disponível para se ligar ao receptor integrin cognato na membrana celular (Figura 5A). O fio inferior é rotulado com um fluoróforo e o fio superior com uma saciador, levando a fluorescência de fundo mínima quando o duplex TGT está intacto. Se um integrino ligar o ligante e aplicar uma força com uma magnitude maior que otol T da sonda, o duplex de DNA se separará levando à fluorescência (Figura 5A). Qualquer sonda TGT que não tenha sido rompida por uma força mecânica permanecerá não fluorescente. Esta fluorescência seletiva de força permite o mapeamento sistemático e quantitativo das forças geradas pela escala pN na resolução limitada à difração. As sondas TGT modulam adicionalmente o limiar de tensão do substrato.
Mostrado aqui é um exemplo representativo de uma superfície TGT com umtol T de 56 pN. As células Cos-7 foram banhadas nesta superfície TGT com ou sem estimulação EGF para estudar o impacto da ativação do EGFR com estimulação de ligantes na adesão celular e mecânica integrin (Figura 5A,B). As células foram incubadas com ou sem EGF nas superfícies TGT por 60 minutos, fixas e imuno-manchadas para exibir a distribuição de adesão focal (paxillin) e a organização do citoesqueleto (F-actin) (Figura 5B). As células foram então imagens usando microscopia RICM e TIRF. Como claramente visto na imagem RICM, a célula Cos-7 que se espalha na superfície TGT de 56 pN foi significativamente melhorada com a estimulação EGF em comparação com sem estimulação. Isso foi quantificado para 50 células em cada condição medindo o tamanho da região de contato do substrato celular a partir da imagem RICM (Figura 5C). A estimulação com EGF resultou em uma morfologia mais circular, representativa das células Cos-7 que se espalham e crescem em seu ambiente fisiológico natural (Figura 5D). A fluorescência de sondas abertas também é maior com a estimulação EGF, como observado na imagem de fluorescência de tensão. A intensidade integrada das sondas abertas, proporcional ao número de sondas abertas, foi muito maior com a estimulação EGF em comparação com o sem (Figura 5B,E). Esta é uma representação de todos os engajamentos receptor-ligantes onde os integrinos aplicaram uma força maior que ttol (56 pN).
A coloração com paxillin mostrou que a distribuição, número, maturação (tamanho) e organização de aderências focais também foram impactadas pela estimulação do EGF. As aderências focais nas células estimuladas pelo EGF pareciam mais maduras e radialmente orientadas em comparação com nenhum controle EGF. A organização citoesqueletal F-actin também foi aprimorada com estimulação EGF, conforme avaliado pela coloração da fhalloidina (Figura 5B). Essas avaliações qualitativas foram feitas por comparação visual de imagens de ambos os grupos de tratamento. A análise quantitativa da adesão focal pode ser feita, mas está além do escopo deste protocolo. Neste experimento, a superfície TGT forneceu uma plataforma para detalhar sistematicamente o efeito da ativação do EGFR na disseminação celular, mecânica integrin e formação de adesão focal.
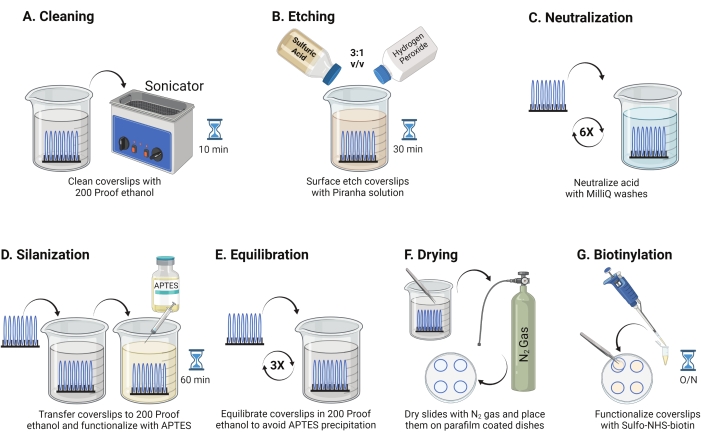
Figura 1: Esquema para o dia 1 da preparação da superfície TGT. (A) Limpe as tampas. (B) Etch a superfície de deslizamento de tampa. (C) Neutralizar a solução piranha. (D) Silanize a superfície para fazer grupos de amina reativa. (E) Equilibre as tampas até a fase orgânica. (F) Seque as tampas com um gás inerte. (G) Biotinilar os grupos de amina da superfície. Clique aqui para ver uma versão maior desta figura.
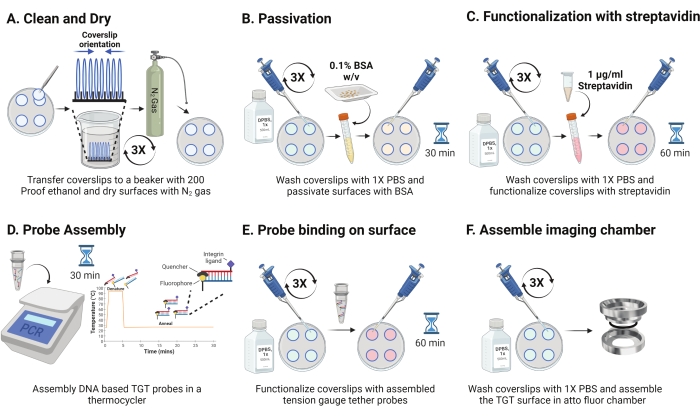
Figura 2: Esquema para o dia 2 da preparação da superfície TGT. (A) Limpe e seque as tampas para remover qualquer biotina residual do dia anterior. (B) Passivate com BSA para evitar a ligação não específica do reagente nas etapas subsequentes. (C) Funcionalize as tampas com streptavidina. (D) Hibridize as sondas em um ciclo termo. (E) Aplique as sondas sintetizadas nas manchas (F) Monte o deslizamento na câmara de imagem celular. Clique aqui para ver uma versão maior desta figura.
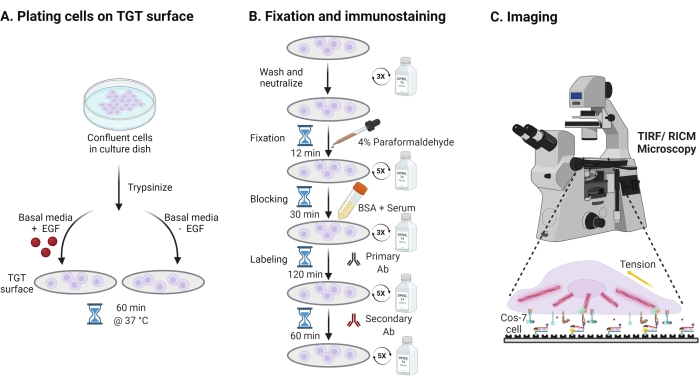
Figura 3: Fluxo de trabalho geral destacando os passos amplos em toda a configuração experimental. (A) Processo para desprendimento celular e revestimento na superfície TGT em mídia basal (DMEM) com ou sem estimulação EGF. (B) Fluxograma das etapas envolvidas na fixação e imuno-coloração pós-fixação e disseminação na superfície TGT. (C) Pós-coloração, as células são imagens em um microscópio de fluorescência invertida com microscopia RICM e TIRF. Clique aqui para ver uma versão maior desta figura.
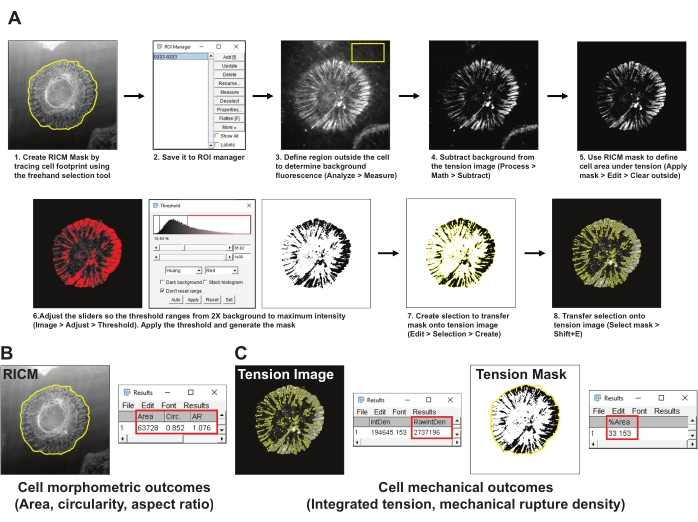
Figura 4: Exemplo de processamento de dados e análise quantitativa. (A) Detalhamento passo a passo do pipeline de análise empregado em Fiji (ImageJ) para quantificação de imagem RICM e tensão. (B) Um exemplo representativo para os desfechos morfométricos de células analisados usando o gasoduto acima. (C) Exemplos representativos para desfechos mecânicos de células analisados utilizando o pipeline acima mencionado. Clique aqui para ver uma versão maior desta figura.
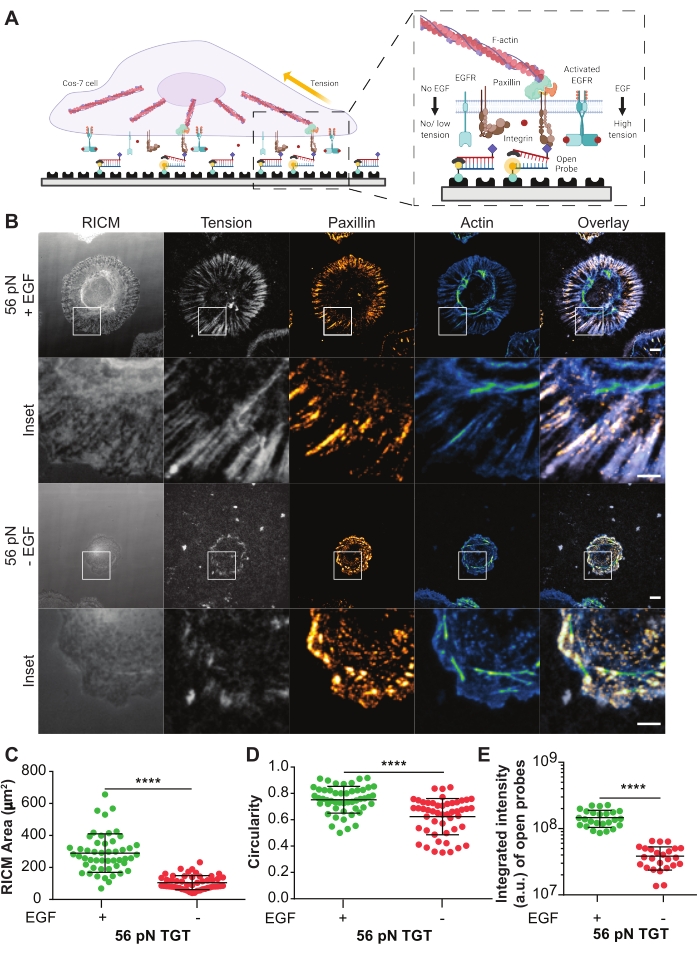
Figura 5: Exemplos de dados de um experimento TGT. (A) Diagrama destacando a zona de contato na interface de superfície membrana celular-TGT. Inset projeta integrins interagindo com seu ligante cognato cRGDFK com (direita) ou sem (esquerda) estimulação EGF. (B) Imagens RICM e TIRF de células Cos-7 espalhadas na superfície TGT de 56 pN. As imagens são obtidas 60 min pós-chapeamento com ou sem estimulação EGF. Imagens individuais de RICM (como adquirida), tensão integrin (escala de cinza), paxillin (quente laranja) e F-actin (azul-esverdeado) são mostradas com sobreposições para ambas as condições de estimulação. Barra de escala: 10 μm. O inset destaca um ROI ampliado (região de interesse) detalhando a colocalização da tensão integrin gerada em locais de formação de adesão marcados por paxillin, e a organização citoesqueletal subcelular subjacente marcada pela actina. Barra de escala: 5 μm. (C-E) Dispersar parcelas para a área de disseminação (pegada celular RICM) (C), circularidade (D) e tensão integrada (E) para células Cos-7 com ou sem estimulação EGF. As barras indicam ± S.D. As diferenças entre os grupos foram avaliadas estatisticamente com o teste t do Aluno; P < 0,0001. n = 50 células em três experimentos independentes. Clique aqui para ver uma versão maior desta figura.
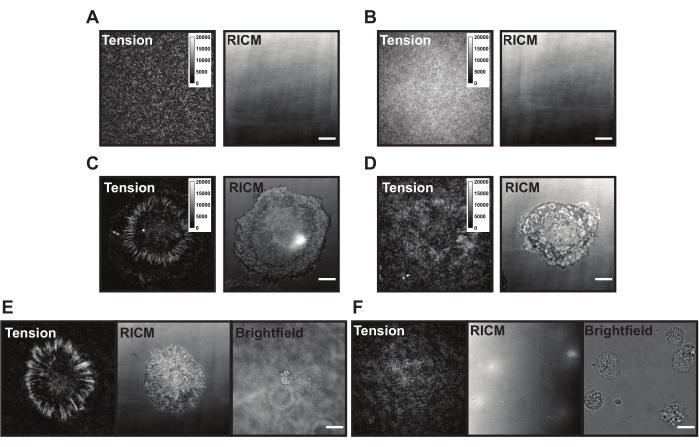
Figura 6: Exemplo superfícies TGT com diferentes possíveis problemas. (A) Imagens de tensão e RICM de uma superfície TGT ideal com sonda montada saciada antes da adesão celular. (B) Imagens de tensão e RICM de uma superfície TGT onde a sonda TGT não tem o fio superior (quencher). A imagem de tensão mostra fluorescência uniforme de fluoróforo aberto no fio inferior. (C) Imagens de tensão e RICM para células espalhadas em uma superfície TGT ideal. (D) Imagens de tensão e RICM para células espalhadas em uma superfície TGT mal fabricada com passivação limitada ou sonda degradada. (E) Imagens de tensão, RICM e campo brilhante para células banhadas em uma superfície ideal com ligante cRGDFK indicando interações cRGDFK-integrin são vitais para a fixação celular e geração de tensão. (F) Imagens de tensão, RICM e campo brilhante para células banhadas em uma superfície sem ligante cRGDFK no TGT. Enquanto as células são visíveis na imagem de campo brilhante, nenhum acessório celular ou tensão integrin gerada é observado. Barra de escala: 10 μm. Clique aqui para ver uma versão maior desta figura.
Discussão
Com o procedimento passo a passo detalhado descrito acima, pode-se preparar superfícies TGT para quantificar a morfologia celular e a tensão integrin gerada por células aderentes durante o apego celular e a disseminação após o tratamento com EGF. O design direto da sonda e a síntese e preparação da superfície, juntamente com a configuração experimental simples forneceram uma plataforma estável para estudar a interação de EGFR e integrins. No geral, os resultados validam que a ativação dependente de ligantes do EGFR melhora a disseminação celular, sintoniza as propriedades de força dos receptores integrin e promove a organização de adesão focal e o amadurecimento. Os resultados obtidos por meio de sondas TGT corroboram a hipótese abrangente de que fatores de crescimento, como o EGFR, atuam como "mecano-organizadores", aumentando a quantidade e a organização espacial da tensão integrin e regulando a orientação e a mecânica das aderências focais.
Ao serem aplicação na superfície TGT, as células pousam, anexam e se espalham à medida que os receptores integrin (αVβ3) sentem e se ligam ao ligante cRGDFK. Ao fazê-lo, as sondas TGT podem ser mecanicamente rompidas, gerando fluorescência no local do engajamento do ligante. A leitura é o cumulativo "histórico de força" da célula interagindo com a superfície. Existem alguns problemas comuns com as superfícies TGT que podem estar presentes durante esses experimentos. Fluorescência de fundo de superfície alta (Figura 6A,B), aparência de superfície irregular, falha das células para gerar sinal de tensão (Figura 6C,D) e falha das células a se espalharem (Figura 6E,F) podem ser devido a deficiências técnicas com a sonda TGT ou síntese superficial. As soluções para essas questões comuns são apresentadas na Tabela 1.
O design simples das sondas TGT fornece aos biólogos celulares uma poderosa ferramenta para estudar resultados específicos de sinalização de fatores de crescimento integrin isoladamente sem interferência de outros receptores de superfície celular, fornecendo apenas ligantes e estímulos específicos. Além disso, as sondas TGT permitem a investigação do limiar de tensão sublinhando receptores individuais de integrin durante a adesão celular à sensibilidade pN. Abordagens alternativas não relatam forças exercidas por receptores individuais com alta resolução espacial em amostras fixas31. A microscopia de força de tração só é sensível às forças nN, uma ordem de magnitude superior às forças aplicadas pelos receptores integrin individuais15, e as sondas de tensão molecular medem as forças da PN, mas por serem reversíveis, elas não resistem robustamente à fixação. Por essas razões, as sondas TGT são uma ferramenta atraente para estudar a mecânica das interações fator-integrin de crescimento.
Existem várias nuances técnicas associadas a sondas TGT que devem ser consideradas antes de projetar um experimento. A imagem de tensão é um instantâneo no tempo, representando o histórico de força e não um indicador dos compromissos receptor-ligantes em qualquer momento. Como a geração de sinal depende da separação da sonda, a fluorescência TGT resulta de sondas abertas não sob tensão ativa do engajamento receptor-ligante. Isso significa que a leitura da tensão integrin obtida na superfície TGT é histórica e cumulativa na natureza representando onde havia forças maiores quet tol; as localizações das forças receptor-ligantes atuais inferioresao T tol não são relatadas19,32. Como a ruptura TGT resulta no término do engajamento receptor-ligante, a disseminação celular é devido a interações integrin-ligantes que experimentam forças mais baixas queo tol T. Portanto, o usuário deve ter cuidado ao definir o tempo pós-chapeamento para estimar os resultados mecânicos associados às adesões baseadas em integrin. Finalmente, o significado de Ttol deve ser considerado. As sondas TGT empregadas aqui têm umtol T de 56 pN, onde ttol é a força constante necessária para romper 50% das sondas quando aplicada para 2 s. Ao considerar sistemas biológicos complicados, os TGTs provavelmente experimentam uma gradação de força heterogênea e diversificada com diferentes dependências de tempo. Se os TGTs forem rompidos por forças maiores queo T tol, a fluorescência seria uma subestimação da tensão total. Alternativamente, forças abaixo dotol T aplicadas por durações mais longas podem romper um número semelhante de sondas, uma vez que forças de alto limiar aplicadas para tempos mais curtos. Ambos os cenários podem resultar na mesma leitura de intensidade de fluorescência, dificultando a resolução da magnitude exata da tensão ou dinâmica usando sondas TGT33,34.
No geral, avaliações de tensão integrin com estimulação de fatores de crescimento devem ser feitas cuidadosamente projetando experimentos com controles internos, comparando perfis de disseminação em outras superfícies revestidas de matriz, fazendo avaliações paralelas da fluorescência TGT nas células na presença ou ausência de estimulação de fatores de crescimento, e usando TGTs com diferentestol T . Os TGTs permitem quantificação do papel do fator de crescimento sinalizando na regulação da mecânica dos receptores integrin, dinâmica de adesão focal e disseminação celular. Este protocolo pode ser usado como um modelo para muitos experimentos baseados em TGT usando sondas com diferentestol T, diferentes ligantes, diferentes tipos de células ou diferentes condições de estimulação. Qualquer proteína de interesse pode ser rotulada após a fixação, e qualquer tipo de análise quantitativa de imagem pode ser implementada. Como tal, apresentamos um modelo para numerosos experimentos TGT.
O uso de sondas TGT não se limita a estudar integrinos, mas pode ser estendido a uma variedade diversificada de receptores de membrana celular em diferentes tipos de células modificando o ligante. As sondas TGT têm sido usadas para investigar o papel das forças na regulação de várias cascatas de sinalização de receptores, incluindo a identificação do papel mecânico da mecânica do receptor notch no desenvolvimento embrionário e neurogênese35, as forças mediando a identificação e a internalização de antígenos por receptores de células B36, e a capacidade mecânica de leitura de prova dos receptores de superfície de células T para detectar mudanças nas forças para aumentar a força e especificidade da transferência de sinal37 . Juntos, esses achados destacam o imenso potencial das sondas TGT em uma variedade de configurações experimentais.
Divulgações
Os autores não declaram conflitos de interesse.
Agradecimentos
Os autores gostariam de reconhecer os membros do laboratório Mattheyses para discussões e críticas frutíferas. Reconhecemos o financiamento para A.L.M. da NSF CAREER 1832100 e NIH R01GM131099.
Materiais
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl)triethoxysilane | Millipore Sigma | 440140 | Surface Preparation |
| 3-hydroxypicolinic acid (3-HPA) | Millipore Sigma | 56197 | Maldi-TOF-MS matrix |
| Acetic Acid, Glacial | Fisher Scientific | A38S | Diluting EGF |
| Acetonitrile (HPLC) | Fisher Scientific | A998SK | Oligonucleotide Preparation |
| Alexa Fluor 488 Phalloidin | Cell Signaling Technology | 8878S | Immunocytochemistry |
| Ammonium Chloride | Fisher Scientific | A687 | Immunocytochemistry |
| Anti-Paxillin antibody [Y113] | Abcam | ab32084 | Immunocytochemistry |
| BD Syringes only with Luer-Lok | BD bioscience | 309657 | Surface Preparation |
| Bio-Gel P-2 | Bio-Rad | 1504118 | Oligonucleotide Preparation |
| Bovine Serum Albumin (BSA) Protease-free Powder | Fisher Scientific | BP9703100 | Surface Preparation |
| Cos-7 cells | ATCC | CRL-1651 | Cell Culture, Passage numbers 11-20 |
| Coverslip Mini-Rack, for 8 coverslips | Fisher Scientific | C14784 | Surface Preparation |
| c(RGDfK(PEG-PEG)), PEG=8-amino-3,6-dioxaoctanoic acid | Vivitide | PCI-3696-PI | Oligonucleotide Preparation |
| Cy3B NHS ester | GE Healthcare | PA63101 | Oligonucleotide Preparation |
| Dimethylformamide | Millipore Sigma | PHR1553 | Oligonucleotide Preparation |
| DMEM with L-Glutamine, 4.5g/L Glucose and Sodium Pyruvate | Fisher Scientific | MT10013C | Cell Culture |
| Epidermal Growth Factor human EGF | Millipore Sigma | E9644 | Cell Culture |
| Ethanol, 200 proof (100%) | Fisher Scientific | 22032601 | Surface Preparation |
| Falcon Standard Tissue Culture Dishes | Fisher Scientific | 08-772E | Surface Preparation |
| Fetal Bovine Serum | Fisher Scientific | 10-438-026 | Cell Culture |
| Flurobrite DMEM | Fisher Scientific | A1896701 | Cell Culture |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 647 | Invitrogen | A-21244 | Immunocytochemistry |
| Goat Serum | Fisher Scientific | 16-210-064 | Immunocytochemistry |
| Hank’s balanced salts (HBSS) | Fisher Scientific | 14-170-161 | Cell Culture |
| Horse Serum | Fisher Scientific | 16050130 | Immunocytochemistry |
| Hydrogen Peroxide | Fisher Scientific | H325-500 | Surface Preparation |
| Nanosep MF centrifugal devices | Pall laboratory | ODM02C35 | Oligonucleotide Preparation |
| NHS-azide | Fisher Scientific | 88902 | Oligonucleotide Preparation |
| Nitrogen Gas Cylinder | Airgas | Surface Preparation | |
| No. 2 round glass coverslips - 25 mm | VWR | 48382-085 | Surface Preparation |
| Parafilm M Laboratory Film | Fisher Scientific | 13-374-10 | Surface Preparation |
| Paraformaldehyde 16% | Fisher Scientific | 50-980-487 | Immunocytochemistry |
| PBS, 1X | Fisher Scientific | 21-030-CV | Surface Preparation/Immunocytochemistry |
| Penicillin-Streptomycin (5,000 U/mL) | Fisher Scientific | 15-070-063 | Cell Culture |
| PYREX Low Form Griffin Beakers | Fisher Scientific | 02-540G | Surface Preparation |
| Sodium Ascorbate | Fisher Scientific | 18-606-310 | Oligonucleotide Preparation |
| Sodium Bicarbonate | Fisher Scientific | S233 | Oligonucleotide Preparation |
| Sodium Chloride | Fisher Scientific | BP358 | Surface Preparation |
| Streptavidin | Fisher Scientific | 434301 | Surface Preparation |
| Sulfo-NHS-LC-Biotin | Fisher Scientific | 21335 | Surface Preparation |
| Sulfuric Acid | Fisher Scientific | A300-500 | Surface Preparation |
| TEAA | Fisher Scientific | NC0322726 | Oligonucleotide Preparation |
| Triethylamine | Millipore Sigma | 471283 | Oligonucleotide Preparation |
| Trifluoroacetic Acid (TFA) | Fisher Scientific | PI28901 | Oligonucleotide Preparation |
| THPTA | Fisher Scientific | NC1296293 | Oligonucleotide Preparation |
| Triton X 100 Detergent Surfact Ams Solution | Fisher Scientific | 85111 | Immunocytochemistry |
| Water, DNA Grade, DNASE, Protease free | Fisher Scientific | BP24701 | Oligonucleotide Preparation |
| Equipment | |||
| Agilent AdvanceBio Oligonucleotide C18 column, 4.6 x 150 mm, 2.7 μm | Agilent | 653950-702 | Oligonucleotide Preparation |
| High-performance liquid chromatography | Agilent | 1100 | Oligonucleotide Preparation |
| Low Speed Orbital Shaker | Fisher Scientific | 10-320-813 | Immunocytochemistry |
| Matrix-assisted laser desorption/ ionization time-of-flight mass spectrometer (MALDI-TOF-MS) | Voyager STR | Oligonucleotide Preparation | |
| Molecular Probes Attofluor Cell Chamber | Fisher Scientific | A7816 | Surface Preparation |
| Nanodrop 2000 UV-Vis Spectrophotometer | Thermo Fisher | Oligonucleotide Preparation | |
| Nikon Eclipse Ti inverted microscope | pe Nikon | Microscopy | |
| Nikon Perfect Focus System | Nikon | Microscopy | |
| NIS Elements software | Nikon | Microscopy | |
| ORCA-Flash4.0 V3 Digital CMOS camera | Hamamatsu | Microscopy | |
| Quad band TIRF 405/488/561/647 cube | CHROMA | Microscopy | |
| RICM Cube | CHROMA | Microscopy | |
| SOLA v-nIR Light Engine | Lumencor | Microscopy | |
| Thermo Forma Steri Cycle 370 CO2 Incubator | Fisher Scientific | Cell Culture | |
| VWR 75D Ultrasonic Cleaner | VWR | 13710 | Surface Preparation |
| Data Analysis | Use | ||
| Fiji (Image J) | https://imagej.net/software/fiji/downloads | Quantitative Analysis | |
| Graph Pad Prism | Graph Pad | Statistical Analysis | |
| Oligo name | 5'modification/ 3' modification | Sequence (5' to 3') | Use |
| Alkyne-21-BHQ2 | 5' Hexynyl/ 3' BHQ_2 | GTGAAATACCGCACAGATGCG | Top strand TGT probe |
| 56 pN TGT | 5' Biosg/TTTTTT/iUniAmM | CGCATCTGTGCGGTATTTCACTTT | Bottom strand TGT probe |
| 12 pN TGT | 5' AmMC6/ 3' BioTEG | CGCATCTGTGCGGTATTTCACTTT | Bottom strand TGT probe |
Referências
- Lim, C. -. G., Jang, J., Kim, C. Cellular machinery for sensing mechanical force. BMB Reports. 51 (12), 623-629 (2018).
- Moraes, C., Sun, Y., Simmons, C. A. (Micro)managing the mechanical microenvironment. Integrative Biology. 3 (10), 959-971 (2011).
- Vogel, V., Sheetz, M. P. Mechanical forces matter in health and disease. From Cancer to Tissue Engineering. Nanotechnology. , 233-303 (2010).
- Wang, J. H. C., Li, B. Mechanics rules cell biology. BMC Sports Science, Medicine and Rehabilitation. 2 (1), 16 (2010).
- Moeendarbary, E., Harris, A. R. Cell mechanics: principles, practices, and prospects. Wiley Interdisciplinary Reviews: Systems Biology and Medicine. 6 (5), 371-388 (2014).
- Streuli, C. H., Akhtar, N. Signal co-operation between integrins and other receptor systems. Biochemical Journal. 418 (3), 491-506 (2009).
- Chiasson-MacKenzie, C., McClatchey, A. I. EGFR-induced cytoskeletal changes drive complex cell behaviors: The tip of the iceberg. Science Signaling. 11 (515), (2018).
- Kechagia, J. Z., Ivaska, J., Roca-Cusachs, P. Integrins as biomechanical sensors of the microenvironment. Nature Reviews Molecular Cell Biology. 20 (8), 457-473 (2019).
- De Luca, A., et al. The role of the EGFR signaling in tumor microenvironment. Journal of Cellular Physiology. 214 (3), 559-567 (2008).
- Javadi, S., Zhiani, M., Mousavi, M. A., Fathi, M. Crosstalk between Epidermal Growth Factor Receptors (EGFR) and integrins in resistance to EGFR tyrosine kinase inhibitors (TKIs) in solid tumors. European Journal of Cell Biology. 99 (4), 151083 (2020).
- Eliceiri, B. P. Integrin and growth factor receptor crosstalk. Circulation Research. 89 (12), 1104-1110 (2001).
- Dan, L., Jian, D., Na, L., Xiaozhong, W. Crosstalk between EGFR and integrin affects invasion and proliferation of gastric cancer cell line, SGC7901. OncoTargets and Therapy. 5, 271-277 (2012).
- Giancotti, F. G., Tarone, G. Positional control of cell fate through joint integrin/receptor protein kinase signaling. Annual Reviews: Cell and Developmental Biology. 19, 173-206 (2003).
- Ricono, J. M., et al. Specific cross-talk between epidermal growth factor receptor and integrin alphavbeta5 promotes carcinoma cell invasion and metastasis. Cancer Research. 69 (4), 1383-1391 (2009).
- Polacheck, W. J., Chen, C. S. Measuring cell-generated forces: a guide to the available tools. Nature Methods. 13 (5), 415-423 (2016).
- Hang, X., et al. Nanosensors for single cell mechanical interrogation. Biosensors and Bioelectronics. 179, 113086 (2021).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Schoen, I., Hu, W., Klotzsch, E., Vogel, V. Probing cellular traction forces by micropillar arrays: contribution of substrate warping to pillar deflection. Nano Letters. 10 (5), 1823-1830 (2010).
- Ma, V. P. -. Y., Salaita, K. DNA Nanotechnology as an Emerging Tool to Study Mechanotransduction in Living Systems. Small. 15 (26), 1900961 (2019).
- Kim, Y., Kim, K. A., Kim, B. C. Double-stranded DNA force sensors to study the molecular level forces required to activate signaling pathways. Journal of the Korean Physical Society. 78 (5), 386-392 (2021).
- Rao, T. C., et al. EGFR activation attenuates the mechanical threshold for integrin tension and focal adhesion formation. Journal of Cell Sciences. 133 (13), (2020).
- Zhang, Y., Ge, C., Zhu, C., Salaita, K. DNA-based digital tension probes reveal integrin forces during early cell adhesion. Nature Communications. 5, 5167 (2014).
- Liu, Y., et al. DNA-based nanoparticle tension sensors reveal that T-cell receptors transmit defined pN forces to their antigens for enhanced fidelity. Proceedings of the National Academy of Sciences of the United States of America. 113 (20), 5610-5615 (2016).
- Zhang, Y., et al. Platelet integrins exhibit anisotropic mechanosensing and harness piconewton forces to mediate platelet aggregation. Proceedings of the National Academy of Sciences of the United States of America. 115 (2), 325-330 (2018).
- Ma, V. P. -. Y., et al. Mechanically induced catalytic amplification reaction for readout of receptor-mediated cellular forces. Angewandte Chemie International Edition. 55 (18), 5488-5492 (2016).
- Wang, X., Ha, T. Defining single molecular forces required to activate integrin and notch signaling. Science. 340 (6135), 991-994 (2013).
- Chen, Y., Lee, H., Tong, H., Schwartz, M., Zhu, C. Force regulated conformational change of integrin αVβ3. Matrix Biology. 60-61, 70-85 (2017).
- Kantlehner, M., et al. Surface coating with cyclic RGD peptides stimulates osteoblast adhesion and proliferation as well as bone formation. ChemBioChem. 1 (2), 107-114 (2000).
- Kapp, T. G., et al. A comprehensive evaluation of the activity and selectivity profile of ligands for RGD-binding integrins. Scientific Reports. 7, 39805 (2017).
- Kok, R. J., et al. Preparation and functional evaluation of RGD-modified proteins as alpha(v)beta(3) integrin directed therapeutics. Bioconjugate Chemistry. 13 (3), 128-135 (2002).
- Li, I. T. S., Ha, T., Chemla, Y. R. Mapping cell surface adhesion by rotation tracking and adhesion footprinting. Scientific Reports. 7 (1), 44502 (2017).
- Wang, Y., et al. Force-activatable biosensor enables single platelet force mapping directly by fluorescence imaging. Biosensors and Bioelectronics. 100, 192-200 (2018).
- Murad, Y., Li, I. T. S. Quantifying molecular forces with serially connected force sensors. Biophysical Journal. 116 (7), 1282-1291 (2019).
- Yasunaga, A., Murad, Y., Li, I. T. S. Quantifying molecular tension-classifications, interpretations and limitations of force sensors. Physical Biology. 17 (1), 011001 (2019).
- Luca, V. C., et al. Notch-Jagged complex structure implicates a catch bond in tuning ligand sensitivity. Science. 355 (6331), 1320-1324 (2017).
- Spillane, K. M., Tolar, P. B cell antigen extraction is regulated by physical properties of antigen-presenting cells. The Journal of Cell Biology. 216 (1), 217-230 (2017).
- Brockman, J. M., Salaita, K. Mechanical proofreading: a general mechanism to enhance the fidelity of information transfer between cells. Frontiers in Physics. 7, 14 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados