Method Article
Büyüme Faktörü Aracılı İntegrin Mekaniği ve Yapışmasını Ölçmek için Gerilim Ölçer Tether Probları
Bu Makalede
Özet
TGT yüzeyi, büyüme faktörü-integrin çapraz konuşmasını incelemek için yenilikçi bir platformdur. Esnek prob tasarımı, adezyon ligandının özgüllüğü ve stimülasyon koşullarının hassas modülasyonu, EGFR-integrin etkileşiminin sağlam nicel değerlendirmelerine izin verir. Sonuçlar, EGFR'yi fokal adezyon montajını ve hücre yayılımını etkileyen bir 'mekanik-düzenleyici' ayar integrin mekaniği olarak vurgulamaktadır.
Özet
Çok hücreli organizmalar, adezyon, proliferasyon, migrasyon ve farklılaşma dahil olmak üzere çoklu fonksiyonları düzenlemek için membran reseptörleri ve çevredeki hücre dışı matristeki (ECM) konyak ligandları arasındaki etkileşimlere güvenir. Mekanik kuvvetler, adezyon reseptörü integrini aracılığıyla hücreden ECM'deki ligandlara iletilebilir. Bu hücre tarafından üretilen kuvvetlerin miktarı ve mekansal organizasyonu, epidermal büyüme faktörü reseptörü (EGFR) dahil olmak üzere büyüme faktörü reseptörleri tarafından modüle edilebilir. Hücre mekaniğindeki çapraz konuşma aracılı değişiklikleri ölçmek ve bunları fokal adezyonlar, hücresel morfoloji ve sinyalleşme ile ilişkilendirmek için şu anda mevcut olan araçlar sınırlıdır. Bu değişiklikleri ölçmek için gerilim ölçer tethers (TGT'ler) olarak bilinen DNA tabanlı moleküler kuvvet sensörleri kullanılmıştır. TGT probları, hem altta yatan kuvvet eşiğini modüle etme hem de kırınım sınırlı uzamsal çözünürlükte tüm yapışkan hücre yüzeyi boyunca pikonewton ölçekli reseptör kuvvetlerini bildirme yetenekleri bakımından benzersizdir. Burada kullanılan TGT probları, bir DNA dubleksinin, floresan sinyali üreten reseptör-ligand kuvvetleri tarafından geri dönüşümsüz ayrışmasına dayanır. Bu, hücrenin kümülatif integrin geriliminin (kuvvet geçmişi) nicelleştirilmesini sağlar. Bu makalede, EGFR'nin integrin mekaniği ve adezyon oluşumu üzerindeki etkisini incelemek için TGT'leri kullanan bir protokol açıklanmaktadır. TGT mekanik algılama platformunun montajı sistematik olarak detaylandırılmıştır ve görüntü kuvvetlerine, fokal yapışmalara ve hücre yayılımına yönelik prosedür özetlenmiştir. Genel olarak, probun altta yatan kuvvet eşiğini, yapışma ligandını ve stimülasyon için kullanılan büyüme faktörünün türünü ve konsantrasyonunu modüle etme yeteneği, bunu, integrin aracılı kuvvetlerin düzenlenmesinde çeşitli membran reseptörlerinin etkileşimini incelemek için sağlam bir platform haline getirmektedir.
Giriş
Hücreler, mekanik kuvvetleri algılama, üretme ve bunlara yanıt verme konusunda içsel bir yeteneğe sahiptir, bu da hücresel fenotipte değişikliklere ve yerel mikro çevrenin yeniden şekillenmesine yol açar 1,2. Kuvvetler, yapışma, göç, proliferasyon, farklılaşma ve yara iyileşmesi dahil olmak üzere hücre davranışının birçok yönünü düzenlemede çok önemli bir rol oynamaktadır 3,4. Bir hücre ile mikro çevre arasındaki çift yönlü mekanik değişimdeki sapmalar, kanser5 de dahil olmak üzere hastalıklı durumlara yol açabilir. Hücre-matriks homeostazının korunmasında çok sayıda membran reseptörü rol oynar; bunlardan integrinler ve epidermal büyüme faktörü reseptörü (EGFR) sağlam bir sinerjiye sahiptir 6,7. Klasik olarak, integrinler mikroçevre ile hücre içi sitoiskelet arasındaki mekanik bağlantıyı kurarken, EGFR hücre büyümesini, proliferasyonunu ve sağkalımını düzenler 8,9. EGFR, hücre içi sinyalleşmeyi kolaylaştıran dış-içi düzenlemeye odaklanmış, oldukça çalışılmış bir terapötik hedeftir. EGFR-integrin crosstalk, kanser10,11 dahil olmak üzere birçok hastalığın ilerlemesini düzenlemek için genetik ve biyokimyasal olarak kurulmuştur. Çalışmalar EGFR-integrin etkileşiminin varlığını gösterirken, sonuçlar plazma zarından7,12,13,14 uzaklıktaki sinyal yolaklarına atfedilmektedir. EGFR'nin veya diğer büyüme faktörlerinin hücre mekaniği üzerindeki etkisi, hücresel kuvvetleri ve sinyal sonuçlarını ölçmek için araçların eksikliği nedeniyle kısmen keşfedilmemiş olarak kalmaktadır. Buradaki zorluk, bu paralel sinyal paradigmaları arasındaki iletişimi incelemek ve hücre mekaniğine spesifik katkılarını ölçmek için uygun araçların belirlenmesinde yatmaktadır.
Hücre adezyon reseptörleri tarafından üretilen kuvvetleri ölçmek için çeşitli yaklaşımlar geliştirilmiştir ve okuyucu bu tekniklerin derinlemesine gözden geçirilmesine yönlendirilmiştir15,16. Kısaca, çekiş kuvveti mikroskobu ve mikro-sütun dizisi tespiti, nanonewton (nN) kuvvetlerini çıkarmak için altta yatan bir substratın deformasyonuna dayanır, bu da bireysel reseptör kuvvetlerinden daha büyük bir büyüklük sırası17,18'dir. AFM ve optik cımbız da dahil olmak üzere tek moleküllü teknikler, tek proteinli pikonewton (pN) kuvvetlerine duyarlıdır, ancak bir seferde yalnızca bir reseptörü ölçer ve iyi (veya herhangi bir) uzamsal çözünürlük sunmaz. DNA tabanlı moleküler gerilim probları ve gerilim ölçer tether (TGT) probları, kırınım sınırlı (veya daha iyi) uzamsal çözünürlüğe sahip pN kuvvet çözünürlüğü sunarak, fibroblastlar, kanser hücreleri, trombositler ve bağışıklık hücreleri de dahil olmak üzere çeşitli hücre tiplerinden19,20 tek hücreli kuvvetlerin incelenmesinde benzersiz bir rol oynar21,22,23,24 . Moleküler gerilim probları, gerçek zamanlı görüntüleme için ideal olan uzatılabilir bir "yay" elemanına sahipken, TGT probları geri dönüşümsüz olarak yırtılır ve arkasında floresan bir "kuvvet geçmişi" bırakır. TGT'ler ayrıca altta yatan substratın gerilim eşiğini modüle eder; benzer kimyasal bileşimlere ancak farklı kopma kuvvetlerine veya gerilim toleranslarına (Ttol) sahip bir dizi prob, fokal yapışma oluşumu ve hücre yayılımı için gereken minimum gerilimi ölçmek için kullanılabilir. TGT probları, biri yüzeye sabitlenmiş, diğeri hücreye bir ligand sunan iki tamamlayıcı DNA ipliğinden oluşur. Bir reseptör ligandı bağlarsa ve probun Ttolundan daha büyük bir kuvvet uygularsa, iplikçikler ayrılacaktır. Ttol, ideal koşullar altında 2 s'lik bir aralıkta probların% 50'sini parçalamak için gereken sabit kuvvet olarak tanımlanır. "Açılan" TGT problarında, üst iplikçikteki bir söndürücü, alt iplikçikteki bir florofordan ayrılabilir. Sadece TGT probunun yırtıldığı yerlerde, muhtemelen Ttol'dan büyük veya ona eşit kuvvetlerle, bir floresan sinyali üretilecektir. TGT probları da sabitlenebilir, böylece biyolojik sistemlerin kolayca manipüle edilmesine ve çoklu koşulların test edilmesine olanak tanır. Bu nedenlerle bu çalışmada TGT probları kullanılmıştır.
TGT probları, integrine bağımlı hücre yapışmasının ve mekanik kuvvetlerin aktif EGFR21 tarafından nasıl modüle edildiğini incelemek için kullanılmıştır. Bu çalışma, EGFR'yi odak yapışma organizasyonunu ve gerilim üretimini ayarlayan bir 'mekano-organizatör' olarak kurdu. Ek olarak, EGF stimülasyonunun fokal adezyonların dağılımını ve olgunluğunu ve artmış hücre yayılımını etkilediği bulunmuştur. Bu yaklaşım, büyüme faktörlerinin tümör progresyonunda ve dinamiklerinde mekanik kuvvetleri nasıl etkilediğini araştırmak için gelecekteki çalışmalarda kullanılabilir. Epitelden mezenkimal geçişi düzenlemede EGFR-integrin çapraz konuşmasının rolü belirlenirken, mekanik kuvvetlerin bu süreçteki rolü henüz araştırılmamıştır10.
Burada, bu deneyler için 56 pN TGT probun sentezi ve montajı, cam kapaklar üzerinde TGT yüzeylerinin oluşturulması, TGT yüzeyinde Cos-7 hücrelerinin uygulanması ve EGF ile stimülasyonu, falloidin ile hücrelerin fiksasyonu ve boyanması ve bir anti-pasilin antikoru, yüksek çözünürlüklü toplam iç yansıma floresansı (TIRF) ve yansıma girişimli kontrast mikroskobu (RICM) görüntülemesini kapsayan ayrıntılı bir protokol sunulmuştur. ve görüntü niceliği. Bu protokol, Cos-7 hücrelerinin EGF stimülasyonunu araştırmak için yazılmış olsa da, birçok TGT tabanlı deney için kolayca uyarlanabilir. Farklı ligandlar, Ttol, hücre tipleri, stimülasyon parametreleri, fiksasyondan sonra etiketlenen proteinler ve kantitatif analizler kolayca ikame edilebilir, bu da bu protokolü sağlam ve yaygın olarak kullanışlı hale getirir.
Protokol
1. TGT oligonükleotid preparatı
NOT: Oligonükleotid prob sentezinin detayları burada özetlenmiştir. Bazı modifikasyonların ve saflaştırma adımlarının özel sentez için dış kaynaklı olabileceğini lütfen unutmayın.
- Siklo[Arg-Gly-Asp-D-Phe-Lys (PEG-PEG)] peptidinin birincil amini, Zhang ve ark.22 tarafından tanımlandığı gibi azid-NHS bağlayıcı ile 10 μL dimetilformamid nihai hacminde 1: 1.5 oranında (100: 150 nmol) karıştırarak aktive edin. Organik baz trietilaminin 0.1 μL'sini ekleyin ve 4 ° C'de 12 saat boyunca inkübe edin.
- Ürünü, 0.1 M TEAA (çözücü A) ve% 100 asetonitril (çözücü B) kullanarak, 1mL / dak akış hızına ve% 0.5 / dak'lık bir gradyana ayarlanmış% 10 çözücü B'nin başlangıç koşuluna sahip ters fazlı HPLC ile saflaştırın. Salınımlı pikleri birleştirin (203 nm'de absorbans) ve MALDI-TOF kütle spektrometrisi ile doğrulayın. Ürün cRGDfK-azid'dir.
- TGT üst ipliğini üretmek için, cRGDfK-azid ve alkin-21-BHQ2 oligonükleotid (TGT üst ipliği: 5Hexynyl/GTGAAATACCGCACAGATGCG/3BHQ_2) 100 μL 1x Fosfat Tamponlu Salin (PBS) içinde 2:1 oranında (͂200 μM: 100 μM) 5 mM sodyum askorbat ve 0,1 μM önceden oluşturulmuş Cu-THPTA ile birleştirin. Reaksiyonun oda sıcaklığında (RT) en az 4 saat veya gece boyunca 4 °C'de ilerlemesine izin verin.
- Fazla boyayı, yan ürünleri, organik çözücüyü ve reaksiyona girmemiş reaktifleri gidermek için karışımı P2 tuzdan arındırma jeli ile işleyin. Santrifüj kolonunu 650 μL önceden hidratlanmış P2 jel ile 1 dakika boyunca 18.000 x g'de döndürerek hazırlayın. Akış sıvısını atın ve reaksiyon karışımını ekleyin. 1 dakika boyunca 18.000 x g'de tekrar döndürün ve akışı toplayın. Reaksiyon karışımını ultra saf su ile 300 μL'lik bir son hacme getirin.
NOT: P2 jelini 6 saat boyunca suyla önceden nemlendirin. - Tuzdan arındırılmış reaksiyon karışımını ters fazlı HPLC ile saflaştırın. Bu saflaştırma için kullanılan organik çözücüler,H2O'da (çözücü A) 0.1 M TEAA ve% 100 MeCN'de (çözücü B veya mobil faz) içerir.
- Karışımı enjekte etmeden önce, kolonu% 10 Solvent B'lik bir başlangıç koşuluyla% 1 / dak'lık bir gradyan ile dengeleyin. Akış hızını 1 mL/dk olarak ayarlayın. Reaksiyon karışımını 500 μL'lik bir enjeksiyon iğnesi ile HPLC döngüsüne enjekte edin.
- DNA için 260 nm ve BHQ2 quencher için 560 nm pik absorpsiyonu görselleştirerek ürünü toplayın. Salınan ürünü bir vakum santrifüj konsantratöründe gece boyunca kurutun.
- TGT alt ipliğini Ma et'te açıklandığı gibi Cy3B-NHS esterine bağlamak için nükleofilik ikame kullanın. al25. 56 pN TGT alt ipliğinin 100 μM'sini (5Biosg / TTTTTT / iUniAmM / CGCATCTGTGCGGTATTTTTTTTTTT) 10 μL DMSO içinde önceden çözünmüş 50 μg Cy3B-NHS esteri ile karıştırın. Bu karışımın pH'ını 0,1 M sodyum bikarbonat ile 9'a ayarlayın ve son hacmi 1x PBS ile 100 μL'ye getirin. Reaksiyon karışımını RT'de gece boyunca inkübe edin.
- Reaksiyona girmemiş reaktifleri, tuzları ve organik çözücüleri ayırmak için P2 jel filtrasyonu ve ters fazlı HPLC kullanarak karışımı sırayla saflaştırın (adım 1.4 ve 1.5'te açıklanmıştır).
- Saflaştırılmış oligonükleotid-boya konjugatlarının konsantrasyonunu, bir spektrofotometre kullanarak absorbanslarını 260 nm'de kaydederek tahmin edin.
- Saflaştırılmış ürünleri MALDI-TOF kütle spektrometrisi ile karakterize edin. Taze MALDI matrisini hazırlamak için fazla 3-hidroksipikolinik asidi TA50 çözücüye (ddH2O'da 50:50 v / v asetonitril ve% 0.1 TFA) çözün. Etiketlenmiş ürünler için tahmini ve ölçülen moleküler ağırlıklar şunlardır: cRGDfK-1-BHQ2 - 8157.9 (hesaplanmış), 8160.1 (bulundu); 56 pN TGT - 10272.7 (hesaplandı), 10295.8 (bulundu) etiketli Cy3B.
- Üst ve alt iplikçikleri nükleaz içermeyen suda 30-50 μM arasındaki bir konsantrasyonda ayrı ayrı çözün. Kısa süreli uygulamalar için 4 °C'de veya uzun süreli uygulamalar için -20 °C'de saklayın. Oligonükleotidlerin stabilitesi, tekrarlanan donma-çözülme döngülerinden etkilenmez.
2. Yüzey hazırlığı
1. Gün:
- 25 mm'lik cam kapakları (8'e kadar) politetrafloroetilen rafa yerleştirin. Rafı, 40 mL 200 prova etanol içeren 50 mL'lik bir borosilikat beherine yerleştirin. RT'de 10-15 dakika boyunca suyun girmesini önlemek için beheri parafin filmle örtün ve 35 kHz'lik bir çalışma frekansında sonikasyon yapın (Şekil 1A).
- 50 mL'lik bir beheri, sülfürik asit ve hidrojen peroksitin bir pirex kabında 3: 1 oranında karıştırılmasıyla taze hazırlanmış 40 mL Piranha çözeltisi ile doldurun. Cam pipetle karıştırın. Kapak kayma rafını beherin içine aktarın ve kapak kayması yüzeyini kazımak için duman davlumbazındaki RT'de 30 dakika boyunca inkübe edin (Şekil 1B).
NOT: Laboratuvar önlüğü, eldiven ve gözlük dahil olmak üzere tam KKD giyin ve kimyasal duman davlumbazında çalışın. Çözeltinin aşırı ısınmasını önlemek için aside yavaşça hidrojen peroksit ekleyin. - Aşındırmadan sonra, kapak kayma rafını ultra saf su içeren bir beher'e aktarmak için cımbız kullanın. Asidi tamamen nötralize etmek için bu adımı 15 s aralıklarla altı kez tekrarlayın (Şekil 1C).
NOT: Piranha çözeltisini asit atık kabına atmadan önce gece boyunca kimyasal davlumbazda bırakın. - Cam yüzeyde desen veya toz parçacığı olmadan yüzeylerin temiz göründüğünden emin olmak için kapak kapaklarını görsel olarak inceleyin. Desenler veya toz algılanırsa 2.1-2.4 arasındaki adımları yineleyin.
NOT: İşlem görmüş kapak kaymalarını suya batırarak ve dikey olarak çıkararak yüzey hidrofilikliğini test edin. Arıtılmış kapaklardaki su, yamalar oluşturan işlenmemiş örtü kaymalarına kıyasla Young'ın halkalarını oluşturmak için tek tip bir tabaka olarak geri çekilir. - Kapak kaydırma rafını 200 geçirmez etanol içeren bir beher'e aktarın ve yüzeyleri organik çözücüye dengelemek için 15 saniye boyunca iki kez yıkayın. Kapak kayma rafını, kapak fişlerini silanize etmek için RT'de 1 saat boyunca% 3 APTES ile 200 geçirmez etanol çözeltisine aktarın (Şekil 1D). Beheri parafin filmle örtün.
NOT: APTES biriktirme parametreleri, yüzey temizleme yöntemine, çözücü su içeriğine, APTES konsantrasyonuna, kuluçka sürelerine ve tavlama sıcaklığına bağlı olarak değişir. - Rafı 200 geçirmez etanol çözeltisi ile temiz bir beherin içine daldırın. Bu yıkamayı her biri 15 saniye boyunca üç kez tekrarlayın (Şekil 1E).
- Kapak kapaklarını düşük çıkış basıncına sahip azot (N2) gazı kullanarak kurulayın. Kapak fişlerini, içine düz bir şekilde yerleştirilmiş bir parça parafin film ile 10 cm'lik polistiren bir kaba yerleştirin. Kapak kapaklarının kuru ve ayrı olduğundan emin olun (Şekil 1F).
- Parafin film üzerine yerleştirilen dört kapak kapağına DMSO'da 100 μL 2 mg / mL NHS-biyotin çözeltisi ekleyin. Üstte diğer dört kapak kapağı olacak şekilde bir "sandviç" ayarlayın (aralarında işlevsellik çözeltisi ile birbirine bakan iki kapak kayması) ve çanağı gece boyunca 4 ° C'de kuluçkaya yatırın (Şekil 1G).
NOT: 4 ° C'de, NHS reaktifi daha kararlıdır ve bu da düzgün yüzey işlevselliğini kolaylaştırır. Ek olarak, sandviç reaktifleri korur. Sandviçin, dışarı sızabileceği ve kapakların kaymasına neden olabileceğinden fazla çözelti eklemekten kaçının.
2. Gün:
- Çanağı 4 °C'den çıkarın ve sandviçlenmiş kapak kapaklarını ayırın. Raftaki kaymaları, kaplanmış yüzey birbirine bakacak şekilde Şekil 2A'da gösterildiği gibi yönlendirin. Her biri 15 s için üç kez 200 kanıt etanol çözeltisi ile yıkayın. N 2 gazı ilekurutun ve içinde parafin filmi bulunan yeni bir kaba koyun.
NOT: Kapak kapaklarının belirtildiği gibi yönlendirilmesi, işlevselleştirilmiş yüzeyin tanımlanmasına yardımcı olur. - Kapak fişlerini 1 mL 1x PBS ile üç kez yıkayarak sulu faza geri dengeleyin. Kapak kapaklarının her birine 1x PBS'de (w/v) 800 μL %0.1 sığır serum albümini (BSA) ekleyin ve yüzeyi pasifleştirmek ve sonraki işlevselleştirme reaktiflerinin spesifik olmayan bağlanmasını engellemek için RT'de 30 dakika inkübe edin (Şekil 2B).
- Kuluçkadan sonra, kapakları 1 mL 1x PBS ile üç kez yıkayın. Kapak kapaklarını işlevselleştirmek için RT'de 1x PBS'ye 45-60 dakika boyunca 800 μL 1 μg / mL streptavidin ekleyin (Şekil 2C).
NOT: Pasivasyon verimliliğini doğrulamak için streptavidin olmadan bir kapak kapağını saklayın (isteğe bağlı). Add10 nM biyotinile moleküller ve deneysel koşullar kullanılarak görüntü. Bu yüzey yoğunluğu kameranın karanlık gürültüsüne yakın olmalıdır. - Adım 2.11 ile eşzamanlı olarak, TGT problarını (üst: 1: 1 molar oranında alt iplikçik), bir termosiklet kullanarak bir PCR tüpünde 100 μL'lik 1 M NaCl'de 50 nM'lik bir son konsantrasyonda birleştirin. İplikleri 95 ° C'de 5 dakika boyunca ayırın ve sıcaklığı 25 ° C'ye düşürerek ve 25 dakika boyunca koruyarak kademeli olarak tavlayın (Şekil 2D). TGT problarının ışığa uzun süre maruz kalmasını önleyin.
- Streptavidin inkübasyonundan sonra, kapak kapaklarını üç kez yıkamak için 1x PBS kullanın. Önceden monte edilmiş TGT problarından dördüne 100 μL ilave edin ve işlevselleştirilmiş tarafı problara bakan kalan 4 kapak fişini kullanarak sandviç yapın (sekiz yüzey dört tüp hibridize TGT probu gerektirir). Alüminyum folyo ile örtün ve probun yüzeye bağlanmasına izin vermek için RT'de 1 saat inkübe edin (Şekil 2E).
- Kuluçkadan sonra, sandviçleri ayırın ve kapak fişlerini 1x PBS ile üç kez yıkayın. TGT yüzeyleri artık görüntüleme için hazırdır. Kapak kapaklarını önceden temizlenmiş görüntüleme odalarına dikkatlice monte edin ve yüzeyleri nemli tutmak için 1x PBS ekleyin (Şekil 2F).
NOT: Odaların aşırı sıkılması yüzeyi çatlatacaktır. Yüzeylerin kurumasını önleyin.
3. Hücre hazırlama ve boyama
- Epidermal büyüme faktörü (EGF) stimülasyonunun Cos-7 mekaniği, adezyonu ve hücre yayılımı üzerindeki etkisini araştırmak için, Cos-7 hücrelerini 2 dakika boyunca% 0.05 Tripsin-EDTA ile tripsinize edin. HBSS ile yıkayarak ve 5 dakika boyunca 800 x g'de santrifüj yaparak tripsini nötralize edin. Nötralizasyon adımını bir kez daha tekrarlayın.
- Dulbecco'nun Modifiye Kartal Ortamı'nda (DMEM) monte edilmiş TGT yüzeylerinde 4 x 104 hücre yoğunluğundaki plaka hücreleri, 50 ng / mL EGF veya EGF'siz DMEM ile desteklenir. Hücrelerin bir hücre kültürü inkübatöründe %5 CO2 ile 37 °C'de 60 dakika yayılmasına izin verin (Şekil 3A).
NOT: Hücreler, büyüme faktörlerinden stimülasyonu önlemek için serum olmadan DMEM'de inkübe edilir. EGF, 1 mg / mL'lik bir stok yapmak için 10 mM asetik asit içinde seyreltilir. DMEM'de görüntüleme deneyleri için 50 ng / mL'de kullanılır. - Kuluçkayı takiben, hücreleri 1x PBS ile üç kez yıkayın ve RT'de 12 dakika boyunca 2 mL% 4 paraformaldehit ile sabitleyin (Şekil 3B).
NOT: Tüm inkübasyon adımları, çözeltilerin düzgün bir şekilde yayılması için ~ 35 rpm'de döner bir çalkalayıcı üzerinde gerçekleştirilir. TGT yüzeylerini görüntülemeye hazır olana kadar kaplayarak ışıktan koruyun. - İsteğe bağlı olarak, paraformaldehit ile ilişkili otofloresansı söndürmek için kapak fişlerini 37 ° C'de 30 dakika boyunca 1x PBS'de 50 mM NH4Cl ile inkübe edin ve 5 dakikalık aralıklarla 1x PBS ile üç kez yıkayın (Şekil 3B).
- Tampon A (1x PBS,% 5 normal at serumu,% 5 normal keçi serumu,% 1 BSA,% 0.025 Triton X-100) ekleyin ve hücreleri bloke etmek ve geçirgenleştirmek için 37 ° C'de 30 dakika kuluçkaya yatırın. 5 dakikalık aralıklarla 1x PBS ile üç kez yıkayın (Şekil 3B).
- Kapaklı görüntüleme odalarını bir nem kabına yerleştirin. Primer anti-paxillin antikorunu (fokal adezyon belirteci) bloke edici tamponda (1x PBS,% 5 normal at serumu,% 5 normal keçi serumu,% 1 BSA,% 0.005 Triton x-100) seyreltin. 37 °C'de 2 saat boyunca kapak kayması başına 200 μL primer antikor çözeltisi ile inkübe edin (Şekil 3B).
NOT: Yüzeylerin kurumasına izin vermeyin. - Kapak kapaklarını 5 dakikalık aralıklarla 1x PBS ile beş kez yıkayın ve nem kabına geri koyun. Hücreleri aynı anda 1:800 seyreltmede boya konjuge keçi anti-tavşan sekonder anti-anti-antikor ve 1:400 seyreltmede boya konjuge falloidin (aktin) karışımı ile 200 μL bloke tampon karışımı ile aynı anda etiketleyin. 60 dakika boyunca 37 °C'de inkübe edin (Şekil 3B).
- Yüzeyleri 5 dakikalık aralıklarla 1x PBS ile beş kez yıkayın ve görüntülemeye hazır olana kadar 4 °C'de saklayın (Şekil 3B).
NOT: Sinyal bozulmasını önlemek için yüzey hazırlığından sonraki 3 gün içinde görüntü örnekleri.
4. Görüntü toplama
- 488, 561 ve 647 TIRF uyarımı, RICM uyarımı, mükemmel bir odak sistemi ve bir dijital kamera ile ters çevrilmiş mikroskopta yüksek sayısal diyafram açıklığına (1.49) sahip bir yağ daldırma 60x hedefi kullanın.
- Hedefe yağ ekleyin, numune odasının kapak kapağı tabanını temizleyin ve numuneyi sahneye yerleştirin. Bir hücreye odaklanın ve mükemmel odağı kullanın.
- Mikroskobu, epifloresan uyarımı ve emisyon filtresi çıkarılmış bir GFP filtre küpü ile RICM görüntüleme moduna getirin. Epi-aydınlatma diyafram diyaframını kapatıp ortalayarak RICM'yi hizalayın.
- Mikroskopu lazer uyarımı ve dört geçişli bir TIRF filtre küpü ile TIRF moduna getirin. 488 nm lazeri odanın tavanındaki küçük bir noktaya odaklayın ve canlı modda kameradaki floresanı izlerken kritik açıyı geçene kadar insidans açısını artırın. Arka plan floresansında keskin bir azalma ve kritik açı aşıldığında tek bir odak düzlemi gözlemleyin.
NOT: TIRF, açık TGT problarını ve fokal yapışmaları vurgulayan numune kapağı kaydırma arayüzüne en yakın ince bir bölgeyi (~100 nm) heyecanlandırırken, hücre içinden odak dışı floresanı ortadan kaldırır. TIRF mevcut değilse, epi-floresan kullanılabilir; ancak sinyal-gürültü oranları daha düşük olacaktır. - RICM kullanarak kameranın "canlı" modunu kullanarak görüntüleme için hücreleri tanımlayın.
- Aktin (640 nm ex), integrin gerilimi (561 nm ex) ve paxillin'in (488 nm ex) RICM görüntüsünü ve TIRF görüntülerini elde edin. 200 ms'lik pozlama süresini kullanarak görüntüleri sırayla elde edin.
NOT: Pozlama süresi, hedef, lazer gücü, emisyon filtreleri ve kamera hassasiyeti gibi birçok faktöre bağlıdır. Sinyal, arka plandan en az 2 kat daha büyük olmalıdır. Arka plan 1000 AU civarındadır, bu nedenle sinyal en az 2000-3000 AU olmalıdır. - En az 30 hücre için 4.4-4.5'i tekrarlayın. Kapak fişlerini değiştirin, odaklanın ve 4.4-4.5'i tekrarlayın.
5. Veri analizi
NOT: Fiji yazılımını kullanarak nicel görüntü analizi ve istatistik yazılımını kullanarak analiz yapın.
- Bir hücre için ayarlanan görüntüyü açın.
- ImageJ Freehand seçim aracını kullanarak RICM görüntüsündeki hücrenin sınırını izleyerek hücre alanının maskesini (RICM maskesi) oluşturun. İlgilenilen bölgeyi (YG) YG yöneticisine kaydedin (Yatırım > Araçlarını Analiz > YG yöneticisi) (Şekil 4A1,2).
- Integrin gerilim görüntüsünde hücrenin dışında temsili bir alan seçin ve en az 200 x 200 piksellik bir yatırım getirisi çizin. Diğer hücreleri veya floresan kalıntıları yatırım getirisinden hariç tutun. Ölçüm aracını kullanarak YG'deki arka plan floresansını ölçün (Analiz > Ölçüm) (Şekil 4A3).
- Adım 5.2'de elde edilen ortalama arka plan floresansını gerilim görüntüsünden çıkarın (İşlem > Matematik > Çıkarma) (Şekil 4A4).
- Hücre ayak izi içindeki gerilim sinyalini tanımlamak için adım 5.2'de oluşturulan RICM maskesini kullanın (ROI yöneticisi > Maskeyi Seç > Uygula > Düzenle > Dışarıyı temizle) (Şekil 4A5).
- Huang'ın otomatik eşik yöntemini kullanarak gerilim görüntüsü için bir eşik maskesi oluşturun (Görüntü > > Eşiğini Ayarla) (Şekil 4A6). Eşik maskesinin, oluşturulan integrin gerilimi alanını en iyi şekilde temsil ettiğinden emin olun. Genel bir kural olarak, eşiği ortalama arka plan floresansının 2 katına ayarlayın.
- Eşikli gerilim maskesinin bir seçimini oluşturun (Düzenle > Seçimi > Oluştur) (Şekil 4A7).
- Seçilen maskeyi adım 5.4'te oluşturulan gerilim görüntüsüne aktarın ve açık probların entegre yoğunluğunu ölçün (ROI yöneticisi > Select (Gerilim Maskesi) > RawIntDen'> Analiz > Ölçümü) (Şekil 4C).
- RICM maskesinden hücre morfometrik özellikleri alanını, daireselliğini ve en boy oranını ölçün (ROI yöneticisi > Select (RICM maskesi) > Maske uygula > Analiz > Ölçümü) (Şekil 4B).
- Gerilim maskesi görüntüsünü seçip RICM maskesini (ROI yöneticisi > Select (RICM Maskesi) > Analiz > %Area >) uygulayarak yırtılmış problarla hücre ayak izinin yüzdesi olarak tanımlanan mekanik kopma yoğunluğunu ölçün (Şekil 4C).
- Daha fazla analiz ve görselleştirme için ölçümleri istatistik yazılımına aktarın.
- Her hücre için 5.1-5.11'i tekrarlayın.
Sonuçlar
Ligand-aktive epidermal büyüme faktörü reseptörünün (EGFR) integrin aracılı hücre mekaniği ve Cos-7 hücrelerinde adezyon oluşumu üzerindeki etkisini araştırmak için açılan TGT probları kullanıldı21. Problar, integrin heterodimer αVβ3 için seçici olan ligand siklik Arg-Gly-Asp-Phe-Lys (cRGDfK) 21,23,25,26'yı α5β1 integrinleri27,28,29,30 için sadece küçük bir afinite ile sunar. TGT probu, biotin-streptavidin bağlama kullanılarak alt iplikçik üzerinden cam bir kapak kayması yüzeyine işlevselleştirilmiş dubleks bir DNA'dan oluşur. Üst iplikçik integrin ligandını gösterir ve hücre zarı üzerindeki konyak integrin reseptörüne bağlanmak için kullanılabilir (Şekil 5A). Alt iplik bir florofor ve üst iplik bir susturucu ile etiketlenmiştir, bu da dubleks TGT sağlam olduğunda minimum arka plan floresansına yol açar. Eğer bir integrin ligandı bağlarsa ve probun T tol'undan daha büyük bir büyüklüğe sahip bir kuvvet uygularsa, DNA dubleks floresana yol açacak şekilde ayrılacaktır (Şekil 5A). Mekanik bir kuvvet tarafından yırtılmamış herhangi bir TGT probu, floresan olmayan olarak kalacaktır. Bu kuvvet seçici açma floresansı, pN ölçeğinde integrin tarafından üretilen kuvvetlerin kırınım sınırlı çözünürlükte sistematik ve kantitatif haritalandırılmasını sağlar. TGT probları ayrıca substratın gerilim eşiğini modüle eder.
Burada, 56 pN'lik bir Ttolü olan TGT yüzeyinin temsili bir örneği gösterilmektedir. Cos-7 hücreleri, ligand stimülasyonu ile EGFR aktivasyonunun hücre yapışması ve integrin mekaniği üzerindeki etkisini incelemek için bu TGT yüzeyine EGF stimülasyonu olsun veya olmasın kaplandı (Şekil 5A, B). Hücreler, fokal adezyon dağılımını (paxillin) ve sitoiskeletin organizasyonunu (F-aktin) göstermek için TGT yüzeylerinde 60 dakika boyunca EGF ile veya EGF'siz olarak inkübe edildi, sabitlendi ve immüno-boyandı (Şekil 5B). Hücreler daha sonra RICM ve TIRF mikroskobu kullanılarak görüntülendi. RICM görüntüsünde açıkça görüldüğü gibi, 56 pN TGT yüzeyinde yayılan Cos-7 hücresi, stimülasyon olmadan karşılaştırıldığında EGF stimülasyonu ile anlamlı derecede artmıştır. Bu, RICM görüntüsünden hücre-substrat temas bölgesinin boyutunu ölçerek her koşulda 50 hücre için ölçülmüştür (Şekil 5C). EGF ile stimülasyon, Cos-7 hücrelerinin doğal fizyolojik ortamlarında yayılmasını ve büyümesini temsil eden daha dairesel bir morfoloji ile sonuçlandı (Şekil 5D). Açık problardan gelen floresan, gerilim floresan görüntüsünde gözlendiği gibi EGF stimülasyonu ile de daha yüksektir. Açık probların sayısı ile orantılı olan açık probların entegre yoğunluğu, EGF stimülasyonu ile onsuza göre çok daha yüksekti (Şekil 5B,E). Bu, integrinlerin Ttol'dan (56 pN) daha büyük bir kuvvet uyguladığı tüm reseptör-ligand angajmanlarının bir temsilidir.
Paxillin ile boyama, fokal adezyonların dağılımının, sayısının, olgunlaşmasının (boyutunun) ve organizasyonunun da EGF stimülasyonundan etkilendiğini göstermiştir. EGF ile uyarılmış hücrelerdeki fokal adezyonlar, EGF kontrollerine kıyasla daha olgun ve radyal yönelimli görünüyordu. F-aktin sitoiskelet organizasyonu, faloidin boyama ile değerlendirildiği gibi, EGF stimülasyonu ile de geliştirilmiştir (Şekil 5B). Bu nitel değerlendirmeler her iki tedavi grubundan alınan görüntülerin görsel olarak karşılaştırılması ile yapılmıştır. Fokal adezyonun kantitatif analizi yapılabilir, ancak bu protokolün kapsamı dışındadır. Bu deneyde, TGT yüzeyi, EGFR aktivasyonunun hücre yayılımı, integrin mekaniği ve fokal adezyon oluşumu üzerindeki etkisini sistematik olarak detaylandırmak için bir platform sağladı.
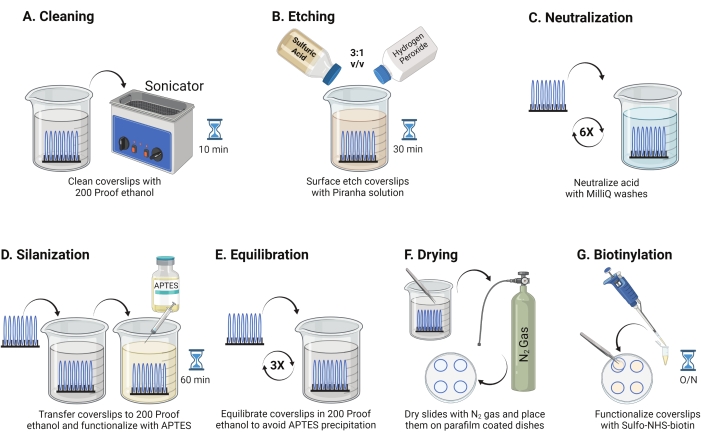
Şekil 1: TGT yüzey hazırlığının 1. Günü için şematik. (A) Kapakları temizleyin. (B) Kapak kayma yüzeyini aşındırın. (C) Piranha çözeltisini nötralize edin. (D) Reaktif amin grupları oluşturmak için yüzeyi silanize edin. (E) Kapak fişlerini organik faza dengeleyin. (F) Kapak kapaklarını inert bir gazla kurulayın. (G) Yüzey amin gruplarını biyotinilasyona tabi tutar. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
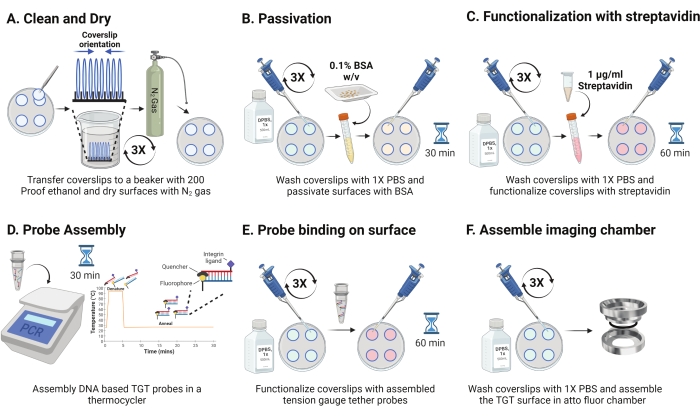
Şekil 2: TGT yüzey hazırlığının 2. Günü için şematik. (A) Bir önceki günden kalan biyotini çıkarmak için kapak kapaklarını temizleyin ve kurutun. (B) Sonraki adımlarda reaktifin spesifik olmayan bağlanmasını önlemek için BSA ile pasifleştirin. (C) Streptavidin ile kapak fişlerini işlevselleştirin. (D) Probları bir termo çevrimcide hibridize edin. (E) Sentezlenmiş probları kapak kapaklarına uygulayın (F) Kapak kapağını hücre görüntüleme odasına monte edin. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
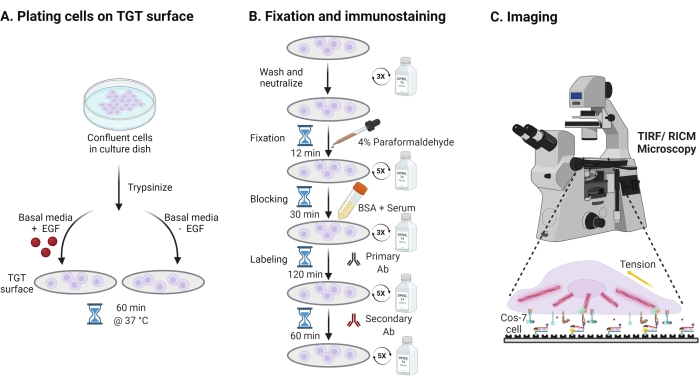
Şekil 3: Tüm deney düzeneğindeki geniş adımları vurgulayan genel iş akışı . (A) EGF stimülasyonu olsun veya olmasın bazal ortamda (DMEM) TGT yüzeyinde hücre ayrılması ve kaplanması işlemi. (B) TGT yüzeyinde bağlantı sonrası ve yayılma sonrası fiksasyon ve immüno-boyama ile ilgili adımların akış şeması. (C) Boyama sonrası, hücreler RICM ve TIRF mikroskobu ile ters çevrilmiş bir floresan mikroskobunda görüntülenir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
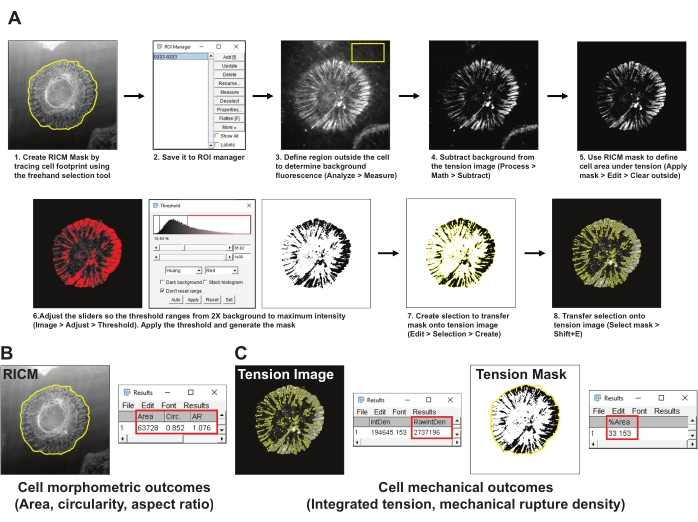
Şekil 4: Veri işleme ve nicel analiz örneği . (A) RICM ve gerilim görüntüsü ölçümü için Fiji'de (ImageJ) kullanılan analiz boru hattının adım adım dökümü. (B) Yukarıdaki boru hattı kullanılarak analiz edilen hücre morfometrik sonuçları için temsili bir örnek. (C) Yukarıda belirtilen boru hattı kullanılarak analiz edilen hücre mekanik sonuçları için temsili örnekler. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
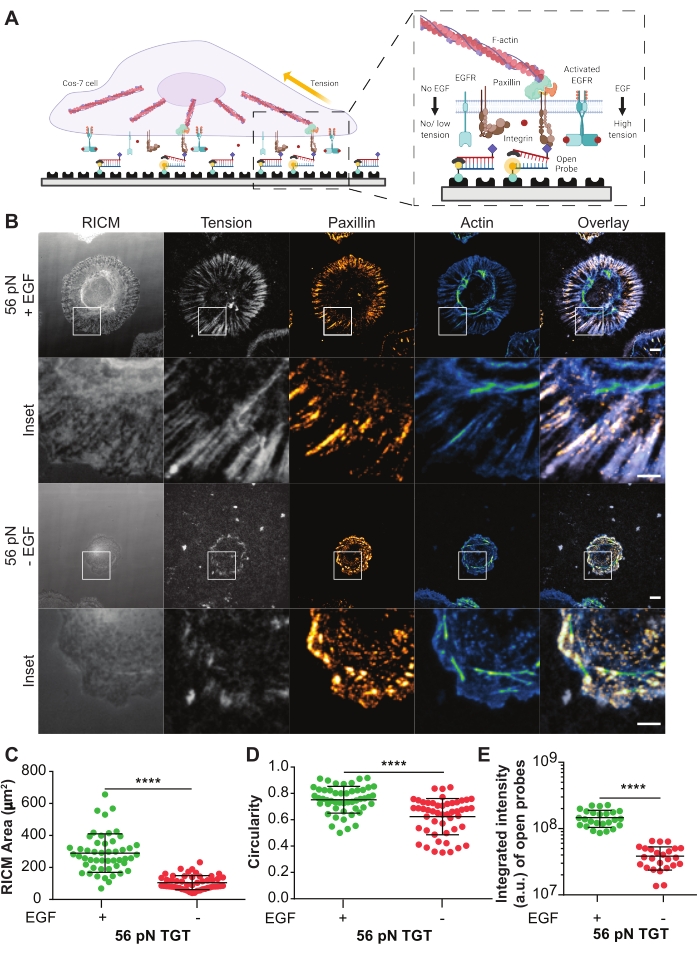
Şekil 5: Bir TGT deneyinden örnek veriler. (A) Hücre zarı-TGT yüzey arayüzündeki temas bölgesini vurgulayan diyagram. Inset projeleri, konyak ligand cRGDfK ile (sağda) veya (solda) EGF stimülasyonu olmadan etkileşime girerek entegre eder. (B) 56 pN TGT yüzeyine yayılan Cos-7 hücrelerinin RICM ve TIRF görüntüleri. Görüntüler, EGF stimülasyonu ile veya EGF stimülasyonu olmadan kaplama sonrası 60 dakika elde edilir. Bireysel RICM (edinildiği gibi), integrin gerilimi (gri tonlamalı), paxillin (turuncu sıcak) ve F-aktin (mavi-yeşil) görüntüleri her iki stimülasyon koşulu için bindirmelerle gösterilir. Ölçek Çubuğu: 10 μm. İç kısım, paxillin tarafından işaretlenmiş adezyon oluşum bölgelerinde üretilen integrin geriliminin kolokalizasyonunu ve aktin ile işaretlenmiş altta yatan hücre altı sitoiskelet organizasyonunu detaylandıran yakınlaştırılmış bir ROI'yi (ilgi alanı) vurgulamaktadır. Ölçek Çubuğu: 5 μm. (C-E) EGF stimülasyonu olan veya olmayan Cos-7 hücreleri için yayılma alanı (RICM hücre ayak izi) (C), dairesellik (D) ve entegre gerilim (E) için saçılma grafikleri. Çubuklar ortalama ± s.d. Gruplar arasındaki farklılıklar Student t-testi ile istatistiksel olarak değerlendirildi; P 0.0001 <. n = Üç bağımsız deneyde 50 hücre. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
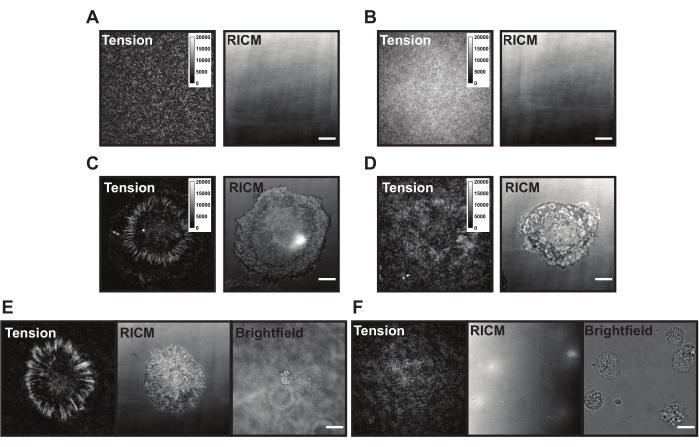
Şekil 6: Farklı olası problemleri olan örnek TGT yüzeyleri. (A) Hücre yapışmasından önce söndürülmüş monte edilmiş prob ile ideal bir TGT yüzeyinin gerilimi ve RICM görüntüleri. (B) TGT probunun üst ipliğinden (quencher) yoksun olduğu bir TGT yüzeyinin gerilimi ve RICM görüntüleri. Gerilim görüntüsü, alt iplikçikteki açık florofordan düzgün floresan gösterir. (C) İdeal bir TGT yüzeyine yayılmış hücreler için gerilim ve RICM görüntüleri. (D) Sınırlı pasivasyon veya bozulmuş prob ile kötü yapılmış bir TGT yüzeyine yayılmış hücreler için gerilim ve RICM görüntüleri. (E) cRGDfK-integrin etkileşimlerini gösteren cRGDfK ligandı ile ideal bir yüzeye kaplanmış hücreler için gerilim, RICM ve parlak alan görüntüleri, hücre bağlanması ve gerilim üretimi için hayati öneme sahiptir. (F) TGT'de cRGDfK ligandı olmayan bir yüzeye kaplanmış hücreler için gerilim, RICM ve parlak alan görüntüleri. Hücreler parlak alan görüntüsünde görülebilirken, hücre bağlantısı veya üretilen integrin gerilimi gözlenmez. Ölçek Çubuğu: 10 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Yukarıda özetlenen ayrıntılı adım adım prosedürle, hücre morfolojisini ölçmek ve hücre bağlanması sırasında yapışkan hücreler tarafından üretilen ve EGF ile tedaviyi takiben yayılan gerilimi integrin etmek için TGT yüzeyleri hazırlanabilir. Basit prob tasarımı ve sentezi ve yüzey hazırlığı, basit deney kurulumuyla birlikte, EGFR ve integrinlerin etkileşimini incelemek için kararlı bir platform sağladı. Genel olarak, sonuçlar EGFR'nin ligand-bağımlı aktivasyonunun hücre yayılımını arttırdığını, integrin reseptörlerinin kuvvet taşıyan özelliklerini ayarladığını ve fokal adezyon organizasyonunu ve olgunlaşmasını desteklediğini doğrulamaktadır. TGT probları kullanılarak elde edilen sonuçlar, EGFR gibi büyüme faktörlerinin 'mekanik-düzenleyiciler' olarak hareket ettiği, integrin geriliminin miktarını ve mekansal organizasyonunu arttırdığı ve fokal adezyonların yönelimini ve mekaniğini düzenlediği kapsamlı hipotezini desteklemektedir.
TGT yüzeyine uygulandıktan sonra, hücreler integrin (αVβ3) reseptörleri cRGDfK ligandını algıladıkça ve bağlandıkça iner, bağlanır ve yayılır. Bunu yaparken, TGT probları mekanik olarak yırtılabilir ve ligand angajman bölgesinde floresan üretebilir. Okuma, yüzeyle etkileşime giren hücrenin kümülatif "kuvvet geçmişi" dir. TGT yüzeylerinde bu deneyler sırasında mevcut olabilecek bazı yaygın sorunlar vardır. Yüksek yüzey arka plan floresansı (Şekil 6A,B), yamalı yüzey görünümü, hücrelerin gerilim sinyali üretememesi (Şekil 6C,D) ve hücrelerin yayılmaması (Şekil 6E,F), TGT probu veya yüzey sentezi ile ilgili teknik eksikliklerden kaynaklanabilir. Bu yaygın sorunların çözümleri Tablo 1'de sunulmuştur.
TGT problarının basit tasarımı, hücre biyologlarına, yalnızca spesifik ligandlar ve stimülasyonlar sağlayarak diğer hücre yüzey reseptörlerinden parazit olmadan spesifik büyüme faktörü-integrin sinyal sonuçlarını izole olarak incelemek için güçlü bir araç sağlar. Ek olarak, TGT probları, pN duyarlılığında hücre adezyonu sırasında bireysel integrin reseptörlerinin altını çizen gerilim eşiğinin araştırılmasına izin verir. Alternatif yaklaşımlar, sabit örneklerde yüksek uzamsal çözünürlüğe sahip bireysel reseptörler tarafından uygulanan kuvvetleri rapor etmede başarısızolur 31. Traksiyon kuvveti mikroskobu sadece nN kuvvetlerine duyarlıdır, bireysel integrin reseptörleri15 tarafından uygulanan kuvvetlerden daha yüksek bir büyüklük sırasına sahiptir ve moleküler gerilim probları pN kuvvetlerini ölçer, ancak geri dönüşümlü oldukları için fiksasyona sağlam bir şekilde dayanmazlar. Bu nedenlerden dolayı, TGT probları, büyüme faktörü-integrin etkileşimlerinin mekaniğini incelemek için çekici bir araçtır.
Bir deney tasarlamadan önce göz önünde bulundurulması gereken TGT problarıyla ilişkili birkaç teknik nüans vardır. Gerilim görüntüsü, kuvvet geçmişini temsil eden ve herhangi bir zaman noktasındaki reseptör-ligand etkileşimlerinin bir göstergesi olmayan, zaman içinde bir anlık görüntüdür. Sinyal üretimi prob ayrımına bağlı olduğundan, TGT floresansı, reseptör-ligand etkileşiminden aktif gerilim altında olmayan açık problardan kaynaklanır. Bu, TGT yüzeyinde elde edilen integrin gerilimi için okumanın, Ttol'dan daha büyük kuvvetlerin olduğu yerleri temsil eden doğada tarihsel ve kümülatif olduğu anlamına gelir; Ttol'dan daha düşük akım reseptör-ligand kuvvetlerinin yerleri19,32 olarak bildirilmemiştir. TGT rüptürü reseptör-ligand etkileşiminin sona ermesiyle sonuçlandığından, hücre yayılımı Ttol'dan daha düşük kuvvetler yaşayan integrin-ligand etkileşimlerinden kaynaklanmaktadır. Bu nedenle kullanıcı, integrin tabanlı yapışmalarla ilişkili mekanik sonuçları tahmin etmek için kaplama sonrası zamanı tanımlarken dikkatli olmalıdır. Son olarak, Ttol'un anlamı dikkate alınmalıdır. Burada kullanılan TGT probları, 56 pN'lik bir Ttol'a sahiptir, burada Ttol, 2 s için uygulandığında probların% 50'sini parçalamak için gereken sabit kuvvettir. Karmaşık biyolojik sistemler göz önüne alındığında, TGT'ler muhtemelen değişen zaman bağımlılıkları ile heterojen ve çeşitli bir kuvvet derecelendirmesi yaşarlar. TGT'ler Ttol'dan daha büyük kuvvetler tarafından parçalanırsa, floresan toplam gerilimin hafife alınması anlamına gelir. Alternatif olarak, daha uzun süreler için uygulanan Ttol'un altındaki kuvvetler, daha kısa süreler için uygulanan yüksek eşik kuvvetleriyle benzer sayıda probu parçalayabilir. Her iki senaryo da aynı floresan yoğunluğu okumasıyla sonuçlanabilir ve TGT probları33,34 kullanılarak tam gerilim büyüklüğünün veya dinamiklerinin çözülmesini zorlaştırabilir.
Genel olarak, büyüme faktörü stimülasyonu ile integrin geriliminin değerlendirmeleri, iç kontrollerle deneyler tasarlanarak, diğer matris kaplı yüzeylerdeki yayılma profilleri karşılaştırılarak, büyüme faktörü stimülasyonunun varlığında veya yokluğunda hücrelerde TGT floresansının paralel değerlendirmeleri yapılarak ve TGT'ler farklı Ttol ile kullanılarak dikkatli bir şekilde yapılmalıdır. . TGT'ler, integrin reseptörlerinin mekaniğini, fokal adezyon dinamiklerini ve hücre yayılımını düzenlemede büyüme faktörü sinyallemesinin rolünün ölçülmesine izin verir. Bu protokol, farklı Ttol, farklı ligandlar, farklı hücre tipleri veya farklı stimülasyon koşullarına sahip problar kullanan birçok TGT tabanlı deney için bir şablon olarak kullanılabilir. İlgilenilen herhangi bir protein, fiksasyondan sonra etiketlenebilir ve her türlü nicel görüntü analizi uygulanabilir. Bu nedenle, çok sayıda TGT deneyi için bir şablon sunuyoruz.
TGT problarının kullanımı integrinleri incelemekle sınırlı değildir, ancak ligandı değiştirerek farklı hücre tipleri arasında çeşitli hücre zarı reseptörleri dizisine genişletilebilir. TGT probları, embriyonik gelişim ve nörogenezde çentik reseptör mekaniğinin mekanik rolünün tanımlanması, B hücre reseptörleri tarafından antijenlerin tanımlanmasına ve içselleştirilmesine aracılık eden kuvvetler36 ve T-hücresi yüzey reseptörlerinin sinyal transferinin gücünü ve özgüllüğünü artırmak için kuvvetlerdeki değişiklikleri tespit etmek için mekanik prova okuma yeteneği37 dahil olmak üzere çeşitli reseptör sinyal kaskadlarının düzenlenmesinde kuvvetlerin rolünü araştırmak için kullanılmıştır. . Birlikte, bu bulgular TGT problarının çeşitli deneysel ortamlarda muazzam potansiyelini vurgulamaktadır.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Yazarlar, verimli tartışmalar ve eleştiriler için Mattheyses laboratuvarının üyelerini tanımak istemektedir. NSF CAREER 1832100 ve NIH R01GM131099'dan A.L.M.'ye fon sağlamayı kabul ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl)triethoxysilane | Millipore Sigma | 440140 | Surface Preparation |
| 3-hydroxypicolinic acid (3-HPA) | Millipore Sigma | 56197 | Maldi-TOF-MS matrix |
| Acetic Acid, Glacial | Fisher Scientific | A38S | Diluting EGF |
| Acetonitrile (HPLC) | Fisher Scientific | A998SK | Oligonucleotide Preparation |
| Alexa Fluor 488 Phalloidin | Cell Signaling Technology | 8878S | Immunocytochemistry |
| Ammonium Chloride | Fisher Scientific | A687 | Immunocytochemistry |
| Anti-Paxillin antibody [Y113] | Abcam | ab32084 | Immunocytochemistry |
| BD Syringes only with Luer-Lok | BD bioscience | 309657 | Surface Preparation |
| Bio-Gel P-2 | Bio-Rad | 1504118 | Oligonucleotide Preparation |
| Bovine Serum Albumin (BSA) Protease-free Powder | Fisher Scientific | BP9703100 | Surface Preparation |
| Cos-7 cells | ATCC | CRL-1651 | Cell Culture, Passage numbers 11-20 |
| Coverslip Mini-Rack, for 8 coverslips | Fisher Scientific | C14784 | Surface Preparation |
| c(RGDfK(PEG-PEG)), PEG=8-amino-3,6-dioxaoctanoic acid | Vivitide | PCI-3696-PI | Oligonucleotide Preparation |
| Cy3B NHS ester | GE Healthcare | PA63101 | Oligonucleotide Preparation |
| Dimethylformamide | Millipore Sigma | PHR1553 | Oligonucleotide Preparation |
| DMEM with L-Glutamine, 4.5g/L Glucose and Sodium Pyruvate | Fisher Scientific | MT10013C | Cell Culture |
| Epidermal Growth Factor human EGF | Millipore Sigma | E9644 | Cell Culture |
| Ethanol, 200 proof (100%) | Fisher Scientific | 22032601 | Surface Preparation |
| Falcon Standard Tissue Culture Dishes | Fisher Scientific | 08-772E | Surface Preparation |
| Fetal Bovine Serum | Fisher Scientific | 10-438-026 | Cell Culture |
| Flurobrite DMEM | Fisher Scientific | A1896701 | Cell Culture |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 647 | Invitrogen | A-21244 | Immunocytochemistry |
| Goat Serum | Fisher Scientific | 16-210-064 | Immunocytochemistry |
| Hank’s balanced salts (HBSS) | Fisher Scientific | 14-170-161 | Cell Culture |
| Horse Serum | Fisher Scientific | 16050130 | Immunocytochemistry |
| Hydrogen Peroxide | Fisher Scientific | H325-500 | Surface Preparation |
| Nanosep MF centrifugal devices | Pall laboratory | ODM02C35 | Oligonucleotide Preparation |
| NHS-azide | Fisher Scientific | 88902 | Oligonucleotide Preparation |
| Nitrogen Gas Cylinder | Airgas | Surface Preparation | |
| No. 2 round glass coverslips - 25 mm | VWR | 48382-085 | Surface Preparation |
| Parafilm M Laboratory Film | Fisher Scientific | 13-374-10 | Surface Preparation |
| Paraformaldehyde 16% | Fisher Scientific | 50-980-487 | Immunocytochemistry |
| PBS, 1X | Fisher Scientific | 21-030-CV | Surface Preparation/Immunocytochemistry |
| Penicillin-Streptomycin (5,000 U/mL) | Fisher Scientific | 15-070-063 | Cell Culture |
| PYREX Low Form Griffin Beakers | Fisher Scientific | 02-540G | Surface Preparation |
| Sodium Ascorbate | Fisher Scientific | 18-606-310 | Oligonucleotide Preparation |
| Sodium Bicarbonate | Fisher Scientific | S233 | Oligonucleotide Preparation |
| Sodium Chloride | Fisher Scientific | BP358 | Surface Preparation |
| Streptavidin | Fisher Scientific | 434301 | Surface Preparation |
| Sulfo-NHS-LC-Biotin | Fisher Scientific | 21335 | Surface Preparation |
| Sulfuric Acid | Fisher Scientific | A300-500 | Surface Preparation |
| TEAA | Fisher Scientific | NC0322726 | Oligonucleotide Preparation |
| Triethylamine | Millipore Sigma | 471283 | Oligonucleotide Preparation |
| Trifluoroacetic Acid (TFA) | Fisher Scientific | PI28901 | Oligonucleotide Preparation |
| THPTA | Fisher Scientific | NC1296293 | Oligonucleotide Preparation |
| Triton X 100 Detergent Surfact Ams Solution | Fisher Scientific | 85111 | Immunocytochemistry |
| Water, DNA Grade, DNASE, Protease free | Fisher Scientific | BP24701 | Oligonucleotide Preparation |
| Equipment | |||
| Agilent AdvanceBio Oligonucleotide C18 column, 4.6 x 150 mm, 2.7 μm | Agilent | 653950-702 | Oligonucleotide Preparation |
| High-performance liquid chromatography | Agilent | 1100 | Oligonucleotide Preparation |
| Low Speed Orbital Shaker | Fisher Scientific | 10-320-813 | Immunocytochemistry |
| Matrix-assisted laser desorption/ ionization time-of-flight mass spectrometer (MALDI-TOF-MS) | Voyager STR | Oligonucleotide Preparation | |
| Molecular Probes Attofluor Cell Chamber | Fisher Scientific | A7816 | Surface Preparation |
| Nanodrop 2000 UV-Vis Spectrophotometer | Thermo Fisher | Oligonucleotide Preparation | |
| Nikon Eclipse Ti inverted microscope | pe Nikon | Microscopy | |
| Nikon Perfect Focus System | Nikon | Microscopy | |
| NIS Elements software | Nikon | Microscopy | |
| ORCA-Flash4.0 V3 Digital CMOS camera | Hamamatsu | Microscopy | |
| Quad band TIRF 405/488/561/647 cube | CHROMA | Microscopy | |
| RICM Cube | CHROMA | Microscopy | |
| SOLA v-nIR Light Engine | Lumencor | Microscopy | |
| Thermo Forma Steri Cycle 370 CO2 Incubator | Fisher Scientific | Cell Culture | |
| VWR 75D Ultrasonic Cleaner | VWR | 13710 | Surface Preparation |
| Data Analysis | Use | ||
| Fiji (Image J) | https://imagej.net/software/fiji/downloads | Quantitative Analysis | |
| Graph Pad Prism | Graph Pad | Statistical Analysis | |
| Oligo name | 5'modification/ 3' modification | Sequence (5' to 3') | Use |
| Alkyne-21-BHQ2 | 5' Hexynyl/ 3' BHQ_2 | GTGAAATACCGCACAGATGCG | Top strand TGT probe |
| 56 pN TGT | 5' Biosg/TTTTTT/iUniAmM | CGCATCTGTGCGGTATTTCACTTT | Bottom strand TGT probe |
| 12 pN TGT | 5' AmMC6/ 3' BioTEG | CGCATCTGTGCGGTATTTCACTTT | Bottom strand TGT probe |
Referanslar
- Lim, C. -. G., Jang, J., Kim, C. Cellular machinery for sensing mechanical force. BMB Reports. 51 (12), 623-629 (2018).
- Moraes, C., Sun, Y., Simmons, C. A. (Micro)managing the mechanical microenvironment. Integrative Biology. 3 (10), 959-971 (2011).
- Vogel, V., Sheetz, M. P. Mechanical forces matter in health and disease. From Cancer to Tissue Engineering. Nanotechnology. , 233-303 (2010).
- Wang, J. H. C., Li, B. Mechanics rules cell biology. BMC Sports Science, Medicine and Rehabilitation. 2 (1), 16 (2010).
- Moeendarbary, E., Harris, A. R. Cell mechanics: principles, practices, and prospects. Wiley Interdisciplinary Reviews: Systems Biology and Medicine. 6 (5), 371-388 (2014).
- Streuli, C. H., Akhtar, N. Signal co-operation between integrins and other receptor systems. Biochemical Journal. 418 (3), 491-506 (2009).
- Chiasson-MacKenzie, C., McClatchey, A. I. EGFR-induced cytoskeletal changes drive complex cell behaviors: The tip of the iceberg. Science Signaling. 11 (515), (2018).
- Kechagia, J. Z., Ivaska, J., Roca-Cusachs, P. Integrins as biomechanical sensors of the microenvironment. Nature Reviews Molecular Cell Biology. 20 (8), 457-473 (2019).
- De Luca, A., et al. The role of the EGFR signaling in tumor microenvironment. Journal of Cellular Physiology. 214 (3), 559-567 (2008).
- Javadi, S., Zhiani, M., Mousavi, M. A., Fathi, M. Crosstalk between Epidermal Growth Factor Receptors (EGFR) and integrins in resistance to EGFR tyrosine kinase inhibitors (TKIs) in solid tumors. European Journal of Cell Biology. 99 (4), 151083 (2020).
- Eliceiri, B. P. Integrin and growth factor receptor crosstalk. Circulation Research. 89 (12), 1104-1110 (2001).
- Dan, L., Jian, D., Na, L., Xiaozhong, W. Crosstalk between EGFR and integrin affects invasion and proliferation of gastric cancer cell line, SGC7901. OncoTargets and Therapy. 5, 271-277 (2012).
- Giancotti, F. G., Tarone, G. Positional control of cell fate through joint integrin/receptor protein kinase signaling. Annual Reviews: Cell and Developmental Biology. 19, 173-206 (2003).
- Ricono, J. M., et al. Specific cross-talk between epidermal growth factor receptor and integrin alphavbeta5 promotes carcinoma cell invasion and metastasis. Cancer Research. 69 (4), 1383-1391 (2009).
- Polacheck, W. J., Chen, C. S. Measuring cell-generated forces: a guide to the available tools. Nature Methods. 13 (5), 415-423 (2016).
- Hang, X., et al. Nanosensors for single cell mechanical interrogation. Biosensors and Bioelectronics. 179, 113086 (2021).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Schoen, I., Hu, W., Klotzsch, E., Vogel, V. Probing cellular traction forces by micropillar arrays: contribution of substrate warping to pillar deflection. Nano Letters. 10 (5), 1823-1830 (2010).
- Ma, V. P. -. Y., Salaita, K. DNA Nanotechnology as an Emerging Tool to Study Mechanotransduction in Living Systems. Small. 15 (26), 1900961 (2019).
- Kim, Y., Kim, K. A., Kim, B. C. Double-stranded DNA force sensors to study the molecular level forces required to activate signaling pathways. Journal of the Korean Physical Society. 78 (5), 386-392 (2021).
- Rao, T. C., et al. EGFR activation attenuates the mechanical threshold for integrin tension and focal adhesion formation. Journal of Cell Sciences. 133 (13), (2020).
- Zhang, Y., Ge, C., Zhu, C., Salaita, K. DNA-based digital tension probes reveal integrin forces during early cell adhesion. Nature Communications. 5, 5167 (2014).
- Liu, Y., et al. DNA-based nanoparticle tension sensors reveal that T-cell receptors transmit defined pN forces to their antigens for enhanced fidelity. Proceedings of the National Academy of Sciences of the United States of America. 113 (20), 5610-5615 (2016).
- Zhang, Y., et al. Platelet integrins exhibit anisotropic mechanosensing and harness piconewton forces to mediate platelet aggregation. Proceedings of the National Academy of Sciences of the United States of America. 115 (2), 325-330 (2018).
- Ma, V. P. -. Y., et al. Mechanically induced catalytic amplification reaction for readout of receptor-mediated cellular forces. Angewandte Chemie International Edition. 55 (18), 5488-5492 (2016).
- Wang, X., Ha, T. Defining single molecular forces required to activate integrin and notch signaling. Science. 340 (6135), 991-994 (2013).
- Chen, Y., Lee, H., Tong, H., Schwartz, M., Zhu, C. Force regulated conformational change of integrin αVβ3. Matrix Biology. 60-61, 70-85 (2017).
- Kantlehner, M., et al. Surface coating with cyclic RGD peptides stimulates osteoblast adhesion and proliferation as well as bone formation. ChemBioChem. 1 (2), 107-114 (2000).
- Kapp, T. G., et al. A comprehensive evaluation of the activity and selectivity profile of ligands for RGD-binding integrins. Scientific Reports. 7, 39805 (2017).
- Kok, R. J., et al. Preparation and functional evaluation of RGD-modified proteins as alpha(v)beta(3) integrin directed therapeutics. Bioconjugate Chemistry. 13 (3), 128-135 (2002).
- Li, I. T. S., Ha, T., Chemla, Y. R. Mapping cell surface adhesion by rotation tracking and adhesion footprinting. Scientific Reports. 7 (1), 44502 (2017).
- Wang, Y., et al. Force-activatable biosensor enables single platelet force mapping directly by fluorescence imaging. Biosensors and Bioelectronics. 100, 192-200 (2018).
- Murad, Y., Li, I. T. S. Quantifying molecular forces with serially connected force sensors. Biophysical Journal. 116 (7), 1282-1291 (2019).
- Yasunaga, A., Murad, Y., Li, I. T. S. Quantifying molecular tension-classifications, interpretations and limitations of force sensors. Physical Biology. 17 (1), 011001 (2019).
- Luca, V. C., et al. Notch-Jagged complex structure implicates a catch bond in tuning ligand sensitivity. Science. 355 (6331), 1320-1324 (2017).
- Spillane, K. M., Tolar, P. B cell antigen extraction is regulated by physical properties of antigen-presenting cells. The Journal of Cell Biology. 216 (1), 217-230 (2017).
- Brockman, J. M., Salaita, K. Mechanical proofreading: a general mechanism to enhance the fidelity of information transfer between cells. Frontiers in Physics. 7, 14 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır