A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نهج ديناميكي ضوئي لدراسة وظيفة تمزق الحويصلة داخل الخلايا
In This Article
Summary
يعد تعطيل الليزر بمساعدة الكروموفور (CALI) بوساطة AlPcS2a أداة قوية لدراسة الضرر الزماني المكاني للحويصلات داخل الخلايا (IVs) في الخلايا الحية.
Abstract
تتشكل الحويصلات داخل الخلايا (IVs) من خلال التداخل الخلوي للحويصلات إلى السيتوبلازم. يشارك التكوين الوريدي في تنشيط مسارات الإشارة المختلفة من خلال نفاذية الأغشية الوريدية وتشكيل الإندوسومات والليزوزومات. يتم تطبيق طريقة تسمى تعطيل الليزر بمساعدة الكروموفور (CALI) لدراسة تكوين IVs والمواد في التحكم في تنظيم IV. CALI هي منهجية ديناميكية ضوئية قائمة على التصوير لدراسة مسار الإشارات الناجم عن نفاذية الغشاء. تسمح هذه الطريقة بالتلاعب الزماني المكاني للعضية المحددة بالتغلغل في الخلية. تم تطبيق طريقة CALI لمراقبة ومراقبة جزيئات معينة من خلال نفاذية الإندوسومات والليزوزومات. من المعروف أن تمزق غشاء IVs يجند بشكل انتقائي البروتينات المرتبطة بالجليكان ، مثل galectin-3. هنا ، يصف البروتوكول تحريض التمزق الوريدي بواسطة AlPcS2a واستخدام galectin-3 كعلامة لتسمية الليزوزومات الضعيفة ، وهو أمر مفيد في دراسة التأثيرات النهائية لتمزق الغشاء الوريدي وتأثيراتها النهائية في حالات مختلفة.
Introduction
تتشكل الإندوسومات ، وهي نوع من الحويصلات داخل الخلايا (IV) ، عن طريق التداخل الخلوي ثم تنضج إلى ليزوزومات. وتشارك مسارات إشارة داخل الخلايا المختلفة في تشكيل IVs. بالإضافة إلى ذلك ، يمكن أن تؤدي المحفزات الداخلية والخارجية المختلفة إلى إتلاف الوريد (على سبيل المثال ، يمكن لمسببات الأمراض الهروب من الغشاء المحدد أثناء العدوى والدخول في السيتوبلازم1). وعادة ما يكون هذا مصحوبا بتمزق الحويصلات الداخلية2. لذلك ، يمكن استخدام تقنيات استهداف الوريد وإتلافه في الدراسات ذات الصلة3.
العلاج الضوئي الديناميكي (PDT) هو علاج يعتمد على الضوء لمكافحة الأمراض عن طريق قتل الأورام أو مسببات الأمراض4. في PDT ، يتم تمييز الخلايا المستهدفة بكروموفورات غير سامة ، تسمى المحسسات الضوئية ، والتي يمكن تنشيطها محليا عن طريق إضاءةالضوء 5,6. تمتص المحسسات الضوئية الطاقة من الضوء وتتحول إلى حالة مفردة مثارة ، مما يؤدي إلى الحالة الثلاثية المثارة طويلة العمر. يمكن أن تخضع المحسسات الضوئية للحالة الثلاثية لنقل الإلكترون أو الطاقة وتشكل أنواع الأكسجين التفاعلية (ROS) في وجود الأكسجين ، ويمكن أن تدمر مكانيا الخلايا الموسومة داخل منطقة الإضاءة7. تختلف النتيجة اعتمادا على قوة الضوء8. من خلال التحكم في تركيز المحسسات الضوئية وشدة إضاءة الضوء ، يمكن تعطيل الجزيئات الحيوية المستهدفة بشكل انتقائي دون تحلل الخلية ، والتي يطلق عليها تعطيل الضوء بمساعدة الكروموفور (CALI) 9. مع التطور الكبير للمحسسات الضوئية التي يمكنها تسمية الأهداف تحت الخلوية المختلفة بشكل انتقائي ، أصبح CALI أداة قيمة للتحكم في تعطيل الجزيئات الحيوية بوساطة الضوء للجزيئات الحيوية الصغيرة مثل النيوكليوتيدات والبروتينات ، وكذلك العضيات مثل الميتوكوندريا والليزوزومات الداخلية3،10،11،12،13.
بالمقارنة مع CALI ، تستخدم الطرق الكيميائية أو الفيزيائية أيضا لإضعاف الأغشية ، مثل السم البكتيري 14,15 وعلاج Leu-Leu-OMe16 للتلف الليزوزومي. ومع ذلك ، تظهر هذه الطرق ضعفا كبيرا في الوريد داخل الخلايا. تستخدم المحسسات الضوئية القوية (أي حمض ثاني السلفونيك كلوريد الفثالوسيانين Al(III) (AlPcS2a)) في كالي؛ يستخدم AlPcS2a ، الذي يستهدف الليزوزومات من خلال التداخل الخلوي ، لتمزق الإندوسومات أو الليزوزومات في منطقة خاضعة للرقابة17. AlPcS2a عبارة عن كروموفور قائم على الفثالوسيانين غير منفذ لغشاء الخلية يرتبط بالدهون على غشاء البلازما ويتم استيعابه من خلال التداخل الخلوي ويتراكم في النهاية داخل الليزوزوم من خلال المسار الداخلي18. يمتص الضوء داخل منطقة طيفية قريبة من الأشعة تحت الحمراء ويولد أكسجينا مفردا ، وهو نوع من أنواع الأكسجين التفاعلية الرئيسية الناتجة عن AlPcS2a18 المثار. يحد اضمحلال الأكسجين المفرد بسرعة من انتشاره ومسافة تفاعله داخل منطقة صغيرة في الخلايا (حوالي 10-20 نانومتر)19. من خلال ضبط مدة حضانة AlPcS2a والإضاءة الضوئية ، يسمح بالتحكم الزماني المكاني في تلف IVs داخل منطقة تحت خلوية. لذلك يصبح CALI أداة قوية لفحص عواقب الضرر الوريدي ، وتشكيل وتنظيم IVs.
في هذه الدراسة ، تم تناول بروتوكول محدد من CALI باستخدام AlPcS2a كمحسس ضوئي. يمكن تطبيق هذا البروتوكول على أنواع مختلفة من الوريد ، بما في ذلك الإندوسومات والليزوزومات ، ويستخدم لفحص استجابات المتابعة بعد تمزق الغشاء. يتم استخدام خلايا HeLa التي تعبر عن galectin-3 الفلوروفور16,20 التي تم الكشف عنها بعد تمزق الليزوزوم لإثبات هذا البروتوكول.
Protocol
1. AlPcS2a إعداد الأسهم
- قم بإذابة 10 ملغ من AlPcS2a في 400 ميكرولتر من 0.1 M NaOH. لتحسين الذوبان ، قم بتسخين المحلول عند 50 درجة مئوية ودوامة.
- امزج المحلول مع 4 مل من محلول ملحي مخزن بالفوسفات (PBS). بعد ذلك، رشح المحلول بمرشح 0.22 ميكرومتر لإزالة الرواسب غير القابلة للذوبان.
- قم بقياس تركيز المحلول من خلال مقياس الطيف الضوئي للأشعة المرئية وفوق البنفسجية. معامل الانقراض ل AlPcS2a عند 672 نانومتر هو 4 × 104 سم -1 م -1. قم بتخفيف محلول AlPcS2a باستخدام PBS لعمل محلول 1 mM. اصنع 1 مل من القسمة واحفظها في درجة حرارة -20 درجة مئوية.
2. النقل
ملاحظة: يتم تطبيق Gal3-GFP كمؤشر لتصوير الخلايا الحية للتمزق الليزوزومي.
- الحفاظ على زراعة خلايا هيلا في DMEM مع 10٪ مصل بقري جنيني (FBS). بعد غسل الخلايا باستخدام برنامج تلفزيوني ، قم بتثريبسين الخلايا ، ثم أعد تعليق الخلايا في DMEM مع استكمال 10٪ FBS.
ملاحظة: هذه الطريقة قابلة للتطبيق على معظم خطوط الخلايا المرفقة ، بما في ذلك خطوط خلايا HeLa و A549. من حيث المبدأ، على الرغم من عدم اختبار الخلايا المعلقة، يمكن إجراء فحوصات CALI معهم. - خفف 300 نانوغرام من بلازميد Gal3-GFP في 25 ميكرولتر من وسط المصل المختزل ، ثم أضف 0.6 ميكرولتر من كاشف P3000. مزيج بلطف. تمييع 0.45 ميكرولتر من كاشف ليبوفيكتامين 3000 في 25 ميكرولتر من وسط المصل المخفض. مزيج بلطف.
- احتضان لمدة 5 دقائق في درجة حرارة الغرفة. امزج الحمض النووي المخفف و Lipofectamine 3000 المخفف ، ثم احتضانه لمدة 10 دقائق في درجة حرارة الغرفة.
- امزج خليط DNA-Lipofectamine ، و 3 × 105 خلايا HeLa معلقة ، و 200 ميكرولتر من DMEM + 10٪ FBS ، ثم قم بزرع الخلايا في المنطقة الزجاجية المركزية لطبق زر زجاجي 35 مم.
3. AlPcS2a تلطيخ
- للسماح بربط الخلية ، احتضان الخلايا عند 37 درجة مئوية في الحاضنة المزودة بنسبة 5٪ CO2 لمدة 4 ساعات على الأقل.
- تمييع AlPcS 2a في DMEM المكمل ب 10٪ FBS لصنع محلول 1 ميكرومتر AlPcS2a. قم بتسخين الوسط المحتوي على AlPcS2a مسبقا في حمام مائي بدرجة حرارة 37 درجة مئوية. استبدل وسيط الاستزراع بالوسط المحتوي على AlPcS2a.
- احتضان الخلايا عند 37 درجة مئوية في الحاضنة المزودة ب 5٪ CO2 طوال الليل (16-18 ساعة).
- في اليوم التالي ، اغسل الخلايا مرتين باستخدام برنامج تلفزيوني لإزالة AlPcS2a خارج الخلية. استبدل الوسط بوسط جديد ، ثم احتضانه عند 37 درجة مئوية لمدة 4 ساعات للسماح للصبغة المتبقية على طول المسار الداخلي بالتراكم في الجسيمات الحالة.
ملاحظة: لتلطيخ الإندوسومات ، احتضان الخلايا في 1 ميكرومتر AlPcS2a في DMEM يحتوي على 10٪ FBS لمدة 15 دقيقة عند 37 درجة مئوية. بعد ذلك ، اغسل الخلايا مرتين باستخدام برنامج تلفزيوني واحتضانها في وسط تم تسخينه مسبقا قبل التصوير .
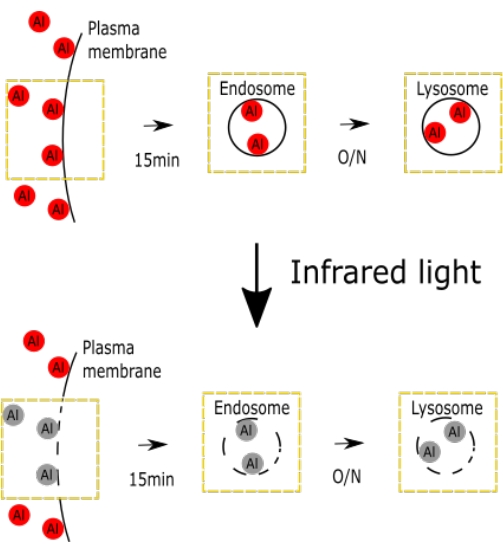
الشكل 1. شكل تخطيطي يمثل الضرر الوريدي الانتقائي مع AlPcS2a. يوضح الشكل مخططات الضرر الوريدي الانتقائي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
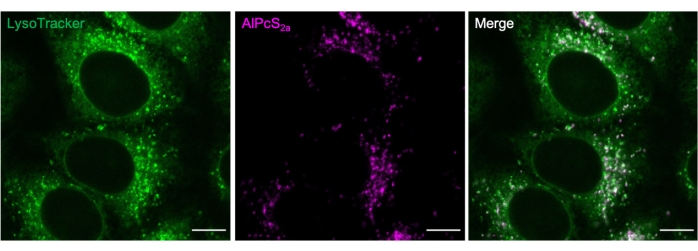
الشكل 2. تلطيخ الليزوزومات مع AlPcS2a. الجسيمات الحالة الموصوفة بين عشية وضحاها ب 1 ميكرومتر AlPcS2a في خلايا هيلا ملطخة بشكل إيجابي بصبغة فلورسنت خضراء 50 نانومتر. شريط المقياس: 10 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
4. عينة التصوير والإضاءة الضوئية
ملاحظة: يمكن إجراء تلف وريدي داخل منطقة تحت خلوية لخلية واحدة أو جميع الخلايا الموسومة ب AlPcS2a في طبق الثقافة. تسمح الإضاءة السائبة لطبق الثقافة بالكامل بالدراسة الكمية لهذا الضرر ، بما في ذلك الدراسات الكيميائية الحيوية.
- التعامل مع الخلايا المفردة عن طريق إتلاف الليزوزومات داخل خلية واحدة ، كما هو موضح أدناه.
- ضع طبق الثقافة على مرحلة المجهر متحد البؤر. استخدم ليزر 488 نانومتر و 561 نانومتر لإثارة GFP و AlPcS2a ، على التوالي.
- ضع دائرة حول منطقة اهتمام 5 × 5 ميكرومتر2 (ROI) على الحويصلات التي تحمل علامة AlPcS2a والتي تم تحديدها لتكون تالفة.
- يضيء النبض عائد الاستثمار باستخدام ليزر 633 نانومتر يبلغ 0.21 ميجاوات لمدة 70 تكرارا. مراقبة تشكيل Gal3 puncta كمؤشر على نفاذية الغشاء الليزوزومي.
- تلف جميع الخلايا المصنفة في طبق مزرعة كما هو موضح أدناه.
- ضع طبق الثقافة على منصة. قم بإضاءة الطبق ب 660 نانومتر من ضوء LED المتوازي (ضوء الأشعة تحت الحمراء القريبة هو القاعدة المثالية على طيف الإثارة في AlPcS2a).
- ضع طبق الاستزراع على المجهر وراقب مؤشرات نفاذية الغشاء كما هو مذكور في الخطوة 4.1.3.
- تقييم إصابة الوريد باستخدام المؤشرات التالية.
- محتويات الإندوسوم أو الليزوزوم هي الأكثر غليكوزيلاتي ، والتي تتعرض للسيتوسول عند التمزق الوريدي. قم بتسمية هذه بسرعة باستخدام galectins المرتبط بالجليكان الخلوي ، بما في ذلك galectin-1 و galectin-3 و galectin-8 و galectin-916,20.
- يمكن تحديد حجم الجرح عن طريق إطلاق صبغة غير منفذة للغشاء كما هو موضح في21.
- الفرق بين الإندوسومات والليزوزومات هو قيمة الأس الهيدروجيني اللمعية. يؤدي التمزق الليزوزومي إلى اضطراب درجة الحموضة اللمعية ، والتي يمكن قياسها باستخدام صبغة حساسة لدرجة الحموضة ، مثل FITC-dextran3.
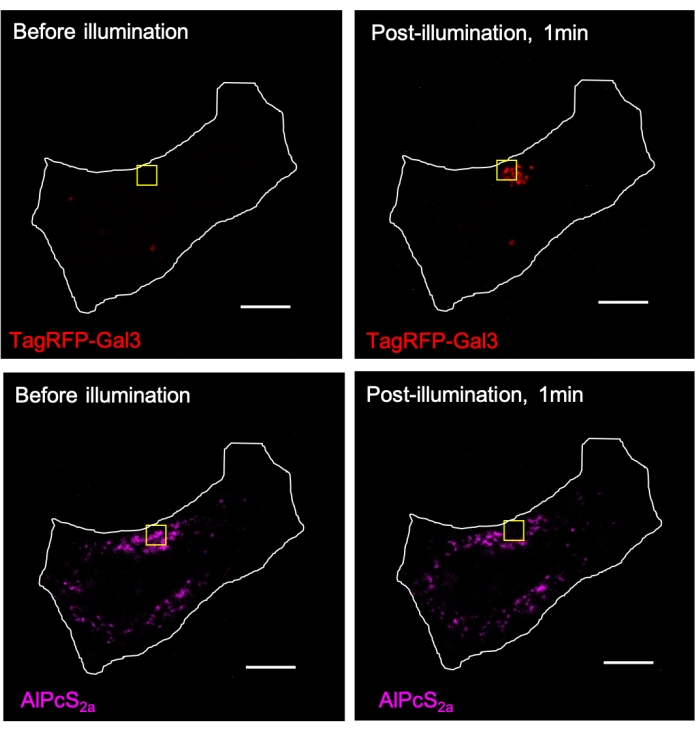
الشكل 3. يحفز CALI بوساطة AlPcS2a التوظيف المحلي ل TagRFP-galectin-3 (Gal3) إلى الجسيمات الحالة داخل منطقة الإضاءة. تم تلطيخ الليزوزومات في خلايا هيلا المعبر عنها TagRFP-galectin-3 بين عشية وضحاها ب 1 ميكرومتر AlPcS2a ، تليها إضاءة مركزة بضوء قريب من الأشعة تحت الحمراء (633 نانومتر) داخل المربع الأصفر. يتم تبييض إشارة AlPcS2a داخل المربع الأصفر ضوئيا ، مصحوبة بتكوين TagRFP-galectin-3 puncta. شريط المقياس: 10 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
النتائج
تم عرض شكل تخطيطي يمثل الضرر الناجم عن AlPcS2a للحقن الوريدي ، بما في ذلك الإندوسوم والليزوزوم (الشكل 1).
يمكن استخدام العلامات المتاحة تجاريا لتحديد ظروف تلطيخ AlPcS2a. على سبيل المثال ، AlPcS 2a puncta وصبغة الفلورسنت الخضراء22 colocalization (الشكل...
Discussion
يرتبط AlPcS2a بغشاء البلازما ، ثم يتم استيعابه عن طريق التداخل الخلوي ويتراكم في النهاية في الجسيمات الحالة. وبالتالي يمكن توطين AlPcS2a في المقصورات تحت الخلوية عن طريق ضبط مدة الحضانة. يتمثل أحد قيود هذه المنهجية في أنه يمكن تصنيف مجموعة فرعية فقط من IVs بواسطة AlPcS2a من خلال التد...
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
يود المؤلفون أن يشكروا المرفق الأساسي لالتهاب Academia Sinica ، IBMS على الدعم البحثي. يتم تمويل المرفق الأساسي من قبل مرفق أكاديميا سينيكا الأساسي ومشروع الأدوات المبتكرة (AS-CFII-111-213). يشكر المؤلفون المرفق الأساسي للمعدات المشتركة التابع لمعهد العلوم الطبية الحيوية (IBMS) ، Academia Sinica (AS) للمساعدة في الحصول على الصور.
Materials
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Al(III) Phthalocyanine Chloride Disulfonic acid (AlPcS2a) | Frontier Scientific | P40632 | |
| Culture dish | ibidi | 812128-200 | |
| Culture Medium | DMEM supplemented with 10% FBS and 100 U/mL penicillin G and 100 mg/mL Streptomycin | ||
| DMEM | Gibco | 11965092 | |
| FBS | Thermo Fisher Scientific | A4736301 | |
| Gal3-GFP plasmid | addgene | ||
| Lipofectamine 3000 kit | Thermo Fisher Scientific | L3000008 | |
| LysoTracker Green DND-26 | Thermo Fisher Scientific | L7526 | green fluorescent dye |
| Multiwall plate | perkinelmer | PK-6005550 | |
| NaOH | Thermo Fisher Scientific | Q15895 | |
| OptiMEM | Thermo Fisher Scientific | 31985070 | |
| Penicillin-streptomycin | Gibco | 15140163 | |
| Phosphate-Buffered Saline (PBS) | Gibco | 21600-069 | 137 mM NaCl, 2.7 mM KCl, 10mM Na2HPO4, 1.8 mM KH2PO4 |
| Cell line | |||
| HeLa Cell Line | ATCC | CCL-2 | The methods are applicable for most of the attached cell lines. Conditions must be determined individually. |
| Equipments | |||
| 0.22 µm Filter | Merck | SLGV013SL | |
| Collimated LED Light (660nm) | Thorlabs | M660L3-C1 and DC2100 | Near-infared light is ideal base on the excitation spectrum of AlPcS2a. |
| Confocal microscopy | Carl Zeiss | LSM 780 | An incubation system is required for long-term imaging. |
| NanoDrop 2000/2000c Spectrophotometers | Thermo Fisher Scientific | ||
| Red LED light | Tholabs | M660L4-C1 |
References
- Cossart, P., Helenius, A. Endocytosis of viruses and bacteria. Cold Spring Harbor Perspectives in Biology. 6 (8), 016972 (2014).
- Daussy, C. F., Wodrich, H. 34;Repair me if you can": membrane damage, response, and control from the viral perspective. Cells. 9 (9), 2042 (2020).
- Hung, Y. H., Chen, L. M., Yang, J. Y., Yang, W. Y. Spatiotemporally controlled induction of autophagy-mediated lysosome turnover. Nature Communications. 4, 2111 (2013).
- Sharma, S. K., et al. Photodynamic therapy for cancer and for infections: what is the difference. Israel Journal of Chemistry. 52 (8-9), 691-705 (2012).
- Kübler, A. C. Photodynamic therapy. Medical Laser Application. 20 (1), 37-45 (2005).
- De Rosa, F. S., Bentley, M. V. Photodynamic therapy of skin cancers: sensitizers, clinical studies and future directives. Pharmaceutical Research. 17 (12), 1447-1455 (2000).
- Hamblin, M. R. New photosensitizers for photodynamic therapy. Biochemical Journal. 473 (4), 347-364 (2016).
- Lavie, G., et al. A photodynamic pathway to apoptosis and necrosis induced by dimethyl tetrahydroxyhelianthrone and hypericin in leukaemic cells: possible relevance to photodynamic therapy. British Journal of Cancer. 79 (3-4), 423-432 (1999).
- Jay, D. G. Selective destruction of protein function by chromophore-assisted laser inactivation. Proceedings of the National Academy of Sciences. 85 (15), 5454-5458 (1988).
- Grate, D., Wilson, C. Laser-mediated, site-specific inactivation of RNA transcripts. Proceedings of the National Academy of Sciences. 96 (11), 6131-6136 (1999).
- Lin, J. Y., et al. Optogenetic inhibition of synaptic release with chromophore-assisted light inactivation (CALI). Neuron. 79 (2), 241-253 (2013).
- Hsieh, C. W., Yang, W. Y. Triggering mitophagy with photosensitizers. Methods in Molecular Biology. 1880, 611-619 (2019).
- Yang, J. Y., Yang, W. Y. Spatiotemporally controlled initiation of Parkin-mediated mitophagy within single cells. Autophagy. 7 (10), 1230-1238 (2011).
- Molinari, M., et al. Vacuoles induced by Helicobacter pylori toxin contain both late endosomal and lysosomal markers. Journal of Biological Chemistry. 272 (40), 25339-25344 (1997).
- Prince, L. R., et al. Subversion of a lysosomal pathway regulating neutrophil apoptosis by a major bacterial toxin, pyocyanin. Journal of Immunology. 180 (5), 3502-3511 (2008).
- Aits, S., et al. Sensitive detection of lysosomal membrane permeabilization by lysosomal galectin puncta assay. Autophagy. 11 (8), 1408-1424 (2015).
- Prasmickaite, L., Hogset, A., Berg, K. Evaluation of different photosensitizers for use in photochemical gene transfection. Photochemistry and Photobiology. 73 (4), 388-395 (2001).
- Berg, K., et al. Photochemical internalization: a novel technology for delivery of macromolecules into cytosol. Cancer Research. 59 (6), 1180-1183 (1999).
- Moan, J., Berg, K. The photodegradation of porphyrins in cells can be used to estimate the lifetime of singlet oxygen. Photochemistry and Photobiology. 53 (4), 549-553 (1991).
- Thurston, T. L., Wandel, M. P., von Muhlinen, N., Foeglein, A., Randow, F. Galectin 8 targets damaged vesicles for autophagy to defend cells against bacterial invasion. Nature. 482 (7385), 414-418 (2012).
- Repnik, U., et al. L-leucyl-L-leucine methyl ester does not release cysteine cathepsins to the cytosol but inactivates them in transiently permeabilized lysosomes. Journal of Cell Science. 130 (18), 3124-3140 (2017).
- Griffiths, G., Hoflack, B., Simons, K., Mellman, I., Kornfeld, S. The mannose 6-phosphate receptor and the biogenesis of lysosomes. Cell. 52 (3), 329-341 (1988).
- Jia, J., et al. Galectin-3 Coordinates a cellular system for lysosomal repair and removal. Developmental Cell. 52 (1), 69-87 (2020).
- Chu, Y. P., Hung, Y. H., Chang, H. Y., Yang, W. Y. Assays to monitor lysophagy. Methods in Enzymology. 588, 231-244 (2017).
- Nguyen, L., Madsen, S. J., Berg, K., Hirschberg, H. An improved in vitro photochemical internalization protocol for 3D spheroid cultures. Lasers in Medical Science. 36 (8), 1567-1571 (2021).
- Daugelaviciene, N., et al. Lysosome-targeted photodynamic treatment induces primary keratinocyte differentiation. Journal of Photochemistry and Photobiology. B, Biology. 218, 112183 (2021).
- Hong, M. H., et al. Intracellular galectins control cellular responses commensurate with cell surface carbohydrate composition. Glycobiology. 30 (1), 49-57 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved