Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une approche photodynamique pour étudier la fonction de rupture des vésicules intracellulaires
Dans cet article
Résumé
L’inactivation laser assistée par chromophore (CALI) médiée par AlPcS2a est un outil puissant pour étudier les dommages spatio-temporels des vésicules intracellulaires (IV) dans les cellules vivantes.
Résumé
Les vésicules intracellulaires (IV) sont formées par endocytose des vésicules dans le cytoplasme. La formation IV est impliquée dans l’activation de diverses voies de signal par perméabilisation des membranes IV et la formation d’endosomes et de lysosomes. Une méthode appelée inactivation laser assistée par chromophore (CALI) est appliquée pour étudier la formation des IV et les matériaux dans le contrôle de la régulation IV. CALI est une méthodologie photodynamique basée sur l’imagerie pour étudier la voie de signalisation induite par la perméabilisation membranaire. La méthode permet de perméabiliser la manipulation spatio-temporelle de l’organite sélectionné dans une cellule. La méthode CALI a été appliquée pour observer et surveiller des molécules spécifiques par perméabilisation d’endosomes et de lysosomes. La rupture membranaire des IV est connue pour recruter sélectivement des protéines liant les glycanes, telles que la galectine-3. Ici, le protocole décrit l’induction de la rupture IV par AlPcS2a et l’utilisation de la galectine-3 comme marqueur pour marquer les lysosomes altérés, ce qui est utile pour étudier les effets en aval de la rupture de la membrane IV et leurs effets en aval dans diverses situations.
Introduction
Les endosomes, un type de vésicule intracellulaire (IV), sont formés par endocytose et mûrissent ensuite en lysosomes. Diverses voies de signal intracellulaires sont impliquées dans la formation des IV; De plus, différents stimuli intrinsèques et extrinsèques peuvent endommager les IV (p. ex., les agents pathogènes peuvent s’échapper de la membrane limitée pendant l’infection et entrer dans le cytoplasme1). Cela s’accompagne généralement de la rupture des vésicules endocytotiques2. Par conséquent, les techniques de ciblage et d’endommagement des IV peuvent être utilisées dans des études connexes3.
La thérapie photodynamique (PDT) est une thérapie dépendante de la lumière pour lutter contre les maladies en tuant les tumeurs ou les agents pathogènes4. Dans la PDT, les cellules ciblées sont marquées avec des chromophores non toxiques, appelés photosensibilisants, qui peuvent être activés localement par l’éclairage lumineux 5,6. Les photosensibilisateurs absorbent l’énergie de la lumière et se transforment en un état singulet excité, conduisant à l’état triplet excité à longue durée de vie. Les photosensibilisateurs de l’état triplet peuvent subir un transfert d’électrons ou d’énergie et former des espèces réactives de l’oxygène (ROS) en présence d’oxygène, et peuvent détruire spatialement les cellules marquées dans la région d’illumination7. La conséquence varie en fonction de la puissance de la lumière8. En contrôlant la concentration de photosensibilisateurs et l’intensité de l’éclairage lumineux, les biomolécules ciblées peuvent être sélectivement inactivées sans lyse cellulaire, appelée inactivation de la lumière assistée par chromophore (CALI)9. Avec le développement significatif de photosensibilisateurs capables de marquer sélectivement diverses cibles subcellulaires, CALI est devenu un outil précieux pour contrôler l’inactivation médiée par la lumière des biomolécules pour les petites biomolécules telles que les nucléotides et les protéines, ainsi que les organites tels que les mitochondries et les endo-lysosomes 3,10,11,12,13.
Par rapport à CALI, des méthodes chimiques ou physiques sont également utilisées pour altérer les membranes, telles que la toxine bactérienne 14,15 et le traitement Leu-Leu-OMe16 pour les lésions lysosomales. Cependant, ces méthodes présentent une altération massive des IV dans les cellules. Des photosensibilisateurs robustes (c.-à-d. l’acide disulfonique de chlorure de phtalocyanine Al(III) (AlPcS2a)) sont utilisés dans le CALI; AlPcS2a, ciblant les lysosomes par endocytose, est utilisé pour rompre des endosomes ou des lysosomes dans une région contrôlée17. AlPcS2a est un chromophore à base de phtalocyanine imperméable à la membrane cellulaire qui se lie aux lipides sur la membrane plasmique et est internalisé par endocytose et finit par s’accumuler dans le lysosome par la voie endocytaire18. Il absorbe la lumière dans une région spectrale proche infrarouge et génère de l’oxygène singulet, un ROS majeur généré par AlPcS2a18 excité. La désintégration de l’oxygène singulet limite rapidement sa diffusion et sa distance de réaction dans une minuscule région dans les cellules (environ 10-20 nm)19. En ajustant la durée d’incubation d’AlPcS2a et l’éclairage lumineux, le contrôle spatio-temporel des dommages des IV dans une zone subcellulaire est autorisé. CALI devient donc un outil puissant pour examiner les conséquences des dommages intraveineux, ainsi que la formation et la régulation des intraveineuses.
Dans cette étude, un protocole spécifique de CALI utilisant AlPcS2a comme photosensibilisateur est abordé. Ce protocole peut être appliqué à divers types d’intraveineuses, y compris les endosomes et les lysosomes, et utilisé pour examiner les réponses de suivi après la rupture de la membrane. Des cellules HeLa exprimant la galectine-3 conjuguée fluorophore-316,20 révélée après rupture du lysosome sont utilisées pour démontrer ce protocole.
Protocole
1. Préparation du stock AlPcS2a
- Dissoudre 10 mg d’AlPcS2a dans 400 μL de NaOH 0,1 M. Pour améliorer la solubilité, chauffer la solution à 50 °C et vortex.
- Mélanger la solution avec 4 mL de solution saline tamponnée au phosphate (PBS). Ensuite, filtrer la solution avec un filtre de 0,22 μm pour éliminer les précipités insolubles.
- Mesurer la concentration de la solution à l’aide d’un spectrophotomètre UV-Vis. Le coefficient d’extinction de AlPcS2a à 672 nm est de 4 x 104 cm-1 M-1. Diluer la solution AlPcS2a avec du PBS pour obtenir une solution de 1 mM. Préparer 1 mL d’aliquotes et conserver à -20 °C.
2. Transfection
NOTE: Gal3-GFP est appliqué comme indicateur pour l’imagerie de cellules vivantes de la rupture lysosomale.
- Maintenir la culture cellulaire HeLa dans du DMEM complété par 10% de sérum fœtal bovin (FBS). Après avoir lavé les cellules avec du PBS, trypsiniser les cellules, puis remettre en suspension les cellules dans du DMEM complété par 10% de FBS.
REMARQUE: La méthode est applicable à la plupart des lignées cellulaires attachées, y compris les lignées cellulaires HeLa et A549. En principe, bien qu’ils n’aient pas testé de cellules en suspension, des tests CALI pourraient être effectués avec celles-ci. - Diluer 300 ng de plasmide Gal3-GFP dans 25 μL de milieu sérique réduit, puis ajouter 0,6 μL de réactif P3000. Mélanger délicatement. Diluer 0,45 μL de réactif Lipofectamine 3000 dans 25 μL de milieu sérique réduit. Mélanger délicatement.
- Incuber pendant 5 min à température ambiante. Mélanger l’ADN dilué et la lipofectamine 3000 diluée, puis incuber pendant 10 min à température ambiante.
- Mélanger le mélange ADN-lipofectamine, 3 x 105 cellules HeLa en suspension et 200 μL de DMEM + 10% FBS, puis ensemencer les cellules sur la région vitrée centrale d’un plat bouton en verre de 35 mm.
3. Coloration AlPcS2a
- Pour permettre la fixation des cellules, incuber les cellules à 37 °C dans l’incubateur alimenté avec 5% de CO2 pendant au moins 4 h.
- Diluer AlPcS 2a dans du DMEM complété avec 10% de FBS pour obtenir une solution d’AlPcS2a de 1 μM. Préchauffer le milieu contenant de l’AlPcS2a dans un bain-marie à 37 °C. Remplacez le milieu de culture par le milieu contenant de l’AlPcS2a.
- Incuber les cellules à 37 °C dans l’incubateur alimenté avec 5% de CO2 pendant une nuit (16-18 h).
- Le lendemain, lavez les cellules deux fois avec du PBS pour éliminer l’AlPcS2a extracellulaire. Remplacer le milieu par un milieu frais, puis incuber à 37 °C pendant 4 h pour permettre au colorant résiduel le long de la voie endocytaire de s’accumuler en lysosomes.
NOTE: Pour colorer les endosomes, incuber des cellules dans 1 μM AlPcS2a dans DMEM contenant 10% FBS pendant 15 min à 37 °C. Ensuite, lavez les cellules deux fois avec du PBS et incuberez-les dans un milieu préchauffé avant l’imagerie.
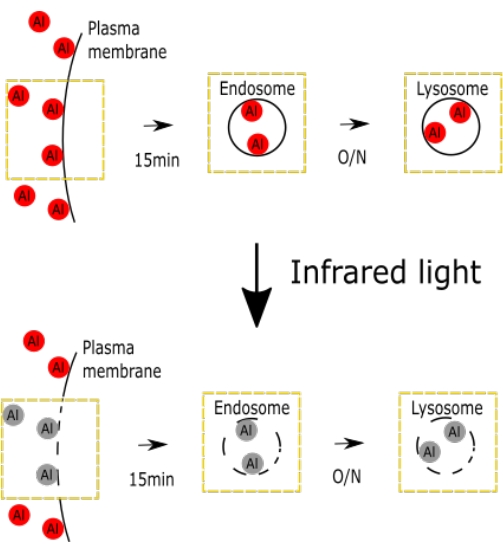
Graphique 1. Figure schématique représentant les dommages IV sélectifs avec AlPcS2a. La figure montre les schémas des dommages intraveineux sélectifs. Veuillez cliquer ici pour voir une version agrandie de cette figure.
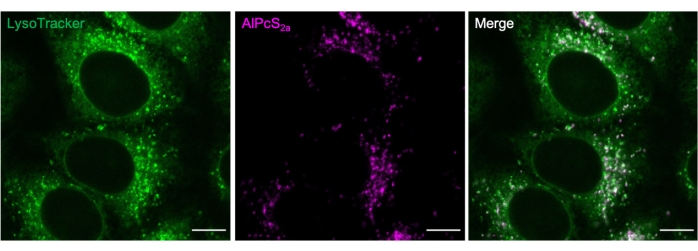
Graphique 2. Coloration lysosomale avec AlPcS2a. Les lysosomes marqués pendant la nuit avec 1 μM AlPcS2a dans les cellules HeLa sont colorés positivement avec un colorant fluorescent vert de 50 nM. Barre d’échelle: 10 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Imagerie des échantillons et éclairage lumineux
REMARQUE: Des dommages IV dans une région sous-cellulaire d’une seule cellule ou de toutes les cellules marquées AlPcS2a dans une boîte de culture peuvent être effectués. L’éclairage en vrac de l’ensemble de la boîte de culture permet une étude quantitative de ces dommages, y compris des études biochimiques.
- Manipuler des cellules individuelles en endommageant les lysosomes dans une seule cellule, comme décrit ci-dessous.
- Placez la capsule de culture sur la scène d’un microscope confocal. Utilisez les lasers 488 nm et 561 nm pour exciter GFP et AlPcS2a, respectivement.
- Encerclez une région d’intérêt (ROI) de 5 x 5 μm2 sur les vésicules marquées AlPcS2a qui sont sélectionnées pour être endommagées.
- Pulse illumine le ROI avec un laser 633 nm de 0,21 mW pour 70 répétitions. Surveiller la formation de Gal3 puncta comme indicateur de perméabilisation de la membrane lysosomale.
- Endommagez toutes les cellules marquées dans une boîte de culture comme décrit ci-dessous.
- Placez le plat de culture sur une plate-forme. Illuminer la parabole avec 660 nm de lumière LED collimatée (la lumière proche infrarouge est une base idéale sur le spectre d’excitation d’AlPcS2a).
- Placer la capsule de culture sur le microscope et surveiller les indicateurs de perméabilisation membranaire comme mentionné à l’étape 4.1.3.
- Évaluer les blessures des intraveineuses à l’aide des indicateurs suivants.
- Le contenu de l’endosome ou du lysosome est le plus fortement glycosylé, qui est exposé au cytosol lors de la rupture IV. Marquez-les rapidement à l’aide de galectines cytosoliques liant le glycane, y compris la galectine-1, la galectine-3, la galectine-8 et la galectine-916,20.
- La taille de la plaie peut être déterminée par la libération d’un colorant imperméable à la membrane comme décrit en21.
- La différence entre les endosomes et les lysosomes réside dans leur pH luminal. La rupture lysosomale perturbe le pH luminal, qui peut être mesuré à l’aide d’un colorant sensible au pH, tel que FITC-dextran3.
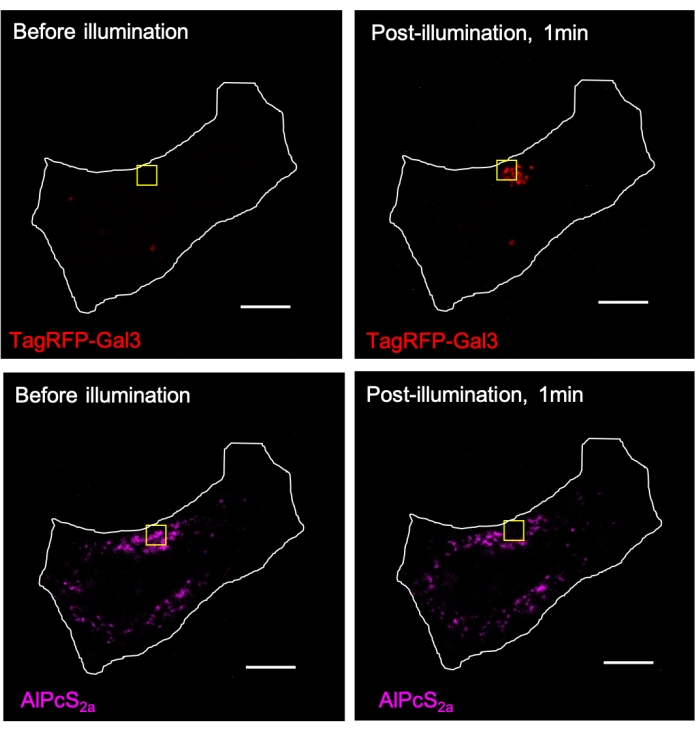
Graphique 3. Le CALI médié par AlPcS2a induit le recrutement local de TagRFP-galectin-3 (Gal3) dans les lysosomes dans la région d’illumination. Les lysosomes dans les cellules HeLa exprimées en TagRFP-galectine-3 ont été colorés pendant la nuit avec 1 μM AlPcS2a, suivis d’une illumination de focalisation avec une lumière proche infrarouge (633 nm) dans le carré jaune. Le signal AlPcS2a dans le carré jaune est photoblanchi, accompagné de la formation de TagRFP-galectin-3 puncta. Barre d’échelle: 10 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Une figure schématique représentant les dommages intraveineux induits par AlPcS2a, y compris l’endosome et le lysosome, a été montrée (Figure 1).
Des marqueurs disponibles dans le commerce peuvent être utilisés pour déterminer les conditions de coloration AlPcS2a . Par exemple, AlPcS 2apuncta et colorant fluorescent vert22 colocalisation (Figure 2).
Discussion
AlPcS2a se lie à la membrane plasmique, puis est internalisé par endocytose et finit par s’accumuler dans les lysosomes. AlPcS2a peut ainsi être localisé dans les compartiments subcellulaires en ajustant la durée d’incubation. Une limite de cette méthodologie est que seule une sous-population d’IV pourrait être marquée par AlPcS2a par endocytose, car il existe de nombreuses autres sources membranaires d’IV, telles que les appareils ER et Golgi. En outre, le marquage sélec...
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Les auteurs souhaitent remercier l’Academia Sinica Inflammation Core Facility, IBMS pour son soutien à la recherche. L’installation de base est financée par le projet d’instrument de base et d’instrument novateur de l’Academia Sinica (AS-CFII-111-213). Les auteurs remercient l’installation de base d’équipement commun de l’Institut des sciences biomédicales (IBMS), Academia Sinica (AS) pour avoir aidé à l’acquisition d’images.
matériels
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Al(III) Phthalocyanine Chloride Disulfonic acid (AlPcS2a) | Frontier Scientific | P40632 | |
| Culture dish | ibidi | 812128-200 | |
| Culture Medium | DMEM supplemented with 10% FBS and 100 U/mL penicillin G and 100 mg/mL Streptomycin | ||
| DMEM | Gibco | 11965092 | |
| FBS | Thermo Fisher Scientific | A4736301 | |
| Gal3-GFP plasmid | addgene | ||
| Lipofectamine 3000 kit | Thermo Fisher Scientific | L3000008 | |
| LysoTracker Green DND-26 | Thermo Fisher Scientific | L7526 | green fluorescent dye |
| Multiwall plate | perkinelmer | PK-6005550 | |
| NaOH | Thermo Fisher Scientific | Q15895 | |
| OptiMEM | Thermo Fisher Scientific | 31985070 | |
| Penicillin-streptomycin | Gibco | 15140163 | |
| Phosphate-Buffered Saline (PBS) | Gibco | 21600-069 | 137 mM NaCl, 2.7 mM KCl, 10mM Na2HPO4, 1.8 mM KH2PO4 |
| Cell line | |||
| HeLa Cell Line | ATCC | CCL-2 | The methods are applicable for most of the attached cell lines. Conditions must be determined individually. |
| Equipments | |||
| 0.22 µm Filter | Merck | SLGV013SL | |
| Collimated LED Light (660nm) | Thorlabs | M660L3-C1 and DC2100 | Near-infared light is ideal base on the excitation spectrum of AlPcS2a. |
| Confocal microscopy | Carl Zeiss | LSM 780 | An incubation system is required for long-term imaging. |
| NanoDrop 2000/2000c Spectrophotometers | Thermo Fisher Scientific | ||
| Red LED light | Tholabs | M660L4-C1 |
Références
- Cossart, P., Helenius, A. Endocytosis of viruses and bacteria. Cold Spring Harbor Perspectives in Biology. 6 (8), 016972 (2014).
- Daussy, C. F., Wodrich, H. 34;Repair me if you can": membrane damage, response, and control from the viral perspective. Cells. 9 (9), 2042 (2020).
- Hung, Y. H., Chen, L. M., Yang, J. Y., Yang, W. Y. Spatiotemporally controlled induction of autophagy-mediated lysosome turnover. Nature Communications. 4, 2111 (2013).
- Sharma, S. K., et al. Photodynamic therapy for cancer and for infections: what is the difference. Israel Journal of Chemistry. 52 (8-9), 691-705 (2012).
- Kübler, A. C. Photodynamic therapy. Medical Laser Application. 20 (1), 37-45 (2005).
- De Rosa, F. S., Bentley, M. V. Photodynamic therapy of skin cancers: sensitizers, clinical studies and future directives. Pharmaceutical Research. 17 (12), 1447-1455 (2000).
- Hamblin, M. R. New photosensitizers for photodynamic therapy. Biochemical Journal. 473 (4), 347-364 (2016).
- Lavie, G., et al. A photodynamic pathway to apoptosis and necrosis induced by dimethyl tetrahydroxyhelianthrone and hypericin in leukaemic cells: possible relevance to photodynamic therapy. British Journal of Cancer. 79 (3-4), 423-432 (1999).
- Jay, D. G. Selective destruction of protein function by chromophore-assisted laser inactivation. Proceedings of the National Academy of Sciences. 85 (15), 5454-5458 (1988).
- Grate, D., Wilson, C. Laser-mediated, site-specific inactivation of RNA transcripts. Proceedings of the National Academy of Sciences. 96 (11), 6131-6136 (1999).
- Lin, J. Y., et al. Optogenetic inhibition of synaptic release with chromophore-assisted light inactivation (CALI). Neuron. 79 (2), 241-253 (2013).
- Hsieh, C. W., Yang, W. Y. Triggering mitophagy with photosensitizers. Methods in Molecular Biology. 1880, 611-619 (2019).
- Yang, J. Y., Yang, W. Y. Spatiotemporally controlled initiation of Parkin-mediated mitophagy within single cells. Autophagy. 7 (10), 1230-1238 (2011).
- Molinari, M., et al. Vacuoles induced by Helicobacter pylori toxin contain both late endosomal and lysosomal markers. Journal of Biological Chemistry. 272 (40), 25339-25344 (1997).
- Prince, L. R., et al. Subversion of a lysosomal pathway regulating neutrophil apoptosis by a major bacterial toxin, pyocyanin. Journal of Immunology. 180 (5), 3502-3511 (2008).
- Aits, S., et al. Sensitive detection of lysosomal membrane permeabilization by lysosomal galectin puncta assay. Autophagy. 11 (8), 1408-1424 (2015).
- Prasmickaite, L., Hogset, A., Berg, K. Evaluation of different photosensitizers for use in photochemical gene transfection. Photochemistry and Photobiology. 73 (4), 388-395 (2001).
- Berg, K., et al. Photochemical internalization: a novel technology for delivery of macromolecules into cytosol. Cancer Research. 59 (6), 1180-1183 (1999).
- Moan, J., Berg, K. The photodegradation of porphyrins in cells can be used to estimate the lifetime of singlet oxygen. Photochemistry and Photobiology. 53 (4), 549-553 (1991).
- Thurston, T. L., Wandel, M. P., von Muhlinen, N., Foeglein, A., Randow, F. Galectin 8 targets damaged vesicles for autophagy to defend cells against bacterial invasion. Nature. 482 (7385), 414-418 (2012).
- Repnik, U., et al. L-leucyl-L-leucine methyl ester does not release cysteine cathepsins to the cytosol but inactivates them in transiently permeabilized lysosomes. Journal of Cell Science. 130 (18), 3124-3140 (2017).
- Griffiths, G., Hoflack, B., Simons, K., Mellman, I., Kornfeld, S. The mannose 6-phosphate receptor and the biogenesis of lysosomes. Cell. 52 (3), 329-341 (1988).
- Jia, J., et al. Galectin-3 Coordinates a cellular system for lysosomal repair and removal. Developmental Cell. 52 (1), 69-87 (2020).
- Chu, Y. P., Hung, Y. H., Chang, H. Y., Yang, W. Y. Assays to monitor lysophagy. Methods in Enzymology. 588, 231-244 (2017).
- Nguyen, L., Madsen, S. J., Berg, K., Hirschberg, H. An improved in vitro photochemical internalization protocol for 3D spheroid cultures. Lasers in Medical Science. 36 (8), 1567-1571 (2021).
- Daugelaviciene, N., et al. Lysosome-targeted photodynamic treatment induces primary keratinocyte differentiation. Journal of Photochemistry and Photobiology. B, Biology. 218, 112183 (2021).
- Hong, M. H., et al. Intracellular galectins control cellular responses commensurate with cell surface carbohydrate composition. Glycobiology. 30 (1), 49-57 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon