Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Фотодинамический подход к изучению функции разрыва внутриклеточных везикул
В этой статье
Резюме
AlPcS-2a-опосредованная хромофорная лазерная инактивация (CALI) является мощным инструментом для изучения пространственно-временного повреждения внутриклеточных везикул (IV) в живых клетках.
Аннотация
Внутриклеточные везикулы (IV) образуются в результате эндоцитоза везикул в цитоплазму. Внутривенное образование участвует в активации различных сигнальных путей посредством пермеабилизации внутривенных мембран и образования эндосом и лизосом. Метод, называемый хромофорно-ассистированной лазерной инактивацией (CALI), применяется для изучения образования внутривенных вливаний и материалов, контролирующих внутривенную регуляцию. CALI - это фотодинамическая методология на основе визуализации для изучения сигнального пути, вызванного проникновением мембраны. Метод позволяет пространственно-временные манипуляции с выбранной органеллой проникать в клетку. Метод CALI был применен для наблюдения и мониторинга конкретных молекул путем проникновения эндосом и лизосом. Известно, что разрыв мембраны внутривенных вливаний селективно рекрутирует гликан-связывающие белки, такие как галектин-3. Здесь протокол описывает индукцию внутривенного разрыва AlPcS2a и использование галектина-3 в качестве маркера для маркировки нарушенных лизосом, что полезно при изучении нисходящих эффектов разрыва мембраны IV и их последующих эффектов в различных ситуациях.
Введение
Эндосомы, тип внутриклеточных везикул (IV), образуются в результате эндоцитоза, а затем созревают в лизосомы. В образовании ВВ участвуют различные внутриклеточные сигнальные пути; кроме того, различные внутренние и внешние стимулы могут повредить внутривенные вливания (например, патогены могут вырваться из ограниченной мембраны во время инфекции и проникнуть в цитоплазму1). Обычно это сопровождается разрывом эндоцитотических везикул2. Таким образом, методы нацеливания и повреждения капельниц могут быть использованы в соответствующих исследованиях3.
Фотодинамическая терапия (ФДТ) - это светозависимая терапия для борьбы с заболеваниями путем уничтожения опухолей или патогенов4. При ФДТ клетки-мишени помечаются нетоксичными хромофорами, называемыми фотосенсибилизаторами, которые могут быть локально активированы световым освещением 5,6. Фотосенсибилизаторы поглощают энергию света и трансформируются в возбужденное синглетное состояние, что приводит к долгоживущему возбужденному триплетному состоянию. Фотосенсибилизаторы триплетного состояния могут подвергаться электронному или энергетическому переносу и образовывать активные формы кислорода (АФК) в присутствии кислорода и могут пространственно разрушать меченые клетки в областиосвещения 7. Последствия варьируются в зависимости от мощности света8. Контролируя концентрацию фотосенсибилизаторов и интенсивность светового освещения, целевые биомолекулы могут быть селективно инактивированы без лизиса клеток, называемого хромофорной инактивацией света (CALI)9. Благодаря значительному развитию фотосенсибилизаторов, которые могут избирательно маркировать различные субклеточные мишени, CALI стал ценным инструментом для контроля светоопосредованной инактивации биомолекул для небольших биомолекул, таких как нуклеотиды и белки, а также органелл, таких как митохондрии и эндолизосомы 3,10,11,12,13.
По сравнению с CALI, химические или физические методы также используются для повреждения мембран, такие как бактериальный токсин 14,15 и лечение лизосомального повреждения Leu-Leu-OMe16. Однако эти методы показывают объемное нарушение внутривенных вливаний в клетках. Надежные фотосенсибилизаторы (т.е. Al(III)фталоцианинхлориддисульфоновая кислота (AlPcS2a)) используются в CALI; AlPcS2a, воздействуя на лизосомы посредством эндоцитоза, используется для разрыва эндосом или лизосом в контролируемой области17. AlPcS2a представляет собой непроницаемый для клеточной мембраны хромофор на основе фталоцианина, который связывается с липидом на плазматической мембране и интернализуется посредством эндоцитоза и в конечном итоге накапливается в лизосоме через эндоцитарный путь18. Он поглощает свет в ближней инфракрасной области спектра и генерирует синглетный кислород, основной АФК, генерируемый возбужденным AlPcS2a18. Распад синглетного кислорода быстро ограничивает его диффузию и расстояние реакции в крошечной области в клетках (примерно 10-20 нм)19. Регулируя продолжительность инкубации AlPcS2a и световое освещение, допускается пространственно-временной контроль повреждения внутривенных вливаний в субклеточной области. Таким образом, CALI становится мощным инструментом для изучения последствий повреждения внутривенного вливания, а также формирования и регулирования внутривенных вливаний.
В этом исследовании рассматривается конкретный протокол CALI с использованием AlPcS2a в качестве фотосенсибилизатора. Этот протокол может применяться к различным типам внутривенных вливаний, включая эндосомы и лизосомы, и использоваться для изучения последующих реакций после разрыва мембраны. Для демонстрации этого протокола используются клетки HeLa, экспрессирующие флуорофор-конъюгированный галектин-316,20, выявленные после разрыва лизосомы.
протокол
1. Подготовка материала AlPcS2a
- Растворите 10 мг AlPcS2a в 400 мкл 0,1 М NaOH. Для улучшения растворимости нагрейте раствор до 50 °C и встряхните.
- Смешайте раствор с 4 мл фосфатно-буферного физиологического раствора (PBS). Затем отфильтруйте раствор фильтром 0,22 мкм, чтобы удалить нерастворимые осадки.
- Измерьте концентрацию раствора с помощью УФ-ВИД спектрофотометра. Коэффициент экстинкции AlPcS2a на длине волны 672 нм равен 4 x 104 см-1 М-1. Разбавьте раствор AlPcS2a PBS, чтобы получить раствор 1 мМ. Сделайте 1 мл аликвот и храните при -20 ° C.
2. Трансфекция
ПРИМЕЧАНИЕ: Gal3-GFP применяется в качестве индикатора для визуализации лизосомального разрыва живых клеток.
- Поддерживайте культуру клеток HeLa в DMEM с добавлением 10% фетальной бычьей сыворотки (FBS). После промывки клеток PBS трипсинизируют клетки, затем ресуспендируют клетки в DMEM с добавлением 10% FBS.
ПРИМЕЧАНИЕ: Метод применим для большинства прикрепленных клеточных линий, включая клеточные линии HeLa и A549. В принципе, несмотря на то, что суспензионные ячейки не тестируются, с ними можно проводить анализы CALI. - Разведите 300 нг плазмиды Gal3-GFP в 25 мкл восстановленной сывороточной среды, а затем добавьте 0,6 мкл реагента P3000. Аккуратно перемешайте. Разбавьте 0,45 мкл реагента Lipofectamine 3000 в 25 мкл восстановленной сывороточной среды. Аккуратно перемешайте.
- Инкубировать 5 минут при комнатной температуре. Смешайте разбавленную ДНК и разбавленный Lipofectamine 3000, а затем инкубируйте в течение 10 мин при комнатной температуре.
- Смешайте смесь ДНК и липофектамина, 3 x 105 суспендированных клеток HeLa и 200 мкл DMEM + 10% FBS, а затем засейте клетки в центральную стеклянную область стеклянной чашки 35 мм.
3. Окрашивание AlPcS2a
- Чтобы обеспечить прикрепление клеток, инкубируйте клетки при 37 ° C в инкубаторе, снабженном 5% CO2, в течение не менее 4 часов.
- Разбавьте AlPcS 2a в DMEM с добавлением 10% FBS, чтобы получить раствор AlPcS2a размером 1 мкМ. Предварительно подогрейте среду, содержащую AlPcS2a, на водяной бане с температурой 37 °C. Замените питательную среду средой, содержащей AlPcS2a.
- Инкубируйте клетки при температуре 37 °C в инкубаторе, снабженном 5% CO2 , в течение ночи (16-18 часов).
- На следующий день дважды промойте клетки PBS, чтобы удалить внеклеточный AlPcS2a. Замените среду свежей средой, а затем инкубируйте при 37 ° C в течение 4 часов, чтобы остаточный краситель вдоль эндоцитарного пути накапливался в лизосомах.
ПРИМЕЧАНИЕ: Для окрашивания эндосом инкубируйте клетки в 1 мкМ AlPcS2a в DMEM, содержащем 10% FBS, в течение 15 мин при 37 °C. Затем дважды промойте клетки PBS и инкубируйте их в предварительно подогретой среде перед визуализацией.
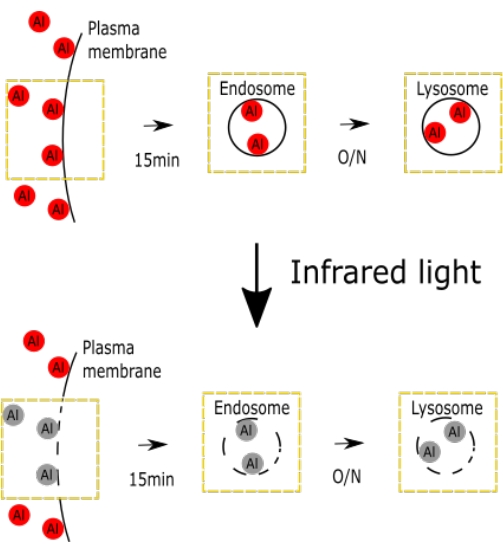
Рисунок 1. Схематичный рисунок, представляющий селективное внутривенное повреждение AlPcS2a. На рисунке представлены схемы селективного внутривенного повреждения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
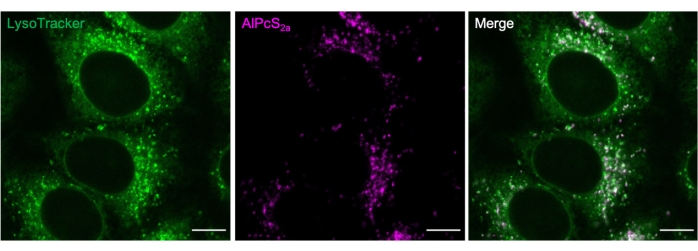
Рисунок 2. Лизосомальное окрашивание AlPcS2a. Лизосомы, меченные в течение ночи 1 мкМ AlPcS2a в клетках HeLa, положительно окрашиваются зеленым флуоресцентным красителем 50 нМ. Масштабная линейка: 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Визуализация образца и световое освещение
ПРИМЕЧАНИЕ: Может быть выполнено внутривенное повреждение в субклеточной области одной клетки или всех клеток, меченных AlPcS2a, в чашке для культивирования. Объемное освещение всей чашки культуры позволяет количественно изучить это повреждение, в том числе биохимические.
- Манипулируйте отдельными клетками, повреждая лизосомы внутри одной клетки, как описано ниже.
- Поместите чашку с культурой на столик конфокального микроскопа. Используйте лазеры с длиной волны 488 нм и 561 нм для возбуждения GFP и AlPcS2a соответственно.
- Обведите область интереса (ROI) размером 5 x 5мкм2 на везикулах, меченных AlPcS2a, которые выбраны для повреждения.
- Pulse освещает ROI с помощью лазера с длиной волны 633 нм мощностью 0,21 мВт в течение 70 повторов. Следите за образованием Gal3 puncta как индикатора пермеабилизации лизосомальной мембраны.
- Повредите все меченые клетки в чашке для культивирования, как описано ниже.
- Поставьте культурное блюдо на платформу. Осветите тарелку коллимированным светодиодным светом с длиной волны 660 нм (ближний инфракрасный свет идеально подходит для спектра возбуждения AlPcS2a).
- Поместите чашку для культивирования на микроскоп и следите за показателями проницаемости мембраны, как указано в шаге 4.1.3.
- Оцените травму от капельниц, используя следующие показатели.
- Содержимое эндосомы или лизосомы наиболее сильно гликозилировано, которое подвергается воздействию цитозоля при внутривенном разрыве. Быстро маркируйте их с помощью цитозольных гликан-связывающих галектинов, включая галектин-1, галектин-3, галектин-8 и галектин-916,20.
- Размер раны можно определить по высвобождению мембранно-непроницаемого красителя, как описано в21.
- Разница между эндосомами и лизосомами заключается в значении рН их просвета. Лизосомальный разрыв нарушает рН просвета, который можно измерить с помощью рН-чувствительного красителя, такого как FITC-декстран3.
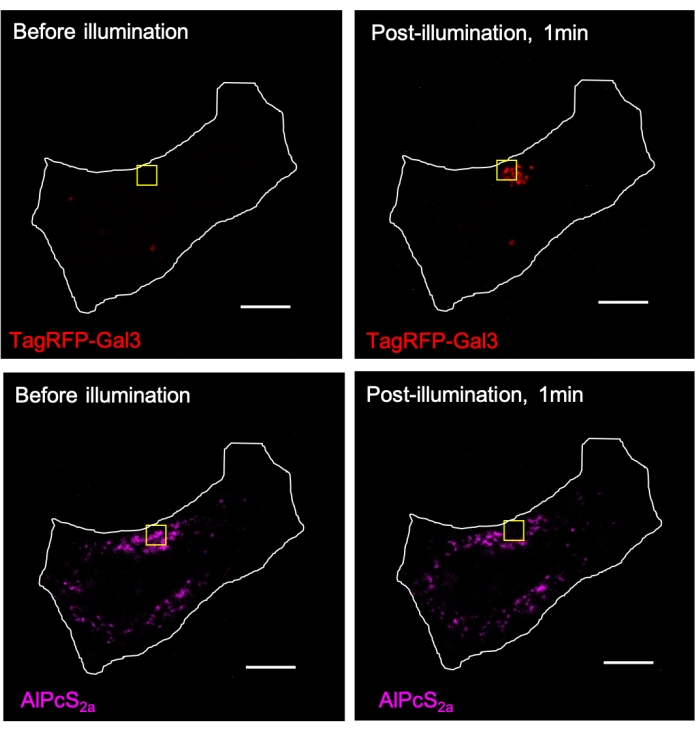
Рисунок 3. AlPcS 2a-опосредованный CALI индуцирует локальное рекрутирование TagRFP-галектина-3 (Gal3) в лизосомы в области освещения. Лизосомы в клетках HeLa, экспрессируемых TagRFP-галектин-3, окрашивали в течение ночи 1 мкМ AlPcS2a с последующей фокусировкой освещения ближним инфракрасным светом (633 нм) в пределах желтого квадрата. Сигнал AlPcS 2a в желтомквадрате фотообесцвечивается, что сопровождается образованием точки TagRFP-галектин-3. Масштабная линейка: 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
На рисунке показана схематическая фигура, представляющая индуцированное AlPcS2a повреждение внутривенного вливания, включая эндосомы и лизосому (рис. 1).
Коммерчески доступные маркеры могут быть использованы для определения условий окрашивания AlPcS...
Обсуждение
AlPcS2a связывается с плазматической мембраной, затем интернализуется эндоцитозом и в конечном итоге накапливается в лизосомах. Таким образом, AlPcS2a может быть локализован в субклеточных компартментах путем регулировки продолжительности инкубации. Ограничением этой методики...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Авторы хотели бы поблагодарить Academia Sinica Inflammation Core Facility, IBMS за поддержку исследований. Основной объект финансируется Проектом Academia Sinica Core Facility and Innovative Instrument (AS-CFII-111-213). Авторы благодарят Common Equipment Core Facility Института биомедицинских наук (IBMS), Academia Sinica (AS) за помощь в получении изображений.
Материалы
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Al(III) Phthalocyanine Chloride Disulfonic acid (AlPcS2a) | Frontier Scientific | P40632 | |
| Culture dish | ibidi | 812128-200 | |
| Culture Medium | DMEM supplemented with 10% FBS and 100 U/mL penicillin G and 100 mg/mL Streptomycin | ||
| DMEM | Gibco | 11965092 | |
| FBS | Thermo Fisher Scientific | A4736301 | |
| Gal3-GFP plasmid | addgene | ||
| Lipofectamine 3000 kit | Thermo Fisher Scientific | L3000008 | |
| LysoTracker Green DND-26 | Thermo Fisher Scientific | L7526 | green fluorescent dye |
| Multiwall plate | perkinelmer | PK-6005550 | |
| NaOH | Thermo Fisher Scientific | Q15895 | |
| OptiMEM | Thermo Fisher Scientific | 31985070 | |
| Penicillin-streptomycin | Gibco | 15140163 | |
| Phosphate-Buffered Saline (PBS) | Gibco | 21600-069 | 137 mM NaCl, 2.7 mM KCl, 10mM Na2HPO4, 1.8 mM KH2PO4 |
| Cell line | |||
| HeLa Cell Line | ATCC | CCL-2 | The methods are applicable for most of the attached cell lines. Conditions must be determined individually. |
| Equipments | |||
| 0.22 µm Filter | Merck | SLGV013SL | |
| Collimated LED Light (660nm) | Thorlabs | M660L3-C1 and DC2100 | Near-infared light is ideal base on the excitation spectrum of AlPcS2a. |
| Confocal microscopy | Carl Zeiss | LSM 780 | An incubation system is required for long-term imaging. |
| NanoDrop 2000/2000c Spectrophotometers | Thermo Fisher Scientific | ||
| Red LED light | Tholabs | M660L4-C1 |
Ссылки
- Cossart, P., Helenius, A. Endocytosis of viruses and bacteria. Cold Spring Harbor Perspectives in Biology. 6 (8), 016972 (2014).
- Daussy, C. F., Wodrich, H. 34;Repair me if you can": membrane damage, response, and control from the viral perspective. Cells. 9 (9), 2042 (2020).
- Hung, Y. H., Chen, L. M., Yang, J. Y., Yang, W. Y. Spatiotemporally controlled induction of autophagy-mediated lysosome turnover. Nature Communications. 4, 2111 (2013).
- Sharma, S. K., et al. Photodynamic therapy for cancer and for infections: what is the difference. Israel Journal of Chemistry. 52 (8-9), 691-705 (2012).
- Kübler, A. C. Photodynamic therapy. Medical Laser Application. 20 (1), 37-45 (2005).
- De Rosa, F. S., Bentley, M. V. Photodynamic therapy of skin cancers: sensitizers, clinical studies and future directives. Pharmaceutical Research. 17 (12), 1447-1455 (2000).
- Hamblin, M. R. New photosensitizers for photodynamic therapy. Biochemical Journal. 473 (4), 347-364 (2016).
- Lavie, G., et al. A photodynamic pathway to apoptosis and necrosis induced by dimethyl tetrahydroxyhelianthrone and hypericin in leukaemic cells: possible relevance to photodynamic therapy. British Journal of Cancer. 79 (3-4), 423-432 (1999).
- Jay, D. G. Selective destruction of protein function by chromophore-assisted laser inactivation. Proceedings of the National Academy of Sciences. 85 (15), 5454-5458 (1988).
- Grate, D., Wilson, C. Laser-mediated, site-specific inactivation of RNA transcripts. Proceedings of the National Academy of Sciences. 96 (11), 6131-6136 (1999).
- Lin, J. Y., et al. Optogenetic inhibition of synaptic release with chromophore-assisted light inactivation (CALI). Neuron. 79 (2), 241-253 (2013).
- Hsieh, C. W., Yang, W. Y. Triggering mitophagy with photosensitizers. Methods in Molecular Biology. 1880, 611-619 (2019).
- Yang, J. Y., Yang, W. Y. Spatiotemporally controlled initiation of Parkin-mediated mitophagy within single cells. Autophagy. 7 (10), 1230-1238 (2011).
- Molinari, M., et al. Vacuoles induced by Helicobacter pylori toxin contain both late endosomal and lysosomal markers. Journal of Biological Chemistry. 272 (40), 25339-25344 (1997).
- Prince, L. R., et al. Subversion of a lysosomal pathway regulating neutrophil apoptosis by a major bacterial toxin, pyocyanin. Journal of Immunology. 180 (5), 3502-3511 (2008).
- Aits, S., et al. Sensitive detection of lysosomal membrane permeabilization by lysosomal galectin puncta assay. Autophagy. 11 (8), 1408-1424 (2015).
- Prasmickaite, L., Hogset, A., Berg, K. Evaluation of different photosensitizers for use in photochemical gene transfection. Photochemistry and Photobiology. 73 (4), 388-395 (2001).
- Berg, K., et al. Photochemical internalization: a novel technology for delivery of macromolecules into cytosol. Cancer Research. 59 (6), 1180-1183 (1999).
- Moan, J., Berg, K. The photodegradation of porphyrins in cells can be used to estimate the lifetime of singlet oxygen. Photochemistry and Photobiology. 53 (4), 549-553 (1991).
- Thurston, T. L., Wandel, M. P., von Muhlinen, N., Foeglein, A., Randow, F. Galectin 8 targets damaged vesicles for autophagy to defend cells against bacterial invasion. Nature. 482 (7385), 414-418 (2012).
- Repnik, U., et al. L-leucyl-L-leucine methyl ester does not release cysteine cathepsins to the cytosol but inactivates them in transiently permeabilized lysosomes. Journal of Cell Science. 130 (18), 3124-3140 (2017).
- Griffiths, G., Hoflack, B., Simons, K., Mellman, I., Kornfeld, S. The mannose 6-phosphate receptor and the biogenesis of lysosomes. Cell. 52 (3), 329-341 (1988).
- Jia, J., et al. Galectin-3 Coordinates a cellular system for lysosomal repair and removal. Developmental Cell. 52 (1), 69-87 (2020).
- Chu, Y. P., Hung, Y. H., Chang, H. Y., Yang, W. Y. Assays to monitor lysophagy. Methods in Enzymology. 588, 231-244 (2017).
- Nguyen, L., Madsen, S. J., Berg, K., Hirschberg, H. An improved in vitro photochemical internalization protocol for 3D spheroid cultures. Lasers in Medical Science. 36 (8), 1567-1571 (2021).
- Daugelaviciene, N., et al. Lysosome-targeted photodynamic treatment induces primary keratinocyte differentiation. Journal of Photochemistry and Photobiology. B, Biology. 218, 112183 (2021).
- Hong, M. H., et al. Intracellular galectins control cellular responses commensurate with cell surface carbohydrate composition. Glycobiology. 30 (1), 49-57 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены