Method Article
قياس تصلب الكبد باستخدام مجهر القوة الذرية إلى جانب مجهر الاستقطاب
In This Article
Summary
نقدم بروتوكولا لقياس الوحدات المرنة للمناطق الغنية بالكولاجين في الكبد الطبيعي والمريض باستخدام مجهر القوة الذرية. يوفر الاستخدام المتزامن لمجهر الاستقطاب دقة مكانية عالية لتوطين المناطق الغنية بالكولاجين في أقسام الكبد.
Abstract
تم التعرف على تصلب المصفوفة كأحد الدوافع الرئيسية لتطور تليف الكبد. له تأثيرات عميقة على جوانب مختلفة من سلوك الخلية مثل وظيفة الخلية والتمايز والحركة. ومع ذلك ، نظرا لأن هذه العمليات ليست متجانسة في جميع أنحاء العضو بأكمله ، فقد أصبح من المهم بشكل متزايد فهم التغيرات في الخواص الميكانيكية للأنسجة على المستوى الخلوي.
لتكون قادرا على مراقبة تصلب المناطق الغنية بالكولاجين داخل فصوص الكبد ، تقدم هذه الورقة بروتوكولا لقياس وحدات مرونة أنسجة الكبد بدقة مكانية عالية بواسطة مجهر القوة الذرية (AFM). AFM هي طريقة حساسة مع إمكانية توصيف الخواص الميكانيكية المحلية ، محسوبة على أنها معامل يونغ (يشار إليه أيضا باسم المرن). يمكن استخدام AFM إلى جانب الفحص المجهري للاستقطاب لتحديد مناطق تطور التليف على وجه التحديد بناء على انكسار ألياف الكولاجين في الأنسجة. باستخدام البروتوكول المقدم ، قمنا بتمييز صلابة المناطق الغنية بالكولاجين من كبد الفئران الليفية والمناطق المقابلة في كبد الفئران الضابطة.
لوحظت زيادة ملحوظة في صلابة المناطق الإيجابية للكولاجين مع تطور التليف. يسمح البروتوكول المقدم بطريقة قابلة للتكرار بدرجة كبيرة لقياس AFM ، بسبب استخدام أنسجة الكبد الثابتة بشكل معتدل ، والتي يمكن استخدامها لزيادة فهم التغيرات التي يسببها المرض في الخواص الميكانيكية للأنسجة المحلية وتأثيرها على مصير الخلايا المجاورة.
Introduction
الكبد عضو حيوي للحفاظ على التوازن في الكائنات الحية 1,2. تمثل أمراض الكبد المزمنة ~ 2 مليون حالة وفاة في جميع أنحاء العالم سنويا3. تنشأ بشكل شائع مثل الالتهابات الفيروسية أو اضطرابات المناعة الذاتية أو متلازمات التمثيل الغذائي أو الأمراض المرتبطة بتعاطي الكحول ويرافقها تليف الكبد التدريجي. تثير إصابة الكبد استجابة التهابية ، مما يؤدي إلى تنشيط الخلايا التي ترسب مصفوفة خارج الخلية (ECM) في استجابة التئام الجروح. ومع ذلك ، في وجود إهانة مزمنة ، تشكل ECM الزائدة أنسجة ندبة لم يتم حلها داخل الكبد ، مما يؤدي إلى تطور تليف الكبد وتليف الكبد وسرطان الكبد ، وفي النهاية إلى فشل الكبد4.
تؤدي إصابة خلايا الكبد على الفور إلى زيادة تصلب الكبد 5,6. يؤثر هذا بشكل مباشر على وظيفة خلايا الكبد ، وينشط الخلايا النجمية الكبدية (HSCs) والخلايا الليفية البابية ، ويؤدي إلى تمايزها إلى الخلايا الليفية العضلية المودعة للكولاجين 7,8. يزيد ترسب ECM الليفي من تصلب الكبد ، مما يخلق حلقة تغذية مرتدة ذاتية التضخيم لتصلب الكبد وتنشيط الخلايا المنتجة للمصفوفة.
وبالتالي ، أصبح تصلب الكبد معلمة مهمة في تشخيص أمراض الكبد. يمكن اكتشاف التغير في خصائص الأنسجة الميكانيكية الحيوية في وقت أبكر من تشخيص التليف عن طريق التحليل النسيجي. لذلك ، تم تطوير تقنيات مختلفة لقياس تصلب الكبد في كل من التطبيقات البحثية والسريرية. في الإعدادات السريرية ، تم استخدام التصوير الإلستوجرافي العابر (TE) 9،10،11،12،13 والتصوير الإلستوجرافي بالرنين المغناطيسي (MRE)14،15،16،17،18 لتشخيص المراحل المبكرة من تلف الكبد بشكل غير جراحي من خلال فحص تصلب الكبد الإجمالي 19.
في TE ، يتم نشر الموجات فوق الصوتية ذات السعة الخفيفة والتردد المنخفض (50 هرتز) عبر الكبد ، ويتم قياس سرعتها ، والتي تستخدم بعد ذلك لحساب معامل مرونة الأنسجة13. ومع ذلك ، فإن هذه التقنية ليست مفيدة للمرضى الذين يعانون من الاستسقاء أو السمنة أو انخفاض المساحات الوربية بسبب الانتقال غير السليم للموجات فوق الصوتية عبر الأنسجة المحيطة بالكبد9.
يعتمد التصوير بالرنين المغناطيسي على طريقة التصوير بالرنين المغناطيسي ويستخدم موجات قص ميكانيكية 20-200 هرتز لاستهداف الكبد. ثم يتم استخدام تسلسل تصوير بالرنين المغناطيسي محدد لتتبع الموجات داخل الأنسجة وحساب تصلب الأنسجة16. ترتبط قيم الصلابة المبلغ عنها باستخدام كل من تقنيات TE و MRE بشكل جيد مع درجة تليف الكبد التي تم الحصول عليها من خزعات عينات الكبد البشرية المصنفة باستخدام درجات METAVIR النسيجية20 (الجدول 1). كما تم تكييف TE و MRE لقياس تصلب الكبد في نماذج القوارض لأغراض البحث21،22،23. ومع ذلك ، نظرا لأن كلتا الطريقتين تستمدان قيم الصلابة من استجابة الأنسجة لموجات القص المنتشرة ، فقد لا تعكس القيم التي تم الحصول عليها الصلابة الميكانيكية المطلقة للنسيج.
من أجل توصيف ميكانيكي مباشر لكبد القوارض ، طور بارنز وآخرون مقايسة نموذجية للأنسجة الهلامية (مقايسة MGT) تتضمن تضمين أنسجة الكبد في هلام بولي أكريلاميد24. يتم ضغط هذا الجل بواسطة قوة موحدة نابضة يمكن من خلالها حساب معامل يونغ. يظهر اختبار MGT ارتباطا جيدا مع مقايسة المسافة البادئة المكيفة لكل من الكبد الطبيعي والليفي24 (الجدول 1).
الجدول 1: قيم تصلب الكبد على المستوى السائب. TE و MRE مقارنة بالقياسات الميكانيكية المباشرة خارج الجسم الحي لوحدات مرونة الكبد باستخدام المسافة البادئة ومقايسات MGT للكبد من مصادر مختلفة. يتم إعطاء العلاقة بين E و G بواسطة E = 2G (1 + v) ، حيث v هي نسبة بواسون للعينة ؛ تمثل F0 إلى F4 درجة التليف في نظام تسجيل METAVIR ، حيث يشير F0 إلى تليف منخفض أو معدوم وكبد تليف الكبد التليف الكبدي F4. الاختصارات: TE = التصوير الإلستوجرافي العابر ؛ MRE = التصوير الإلستوجرافي بالرنين المغناطيسي ؛ MGT = نموذج هلام الأنسجة. E = معامل المرونة (يونغ) ؛ G = معامل القص. الرجاء الضغط هنا لتحميل هذا الجدول.
أحد العيوب الرئيسية لقياسات تصلب الكبد العامة هو أنها لا توفر دقة على المستوى الخلوي لعدم تجانس تصلب الكبد. أثناء تطور التليف ، تظهر المناطق الغنية بالكولاجين صلابة أعلى مقارنة بالحمة المحيطة25,26. يؤثر تدرج الصلابة هذا محليا على الخلايا المقيمة ويلعب دورا مهما في دفع عدم تجانس HSC27. وبالتالي ، يجب تمييز التغييرات في الخواص الميكانيكية المحلية أثناء تطور أمراض الكبد على المستوى المجهري لفهم تطور التليف بشكل أفضل.
يسمح AFM بقياس الخواص الميكانيكية للأنسجة بدقة عالية وحساسية عالية للقوة. يستخدم AFM طرف الكابولي لوضع مسافة بادئة لسطح العينة بقوى منخفضة تصل إلى عدة بيكونيوتون ، مما يؤدي إلى تشوه على المستوى المجهري أو النانوي بناء على هندسة وحجم الطرف المستخدم. ثم يتم قياس استجابة قوة العينة للإجهاد المطبق على أنه الانحراف في الكابولي28. يتم جمع منحنيات إزاحة القوة من نهج وتراجع الكابولي ، والتي يمكن تزويدها بنماذج ميكانيكا التلامس المناسبة لتقييم الصلابة المحلية للعينة29.
بالإضافة إلى قياس صلابة منطقة معينة ، يمكن ل AFM أيضا توفير معلومات طبوغرافية حول ميزات محددة في العينة ، مثل بنية ألياف الكولاجين30،31،32. وصفت دراسات متعددة تطبيق AFM لقياس صلابة الأنسجة السليمة والمريضة المختلفة ، مثل الجلد 32،33 ، الرئة 34،35 ، الدماغ 36 ، الثدييات37،38،39 ، الغضروف 40 ، أو القلب 41،42،43،44 من عينات نموذج المريض والفأر. علاوة على ذلك ، تم استخدام AFM أيضا في المختبر لتحديد صلابة الخلايا وسقالات البروتين خارج الخلية45،46،47.
قياس الخواص الميكانيكية للعينات البيولوجية باستخدام AFM غير تافه بسبب نعومتها وهشاشتها. وهكذا ، قامت دراسات مختلفة بتوحيد الظروف والإعدادات المختلفة ، والتي تسفر عن قيم متقلبة على نطاق واسع لوحدات يونغ (تمت مراجعتها بواسطة Mckee et al.48). على غرار الأنسجة الرخوة الأخرى ، تظهر قيم معامل الكبد يونغ عند درجات مختلفة من تليف الكبد أيضا تباينا كبيرا (الجدول 2). تنشأ الاختلافات في قيم معامل يونغ من الاختلافات في طريقة تشغيل AFM ، وطرف الكابولي ، وطريقة تحضير العينة ، وسمك العينة ، وعمق المسافة البادئة والقوى ، وبيئة أنسجة الكبد أثناء القياس ، وطريقة التحليل (الجدول 2).
الجدول 2: قيم تصلب الكبد على المستوى الخلوي. تصف قيم تصلب الكبد التي تم الحصول عليها باستخدام AFM الخواص الميكانيكية للكبد على المستوى الخلوي. الاختصارات: AFM = مجهر القوة الذرية ؛ E = معامل المرونة (يونغ) ؛ PFA = بارافورمالدهيد ؛ PBS = محلول ملحي مخزن بالفوسفات. الرجاء الضغط هنا لتحميل هذا الجدول.
تصف هذه الورقة بروتوكولا للقياس القابل للتكرار لوحدات يونغ للمناطق الليفية الغنية بالكولاجين في أنسجة الكبد بواسطة AFM مع توطين دقيق يوفره استخدام الفحص المجهري للاستقطاب. قمنا بإعطاء رابع كلوريد الكربون (CCl4) للحث على ترسب الكولاجين بطريقة فصية مركزية49 في نموذج فأر ، يحاكي بشكل موثوق الجوانب الحاسمة لتليف الكبد البشري50. تتيح الصور المجهرية المستقطبة تصور الكولاجين في الكبد بسبب انكسار ألياف الكولاجين51 ، مما يسمح بتحديد المواقع الدقيقة لطرف الكابولي فوق منطقة الاهتمام المرغوبة داخل الفصيص الكبدي52.
Protocol
تم إجراء جميع التجارب على الحيوانات وفقا لبروتوكول حيواني معتمد من قبل لجنة رعاية الحيوان التابعة لمعهد علم الوراثة الجزيئية ووفقا لتوجيه الاتحاد الأوروبي 2010/63 / EU للتجارب على الحيوانات. يظهر رسم تخطيطي شامل للبروتوكول المقدم في الشكل 1.
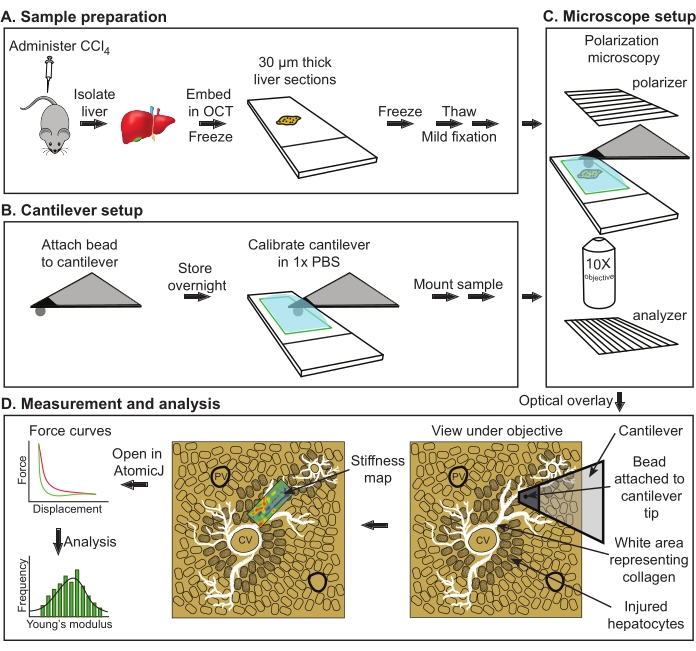
الشكل 1: التخطيطي العام لتقييم AFM لمعامل يونغ من كبد الفئران. (أ) عزل الكبد عن الفئران الضابطة أو المعالجة متبوعا بالتقسيم والتخزين عند -80 درجة مئوية (الحد الأقصى للتخزين ، 2 أسابيع). (ب) ربط الخرزة الكروية بالكابولي مع المعالجة اللاحقة للغراء طوال الليل (يسار). معايرة الكابولي متبوعة بتركيب العينة (يمين). (ج) محاذاة المستقطب والمحلل لتصور هياكل الكولاجين الساطعة متبوعة بتراكب للصورة في الكاميرا مع مجال القياس تحت الكابولي AFM. (د) اقتناء خرائط الصلابة وتحليلها. الاختصارات: AFM = مجهر القوة الذرية ؛ PBS = محلول ملحي مخزن بالفوسفات ؛ OCT = مركب درجة حرارة القطع الأمثل ؛ جL4 = رابع كلوريد الكربون. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
1. إعداد العينة I
- استئصال الكبد من البطن المفتوح للفأر القتل الرحيم عن طريق خلع عنق الرحم تحت التخدير. اعزل الفص الجانبي الأيسر وقم بتضمين النصف الجانبي من الفص في مركب درجة حرارة القطع المثلى (OCT) عن طريق التجميد السريع على الثلج الجاف. قم بتخزين الأنسجة المدمجة في OCT عند -80 درجة مئوية.
ملاحظة: أظهرت الدراسات السابقة أن قيم الصلابة متشابهة بين الأنسجة المجمدة والطازجة25,26. - قسم أقسام الكبد بسمك 30 ميكرومتر على شرائح موجبة الشحنة باستخدام cryotome وتخزين الشرائح في -80 °C حتى يوم قياس AFM لا يزيد عن 2 أسابيع وبالتالي.
2. إعداد الأداة
- ربط حبة 5.7 ميكرومتر بطرف ناتئ AFM (الشكل التكميلي S1 ، الخطوات 1-5)
ملاحظة: تم وصف ارتباط الخرزة بالكابولي سابقا بواسطة Norman et al.46.- انشر معلق حبات راتنج الميلامين بقطر 5.7 ميكرومتر بالتساوي على نصف مساحة الشريحة الزجاجية وجففها في الهواء لتبخير المذيب (الشكل التكميلي S1 ، الخطوة 1).
- في النصف الآخر من الشريحة ، باستخدام طرف 10 ميكرولتر ، قم بعمل خط رفيع من راتنجات الايبوكسي المخلوطة مسبقا مع وقت عمل طويل (الشكل التكميلي S1 ، الخطوة 1).
- قم بتحميل مسبار الكابولي على رأس AFM وفقا لتعليمات الشركة المصنعة.
- قم بتركيب الشريحة والغطاء برأس AFM المزود بمسبار الكابولي.
ملاحظة: تم استخدام ناتئ SD-qp-BioT-TL-10 في الدراسة. - أحضر غراء راتنجات الايبوكسي المخلوط مسبقا إلى مركز الشريحة واقترب من الغراء مع الكابولي بقوة منخفضة (اضبط نقطة ضبط على 1 فولت لاتباع هذا البروتوكول ؛ الشكل التكميلي S1، الخطوة 2).
ملاحظة: قبل الاقتراب من سطح الشريحة ، تأكد من محاذاة الليزر في مركز طرف الكابولي ، المشار إليه بجهد عالي المجموع باتباع الخطوات 6-8 في القسم 2 ، الجزء 3 ، معايرة ثابت الزنبرك لناتئ AFM. - بعد أن يتلامس طرف مسبار الكابولي مع الغراء ، حركه فوق الشريحة مباشرة لإزالة الغراء الزائد.
- الآن ، اسحب طرف الكابولي من الشريحة وحرك الشريحة لإحضار حبة واحدة في المنتصف (الشكل التكميلي S1 ، الخطوة 3). اقترب من الخرزة مرة أخرى باستخدام مسبار الكابولي AFM بقوة أعلى (نقطة الضبط 2 فولت) لربط الخرزة في وسط مسبار الكابولي واتركها لمدة 10 ثوان على الأقل (الشكل التكميلي S1 ، الخطوة 4).
- استخرج مسبار الكابولي واحتفظ به طوال الليل في درجة حرارة الغرفة لتصلب الغراء أو اتبع التعليمات الخاصة براتنجات الايبوكسي (الشكل التكميلي S1 ، الخطوة 5).
- إعداد المستقطب والمحلل
- لتحديد مجالات الاهتمام داخل أقسام الكبد ، قم بإعداد المجهر باستخدام المستقطب والمحلل. قم بمحاذاة سمت الاهتزاز بزاوية تتراوح بين 0 درجة و 90 درجة مع بعضها البعض عن طريق تدوير أحدهما فيما يتعلق بالآخر يدويا أو بطريقة آلية لتقليل الضوء المرسل وزيادة الأشعة غير العادية التي تمر عبر الهدف. تأكد من أن ألياف الكولاجين تظهر ساطعة على خلفية داكنة في الصورة المستقطبة (الشكل 2) ، والتي تنعكس من خلال التحول في ذروة الرسم البياني للصورة نحو وحدات البكسل الساطعة.

الشكل 2: تظهر صور الفحص المجهري التمثيلي تصورا واضحا لألياف الكولاجين في الفحص المجهري المستقطب مقارنة بصور برايتفيلد. خضعت أقسام الكبد من الفئران التي عولجت ب CCl4 لمدة 3 أسابيع ل (A) برايتفيلد و (B) الفحص المجهري المستقطب. تظهر ألياف الكولاجين ثنائية الانكسار بوضوح باللون الأبيض في الصور المستقطبة مقارنة بصور برايتفيلد. يمثل المربع الأحمر المنطقة الغنية بالكولاجين المستخدمة لقياس AFM. تعرض الأجزاء الداخلية طرق عرض مكبرة للمنطقة في المربع الأحمر. شريط المقياس = 100 ميكرومتر. الاختصارات: AFM = مجهر القوة الذرية ؛ CCl4 = رابع كلوريد الكربون ؛ السيرة الذاتية = الوريد المركزي ؛ PV = الوريد البابي. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
ملاحظة: بالنسبة لهذا البروتوكول ، يمكن تثبيت رأس AFM على أي مجهر مقلوب مناسب مع إمكانية إدخال مستقطب ومحلل. يجب وضع النظام في وحدة عزل لتقليل ضوضاء الخلفية.
- معايرة ثابت الربيع لناتئ AFM
- قم بتحميل مسبار الكابولي (المعد وفقا للخطوات 1-8 في القسم 2 ، الجزء 1 ، إرفاق حبة 5.7 ميكرومتر بطرف الكابولي AFM) برأس AFM وفقا لتعليمات الشركة المصنعة.
- نظف الكابولي بنسبة 70٪ إيثانول لمنع تلوث الكابولي أثناء القياس. اغسل على نطاق واسع بالماء المقطر لإزالة الإيثانول المتبقي من الحافة.
- قم بتمكين وضع الاتصال وحدد تعيين القوة كطريقة للقياس.
- افتح جميع النوافذ ذات الصلة (Z Stepper Motors ، التحكم في المرحلة الآلية ، عارض البيانات ، راسم الذبذبات لخريطة مسح القوة ، محاذاة الليزر ، ونافذة الكاميرا ) في علامات تبويب البرنامج بالنقر فوق الأزرار المقابلة.
- قم بتركيب شريحة زجاجية نظيفة تحتوي على 1.2 مل من محلول ملحي 1x مخزن بالفوسفات (PBS) في مساحة تبلغ حوالي 2 سم × 4 سم محددة بقلم تحديد كاره للماء. قم بتركيب رأس AFM على مرحلة المجهر وتأكد من أن الكابولي مغمور بالكامل في PBS.
- ركز الهدف على طرف الكابولي. قلل من شدة الضوء المرسل على المجهر للحصول على رؤية أفضل لموضع الليزر على الشاشة.
- استهدف الليزر إلى الطرف الشفاف للناتئ (الذي يتم إرفاق الخرزة الكروية تحته) وقم بمحاذاة المرآة باستخدام المقابض الموجودة على رأس AFM لزيادة الكثافة الإجمالية لشعاع الليزر على الكاشف (كما هو موضح بالمجموع في نافذة محاذاة الليزر ).
- قم بمحاذاة كاشف الثنائي الضوئي باستخدام المقابض الموجودة على رأس AFM لوضع الليزر في مركزه.
- دع الكابولي يستقر لمدة 15 دقيقة قبل الشروع في المعايرة.
- افتح مدير المعايرة وأدخل نوع الكابولي وأبعاد الكابولي والظروف البيئية. قم بمعايرة ثابت الزنبرك والحساسية (المعروف أيضا باسم حساسية الرافعة الضوئية العكسية ، InvOLS) بالنقر فوق معايرة. تأكد من دقة ثابت الزنبرك الذي تم الحصول عليه بعد المعايرة مع إعلان الشركة المصنعة. قم بمعايرة الكابولي في وضع خال من التلامس (يتم إجراء المعايرة بواسطة البرنامج باستخدام النظرية الحرارية المستمدة من Sader et al.58).
ملاحظة: يمثل ثابت الزنبرك للناتئ صلابة الكابولي ويعطى بقوة مقاومة الكابولي لأنه يتشوه حسب طول التشوه من حيث N / m. تصور حساسية الكابولي قيمة استجابة الصمام الثنائي الضوئي (بالفولت) استجابة لانحراف الكابولي (بالنانومتر) وعادة ما يتم تقديمها من حيث نانومتر / فولت59. في الوضع الخالي من التلامس ، يتم تسجيل طيف الضوضاء الحرارية وتزويده بالوظيفة الهيدروديناميكية60 بواسطة برنامج التحكم AFM تلقائيا بعد المعايرة. يوفر التركيب معلمات المعايرة ، وهي ثابت الزنبرك و InvOLS. كان ثابت الربيع للناتئ SD-qp-BioT-TL-10 المستخدم في هذه الدراسة 0.09 نيوتن / م ، كما أعلنت الشركة المصنعة.
3. إعداد العينة II
- قم بإذابة الأجزاء المجمدة (المخزنة عند -80 درجة مئوية ، كما هو موضح في القسم 1 ، تحضير العينة I) في درجة حرارة الغرفة لمدة 2 دقيقة.
- ثبت الأقسام باستخدام 4٪ بارافورمالدهيد (PFA) المثلج في 1x PBS لمدة 10 دقائق عند 4 درجات مئوية متبوعا بغسيل مكثف (5x) مع 1x PBS. امسح PBS المتبقي حول القسم بمنديل وحدد حدا يبلغ حوالي 2 سم × 4 سم حول قسم الكبد بقلم علامة كاره للماء. قم بتغطية العينة ب 1x PBS (تأكد من أن المنطقة المحددة تحتوي على ~ 1.2 مل من 1x PBS). استخدم العينة لقياسات AFM.
ملاحظة: نظرا لأن PFA مادة كيميائية خطرة ، فيجب التعامل معها بعناية لمنع ملامسة الجلد أو العينين. لتجنب أبخرتها السامة ، يجب تنفيذ جميع الإجراءات التي تنطوي على PFA في غطاء دخان كيميائي معتمد أو منطقة تهوية أخرى معتمدة.
4. القياس
- قم بتمكين الحفظ التلقائي بالانتقال إلى علامة التبويب " الإعداد" ووضع علامة على الحفظ التلقائي. حدد اسم الملف والدليل لحفظ ملفات القياس بالانتقال إلى علامة التبويب الإعداد ثم النقر فوق حفظ الإعدادات.
- قم بتحميل العينة (المعدة وفقا للقسم 3 ، تحضير العينة II). اقترب من سطح الأنسجة باستخدام ناتئ AFM عن طريق تشغيل الليزر والنقر فوق مفتاح النهج . بعد أن يكون الطرف ملامسا لسطح الأنسجة ، اسحب الطرف الكابولي بحيث يظل الطرف في بؤرة الهدف (بالنقر فوق مفتاح التراجع ، الذي يسحب الكابولي إلى الطرف العلوي من نطاق بيزو). أعد محاذاة الكاشف إذا تم تحريك موضع الليزر بعيدا عن مركزه في نافذة محاذاة الليزر .
- قم بإيقاف تشغيل الليزر وتراكب المجال البصري للمجهر باستخدام خرائط قياس AFM بالنقر فوق علامة التبويب الملحقات ثم تحديد المعايرة البصرية للتراكب المباشر. في النافذة التالية ، انقر فوق التالي لالتقاط سلسلة من الصور للناتئ الذي يقوم بمسح منطقة معينة. انقر فوق التالي مرة أخرى للانتقال إلى النافذة التالية.
- في الصورة الأولى ، انقر فوق وسط طرف الكابولي يدويا لتصوير موضع الطرف في البرنامج. يمكن التلاعب بحجم الدائرة التي تصور موضع الطرف من خلال الإشارة إلى نصف قطرها لزيادة الدقة. انقر فوق معايرة لاكتشاف موضع طرف الكابولي تلقائيا في كل الصور. تأكد من دقة اكتشاف التلميح من خلال تصفح الصور.
- انقر فوق التالي ثم فوق إنهاء لإنهاء التراكب البصري وحفظ سلسلة الصور الملتقطة أثناء المعايرة البصرية.
- اسحب الكابولي أكثر لتجنب اصطدامه بالأسطح الأعلى على الشريحة. حرك المسرح لوضع منطقة غنية بالكولاجين داخل المربع الأخضر المرئي في علامة التبويب عارض البيانات باستخدام الصورة المستقطبة. حدد المنطقة الغنية بالكولاجين عن طريق عمل مستطيل حولها باستخدام الضغط لفترة طويلة على زر الماوس الأيسر داخل المربع الأخضر المحدد. حدد أبعاد المنطقة المحددة واتجاهها ودقتها ضمن علامة التبويب الشبكة على الجانب الأيمن. انقر فوق تأكيد منطقة المسح الجديدة لتعيين المنطقة المحددة كمنطقة قياس.
- احتفظ بمعلمات IGain و PGain لحلقة التغذية الراجعة عند القيم الافتراضية ، إذا لم يتم تقديم حالات عدم استقرار كبيرة في شكل حساسية مفرطة للنظام. لاتباع هذا البروتوكول ، اضبط IGain على 50 هرتز و PGain على 0.001.
- اضبط نقطة الضبط على 1 nN.
ملاحظة: نقطة الضبط هي قوة التفاعل بين الطرف والسطح أثناء الحالة الثابتة. بالنسبة لمعظم العينات اللينة (الخلايا والمواد الهلامية والأنسجة) ، تكون قيم نقطة الضبط في حدود 0.5-2.0 nN مناسبة. - حدد قيمة نقطة الضبط النسبية وفقا للخصائص الميكانيكية للمادة المدروسة وصلابة الكابولي. بالنسبة لهذا البروتوكول ، قم بتعيين القيمة على 5 nN.
ملاحظة: تمثل نقطة الضبط النسبية أقصى قوة للتفاعل ، عندما يتم الوصول إلى ذروة منحنى مسافة القوة وتعود حركة الطرف إلى خط الأساس. بالنسبة للمواد اللينة (1-50 كيلو باسكال) ، يتم تعيين هذه المعلمة بوحدات نانونيوتن (nN). علاوة على ذلك ، بالنسبة للناتئ الناعم (مع ثابت زنبرك من 0.05 نيوتن / م إلى 0.35 نيوتن / م) ، فإن القوة القصوى التي يمكن تطبيقها هي حوالي 50 نانونيوتن. اضبط قيم نقطة الضبط ونقطة الضبط النسبية وفقا لذلك.- تأكد من أن قيمة نقطة الضبط المحددة لا تؤدي إلى عمق مسافة بادئة أكبر من نصف قطر المسافة البادئة الكروية ، وإلا لا يمكن تحديد سطح المسافة البادئة بشكل صحيح في حساب معامل يونغ. احسب متوسط قيمة عمق المسافة البادئة بعد التشغيل الأول للمسافات البادئة ؛ انظر القسم 5 ، تحليل البيانات ، لمعرفة كيفية معالجة البيانات المسجلة. اضبط قيمة نقطة الضبط إذا لزم الأمر.
- اضبط ضبط خط الأساس على أنه 5.
ملاحظة: هنا ، يشير خط الأساس إلى درجة كثير الحدود المستخدمة لملاءمة منحنيات النهج والسحب. ضبط خط الأساس على 5 يناسب المنحنيات بدقة عالية وبالتالي يضمن التقاط ضوضاء الخلفية أثناء القياسات. - حدد طول حركة الكابولي في المحور Z (طول Z) وفقا لتضاريس سطح العينة. لاتباع هذا البروتوكول ، اضبط طول Z على 15 ميكرومتر.
ملاحظة: تقلل القيمة العالية (على سبيل المثال 15 ميكرومتر) من حساسية القياس ولكنها عادة ما تكون مطلوبة للعينات ذات السطح غير المنتظم للغاية مثل أنسجة الكبد الليفية. - اضبط حركة Z على مدة ثابتة.
ملاحظة: يمكن أيضا ضبط حركة Z على سرعة ثابتة لعرض البيانات التي تشير إلى حركة Z (سرعة التمديد وتمديد الوقت) في وضع مختلف. - اضبط وقت التمديد على 1 ثانية. قم بتعيين تأخير التمديد وتأخير التراجع على أنه 0.
ملاحظة: استخدم سرعات تمديد تبلغ >5.0 ميكرومتر / ثانية للمواد شديدة النعومة61 ، حيث ستؤدي سرعات المسافة البادئة المنخفضة إلى استجابة أكثر لزوجة وأقل مرونة من الأسطح الناعمة. تأخير التمديد وتأخير التراجع هي معلمات يمكن استخدامها لدراسة تفاعل محدد بين طرف الكابولي والركيزة (على سبيل المثال تفاعلات البروتينات التي تم تجميدها على سطح الكابولي مع البروتينات المثبتة على سطح الشريحة). - اضبط معدل العينة على 5000 هرتز.
ملاحظة: يشير معدل العينة إلى تكرار النقاط التي يتم تسجيلها على منحنى الاقتراب والتراجع الكامل. اضبط هذا على قيمة عالية (على سبيل المثال 5000 هرتز) لتجنب فقدان مناطق معينة من المنحنيات بسبب انتقالها السريع للغاية. - ضع علامة على الحلقة المغلقة Z باستخدام علامة لتمكين نظام حلقة التغذية المرتدة ، والذي يضمن مسافة ثابتة بين سطح العينة وطرف الكابولي.
- افصل المرحلة الآلية عن طريق إلغاء تحديد Engage والنقر فوق Approach لمقاربة العينة باستخدام الكابولي. انقر فوق بدء المسح لبدء جمع منحنيات مسافة القوة في المنطقة المحددة في الخطوة 6 ؛ القسم 4 ، القياس.
5. تحليل البيانات
- تحليل البيانات المكتسبة باستخدام البرنامج مفتوح المصدر "AtomicJ" (والذي يمكن تنزيله من https://sourceforge.net/projects/jrobust/).
ملاحظة: وهو يدعم الملفات التي تم جمعها من Agilent Technologies أو JPK Instruments أو مجاهر القوة الذرية Bruker. - قم بتحميل منحنيات القوة في البرنامج بالنقر فوق منحنيات قوة العملية وأيقونة الخرائط في AtomicJ (الشكل التكميلي S2A ، x). في مساعد المعالجة ، أضف الخرائط المراد تحليلها بالنقر فوق الزر " إضافة" (الشكل التكميلي S2A ، y). انقر فوق التالي بعد تحميل الخرائط (الشكل التكميلي S2A ، z).
- حدد إعدادات المعالجة في النافذة التالية وفقا للخطوات الموضحة أدناه (المقابلة للخطوات الواردة في الشكل التكميلي S2B ، الخطوات من 1 إلى 11):
- قم بتقدير نقطة الاتصال بين العينة والكابولي يدويا عن طريق الحساب أو تلقائيا باستخدام مجموعة من معلمات منحنى التركيب. لاتباع هذا البروتوكول ، استخدم التقدير التلقائي لنقطة الاتصال.
- حدد نقطة الاتصال بين الكابولي والعينة بطريقة الشبكة المركزة الكلاسيكية.
- حدد طريقة التقدير للحصول على أفضل تحديد لنقطة الاتصال بناء على جودة منحنيات القوة المقاسة ، والتي يجب تحديدها تجريبيا أثناء تحسين تحليل البيانات. لاتباع هذا البروتوكول، استخدم الأسلوب المستقل للنموذج.
- قم بملاءمة منحنى المسافة البادئة للقوة باستخدام نموذج كلاسيكي (استخدم L2 الكلاسيكي للنموذج المناسب لاتباع هذا البروتوكول).
ملاحظة: ملاءمة النموذج ومقدر الاتصال هما معلمتان تحكمان كيفية تركيب المنحنيات بواسطة البرنامج وكيفية إنشاء نقطة الاتصال في المنحنى المجهز ، على التوالي. لهذه القياسات ، تم استخدام الخيار الكلاسيكي ، والذي يستخدم انحدار المربعات الصغرى. يعالج هذا كل نقطة منخفضة القوة على المنحنى كنقطة اتصال تجريبية ويصلح كثير الحدود للمنطقة قبل نقطة اتصال التجربة. ثم يناسب نموذج الاتصال المناسب لبيانات المسافة البادئة للقوة التي تم جمعها. النقطة التي تعطي أقل مجموع من المربعات يفترض أنها نقطة الاتصال. يمكن استخدام طرق أخرى بناء على جودة منحنيات القوة التي تم الحصول عليها62,63. - اضبط ملاءمة النموذج على منحنى السحب .
- اضبط نسبة بواسون على 0.45 ، على النحو الموصى به للأنسجة الرخوة مثل الكبد24.
- اضبط ملاءمة المنحنى باستخدام درجة خط الأساس 3 ودرجة الاتصال الداخلي 1. قم بتغيير درجة الملاءمة متعددة الحدود بناء على مقياس انحرافات المنحنيات عن النموذج.
- حدد النموذج المستخدم ليناسب منحنيات السحب. استخدم نموذج سنيدون ، الذي يحسب معامل يونغ بناء على المعادلة (1) والمعادلة (2):
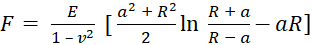 (1)
(1)
δ =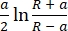 (2)
(2)
حيث F هي القوة ، E هي معامل يونغ ، v هي نسبة بواسون للعينة ، δ هي عمق المسافة البادئة ، a هي نصف قطر التلامس ، و R هي نصف قطر الكرة62,63. - املأ نصف قطر الطرف الكروي بالميكرومتر (2.9 ميكرومتر في هذا البروتوكول).
- قم بتحميل ثابت الربيع و InvOLS من ملفات البيانات عن طريق تمكين القراءة ( حدد المربعات).
- انقر فوق "إنهاء".
ملاحظة: يتم تقديم البيانات التي تم تحليلها في شكل خرائط للانحراف الرأسي ، والارتفاع ، والالتصاق ، وقوة الاتصال ، والتشوه ، وقوة الالتصاق ، وقيم R2 ، والمنحدر ، ومعامل يونغ ، والمسافة البادئة الانتقالية ، وقوة الانتقال ، وموضع التلامس المحسوب لكل منحنى قوة (الشكل التكميلي S3 ، أعلى اليسار). تعرض نافذتان إضافيتان منحنيات القوة والقيم الأولية (الشكل التكميلي S3 ، اللوحات العلوية اليمنى والسفلية ، على التوالي).
- استبعاد منحنيات القوة حيث اقترب الكابولي من سطح قسم الكبد بشكل غير صحيح. لتحديد هذه ، ابحث عن المنحنيات ذات الضوضاء العالية والأشكال الشاذة و / أو النهج غير المكتمل ، كما هو موضح في الشكل 3 وتمت مناقشته بالتفصيل في مكان آخر46.
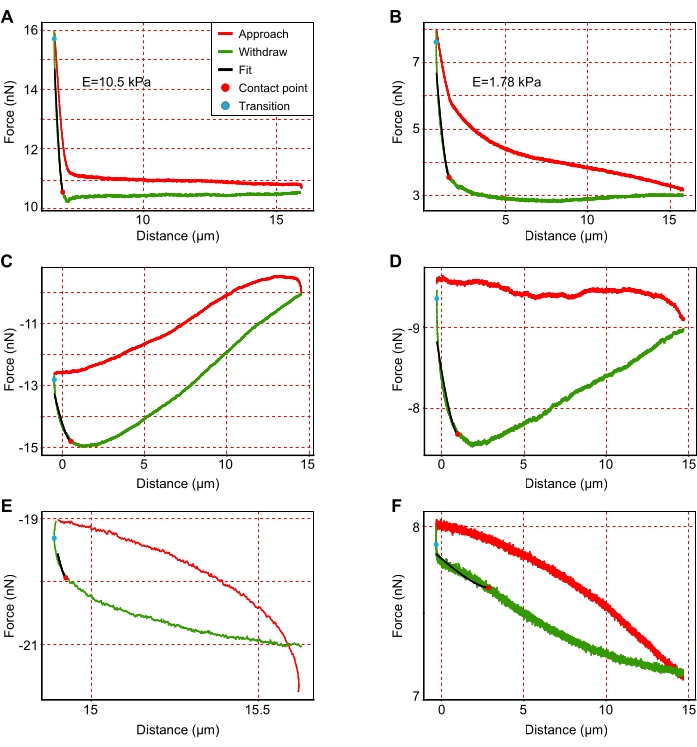
الشكل 3: أمثلة على منحنيات إزاحة القوة التمثيلية. (أ ، ب) منحنيات قوة تمثيلية قابلة للتفسير ل أكثر صلابة (A; E = 10.5 كيلو باسكال) وأكثر ليونة (B ؛ E = 1.78 كيلو باسكال) المناطق المناسبة للتحليل. (ج-و) الرسوم البيانية التمثيلية غير القابلة للتفسير والتي يجب استبعادها من التحليل بسبب النهج غير الصحيح (C-E) أو (F) الضوضاء الأعلى. كما هو موضح في وسيلة الإيضاح الواردة في (أ) ، تظهر المنحنيات الحمراء نهج الكابولي ، وتظهر المنحنيات الخضراء تراجع الكابولي. تظهر الخطوط السوداء تركيب منحنى الانسحاب للناتئ. ميل الخطوط السوداء يتوافق مع معامل يونغ. تتوافق النقطتان الحمراء والزرقاء مع نقطة الاتصال ونقطة الانتقال ، على التوالي. نقطة الاتصال هي نقطة الاتصال الأخيرة بين الكابولي والركيزة أثناء التراجع ، بينما تصف نقطة الانتقال انتقال الكابولي من الاقتراب إلى التراجع. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
النتائج
تم فحص أقسام الكبد الثابتة بشكل معتدل ، والتي يبلغ سمكها 30 ميكرومتر والتي تم الحصول عليها من الفئران الضابطة ومن الفئران المصابة بالتليف الخفيف أو المتقدم (الناجم عن حقن CCl4 لمدة 3 أسابيع أو 6 أسابيع ، على التوالي49) باستخدام AFM كما هو موضح في هذا البروتوكول. تم اختيار ألياف الكولاجين القريبة من الأوردة المركزية لقياس خرائط الصلابة. تم تحليل المناطق القريبة من الأوردة المركزية ، والتي تتوافق مع المناطق التي تتشكل فيها ألياف الكولاجين في الحيوانات المعالجة ب CCl 4 عادة ، في الكبد الضابط (الشكل 4 أ). كان توزيع وحدات يونغ قابلا للتكرار عبر كبد التحكم المختلفة والمناطق الغنية بالكولاجين داخل قسم كبد واحد (الشكل 4 ب: مخطط الكمان الأيسر).
في الحيوانات المعالجة ب CCl 4 ، أظهرت خرائط الصلابة المقابلة للمناطق المحيطة بالمركز لرواسب الكولاجين قيما أعلى بكثير لمعامل يونغ مقارنة بالمناطق المكافئة في الفئران الضابطة (الشكل 4B: 1.9 كيلو باسكال مقابل 2.6 كيلو باسكال قيم معامل يونغ للتحكم مقابل 3 أسابيع CCl 4 فأر معالج ؛ p = 0.07 ؛ 1.9 كيلو باسكال مقابل 5.1 كيلو باسكال قيم معامل يونغ للتحكم مقابل 6 أسابيع CCl 4 -الفأر المعالج. ع = 0.02). علاوة على ذلك ، كانت هناك زيادة كبيرة في قيم معامل يونغ مع معالجة CCl 4 أطول (الشكل 4B ؛ 2.6 كيلو باسكال مقابل 5.1 كيلو باسكال متوسط قيم معامل يونغ لمدة 3 أسابيع مقابل 6 أسابيع CCl4 فأر معالج ؛ p = 0.04). هذا يدل على تصلب تدريجي لرواسب الكولاجين مع تطور التليف وأن قياسات AFM تعكس تكوين الليف.
لتقييم تأثير التخزين المطول لأقسام الكبد المضمنة في OCT على الخواص الميكانيكية لألياف الكولاجين ، قمنا بقياس صلابة ألياف الكولاجين في أقسام الفئران المعالجة ب CCl4 ، والتي تم تخزينها عند -80 درجة مئوية لمدة 2 أسابيع أو 3 أشهر على الشريحة بعد القطع (الشكل 5). أظهرت قياسات AFM قيما أقل بكثير لمعامل يونغ في المناطق الغنية بالكولاجين للأقسام المخزنة لمدة 3 أشهر مقارنة بتلك التي تم الحصول عليها من المقاطع المقاسة في غضون أسبوعين من تقسيم العينة (الشكل 5 ؛ 4.7 كيلو باسكال مقابل 3.6 كيلو باسكال متوسط قيم معامل يونغ لمدة أسبوعين مقابل 3 أشهر تخزين ؛ ص < 0.001). وبالتالي ، من المهم قياس الخواص الميكانيكية لأنسجة الكبد بعد وقت قصير من تحضير الأقسام من فصوص الكبد المدمجة في OCT.
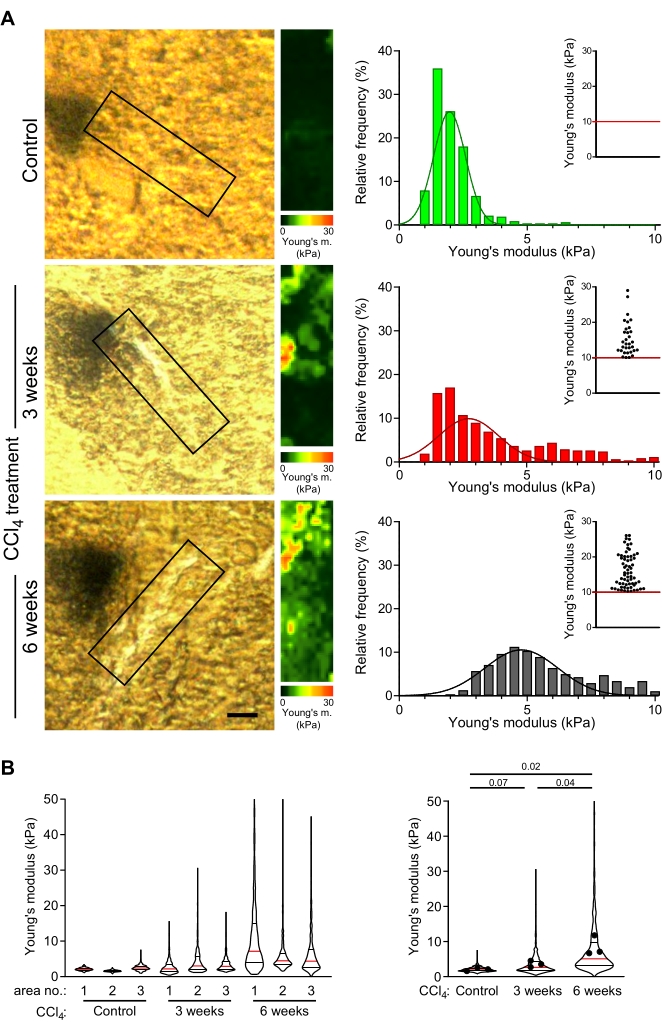
الشكل 4: تكشف قياسات AFM عن تصلب تدريجي للمناطق الغنية بالكولاجين المرتبط بعلاج CCl4 لفترات طويلة. (أ) تم استخدام أقسام الكبد من الفئران الضابطة والفئران المعالجة ب CCl4 لمدة 3 أسابيع أو 6 أسابيع لقياس الخواص الميكانيكية للمناطق الغنية بالكولاجين. المناطق المحاصرة لأقسام الكبد الموضحة في صور الفحص المجهري المستقطب (يسار) هي مناطق مسح غنية بالكولاجين (أو مناطق مقابلة في الكبد الضابط) تم اختيارها لقياسات AFM (30 ميكرومتر × 100 ميكرومتر ، 10 بكسل × 36 بكسل). تظهر خرائط معامل يونغ ذات المقاييس اللونية المقابلة لهذه المناطق المربعة على اليمين ، بما في ذلك الرسوم البيانية لقيم معامل يونغ من هذه الخرائط ؛ تظهر مخططات التشتت المضمنة قيما >10 كيلوباسكال لكل شرط. يتم تصور تصلب الكبد على أنه تحول تدريجي نحو اليمين في توزيع الرسم البياني وتكرار أعلى للنقاط في مخطط التشتت الداخلي. شريط المقياس = 20 ميكرومتر. (ب) تظهر مخططات الكمان توزيع الوحدات المرنة من ثلاث مناطق تم قياسها لكل حالة (يسار) وتلخيص قيم الوحدات المرنة من جميع الخرائط الثلاث (يمين). تظهر مخططات الكمان الوسيط (الخط الأحمر) والنسبةالمئوية 25 والنسبة المئوية 75 (الخطوط السوداء) ؛ تمثل النقاط القيم المتوسطة للخرائط الفردية من المناطق 1-3. تم حساب قيم p المقدمة باستخدام اختبار t للطالب الذي تم إجراؤه على الوسائل. الاختصارات: AFM = مجهر القوة الذرية ؛ جL4 = رابع كلوريد الكربون. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
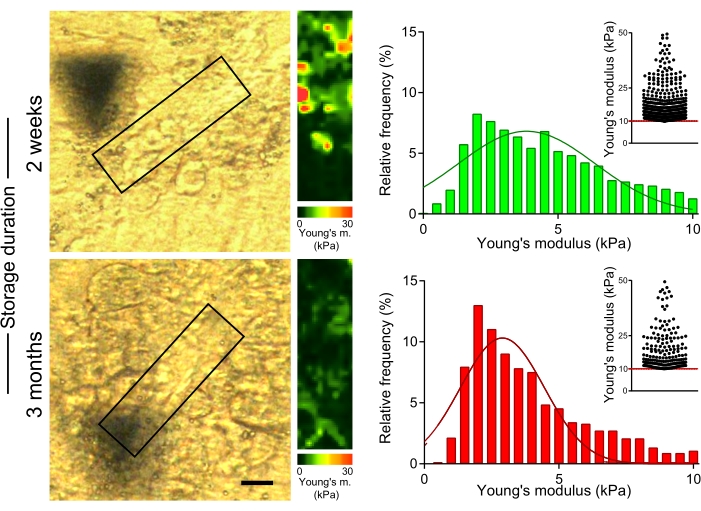
الشكل 5: يؤدي التخزين الممتد لأقسام الكبد إلى انخفاض في صلابة المناطق الغنية بالكولاجين. تم استخدام أقسام الكبد (المحضرة من الفئران المعالجة ب CCl4 لمدة أسبوعين) المخزنة عند -80 درجة مئوية لمدة أسبوعين أو 3 أشهر لقياس معامل يونغ. صور مجهرية مستقطبة (يسار) مع مربعات تشير إلى المناطق الغنية بالكولاجين المستخدمة لقياس AFM (30 ميكرومتر × 100 ميكرومتر ، 10 بكسل × 36 بكسل). خرائط معامل يونغ المقابلة مع مقاييس الألوان (يمين). تظهر الرسوم البيانية قيم معامل يونغ التي تم جمعها من 4-6 مناطق في كل عينة. تظهر الرسوم البيانية المبعثرة المضمنة قيما >10 كيلوباسكال لكل شرط. شريط المقياس = 20 ميكرومتر. الاختصارات: AFM = مجهر القوة الذرية ؛ جL4 = رابع كلوريد الكربون. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الشكل التكميلي S1: طريقة لتعديل الكابولي باستخدام حبة صغيرة من راتنج الميلامين. (أ) يوضح الرسم التخطيطي ارتباط حبة كروية بطرف الكابولي. للحصول على وصف تدريجي ، انظر القسم 2 ، الجزء 1 ، مرفق حبة 5.7 ميكرومتر بطرف ناتئ AFM. (ب) صورة مجهرية لخرزة كروية طولها 5.7 ميكرومتر متصلة بطرف الكابولي الموضح من الأعلى (يسار) والمنظر الجانبي (يمين). قضبان المقياس = 20 ميكرومتر. الاختصارات: AFM = مجهر القوة الذرية ؛ RT = درجة حرارة الغرفة. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي S2: تحليل البيانات في AtomicJ. (أ) تسلسل الخطوات الواجب اتباعها لفتح خرائط الصلابة في AtomicJ. بنقرة واحدة بزر الماوس الأيسر على منحنيات قوة العملية والخرائط (x) تفتح مساعد المعالجة. يمكن تحميل الملفات إلى مساعد المعالجة بالنقر فوق إضافة (y) وتحديد الملفات المطلوبة. انقر فوق التالي (z) للمتابعة إلى الخطوة التالية. (ب) معلمات تركيب المنحنى ، ونموذج ميكانيكا الاتصال المناسب ، وإعدادات AFM المستخدمة أثناء القياس. تشير الخطوات من 1 إلى 11 إلى النقاط الفرعية المقابلة المفصلة في البروتوكول الخطوة 3 ، القسم 5 ، تحليل البيانات. الرجاء الضغط هنا لتنزيل هذا الملف.
الشكل التكميلي S3: مخطط البيانات التي تم تحليلها في AtomicJ. تظهر معاينة البيانات التي تم تحليلها خرائط الصلابة (النافذة العلوية اليسرى) ومنحنيات القوة (النافذة اليمنى العليا) والبيانات الأولية (النافذة السفلية). اختصار: AFM = مجهر القوة الذرية. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
يوفر البروتوكول المقدم طريقة قابلة للتكرار خطوة بخطوة لقياس AFM لأنسجة كبد الفأر الطبيعية والليفية. يوفر الفحص المجهري للاستقطاب المقترن دقة مكانية عالية ويتيح تصور ألياف الكولاجين بسبب انكسارها. علاوة على ذلك ، يتم توفير وصف مفصل لتحليل منحنيات القوة التي تم الحصول عليها. يمكن إجراء قياس صلابة AFM على المستوى الخلوي ، مما يسمح بمراقبة التغيرات المحلية في الخواص الميكانيكية لأنسجة الكبد بسبب تطور مرض ليفي. تليف الكبد ليس عملية متجانسة تؤثر على العضو بأكمله. على العكس من ذلك ، تتخلل مناطق الحاجز الليفي الغني بالكولاجين مناطق ذات رواسب كولاجين منخفضة أو معدومة. وبالتالي ، فإن تغيرات الصلابة خاصة بالبيئة المكروية المحلية وتؤثر فقط على الخلايا الملامسة محليا للمناطق التي تضررت من الإصابة. هذا المقياس المجهري لعدم تجانس الصلابة واضح أيضا في تفاصيل خرائط معامل AFM Young ، حيث تحد نقاط الصلابة العالية مناطق الصلابة الطبيعية تقريبا. يوضح هذا الاختلاف أنه حتى منطقة أنسجة ندبة الكولاجين ليست متجانسة ميكانيكيا وتتطلب قياس AFM ليتم توصيفه على المستوى الخلوي (الشكل 4).
يسمح البروتوكول المقدم بقياسات تصلب الكبد بواسطة AFM بشكل مستقل عن مجموعة الكبد ، حيث يمكن تخزين فصوص الكبد بأكملها المضمنة في OCT لفترة طويلة عند -80 درجة مئوية. ومع ذلك ، بمجرد تقسيم الأنسجة ، نوصي بقياس العينات في غضون ~ 2 أسابيع حيث لاحظنا تليين تدريجي لأقسام الأنسجة المخزنة لفترات زمنية أطول (الشكل 5).
يسمح AFM المجهز بمجهر الاستقطاب بتحديد منطقة الاهتمام بدقة داخل بنية فصيص الكبد. ومع ذلك ، فإنه يحتوي أيضا على بعض القيود التي يجب مراعاتها عند تفسير النتائج. تم قياس قيم الصلابة التي تم الحصول عليها هنا في درجة حرارة الغرفة. نفترض أن تأثيرات درجة الحرارة على الخواص الميكانيكية للأنسجة الرخوة ستكون صغيرة ؛ ومع ذلك ، قد يكون هذا أحد أسباب الاختلافات بين القيم المبلغ عنها في الجسم الحي للخواص الميكانيكية لأنسجة الكبد والقيم في هذه الدراسة.
علاوة على ذلك ، يسمح هذا البروتوكول بتحليل AFM لأنسجة الكبد لمدة تصل إلى 3 ساعات ، الأمر الذي يتطلب تثبيتا خفيفا للأنسجة. من المرجح أن يؤثر التثبيت المعتدل لأقسام الأنسجة ، وكذلك دورة التجميد والذوبان ، على القيم المطلقة لمعامل يونغ. وبالتالي ، قد تختلف القيم المبلغ عنها لوحدات يونغ عن القيم في الجسم الحي . هناك حاجة إلى مزيد من الدراسات لتحسين بروتوكول قياس القيم المطلقة لمعامل يونغ من أقسام الكبد ، والتي يمكن تحقيقها بطريقة مختلفة لتثبيت أنسجة الكبد64.
ومع ذلك ، لاحظنا زيادة تصلب المناطق الغنية بالكولاجين في كبد الفئران المعالجة ب CCl4 لمدة 3 أسابيع مقارنة ب 6 أسابيع. تتوافق هذه التغييرات مع تطور التليف أثناء الإصابة المطولة (الشكل 4) وتظهر أنه يمكن التحقيق في الاختلافات النسبية بين العلاجات المختلفة باستخدام البروتوكول المقدم. هذا يتفق مع ملاحظات Calò et al. ، الذين أظهروا أن أقسام الكبد الثابتة بشكل معتدل تظهر اختلافات مماثلة في قيم الصلابة بين المناطق الغنية بالكولاجين والمناطق التي تفتقر إلى الكولاجين كما هو الحال في الأنسجة الطازجة25.
استخدمنا الكابولي SD-qp-BioT-TL-10 (ثابت الربيع النظري ~ 0.09 نيوتن / م) المعدل بطرف كروي قطره 5.7 ميكرومتر لتقليل الاضطراب الميكانيكي لأنسجة الكبد أثناء القياسات. مكنت حبة 5.7 ميكرومتر المسافة البادئة الكافية للعينة للتحقق من صلابتها مع الحفاظ على سلامتها. يمكن استخدام حبة ذات قطر أصغر ، بعد عدة تحسينات ، للحصول على دقة أعلى في خرائط الصلابة ولكنها قد تؤدي إلى مزيد من المبالغة في تقدير قيم معامل يونغ (لمزيد من التفاصيل ، انظر Crichton et al.65). باستخدام مجموعة حبيبات الكابولي المحددة ، تمكنا من توصيف صلابة العينة في نطاق واسع ، من عشرات الوحدات من Pa إلى ~ 100 كيلو باسكال.
تم استخدام نموذج سنيدون لاشتقاق معامل يونغ من منحنيات القوة ، لأنه يسمح بتحليل المسافات البادئة العميقة باستخدام المجسات الغروية62. نموذج سنيدون ، على عكس نموذج هيرتز ، لا يعاني من القيد المتمثل في أن نصف قطر التلامس يجب أن يكون أصغر بكثير من نصف قطر الكرة. يفترض كذلك أن سمك العينة أكبر بعدة مرات من عمق المسافة البادئة30,66. في الدراسة الحالية ، كانت المسافة البادئة ~ 2 ميكرومتر بحجم حبة 5.7 ميكرومتر وسمك عينة 30 ميكرومتر في المناطق الغنية بالكولاجين. وهكذا ، كان نموذج سنيدون مناسبا. نماذج أخرى63 بالنظر إلى قوة الالتصاق بين الطرف والركيزة يمكن استخدامها لأنواع مختلفة من الأنسجة.
ينفذ التحليل في AtomicJ تصحيحات للسمك المحدود للعينات لتقليل مساهمة الركيزة أثناء اشتقاق معامل يونغ62,67. في تحليل منحنيات القوة التي تم الحصول عليها ، استخدمنا نسبة بواسون واحدة تبلغ 0.45 ، والتي تمت التوصية بها سابقا لأعضاء الأنسجة الرخوة24. هذا التقريب ليس له تأثير كبير على القيم المحسوبة لمعامل يونغ ، حيث أن التغير في قيمة نسبة بواسون من 0.4 إلى 0.5 ينتج عنه فقط انخفاض 0.893x في قيم معامل يونغ المحسوبة وفقا لمعادلة سنيدون. بالنظر إلى الاختلافات المتعددة في معامل يونغ بين الفترات المختلفة لعلاجات CCl4 ، فإن الأخطاء الناتجة عن تقريب نسبة بواسون هامشية فقط.
استخدمنا منحنيات السحب لحساب قيم الصلابة ، حيث كنا مهتمين بالاستجابة المرنة للأنسجة للحمل الذي يوفره الكابولي بدلا من الاستجابة البلاستيكية للمسافة البادئة68. نظرا للاستجابة اللزجة المرنة للأنسجة الرخوة ، قد تبالغ منحنيات السحب المناسبة في تقدير معامل يونغ ، والذي يجب أخذه في الاعتبار. علاوة على ذلك ، لاحظنا أن تحليل البيانات باستخدام منحنيات النهج ينتج عنه اتجاهات مماثلة في قيم الصلابة بين المناطق الليفية ومناطق التحكم ، على الرغم من أن القيم المطلقة أقل في المقابل (البيانات غير معروضة).
أثناء تحسين البروتوكول ، حددنا عدة خطوات حاسمة لتكرار القياسات. أولا ، من المهم التأكد من أن الخرزة موجودة تقريبا في وسط الطرف الشفاف أثناء ربطها بالكابولي. هذا يمنع عدم التوازن الميكانيكي المحتمل أثناء المسافة البادئة. ثانيا ، أثناء تثبيت الكبد مع PFA ، من الضروري اتباع الحدود الزمنية للذوبان والتثبيت بدقة. قد يؤثر تغيير توقيت هذه الخطوة بشدة على الخواص الميكانيكية لأقسام الأنسجة. ثالثا ، يجب معايرة الكابولي بشكل متكرر مع المراقبة المستمرة وإدخال قيم درجة الحرارة المتزامنة لتجنب أي قطع أثرية تحدث في قيم الصلابة بسبب تقلبات درجة الحرارة. أخيرا ، لا ينبغي قياس قسم كبد واحد لمدة تزيد عن 3 ساعات من التحضير ، حيث قد يتبخر برنامج تلفزيوني متراكب على مدى فترات أطول. يمكن للقراء الرجوع إلى جدول استكشاف الأخطاء وإصلاحها (الجدول 3) لحل المشكلات التي تمت مواجهتها أثناء قياس AFM ، والتي تمت مناقشتها أيضا بإسهاب في Norman et al.46.
الجدول 3: دليل استكشاف الأخطاء وإصلاحها. الرجاء الضغط هنا لتحميل هذا الجدول.
يسمح البروتوكول المقدم بفحص AFM القابل للتكرار لأنسجة الكبد. لديه القدرة على الكشف عن معلومات حول تطور مرض الكبد الليفي وانحداره في نهاية المطاف على المستوى المجهري ويمكن أن يساهم في تطوير علاجات تستهدف مناطق الندبة الليفية التي تشكلت أثناء تطور مرض الكبد المزمن.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
تم دعم هذا العمل من قبل وكالة المنح في جمهورية التشيك (18-02699S) ، ومشروع البحث المؤسسي للأكاديمية التشيكية للعلوم (RVO 68378050) ، ومشروع MEYS CR NICR EXCELES (LX22NPO05102). CIISB ، مركز Instruct-CZ التابع لاتحاد Instruct-ERIC EU ، بتمويل من مشروع البنية التحتية MEYS CR LM2018127 ومشروع الصندوق الأوروبي للتنمية الإقليمية "UP CIISB" (رقم. CZ.02.1.01/0.0/0.0/18_046/0015974) ماليا القياسات في CF Nanobiotechnology, CEITEC MU. كما نعترف بالمرفق الأساسي للفحص المجهري الضوئي ، IMG CAS ، براغ ، جمهورية التشيك ، بدعم من MEYS (LM2018129 ، CZ.02.1.01 / 0.0 / 0.0 / 18_046 / 0016045) و RVO: 68378050-KAV-NPUI ، لدعمهم مع التصوير المجهري المقدم هنا.
Materials
| Name | Company | Catalog Number | Comments |
| AFM head | Bruker | JPK nanowizard 3 | |
| Cameras | Andor | Zyla 5.5 USB (sCMOS, water cooled) | |
| The Imagingsource | S/N:12310015 | ||
| Cantilever | SD-qp-BioT-TL-10, Nanosensors | S/N:73750F05 | |
| Cryotome | Leica | CM1950 | |
| Epoxy resin glue (Long working time ) | Bison epoxy universal | ||
| Melamine beads; diameter, 5.7 um | Microparticles, GmbH | MF-R-5.7 | |
| Microscope | Olympus | IX81 | |
| Hydrophobic slide marker | SuperHT | PAP PEN | |
| Software | JPK nanowizard v6.1.151 | ||
| AtomicJ v2.3.1 | |||
| Superfrost slides | Thermoscientific | ref no. J1800AMNZ | |
| System | Ubuntu 14.04.5 LTS | ||
| Vibration isolation control unit | Tablestable | AVI-200-S |
References
- vanden Berghe, G. The role of the liver in metabolic homeostasis: Implications for inborn errors of metabolism. Journal of Inherited Metabolic Dis. 14 (4), 407-420 (1991).
- Stanger, B. Z. Cellular homeostasis and repair in the mammalian liver. Annual Reviews of Physiology. 77, 179-200 (2015).
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Hernandez-Gea, V., Friedman, S. L. Pathogenesis of liver fibrosis. Annual Review of Pathology. 6, 425-456 (2011).
- Georges, P. C., et al. Increased stiffness of the rat liver precedes matrix deposition: Implications for fibrosis. American Journal of Physiology. Gastrointestinal and Liver Physiology. 293 (6), 1147-1154 (2007).
- Perepelyuk, M., et al. Hepatic stellate cells and portal fibroblasts are the major cellular sources of collagens and lysyl oxidases in normal liver and early after injury. American Journal of Physiology. Gastrointestinal and Liver Physiology. 304 (6), 605-614 (2013).
- Wells, R. G. The role of matrix stiffness in regulating cell behavior. Hepatology. 47 (5), 1394-1400 (2008).
- Olsen, A. L., et al. Hepatic stellate cells require a stiff environment for myofibroblastic differentiation. American Journal of Physiology. Gastrointestinal and Liver Physiology. 301 (1), 110-118 (2011).
- Sandrin, L., et al. Transient elastography: A new noninvasive method for assessment of hepatic fibrosis. Ultrasound in Medicine & Biology. 29 (12), 1705-1713 (2003).
- Ling, W., et al. Effects of vascularity and differentiation of hepatocellular carcinoma on tumor and liver stiffness: In vivo and in vitro studies. Ultrasound in Medicine & Biology. 40 (4), 739-746 (2014).
- Wong, V. W. S., et al. Diagnosis of fibrosis and cirrhosis using liver stiffness measurement in nonalcoholic fatty liver disease. Hepatology. 51 (2), 454-462 (2010).
- Cha, S. W., et al. Nondiseased liver stiffness measured by shearwave elastography a pilot study. Journal of Ultrasound in Medicine. 33 (1), 53-60 (2014).
- Castera, L., Forns, X., Alberti, A. Non-invasive evaluation of liver fibrosis using transient elastography. Journal of Hepatology. 48 (5), 835-847 (2008).
- Chang, W., et al. Liver fibrosis staging with MR elastography: Comparison of diagnostic performance between patients with chronic hepatitis B and those with other etiologic causes. Radiology. 280 (1), 88-97 (2016).
- Venkatesh, S. K., Yin, M., Ehman, R. L. Magnetic resonance elastography of liver: Clinical applications. Journal of Computer Assisted Tomography. 37 (6), 887-896 (2013).
- Venkatesh, S. K., Yin, M., Ehman, R. L. Magnetic resonance elastography of liver: Technique, analysis and clinical applications. Journal of Magnetic Resonance Imaging. 37 (3), 544-555 (2013).
- Venkatesh, S. K., Wang, G., Teo, L. L. S., Ang, B. W. L. Magnetic resonance elastography of liver in healthy Asians: Normal liver stiffness quantification and reproducibility assessment. Journal of Magnetic Resonance Imaging. 39 (1), 1-8 (2014).
- Lee, D. H., Lee, J. M., Han, J. K., Choi, B. I. MR elastography of healthy liver parenchyma: Normal value and reliability of the liver stiffness value measurement. Journal of Magnetic Resonance Imaging. 38 (5), 1215-1223 (2013).
- Mueller, S. Liver stiffness: A novel parameter for the diagnosis of liver disease. Hepatic Medicine. Evidence and Research. 2, 49-67 (2010).
- Goodman, Z. D. Grading and staging systems for inflammation and fibrosis in chronic liver diseases. Journal of Hepatology. 47 (4), 598-607 (2007).
- Salameh, N., et al. Hepatic viscoelastic parameters measured with MR elastography: Correlations with quantitative analysis of liver fibrosis in the rat. Journal of Magnetic Resonance Imaging. 26 (4), 956-962 (2007).
- Yin, M., et al. Quantitative assessment of hepatic fibrosis in an animal model with magnetic resonance elastography. Magnetic Resonance in Medicine. 58 (2), 346-353 (2007).
- Bastard, C., et al. Transient micro-elastography: A novel non-invasive approach to measure liver stiffness in mice. World Journal of Gastroenterology. 17 (8), 968-975 (2011).
- Barnes, S. L., Lyshchik, A., Washington, M. K., Gore, J. C., Miga, M. I. Development of a mechanical testing assay for fibrotic murine liver. Medical Physics. 34 (11), 4439-4450 (2007).
- Calò, A., et al. Spatial mapping of the collagen distribution in human and mouse tissues by force volume atomic force microscopy. Scientific Reports. 10, 15664 (2020).
- Desai, S. S., et al. Physiological ranges of matrix rigidity modulate primary mouse hepatocyte function in part through hepatocyte nuclear factor 4 alpha. Hepatology. 64 (1), 261-275 (2016).
- Kostallari, E., et al. Stiffness is associated with hepatic stellate cell heterogeneity during liver fibrosis. American Journal of Physiology. Gastrointestinal and Liver Physiology. 322 (2), 234-246 (2022).
- Binnig, G., Qaute, C. F., Gerber, C. Atomic force microscope. Physical Review Letters. 56 (9), (1986).
- Johnson, K. L. . Contact Mechanics. , (1985).
- Asgari, M., Latifi, N., Giovanniello, F., Espinosa, H. D., Amabili, M. Revealing layer-specific ultrastructure and nanomechanics of fibrillar collagen in human aorta via atomic force microscopy testing: Implications on tissue mechanics at macroscopic scale. Advanced NanoBiomed Research. 2 (5), 2100159 (2022).
- Amabili, M., et al. Microstructural and mechanical characterization of the layers of human descending thoracic aortas. Acta Biomaterialia. 134, 401-421 (2021).
- Grant, C. A., Twigg, P. C., Tobin, D. J. Static and dynamic nanomechanical properties of human skin tissue using atomic force microscopy: Effect of scarring in the upper dermis. Acta Biomaterialia. 8 (11), 4123-4129 (2012).
- Geerligs, M., et al. In vitro indentation to determine the mechanical properties of epidermis. Journal of Biomechanics. 44 (6), 1176-1181 (2011).
- Liu, F., Tschumperlin, D. J. Micro-mechanical characterization of lung tissue using atomic force microscopy. Journal of Visualized Experiments. (54), e2911 (2011).
- Sicard, D., Fredenburgh, L. E., Tschumperlin, D. J. Measured pulmonary arterial tissue stiffness is highly sensitive to AFM indenter dimensions. Journal of the Mechanical Behavior of Biomedical Materials. 74, 118-127 (2017).
- Babu, P. K. V., Radmacher, M. Mechanics of brain tissues studied by atomic force microscopy: A perspective. Frontiers in Neuroscience. 13, 600 (2019).
- del Mar Vivanco, M. . Mammary Stem Cells: Methods and protocols. , (2015).
- Zanetti-Dällenbach, R., et al. Length scale matters: Real-time elastography versus nanomechanical profiling by atomic force microscopy for the diagnosis of breast lesions. Biomed Research International. 2018, 3840597 (2018).
- Lopez, J. I., Kang, I., You, W. -. K., McDonald, D. M., Weaver, V. M. In situ force mapping of mammary gland transformation. Integrative Biology. 3 (9), 910-921 (2011).
- Stolz, M., et al. Early detection of aging cartilage and osteoarthritis in mice and patient samples using atomic force microscopy. Nature Nanotechnol. 4 (3), 186-192 (2009).
- Borin, D., Pecorari, I., Pena, B., Sbaizero, O. Novel insights into cardiomyocytes provided by atomic force microscopy. Seminars in Cell & Developmental Biology. 73, 4-12 (2018).
- Lachaize, V., et al. Atomic Force Microscopy: An innovative technology to explore cardiomyocyte cell surface in cardiac physio/pathophysiology. Letters in Applied NanoBioScience. 4 (4), 321-324 (2015).
- Lieber, S. C., et al. Aging increases stiffness of cardiac myocytes measured by atomic force microscopy nanoindentation. American Journal of Physiology. Heart and Circulatory Physiology. 287 (2), 645-651 (2004).
- Guedes, A. F., et al. Atomic force microscopy as a tool to evaluate the risk of cardiovascular diseases in patients. Nature Nanotechnology. 11 (8), 687-692 (2016).
- Zhu, Y., Dong, Z., Wejinya, U. C., Jin, S., Ye, K. Determination of mechanical properties of soft tissue scaffolds by atomic force microscopy nanoindentation. Journal of Biomechanics. 44 (13), 2356-2361 (2011).
- Norman, M. D. A., Ferreira, S. A., Jowett, G. M., Bozec, L., Gentleman, E. Measuring the elastic modulus of soft culture surfaces and three-dimensional hydrogels using atomic force microscopy. Nature Protocols. 16 (5), 2418-2449 (2021).
- Thomas, G., Burnham, N. A., Camesano, T. A., Wen, Q. Measuring the mechanical properties of living cells using atomic force microscopy. Journal of Visualized Experiments. (76), e50497 (2013).
- McKee, C. T., Last, J. A., Russell, P., Murphy, C. J. Indentation versus tensile measurements of Young's modulus for soft biological tissues. Tissue Engineering. Part B, Reviews. 17 (3), 155-164 (2011).
- Scholten, D., Trebicka, J., Liedtke, C., Weiskirchen, R. The carbon tetrachloride model in mice. Laboratory Animals. 49, 4-11 (2015).
- Nevzorova, Y. A., Boyer-Diaz, Z., Cubero, F. J., Gracia-Sancho, J. Animal models for liver disease - A practical approach for translational research. Journal of Hepatology. 73 (2), 423-440 (2020).
- Ribeiro, J. F., dos Anjos, E. H. M., Mello, M. L. S., de Campos Vidal, B. Skin collagen fiber molecular order: A pattern of distributional fiber orientation as assessed by optical anisotropy and image analysis. PLoS One. 8 (1), 54724 (2013).
- Ozkan, A., et al. The influence of chronic liver diseases on hepatic vasculature: A liver-on-a-chip review. Micromachines. 11 (5), 487 (2020).
- Guimarães, C. F., Gasperini, L., Marques, A. P., Reis, R. L. The stiffness of living tissues and its implications for tissue engineering. Nature Reviews Materials. 5, 351-370 (2020).
- Khajehahmadi, Z., et al. Liver stiffness correlates with serum osteopontin and TAZ expression in human liver cirrhosis. Annals of the New York Academy of Sciences. 1465 (1), 117-131 (2020).
- Tian, M., et al. The nanomechanical signature of liver cancer tissues and its molecular origin. Nanoscale. 7 (30), 12998-13010 (2015).
- Zhao, G., et al. Mechanical stiffness of liver tissues in relation to integrin β1 expression may influence the development of hepatic cirrhosis and hepatocellular carcinoma. Journal of Surgical Oncology. 102 (5), 482-489 (2010).
- Gang, Z., Qi, Q., Jing, C., Wang, C. Measuring microenvironment mechanical stress of rat liver during diethylnitrosamine induced hepatocarcinogenesis by atomic force microscope. Microscopy Research and Technique. 72 (9), 672-678 (2009).
- Sader, J. E., et al. Spring constant calibration of atomic force microscope cantilevers of arbitrary shape. The Review of Scientific Instruments. 83 (10), 103705 (2012).
- JPK Instruments. A practical guide to AFM force spectroscopy and data analysis. JPK Instruments Technical Note. JPK Instruments. , 1-8 (2016).
- van Eysden, C. A., Sader, J. E. Frequency response of cantilever beams immersed in viscous fluids. Journal of Applied Physics. 101, 044908 (2015).
- Kim, Y., Yang, Y. I., Choi, I., Yi, J. Dependence of approaching velocity on the force-distance curve in AFM analysis. Korean Journal of Chemical Engineering. 27, 324-327 (2010).
- Hermanowicz, P., Sarna, M., Burda, K., Gabryś, H. AtomicJ: An open source software for analysis of force curves. The Review of Scientific Instruments. 85 (6), 063703 (2014).
- Hermanowicz, P. . AtomicJ 2.3.1 User's Manual. , (2021).
- Iwashita, M., et al. Comparative Analysis of Brain Stiffness Among Amniotes Using Glyoxal Fixation and Atomic Force Microscopy. Frontiers in Cell and Developmental Biology. 8, 574619 (2020).
- Crichton, M. L., et al. The viscoelastic, hyperelastic and scale dependent behaviour of freshly excised individual skin layers. Biomaterials. 32 (20), 4670-4681 (2011).
- Puricelli, L., Galluzzi, M., Schulte, C., Podestà, A., Milani, P. Nanomechanical and topographical imaging of living cells by atomic force microscopy with colloidal probes. The Review of Scientific Instruments. 86 (3), 033705 (2015).
- Hermanowicz, P. Determination of Young's modulus of samples of arbitrary thickness from force distance curves: Numerical investigations and simple approximate formulae. International Journal of Mechanical Sciences. 193, 106138 (2021).
- Han, R., Chen, J. A modified Sneddon model for the contact between conical indenters and spherical samples. Journal of Materials Research. 36, 1762-1771 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved