Method Article
Измерение жесткости печени с помощью атомно-силовой микроскопии в сочетании с поляризационной микроскопией
В этой статье
Резюме
Представлен протокол измерения модулей упругости богатых коллагеном участков в нормальной и больной печени с помощью атомно-силовой микроскопии. Одновременное использование поляризационной микроскопии обеспечивает высокую пространственную точность локализации богатых коллагеном участков в отделах печени.
Аннотация
Жесткость матрицы была признана одним из ключевых факторов прогрессирования фиброза печени. Он оказывает глубокое влияние на различные аспекты поведения клеток, такие как функция клеток, дифференцировка и подвижность. Однако, поскольку эти процессы не однородны по всему органу, становится все более важным понимать изменения механических свойств тканей на клеточном уровне.
Чтобы иметь возможность контролировать жесткость богатых коллагеном областей в долях печени, в этой статье представлен протокол измерения модулей упругости тканей печени с высокой пространственной точностью с помощью атомно-силовой микроскопии (AFM). AFM является чувствительным методом с потенциалом для характеристики локальных механических свойств, рассчитанных как модуль Юнга (также называемый упругим). AFM в сочетании с поляризационной микроскопией может быть использован для конкретного определения местоположения областей развития фиброза на основе двулучепреломления коллагеновых волокон в тканях. Используя представленный протокол, мы охарактеризовали жесткость богатых коллагеном участков фиброзной печени мыши и соответствующих участков в печени контрольных мышей.
Заметное увеличение жесткости коллаген-положительных участков наблюдалось при развитии фиброза. Представленный протокол допускает высоковоспроизводимый метод измерения ОВМ, благодаря использованию умеренно фиксированной ткани печени, который может быть использован для дальнейшего понимания инициированных болезнью изменений механических свойств местной ткани и их влияния на судьбу соседних клеток.
Введение
Печень является жизненно важным органом для поддержания гомеостаза в организмах 1,2. Хронические заболевания печени составляют ~ 2 миллиона смертей во всем мире ежегодно3. Они возникают чаще всего как вирусные инфекции, аутоиммунные расстройства, метаболические синдромы или заболевания, связанные со злоупотреблением алкоголем, и сопровождаются прогрессирующим фиброзом печени. Повреждение печени вызывает воспалительную реакцию, которая приводит к активации клеток, откладывающих внеклеточный матрикс (ECM) в реакции заживления ран. Однако при наличии хронического инсульта избыток ECM образует неразрешенную рубцовую ткань внутри печени, что приводит к развитию фиброза печени, цирроза, карциномы печени и, в конечном счете, к печеночной недостаточности4.
Повреждение гепатоцитов сразу же приводит к увеличению жесткости печени 5,6. Это напрямую влияет на функцию гепатоцитов, активирует печеночные звездчатые клетки (ГСК) и портальные фибробласты и приводит к их трансдифференциации к коллагенопонавливающим миофибробластам 7,8. Отложение волокнистого ECM еще больше увеличивает жесткость печени, создавая самоусиливающуюся петлю обратной связи жесткости печени и активацию клеток, продуцирующих матрицу.
Таким образом, жесткость печени стала важным параметром в прогнозе заболеваний печени. Изменение биомеханических свойств тканей может быть обнаружено раньше, чем фиброз может быть диагностирован с помощью гистологического анализа. Поэтому различные методы измерения жесткости печени были разработаны как в исследовательском, так и в клиническом применении. В клинических условиях транзиторная эластография (ТЭ)9,10,11,12,13 и магнитно-резонансная эластография (МРЭ)14,15,16,17,18 были использованы для неинвазивной диагностики ранних стадий повреждения печени путем изучения грубой жесткости печени19.
В ТЭ ультразвуковые волны легкой амплитуды и низкой частоты (50 Гц) распространяются через печень, и измеряется их скорость, которая затем используется для расчета модуля упругоститканей 13. Однако этот метод не полезен для пациентов с асцитом, ожирением или нижними межреберными пространствами из-за неправильной передачи ультразвуковых волн через ткани, окружающие печень9.
MRE основана на методе магнитно-резонансной томографии и использует механические сдвиговые волны 20-200 Гц для нацеливания на печень. Затем специальная последовательность магнитно-резонансной томографии используется для отслеживания волн внутри ткани и расчета жесткости ткани16. Значения жесткости, представленные с помощью методов TE и MRE, хорошо коррелируют со степенью фиброза печени, полученной из биопсии образцов печени человека, ранжированных с использованием гистологических баллов METAVIR20 (таблица 1). TE и MRE также были адаптированы для измерения жесткости печени на моделях грызунов для исследовательских целей 21,22,23. Однако, поскольку оба метода получают значения жесткости из реакции ткани на распространяющиеся волны сдвига, полученные значения могут не отражать абсолютную механическую жесткость ткани.
Для прямой механической характеристики печени грызунов Barnes et al. разработали модельно-гель-тканевый анализ (MGT assay), включающий встраивание ткани печени в полиакриламидный гель24. Этот гель сжимается импульсной равномерной силой, из которой можно рассчитать модуль Юнга. Анализ MGT показывает хорошую корреляцию с анализом углубления, адаптированным как для нормальной, так и для фиброзной печени24 (таблица 1).
Таблица 1: Значения жесткости печени на объемном уровне. TE и MRE по сравнению с прямыми ex vivo механическими измерениями модулей эластичности печени с использованием анализов индументов и MGT для печени из разных источников. Отношение между E и G задается E = 2G (1 + v), где v — отношение Пуассона к выборке; От F0 до F4 представляют собой оценку фиброза в системе оценки METAVIR, при этом F0 обозначает низкий или отсутствующий фиброз и F4 цирротическую печень. Сокращения: TE = переходная эластография; MRE = магнитно-резонансная эластография; MGT = модель-гель-ткань; E = модуль упругости (Юнга); G = модуль сдвига. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Одним из основных недостатков общих измерений жесткости печени является то, что они не обеспечивают разрешение гетерогенности жесткости на клеточном уровне в печени. Во время прогрессирования фиброза богатые коллагеном участки демонстрируют более высокую ригидность по сравнению с окружающей паренхимой25,26. Этот градиент жесткости локально влияет на резидентные клетки и играет важную роль в управлении гетерогенностью HSC27. Таким образом, изменения местных механических свойств при развитии заболевания печени необходимо характеризовать на микроскопическом уровне, чтобы лучше понять прогрессирование фиброза.
AFM позволяет измерять механические свойства ткани с высоким разрешением и высокой чувствительностью к силе. AFM использует наконечник консольного аппарата для отступа поверхности образца с силами до нескольких пиконьютонов, вызывая деформацию на микроскопическом или наноскопическом уровне на основе геометрии и размера используемого наконечника. Затем силовая реакция образца на приложенную деформацию измеряется как отклонение в консольном устройстве28. Кривые смещения силы собираются из приближения и втягивания консольного аппарата, который может быть оснащен соответствующими моделями контактной механики для оценки локальной жесткости образца29.
В дополнение к измерению жесткости данной области, AFM может также предоставлять топографическую информацию о конкретных особенностях в образце, таких как структура коллагеновых волокон 30,31,32. Многочисленные исследования описывали применение AFM для измерения жесткости различных здоровых и больных тканей, таких как кожа32,33, легкие34,35, мозг36, молочныежелезы 37,38,39, хрящ40 или сердце 41,42,43,44 из образцов модели пациентки и мыши. Кроме того, AFM также использовался in vitro для определения жесткости клеток и внеклеточных белковых каркасов 45,46,47.
Измерение механических свойств биологических образцов с помощью ОВМ является нетривиальным из-за их мягкости и хрупкости. Таким образом, различные исследования стандартизировали различные условия и настройки, которые дают широко колеблющиеся значения модулей Юнга (обзор Mckee et al.48). Подобно другим мягким тканям, значения модуля юнга печени при различных степенях фиброза печени также показывают обширные вариации (таблица 2). Различия в значениях модуля Юнга обусловлены различиями в режиме работы АСМ, консольном наконечнике, методе пробоподготовки, толщине образца, глубине и силах углубления, среде тканей печени при измерении и методе анализа (таблица 2).
Таблица 2: Значения жесткости печени на клеточном уровне. Значения жесткости печени, полученные с помощью AFM, описывают механические свойства печени на клеточном уровне. Сокращения: AFM = атомно-силовая микроскопия; E = модуль упругости (Юнга); PFA = параформальдегид; PBS = фосфатно-буферный физиологический раствор. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
В данной работе описан протокол воспроизводимого измерения модулей Юнга богатых коллагеном фиброзных участков в ткани печени методом AFM с точной локализацией, обеспечиваемой использованием поляризационной микроскопии. Мы ввели тетрахлорметан (CCl4), чтобы индуцировать осаждение коллагена центрилобальным способом49 в мышиной модели, надежно имитируя важнейшие аспекты фиброза печени человека50. Поляризованные микроскопические изображения позволяют визуализировать коллаген в печени за счет двулучепреломления коллагеновых волокон51, что позволяет точно позиционировать консольный наконечник над желаемой областью интереса в пределах печеночной дольки52.
протокол
Все эксперименты на животных проводились в соответствии с протоколом на животных, утвержденным Комитетом по уходу за животными Института молекулярной генетики, и в соответствии с Директивой ЕС 2010/63/EU для экспериментов на животных. Общая принципиальная схема представленного протокола показана на рисунке 1.
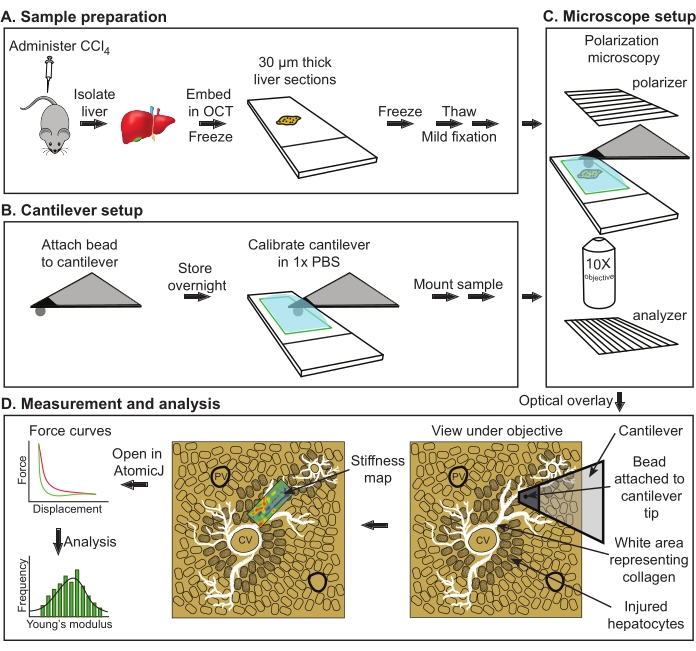
Рисунок 1: Общая схема оценки ОВМ модуля Юнга из печени мышей. (А) Выделение печени от контрольных или обработанных мышей с последующим секционированием и хранением при −80 °C (максимальное хранение, 2 недели). (B) Прикрепление шарообразной бусины к консольному изделию с последующим отверждением клея в течение ночи (слева). Консольная калибровка с последующим монтажом образца (справа). (C) Выравнивание поляризатора и анализатора для визуализации ярких коллагеновых структур с последующим наложением изображения в камере с полем измерения под консолью AFM. D) получение карт жесткости и анализ. Сокращения: AFM = атомно-силовая микроскопия; PBS = фосфатно-буферный физиологический раствор; OCT = оптимальная температура резания соединения; CCl4 = тетрахлорметан. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
1. Пробоподготовка I
- Иссечение печени из вскрытого брюшка мыши, усыпленной вывихом шейки матки под наркозом. Изолируйте левую боковую долю и встройте боковую половину доли в соединение оптимальной температуры резания (OCT) путем быстрой заморозки на сухом льду. Храните внедренную ткань OCT при температуре −80 °C.
ПРИМЕЧАНИЕ: Предыдущие исследования показали, что значения жесткости сходны между замороженными и свежими тканями25,26. - Секция печени толщиной 30 мкм на положительно заряженных слайдах с использованием криотома и храните слайды при температуре −80 °C до дня измерения AFM не более 2 недель.
2. Настройка инструмента
- Крепление шарика 5,7 мкм к консольному наконечнику AFM (Дополнительный рисунок S1, этапы 1-5)
ПРИМЕЧАНИЕ: Прикрепление бусины к консолью также было ранее описано Norman et al.46.- Равномерно распределите суспензию шариков меламиновой смолы диаметром 5,7 мкм на половину площади стеклянного предметного стекла и высушите на воздухе для испарения растворителя (дополнительный рисунок S1, этап 1).
- На другой половине слайда, используя наконечник объемом 10 мкл, сделайте тонкую линию предварительно смешанной эпоксидной смолы с длительным временем работы (дополнительный рисунок S1, шаг 1).
- Загрузите консольный зонд на головку AFM в соответствии с инструкциями производителя.
- Установите затвор и крышку с головкой AFM, оснащенной консольным зондом.
ПРИМЕЧАНИЕ: В исследовании использовался консоль SD-qp-BioT-TL-10. - Поднесите предварительно смешанный клей из эпоксидной смолы к центру слайда и подойдите к клею консолью с малым усилием (установите заданное значение 1 В, чтобы следовать этому протоколу; Дополнительный рисунок S1, шаг 2).
ПРИМЕЧАНИЕ: Прежде чем приблизиться к поверхности слайда, убедитесь, что лазер выровнен по центру кончика консольной консоли, что обозначается высоким суммарным напряжением, выполнив шаги 6-8 в разделе 2, часть 3, Калибровка постоянной пружины консольного устройства AFM. - После того, как кончик консольного зонда соприкоснется с клеем, переместите его чуть выше слайда, чтобы удалить лишний клей.
- Теперь уберите кончик консольного наконечника с слайда и переместите слайд, чтобы привести одну бусину в центр (дополнительный рисунок S1, шаг 3). Снова подойдите к шарику с помощью консольного зонда AFM с более высокой силой (заданное значение 2 В), чтобы прикрепить шарик в центре консольного зонда и оставить его по крайней мере на 10 с (дополнительный рисунок S1, шаг 4).
- Извлеките консольный зонд и держите его в течение ночи при комнатной температуре, чтобы затвердеть клей, или следуйте инструкциям для эпоксидной смолы (дополнительный рисунок S1, шаг 5).
- Настройка поляризатора и анализатора
- Чтобы найти области, представляющие интерес, в пределах отделов печени, установите микроскоп с поляризатором и анализатором. Выровняйте их вибрационные азимуты под углом от 0° до 90° друг к другу, поворачивая один из них по отношению к другому вручную или автоматическим способом, чтобы свести к минимуму пропускаемый свет и максимизировать необычные лучи, проходящие через объект. Убедитесь, что коллагеновые волокна кажутся яркими на темном фоне поляризованного изображения (рисунок 2), что отражается сдвигом пика гистограммы изображения в сторону ярких пикселей.

Рисунок 2: Репрезентативные изображения микроскопии показывают выраженную визуализацию коллагеновых волокон в поляризованной микроскопии по сравнению с изображениями яркого поля. Участки печени мышей, получавших CCl4 в течение 3 недель, подвергали (А) яркой и (В) поляризованной микроскопии. Двулучепреломляющие коллагеновые волокна хорошо видны белым цветом на поляризованных изображениях по сравнению с яркими изображениями. Красное поле представляет богатую коллагеном область, используемую для измерения AFM. Вставки показывают увеличенные виды области в красном поле. Шкала шкалы = 100 мкм. Сокращения: AFM = атомно-силовая микроскопия; CCl4 = тетрахлорметан; CV = центральная вена; PV = портальная жила. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
ПРИМЕЧАНИЕ: Для этого протокола головка AFM может быть установлена на любой подходящий инвертированный микроскоп с возможностью вставки поляризатора и анализатора. Система должна быть размещена в изоляционном блоке для уменьшения фонового шума.
- Калибровка постоянной пружины консольного afm
- Загрузите консольный зонд (подготовленный в соответствии со стадиями 1-8 в разделе 2, часть 1, Прикрепление шарика 5,7 мкм к консольному наконечнику AFM) к головке AFM в соответствии с инструкциями завода-изготовителя.
- Очистите консоль 70% этанолом, чтобы предотвратить загрязнение консольного аппарата во время измерения. Тщательно вымойте дистиллированной водой, чтобы удалить остаточный этанол из наконечника.
- Включите режим контакта и выберите отображение силы в качестве метода измерения.
- Откройте все соответствующие окна (Z Stepper Motors, Motorized Stage Control, Data Viewer, Force Scan Map Oscilloscope, Laser Alignment и Camera window) во вкладках программного обеспечения, нажав на соответствующие кнопки.
- Установите чистый стеклянный слайд, содержащий 1,2 мл 1x фосфат-буферного физиологического раствора (PBS), на площади примерно 2 см х 4 см, очерченной гидрофобной маркерной ручкой. Установите головку AFM на ступень микроскопа и убедитесь, что консоль полностью погружена в PBS.
- Сосредоточьте цель на консольном наконечнике. Уменьшите интенсивность пропускаемого света на микроскопе, чтобы получить лучшее представление о положении лазера на мониторе.
- Направьте лазер на полупрозрачный конец консольного аппарата (под которым прикреплена сферическая бусина) и выровняйте зеркало с помощью ручек на головке AFM, чтобы максимизировать общую интенсивность лазерного луча на детекторе (изображена суммой в окне лазерного выравнивания ).
- Выровняйте фотодиодный детектор с помощью ручек, присутствующих на головке AFM, чтобы расположить лазер в его центре.
- Дайте консолью стабилизироваться в течение 15 минут, прежде чем приступить к калибровке.
- Откройте менеджер калибровки и введите тип консольного устройства, размеры консольного устройства и условия окружающей среды. Откалибруйте постоянную пружины и чувствительность (также известную как обратная оптическая чувствительность рычага, InvOLS), щелкнув Калибровать. Подтвердите точность пружинной константы, полученной после калибровки, декларацией производителя. Калибруйте консоль в бесконтактном режиме (калибровка выполняется программным обеспечением с использованием тепловой теоремы, полученной Sader et al.58).
ПРИМЕЧАНИЕ: Постоянная пружины консольного аппарата представляет собой жесткость консольного аппарата и задается силой сопротивления консольного аппарата при его деформации по длине деформации в единицах Н/м. Чувствительность консольного аппарата отражает значение отклика фотодиода (в вольтах) в ответ на отклонение кантилевера (в нанометрах) и обычно представляется в терминах нм/В59. В бесконтактном режиме спектр теплового шума регистрируется и оснащается гидродинамической функцией60 управляющим программным обеспечением AFM автоматически после калибровки. Фитинг обеспечивает параметры калибровки, а именно постоянную пружины и InvOLS. Пружинная константа консольного аппарата SD-qp-BioT-TL-10, используемого в этом исследовании, составляла 0,09 Н/м, как заявлено производителем.
3. Пробоподготовка II
- Разморозить замороженные срезы (хранить при −80 °C, как описано в Разделе 1, Пробоподготовка I) при комнатной температуре в течение 2 мин.
- Зафиксируйте участки ледяным 4% параформальдегидом (PFA) в 1x PBS в течение 10 мин при 4 °C с последующей тщательной промывкой (5x) с 1x PBS. Протрите остатки PBS вокруг сечения тканью и отметьте границу примерно 2 см х 4 см вокруг участка печени гидрофобной маркерной ручкой. Накройте образец 1x PBS (убедитесь, что разграниченная область содержит ~1,2 мл 1x PBS). Используйте образец для измерений AFM.
ПРИМЕЧАНИЕ: Поскольку ПФА является опасным химическим веществом, с ним необходимо обращаться осторожно, чтобы предотвратить контакт с кожей или глазами. Чтобы избежать токсичных паров, все процедуры, связанные с PFA, должны проводиться в сертифицированном химическом вытяжном шкафу или другой утвержденной вентилируемой зоне.
4. Измерение
- Включите автосохранение, перейдя на вкладку Настройка и поставив галочку на Автосохранение. Укажите имя файла и каталог для сохранения файлов измерений, перейдя на вкладку Настройка и щелкнув Сохранение настроек.
- Загрузите образец (подготовленный в соответствии с Разделом 3, Пробоподготовка II). Подойдите к поверхности ткани с помощью консольного устройства AFM, включив лазер и щелкнув клавишу «Подход ». После того, как наконечник соприкоснется с поверхностью ткани, втяните консольный наконечник так, чтобы наконечник оставался в фокусе объектива (нажав на клавишу втягивания , которая втягивает консоль в верхний конец пьезодиапазона). Перестройте детектор, если лазерное положение удалено от его центра в окне лазерного выравнивания .
- Выключите лазер и наложите на оптическое поле микроскопа карты измерений AFM, щелкнув вкладку «Аксессуары » и выбрав «Прямая оптическая калибровка». В последующем окне нажмите далее , чтобы сделать серию изображений консольного сканирования определенной области. Нажмите кнопку Далее еще раз, чтобы перейти к следующему окну.
- На первом изображении нажмите на центр наконечника консольного устройства вручную, чтобы отобразить положение наконечника в программном обеспечении. Кругом, изображающим положение наконечника, можно манипулировать по размеру, указывая его радиус для повышения точности. Нажмите кнопку «Откалибровать», чтобы автоматически определить положение кончика консоли на всех изображениях. Подтвердите точность обнаружения наконечников, просмотрев изображения.
- Нажмите кнопку Далее , а затем Готово , чтобы завершить оптическое наложение и сохранить серию изображений, полученных во время оптической калибровки.
- Уберите консоль дальше, чтобы избежать столкновения с более высокими поверхностями на слайде. Переместите рабочую область, чтобы поместить богатую коллагеном область внутри зеленого поля, видимого на вкладке Средство просмотра данных , используя поляризованное изображение. Выделите область, богатую коллагеном, сделав прямоугольник вокруг нее долгим нажатием левой кнопки мыши внутри указанного зеленого поля. Определите размеры, ориентацию и разрешение выбранной области на вкладке Сетка слева. Нажмите « Подтвердить новую область сканирования», чтобы установить выбранную область в качестве области измерения.
- Сохраните IGain и PGain-параметры цикла обратной связи при значениях по умолчанию, если не представлены основные неустойчивости в виде сверхчувствительности системы. Чтобы следовать этому протоколу, установите IGain на 50 Гц и PGain на 0,001.
- Установите заданное значение в 1 нН.
ПРИМЕЧАНИЕ: Заданное значение - это сила взаимодействия кончика и поверхности во время стационарного состояния. Для большинства мягких образцов (клеток, гелей и тканей) подходят значения Setpoint в диапазоне 0,5-2,0 нН . - Выберите относительное значение заданного значения в соответствии с механическими свойствами исследуемого материала и жесткостью консольного устройства. Для этого протокола установите значение 5 нН.
ПРИМЕЧАНИЕ: Относительное заданное значение представляет собой максимальную силу взаимодействия, когда достигается пик кривой сила-расстояние и движение наконечника возвращается к базовой линии. Для мягких материалов (1-50 кПа) этот параметр устанавливается в единицах наноньютонов (нН). Более того, для мягкого консольного аппарата (с постоянной пружины от 0,05 Н/м до 0,35 Н/м) максимальное усилие, которое может быть приложено, составляет приблизительно 50 нН. Соответствующим образом настройте значения заданного значения и относительные значения заданной точки .- Убедитесь, что заданное значение заданного значения не приводит к глубине отступа, превышающей радиус сферического индентора, в противном случае поверхность отступа не может быть правильно определена при расчете модуля Юнга. Рассчитать среднее значение глубины отступа после первого прогона отступов; См. Раздел 5, Анализ данных, чтобы узнать, как обрабатывать записанные данные. При необходимости настройте значение заданного значения .
- Установите для параметра Настроить базовую линию значение 5.
ПРИМЕЧАНИЕ: Здесь базовая линия относится к степени полинома, используемой для подгонки подхода и кривых втягивания. Установка базовой линии на 5 соответствует кривым с высоким разрешением и, таким образом, обеспечивает захват фонового шума во время измерений. - Выберите длину консольного движения по оси Z (Z-длина) в соответствии с топографией поверхности образца. Чтобы следовать этому протоколу, установите Z-длину в 15 мкм.
ПРИМЕЧАНИЕ: Высокое значение (например, 15 мкм) снижает чувствительность измерений, но обычно требуется для образцов с очень неровной поверхностью, таких как фиброзная ткань печени. - Установите для параметра Z движение значение Постоянная длительность.
ПРИМЕЧАНИЕ: Движение Z также может быть установлено в постоянную скорость для просмотра данных, относящихся к движению Z (Extend Speed and Extend Time) в другом режиме. - Установите для параметра Время продления значение 1 с. Установите для параметров Задержка расширения и Задержка втягивания значение 0.
ПРИМЕЧАНИЕ: Используйте увеличенные скорости >5,0 мкм/с для очень мягких материалов61, так как более низкие скорости отступа приведут к более вязкой и менее упругой реакции от мягких поверхностей. Задержка расширения и задержка втягивания являются параметрами, которые могут быть использованы для изучения специфического взаимодействия между кончиком консольа и субстратом (например, взаимодействия белков, обездвиженных на поверхности кантилевера, с белками, иммобилизованными на поверхности слайда). - Установите частоту дискретизации 5000 Гц.
ПРИМЕЧАНИЕ: Частота дискретизации относится к частоте точек, которые регистрируются на полной кривой приближения-втягивания. Установите это значение на высокое значение (например, 5000 Гц), чтобы избежать пропуска определенных областей кривых из-за их чрезвычайно быстрого перехода. - Пометьте замкнутый контур Z тиком , чтобы включить систему петли обратной связи, которая обеспечивает непрерывное расстояние между поверхностью образца и консольным наконечником.
- Отключите моторизованную ступень, сняв флажок Engage и Click on Approach , чтобы подойти к образцу с помощью консольного устройства. Нажмите « Начать сканирование», чтобы начать сбор кривых силы-расстояния в области, заданной на шаге 6; Раздел 4, Измерение.
5. Анализ данных
- Анализируйте полученные данные с помощью программного обеспечения с открытым исходным кодом «AtomicJ» (которое можно скачать с https://sourceforge.net/projects/jrobust/).
ПРИМЕЧАНИЕ: Он поддерживает файлы, собранные с Agilent Technologies, JPK Instruments или атомно-силовых микроскопов Bruker. - Загрузите кривые силы в программу, щелкнув по значку кривых силы процесса и карт в AtomicJ (дополнительный рисунок S2A, x). В помощнике по обработке добавьте карты для анализа, нажав на кнопку Добавить (Дополнительный рисунок S2A, y). Нажмите далее после загрузки карт (Дополнительный рисунок S2A, z).
- Укажите параметры обработки в следующем окне в соответствии с описанными ниже шагами (соответствующими шагам на дополнительном рисунке S2B, шаги 1-11):
- Оцените точку контакта между образцом и консолью вручную путем расчета или автоматически с использованием набора параметров кривой подгонки. Чтобы следовать этому протоколу, используйте автоматическую оценку контактной точки.
- Определите точку контакта между консолью и образцом методом классической сфокусированной сетки.
- Выберите метод оценки , чтобы получить наилучшее определение точки контакта на основе качества измеряемых кривых силы, которое необходимо эмпирически определить в ходе оптимизации анализа данных. Чтобы следовать этому протоколу, используйте независимый метод Model.
- Подойдите к кривой отступа силы с помощью классической модели (используйте классический L2 для соответствия модели , чтобы следовать этому протоколу).
ПРИМЕЧАНИЕ: Подгонка модели и оценщик контакта являются параметрами, которые определяют, как кривые устанавливаются программным обеспечением и как точка контакта устанавливается в установленной кривой, соответственно. Для этих измерений использовался классический вариант, который использует регрессию наименьших квадратов. Это обрабатывает каждую точку с низкой силой на кривой как пробную точку контакта и помещает полином в область перед пробной точкой контакта. Затем он подгоняет соответствующую контактную модель к собранным данным о силовом отступе. Точка, дающая наименьшую сумму квадратов, принимается за точку контакта. Другие методы могут быть использованы на основе качества силовых кривых, полученных62,63. - Установите подгонку модели на кривую Withdraw .
- Установите коэффициент Пуассона равным 0,45, как рекомендуется для мягких тканей, таких как печень24.
- Установите подгонку кривой, используя базовую степень 3 и контактную степень 1. Изменение степени подгонки полиномов на основе масштаба отклонений кривых от модели.
- Выберите модель, используемую для соответствия кривым вывода. Используйте модель Снеддона , которая вычисляет модуль Юнга на основе уравнения (1) и уравнения (2):
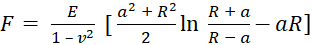 (1)
(1)
δ =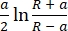 (2)
(2)
где F — сила, E — модуль Юнга, v — отношение Пуассона образца, δ — глубина отступа, a — радиус контакта, R — радиуссферы 62,63. - Заполните радиус сферического наконечника в микрометрах (2,9 мкм в этом протоколе).
- Загрузите константу Spring и InvOLS из файлов данных, включив чтение (установите флажки).
- Нажмите кнопку Готово.
ПРИМЕЧАНИЕ: Анализируемые данные представлены в виде карт вертикального отклонения, высоты, адгезии, контактной силы, деформации, силы сцепления, значенийR2 , наклона, модуля Юнга, отступа перехода, силы перехода и положения контакта, рассчитанных для каждой кривой силы (дополнительный рисунок S3, вверху слева). Два дополнительных окна отображают кривые силы и необработанные значения (дополнительный рисунок S3, верхняя правая и нижняя панели соответственно).
- Исключите силовые кривые, где консоль неправильно приблизилась к поверхности отдела печени. Чтобы идентифицировать их, ищите кривые с высоким уровнем шума, аберрантными формами и/или неполным подходом, как показано на рисунке 3 и подробно рассмотрено в другом месте46.
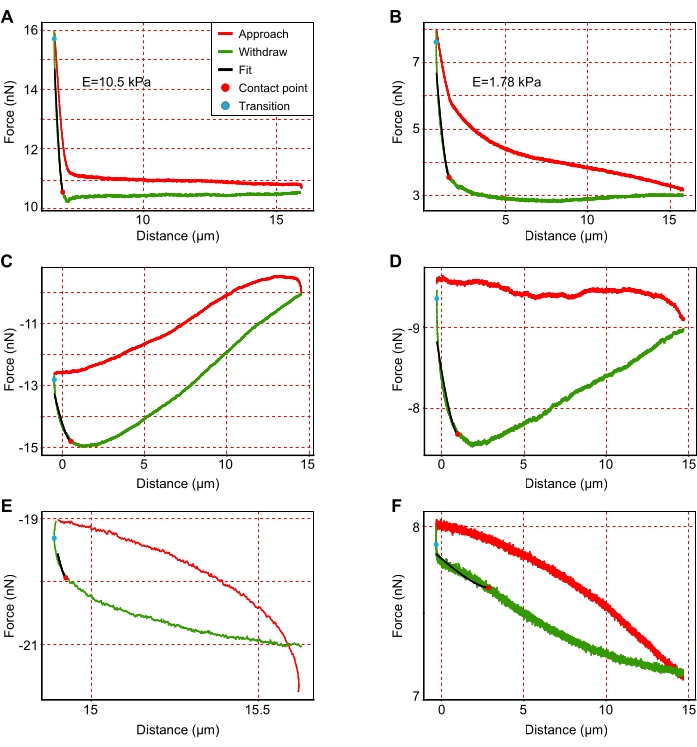
Рисунок 3: Примеры репрезентативных кривых силы-смещения. (A,B) Репрезентативные интерпретируемые кривые силы для более жестких (A; E = 10,5 кПа) и мягче (B; E = 1,78 кПа) области, пригодные для анализа. (С-Ф) Репрезентативные неинтерпретируемые графики, которые необходимо исключить из анализа из-за (C-E) неправильного подхода или (F) более высокого шума. Как указано в легенде, приведенной в пункте (А), красные кривые показывают приближение кантилевера, а зеленые кривые показывают втягивание кантилевера. Черные линии показывают подгонку кривой отвода консольного аппарата. Наклон черных линий соответствует модулю Юнга. Красная и синяя точки соответствуют точке контакта и точке перехода соответственно. Точка контакта является последней точкой контакта между консолью и субстратом во время втягивания, в то время как точка перехода описывает переход консольного от приближения к втягиванию. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Умеренно фиксированные участки печени толщиной 30 мкм, полученные от контрольных мышей и у мышей с легким или прогрессирующим фиброзом (индуцированные инъекцией CCl4 в течение 3 недель или 6 недель, соответственно49), исследовали с помощью ОВМ, как описано в этом протоколе. Коллагеновые волокна вблизи центральных вен были выбраны для измерения карт жесткости. Области, близкие к центральным венам, которые соответствуют областям, где обычно образуются коллагеновые волокна у животных, обработанных CCl4, были проанализированы в контрольной печени (рисунок 4A). Распределение модулей Юнга было воспроизводимым по различным контрольным печенкам и богатым коллагеном областям в пределах одного участка печени (рисунок 4B: левый скрипичный график).
У животных, обработанных CCl4, карты жесткости, соответствующие перицентральным областям отложений коллагена, показали значительно более высокие значения модулей Юнга по сравнению с эквивалентными областями у контрольных мышей (Рисунок 4B: 1,9 кПа против 2,6 кПа медианных значений модуля Юнга для контроля по сравнению с 3 неделями CCl4-обработанной мышью; p = 0,07; 1,9 кПа против 5,1 кПа медианных значений модуля Юнга для контроля против 6 недель CCl4 - обработанная мышь; p = 0,02). Кроме того, наблюдалось значительное увеличение значений модулей Юнга при более длительном лечении CCl4 (Рисунок 4B; 2,6 кПа против 5,1 кПа медианных значений модуля Юнга за 3 недели против 6 недель CCl4-обработанной мыши; p = 0,04). Это показывает постепенное жесткость отложений коллагена с прогрессированием фиброза и то, что измерения AFM отражают фиброгенез.
Чтобы оценить влияние длительного хранения ОКТ-встроенных участков печени на механические свойства коллагеновых волокон, мы измерили жесткость коллагеновых волокон в секциях мышей, обработанных CCl4, которые хранились при −80 °C в течение 2 недель или 3 месяцев на слайде после резки (рисунок 5). Измерения AFM показали значительно более низкие значения модулей Юнга в богатых коллагеном областях для участков, хранящихся в течение 3 месяцев, по сравнению с теми, которые были получены из секций, измеренных в течение 2 недель после секционирования образца (рисунок 5; 4,7 кПа против 3,6 кПа медианных значений модуля Юнга в течение 2 недель против 3 месяцев хранения; p < 0,001). Таким образом, важно измерить механические свойства ткани печени вскоре после того, как срезы получены из ОКТ-встроенных долей печени.
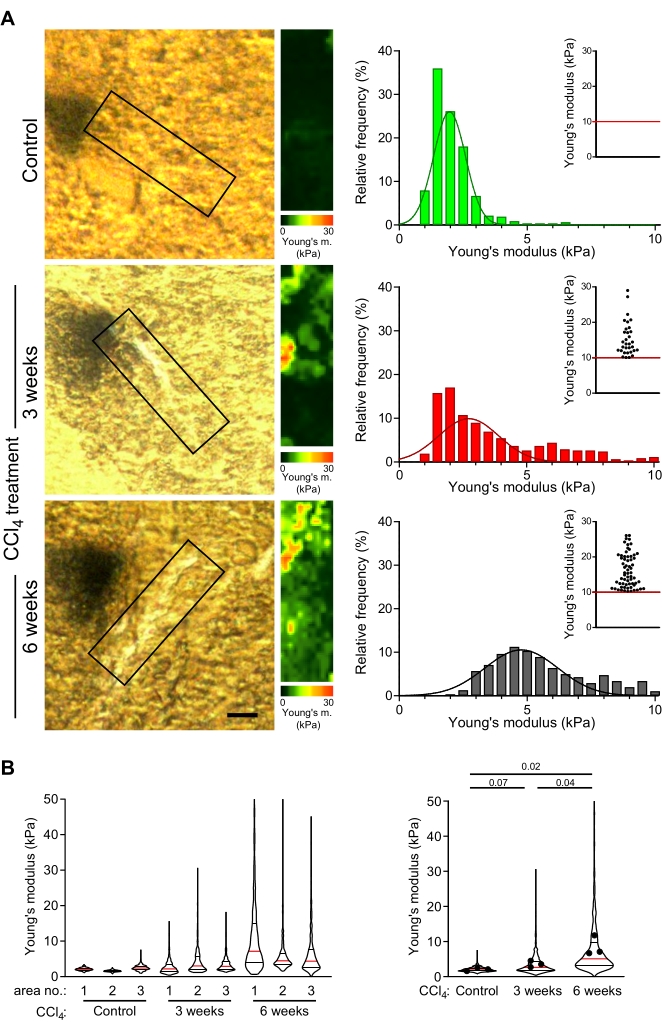
Рисунок 4: Измерения AFM показывают прогрессирующую жесткость областей, богатых коллагеном, коррелирующих с длительным лечением CCl4 . (A) Участки печени контрольных мышей и мышей, получавших CCl4 в течение 3 недель или 6 недель, использовались для измерения механических свойств областей, богатых коллагеном. Коробочные области участков печени, показанные на поляризованных микроскопических изображениях (слева), представляют собой богатые коллагеном области сканирования (или соответствующие области в контрольной печени), выбранные для измерений AFM (30 мкм x 100 мкм, 10 пикселей x 36 пикселей). Справа показаны карты модуля Юнга с цветовыми шкалами, соответствующими этим коробочным областям, включая гистограммы значений модуля Юнга из этих карт; Точечные диаграммы врезок показывают значения >10 кПа для каждого условия. Жесткость печени визуализируется как постепенное смещение вправо в распределении гистограммы и более высокая частота точек на шкале рассеяния вставки. Шкала = 20 мкм. (B) Скрипичные графики показывают распределение модулей упругости из трех областей, измеренных для каждого условия (слева) и суммированные значения модулей упругости из всех трех карт (справа). Скрипичные графики показывают медиану (красная линия),25-й процентиль и 75-й процентиль (черные линии); точки представляют собой средние значения отдельных карт из районов 1-3. Представленные p-значения были рассчитаны с использованием t-теста студента, выполненного на средних. Сокращения: AFM = атомно-силовая микроскопия; CCl4 = тетрахлорметан. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
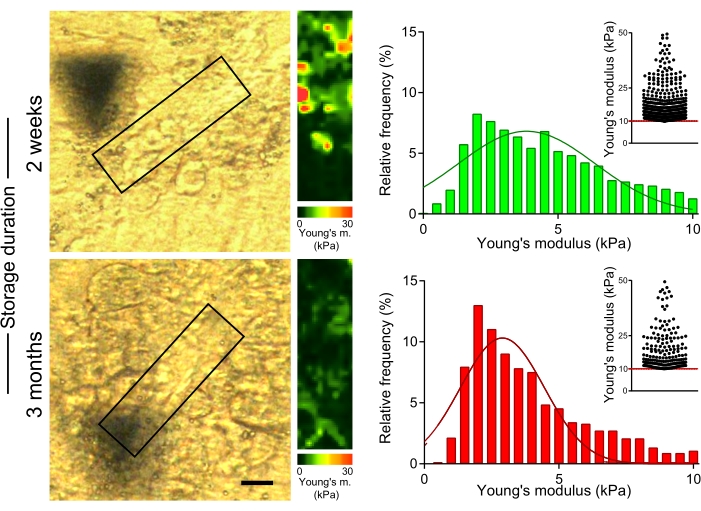
Рисунок 5: Длительное хранение участков печени приводит к снижению жесткости участков, богатых коллагеном. Срезы печени (приготовленные из мышей, получавших CCl4 в течение 2 недель), хранимые при -80 °C в течение 2 недель или 3 месяцев, использовались для измерения модуля Юнга. Изображения поляризованной микроскопии (слева) с полями, указывающими богатые коллагеном области, используемые для измерения AFM (30 мкм x 100 мкм, 10 пикселей x 36 пикселей). Соответствующие карты модуля Юнга с цветовыми шкалами (справа). Гистограммы показывают значения модуля Юнга, собранные из 4-6 областей в каждом образце; Точечные диаграммы врезок показывают значения >10 кПа для каждого условия. Шкала бар = 20 мкм. Сокращения: AFM = атомно-силовая микроскопия; CCl4 = тетрахлорметан. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок S1: Способ модификации консольного аппарата микрошарикой из меламиновой смолы. (A) Нарисованная схема иллюстрирует прикрепление сферической бусины к кончику консольного аппарата. Для пошагового описания см. Раздел 2, Часть 1, Прикрепление шарика 5,7 мкм к консольному наконечнику AFM. (B) Микроскопическое изображение сферической бусины размером 5,7 мкм, прикрепленной к консольному наконечнику, показанное сверху (слева) и сбоку (справа). Шкала стержней = 20 мкм. Сокращения: AFM = атомно-силовая микроскопия; RT = комнатная температура. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S2: Анализ данных в AtomicJ. (A) Последовательность шагов, которые необходимо выполнить для открытия карт жесткости в AtomicJ. Один щелчок левой кнопкой мыши по кривым силы процесса и картам (x) открывает помощника по обработке. Файлы можно загрузить в помощник по обработке , нажав на добавить (y) и выбрав необходимые файлы. Нажмите на следующий (z), чтобы перейти к следующему шагу. (B) Параметры для подгонки кривых, соответствующая модель контактной механики и настройки AFM, используемые во время измерения. Шаги 1-11 относятся к соответствующим подпунктам, подробно описанным в протоколе шаг 3, раздел 5, анализ данных. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок S3: Описание анализируемых данных в AtomicJ. Предварительный просмотр проанализированных данных показывает карты жесткости (верхнее левое окно), кривые силы (верхнее правое окно) и необработанные данные (нижнее окно). Аббревиатура: AFM = атомно-силовая микроскопия. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Представленный протокол обеспечивает пошаговый воспроизводимый метод измерения ОВМ нормальной и фиброзной ткани печени мыши. Связанная поляризационная микроскопия обеспечивает высокую пространственную точность и позволяет визуализировать коллагеновые волокна благодаря их двулучепреломлению. Далее приводится подробное описание анализа полученных силовых кривых. Измерение жесткости АСМ может быть выполнено на клеточном уровне, что позволяет контролировать местные изменения механических свойств ткани печени из-за развития фиброзного заболевания. Фиброз печени не является однородным процессом, затрагивающим весь орган. Напротив, области богатых коллагеном фиброзных перегородок перемежаются с областями с низкими или отсутствующими коллагеновыми отложениями. Таким образом, изменения жесткости специфичны для местного микроокружения и влияют только на клетки, локально контактирующие с областями, поврежденными травмой. Этот микромасштаб гетерогенности жесткости также очевиден в деталях карт модуля AFM Янга, где точки высокой жесткости граничат с областями почти нормальной жесткости. Это изменение показывает, что даже коллагеновая область рубцовой ткани не является механически однородной и требует, чтобы измерение AFM было охарактеризовано на клеточном уровне (рисунок 4).
Представленный протокол позволяет измерять жесткость печени с помощью AFM независимо от сбора печени, так как целые доли печени, встроенные в OCT, могут храниться в течение длительного периода при -80 °C. Однако, как только ткань разделена, мы рекомендуем измерять образцы в течение ~ 2 недель, поскольку мы наблюдали постепенное размягчение участков ткани, хранящихся в течение более длительных периодов времени (рисунок 5).
AFM, оснащенный поляризационной микроскопией, позволяет точно определить область интереса в структуре дольков печени. Тем не менее, он также имеет некоторые ограничения, которые необходимо учитывать при интерпретации результатов. Полученные здесь значения жесткости измерялись при комнатной температуре. Предположим, что влияние температуры на механические свойства мягких тканей будет небольшим; однако это может быть одной из причин различий между сообщенными in vivo значениями механических свойств тканей печени и значениями в этом исследовании.
Кроме того, этот протокол позволяет проводить АСМ-анализ ткани печени в течение 3 ч, что требует легкой фиксации ткани. Легкая фиксация участков тканей, а также цикл замораживания-оттаивания, скорее всего, повлияют на абсолютные значения модуля Юнга. Таким образом, сообщаемые значения модулей Юнга могут отличаться от значений in vivo . Необходимы дальнейшие исследования для оптимизации протокола измерения абсолютных значений модуля Юнга от срезов печени, что может быть достигнуто другим методом фиксации печеночной ткани64.
Тем не менее, мы наблюдали увеличение жесткости богатых коллагеном областей в печени мышей, получавших CCl4 в течение 3 недель по сравнению с 6 неделями. Такие изменения соответствуют прогрессированию фиброза во время длительного повреждения (рисунок 4) и показывают, что относительные различия могут быть исследованы между различными методами лечения с использованием представленного протокола. Это согласуется с наблюдениями Calò et al., которые показали, что умеренно фиксированные участки печени показывают аналогичные различия в значениях жесткости между областями, богатыми коллагеном и не имеющими коллагена, как и в свежих тканях25.
Мы использовали консоль SD-qp-BioT-TL-10 (теоретическая пружинная константа ~ 0,09 Н/м), модифицированную сферическим наконечником диаметром 5,7 мкм, чтобы свести к минимуму механическое разрушение ткани печени во время измерений. Шарик размером 5,7 мкм позволил достаточное углубление образца для проверки его жесткости при сохранении его целостности. Шарик с меньшим диаметром может быть использован после нескольких оптимизаций для получения более высокого разрешения в картах жесткости, но может привести к дальнейшей переоценке значений модуля Юнга (для получения более подробной информации см. Crichton et al.65). Используя указанный консольно-шариковый ансамбль, мы смогли охарактеризовать жесткость образца в широком диапазоне, от десятков единиц Па до ~100 кПа.
Модель Снеддона была использована для получения модуля Юнга из кривых силы, поскольку она позволяет анализировать глубокие углубления с коллоидными зондами62. Модель Снеддона, в отличие от модели Герца, не страдает от ограничения, что радиус контакта должен быть намного меньше радиуса сферы. Далее предполагается, что толщина образца в несколько раз превышает глубину отступа 30,66. В настоящем исследовании углубление составляло ~2 мкм при размере шарика 5,7 мкм и толщине образца 30 мкм в областях, богатых коллагеном; таким образом, модель Снеддона была уместной. Другие модели63, учитывающие силу адгезии между наконечником и подложкой, могут быть использованы для различных типов тканей.
Анализ в AtomicJ реализует поправки на конечную толщину образцов, чтобы минимизировать вклад подложки при получении модуля Юнга62,67. При анализе полученных силовых кривых мы использовали один коэффициент Пуассона 0,45, который ранее был рекомендован для органов мягких тканей24. Это приближение не оказывает существенного влияния на расчетные значения модуля Юнга, так как изменение значения коэффициента Пуассона от 0,4 до 0,5 приводит лишь к уменьшению в 0,893 раза значений модуля Юнга, рассчитанных по уравнению Снеддона. Учитывая многократные различия в модуле Юнга между различными длительностямиобработки CCl 4, ошибки, возникающие при аппроксимации соотношения Пуассона, являются лишь незначительными.
Мы использовали кривые вывода для расчета значений жесткости, так как нас интересовала упругая реакция ткани на нагрузку, обеспечиваемую консолью, а не пластическая реакция на отступ68. Из-за вязкоупругогого отклика мягких тканей кривые посадки могут переоценить модуль Юнга, что следует иметь в виду. Кроме того, мы заметили, что анализ данных с кривыми подхода дает аналогичные тенденции в значениях жесткости между фиброзной и контрольной областями, хотя абсолютные значения соответственно ниже (данные не показаны).
Оптимизируя протокол, мы определили несколько шагов, критически важных для воспроизводимости измерений. Во-первых, важно убедиться, что шарик находится примерно в центре полупрозрачного наконечника при прикреплении к консолью. Это предотвращает возможный механический дисбаланс во время углубления. Во-вторых, во время фиксации печени при ПФА необходимо строго соблюдать временные рамки оттаивания и фиксации. Изменение сроков этого этапа может серьезно повлиять на механические свойства срезов ткани. В-третьих, консольный станок должен быть многократно откалиброван с непрерывным мониторингом и вводом одновременных значений температуры, чтобы избежать каких-либо артефактов, возникающих в значениях жесткости из-за колебаний температуры. Наконец, один участок печени не следует измерять более 3 ч после приготовления, так как наложенный PBS может испаряться в течение более длительных периодов времени. Читатели могут обратиться к таблице устранения неполадок (таблица 3) для решения проблем, возникших во время измерения AFM, также обсуждаемой в Norman et al.46.
Таблица 3: Руководство по устранению неполадок. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Представленный протокол допускает воспроизводимое ОВМ-зондирование ткани печени. Он может раскрыть информацию о развитии и возможной регрессии фиброзного заболевания печени на микроскопическом уровне и может способствовать разработке методов лечения, нацеленных на фиброзные рубцовые области, образующиеся во время прогрессирования хронического заболевания печени.
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Эта работа была поддержана Грантовым агентством Чешской Республики (18-02699S), Институциональным исследовательским проектом Чешской академии наук (RVO 68378050) и проектом MEYS CR NICR EXCELES (LX22NPO05102). CIISB, Instruct-CZ Центр консорциума Instruct-ERIC EU, финансируемый инфраструктурным проектом MEYS CR LM2018127 и Европейским фондом регионального развития-проектом «UP CIISB» (No. CZ.02.1.01/0.0/0.0/18_046/0015974) оказал финансовую поддержку измерениям в CF Nanobiotechnology, CEITEC MU. Мы также выражаем признательность Центру световой микроскопии, IMG CAS, Прага, Чешская Республика, при поддержке MEYS (LM2018129, CZ.02.1.01/0.0/0.0/18_046/0016045) и RVO: 68378050-KAV-NPUI, за их поддержку с помощью микроскопической визуализации, представленной здесь.
Материалы
| Name | Company | Catalog Number | Comments |
| AFM head | Bruker | JPK nanowizard 3 | |
| Cameras | Andor | Zyla 5.5 USB (sCMOS, water cooled) | |
| The Imagingsource | S/N:12310015 | ||
| Cantilever | SD-qp-BioT-TL-10, Nanosensors | S/N:73750F05 | |
| Cryotome | Leica | CM1950 | |
| Epoxy resin glue (Long working time ) | Bison epoxy universal | ||
| Melamine beads; diameter, 5.7 um | Microparticles, GmbH | MF-R-5.7 | |
| Microscope | Olympus | IX81 | |
| Hydrophobic slide marker | SuperHT | PAP PEN | |
| Software | JPK nanowizard v6.1.151 | ||
| AtomicJ v2.3.1 | |||
| Superfrost slides | Thermoscientific | ref no. J1800AMNZ | |
| System | Ubuntu 14.04.5 LTS | ||
| Vibration isolation control unit | Tablestable | AVI-200-S |
Ссылки
- vanden Berghe, G. The role of the liver in metabolic homeostasis: Implications for inborn errors of metabolism. Journal of Inherited Metabolic Dis. 14 (4), 407-420 (1991).
- Stanger, B. Z. Cellular homeostasis and repair in the mammalian liver. Annual Reviews of Physiology. 77, 179-200 (2015).
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Hernandez-Gea, V., Friedman, S. L. Pathogenesis of liver fibrosis. Annual Review of Pathology. 6, 425-456 (2011).
- Georges, P. C., et al. Increased stiffness of the rat liver precedes matrix deposition: Implications for fibrosis. American Journal of Physiology. Gastrointestinal and Liver Physiology. 293 (6), 1147-1154 (2007).
- Perepelyuk, M., et al. Hepatic stellate cells and portal fibroblasts are the major cellular sources of collagens and lysyl oxidases in normal liver and early after injury. American Journal of Physiology. Gastrointestinal and Liver Physiology. 304 (6), 605-614 (2013).
- Wells, R. G. The role of matrix stiffness in regulating cell behavior. Hepatology. 47 (5), 1394-1400 (2008).
- Olsen, A. L., et al. Hepatic stellate cells require a stiff environment for myofibroblastic differentiation. American Journal of Physiology. Gastrointestinal and Liver Physiology. 301 (1), 110-118 (2011).
- Sandrin, L., et al. Transient elastography: A new noninvasive method for assessment of hepatic fibrosis. Ultrasound in Medicine & Biology. 29 (12), 1705-1713 (2003).
- Ling, W., et al. Effects of vascularity and differentiation of hepatocellular carcinoma on tumor and liver stiffness: In vivo and in vitro studies. Ultrasound in Medicine & Biology. 40 (4), 739-746 (2014).
- Wong, V. W. S., et al. Diagnosis of fibrosis and cirrhosis using liver stiffness measurement in nonalcoholic fatty liver disease. Hepatology. 51 (2), 454-462 (2010).
- Cha, S. W., et al. Nondiseased liver stiffness measured by shearwave elastography a pilot study. Journal of Ultrasound in Medicine. 33 (1), 53-60 (2014).
- Castera, L., Forns, X., Alberti, A. Non-invasive evaluation of liver fibrosis using transient elastography. Journal of Hepatology. 48 (5), 835-847 (2008).
- Chang, W., et al. Liver fibrosis staging with MR elastography: Comparison of diagnostic performance between patients with chronic hepatitis B and those with other etiologic causes. Radiology. 280 (1), 88-97 (2016).
- Venkatesh, S. K., Yin, M., Ehman, R. L. Magnetic resonance elastography of liver: Clinical applications. Journal of Computer Assisted Tomography. 37 (6), 887-896 (2013).
- Venkatesh, S. K., Yin, M., Ehman, R. L. Magnetic resonance elastography of liver: Technique, analysis and clinical applications. Journal of Magnetic Resonance Imaging. 37 (3), 544-555 (2013).
- Venkatesh, S. K., Wang, G., Teo, L. L. S., Ang, B. W. L. Magnetic resonance elastography of liver in healthy Asians: Normal liver stiffness quantification and reproducibility assessment. Journal of Magnetic Resonance Imaging. 39 (1), 1-8 (2014).
- Lee, D. H., Lee, J. M., Han, J. K., Choi, B. I. MR elastography of healthy liver parenchyma: Normal value and reliability of the liver stiffness value measurement. Journal of Magnetic Resonance Imaging. 38 (5), 1215-1223 (2013).
- Mueller, S. Liver stiffness: A novel parameter for the diagnosis of liver disease. Hepatic Medicine. Evidence and Research. 2, 49-67 (2010).
- Goodman, Z. D. Grading and staging systems for inflammation and fibrosis in chronic liver diseases. Journal of Hepatology. 47 (4), 598-607 (2007).
- Salameh, N., et al. Hepatic viscoelastic parameters measured with MR elastography: Correlations with quantitative analysis of liver fibrosis in the rat. Journal of Magnetic Resonance Imaging. 26 (4), 956-962 (2007).
- Yin, M., et al. Quantitative assessment of hepatic fibrosis in an animal model with magnetic resonance elastography. Magnetic Resonance in Medicine. 58 (2), 346-353 (2007).
- Bastard, C., et al. Transient micro-elastography: A novel non-invasive approach to measure liver stiffness in mice. World Journal of Gastroenterology. 17 (8), 968-975 (2011).
- Barnes, S. L., Lyshchik, A., Washington, M. K., Gore, J. C., Miga, M. I. Development of a mechanical testing assay for fibrotic murine liver. Medical Physics. 34 (11), 4439-4450 (2007).
- Calò, A., et al. Spatial mapping of the collagen distribution in human and mouse tissues by force volume atomic force microscopy. Scientific Reports. 10, 15664 (2020).
- Desai, S. S., et al. Physiological ranges of matrix rigidity modulate primary mouse hepatocyte function in part through hepatocyte nuclear factor 4 alpha. Hepatology. 64 (1), 261-275 (2016).
- Kostallari, E., et al. Stiffness is associated with hepatic stellate cell heterogeneity during liver fibrosis. American Journal of Physiology. Gastrointestinal and Liver Physiology. 322 (2), 234-246 (2022).
- Binnig, G., Qaute, C. F., Gerber, C. Atomic force microscope. Physical Review Letters. 56 (9), (1986).
- Johnson, K. L. . Contact Mechanics. , (1985).
- Asgari, M., Latifi, N., Giovanniello, F., Espinosa, H. D., Amabili, M. Revealing layer-specific ultrastructure and nanomechanics of fibrillar collagen in human aorta via atomic force microscopy testing: Implications on tissue mechanics at macroscopic scale. Advanced NanoBiomed Research. 2 (5), 2100159 (2022).
- Amabili, M., et al. Microstructural and mechanical characterization of the layers of human descending thoracic aortas. Acta Biomaterialia. 134, 401-421 (2021).
- Grant, C. A., Twigg, P. C., Tobin, D. J. Static and dynamic nanomechanical properties of human skin tissue using atomic force microscopy: Effect of scarring in the upper dermis. Acta Biomaterialia. 8 (11), 4123-4129 (2012).
- Geerligs, M., et al. In vitro indentation to determine the mechanical properties of epidermis. Journal of Biomechanics. 44 (6), 1176-1181 (2011).
- Liu, F., Tschumperlin, D. J. Micro-mechanical characterization of lung tissue using atomic force microscopy. Journal of Visualized Experiments. (54), e2911 (2011).
- Sicard, D., Fredenburgh, L. E., Tschumperlin, D. J. Measured pulmonary arterial tissue stiffness is highly sensitive to AFM indenter dimensions. Journal of the Mechanical Behavior of Biomedical Materials. 74, 118-127 (2017).
- Babu, P. K. V., Radmacher, M. Mechanics of brain tissues studied by atomic force microscopy: A perspective. Frontiers in Neuroscience. 13, 600 (2019).
- del Mar Vivanco, M. . Mammary Stem Cells: Methods and protocols. , (2015).
- Zanetti-Dällenbach, R., et al. Length scale matters: Real-time elastography versus nanomechanical profiling by atomic force microscopy for the diagnosis of breast lesions. Biomed Research International. 2018, 3840597 (2018).
- Lopez, J. I., Kang, I., You, W. -. K., McDonald, D. M., Weaver, V. M. In situ force mapping of mammary gland transformation. Integrative Biology. 3 (9), 910-921 (2011).
- Stolz, M., et al. Early detection of aging cartilage and osteoarthritis in mice and patient samples using atomic force microscopy. Nature Nanotechnol. 4 (3), 186-192 (2009).
- Borin, D., Pecorari, I., Pena, B., Sbaizero, O. Novel insights into cardiomyocytes provided by atomic force microscopy. Seminars in Cell & Developmental Biology. 73, 4-12 (2018).
- Lachaize, V., et al. Atomic Force Microscopy: An innovative technology to explore cardiomyocyte cell surface in cardiac physio/pathophysiology. Letters in Applied NanoBioScience. 4 (4), 321-324 (2015).
- Lieber, S. C., et al. Aging increases stiffness of cardiac myocytes measured by atomic force microscopy nanoindentation. American Journal of Physiology. Heart and Circulatory Physiology. 287 (2), 645-651 (2004).
- Guedes, A. F., et al. Atomic force microscopy as a tool to evaluate the risk of cardiovascular diseases in patients. Nature Nanotechnology. 11 (8), 687-692 (2016).
- Zhu, Y., Dong, Z., Wejinya, U. C., Jin, S., Ye, K. Determination of mechanical properties of soft tissue scaffolds by atomic force microscopy nanoindentation. Journal of Biomechanics. 44 (13), 2356-2361 (2011).
- Norman, M. D. A., Ferreira, S. A., Jowett, G. M., Bozec, L., Gentleman, E. Measuring the elastic modulus of soft culture surfaces and three-dimensional hydrogels using atomic force microscopy. Nature Protocols. 16 (5), 2418-2449 (2021).
- Thomas, G., Burnham, N. A., Camesano, T. A., Wen, Q. Measuring the mechanical properties of living cells using atomic force microscopy. Journal of Visualized Experiments. (76), e50497 (2013).
- McKee, C. T., Last, J. A., Russell, P., Murphy, C. J. Indentation versus tensile measurements of Young's modulus for soft biological tissues. Tissue Engineering. Part B, Reviews. 17 (3), 155-164 (2011).
- Scholten, D., Trebicka, J., Liedtke, C., Weiskirchen, R. The carbon tetrachloride model in mice. Laboratory Animals. 49, 4-11 (2015).
- Nevzorova, Y. A., Boyer-Diaz, Z., Cubero, F. J., Gracia-Sancho, J. Animal models for liver disease - A practical approach for translational research. Journal of Hepatology. 73 (2), 423-440 (2020).
- Ribeiro, J. F., dos Anjos, E. H. M., Mello, M. L. S., de Campos Vidal, B. Skin collagen fiber molecular order: A pattern of distributional fiber orientation as assessed by optical anisotropy and image analysis. PLoS One. 8 (1), 54724 (2013).
- Ozkan, A., et al. The influence of chronic liver diseases on hepatic vasculature: A liver-on-a-chip review. Micromachines. 11 (5), 487 (2020).
- Guimarães, C. F., Gasperini, L., Marques, A. P., Reis, R. L. The stiffness of living tissues and its implications for tissue engineering. Nature Reviews Materials. 5, 351-370 (2020).
- Khajehahmadi, Z., et al. Liver stiffness correlates with serum osteopontin and TAZ expression in human liver cirrhosis. Annals of the New York Academy of Sciences. 1465 (1), 117-131 (2020).
- Tian, M., et al. The nanomechanical signature of liver cancer tissues and its molecular origin. Nanoscale. 7 (30), 12998-13010 (2015).
- Zhao, G., et al. Mechanical stiffness of liver tissues in relation to integrin β1 expression may influence the development of hepatic cirrhosis and hepatocellular carcinoma. Journal of Surgical Oncology. 102 (5), 482-489 (2010).
- Gang, Z., Qi, Q., Jing, C., Wang, C. Measuring microenvironment mechanical stress of rat liver during diethylnitrosamine induced hepatocarcinogenesis by atomic force microscope. Microscopy Research and Technique. 72 (9), 672-678 (2009).
- Sader, J. E., et al. Spring constant calibration of atomic force microscope cantilevers of arbitrary shape. The Review of Scientific Instruments. 83 (10), 103705 (2012).
- JPK Instruments. A practical guide to AFM force spectroscopy and data analysis. JPK Instruments Technical Note. JPK Instruments. , 1-8 (2016).
- van Eysden, C. A., Sader, J. E. Frequency response of cantilever beams immersed in viscous fluids. Journal of Applied Physics. 101, 044908 (2015).
- Kim, Y., Yang, Y. I., Choi, I., Yi, J. Dependence of approaching velocity on the force-distance curve in AFM analysis. Korean Journal of Chemical Engineering. 27, 324-327 (2010).
- Hermanowicz, P., Sarna, M., Burda, K., Gabryś, H. AtomicJ: An open source software for analysis of force curves. The Review of Scientific Instruments. 85 (6), 063703 (2014).
- Hermanowicz, P. . AtomicJ 2.3.1 User's Manual. , (2021).
- Iwashita, M., et al. Comparative Analysis of Brain Stiffness Among Amniotes Using Glyoxal Fixation and Atomic Force Microscopy. Frontiers in Cell and Developmental Biology. 8, 574619 (2020).
- Crichton, M. L., et al. The viscoelastic, hyperelastic and scale dependent behaviour of freshly excised individual skin layers. Biomaterials. 32 (20), 4670-4681 (2011).
- Puricelli, L., Galluzzi, M., Schulte, C., Podestà, A., Milani, P. Nanomechanical and topographical imaging of living cells by atomic force microscopy with colloidal probes. The Review of Scientific Instruments. 86 (3), 033705 (2015).
- Hermanowicz, P. Determination of Young's modulus of samples of arbitrary thickness from force distance curves: Numerical investigations and simple approximate formulae. International Journal of Mechanical Sciences. 193, 106138 (2021).
- Han, R., Chen, J. A modified Sneddon model for the contact between conical indenters and spherical samples. Journal of Materials Research. 36, 1762-1771 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены