Method Article
Polarizasyon Mikroskobu ile Birleştirilmiş Atomik Kuvvet Mikroskobu Kullanılarak Karaciğer Sertliğinin Ölçülmesi
Bu Makalede
Özet
Normal ve hastalıklı karaciğerde kollajen bakımından zengin alanların elastik modüllerini atomik kuvvet mikroskobu kullanarak ölçmek için bir protokol sunuyoruz. Polarizasyon mikroskobunun eşzamanlı kullanımı, karaciğer bölümlerinde kollajen bakımından zengin alanların lokalizasyonu için yüksek mekansal hassasiyet sağlar.
Özet
Matriks sertleşmesi, karaciğer fibrozisinin ilerlemesinin temel itici güçlerinden biri olarak kabul edilmiştir. Hücre fonksiyonu, farklılaşma ve hareketlilik gibi hücre davranışının çeşitli yönleri üzerinde derin etkileri vardır. Bununla birlikte, bu süreçler tüm organ boyunca homojen olmadığından, dokuların hücresel düzeyde mekanik özelliklerindeki değişiklikleri anlamak giderek daha önemli hale gelmiştir.
Karaciğer loblarındaki kollajen bakımından zengin alanların sertleşmesini izleyebilmek için, bu makale karaciğer dokusu elastik modüllerini atomik kuvvet mikroskobu (AFM) ile yüksek uzamsal hassasiyetle ölçmek için bir protokol sunmaktadır. AFM, Young'ın (elastik olarak da adlandırılır) modülü olarak hesaplanan yerel mekanik özellikleri karakterize etme potansiyeline sahip hassas bir yöntemdir. AFM, polarizasyon mikroskobu ile birleştiğinde, dokulardaki kollajen liflerinin birefringansına dayanan fibroz gelişim alanlarını spesifik olarak bulmak için kullanılabilir. Sunulan protokolü kullanarak, fibrotik fare karaciğerlerinden ve kontrol farelerinin karaciğerlerindeki karşılık gelen alanlardan kollajen bakımından zengin alanların sertliğini karakterize ettik.
Fibroz gelişimi ile kollajen pozitif alanların sertliğinde belirgin bir artış gözlendi. Sunulan protokol, hafif sabit karaciğer dokusunun kullanımı nedeniyle, lokal doku mekanik özelliklerinde hastalık tarafından başlatılan değişikliklerin ve bunların komşu hücrelerin kaderi üzerindeki etkilerinin daha iyi anlaşılması için kullanılabilecek, yüksek oranda tekrarlanabilir bir AFM ölçüm yöntemine izin verir.
Giriş
Karaciğer, organizmalarda homeostazı korumak için hayati bir organdır 1,2. Kronik karaciğer hastalıkları dünya çapında yılda ~ 2 milyon ölümden sorumludur3. En sık viral enfeksiyonlar, otoimmün bozukluklar, metabolik sendromlar veya alkol kötüye kullanımı ile ilişkili hastalıklar olarak ortaya çıkarlar ve ilerleyici karaciğer fibrozisi eşlik ederler. Karaciğer hasarı, yara iyileşmesi yanıtında hücre dışı matriks (ECM) biriktiren hücrelerin aktivasyonuna yol açan enflamatuar bir yanıt ortaya çıkarır. Bununla birlikte, kronik bir hakaret varlığında, aşırı ECM karaciğerde çözülmemiş skar dokusu oluşturur ve karaciğer fibrozu, siroz, karaciğer karsinomu ve nihayetinde karaciğer yetmezliğinin gelişmesine yol açar4.
Hepatosit hasarı hemen artmış karaciğer sertliğiile sonuçlanır 5,6. Bu, hepatosit fonksiyonunu doğrudan etkiler, hepatik yıldız hücrelerini (HSC'ler) ve portal fibroblastları aktive eder ve kollajen biriktiren miyofibroblastlara transdiferansiyasyonlarıyla sonuçlanır 7,8. Fibröz ECM'nin birikmesi, karaciğer sertliğini daha da arttırır ve karaciğer sertleşmesi ve matris üreten hücre aktivasyonunun kendiliğinden güçlenen bir geri besleme döngüsü oluşturur.
Bu nedenle karaciğer sertliği karaciğer hastalığı prognozunda önemli bir parametre haline gelmiştir. Biyomekanik doku özelliklerindeki değişiklik, fibrozisin histolojik analiz ile teşhis edilebilmesinden daha erken tespit edilebilir. Bu nedenle, karaciğer sertliği ölçümü için hem araştırma hem de klinik uygulamalarda çeşitli teknikler geliştirilmiştir. Klinik ortamlarda, geçici elastografi (TE)9,10,11,12,13 ve manyetik rezonans elastografi (MRE)14,15,16,17,18, brüt karaciğer sertliğini inceleyerek karaciğer hasarının erken evrelerini non-invaziv olarak teşhis etmek için kullanılmıştır 19.
TE'de, hafif genlikli ve düşük frekanslı (50 Hz) ultrason dalgaları karaciğerden yayılır ve hızları ölçülür, bu da daha sonra doku elastik modülü13'ü hesaplamak için kullanılır. Bununla birlikte, bu teknik, ultrason dalgalarının karaciğeri çevreleyen dokulardan yanlış iletilmesi nedeniyle asit, obezite veya daha düşük interkostal boşlukları olan hastalar için yararlı değildir9.
MRE, manyetik rezonans görüntüleme yöntemine dayanır ve karaciğeri hedeflemek için 20-200 Hz mekanik kesme dalgaları kullanır. Daha sonra doku içindeki dalgaları izlemek ve doku sertliğini hesaplamak için spesifik bir manyetik rezonans görüntüleme dizisi kullanılır16. Hem TE hem de MRE teknikleri ile bildirilen sertlik değerleri, histolojik METAVIR skorları20 kullanılarak sıralanan insan karaciğer örneklerinin biyopsilerinden elde edilen karaciğer fibrozisinin derecesi ile iyi korelasyon göstermektedir (Tablo 1). TE ve MRE ayrıca araştırma amaçlı kemirgen modellerinde karaciğer sertliğinin ölçülmesi için uyarlanmıştır21,22,23. Bununla birlikte, her iki yöntem de sertlik değerlerini dokunun yayılan kesme dalgalarına verdiği tepkiden türettiği için, elde edilen değerler dokunun mutlak mekanik sertliğini yansıtmayabilir.
Kemirgen karaciğerlerinin doğrudan mekanik karakterizasyonu için Barnes ve ark., karaciğer dokusunun poliakrilamid jel24'e gömülmesini içeren bir model-jel-doku testi (MGT testi) geliştirmiştir. Bu jel, Young modülünün hesaplanabileceği darbeli bir üniform kuvvetle sıkıştırılır. MGT testi, hem normal hem de fibrotik karaciğerler için uyarlanmış bir girinti testi ile iyi bir korelasyon göstermektedir24 (Tablo 1).
Tablo 1: Toplu düzeyde karaciğer sertlik değerleri. TE ve MRE, farklı kaynaklardan gelen karaciğerler için girinti ve MGT testleri kullanılarak karaciğer elastik modüllerinin doğrudan ex vivo mekanik ölçümleriyle karşılaştırılmıştır. E ve G arasındaki ilişki E = 2G (1 + v) ile verilir, burada v , Poisson'un numunenin oranıdır; F0 ila F4, METAVIR skorlama sistemindeki fibroz skorunu temsil eder, F0 düşük fibroz veya hiç fibroz ve F4 sirotik karaciğerleri gösterir. Kısaltmalar: TE = geçici elastografi; MRE = manyetik rezonans elastografi; MGT = model-jel-doku; E = elastik (Young's) modülü; G = kesme modülü. Bu tabloyu indirmek için lütfen tıklayınız.
Jenerik karaciğer sertliği ölçümlerinin en büyük dezavantajlarından biri, karaciğerdeki sertlik heterojenliğinin hücresel düzeyde çözünürlüğünü sağlamamalarıdır. Fibrozisin ilerlemesi sırasında, kollajen bakımından zengin alanlar, çevredeki parankim 25,26'ya kıyasla daha yüksek sertlik gösterir. Bu sertlik gradyanı lokal olarak yerleşik hücreleri etkiler ve HSC heterojenitesinin yönlendirilmesinde önemli bir rol oynar27. Bu nedenle, karaciğer hastalığı gelişimi sırasında lokal mekanik özelliklerdeki değişikliklerin, fibroz progresyonunu daha iyi anlamak için mikroskobik düzeyde karakterize edilmesi gerekir.
AFM, dokunun mekanik özelliklerinin yüksek çözünürlük ve yüksek kuvvet hassasiyeti ile ölçülmesini sağlar. AFM, bir numunenin yüzeyini birkaç pikonewton kadar düşük kuvvetlerle girintilemek için bir konsol ucunu kullanır ve kullanılan ucun geometrisine ve boyutuna bağlı olarak mikroskobik veya nanoskopik düzeyde bir deformasyona neden olur. Numunenin uygulanan gerinime kuvvet tepkisi daha sonra konsol28'deki sapma olarak ölçülür. Kuvvet-yer değiştirme eğrileri, numunenin yerel sertliğini değerlendirmek için uygun temas mekaniği modelleriyle donatılabilen konsol29'un yaklaşımından ve geri çekilmesinden toplanır.
Belirli bir alanın sertliğini ölçmenin yanı sıra, AFM, kollajen liflerinin yapısı30,31,32 gibi numunedeki belirli özellikler hakkında topografik bilgiler de sağlayabilir. Birçok çalışma, hem hasta hem de fare model örneklerinden cilt 32,33, akciğer 34,35, beyin 36, meme37,38,39, kıkırdak 40 veya kalp 41,42,43,44 gibi çeşitli sağlıklı ve hastalıklı dokuların sertliğini ölçmek için AFM'nin uygulanmasını tanımlamıştır. Ayrıca, AFM, hücrelerin sertliğini ve hücre dışı protein iskeleleri45,46,47'yi belirlemek için in vitro olarak da kullanılmıştır.
AFM kullanılarak biyolojik numunelerin mekanik özelliklerinin ölçülmesi, yumuşaklıkları ve kırılganlıkları nedeniyle önemsiz değildir. Bu nedenle, çeşitli çalışmalar, Young modüllerinin geniş çapta dalgalanan değerlerini veren farklı koşulları ve ortamları standartlaştırmıştır (Mckee ve ark.48 tarafından gözden geçirilmiştir). Diğer yumuşak dokulara benzer şekilde, karaciğer fibrozisinin farklı derecelerindeki karaciğer Young modül değerleri de geniş farklılıklar göstermektedir (Tablo 2). Young modül değerlerindeki farklılıklar AFM çalışma modu, konsol ucu, numune hazırlama yöntemi, numune kalınlığı, girinti derinliği ve kuvvetleri, ölçüm sırasında karaciğer dokusu ortamı ve analiz yöntemindeki farklılıklardan kaynaklanmaktadır (Tablo 2).
Tablo 2: Hücresel düzeyde karaciğer sertlik değerleri. AFM kullanılarak elde edilen karaciğer sertliği değerleri, karaciğerin hücresel düzeyde mekanik özelliklerini tanımlar. Kısaltmalar: AFM = atomik kuvvet mikroskobu; E = elastik (Young's) modülü; PFA = paraformaldehit; PBS = fosfat tamponlu salin. Bu tabloyu indirmek için lütfen tıklayınız.
Bu yazıda, Young'ın karaciğer dokusundaki kollajen bakımından zengin fibrotik alanların modüllerinin AFM ile tekrarlanabilir ölçümü için polarizasyon mikroskobu kullanılarak sağlanan kesin bir lokalizasyon ile bir protokol açıklanmaktadır. Bir fare modelinde sentrilobuler bir tarzda49 kollajen birikimini indüklemek için karbon tetraklorür (CCl4 ) uyguladık ve insan karaciğer fibrozu50'nin önemli yönlerini güvenilir bir şekilde taklit ettik. Polarize mikroskobik görüntüler, kollajen liflerinin birefringencesi nedeniyle karaciğerdeki kollajenin görselleştirilmesini sağlar51, bu da konsol ucunun hepatik lobül52 içindeki istenen ilgi alanı üzerinde doğru bir şekilde konumlandırılmasını sağlar.
Protokol
Tüm hayvan deneyleri, Moleküler Genetik Enstitüsü Hayvan Bakım Komitesi tarafından onaylanan bir hayvan protokolüne ve hayvan deneyleri için AB Direktifi 2010/63/EU'ya göre gerçekleştirilmiştir. Sunulan protokolün genel şematik diyagramı Şekil 1'de gösterilmiştir.
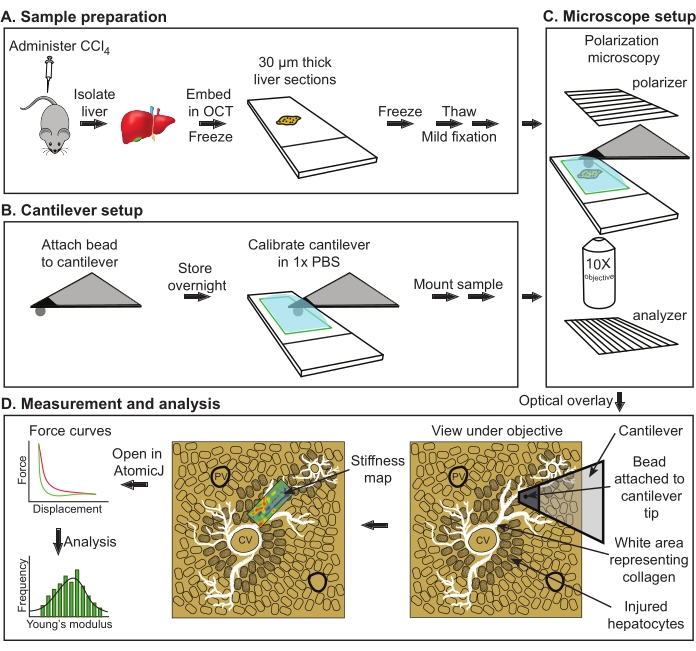
Şekil 1: Young modülünün fare karaciğerlerinden AFM değerlendirmesinin genel şeması. (A) Karaciğerin kontrol veya tedavi edilen farelerden izole edilmesi, ardından -80 ° C'de kesitleme ve depolama (maksimum depolama, 2 hafta). (B) Küresel boncuğun konsola tutturulması ve daha sonra tutkalın gece boyunca kürlenmesi (solda). Konsol kalibrasyonu ve ardından numune montajı (sağda). (C) Parlak kollajen yapılarını görselleştirmek için polarizörün ve analizörün hizalanması, ardından kameradaki görüntünün AFM konsolunun altındaki ölçüm alanıyla kaplanması. (D) Sertlik haritalarının alınması ve analizi. Kısaltmalar: AFM = atomik kuvvet mikroskobu; PBS = fosfat tamponlu salin; OCT = optimum kesme sıcaklığı bileşiği; CCl4 = karbon tetraklorür. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
1. Numune hazırlama I
- Karaciğeri, anestezi altında servikal çıkık ile ötenazi yapılan bir farenin açık karnından çıkarın. Sol lateral lobu izole edin ve kuru buz üzerinde hızlı dondurma ile lobun lateral yarısını optimum kesme sıcaklığı (OCT) bileşiğine gömün. OCT'ye gömülü dokuyu -80 °C'de saklayın.
NOT: Önceki çalışmalar, dondurulmuş ve taze dokular arasında sertlik değerlerinin benzer olduğunu göstermiştir25,26. - Bölüm 30 μm kalınlığında karaciğer kesitleri, bir kriyotom kullanarak pozitif yüklü slaytlar üzerine yerleştirilir ve slaytları AFM ölçüm gününe kadar -80 ° C'de saklar.
2. Cihazın ayarlanması
- AFM konsol ucuna 5,7 μm'lik bir boncuğun takılması (Ek Şekil S1, adım 1-5)
NOT: Boncuğun konsola tutturulması daha önce Norman ve ark.46 tarafından da tanımlanmıştır.- 5.7 μm çapında melamin reçine boncuklarının süspansiyonunu bir cam sürgü alanının yarısına eşit olarak yayın ve çözücüyü buharlaştırmak için hava ile kurutun (Ek Şekil S1, adım 1).
- Slaytın diğer yarısında, 10 μL'lik bir uç kullanarak, uzun bir çalışma süresine sahip ince bir önceden karıştırılmış epoksi reçine çizgisi yapın (Ek Şekil S1, adım 1).
- Konsol probunu üreticinin talimatlarına göre AFM kafasına yükleyin.
- Sürgüyü ve kapağı, konsol probu ile donatılmış AFM kafasıyla monte edin.
NOT: Çalışmada SD-qp-BioT-TL-10 konsol kullanılmıştır. - Önceden karıştırılmış epoksi reçine yapıştırıcısını slaytın merkezine getirin ve tutkala konsolla düşük bir kuvvetle yaklaşın (bu protokolü takip etmek için bir ayar noktasını 1 V'a ayarlayın; Ek Şekil S1, adım 2).
NOT: Sürgü yüzeyine yaklaşmadan önce, lazerin konsol ucunun merkezinde hizalandığından ve AFM konsolunun yay sabitinin kalibrasyonu Bölüm 2, Bölüm 3, Bölüm 6-8'deki adımları izleyerek yüksek toplam voltajla gösterildiğinden emin olun. - Konsol probunun ucu tutkalla temas ettikten sonra, fazla yapıştırıcıyı çıkarmak için sürgüyü hemen üzerinde hareket ettirin.
- Şimdi, konsol ucunu slayttan geri çekin ve ortasına tek bir boncuk getirmek için slaytı hareket ettirin (Ek Şekil S1, adım 3). Boncuğu konsol probunun ortasına tutturmak ve en az 10 s bekletmek için daha yüksek bir kuvvetle (ayar noktası 2 V) AFM konsol probu ile boncuğa tekrar yaklaşın (Ek Şekil S1, adım 4).
- Konsol probunu çıkarın ve yapıştırıcıyı sertleştirmek için gece boyunca oda sıcaklığında tutun veya epoksi reçinesi için talimatları izleyin (Ek Şekil S1, adım 5).
- Polarizör ve analizörün kurulması
- Karaciğer kesitlerindeki ilgi alanlarını bulmak için, mikroskopu polarizör ve analizör ile kurun. İletilen ışığı en aza indirmek ve hedeften geçen olağanüstü ışınları en üst düzeye çıkarmak için titreşim azimutlarını 0° ile 90° arasında bir açıyla birbirlerine göre manuel olarak veya otomatik bir şekilde döndürerek birbirlerine hizalayın. Kollajen liflerinin, görüntü histogramının tepe noktasının parlak piksellere doğru kaymasıyla yansıtılan polarize görüntüdeki koyu renkli bir arka plana karşı parlak göründüğünden emin olun (Şekil 2).

Şekil 2: Temsili mikroskopi görüntüleri, polarize mikroskopide kollajen liflerinin parlak alan görüntülerine kıyasla belirgin bir şekilde görselleştirildiğini göstermektedir. CCl4 ile 3 hafta boyunca tedavi edilen farelerden alınan karaciğer kesitleri (A) parlak alan ve (B) polarize mikroskopiye tabi tutuldu. Birefringent kollajen lifleri, parlak alan görüntülerine kıyasla polarize görüntülerde beyaz renkte açıkça görülebilir. Kırmızı kutu, AFM ölçümü için kullanılan kolajen bakımından zengin alanı temsil eder. Kümeler, kırmızı kutudaki alanın yakınlaştırılmış görünümlerini gösterir. Ölçek çubuğu = 100 μm. Kısaltmalar: AFM = atomik kuvvet mikroskobu; CCl4 = karbon tetraklorür; CV = merkezi damar; PV = portal ven. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
NOT: Bu protokol için, AFM kafası, bir polarizör ve bir analizör yerleştirme imkanı ile uygun herhangi bir ters çevrilmiş mikroskopa monte edilebilir. Arka plan gürültüsünü azaltmak için sistem bir izolasyon ünitesine yerleştirilmelidir.
- AFM konsolunun yay sabitinin kalibrasyonu
- Konsol probunu (Bölüm 2, Bölüm 1, 5,7 μm'lik bir boncuğun AFM konsol ucuna tutturulması) 1-8. adımlara göre hazırlanmış) üreticinin talimatlarına göre AFM kafasına yükleyin.
- Ölçüm sırasında konsol kontaminasyonunu önlemek için konsol %70 etanol ile temizleyin. Artık etanolün ucundan uzaklaştırılması için damıtılmış suyla iyice yıkayın.
- Temas modunu etkinleştirin ve ölçüm yöntemi olarak kuvvet eşlemeyi seçin.
- İlgili düğmelere tıklayarak yazılım sekmelerinde ilgili tüm pencereleri (Z Step Motors, Motorized Stage Control, Data Viewer, Force Scan Map Osiloscope, Laser Alignment ve Kamera penceresi) açın.
- 1,2 mL 1x fosfat tamponlu salin (PBS) içeren temiz bir cam kaydırağı, hidrofobik bir işaretleyici kalemle çizilmiş yaklaşık 2 cm x 4 cm'lik bir alana monte edin. AFM kafasını mikroskop aşamasına monte edin ve konsol PBS'ye tamamen daldırıldığından emin olun.
- Hedefi konsol ucuna odaklayın. Monitördeki lazer pozisyonunu daha iyi görebilmek için mikroskopta iletilen ışığın yoğunluğunu azaltın.
- Lazeri konsol üzerindeki yarı saydam ucuna (küresel boncuğun takılı) hedefleyin ve dedektördeki lazer ışınının toplam yoğunluğunu en üst düzeye çıkarmak için AFM kafasındaki düğmeleri kullanarak aynayı hizalayın (Lazer Hizalama penceresindeki toplamla gösterilir).
- Lazeri merkezine konumlandırmak için AFM kafasında bulunan düğmeleri kullanarak fotodiyot dedektörünü hizalayın.
- Kalibrasyona devam etmeden önce konsol 15 dakika boyunca stabilize olsun.
- Kalibrasyon yöneticisini açın ve konsol türünü, konsol boyutlarını ve çevresel koşulları ekleyin. Kalibre Et'e tıklayarak yay sabitini ve hassasiyetini (ters optik kol hassasiyeti, InvOLS olarak da bilinir) kalibre edin. Kalibrasyondan sonra elde edilen yay sabitinin doğruluğunu üreticinin beyanı ile onaylayın. Konsolu temassız modda kalibre edin (kalibrasyon, Sader ve ark.58 tarafından türetilen termal teorem kullanılarak yazılım tarafından gerçekleştirilir).
NOT: Konsol yay sabiti, konsol sertliğini temsil eder ve N / m cinsinden deformasyon uzunluğu başına deforme olurken konsol direnç kuvveti tarafından verilir. Konsol hassasiyeti, konsol sapmasına (nanometre cinsinden) yanıt olarak fotodiyot tepkisinin değerini (volt cinsinden) gösterir ve genellikle nm / V59 cinsinden sunulur. Temassız modda, termal gürültü spektrumu kaydedilir ve kalibrasyondan sonra otomatik olarak AFM kontrol yazılımı tarafından hidrodinamik fonksiyon60 ile donatılmıştır. Bağlantı elemanı, kalibrasyon parametrelerini, yani yay sabitini ve InvOLS'yi sağlar. Bu çalışmada kullanılan SD-qp-BioT-TL-10 konsolunun yay sabiti, üretici tarafından beyan edildiği gibi 0.09 N / m idi.
3. Numune hazırlama II
- Dondurulmuş bölümleri (Bölüm 1, Numune hazırlama I'de açıklandığı gibi -80 °C'de saklanır) oda sıcaklığında 2 dakika boyunca çözün.
- Buz gibi soğuk% 4 paraformaldehit (PFA) içeren bölümleri 4 ° C'de 10 dakika boyunca 1x PBS'de sabitleyin, ardından 1x PBS ile kapsamlı yıkama (5x). Bölümün etrafındaki artık PBS'yi bir mendille silin ve karaciğer bölümünün etrafında yaklaşık 2 cm x 4 cm'lik bir sınırı hidrofobik bir işaretleyici kalemle işaretleyin. Numuneyi 1x PBS ile örtün (sınırlandırılmış alanın ~1,2 mL 1x PBS içerdiğinden emin olun). AFM ölçümleri için numuneyi kullanın.
NOT: PFA tehlikeli bir kimyasal olduğundan, cilt veya gözlerle teması önlemek için dikkatle kullanılmalıdır. Zehirli dumanlarından kaçınmak için, PFA içeren tüm prosedürler sertifikalı bir kimyasal duman davlumbazında veya başka bir onaylı havalandırmalı alanda gerçekleştirilmelidir.
4. Ölçüm
- Kurulum sekmesine gidip Otomatik Kaydet'te onay işareti yaparak otomatik kaydetmeyi etkinleştirin. Kurulum sekmesine gidip Ayarları Kaydetme'ye tıklayarak ölçüm dosyalarını kaydetmek için dosya adını ve dizini belirtin.
- Numuneyi yükleyin (Bölüm 3, Numune hazırlama II'ye göre hazırlanmıştır). Lazeri açıp Yaklaşım tuşuna tıklayarak AFM konsoluyla doku yüzeyine yaklaşın . Uç doku yüzeyi ile temas ettikten sonra, konsol ucunu hedefin odağında kalacak şekilde geri çekin (konsolu piezo aralığının üst ucuna geri çeken Geri Çekme tuşuna tıklayarak). Lazer konumu Lazer Hizalama penceresindeki merkezinden uzaklaştırılırsa dedektörü yeniden hizalayın .
- Lazeri kapatın ve mikroskopun optik alanını AFM ölçüm haritalarıyla kaplayın, Aksesuarlar sekmesine tıklayın ve ardından Doğrudan Bindirme Optik Kalibrasyonu'nu seçin. Sonraki pencerede, belirli bir alanı tarayan konsol görüntüsünün bir dizi görüntüsünü çekmek için İleri'ye tıklayın. Sonraki pencereye gitmek için İleri'yi tekrar tıklatın.
- İlk görüntüde, yazılımdaki uç konumunu göstermek için konsol ucunun ucunun ortasına manuel olarak tıklayın. Uç konumunu gösteren daire, doğruluğu artırmak için Yarıçapı belirtilerek boyut olarak manipüle edilebilir. Tüm görüntülerde konsol ucu konumunu otomatik olarak algılamak için Kalibre Et'i tıklatın. Görüntüleri inceleyerek uç algılamanın doğruluğunu onaylayın.
- Optik bindirmeyi tamamlamak ve optik kalibrasyon sırasında yakalanan görüntü serisini kaydetmek için İleri'yi ve ardından Son'u tıklatın.
- Kızaktaki daha yüksek yüzeylerle çarpışmasını önlemek için konsolunu daha da geri çekin. Polarize görüntüyü kullanarak Veri Görüntüleyicisi sekmesinde görünen yeşil kutunun içine kolajen bakımından zengin bir alan yerleştirmek için sahne alanını hareket ettirin. Belirtilen yeşil kutunun içindeki sol fare düğmesine uzun basarak etrafında bir dikdörtgen oluşturarak kolajen bakımından zengin alanı seçin. Sol taraftaki Kılavuz sekmesi altında seçili alanın boyutlarını, yönünü ve çözünürlüğünü tanımlayın. Seçilen alanı ölçüm alanı olarak ayarlamak için Yeni Tarama Bölgesini Onayla'ya tıklayın.
- Geri besleme döngüsünün IGain ve PGain parametrelerini varsayılan değerlerde tutun, eğer sistem aşırı duyarlılığı şeklinde önemli bir kararsızlık sunulmazsa. Bu protokolü takip etmek için IGain'i 50 Hz'de ve PGain'i 0,001'de ayarlayın.
- Ayar Noktası'nı 1 nN'ye ayarlayın.
NOT: Ayar noktası, durağan durum sırasında uç-yüzey etkileşiminin kuvvetidir. Çoğu yumuşak numune (hücreler, jeller ve dokular) için, 0,5-2,0 nN aralığındaki Ayar noktası değerleri uygundur. - İncelenen malzemenin mekanik özelliklerine ve konsol sertliğine göre Göreceli Ayar Noktası Değeri'ni seçin. Bu protokol için değeri 5 nN olarak ayarlayın.
NOT: Göreli ayar noktası, kuvvet-mesafe eğrisinin zirvesine ulaşıldığında ve uç hareketi taban çizgisine döndüğünde, maksimum etkileşim kuvvetini temsil eder. Yumuşak malzemeler (1-50 kPa) için, bu parametre nanonewton (nN) birimlerinde ayarlanır. Ayrıca, yumuşak bir konsol için (0,05 N / m ila 0,35 N / m arasında bir yay sabiti ile), uygulanabilecek maksimum kuvvet yaklaşık 50 nN'dir. Ayar Noktası ve Göreli Ayar Noktası Değerlerini buna göre ayarlayın.- Verilen ayar noktası değerinin, küresel girintinin yarıçapından daha büyük bir girinti derinliğine yol açmadığından emin olun, aksi takdirde girinti yüzeyi Young modülünün hesaplanmasında düzgün bir şekilde tanımlanamaz. Girintilerin ilk çalıştırılmasından sonra girinti derinliğinin ortalama değerini hesaplayın; Kaydedilen verilerin nasıl işleneceğini öğrenmek için Bölüm 5, Veri analizi'ne bakın. Gerekirse Ayar Noktası Değeri'ni ayarlayın.
- Taban Çizgisini Ayarla'yı 5 olarak ayarlayın.
NOT: Burada, Taban Çizgisi , yaklaşımı uygulamak ve eğrileri geri çekmek için kullanılan polinomun derecesini ifade eder. Taban çizgisini 5 olarak ayarlamak, eğrileri yüksek çözünürlüğe sığdırır ve böylece ölçümler sırasında arka plan gürültüsünün yakalanmasını sağlar. - Numunenin yüzey topografyasına göre Z eksenindeki konsol hareketinin uzunluğunu (Z uzunluğu) seçin. Bu protokolü takip etmek için Z uzunluğunu 15 μm'ye ayarlayın.
NOT: Yüksek bir değer (örneğin 15 μm) ölçüm hassasiyetini azaltır, ancak genellikle fibrotik karaciğer dokusu gibi oldukça düzensiz bir yüzeye sahip numuneler için gereklidir. - Z hareketini Sabit Süre olarak ayarlayın.
NOT: Z hareketi, farklı bir modda Z hareketine (Hızı Uzat ve Süreyi Uzat) başvuran verileri görüntülemek için Sabit hız olarak da ayarlanabilir. - Uzatma Süresi'ni 1 sn'ye ayarlayın. Uzatma Gecikmesi ve Geri Çekme Gecikmesi'ni 0 olarak ayarlayın.
NOT: Çok yumuşak malzemeler için >5,0 μm/sn uzatma hızları kullanın61, çünkü daha düşük girinti hızları yumuşak yüzeylerden daha viskoz ve daha az elastik bir tepki ile sonuçlanacaktır. Uzatma Gecikmesi ve Geri Çekme Gecikmesi , konsol ucu ve substrat arasındaki spesifik etkileşimi incelemek için kullanılabilecek parametrelerdir (örneğin, konsol yüzeyinde hareketsiz hale getirilmiş bir proteinin, slayt yüzeyinde hareketsiz hale getirilmiş proteinlerle etkileşimleri). - Örnekleme Hızı'nı 5000 Hz olarak ayarlayın.
NOT: Örnekleme Hızı, tam bir yaklaşım-geri çekilme eğrisine kaydedilen noktaların sıklığını ifade eder. Son derece hızlı geçişleri nedeniyle eğrilerin belirli bölgelerini kaçırmamak için bunu yüksek bir değere (örneğin 5000 Hz) ayarlayın. - Numune yüzeyi ile konsol ucu arasında kirlilik mesafesi sağlayan bir geri besleme döngüsü sistemini etkinleştirmek için Z Kapalı Döngüsünü bir Kene ile işaretleyin.
- Örneğe konsolla yaklaşmak için Engage ( Devreye Sok) seçimini kaldırarak motorlu sahnenin bağlantısını kesin ve Yaklaşım'a tıklayın. Adım 6'da ayarlanan alanda kuvvet-mesafe eğrilerini toplamaya başlamak için Taramayı Başlat'a tıklayın; Bölüm 4, Ölçüm.
5. Veri analizi
- Elde edilen verileri açık kaynaklı yazılım "AtomicJ" (https://sourceforge.net/projects/jrobust/'den indirilebilir) kullanarak analiz edin.
NOT: Agilent Technologies, JPK Instruments veya Bruker atomik kuvvet mikroskoplarından toplanan dosyaları destekler. - AtomicJ'deki işlem kuvveti eğrileri ve haritalar simgesine tıklayarak kuvvet eğrilerini programa yükleyin (Ek Şekil S2A, x). İşlem yardımcısında, Ekle düğmesine tıklayarak analiz edilecek haritaları ekleyin (Ek Şekil S2A, y). Haritalar yüklendikten sonra İleri'ye tıklayın (Ek Şekil S2A, z).
- Bir sonraki pencerede işleme ayarlarını aşağıda açıklanan adımlara göre belirtin ( Ek Şekil S2B, adım 1-11'deki adımlara karşılık gelir):
- Numune ile konsol arasındaki temas noktasını manuel olarak veya bir dizi montaj eğrisi parametresi kullanarak otomatik olarak tahmin edin. Bu protokolü takip etmek için, temas noktasının otomatik tahminini kullanın.
- Klasik odaklı ızgara yöntemi ile konsol ve numune arasındaki temas noktasını belirleyin.
- Veri analizinin optimizasyonu sırasında ampirik olarak belirlenmesi gereken ölçülen kuvvet eğrilerinin kalitesine bağlı olarak temas noktasının en iyi şekilde belirlenmesini sağlamak için tahmin yöntemini seçin. Bu protokolü izlemek için Modelden bağımsız yöntemi kullanın.
- Klasik bir model kullanarak kuvvet girinti eğrisini sığdırın (bu protokolü takip etmek üzere modele uyması için Klasik L2'yi kullanın).
NOT: Model sığdırma ve Temas tahmincisi, sırasıyla eğrilerin yazılım tarafından nasıl takıldığını ve temas noktasının takılı eğride nasıl kurulduğunu yöneten parametrelerdir. Bu ölçümler için, en küçük kareler regresyonunu kullanan Klasik seçenek kullanılmıştır. Bu, eğri üzerindeki her düşük kuvvet noktasını bir deneme temas noktası olarak işler ve deneme temas noktasından önce bölgeye bir polinom sığdırır. Daha sonra toplanan kuvvet girinti verilerine uygun temas modelini sığdırır. En düşük kare toplamını veren nokta, temas noktası olarak kabul edilir. 62,63 elde edilen kuvvet eğrilerinin kalitesine göre diğer yöntemler kullanılabilir. - Modelin uyumunu Para Çekme eğrisine ayarlayın.
- Poisson oranını, karaciğer 24 gibi yumuşak dokular için önerildiği gibi 0.45 olarak ayarlayın.
- Eğrinin uyumunu 3 taban çizgisi derecesi ve temas içi derecesi 1 kullanarak ayarlayın. Eğrilerin modelden sapmalarının ölçeğine bağlı olarak polinom uyum derecesini değiştirin.
- Para çekme eğrilerine uymak için kullanılan modeli seçin. Young modülünü denklem (1) ve denklem (2)'ye göre hesaplayan Sneddon modelini kullanın:
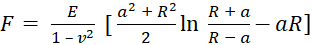 (1)
(1)
δ =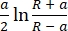 (2)
(2)
burada F kuvvettir, E Young'ın modülüdür, v numunenin Poisson oranıdır, δ girinti derinliğidir, a temas yarıçapıdır ve R küre yarıçapı62,63'tür. - Küresel ucun yarıçapını mikrometre cinsinden doldurun (bu protokolde 2,9 μm ).
- Okumayı etkinleştirerek Spring sabitini ve InvOLS'yi veri dosyalarından yükleyin (kutuları işaretleyin).
- Son'a tıklayın.
NOT: Analiz edilen veriler, her kuvvet eğrisi için hesaplanan dikey sapma, yükseklik, yapışma, temas kuvveti, deformasyon, yapışma kuvveti, R2 değerleri, eğim, Young modülü, geçiş girintisi, geçiş kuvveti ve temas konumu haritaları şeklinde sunulmaktadır (Ek Şekil S3, sol üstte). İki ek pencere kuvvet eğrilerini ve ham değerleri görüntüler (sırasıyla Ek Şekil S3, sağ üst ve alt paneller).
- Konsol karaciğer bölümünün yüzeyine yanlış yaklaştığı kuvvet eğrilerini hariç tutun. Bunları tanımlamak için, Şekil 3'te gösterildiği ve46'nın başka bir yerinde ayrıntılı olarak tartışıldığı gibi, yüksek gürültülü, anormal şekillere ve / veya eksik yaklaşıma sahip eğrileri arayın.
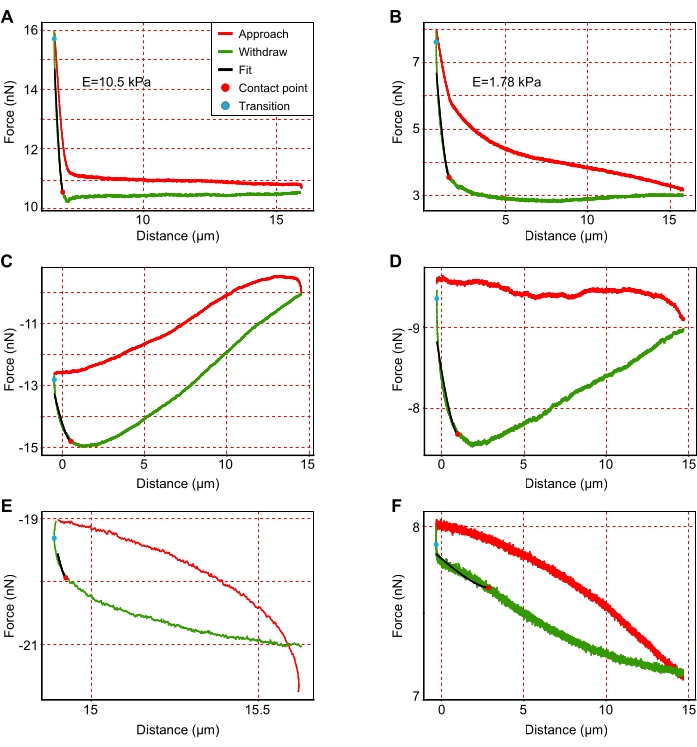
Şekil 3: Temsili kuvvet-yer değiştirme eğrilerine örnekler. (A,B) Daha sert (A; E = 10,5 kPa) ve daha yumuşak (B; E = 1.78 kPa) analiz için uygun alanlar. (C-F) (C-E) yanlış yaklaşım veya (F) daha yüksek gürültü nedeniyle analizden çıkarılması gereken temsili yorumlanamayan grafikler. (A)'da verilen göstergede belirtildiği gibi, kırmızı eğriler konsola yaklaşımını gösterir ve yeşil eğriler konsol geri çekilmesini gösterir. Siyah çizgiler, konsol çekme eğrisinin uymasını gösterir. Siyah çizgilerin eğimi Young modülüne karşılık gelir. Kırmızı ve mavi noktalar sırasıyla temas noktasına ve geçiş noktasına karşılık gelir. Temas noktası, geri çekme sırasında konsol ve substrat arasındaki son temas noktasıdır, geçiş noktası ise konsol yaklaşımından geri çekilmeye geçişini tanımlar. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Kontrol farelerinden ve hafif veya ileri fibrozlu farelerden (sırasıyla 3 hafta veya 6 hafta boyunca CCl4 enjeksiyonu ile indüklenen, sırasıyla49) elde edilen hafif sabit, 30 μm kalınlığındaki karaciğer kesitleri, bu protokolde açıklandığı gibi AFM ile incelendi. Sertlik haritalarının ölçümü için santral damarlara yakın kollajen lifleri seçildi. CCl4 ile tedavi edilen hayvanlarda genellikle kollajen liflerinin oluştuğu alanlara karşılık gelen merkezi damarlara yakın alanlar, kontrol karaciğerlerinde analiz edildi (Şekil 4A). Young modülünün dağılımı, tek bir karaciğer kesiti içindeki farklı kontrol karaciğerleri ve kollajen bakımından zengin alanlar arasında tekrarlanabilirdi (Şekil 4B: sol keman grafiği).
CCl 4 ile muamele edilmiş hayvanlarda, kollajen birikintilerinin perisantral alanlarına karşılık gelen sertlik haritaları, kontrol farelerindeki eşdeğer alanlara kıyasla Young modülünün anlamlı derecede daha yüksek değerlerini göstermiştir (Şekil 4B: 1.9 kPa'ya karşı 2.6 kPa medyan Young'ın kontrol modülü değerleri vs 3 hafta CCl 4 ile muamele edilmiş fare; p = 0.07; 1.9 kPa vs 5.1 kPa medyan Young'ın kontrol modülü değerleri vs 6 hafta CCl4 -tedavi edilmiş fare; p = 0.02). Ayrıca, daha uzun CCl 4 tedavisi ile Young modülünün değerlerinde anlamlı bir artış vardı (Şekil 4B; 2.6 kPa'ya karşı 5.1 kPa medyan Young modül değerleri 3 hafta boyunca 6 hafta CCl4 ile tedavi edilen fare; p = 0.04). Bu, fibroz ilerlemesi ile kollajen birikintilerinin kademeli olarak sertleştiğini ve AFM ölçümlerinin fibrogenezi yansıttığını göstermektedir.
OCT-gömülü karaciğer kesitlerinin uzun süreli depolanmasının kollajen liflerinin mekanik özellikleri üzerindeki etkisini değerlendirmek için, CCl4 ile muamele edilmiş farelerin bölümlerinde, kesildikten sonra slaytta 2 hafta veya 3 ay boyunca -80 ° C'de saklanan kollajen liflerinin sertliğini ölçtük (Şekil 5). AFM ölçümleri, 3 ay boyunca saklanan bölümler için kollajen bakımından zengin alanlarda Young modülünün değerlerinin, numune kesitinden sonraki 2 hafta içinde ölçülen bölümlerden elde edilenlere kıyasla anlamlı derecede daha düşük olduğunu göstermiştir (Şekil 5; 4.7 kPa'ya karşı 3.6 kPa medyan Young'ın modül değerleri 2 hafta boyunca 3 aylık depolamaya karşı; p < 0.001). Bu nedenle, OCT-gömülü karaciğer loblarından bölümler hazırlandıktan kısa bir süre sonra karaciğer dokusunun mekanik özelliklerini ölçmek önemlidir.
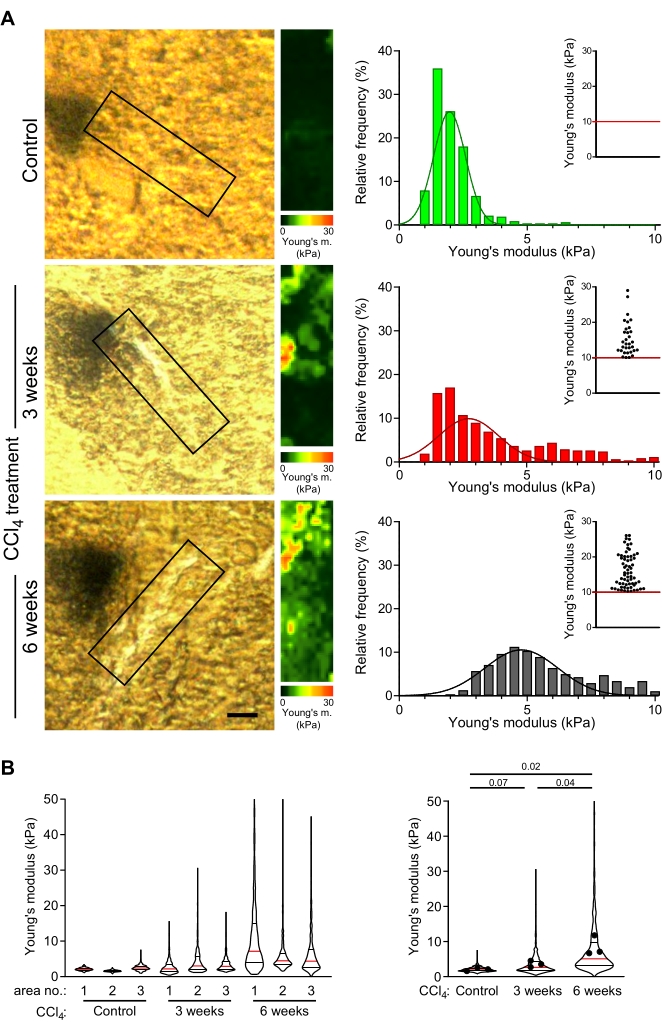
Şekil 4: AFM ölçümleri, uzun süreli CCl4 tedavisi ile ilişkili kollajen bakımından zengin alanların ilerleyici sertleşmesini ortaya koymaktadır. (A) Kollajen bakımından zengin alanların mekanik özelliklerini ölçmek için kontrol farelerinden ve CCl4 ile 3 hafta veya 6 hafta boyunca tedavi edilen farelerden karaciğer bölümleri kullanılmıştır. Polarize mikroskopi görüntülerinde (solda) gösterilen karaciğer bölümlerinin kutulu alanları, AFM ölçümleri için seçilen kollajen bakımından zengin tarama alanlarıdır (veya kontrol karaciğerindeki karşılık gelen bölgeler) (30 μm x 100 μm, 10 piksel x 36 piksel). Bu kutulu alanlara karşılık gelen renk ölçeklerine sahip Young'ın modül haritaları, bu haritalardan Young'ın modül değerlerinin histogramları da dahil olmak üzere sağda gösterilmiştir; iç dağılım grafikleri her koşul için >10 kPa değerlerini gösterir. Karaciğerin sertleşmesi, histogram dağılımında kademeli olarak sağa doğru bir kayma ve iç saçılma grafiğinde daha yüksek bir nokta frekansı olarak görselleştirilir. Ölçek çubuğu = 20 μm. (B) Keman grafikleri, her koşul için ölçülen üç alandan elastik modüllerin dağılımını gösterir (solda) ve her üç haritadan da özetlenmiş elastik modül değerleri (sağda). Keman grafikleri medyan (kırmızı çizgi), 25. yüzdelik dilim ve 75. yüzdelik dilimi (siyah çizgiler) gösterir; noktalar, 1-3 arasındaki alanlardaki tek tek haritaların ortalama değerlerini temsil eder. Sunulan p-değerleri, bir Öğrencinin araçlar üzerinde yapılan t-testi kullanılarak hesaplanmıştır. Kısaltmalar: AFM = atomik kuvvet mikroskobu; CCl4 = karbon tetraklorür. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
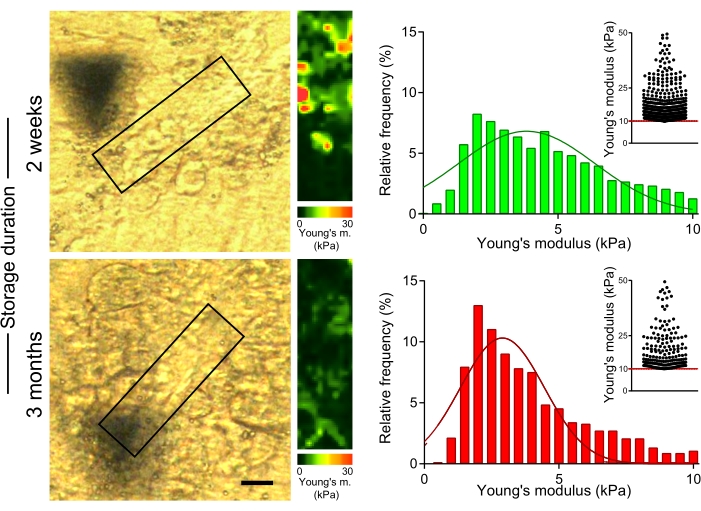
Şekil 5: Karaciğer bölümlerinin uzun süre depolanması, kollajen bakımından zengin alanların sertliğinde bir azalmaya yol açar. Young modülünü ölçmek için 2 hafta veya 3 ay boyunca -80 ° C'de depolanan karaciğer bölümleri (2 hafta boyunca CCl4 ile tedavi edilen farelerden hazırlanmıştır) kullanılmıştır. AFM ölçümü için kullanılan kolajen bakımından zengin alanları gösteren kutular içeren polarize mikroskopi görüntüleri (solda) (30 μm x 100 μm, 10 piksel x 36 piksel). Karşılık gelen Young modülü renk ölçekleriyle eşlenir (sağda). Histogramlar, her örnekte 4-6 alandan toplanan Young modül değerlerini gösterir; iç dağılım grafikleri, her koşul için >10 kPa değerlerini gösterir. Ölçek çubuğu = 20 μm. Kısaltmalar: AFM = atomik kuvvet mikroskobu; CCl4 = karbon tetraklorür. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Şekil S1: Bir melamin reçinesi mikro boncuk ile konsol değiştirme yöntemi. (A) Çizilmiş şematik, küresel bir boncuğun konsol ucuna tutturulmasını gösterir. Adım adım açıklama için bkz: Bölüm 2, Bölüm 1, AFM konsol ucuna 5,7 μm boncuk takılması. (B) Konsol ucuna tutturulmuş küresel 5,7 μm boncuğun mikroskopi görüntüsü, üstten (solda) ve yanal görünümden (sağda) gösterilmiştir. Ölçek çubukları = 20 μm. Kısaltmalar: AFM = atomik kuvvet mikroskobu; RT = oda sıcaklığı. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil S2: AtomicJ'de veri analizi. (A) AtomicJ'de sertlik haritalarının açılması için izlenecek adımlar dizisi. İşlem kuvveti eğrilerine ve haritalarına (x) tek bir sol tıklama işlem yardımcısını açar. Dosyalar, ekle (y) düğmesine tıklayarak ve gerekli dosyaları seçerek işlem asistanına yüklenebilir. Bir sonraki adıma geçmek için sonraki (z) düğmesine tıklayın. (B) Eğri uydurma parametreleri, uygun temas mekaniği modeli ve ölçüm sırasında kullanılan AFM ayarları. Adım 1-11, protokol adım 3, Bölüm 5, Veri analizinde ayrıntılı olarak açıklanan ilgili alt noktalara başvurur. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil S3: AtomicJ'de analiz edilen verilerin ana hatları. Analiz edilen verilerin önizlemesi sertlik haritalarını (sol üst pencere), kuvvet eğrilerini (sağ üst pencere) ve ham verileri (alt pencere) gösterir. Kısaltma: AFM = atomik kuvvet mikroskobu. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Sunulan protokol, normal ve fibrotik fare karaciğer dokusunun AFM ölçümü için adım adım tekrarlanabilir bir yöntem sağlar. Birleştirilmiş polarizasyon mikroskobu, yüksek uzamsal hassasiyet sağlar ve kollajen liflerinin çift kırılmaları nedeniyle görselleştirilmesini sağlar. Ayrıca, elde edilen kuvvet eğrilerinin analizinin ayrıntılı bir açıklaması sağlanmaktadır. AFM sertlik ölçümü hücresel düzeyde yapılabilir, bu da gelişen fibrotik hastalığa bağlı olarak karaciğer dokusunun mekanik özelliklerindeki lokal değişikliklerin izlenmesini sağlar. Karaciğer fibrozisi tüm organı etkileyen homojen bir süreç değildir. Aksine, kollajen bakımından zengin fibrotik septa alanları, düşük kollajen birikintisi olan veya hiç olmayan alanlarla serpiştirilir. Bu nedenle, sertlik değişiklikleri yerel mikro çevreye özgüdür ve yalnızca yaralanmadan zarar gören bölgelerle temas halinde olan hücreleri lokal olarak etkiler. Bu mikro sertlik heterojenliği, AFM Young'ın modül haritalarının ayrıntılarında da belirgindir; burada yüksek sertlik noktaları neredeyse normal sertlik alanlarını sınırlar. Bu varyasyon, kollajen skar dokusu alanının bile mekanik olarak homojen olmadığını ve AFM ölçümünün hücresel düzeyde karakterize edilmesini gerektirdiğini göstermektedir (Şekil 4).
Sunulan protokol, karaciğer koleksiyonundan bağımsız olarak AFM tarafından karaciğer sertliğinin ölçülmesine izin verir, çünkü OKT'ye gömülü tüm karaciğer lobları -80 ° C'de uzun bir süre saklanabilir. Bununla birlikte, doku kesitlendikten sonra, daha uzun süre saklanan doku kesitlerinin kademeli olarak yumuşadığını gözlemlediğimiz için numuneleri ~ 2 hafta içinde ölçmenizi öneririz (Şekil 5).
Polarizasyon mikroskobu ile donatılmış AFM, karaciğer lobül yapısı içindeki ilgi alanının tam olarak konumlandırılmasını sağlar. Bununla birlikte, sonuçları yorumlarken göz önünde bulundurulması gereken bazı sınırlamaları da vardır. Burada elde edilen sertlik değerleri oda sıcaklığında ölçülmüştür. Sıcaklığın yumuşak dokunun mekanik özellikleri üzerindeki etkilerinin küçük olacağını varsayıyoruz; ancak karaciğer dokularının mekanik özelliklerinin bildirilen in vivo değerleri ile bu çalışmadaki değerler arasındaki farklılıkların nedenlerinden biri de bu olabilir.
Ayrıca, bu protokol, karaciğer dokusunun AFM analizine 3 saate kadar izin verir ve bu da dokunun hafif fiksasyonunu gerektirir. Doku kesitlerinin hafif fiksasyonu ve donma-çözülme döngüsü, büyük olasılıkla Young modülünün mutlak değerlerini etkileyecektir. Bu nedenle, Young modülünün bildirilen değerleri in vivo değerlerden farklı olabilir. Young modülünün mutlak değerlerinin karaciğer bölümlerinden ölçülmesi için protokolü optimize etmek için daha ileri çalışmalara ihtiyaç vardır, bu da karaciğer dokusunun sabitlenmesi için farklı bir yöntemle elde edilebilir64.
Bununla birlikte, CCl4 ile tedavi edilen farelerin karaciğerlerinde kollajen bakımından zengin alanların sertliğinin 3 hafta boyunca 6 haftaya kıyasla arttığını gözlemledik. Bu tür değişiklikler, uzun süreli yaralanma sırasında fibroz ilerlemesine karşılık gelir (Şekil 4) ve sunulan protokol kullanılarak farklı tedaviler arasında göreceli farklılıkların araştırılabileceğini göstermektedir. Bu, hafif sabit karaciğer kesitlerinin, taze doku25'te olduğu gibi kollajen bakımından zengin ve kollajen eksikliği olan alanlar arasındaki sertlik değerlerinde benzer farklılıklar gösterdiğini gösteren Calò ve ark.'nın gözlemleriyle uyumludur.
Ölçümler sırasında karaciğer dokusunun mekanik bozulmasını en aza indirmek için 5.7 μm çapında küresel bir uç ile modifiye edilmiş SD-qp-BioT-TL-10 konsolunu (teorik yay sabiti ~ 0.09 N / m) kullandık. 5,7 μm'lik bir boncuk, bütünlüğünü korurken sertliğini araştırmak için numunenin yeterli girintisini sağladı. Daha küçük çaplı bir boncuk, birkaç optimizasyondan sonra, sertlik haritalarında daha yüksek çözünürlük elde etmek için kullanılabilir, ancak Young'ın modül değerlerinin daha fazla abartılmasına neden olabilir (daha fazla ayrıntı için bkz. Belirtilen konsol-boncuk topluluğunu kullanarak, numune sertliğini onlarca Pa biriminden ~ 100 kPa'ya kadar geniş bir aralıkta karakterize edebildik.
Sneddon'un modeli, Young'ın modülünü kuvvet eğrilerinden türetmek için kullanıldı, çünkü kolloidal problarla derin girintilerin analizine izin veriyor62. Sneddon'un modeli, Hertz'in modelinden farklı olarak, temas yarıçapının küre yarıçapından çok daha küçük olması gerektiği kısıtlamasından muzdarip değildir. Ayrıca, numune kalınlığının girinti derinliği 30,66'dan birkaç kat daha büyük olduğunu varsayar. Bu çalışmada, kollajen bakımından zengin bölgelerde girinti ~2 μm, boncuk boyutu 5.7 μm ve örnek kalınlığı 30 μm idi; bu nedenle Sneddon'un modeli uygundu. Diğer modeller63 uç ve substrat arasındaki yapışma kuvveti göz önüne alındığında farklı doku tipleri için kullanılabilir.
AtomicJ'deki analiz, Young modülü62,67'yi türetirken bir substratın katkısını en aza indirmek için numunelerin sonlu kalınlığı için düzeltmeler uygular. Elde edilen kuvvet eğrilerinin analizinde, daha önce yumuşak doku organları için önerilen 0.45'lik tek bir Poisson oranı kullandık24. Bu yaklaşımın Young modülünün hesaplanan değerleri üzerinde önemli bir etkisi yoktur, çünkü Poisson oranının 0.4'ten 0.5'e olan değerindeki değişim, Sneddon'un denklemine göre hesaplanan Young modül değerlerinde yalnızca 0.893x azalmaya neden olur. CCl4 tedavilerinin farklı süreleri arasındaki Young modülündeki çok katlı farklılıklar göz önüne alındığında, Poisson'un oranına yaklaşarak üretilen hatalar sadece marjinaldir.
Sertlik değerlerini hesaplamak için geri çekilme eğrilerini kullandık, çünkü girinti68'e plastik tepkiden ziyade dokunun konsol tarafından sağlanan yüke elastik tepkisiyle ilgileniyorduk. Yumuşak dokunun viskoelastik tepkisi nedeniyle, uygun geri çekilme eğrileri, akılda tutulması gereken Young modülünü abartabilir. Ayrıca, yaklaşım eğrileri ile veri analizinin, fibrotik ve kontrol alanları arasındaki sertlik değerlerinde benzer eğilimler ortaya koyduğunu, ancak mutlak değerlerin buna karşılık olarak daha düşük olduğunu gözlemledik (veriler gösterilmemiştir).
Protokolü optimize ederken, ölçümlerin tekrarlanabilirliği için kritik olan birkaç adım belirledik. İlk olarak, konsola takılırken boncuğun yaklaşık olarak yarı saydam ucun merkezinde olmasını sağlamak önemlidir. Bu, girinti sırasında olası mekanik dengesizliği önler. İkincisi, PFA ile karaciğer fiksasyonu sırasında, çözülme ve fiksasyon için zaman sınırlarını kesinlikle takip etmek gerekir. Bu adımın zamanlamasını değiştirmek, doku kesitlerinin mekanik özelliklerini ciddi şekilde etkileyebilir. Üçüncüsü, sıcaklık dalgalanmaları nedeniyle sertlik değerlerinde herhangi bir artefaktın oluşmasını önlemek için konsol sürekli izleme ve eşzamanlı sıcaklık değerlerinin girilmesi ile tekrar tekrar kalibre edilmelidir. Son olarak, tek bir karaciğer bölümü, hazırlıktan 3 saatten daha uzun bir süre boyunca ölçülmemelidir, çünkü üst üste binmiş PBS daha uzun süreler boyunca buharlaşabilir. Okuyucular, AFM ölçümü sırasında karşılaşılan sorunları çözmek için sorun giderme tablosuna (Tablo 3) başvurabilir, ayrıca Norman ve ark.46'da da uzun uzadıya tartışılmıştır.
Tablo 3: Sorun giderme kılavuzu. Bu tabloyu indirmek için lütfen tıklayınız.
Sunulan protokol, karaciğer dokusunun tekrarlanabilir AFM problanmasına izin verir. Fibrotik karaciğer hastalığının gelişimi ve nihayetinde gerilemesi hakkında mikroskobik düzeyde bilgi verme potansiyeline sahiptir ve kronik karaciğer hastalığının ilerlemesi sırasında oluşan fibrotik skar bölgelerini hedef alan tedavilerin geliştirilmesine katkıda bulunabilir.
Açıklamalar
Yazarların açıklayacağı bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma Çek Cumhuriyeti Hibe Ajansı (18-02699S), Çek Bilimler Akademisi Kurumsal Araştırma Projesi (RVO 68378050) ve MEYS CR projesi NICR EXCELES (LX22NPO05102) tarafından desteklenmiştir. CIISB, MEYS CR altyapı projesi LM2018127 ve Avrupa Bölgesel Kalkınma Fonu-Projesi "UP CIISB" tarafından finanse edilen Instruct-ERIC AB konsorsiyumunun Instruct-CZ Merkezi (No. CZ.02.1.01/0.0/0.0/18_046/0015974), CF Nanobiyoteknoloji, CEITEC MU'daki ölçümleri finansal olarak destekledi. Ayrıca, MEYS (LM2018129, CZ.02.1.01/0.0/0.0/18_046/0016045) ve RVO: 68378050-KAV-NPUI tarafından desteklenen Işık Mikroskobu Çekirdek Tesisi, IMG CAS, Prag, Çek Cumhuriyeti'ne de burada sunulan mikroskopi görüntülemeye verdikleri destek için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| AFM head | Bruker | JPK nanowizard 3 | |
| Cameras | Andor | Zyla 5.5 USB (sCMOS, water cooled) | |
| The Imagingsource | S/N:12310015 | ||
| Cantilever | SD-qp-BioT-TL-10, Nanosensors | S/N:73750F05 | |
| Cryotome | Leica | CM1950 | |
| Epoxy resin glue (Long working time ) | Bison epoxy universal | ||
| Melamine beads; diameter, 5.7 um | Microparticles, GmbH | MF-R-5.7 | |
| Microscope | Olympus | IX81 | |
| Hydrophobic slide marker | SuperHT | PAP PEN | |
| Software | JPK nanowizard v6.1.151 | ||
| AtomicJ v2.3.1 | |||
| Superfrost slides | Thermoscientific | ref no. J1800AMNZ | |
| System | Ubuntu 14.04.5 LTS | ||
| Vibration isolation control unit | Tablestable | AVI-200-S |
Referanslar
- vanden Berghe, G. The role of the liver in metabolic homeostasis: Implications for inborn errors of metabolism. Journal of Inherited Metabolic Dis. 14 (4), 407-420 (1991).
- Stanger, B. Z. Cellular homeostasis and repair in the mammalian liver. Annual Reviews of Physiology. 77, 179-200 (2015).
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Hernandez-Gea, V., Friedman, S. L. Pathogenesis of liver fibrosis. Annual Review of Pathology. 6, 425-456 (2011).
- Georges, P. C., et al. Increased stiffness of the rat liver precedes matrix deposition: Implications for fibrosis. American Journal of Physiology. Gastrointestinal and Liver Physiology. 293 (6), 1147-1154 (2007).
- Perepelyuk, M., et al. Hepatic stellate cells and portal fibroblasts are the major cellular sources of collagens and lysyl oxidases in normal liver and early after injury. American Journal of Physiology. Gastrointestinal and Liver Physiology. 304 (6), 605-614 (2013).
- Wells, R. G. The role of matrix stiffness in regulating cell behavior. Hepatology. 47 (5), 1394-1400 (2008).
- Olsen, A. L., et al. Hepatic stellate cells require a stiff environment for myofibroblastic differentiation. American Journal of Physiology. Gastrointestinal and Liver Physiology. 301 (1), 110-118 (2011).
- Sandrin, L., et al. Transient elastography: A new noninvasive method for assessment of hepatic fibrosis. Ultrasound in Medicine & Biology. 29 (12), 1705-1713 (2003).
- Ling, W., et al. Effects of vascularity and differentiation of hepatocellular carcinoma on tumor and liver stiffness: In vivo and in vitro studies. Ultrasound in Medicine & Biology. 40 (4), 739-746 (2014).
- Wong, V. W. S., et al. Diagnosis of fibrosis and cirrhosis using liver stiffness measurement in nonalcoholic fatty liver disease. Hepatology. 51 (2), 454-462 (2010).
- Cha, S. W., et al. Nondiseased liver stiffness measured by shearwave elastography a pilot study. Journal of Ultrasound in Medicine. 33 (1), 53-60 (2014).
- Castera, L., Forns, X., Alberti, A. Non-invasive evaluation of liver fibrosis using transient elastography. Journal of Hepatology. 48 (5), 835-847 (2008).
- Chang, W., et al. Liver fibrosis staging with MR elastography: Comparison of diagnostic performance between patients with chronic hepatitis B and those with other etiologic causes. Radiology. 280 (1), 88-97 (2016).
- Venkatesh, S. K., Yin, M., Ehman, R. L. Magnetic resonance elastography of liver: Clinical applications. Journal of Computer Assisted Tomography. 37 (6), 887-896 (2013).
- Venkatesh, S. K., Yin, M., Ehman, R. L. Magnetic resonance elastography of liver: Technique, analysis and clinical applications. Journal of Magnetic Resonance Imaging. 37 (3), 544-555 (2013).
- Venkatesh, S. K., Wang, G., Teo, L. L. S., Ang, B. W. L. Magnetic resonance elastography of liver in healthy Asians: Normal liver stiffness quantification and reproducibility assessment. Journal of Magnetic Resonance Imaging. 39 (1), 1-8 (2014).
- Lee, D. H., Lee, J. M., Han, J. K., Choi, B. I. MR elastography of healthy liver parenchyma: Normal value and reliability of the liver stiffness value measurement. Journal of Magnetic Resonance Imaging. 38 (5), 1215-1223 (2013).
- Mueller, S. Liver stiffness: A novel parameter for the diagnosis of liver disease. Hepatic Medicine. Evidence and Research. 2, 49-67 (2010).
- Goodman, Z. D. Grading and staging systems for inflammation and fibrosis in chronic liver diseases. Journal of Hepatology. 47 (4), 598-607 (2007).
- Salameh, N., et al. Hepatic viscoelastic parameters measured with MR elastography: Correlations with quantitative analysis of liver fibrosis in the rat. Journal of Magnetic Resonance Imaging. 26 (4), 956-962 (2007).
- Yin, M., et al. Quantitative assessment of hepatic fibrosis in an animal model with magnetic resonance elastography. Magnetic Resonance in Medicine. 58 (2), 346-353 (2007).
- Bastard, C., et al. Transient micro-elastography: A novel non-invasive approach to measure liver stiffness in mice. World Journal of Gastroenterology. 17 (8), 968-975 (2011).
- Barnes, S. L., Lyshchik, A., Washington, M. K., Gore, J. C., Miga, M. I. Development of a mechanical testing assay for fibrotic murine liver. Medical Physics. 34 (11), 4439-4450 (2007).
- Calò, A., et al. Spatial mapping of the collagen distribution in human and mouse tissues by force volume atomic force microscopy. Scientific Reports. 10, 15664 (2020).
- Desai, S. S., et al. Physiological ranges of matrix rigidity modulate primary mouse hepatocyte function in part through hepatocyte nuclear factor 4 alpha. Hepatology. 64 (1), 261-275 (2016).
- Kostallari, E., et al. Stiffness is associated with hepatic stellate cell heterogeneity during liver fibrosis. American Journal of Physiology. Gastrointestinal and Liver Physiology. 322 (2), 234-246 (2022).
- Binnig, G., Qaute, C. F., Gerber, C. Atomic force microscope. Physical Review Letters. 56 (9), (1986).
- Johnson, K. L. . Contact Mechanics. , (1985).
- Asgari, M., Latifi, N., Giovanniello, F., Espinosa, H. D., Amabili, M. Revealing layer-specific ultrastructure and nanomechanics of fibrillar collagen in human aorta via atomic force microscopy testing: Implications on tissue mechanics at macroscopic scale. Advanced NanoBiomed Research. 2 (5), 2100159 (2022).
- Amabili, M., et al. Microstructural and mechanical characterization of the layers of human descending thoracic aortas. Acta Biomaterialia. 134, 401-421 (2021).
- Grant, C. A., Twigg, P. C., Tobin, D. J. Static and dynamic nanomechanical properties of human skin tissue using atomic force microscopy: Effect of scarring in the upper dermis. Acta Biomaterialia. 8 (11), 4123-4129 (2012).
- Geerligs, M., et al. In vitro indentation to determine the mechanical properties of epidermis. Journal of Biomechanics. 44 (6), 1176-1181 (2011).
- Liu, F., Tschumperlin, D. J. Micro-mechanical characterization of lung tissue using atomic force microscopy. Journal of Visualized Experiments. (54), e2911 (2011).
- Sicard, D., Fredenburgh, L. E., Tschumperlin, D. J. Measured pulmonary arterial tissue stiffness is highly sensitive to AFM indenter dimensions. Journal of the Mechanical Behavior of Biomedical Materials. 74, 118-127 (2017).
- Babu, P. K. V., Radmacher, M. Mechanics of brain tissues studied by atomic force microscopy: A perspective. Frontiers in Neuroscience. 13, 600 (2019).
- del Mar Vivanco, M. . Mammary Stem Cells: Methods and protocols. , (2015).
- Zanetti-Dällenbach, R., et al. Length scale matters: Real-time elastography versus nanomechanical profiling by atomic force microscopy for the diagnosis of breast lesions. Biomed Research International. 2018, 3840597 (2018).
- Lopez, J. I., Kang, I., You, W. -. K., McDonald, D. M., Weaver, V. M. In situ force mapping of mammary gland transformation. Integrative Biology. 3 (9), 910-921 (2011).
- Stolz, M., et al. Early detection of aging cartilage and osteoarthritis in mice and patient samples using atomic force microscopy. Nature Nanotechnol. 4 (3), 186-192 (2009).
- Borin, D., Pecorari, I., Pena, B., Sbaizero, O. Novel insights into cardiomyocytes provided by atomic force microscopy. Seminars in Cell & Developmental Biology. 73, 4-12 (2018).
- Lachaize, V., et al. Atomic Force Microscopy: An innovative technology to explore cardiomyocyte cell surface in cardiac physio/pathophysiology. Letters in Applied NanoBioScience. 4 (4), 321-324 (2015).
- Lieber, S. C., et al. Aging increases stiffness of cardiac myocytes measured by atomic force microscopy nanoindentation. American Journal of Physiology. Heart and Circulatory Physiology. 287 (2), 645-651 (2004).
- Guedes, A. F., et al. Atomic force microscopy as a tool to evaluate the risk of cardiovascular diseases in patients. Nature Nanotechnology. 11 (8), 687-692 (2016).
- Zhu, Y., Dong, Z., Wejinya, U. C., Jin, S., Ye, K. Determination of mechanical properties of soft tissue scaffolds by atomic force microscopy nanoindentation. Journal of Biomechanics. 44 (13), 2356-2361 (2011).
- Norman, M. D. A., Ferreira, S. A., Jowett, G. M., Bozec, L., Gentleman, E. Measuring the elastic modulus of soft culture surfaces and three-dimensional hydrogels using atomic force microscopy. Nature Protocols. 16 (5), 2418-2449 (2021).
- Thomas, G., Burnham, N. A., Camesano, T. A., Wen, Q. Measuring the mechanical properties of living cells using atomic force microscopy. Journal of Visualized Experiments. (76), e50497 (2013).
- McKee, C. T., Last, J. A., Russell, P., Murphy, C. J. Indentation versus tensile measurements of Young's modulus for soft biological tissues. Tissue Engineering. Part B, Reviews. 17 (3), 155-164 (2011).
- Scholten, D., Trebicka, J., Liedtke, C., Weiskirchen, R. The carbon tetrachloride model in mice. Laboratory Animals. 49, 4-11 (2015).
- Nevzorova, Y. A., Boyer-Diaz, Z., Cubero, F. J., Gracia-Sancho, J. Animal models for liver disease - A practical approach for translational research. Journal of Hepatology. 73 (2), 423-440 (2020).
- Ribeiro, J. F., dos Anjos, E. H. M., Mello, M. L. S., de Campos Vidal, B. Skin collagen fiber molecular order: A pattern of distributional fiber orientation as assessed by optical anisotropy and image analysis. PLoS One. 8 (1), 54724 (2013).
- Ozkan, A., et al. The influence of chronic liver diseases on hepatic vasculature: A liver-on-a-chip review. Micromachines. 11 (5), 487 (2020).
- Guimarães, C. F., Gasperini, L., Marques, A. P., Reis, R. L. The stiffness of living tissues and its implications for tissue engineering. Nature Reviews Materials. 5, 351-370 (2020).
- Khajehahmadi, Z., et al. Liver stiffness correlates with serum osteopontin and TAZ expression in human liver cirrhosis. Annals of the New York Academy of Sciences. 1465 (1), 117-131 (2020).
- Tian, M., et al. The nanomechanical signature of liver cancer tissues and its molecular origin. Nanoscale. 7 (30), 12998-13010 (2015).
- Zhao, G., et al. Mechanical stiffness of liver tissues in relation to integrin β1 expression may influence the development of hepatic cirrhosis and hepatocellular carcinoma. Journal of Surgical Oncology. 102 (5), 482-489 (2010).
- Gang, Z., Qi, Q., Jing, C., Wang, C. Measuring microenvironment mechanical stress of rat liver during diethylnitrosamine induced hepatocarcinogenesis by atomic force microscope. Microscopy Research and Technique. 72 (9), 672-678 (2009).
- Sader, J. E., et al. Spring constant calibration of atomic force microscope cantilevers of arbitrary shape. The Review of Scientific Instruments. 83 (10), 103705 (2012).
- JPK Instruments. A practical guide to AFM force spectroscopy and data analysis. JPK Instruments Technical Note. JPK Instruments. , 1-8 (2016).
- van Eysden, C. A., Sader, J. E. Frequency response of cantilever beams immersed in viscous fluids. Journal of Applied Physics. 101, 044908 (2015).
- Kim, Y., Yang, Y. I., Choi, I., Yi, J. Dependence of approaching velocity on the force-distance curve in AFM analysis. Korean Journal of Chemical Engineering. 27, 324-327 (2010).
- Hermanowicz, P., Sarna, M., Burda, K., Gabryś, H. AtomicJ: An open source software for analysis of force curves. The Review of Scientific Instruments. 85 (6), 063703 (2014).
- Hermanowicz, P. . AtomicJ 2.3.1 User's Manual. , (2021).
- Iwashita, M., et al. Comparative Analysis of Brain Stiffness Among Amniotes Using Glyoxal Fixation and Atomic Force Microscopy. Frontiers in Cell and Developmental Biology. 8, 574619 (2020).
- Crichton, M. L., et al. The viscoelastic, hyperelastic and scale dependent behaviour of freshly excised individual skin layers. Biomaterials. 32 (20), 4670-4681 (2011).
- Puricelli, L., Galluzzi, M., Schulte, C., Podestà, A., Milani, P. Nanomechanical and topographical imaging of living cells by atomic force microscopy with colloidal probes. The Review of Scientific Instruments. 86 (3), 033705 (2015).
- Hermanowicz, P. Determination of Young's modulus of samples of arbitrary thickness from force distance curves: Numerical investigations and simple approximate formulae. International Journal of Mechanical Sciences. 193, 106138 (2021).
- Han, R., Chen, J. A modified Sneddon model for the contact between conical indenters and spherical samples. Journal of Materials Research. 36, 1762-1771 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır