Method Article
Misurazione della rigidità epatica mediante microscopia a forza atomica accoppiata con microscopia a polarizzazione
In questo articolo
Riepilogo
Presentiamo un protocollo per misurare i moduli elastici di aree ricche di collagene in fegato normale e malato utilizzando la microscopia a forza atomica. L'uso simultaneo della microscopia a polarizzazione fornisce un'elevata precisione spaziale per localizzare aree ricche di collagene nelle sezioni del fegato.
Abstract
L'irrigidimento della matrice è stato riconosciuto come uno dei fattori chiave della progressione della fibrosi epatica. Ha effetti profondi su vari aspetti del comportamento cellulare come la funzione cellulare, la differenziazione e la motilità. Tuttavia, poiché questi processi non sono omogenei in tutto l'organo, è diventato sempre più importante comprendere i cambiamenti nelle proprietà meccaniche dei tessuti a livello cellulare.
Per essere in grado di monitorare l'irrigidimento delle aree ricche di collagene all'interno dei lobi del fegato, questo documento presenta un protocollo per misurare i moduli elastici del tessuto epatico con elevata precisione spaziale mediante microscopia a forza atomica (AFM). L'AFM è un metodo sensibile con il potenziale di caratterizzare le proprietà meccaniche locali, calcolato come modulo di Young (noto anche come elastico). L'AFM accoppiato con la microscopia a polarizzazione può essere utilizzato per localizzare specificamente le aree di sviluppo della fibrosi in base alla birifrangenza delle fibre di collagene nei tessuti. Utilizzando il protocollo presentato, abbiamo caratterizzato la rigidità delle aree ricche di collagene da fegati di topo fibrotici e aree corrispondenti nei fegati dei topi di controllo.
Un notevole aumento della rigidità delle aree collagene-positive è stato osservato con lo sviluppo della fibrosi. Il protocollo presentato consente un metodo altamente riproducibile di misurazione dell'AFM, grazie all'uso di tessuto epatico leggermente fissato, che può essere utilizzato per approfondire la comprensione dei cambiamenti avviati dalla malattia nelle proprietà meccaniche dei tessuti locali e il loro effetto sul destino delle cellule vicine.
Introduzione
Il fegato è un organo vitale per il mantenimento dell'omeostasi negli organismi 1,2. Le malattie croniche del fegato rappresentano ~ 2 milioni di morti in tutto il mondo ogni anno3. Hanno origine più comunemente come infezioni virali, disturbi autoimmuni, sindromi metaboliche o malattie legate all'abuso di alcol e sono accompagnati da fibrosi epatica progressiva. Il danno epatico provoca una risposta infiammatoria, che porta all'attivazione delle cellule che depositano la matrice extracellulare (ECM) in una risposta di guarigione delle ferite. Tuttavia, in presenza di un insulto cronico, l'eccesso di ECM forma tessuto cicatriziale irrisolto all'interno del fegato, portando allo sviluppo di fibrosi epatica, cirrosi, carcinoma epatico e, infine, insufficienza epatica4.
La lesione degli epatociti provoca immediatamente un aumento della rigidità epatica 5,6. Ciò influenza direttamente la funzione degli epatociti, attiva le cellule stellate epatiche (HSC) e i fibroblasti portale e provoca la loro transdifferenziazione in miofibroblasti depositanti di collagene 7,8. La deposizione di ECM fibrosa aumenta ulteriormente la rigidità epatica, creando un ciclo di feedback auto-amplificatore di irrigidimento del fegato e attivazione cellulare produttrice di matrice.
La rigidità epatica è, quindi, diventata un parametro importante nella prognosi delle malattie del fegato. Il cambiamento nelle proprietà biomeccaniche del tessuto può essere rilevato prima che la fibrosi possa essere diagnosticata mediante analisi istologica. Pertanto, sono state sviluppate varie tecniche per la misurazione della rigidità epatica sia nella ricerca che nelle applicazioni cliniche. In ambito clinico, l'elastografia transitoria (TE)9,10,11,12,13 e l'elastografia a risonanza magnetica (MRE)14,15,16,17,18 sono state impiegate per diagnosticare in modo non invasivo le prime fasi del danno epatico esaminando la rigidità epatica grossolana 19.
In TE, le onde ultrasoniche di lieve ampiezza e bassa frequenza (50 Hz) vengono propagate attraverso il fegato e viene misurata la loro velocità, che viene quindi utilizzata per calcolare il modulo elastico tissutale13. Tuttavia, questa tecnica non è utile per i pazienti con ascite, obesità o spazi intercostali inferiori a causa della trasmissione impropria delle onde ultrasoniche attraverso i tessuti che circondano il fegato9.
La MRE si basa sulla modalità di risonanza magnetica e utilizza onde di taglio meccaniche a 20-200 Hz per colpire il fegato. Una specifica sequenza di risonanza magnetica viene quindi utilizzata per tracciare le onde all'interno del tessuto e per calcolare la rigidità del tessuto16. I valori di rigidità riportati con entrambe le tecniche TE e MRE sono ben correlati con il grado di fibrosi epatica ottenuto da biopsie di campioni di fegato umano classificati utilizzando i punteggi istologici METAVIR20 (Tabella 1). TE e MRE sono stati adattati anche per la misurazione della rigidità epatica in modelli di roditori per scopi di ricerca21,22,23. Tuttavia, poiché entrambi i metodi derivano i valori di rigidezza dalla risposta del tessuto alle onde di taglio che si propagano, i valori ottenuti potrebbero non riflettere la rigidità meccanica assoluta del tessuto.
Per una caratterizzazione meccanica diretta dei fegati dei roditori, Barnes et al. hanno sviluppato un test modello-gel-tessuto (saggio MGT) che coinvolge l'incorporazione del tessuto epatico in gel di poliacrilammide24. Questo gel è compresso da una forza uniforme pulsata da cui è possibile calcolare il modulo di Young. Il test MGT mostra una buona correlazione con un test di indentazione adattato sia per il fegato normale che per quello fibrotico24 (Tabella 1).
Tabella 1: Valori di rigidità epatica a livello di massa. TE e MRE confrontati con misurazioni meccaniche dirette ex vivo di moduli elastici epatici utilizzando saggi di indentazione e MGT per fegati provenienti da fonti diverse. La relazione tra E e G è data da E = 2G (1 + v), dove v è il rapporto di Poisson del campione; F0 a F4 rappresentano il punteggio di fibrosi nel sistema di punteggio METAVIR, con F0 che indica una fibrosi bassa o assente e fegati cirrotici F4. Abbreviazioni: TE = elastografia transitoria; MRE = elastografia a risonanza magnetica; MGT = modello-gel-tessuto; E = modulo elastico (di Young); G = modulo di taglio. Clicca qui per scaricare questa tabella.
Uno dei principali svantaggi delle misurazioni generiche della rigidità epatica è che non forniscono una risoluzione a livello cellulare dell'eterogeneità della rigidità nel fegato. Durante la progressione della fibrosi, le aree ricche di collagene mostrano una maggiore rigidità rispetto al parenchima circostante25,26. Questo gradiente di rigidità influenza localmente le cellule residenti e svolge un ruolo importante nel guidare l'eterogeneità HSC27. Pertanto, i cambiamenti nelle proprietà meccaniche locali durante lo sviluppo della malattia epatica devono essere caratterizzati a livello microscopico per comprendere meglio la progressione della fibrosi.
L'AFM consente di misurare le proprietà meccaniche del tessuto con alta risoluzione e alta sensibilità alla forza. AFM utilizza la punta di un cantilever per indentare la superficie di un campione con forze fino a diversi piconewton, inducendo una deformazione a livello microscopico o nanoscopico in base alla geometria e alle dimensioni della punta impiegata. La risposta forzata del campione alla deformazione applicata viene quindi misurata come deflessione nel cantilever28. Le curve forza-spostamento sono raccolte dall'avvicinamento e dalla retrazione del cantilever, che può essere dotato di opportuni modelli di meccanica di contatto per valutare la rigidità locale del campione29.
Oltre a misurare la rigidità di una determinata area, AFM può anche fornire informazioni topografiche su caratteristiche specifiche del campione, come la struttura delle fibre di collagene30,31,32. Diversi studi hanno descritto l'applicazione di AFM per misurare la rigidità di vari tessuti sani e malati, come pelle 32,33, polmone 34,35, cervello36, mammario37,38,39, cartilagine 40 o cuore41,42,43,44 da campioni di pazienti e modelli murini. Inoltre, l'AFM è stato utilizzato anche in vitro per determinare la rigidità delle cellule e degli scaffold proteici extracellulari45,46,47.
La misurazione delle proprietà meccaniche dei campioni biologici utilizzando AFM non è banale a causa della loro morbidezza e fragilità. Pertanto, vari studi hanno standardizzato diverse condizioni e impostazioni, che producono valori ampiamente fluttuanti dei moduli di Young (rivisti da Mckee et al.48). Analogamente ad altri tessuti molli, anche i valori del modulo di Young epatico a diversi gradi di fibrosi epatica mostrano ampie variazioni (Tabella 2). Le differenze nei valori del modulo di Young derivano da differenze nella modalità di funzionamento AFM, punta a sbalzo, metodo di preparazione del campione, spessore del campione, profondità e forze di indentazione, ambiente del tessuto epatico durante la misurazione e metodo di analisi (Tabella 2).
Tabella 2: Valori di rigidità epatica a livello cellulare. I valori di rigidità epatica ottenuti utilizzando AFM descrivono le proprietà meccaniche del fegato a livello cellulare. Abbreviazioni: AFM = microscopia a forza atomica; E = modulo elastico (di Young); PFA = paraformaldeide; PBS = soluzione salina tamponata con fosfato. Clicca qui per scaricare questa tabella.
Questo articolo descrive un protocollo per la misurazione riproducibile dei moduli di Young di aree fibrotiche ricche di collagene nel tessuto epatico mediante AFM con una localizzazione precisa fornita dall'uso della microscopia a polarizzazione. Abbiamo somministrato tetracloruro di carbonio (CCl4) per indurre la deposizione di collagene in modo centrilobulare49 in un modello murino, imitando in modo affidabile aspetti cruciali della fibrosi epatica umana50. Le immagini microscopiche polarizzate consentono la visualizzazione del collagene nel fegato grazie alla birifrangenza delle fibre di collagene51, che consente un posizionamento accurato della punta a sbalzo sull'area di interesse desiderata all'interno del lobulo epatico52.
Protocollo
Tutti gli esperimenti sugli animali sono stati eseguiti in conformità con un protocollo animale approvato dal Comitato per la cura degli animali dell'Istituto di genetica molecolare e secondo la direttiva UE 2010/63 / UE per gli esperimenti sugli animali. Un diagramma schematico generale del protocollo presentato è mostrato nella Figura 1.
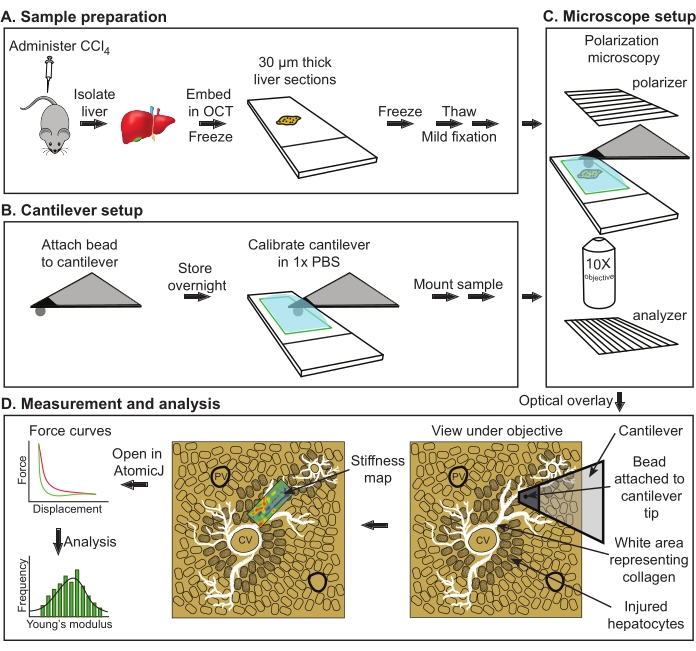
Figura 1: Schema generale della valutazione AFM del modulo di Young da fegati di topo. (A) Isolamento del fegato da topi di controllo o trattati seguito da sezionamento e conservazione a -80 °C (conservazione massima, 2 settimane). (B) Fissaggio del tallone sferico al cantilever con successiva polimerizzazione della colla durante la notte (a sinistra). Calibrazione a sbalzo seguita dal montaggio del campione (a destra). (C) Allineamento del polarizzatore e dell'analizzatore per visualizzare strutture di collagene luminose seguite da una sovrapposizione dell'immagine nella telecamera con il campo di misurazione sotto il cantilever AFM. (D) Acquisizione di mappe di rigidezza e analisi. Abbreviazioni: AFM = microscopia a forza atomica; PBS = soluzione salina tamponata fosfato; OCT = mescola con temperatura di taglio ottimale; CCl4 = tetracloruro di carbonio. Fare clic qui per visualizzare una versione ingrandita di questa figura.
1. Preparazione del campione I
- Asportare il fegato dall'addome aperto di un topo eutanasia per dislocazione cervicale sotto anestesia. Isolare il lobo laterale sinistro e incorporare la metà laterale del lobo nel composto della temperatura di taglio ottimale (OCT) mediante congelamento rapido su ghiaccio secco. Conservare il tessuto incorporato nell'OCT a -80 °C.
NOTA: Studi precedenti hanno dimostrato che i valori di rigidità sono simili tra tessuti congelati e freschi25,26. - Sezione 30 μm sezioni di fegato spesse su vetrini caricati positivamente utilizzando un criotomo e conservare i vetrini a -80 °C fino al giorno della misurazione dell'AFM non più di 2 settimane dopo.
2. Configurazione dello strumento
- Fissaggio di un tallone da 5,7 μm alla punta a sbalzo AFM (Figura supplementare S1, passi 1-5)
NOTA: L'attacco del tallone al cantilever è stato anche precedentemente descritto da Norman et al.46.- Stendere uniformemente la sospensione di sfere di resina melamminica da 5,7 μm di diametro su metà dell'area di un vetrino e asciugarla all'aria per far evaporare il solvente (Figura supplementare S1, fase 1).
- Sull'altra metà del vetrino, utilizzando una punta da 10 μL, fare una sottile linea di resina epossidica premiscelata con un lungo tempo di lavoro (Figura supplementare S1, fase 1).
- Caricare la sonda a sbalzo sulla testa AFM secondo le istruzioni del produttore.
- Montare la slitta e il coperchio con la testa AFM dotata della sonda a sbalzo.
NOTA: Nello studio è stato utilizzato un cantilever SD-qp-BioT-TL-10. - Portare la colla in resina epossidica premiscelata al centro della slitta e avvicinarsi alla colla con il cantilever con una forza bassa (impostare un setpoint a 1 V per seguire questo protocollo; Figura supplementare S1, passo 2).
NOTA: Prima di avvicinarsi alla superficie del vetrino, assicurarsi che il laser sia allineato al centro della punta a sbalzo, indicata da una tensione ad alta somma, seguendo i passaggi 6-8 nella Sezione 2, Parte 3, Calibrazione della costante della molla del cantilever AFM. - Dopo che la punta della sonda a sbalzo entra in contatto con la colla, spostarla appena sopra la diapositiva per rimuovere la colla in eccesso.
- Ora, ritrarre la punta a sbalzo dalla diapositiva e spostare la diapositiva per portare una singola perlina al centro (Figura supplementare S1, passaggio 3). Avvicinarsi nuovamente al tallone con la sonda a sbalzo AFM con una forza maggiore (setpoint 2 V) per fissare il tallone al centro della sonda a sbalzo e lasciarlo per almeno 10 s (Figura supplementare S1, passo 4).
- Estrarre la sonda a sbalzo e tenerla per una notte a temperatura ambiente per indurire la colla o seguire le istruzioni per la resina epossidica (Figura supplementare S1, fase 5).
- Configurazione del polarizzatore e dell'analizzatore
- Per individuare le aree di interesse all'interno delle sezioni del fegato, impostare il microscopio con il polarizzatore e l'analizzatore. Allineare i loro azimut di vibrazione con un angolo compreso tra 0° e 90° l'uno con l'altro ruotando uno di essi rispetto all'altro manualmente o in modo automatizzato per ridurre al minimo la luce trasmessa e massimizzare i raggi straordinari che attraversano l'obiettivo. Assicurati che le fibre di collagene appaiano luminose su uno sfondo scuro nell'immagine polarizzata (Figura 2), che viene riflesso da uno spostamento del picco dell'istogramma dell'immagine verso i pixel luminosi.

Figura 2: Le immagini di microscopia rappresentative mostrano una visualizzazione pronunciata delle fibre di collagene nella microscopia polarizzata rispetto alle immagini a campo chiaro. Le sezioni epatiche di topi trattati con CCl4 per 3 settimane sono state sottoposte a (A) microscopia a campo chiaro e (B) polarizzata. Le fibre di collagene birifrangenti sono chiaramente visibili in bianco nelle immagini polarizzate rispetto alle immagini in campo chiaro. La scatola rossa rappresenta l'area ricca di collagene utilizzata per la misurazione AFM. I riquadri mostrano le viste ingrandite dell'area nel riquadro rosso. Barra di scala = 100 μm. Abbreviazioni: AFM = microscopia a forza atomica; CCl4 = tetracloruro di carbonio; CV = vena centrale; PV = vena porta. Fare clic qui per visualizzare una versione ingrandita di questa figura.
NOTA: Per questo protocollo, la testa AFM può essere installata su qualsiasi microscopio invertito adatto con la possibilità di inserire un polarizzatore e un analizzatore. Il sistema deve essere collocato in un'unità di isolamento per ridurre il rumore di fondo.
- Taratura della costante di molla del cantilever AFM
- Caricare la sonda a sbalzo (preparata secondo i passaggi da 1 a 8 della Sezione 2, Parte 1, Fissaggio di un tallone da 5,7 μm alla punta a sbalzo AFM) sulla testa AFM secondo le istruzioni del fabbricante.
- Pulire il cantilever con etanolo al 70% per evitare la contaminazione del cantilever durante la misurazione. Lavare abbondantemente con acqua distillata per rimuovere l'etanolo residuo dalla punta.
- Abilitare la modalità di contatto e selezionare la mappatura della forza come metodo di misurazione.
- Aprire tutte le finestre rilevanti (motori passo-passo Z, controllo motorizzato dello stadio, visualizzatore dati, oscilloscopio mappa a scansione forzata, allineamento laser e finestra della fotocamera ) nelle schede del software facendo clic sui pulsanti corrispondenti.
- Montare un vetrino pulito contenente 1,2 ml di soluzione salina tamponata con fosfato (PBS) 1x in un'area di circa 2 cm x 4 cm delineata con un pennarello idrofobo. Montare la testa AFM sul palco del microscopio e assicurarsi che il cantilever sia completamente immerso nel PBS.
- Focalizzare l'obiettivo sulla punta a sbalzo. Ridurre l'intensità della luce trasmessa al microscopio per ottenere una migliore visione della posizione del laser sul monitor.
- Puntare il laser verso l'estremità traslucida del cantilever (sotto il quale è fissata la perlina sferica) e allineare lo specchio utilizzando le manopole sulla testa AFM per massimizzare l'intensità totale del raggio laser sul rilevatore (rappresentato dalla somma nella finestra di allineamento laser ).
- Allineare il rilevatore di fotodiodi utilizzando le manopole presenti sulla testa AFM per posizionare il laser al suo centro.
- Lasciare stabilizzare il cantilever per 15 minuti prima di procedere con la calibrazione.
- Aprire Gestione calibrazione e inserire il tipo di cantilver, le dimensioni a sbalzo e le condizioni ambientali. Calibrare la costante della molla e la sensibilità (nota anche come sensibilità della leva ottica inversa, InvOLS) facendo clic su Calibra. Confermare l'accuratezza della costante della molla ottenuta dopo la calibrazione con la dichiarazione del produttore. Calibrare il cantilever in modalità senza contatto (la calibrazione viene eseguita dal software utilizzando il teorema termico derivato da Sader et al.58).
NOTA: La costante della molla del cantilever rappresenta la rigidità del cantilever ed è data dalla forza di resistenza del cantilever mentre si deforma per la lunghezza di deformazione in termini di N/m. La sensibilità del cantilever rappresenta il valore della risposta del fotodiodo (in volt) in risposta alla deflessione del cantilever (in nanometri) ed è solitamente presentata in termini di nm/V59. In modalità senza contatto, lo spettro del rumore termico viene registrato e dotato della funzione idrodinamica60 dal software di controllo AFM automaticamente dopo la calibrazione. Il raccordo fornisce i parametri di calibrazione, ovvero la costante della molla e l'InvOLS. La costante di molla del cantilever SD-qp-BioT-TL-10 utilizzato in questo studio era di 0,09 N/m, come dichiarato dal produttore.
3. Preparazione del campione II
- Scongelare le sezioni congelate (conservate a -80 °C, come descritto nella Sezione 1, Preparazione del campione I) a temperatura ambiente per 2 minuti.
- Fissare le sezioni con paraformaldeide (PFA) al 4% ghiacciata in 1x PBS per 10 minuti a 4 °C seguita da un lavaggio esteso (5x) con 1x PBS. Pulire il PBS residuo intorno alla sezione con un fazzoletto e segnare un limite di circa 2 cm x 4 cm intorno alla sezione epatica con un pennarello idrofobo. Coprire il campione con 1x PBS (assicurarsi che l'area delimitata contenga ~1,2 mL di 1x PBS). Utilizzare il campione per le misurazioni AFM.
NOTA: Poiché il PFA è una sostanza chimica pericolosa, deve essere maneggiato con cura per evitare il contatto con la pelle o gli occhi. Per evitare i suoi fumi tossici, tutte le procedure che coinvolgono PFA devono essere eseguite in una cappa chimica certificata o in un'altra area ventilata approvata.
4. Misurazione
- Abilita il salvataggio automatico andando alla scheda Configurazione e facendo un segno di spunta su Salvataggio automatico. Specificare il nome del file e la directory per il salvataggio dei file di misurazione accedendo alla scheda Setup (Impostazioni di configurazione) e quindi facendo clic su Saving Settings (Salvataggio impostazioni).
- Caricare il campione (preparato conformemente alla Sezione 3, Preparazione del campione II). Avvicinarsi alla superficie del tessuto con il cantilever AFM accendendo il laser e facendo clic sul tasto Approach . Dopo che la punta è a contatto con la superficie del tessuto, ritrarre la punta a sbalzo in modo che la punta rimanga al centro dell'obiettivo (facendo clic sul tasto Retrazione, che ritrae il cantilever all'estremità superiore della gamma piezoelettrica). Riallineare il rilevatore se la posizione del laser viene spostata dal centro nella finestra Allineamento laser .
- Spegnere il laser e sovrapporre il campo ottico del microscopio con le mappe di misurazione AFM facendo clic sulla scheda Accessori e quindi selezionando Direct Overlay Optical Calibration. Nella finestra successiva, fare clic su Avanti per scattare una serie di immagini del cantilever che scansiona un'area specifica. Fare di nuovo clic su Avanti per passare alla finestra successiva.
- Nella prima immagine, fare clic manualmente sul centro della punta del cantilever per rappresentare la posizione della punta nel software. Il cerchio che rappresenta la posizione della punta può essere manipolato in dimensioni indicando il suo raggio per aumentare la precisione. Fare clic su Calibra per rilevare automaticamente la posizione della punta a sbalzo in tutte le immagini. Conferma l'accuratezza del rilevamento delle punte esaminando le immagini.
- Fare clic su Avanti , quindi su Fine per completare la sovrapposizione ottica e salvare la serie di immagini acquisite durante la calibrazione ottica.
- Ritrarre ulteriormente il cantilever per evitare la sua collisione con superfici più alte sulla slitta. Sposta lo stage per posizionare un'area ricca di collagene all'interno del riquadro verde visibile nella scheda Visualizzatore dati utilizzando l'immagine polarizzata. Seleziona l'area ricca di collagene creando un rettangolo attorno ad essa premendo a lungo il pulsante sinistro del mouse all'interno della casella verde specificata. Definite le dimensioni, l'orientamento e la risoluzione dell'area selezionata nella scheda Griglia sul lato sinistro. Fare clic su Conferma nuova regione di scansione per impostare l'area selezionata come area di misurazione.
- Mantenere i parametri IGain e PGain dei valori predefiniti del ciclo di feedback, se non vengono presentate instabilità importanti sotto forma di ipersensibilità del sistema. Per seguire questo protocollo, impostare IGain a 50 Hz e PGain a 0,001.
- Impostare il setpoint su 1 nN.
NOTA: il setpoint è la forza dell'interazione punta-superficie durante lo stato stazionario. Per la maggior parte dei campioni molli (cellule, gel e tessuti), sono appropriati valori di setpoint nell'intervallo 0,5-2,0 nN . - Selezionare il Valore di Setpoint Relativo in base alle proprietà meccaniche del materiale studiato e alla rigidità del cantilever. Per questo protocollo, impostare il valore su 5 nN.
NOTA: il setpoint relativo rappresenta la forza massima di interazione, quando viene raggiunto il picco della curva forza-distanza e il movimento della punta ritorna alla linea di base. Per i materiali morbidi (1-50 kPa), questo parametro è impostato in unità di nanonewton (nN). Inoltre, per un cantilever morbido (con una costante di molla da 0,05 N/m a 0,35 N/m), la forza massima che può essere applicata è di circa 50 NN. Regolate di conseguenza i valori di setpoint e setpoint relativi.- Assicurarsi che il valore di setpoint specificato non porti a una profondità di indentazione superiore al raggio del penetratore sferico, altrimenti la superficie di rientro non può essere definita correttamente nel calcolo del modulo di Young. Calcolare il valore medio della profondità di indentazione dopo la prima esecuzione delle indentazioni; vedere Sezione 5, Analisi dei dati, per sapere come elaborare i dati registrati. Se necessario, regolare il valore del setpoint .
- Impostare Regola linea di base su 5.
NOTA: in questo caso, la linea di base si riferisce al grado di polinomio utilizzato per adattare le curve di attacco e di ritrazione. L'impostazione della linea di base su 5 adatta le curve ad alta risoluzione e garantisce quindi l'acquisizione del rumore di fondo durante le misurazioni. - Selezionare la lunghezza del movimento a sbalzo nell'asse Z (lunghezza Z) in base alla topografia della superficie del campione. Per seguire questo protocollo, impostare la lunghezza Z a 15 μm.
NOTA: Un valore elevato (ad es. 15 μm) riduce la sensibilità di misura, ma di solito è richiesto per campioni con una superficie altamente irregolare come il tessuto epatico fibrotico. - Impostare il movimento Z su Durata costante.
NOTA: il movimento Z può anche essere impostato su Velocità costante per visualizzare i dati relativi al movimento Z (Estendi velocità ed Estendi tempo) in una modalità diversa. - Impostare il tempo di estensione su 1 s. Impostare Ritardo estensione e Ritardo retrazione su 0.
NOTA: Utilizzare velocità di estensione di >5,0 μm/s per materiali molto morbidi61, poiché velocità di rientranza inferiori si tradurranno in una risposta più viscosa e meno elastica dalle superfici morbide. Extension Delay e Retraction Delay sono parametri che possono essere utilizzati per studiare specifiche interazioni tra la punta a sbalzo e il substrato (ad esempio interazioni di una proteina immobilizzata sulla superficie del cantilever con proteine immobilizzate sulla superficie del vetrino). - Impostare la frequenza di campionamento su 5000 Hz.
NOTA: la frequenza di campionamento si riferisce alla frequenza dei punti registrati su una curva di attacco-retrazione completa. Impostate questo valore su un valore alto (ad es. 5000 Hz) per evitare di perdere alcune regioni delle curve a causa della loro transizione estremamente rapida. - Contrassegnare il circuito chiuso Z con un segno di spunta per attivare un sistema di circuito di retroazione, che garantisce la distanza di contatto tra la superficie del campione e la punta a sbalzo.
- Disinnestare lo stadio motorizzato deselezionando Coinvolgi e fai clic su Avvicina per avvicinarti al campione con il cantilever. Fare clic su Avvia scansione per iniziare a raccogliere le curve forza-distanza nell'area impostata al punto 6; Sezione 4, Misurazione.
5. Analisi dei dati
- Analizza i dati acquisiti utilizzando il software open source "AtomicJ" (che può essere scaricato da https://sourceforge.net/projects/jrobust/).
NOTA: supporta i file raccolti dai microscopi a forza atomica Agilent Technologies, JPK Instruments o Bruker. - Caricare le curve di forza nel programma facendo clic sull'icona Curve di forza di processo e mappe in AtomicJ (Figura supplementare S2A, x). Nell'assistente di elaborazione, aggiungere le mappe da analizzare facendo clic sul pulsante Aggiungi (Figura supplementare S2A, y). Fare clic su Avanti dopo aver caricato le mappe (Figura supplementare S2A, z).
- Specificare le impostazioni di elaborazione nella finestra successiva in base ai passaggi descritti di seguito (corrispondenti ai passaggi nella Figura supplementare S2B, passaggi 1-11):
- Stimare manualmente il punto di contatto tra il campione e il cantilever mediante calcolo o automaticamente utilizzando una serie di parametri della curva di raccordo. Per seguire questo protocollo, utilizzare la stima automatica del punto di contatto.
- Determinare il punto di contatto tra il cantilever e il campione con il metodo della griglia focalizzata classica.
- Selezionare il metodo di stima per ottenere la migliore determinazione del punto di contatto in base alla qualità delle curve di forza misurate, che deve essere determinata empiricamente durante l'ottimizzazione dell'analisi dei dati. Per seguire questo protocollo, utilizzare il metodo indipendente dal modello.
- Adattare la curva di rientro della forza utilizzando un modello classico (utilizzare L2 classico per adattare il modello a seguire questo protocollo).
NOTA: Model fit e Contact estimator sono parametri che regolano rispettivamente il modo in cui le curve vengono adattate dal software e il modo in cui viene stabilito il punto di contatto nella curva adattata. Per queste misure è stata utilizzata l'opzione classica, che utilizza la regressione dei minimi quadrati. Questo elabora ogni punto a bassa forza sulla curva come un punto di contatto di prova e adatta un polinomio alla regione prima del punto di contatto di prova. Quindi adatta il modello di contatto appropriato ai dati di rientro della forza raccolti. Il punto che dà la somma più bassa di quadrati è assunto come punto di contatto. Altri metodi possono essere utilizzati in base alla qualità delle curve di forza ottenute62,63. - Impostate l'adattamento del modello sulla curva di ritiro .
- Impostare il rapporto di Poisson come 0,45, come raccomandato per i tessuti molli come il fegato24.
- Impostate l'adattamento della curva utilizzando un grado di linea di base pari a 3 e un grado di contatto pari a 1. Modificate il grado di adattamento polinomiale in base alla scala delle deviazioni delle curve dal modello.
- Selezionate il modello utilizzato per adattare le curve di prelievo. Usa il modello di Sneddon , che calcola il modulo di Young in base all'equazione (1) e all'equazione (2):
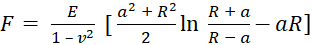 (1)
(1)
δ =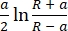 (2)
(2)
dove F è la forza, E è il modulo di Young, v è il rapporto di Poisson del campione, δ è la profondità di indentazione, a è il raggio di contatto e R è il raggio della sfera62,63. - Riempire il raggio della punta sferica in micrometri (2,9 μm in questo protocollo).
- Caricare la costante Spring e InvOLS dai file di dati abilitando la lettura ( selezionare le caselle).
- Fare clic su Fine.
NOTA: I dati analizzati sono presentati sotto forma di mappe di deflessione verticale, altezza, adesione, forza di contatto, deformazione, forza di adesione, valori R2 , pendenza, modulo di Young, rientranza di transizione, forza di transizione e posizione di contatto calcolata per ciascuna curva di forza (Figura supplementare S3, in alto a sinistra). Due finestre aggiuntive visualizzano curve di forza e valori non elaborati (Figura supplementare S3, rispettivamente pannelli in alto a destra e in basso).
- Escludere le curve di forza in cui il cantilever si è avvicinato in modo errato alla superficie della sezione epatica. Per identificarli, cercare curve con rumore elevato, forme aberranti e/o approccio incompleto, come dimostrato nella Figura 3 e discusso in dettaglio altrove46.
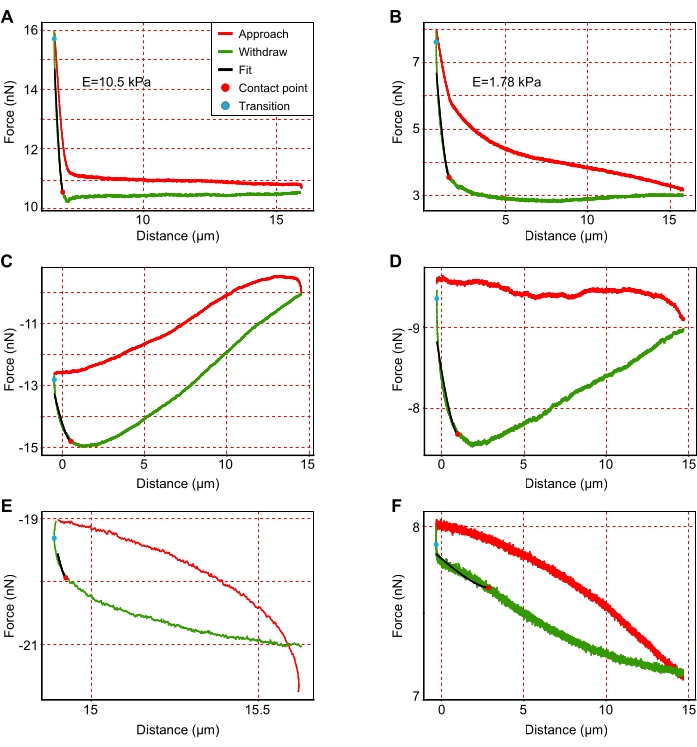
Figura 3: Esempi di curve rappresentative forza-spostamento. (A,B) Curve di forza interpretabili rappresentative per le più rigide (A; E = 10,5 kPa) e più morbido (B; E = 1,78 kPa) aree adatte all'analisi. (C-F) Grafici rappresentativi non interpretabili che devono essere esclusi dall'analisi a causa di (C-E) approccio errato o (F) rumore più elevato. Come indicato nella legenda fornita in (A), le curve rosse mostrano l'avvicinamento del cantilever, mentre le curve verdi mostrano la retrazione del cantilever. Le linee nere mostrano il raccordo della curva di ritiro del cantilever. La pendenza delle linee nere corrisponde al modulo di Young. I punti rosso e blu corrispondono rispettivamente al punto di contatto e al punto di transizione. Il punto di contatto è l'ultimo punto di contatto tra il cantilever e il substrato durante la retrazione, mentre il punto di transizione descrive la transizione del cantilever dall'avvicinamento alla retrazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Risultati
Sezioni epatiche lievemente fisse, spesse 30 μm ottenute da topi di controllo e da topi con fibrosi lieve o avanzata (indotta mediante iniezione di CCl4 per 3 settimane o 6 settimane, rispettivamente49) sono state esaminate con AFM come descritto in questo protocollo. Le fibre di collagene vicino alle vene centrali sono state selezionate per la misurazione delle mappe di rigidità. Le aree vicine alle vene centrali, che corrispondono alle aree in cui di solito si formano le fibre di collagene negli animali trattati con CCl4, sono state analizzate nei fegati di controllo (Figura 4A). La distribuzione dei moduli di Young era riproducibile attraverso diversi fegati di controllo e aree ricche di collagene all'interno di una singola sezione del fegato (Figura 4B: grafico del violino sinistro).
Negli animali trattati con CCl 4, le mappe di rigidità corrispondenti alle aree pericentrali dei depositi di collagene hanno mostrato valori significativamente più elevati dei moduli di Young rispetto alle aree equivalenti nei topi di controllo (Figura 4B: 1,9 kPa vs. 2,6 kPa mediana dei valori del modulo di Young per il controllo vs. 3 settimane di topo trattato con CCl 4; p = 0,07; 1,9 kPa vs. 5,1 kPa valori mediani del modulo di Young per il controllo vs. 6 settimane CCl4 -topo trattato; p = 0,02). Inoltre, c'è stato un aumento significativo dei valori dei moduli di Young con un trattamento CCl 4 più lungo (Figura 4B; 2,6 kPa vs 5,1 kPa valori del modulo mediano di Young per 3 settimane vs. 6 settimane di topi trattati con CCl4; p = 0,04). Ciò mostra un graduale irrigidimento dei depositi di collagene con progressione della fibrosi e che le misurazioni AFM riflettono la fibrogenesi.
Per valutare l'effetto della conservazione prolungata di sezioni epatiche incorporate in OCT sulle proprietà meccaniche delle fibre di collagene, abbiamo misurato la rigidità delle fibre di collagene in sezioni di topi trattati con CCl4, che sono stati conservati a -80 ° C per 2 settimane o 3 mesi sul vetrino dopo il taglio (Figura 5). Le misurazioni AFM hanno mostrato valori significativamente più bassi dei moduli di Young nelle aree ricche di collagene per le sezioni conservate per 3 mesi rispetto a quelle ottenute dalle sezioni misurate entro 2 settimane dal sezionamento del campione (Figura 5; 4,7 kPa rispetto ai valori del modulo di Young mediano di 3,6 kPa per 2 settimane rispetto a 3 mesi di conservazione; p < 0,001). Pertanto, è importante misurare le proprietà meccaniche del tessuto epatico poco dopo che le sezioni sono state preparate dai lobi epatici incorporati nell'OCT.
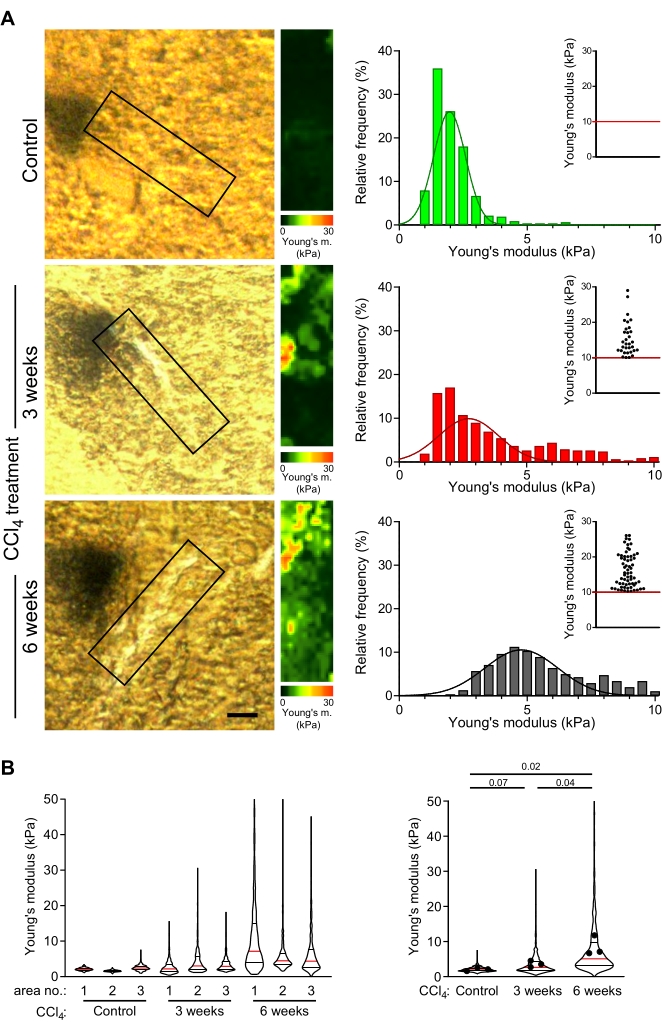
Figura 4: Le misurazioni dell'AFM rivelano un progressivo irrigidimento delle aree ricche di collagene correlate al trattamento prolungato con CCl4. (A) Sezioni di fegato di topi di controllo e topi trattati con CCl4 per 3 settimane o 6 settimane sono state utilizzate per misurare le proprietà meccaniche delle aree ricche di collagene. Le aree inscatolate delle sezioni epatiche mostrate nelle immagini di microscopia polarizzata (a sinistra) sono aree di scansione ricche di collagene (o regioni corrispondenti nel fegato di controllo) selezionate per le misurazioni AFM (30 μm x 100 μm, 10 pixel x 36 pixel). Le mappe del modulo di Young con scale di colori corrispondenti a queste aree riposte sono mostrate sulla destra, compresi gli istogrammi dei valori del modulo di Young da queste mappe; I grafici a dispersione inseriti mostrano valori >10 kPa per ogni condizione. L'irrigidimento del fegato viene visualizzato come un graduale spostamento verso destra nella distribuzione dell'istogramma e una maggiore frequenza di punti nel grafico a dispersione inserito. Barra di scala = 20 μm. (B) I grafici a violino mostrano la distribuzione dei moduli elastici da tre aree misurate per ciascuna condizione (a sinistra) e riassumono i valori dei moduli elastici da tutte e tre le mappe (a destra). I grafici del violino mostrano la mediana (linea rossa), il 25° percentile e il 75° percentile (linee nere); I punti rappresentano i valori medi delle singole mappe delle aree 1-3. I valori p presentati sono stati calcolati utilizzando un t-test di Student eseguito sulle medie. Abbreviazioni: AFM = microscopia a forza atomica; CCl4 = tetracloruro di carbonio. Fare clic qui per visualizzare una versione ingrandita di questa figura.
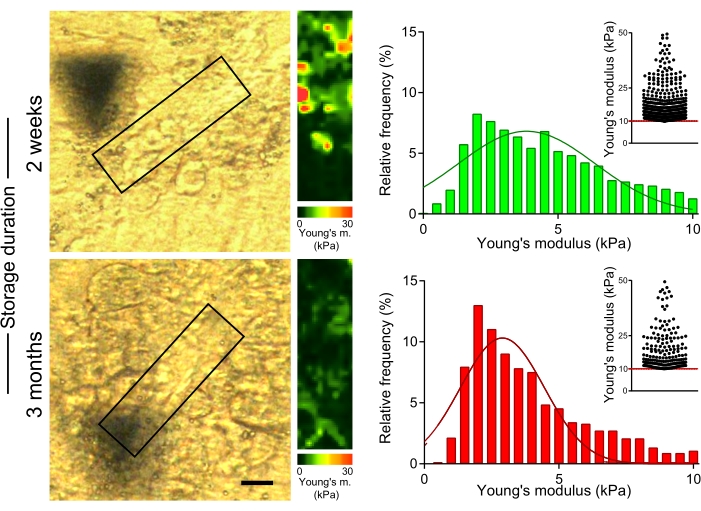
Figura 5: La conservazione prolungata delle sezioni del fegato porta ad una diminuzione della rigidità delle aree ricche di collagene. Per misurare il modulo di Young sono state utilizzate sezioni di fegato (preparate da topi trattati con CCl4 per 2 settimane) conservate a -80 °C per 2 settimane o 3 mesi. Immagini al microscopio polarizzato (a sinistra) con caselle che indicano le aree ricche di collagene utilizzate per la misurazione dell'AFM (30 μm x 100 μm, 10 pixel x 36 pixel). Mappe del modulo di Young corrispondenti con scale di colori (a destra). Gli istogrammi mostrano i valori del modulo di Young raccolti da 4-6 aree in ciascun campione; I grafici a dispersione inseriti mostrano valori >10 kPa per ogni condizione. Barra della scala = 20 μm. Abbreviazioni: AFM = microscopia a forza atomica; CCl4 = tetracloruro di carbonio. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Figura supplementare S1: Metodo per modificare il cantilever con un micro perlo di resina melamminica. (A) Lo schema disegnato illustra il fissaggio di una perla sferica alla punta del cantilever. Per una descrizione graduale, vedere Sezione 2, Parte 1, Fissaggio di un tallone da 5,7 μm alla punta a sbalzo AFM. (B) Immagine al microscopio di una sferica da 5,7 μm attaccata alla punta a sbalzo mostrata dall'alto (a sinistra) e laterale (a destra). Barre della scala = 20 μm. Abbreviazioni: AFM = microscopia a forza atomica; RT = temperatura ambiente. Clicca qui per scaricare questo file.
Figura supplementare S2: Analisi dei dati in AtomicJ. (A) La sequenza di passaggi da seguire per l'apertura delle mappe di rigidezza in AtomicJ. Un singolo clic sinistro sulle curve di forza di processo e sulle mappe (x) apre l'assistente di elaborazione. I file possono essere caricati nell'assistente di elaborazione facendo clic su aggiungi (y) e selezionando i file richiesti. Fare clic su Avanti (z) per procedere al passaggio successivo. (B) Parametri per l'adattamento della curva, il modello di meccanica di contatto appropriato e le impostazioni AFM utilizzate durante la misurazione. I passaggi da 1 a 11 si riferiscono ai corrispondenti sottopunti dettagliati nella fase 3 del protocollo, Sezione 5, Analisi dei dati. Clicca qui per scaricare questo file.
Figura supplementare S3: Schema dei dati analizzati in AtomicJ. L'anteprima dei dati analizzati mostra le mappe di rigidità (finestra in alto a sinistra), le curve di forza (finestra in alto a destra) e i dati grezzi (finestra inferiore). Abbreviazione: AFM = microscopia a forza atomica. Clicca qui per scaricare questo file.
Discussione
Il protocollo presentato fornisce un metodo riproducibile passo-passo per la misurazione AFM del tessuto epatico di topo normale e fibrotico. La microscopia a polarizzazione accoppiata fornisce un'elevata precisione spaziale e consente la visualizzazione delle fibre di collagene grazie alla loro birifrangenza. Inoltre, viene fornita una descrizione dettagliata dell'analisi delle curve di forza ottenute. La misurazione della rigidità AFM può essere eseguita a livello cellulare, il che consente di monitorare i cambiamenti locali nelle proprietà meccaniche del tessuto epatico dovuti allo sviluppo di malattie fibrotiche. La fibrosi epatica non è un processo omogeneo che colpisce l'intero organo. Al contrario, le aree di setti fibrotici ricchi di collagene sono intervallate da aree di depositi di collagene bassi o assenti. Pertanto, i cambiamenti di rigidità sono specifici del microambiente locale e influenzano solo le cellule localmente a contatto con le aree danneggiate da lesioni. Questa microscala di eterogeneità della rigidità è evidente anche nei dettagli delle mappe del modulo di AFM Young, dove i punti di elevata rigidità confinano con le aree di rigidità quasi normale. Questa variazione mostra che anche l'area del tessuto cicatriziale del collagene non è meccanicamente omogenea e richiede la misurazione dell'AFM per essere caratterizzata a livello cellulare (Figura 4).
Il protocollo presentato consente di misurare la rigidità epatica mediante AFM indipendentemente dalla raccolta del fegato, poiché i lobi interi del fegato incorporati nell'OCT possono essere conservati per un periodo prolungato a -80 °C. Tuttavia, una volta sezionato il tessuto, si consiglia di misurare i campioni entro ~ 2 settimane poiché abbiamo osservato un graduale ammorbidimento delle sezioni di tessuto conservate per periodi di tempo più lunghi (Figura 5).
L'AFM dotato di microscopia a polarizzazione consente di localizzare con precisione l'area di interesse all'interno della struttura del lobulo epatico. Tuttavia, ha anche alcune limitazioni che devono essere considerate quando si interpretano i risultati. I valori di rigidità qui ottenuti sono stati misurati a temperatura ambiente. Supponiamo che gli effetti della temperatura sulle proprietà meccaniche dei tessuti molli saranno piccoli; Tuttavia, questo potrebbe essere uno dei motivi delle differenze tra i valori riportati in vivo delle proprietà meccaniche dei tessuti epatici e i valori in questo studio.
Inoltre, questo protocollo consente l'analisi AFM del tessuto epatico fino a 3 ore, che richiede una lieve fissazione del tessuto. La lieve fissazione delle sezioni di tessuto, così come il ciclo di congelamento-disgelo, molto probabilmente influenzerà i valori assoluti del modulo di Young. Pertanto, i valori riportati dei moduli di Young potrebbero differire dai valori in vivo . Sono necessari ulteriori studi per ottimizzare il protocollo per la misurazione dei valori assoluti del modulo di Young da sezioni epatiche, che possono essere ottenuti con un metodo diverso per la fissazione del tessuto epatico64.
Tuttavia, abbiamo osservato una crescente rigidità delle aree ricche di collagene nel fegato dei topi trattati con CCl4 per 3 settimane rispetto a 6 settimane. Tali cambiamenti corrispondono alla progressione della fibrosi durante una lesione prolungata (Figura 4) e mostrano che le differenze relative possono essere sondate tra i diversi trattamenti utilizzando il protocollo presentato. Ciò è in accordo con le osservazioni di Calò et al., che hanno dimostrato che sezioni epatiche leggermente fisse mostrano differenze simili nei valori di rigidità tra aree ricche di collagene e prive di collagene come nel tessuto fresco25.
Abbiamo utilizzato il cantilever SD-qp-BioT-TL-10 (costante teorica della molla ~0,09 N/m) modificato con una punta sferica di 5,7 μm di diametro per ridurre al minimo la rottura meccanica del tessuto epatico durante le misurazioni. Un tallone da 5,7 μm ha consentito una rientranza sufficiente del campione per sondarne la rigidità preservandone l'integrità. Un tallone con un diametro più piccolo può essere utilizzato, dopo diverse ottimizzazioni, per ottenere una risoluzione più elevata nelle mappe di rigidità, ma potrebbe portare a un'ulteriore sovrastima dei valori del modulo di Young (per maggiori dettagli, vedi Crichton et al.65). Utilizzando l'insieme di perline a sbalzo specificato, siamo stati in grado di caratterizzare la rigidità del campione in un ampio intervallo, da decine di unità di Pa a ~ 100 kPa.
Il modello di Sneddon è stato utilizzato per derivare il modulo di Young dalle curve di forza, in quanto consente l'analisi di rientranze profonde con sonde colloidali62. Il modello di Sneddon, a differenza del modello di Hertz, non soffre del vincolo che il raggio di contatto deve essere molto più piccolo del raggio della sfera. Si presuppone inoltre che lo spessore del campione sia parecchie volte superiore alla profondità di indentazione30,66. Nel presente studio, l'indentazione era ~ 2 μm con una dimensione del tallone di 5,7 μm e uno spessore del campione di 30 μm in aree ricche di collagene; quindi, il modello di Sneddon era appropriato. Altri modelli63 considerando la forza di adesione tra punta e substrato possono essere utilizzati per diversi tipi di tessuti.
L'analisi in AtomicJ implementa correzioni per lo spessore finito dei campioni per minimizzare il contributo di un substrato derivando il modulo di Young62,67. Nell'analisi delle curve di forza ottenute, abbiamo utilizzato un singolo rapporto di Poisson di 0,45, che è stato precedentemente raccomandato per gli organi dei tessuti molli24. Questa approssimazione non ha un effetto significativo sui valori calcolati del modulo di Young, poiché la variazione del valore del rapporto di Poisson da 0,4 a 0,5 risulta solo in una diminuzione di 0,893 volte i valori del modulo di Young calcolati secondo l'equazione di Sneddon. Date le molteplici differenze nel modulo di Young tra le diverse durate dei trattamenti CCl4, gli errori prodotti approssimando il rapporto di Poisson sono solo marginali.
Abbiamo usato curve di prelievo per calcolare i valori di rigidità, poiché eravamo interessati alla risposta elastica del tessuto al carico fornito dal cantilever piuttosto che alla risposta plastica all'indentazione68. A causa della risposta viscoelastica dei tessuti molli, le curve di ritiro potrebbero sovrastimare il modulo di Young, che dovrebbe essere tenuto a mente. Inoltre, abbiamo osservato che l'analisi dei dati con curve di approccio produce tendenze simili nei valori di rigidità tra aree fibrotiche e di controllo, sebbene i valori assoluti siano corrispondentemente inferiori (dati non mostrati).
Durante l'ottimizzazione del protocollo, abbiamo identificato diversi passaggi critici per la riproducibilità delle misurazioni. Innanzitutto, è importante assicurarsi che il tallone sia approssimativamente al centro della punta traslucida mentre si attacca al cantilever. Ciò impedisce possibili squilibri meccanici durante l'indentazione. In secondo luogo, durante la fissazione del fegato con PFA, è necessario seguire rigorosamente i limiti di tempo per lo scongelamento e la fissazione. La modifica dei tempi di questo passaggio potrebbe influire gravemente sulle proprietà meccaniche delle sezioni di tessuto. In terzo luogo, il cantilever deve essere ripetutamente calibrato con monitoraggio continuo e immissione di valori di temperatura simultanei per evitare che si verifichino artefatti nei valori di rigidità dovuti alle fluttuazioni di temperatura. Infine, una singola sezione del fegato non deve essere misurata per più di 3 ore dalla preparazione, poiché la PBS sovrapposta può evaporare per periodi più lunghi. I lettori possono fare riferimento alla tabella di risoluzione dei problemi (Tabella 3) per risolvere i problemi incontrati durante la misurazione AFM, discussa anche in dettaglio in Norman et al.46.
Tabella 3: Guida alla risoluzione dei problemi. Clicca qui per scaricare questa tabella.
Il protocollo presentato consente il sondaggio AFM riproducibile del tessuto epatico. Ha il potenziale per rivelare informazioni sullo sviluppo e l'eventuale regressione della malattia epatica fibrotica a livello microscopico e può contribuire allo sviluppo di terapie mirate alle regioni cicatriziali fibrotiche formate durante la progressione della malattia epatica cronica.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla Grant Agency della Repubblica Ceca (18-02699S), dal Progetto di ricerca istituzionale dell'Accademia ceca delle scienze (RVO 68378050) e dal progetto MEYS CR NICR EXCELES (LX22NPO05102). CIISB, Instruct-CZ Centre of Instruct-ERIC EU consortium, finanziato dal progetto infrastrutturale MEYS CR LM2018127 e dal progetto del Fondo europeo di sviluppo regionale "UP CIISB" (No. CZ.02.1.01/0.0/0.0/18_046/0015974) ha sostenuto finanziariamente le misurazioni presso il CF Nanobiotechnology, CEITEC MU. Ringraziamo inoltre la Light Microscopy Core Facility, IMG CAS, Praga, Repubblica Ceca, supportata da MEYS (LM2018129, CZ.02.1.01/0.0/0.0/18_046/0016045) e RVO: 68378050-KAV-NPUI, per il loro supporto con l'imaging microscopico qui presentato.
Materiali
| Name | Company | Catalog Number | Comments |
| AFM head | Bruker | JPK nanowizard 3 | |
| Cameras | Andor | Zyla 5.5 USB (sCMOS, water cooled) | |
| The Imagingsource | S/N:12310015 | ||
| Cantilever | SD-qp-BioT-TL-10, Nanosensors | S/N:73750F05 | |
| Cryotome | Leica | CM1950 | |
| Epoxy resin glue (Long working time ) | Bison epoxy universal | ||
| Melamine beads; diameter, 5.7 um | Microparticles, GmbH | MF-R-5.7 | |
| Microscope | Olympus | IX81 | |
| Hydrophobic slide marker | SuperHT | PAP PEN | |
| Software | JPK nanowizard v6.1.151 | ||
| AtomicJ v2.3.1 | |||
| Superfrost slides | Thermoscientific | ref no. J1800AMNZ | |
| System | Ubuntu 14.04.5 LTS | ||
| Vibration isolation control unit | Tablestable | AVI-200-S |
Riferimenti
- vanden Berghe, G. The role of the liver in metabolic homeostasis: Implications for inborn errors of metabolism. Journal of Inherited Metabolic Dis. 14 (4), 407-420 (1991).
- Stanger, B. Z. Cellular homeostasis and repair in the mammalian liver. Annual Reviews of Physiology. 77, 179-200 (2015).
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Hernandez-Gea, V., Friedman, S. L. Pathogenesis of liver fibrosis. Annual Review of Pathology. 6, 425-456 (2011).
- Georges, P. C., et al. Increased stiffness of the rat liver precedes matrix deposition: Implications for fibrosis. American Journal of Physiology. Gastrointestinal and Liver Physiology. 293 (6), 1147-1154 (2007).
- Perepelyuk, M., et al. Hepatic stellate cells and portal fibroblasts are the major cellular sources of collagens and lysyl oxidases in normal liver and early after injury. American Journal of Physiology. Gastrointestinal and Liver Physiology. 304 (6), 605-614 (2013).
- Wells, R. G. The role of matrix stiffness in regulating cell behavior. Hepatology. 47 (5), 1394-1400 (2008).
- Olsen, A. L., et al. Hepatic stellate cells require a stiff environment for myofibroblastic differentiation. American Journal of Physiology. Gastrointestinal and Liver Physiology. 301 (1), 110-118 (2011).
- Sandrin, L., et al. Transient elastography: A new noninvasive method for assessment of hepatic fibrosis. Ultrasound in Medicine & Biology. 29 (12), 1705-1713 (2003).
- Ling, W., et al. Effects of vascularity and differentiation of hepatocellular carcinoma on tumor and liver stiffness: In vivo and in vitro studies. Ultrasound in Medicine & Biology. 40 (4), 739-746 (2014).
- Wong, V. W. S., et al. Diagnosis of fibrosis and cirrhosis using liver stiffness measurement in nonalcoholic fatty liver disease. Hepatology. 51 (2), 454-462 (2010).
- Cha, S. W., et al. Nondiseased liver stiffness measured by shearwave elastography a pilot study. Journal of Ultrasound in Medicine. 33 (1), 53-60 (2014).
- Castera, L., Forns, X., Alberti, A. Non-invasive evaluation of liver fibrosis using transient elastography. Journal of Hepatology. 48 (5), 835-847 (2008).
- Chang, W., et al. Liver fibrosis staging with MR elastography: Comparison of diagnostic performance between patients with chronic hepatitis B and those with other etiologic causes. Radiology. 280 (1), 88-97 (2016).
- Venkatesh, S. K., Yin, M., Ehman, R. L. Magnetic resonance elastography of liver: Clinical applications. Journal of Computer Assisted Tomography. 37 (6), 887-896 (2013).
- Venkatesh, S. K., Yin, M., Ehman, R. L. Magnetic resonance elastography of liver: Technique, analysis and clinical applications. Journal of Magnetic Resonance Imaging. 37 (3), 544-555 (2013).
- Venkatesh, S. K., Wang, G., Teo, L. L. S., Ang, B. W. L. Magnetic resonance elastography of liver in healthy Asians: Normal liver stiffness quantification and reproducibility assessment. Journal of Magnetic Resonance Imaging. 39 (1), 1-8 (2014).
- Lee, D. H., Lee, J. M., Han, J. K., Choi, B. I. MR elastography of healthy liver parenchyma: Normal value and reliability of the liver stiffness value measurement. Journal of Magnetic Resonance Imaging. 38 (5), 1215-1223 (2013).
- Mueller, S. Liver stiffness: A novel parameter for the diagnosis of liver disease. Hepatic Medicine. Evidence and Research. 2, 49-67 (2010).
- Goodman, Z. D. Grading and staging systems for inflammation and fibrosis in chronic liver diseases. Journal of Hepatology. 47 (4), 598-607 (2007).
- Salameh, N., et al. Hepatic viscoelastic parameters measured with MR elastography: Correlations with quantitative analysis of liver fibrosis in the rat. Journal of Magnetic Resonance Imaging. 26 (4), 956-962 (2007).
- Yin, M., et al. Quantitative assessment of hepatic fibrosis in an animal model with magnetic resonance elastography. Magnetic Resonance in Medicine. 58 (2), 346-353 (2007).
- Bastard, C., et al. Transient micro-elastography: A novel non-invasive approach to measure liver stiffness in mice. World Journal of Gastroenterology. 17 (8), 968-975 (2011).
- Barnes, S. L., Lyshchik, A., Washington, M. K., Gore, J. C., Miga, M. I. Development of a mechanical testing assay for fibrotic murine liver. Medical Physics. 34 (11), 4439-4450 (2007).
- Calò, A., et al. Spatial mapping of the collagen distribution in human and mouse tissues by force volume atomic force microscopy. Scientific Reports. 10, 15664 (2020).
- Desai, S. S., et al. Physiological ranges of matrix rigidity modulate primary mouse hepatocyte function in part through hepatocyte nuclear factor 4 alpha. Hepatology. 64 (1), 261-275 (2016).
- Kostallari, E., et al. Stiffness is associated with hepatic stellate cell heterogeneity during liver fibrosis. American Journal of Physiology. Gastrointestinal and Liver Physiology. 322 (2), 234-246 (2022).
- Binnig, G., Qaute, C. F., Gerber, C. Atomic force microscope. Physical Review Letters. 56 (9), (1986).
- Johnson, K. L. . Contact Mechanics. , (1985).
- Asgari, M., Latifi, N., Giovanniello, F., Espinosa, H. D., Amabili, M. Revealing layer-specific ultrastructure and nanomechanics of fibrillar collagen in human aorta via atomic force microscopy testing: Implications on tissue mechanics at macroscopic scale. Advanced NanoBiomed Research. 2 (5), 2100159 (2022).
- Amabili, M., et al. Microstructural and mechanical characterization of the layers of human descending thoracic aortas. Acta Biomaterialia. 134, 401-421 (2021).
- Grant, C. A., Twigg, P. C., Tobin, D. J. Static and dynamic nanomechanical properties of human skin tissue using atomic force microscopy: Effect of scarring in the upper dermis. Acta Biomaterialia. 8 (11), 4123-4129 (2012).
- Geerligs, M., et al. In vitro indentation to determine the mechanical properties of epidermis. Journal of Biomechanics. 44 (6), 1176-1181 (2011).
- Liu, F., Tschumperlin, D. J. Micro-mechanical characterization of lung tissue using atomic force microscopy. Journal of Visualized Experiments. (54), e2911 (2011).
- Sicard, D., Fredenburgh, L. E., Tschumperlin, D. J. Measured pulmonary arterial tissue stiffness is highly sensitive to AFM indenter dimensions. Journal of the Mechanical Behavior of Biomedical Materials. 74, 118-127 (2017).
- Babu, P. K. V., Radmacher, M. Mechanics of brain tissues studied by atomic force microscopy: A perspective. Frontiers in Neuroscience. 13, 600 (2019).
- del Mar Vivanco, M. . Mammary Stem Cells: Methods and protocols. , (2015).
- Zanetti-Dällenbach, R., et al. Length scale matters: Real-time elastography versus nanomechanical profiling by atomic force microscopy for the diagnosis of breast lesions. Biomed Research International. 2018, 3840597 (2018).
- Lopez, J. I., Kang, I., You, W. -. K., McDonald, D. M., Weaver, V. M. In situ force mapping of mammary gland transformation. Integrative Biology. 3 (9), 910-921 (2011).
- Stolz, M., et al. Early detection of aging cartilage and osteoarthritis in mice and patient samples using atomic force microscopy. Nature Nanotechnol. 4 (3), 186-192 (2009).
- Borin, D., Pecorari, I., Pena, B., Sbaizero, O. Novel insights into cardiomyocytes provided by atomic force microscopy. Seminars in Cell & Developmental Biology. 73, 4-12 (2018).
- Lachaize, V., et al. Atomic Force Microscopy: An innovative technology to explore cardiomyocyte cell surface in cardiac physio/pathophysiology. Letters in Applied NanoBioScience. 4 (4), 321-324 (2015).
- Lieber, S. C., et al. Aging increases stiffness of cardiac myocytes measured by atomic force microscopy nanoindentation. American Journal of Physiology. Heart and Circulatory Physiology. 287 (2), 645-651 (2004).
- Guedes, A. F., et al. Atomic force microscopy as a tool to evaluate the risk of cardiovascular diseases in patients. Nature Nanotechnology. 11 (8), 687-692 (2016).
- Zhu, Y., Dong, Z., Wejinya, U. C., Jin, S., Ye, K. Determination of mechanical properties of soft tissue scaffolds by atomic force microscopy nanoindentation. Journal of Biomechanics. 44 (13), 2356-2361 (2011).
- Norman, M. D. A., Ferreira, S. A., Jowett, G. M., Bozec, L., Gentleman, E. Measuring the elastic modulus of soft culture surfaces and three-dimensional hydrogels using atomic force microscopy. Nature Protocols. 16 (5), 2418-2449 (2021).
- Thomas, G., Burnham, N. A., Camesano, T. A., Wen, Q. Measuring the mechanical properties of living cells using atomic force microscopy. Journal of Visualized Experiments. (76), e50497 (2013).
- McKee, C. T., Last, J. A., Russell, P., Murphy, C. J. Indentation versus tensile measurements of Young's modulus for soft biological tissues. Tissue Engineering. Part B, Reviews. 17 (3), 155-164 (2011).
- Scholten, D., Trebicka, J., Liedtke, C., Weiskirchen, R. The carbon tetrachloride model in mice. Laboratory Animals. 49, 4-11 (2015).
- Nevzorova, Y. A., Boyer-Diaz, Z., Cubero, F. J., Gracia-Sancho, J. Animal models for liver disease - A practical approach for translational research. Journal of Hepatology. 73 (2), 423-440 (2020).
- Ribeiro, J. F., dos Anjos, E. H. M., Mello, M. L. S., de Campos Vidal, B. Skin collagen fiber molecular order: A pattern of distributional fiber orientation as assessed by optical anisotropy and image analysis. PLoS One. 8 (1), 54724 (2013).
- Ozkan, A., et al. The influence of chronic liver diseases on hepatic vasculature: A liver-on-a-chip review. Micromachines. 11 (5), 487 (2020).
- Guimarães, C. F., Gasperini, L., Marques, A. P., Reis, R. L. The stiffness of living tissues and its implications for tissue engineering. Nature Reviews Materials. 5, 351-370 (2020).
- Khajehahmadi, Z., et al. Liver stiffness correlates with serum osteopontin and TAZ expression in human liver cirrhosis. Annals of the New York Academy of Sciences. 1465 (1), 117-131 (2020).
- Tian, M., et al. The nanomechanical signature of liver cancer tissues and its molecular origin. Nanoscale. 7 (30), 12998-13010 (2015).
- Zhao, G., et al. Mechanical stiffness of liver tissues in relation to integrin β1 expression may influence the development of hepatic cirrhosis and hepatocellular carcinoma. Journal of Surgical Oncology. 102 (5), 482-489 (2010).
- Gang, Z., Qi, Q., Jing, C., Wang, C. Measuring microenvironment mechanical stress of rat liver during diethylnitrosamine induced hepatocarcinogenesis by atomic force microscope. Microscopy Research and Technique. 72 (9), 672-678 (2009).
- Sader, J. E., et al. Spring constant calibration of atomic force microscope cantilevers of arbitrary shape. The Review of Scientific Instruments. 83 (10), 103705 (2012).
- JPK Instruments. A practical guide to AFM force spectroscopy and data analysis. JPK Instruments Technical Note. JPK Instruments. , 1-8 (2016).
- van Eysden, C. A., Sader, J. E. Frequency response of cantilever beams immersed in viscous fluids. Journal of Applied Physics. 101, 044908 (2015).
- Kim, Y., Yang, Y. I., Choi, I., Yi, J. Dependence of approaching velocity on the force-distance curve in AFM analysis. Korean Journal of Chemical Engineering. 27, 324-327 (2010).
- Hermanowicz, P., Sarna, M., Burda, K., Gabryś, H. AtomicJ: An open source software for analysis of force curves. The Review of Scientific Instruments. 85 (6), 063703 (2014).
- Hermanowicz, P. . AtomicJ 2.3.1 User's Manual. , (2021).
- Iwashita, M., et al. Comparative Analysis of Brain Stiffness Among Amniotes Using Glyoxal Fixation and Atomic Force Microscopy. Frontiers in Cell and Developmental Biology. 8, 574619 (2020).
- Crichton, M. L., et al. The viscoelastic, hyperelastic and scale dependent behaviour of freshly excised individual skin layers. Biomaterials. 32 (20), 4670-4681 (2011).
- Puricelli, L., Galluzzi, M., Schulte, C., Podestà, A., Milani, P. Nanomechanical and topographical imaging of living cells by atomic force microscopy with colloidal probes. The Review of Scientific Instruments. 86 (3), 033705 (2015).
- Hermanowicz, P. Determination of Young's modulus of samples of arbitrary thickness from force distance curves: Numerical investigations and simple approximate formulae. International Journal of Mechanical Sciences. 193, 106138 (2021).
- Han, R., Chen, J. A modified Sneddon model for the contact between conical indenters and spherical samples. Journal of Materials Research. 36, 1762-1771 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon