Method Article
فحص CAM-Delam لتسجيل الخصائص النقيلية عن طريق تحديد قدرة التحلل والغزو للخلايا السرطانية
In This Article
Summary
إن اختبار CAM-Delam لتقييم القدرة النقيلية للخلايا السرطانية سريع نسبيا وسهل ورخيص. يمكن استخدام هذه الطريقة لكشف الآليات الجزيئية التي تنظم تكوين ورم خبيث ولفحص الأدوية. يمكن أن يكون الفحص الأمثل لتحليل عينات الورم البشري طريقة سريرية لعلاج السرطان الشخصي.
Abstract
السبب الرئيسي للوفيات المرتبطة بالسرطان هو تكوين ورم خبيث (أي عندما تنتشر الخلايا السرطانية من الورم الأساسي إلى الأعضاء البعيدة وتشكل أوراما ثانوية). التفكيك ، الذي يعرف بأنه تدهور الصفيحة القاعدية والغشاء السفلي ، هو العملية الأولية التي تسهل انتقال الخلايا السرطانية وانتشارها إلى الأنسجة والأعضاء الأخرى. إن تسجيل قدرة الخلايا السرطانية على التفكيك يشير إلى الإمكانات النقيلية لهذه الخلايا.
لقد طورنا طريقة موحدة ، وهي فحص CAM-Delam السابق ، لتصور وتحديد قدرة الخلايا السرطانية على التطهير والغزو ، وبالتالي القدرة على تقييم العدوانية النقيلية. باختصار ، تتضمن طريقة CAM-Delam بذر الخلايا السرطانية في حلقات السيليكون على الغشاء المشيمي (CAM) في اليوم الجنيني 10 ، تليها الحضانة من ساعات إلى بضعة أيام. يتضمن فحص CAM-Delam استخدام غرفة رطبة داخلية أثناء حضانة جنين الفرخ. أدى هذا النهج الجديد إلى زيادة بقاء الجنين من 10٪ -50٪ إلى 80٪ -90٪ ، مما أدى إلى حل المشكلات التقنية السابقة مع انخفاض معدلات بقاء الجنين في اختبارات CAM المختلفة.
بعد ذلك ، تم عزل عينات CAM مع مجموعات الخلايا السرطانية المرتبطة بها وإصلاحها وتجميدها. وأخيرا، تم تصور العينات المجزأة بالتبريد وتحليلها بحثا عن تلف الغشاء السفلي وغزو الخلايا السرطانية باستخدام الكيمياء النسيجية المناعية. من خلال تقييم مختلف خطوط الخلايا السرطانية النقيلية وغير النقيلية المعروفة المصممة للتعبير عن بروتين الفلورسنت الأخضر (GFP) ، أظهرت النتائج الكمية ل CAM-Delam أن أنماط قدرة التفكيك تعكس العدوانية النقيلية ويمكن تسجيلها في أربع فئات. الاستخدام المستقبلي لهذا الفحص ، بصرف النظر عن تحديد قدرة التفكيك كميا كمؤشر على العدوانية النقيلية ، هو الكشف عن الآليات الجزيئية التي تتحكم في التفكيك ، والغزو ، وتشكيل النقائل الدقيقة ، والتغيرات في البيئة الدقيقة للورم.
Introduction
ما يقرب من 90 ٪ من الوفيات في مرضى السرطان ناتجة عن عواقب ورم خبيث للسرطان ، وهو تكوين أورام ثانوية في أجزاء أخرى من الجسم من حيث نشأ السرطان في الأصل1. لذلك ، من المهم تحديد الآليات المتعلقة بالنقائل للعثور على أهداف محتملة لقمع تكوين النقائل السرطانية. في وقت لاحق ، هناك حاجة إلى أنظمة نموذجية يمكن من خلالها تقييم العملية النقيلية.
أثناء الانبثاث ، تخضع الخلايا السرطانية للانتقال الظهاري إلى الوسيط (EMT) ، وهي عملية خلوية طبيعية تفقد فيها الخلايا الظهارية خصائص الالتصاق والقطبية وبدلا من ذلك تكتسب طابعا وسيطا غازيا2. التفكيك هو جزء من عملية EMT وينطوي على تدهور اللامينين في الغشاء السفلي ، وهو شرط أساسي للخلايا السرطانية لمغادرة الورم الأساسي وغزو الأنسجة الأخرى. تشمل العوامل الرئيسية التي يتم تنظيمها أثناء تكوين ورم خبيث مصفوفة ميتالوبروتيناز (MMPs) ، و ADAM (ثنائي intergin و metalloproteinase) ، و ADAMTS (ADAM مع زخارف ثرومبوسبوندين) ، و MMPs من نوع الغشاء (MT-MMPs) 3,4. هذه العوامل تتحلل جزيئات مثل اللامينين ، والتي يتم التعبير عنها في جميع الأغشية السفلية ، لتسهيل هجرة الخلايا والغزو.
الغشاء المشيمي (CAM) لبيضة الفرخ المخصبة هو نوع من الغشاء السفلي. تم استخدام بيض الفرخ المخصب كنماذج نقيلية ، حيث تم زرع الخلايا السرطانية على CAM خارج الجنين وتشكيل ورم خبيث لاحق لوحظ في أجنة الفرخ5. علاوة على ذلك ، كثيرا ما تستخدم النماذج النقيلية للفئران في الجسم الحي ، حيث يتم زرع الخلايا السرطانية في الفئران ويتم تحليل النقائل في مختلف الأعضاء6. هذا النهج يستغرق وقتا طويلا ومكلفا وقد يسبب إزعاجا للحيوانات. لمعالجة هذا ، قمنا بتطوير فحص CAM-Delam ، وهو نموذج أسرع وأرخص لتقييم العدوانية النقيلية للخلايا السرطانية. في هذا النموذج ، يتم الجمع بين قدرة الخلايا السرطانية على تحلل CAM الفرخ (على سبيل المثال ، قدرة التفكيك) مع غزو الخلايا السرطانية المحتمل في اللحمة المتوسطة وتستخدم كمقياس للعدوانية النقيلية.
تصف هذه المقالة ، استنادا إلى منشور سابق7 ، فحص CAM-Delam بالتفصيل ، من التعامل مع بيض الفرخ المخصب ، وزراعة الخلايا السرطانية والبذر ، والتشريح ، وتحليل عينات CAM ، إلى تسجيل قدرة التفكيك للخلايا السرطانية إلى أربع فئات: سليمة ، معدلة ، تالفة ، وغزو. كما نعطي أمثلة على كيفية استخدام هذا الفحص لتحديد الآليات الجزيئية التي تنظم عملية التفكيك.
Protocol
باختصار ، يلخص الشكل 1 الخطوات العامة في فحص CAM-Delam. يعتمد البروتوكول أدناه على 30 بيضة دجاج مخصبة مستزرعة واستخدام خطين مختلفين من الخلايا السرطانية يتم زرعهما بشكل منفصل في ثلاث حلقات / بويضة وتحليلها في أربع نقاط زمنية.
1. حضانة البيض
- استخدم بيض الفرخ المخصب من المفرخ المحلي ، والذي يضمن أكثر من 90٪ من الإخصاب
ملاحظة: لا ينبغي تخزين البيض لأكثر من 4 أيام في درجة حرارة الغرفة (RT). في السويد، لا يلزم الحصول على إذن أخلاقي للاستخدام التجريبي للدجاج الجنيني إلا من اليوم الجنيني (E) 14 وما بعده. - إذا لزم الأمر ، امسح بعناية ميكانيكيا أي أوساخ أو ريش على البيض باستخدام منشفة ورقية جافة أو مبللة في الماء.
- تنظيف وتعقيم حاضنة البيض مع 70 ٪ من الإيثانول قبل الاستخدام (في كل مرة).
- ضع العدد المطلوب من البيض في صواني البيض واحتضن بيض الفرخ أفقيا في حاضنة البيض عند 37.5-38 درجة مئوية مع رطوبة 70٪. اعتبر هذا يوم حضانة 0 (الشكل 1 أ).
2. إعداد قارب الوزن والصناديق البلاستيكية وأدوات التشريح
- استخدم 70٪ من الإيثانول لتعقيم 30 قاربا يزن و 30 صندوقا بلاستيكيا صغيرا (~ 0.4 لتر) مع أغطية شفافة.
- جفف قوارب الوزن والصناديق في غطاء ورقاقي بين عشية وضحاها (ON) وخزنها في صندوق بلاستيكي مغلق حتى يتم استخدامها مرة أخرى في يوم الحضانة 3.
- تعقيم 2 لتر من H 2 O المقطر أو منزوع الأيوناتلكل 30 بيضة محتضنة.
- تعقيم زوجين من المقص وثلاثة أزواج من الملقط عن طريق رش 70٪ من الإيثانول. جفف الأدوات في الهواء ثم قم بتخزينها في صندوق معقم حتى يوم الحضانة 3.
ملاحظة: يمكن تنفيذ هذه الإجراءات (الخطوات 2.1-2.4) في أي يوم قبل يوم الحضانة 3. استخدم القفازات لتجنب التلوث.
3. فتح البيض ونقله إلى الغرفة الداخلية المرطبة
ملاحظة: استخدم قفازات وقناع وجه لتجنب التلوث.
- أضف ما يقرب من 50 مل من H2O المعقم إلى الصناديق البلاستيكية المعقمة. احتفظ بالصناديق المملوءة بالماء بأغطية مغلقة ، لتجنب التلوث ، في RT حتى الاستخدام.
- في يوم الحضانة 3 ، قم بتكسير قشر البيض باستخدام الجزء الحاد من المقص وقطع فتحة مستقيمة في القشرة.
- قم بفتح قشر البيض يدويا فوق قارب وزن وجمع بياض البيض وصفار البيض والجنين السليم المرفق به في قارب الوزن (الشكل 1B). ابحث عن جنين سليم بقلب نابض وصفار سليم وأوعية دموية متطورة للتجربة (>95٪ من البويضات المحتضنة). تخلص من البيض مع جنين مشوه ، أو جنين بدون قلب نابض ، أو صفار بيض مكسور ، أو أوعية دموية صفار تالفة.
- انقل قارب الوزن برفق إلى غرفة داخلية رطبة.
ملاحظة: بالنسبة للخطوات من 3.2.إلى 3.4، اعمل بأسرع ما يمكن لتجنب التلوث، وإذا أمكن، استخدم غطاء رأس صفحي. - احتضان الغرفة الداخلية المرطبة في حاضنة البيض (الشكل 1C).
- قم بزراعة البيض بدون قشرة من اليوم 3 إلى اليوم 10 في حاضنة البيض قبل استخدامه (انظر الخطوة 3.6) ، وعند الحاجة ، أضف الماء إلى الحاضنة للحفاظ على رطوبة 70٪.
- تحقق من الغرف الداخلية المرطبة من خلال الغطاء البلاستيكي الشفاف بحثا عن الأجنة الميتة أو البيض الملوث بدون قشرة كل يوم ، وقم بإزالتها من الحاضنة.
4. إعداد حلقات السيليكون
- لإعداد حلقات السيليكون ، قم بقطع أنبوب سيليكون بقطر داخلي وخارجي يبلغ 4 مم و 5 مم ، على التوالي ، بسماكة ~ 1 مم ، ويفضل استخدام قاطع ورق (الشكل 1D).
- انقل حلقات السيليكون إلى زجاجات زجاجية صغيرة (الشكل 1D) ، وقم بتغطيتها بورق معدني ، وقم بتعقيمها باستخدام الأوتوكلاف أو ما شابه ذلك.
ملاحظة: تجنب التعقيم المتكرر لحلقات السيليكون غير المستخدمة التي قد تكون ملوثة، لأن هذا العلاج يقلل من قدرة حلقات السيليكون على الالتصاق بالغشاء، مع تسرب لاحق لمحلول الخلية السرطانية/الكولاجين/RPMI خارج الحلقات. - قم بتخزين حلقات السيليكون المعقمة في RT.
ملاحظة: يمكن القيام بهذه الخطوة في أي يوم قبل يوم الحضانة 10.
5. تحضير الخلايا السرطانية
ملاحظة: يتم تخزين المحاليل مثل وسط زراعة الخلايا والتريبسين و 1x PBS عند 4 درجات مئوية ويجب تسخينها إلى 37 درجة مئوية في حمام مائي قبل إضافتها إلى الخلايا. بعد التسخين ، اشطف الزجاجات في 70٪ من الإيثانول وجففها قبل الاستخدام.
- استزرع خطوط الخلايا السرطانية ذات الأهمية في وسط الثقافة ذي الصلة في حاضنة زراعة الخلايا عند 37 درجة مئوية في وجود 5٪ (v / v) CO2.
ملاحظة: هنا ، تم استزراع الورم الأرومي الدبقي U251-GFP وخلايا سرطان البروستاتا PC-3U-GFP في وسط RPMI متوسط RPMI كامل مع 10٪ (v / v) مصل بقري جنيني (FBS) و 1٪ (v / v) البنسلين الستربتومايسين (PS). - خطط لزراعة الخلايا السرطانية بحيث يكون ما يقرب من 50 × 106 خلايا سرطانية جاهزة للحصاد في يوم الحضانة 10 من فحص CAM-Delam.
- تغيير وسط زراعة الخلايا كل 2-3 أيام ، أو عندما يتغير اللون المتوسط من الوردي إلى البرتقالي / الأصفر.
- اختياري: حث نقص الأكسجة عن طريق علاج الخلايا السرطانية مع CoCl2 للتحقيق في الآثار الميكانيكية الجزيئية على التفكيك 1 يوم قبل حصاد الخلايا.
تحذير: CoCl2 له سمية معتدلة. تعامل بعناية في غطاء الدخان ، واتبع تعليمات الشركة المصنعة.- قم بتحضير محلول مخزون CoCl 2 الطازج20 mM عن طريق إذابة 0.0258 جم في 10 مل من H20 المقطر المعقم في أنبوب مخروطي 15 مل ملفوف بورق الألومنيوم للحماية من الضوء.
- في أنبوب مخروطي سعة 50 مل ، امزج 250 ميكرولتر من محلول مخزون CoCl2 سعة 20 ملليمتر في 25 مل من وسط RPMI مع 1٪ (v / v) PS (ولكن بدون FBS) لكل طبق زراعة خلايا قطره 15 سم. دوامة بلطف.
- قم بإزالة وسط RPMI الكامل من أطباق زراعة الخلايا.
- اغسل الخلايا بتعقيم 1x PBS 2x.
- أضف 25 مل من وسط RPMI مع 200 ميكرومتر CoCl2 خلية تريبسينات (انظر الخطوة 5.6).
- في يوم حضانة البيض 10 ، قم بإعداد 1 مل من مزيج الكولاجين / RPMI (نسبة 1: 3) ، الذي يحتوي على 250 ميكرولتر من الكولاجين من النوع الأول (5 ملغ / مل) و 750 ميكرولتر من وسط زراعة الخلايا RPMI مع استكمال 10٪ FBS و 1٪ (v / v) PS. حافظ على مزيج الكولاجين / RPMI على الجليد.
- التربسين الخلايا السرطانية لعزل الخلايا عن طريق إزالة وسط زراعة الخلايا أولا وغسل 2x مع 1x PBS.
- أضف 3 مل من محلول التربسين (0.05٪) لكل طبق زراعة خلية قطره 15 سم واحتضنه لمدة 2-3 دقائق في حاضنة زراعة الخلايا حتى تنفصل الخلايا. استخدم مجهرا مقلوبا على سطح الطاولة لرؤية الخلايا المنفصلة. إذا لزم الأمر، اضغط برفق على جانب القارورة لإزاحة الخلايا العالقة أو المرفقة المتبقية.
- قم بتعطيل التربسين عن طريق إضافة 5 مل من وسط RPMI الكامل إلى كل طبق من أطباق زراعة الخلايا وجمع تعليق الخلية من جميع أطباق زراعة الخلايا في أنبوب 50 مل.
- عد الخلايا السرطانية بطريقة استبعاد Trypan Blue للتمييز بين الخلايا الحية والميتة باستخدام عداد الخلايا. أضف 10 ميكرولتر من تعليق الخلية إلى 10 ميكرولتر من 0.4٪ من بقع التربان الزرقاء. امزج العينة عن طريق السحب لأعلى ولأسفل عدة مرات ، ثم قم بتحميل 10 ميكرولتر من خليط الخلية لكل غرفة في شريحة العينة في عداد الخلايا. كرر عد الخلايا 3x للتحقق من رقم الخلية/مل.
- حساب وطرد مركزي لتعليق زراعة الخلايا الصحيح الذي يحتوي على 50 × 106 خلايا سرطانية حية في أنبوب 50 مل عند 500 × جم لمدة 5 دقائق.
- تخلص من السوبرناتانت واخلط حبيبة الخلية مع 1 مل من مزيج الكولاجين / RPMI. بما أن الكولاجين مادة هلامية ، امزج الخلايا ببطء شديد وبعناية مع ماصة 1 مل لتجنب فقدان الخلايا في تكوين الفقاعات.
- احتفظ بتعليق الخلية المحضر على الجليد وأحضره إلى منطقة عمل البيض.
ملاحظة: تجنب الاحتفاظ بالخلايا السرطانية المعدة على الجليد لفترة طويلة جدا. يجب وضع الخلايا السرطانية المعدة على CAM في غضون 15-25 دقيقة.
6. بذر الخلايا السرطانية على الطب التكميلي والبديل
ملاحظة: استخدم قفازات وقناع وجه لتجنب التلوث.
- في يوم الحضانة 10 ، أخرج الغرف الداخلية المرطبة مع البيض المحتضن بدون قشرة من الحاضنة.
ملاحظة: يمكن استخدام ما يقرب من 90٪ من العدد الأولي للبيض المحتضن. انظر الشكل 2. - افتح الغرفة الداخلية المرطبة وضع ما يصل إلى ست حلقات سيليكون على CAM باستخدام ملقط معقم.
ملاحظة: تجنب وضع حلقات السيليكون بالقرب من بعضها البعض أو بالقرب من الأوعية الدموية الأكبر. - امزج تعليق الخلايا السرطانية عن طريق السحب للحصول على توزيع متساو للخلايا السرطانية ، وأضف 20 ميكرولتر (1 × 106 خلايا) من تعليق الخلايا السرطانية المحضر داخل حلقة سيليكون (الشكل 1E). عند إضافة الخلايا ، احتفظ بطرف الماصة فوق CAM للتأكد من عدم إتلاف الغشاء.
ملاحظة: وفقا للنتائج السابقة7 ، يمكن زرع خلايا سرطانية مختلفة في حلقات منفصلة على نفس CAM. - أغلق الغرفة الداخلية الرطبة وضعها في حاضنة البيض.
7. عزل الطب التكميلي والبديل مع الخلايا السرطانية المرتبطة به
- بعد 14 ساعة و 1.5 يوم و 2.5 يوم و 3.5 يوم من الحضانة ، أخرج ما يقرب من سبع غرف داخلية مرطبة وافتح الأغطية واحدة تلو الأخرى.
- باستخدام زوج من المقصات ، قم بتشريح الخلايا السرطانية المستزرعة المرتبطة ب CAM (ما يسمى عينات CAM-Delam) عن طريق القطع خارج حلقة السيليكون (الشكل 1F).
- انقل على الفور عينة CAM-Delam المعزولة باستخدام ملقط إلى 4٪ بارافورمالديهايد (PFA) في مخزن فوسفات مؤقت 0.1 M (PB) في طبق بتري لتثبيت الأنسجة. يحفظ على الجليد أو عند 4 درجات مئوية لمدة 1 ساعة.
ملاحظة: قم بتخزين محلول PFA بنسبة 4٪ في درجة حرارة 4 درجات مئوية لمدة أقصاها 5 أيام. تحذير: PFA سامة. عند التعامل مع مسحوق PFA وحلول PFA ، استخدم غطاء الدخان وارتد قناع الوجه والقفازات. تجنب استنشاق مسحوق أو أبخرة المحلول. اتبع إرشادات الشركة المصنعة. - قطع رؤوس أجنة الدجاج والتخلص منها كنفايات بيولوجية في صناديق محددة.
- قم بإزالة محلول PFA بنسبة 4٪ وإضافة 30٪ من السكروز في 0.1 M PB إلى عينات CAM-Delam والتوازن عند 4 درجات مئوية لمدة ساعة واحدة.
- تحت مجهر التشريح ، قم بإزالة حلقة السيليكون بعناية باستخدام الملقط. باستخدام زوج من المقصات ، قم بقطع عينة CAM-Delam في شكل مستطيل مع الخلايا السرطانية في الوسط (الشكل 1G).
- باستخدام زوج من الملقط ، انقل عينات CAM-Delam إلى وسط مقطع مجمد في طبق بتري لإزالة السكروز الزائد ثم إلى قوالب التضمين في وسط القسم المجمد.
- تحت مجهر التشريح ، ضع عينة CAM-Delam على شكل حرف U في اتجاه رأسي في قوالب التضمين باستخدام أي أداة تشبه الإبرة (الشكل 1G).
- قم بتجميد وتخزين عينات CAM-Delam عند -80 درجة مئوية.
8. تقسيم عينات CAM-Delam
- قسم عينات CAM-Delam المجمدة عند 10 ميكرومتر على 5-6 شرائح متتالية باستخدام التقسيم بالتبريد.
- قم بتخزين الشرائح مع أقسام عند -80 درجة مئوية أو استخدمها مباشرة لتلطيخ الكيمياء النسيجية المناعية.
9. تلطيخ الكيمياء النسيجية المناعية
- أحضر الشرائح من -80 درجة مئوية إلى RT لمدة 5 دقائق قبل بدء البروتوكول المناعي.
- اصنع خطا بعلامة مسعورة على الشرائح حيث تنتهي الأقسام. اتركها تجف لبضع دقائق.
- ضع الشرائح في غرفة رطبة (H2O) وقم بتغطية الأقسام بمحلول الحجب ~ 200-500 ميكرولتر (10٪ مصل ربلة الساق الجنينية و 0.1٪ أزيد الصوديوم في محلول ملحي مخزن مؤقتا ب Tris-100 بنسبة 0.1٪ Triton X-100 [TBST]) واحتضنها لمدة 15-30 دقيقة.
ملاحظة: من هذه الخطوة فصاعدا، لا تدع الشرائح تجف في أي وقت. - صب محلول الحجب واستبدله ب 100-150 ميكرولتر من الجسم المضاد الأساسي ذي الأهمية المخفف في محلول الحجب واحتضان ON عند 4 درجات مئوية. يفضل استخدام الجسم المضاد الأرنب المضاد للأمينين-111 لتحديد الصفيحة القاعدية مع علامة الخلية السرطانية ، إن لم يكن باستخدام GFP أو خطوط الخلايا السرطانية الأخرى الموسومة بالفلورسنت.
ملاحظة: هنا ، تم استخدام عامل ويلبراند المضاد للأرنب أيضا للكشف عن الأوعية الدموية في CAM. - قم بإعداد ثلاث كوفيت زجاجية مملوءة بمخزن TBST المؤقت.
- صب محلول الأجسام المضادة الأساسي ، وانقل الشرائح إلى اللقيمات الزجاجية ، واغسل 3 مرات على الأقل لمدة 5 دقائق لكل منها في TBST.
- قم بإزالة TBST الزائد من الشريحة ومن منطقة الحاجز الكارهة للماء باستخدام منديل ورقي ناعم.
- قم بتغطية الشريحة ب 100-150 ميكرولتر من جسم مضاد فلوري ثانوي مناسب مخفف في محلول مانع مع 4',6-diamidino-2-phenylindole و dihydrochloride (DAPI) واحتضنه في الظلام في RT لمدة 1 ساعة.
- صب محلول الأجسام المضادة الثانوي ، وانقل الشرائح إلى الكوفيت الزجاجي ، واغسل 3 مرات على الأقل لمدة 5 دقائق لكل منها في TBST.
- قم بإزالة TBST الزائد من الشريحة ومن منطقة الحاجز الكارهة للماء باستخدام منديل ورقي ناعم.
- قم بتركيب الشرائح عن طريق وضع 1-2 قطرات من وسط تركيب الفلورسنت على الشريحة ، ووضع غطاء زجاجي بلطف ، وتجنب فقاعات الهواء.
- اترك الشرائح تجف لمدة 1 ساعة على الأقل عند 4 درجات مئوية قبل التحليل ، وقم بتخزين الشرائح 4 درجات مئوية.
10. التصوير المجهري وتسجيل التفكيك
- قم بتصوير الأقسام باستخدام مجهر epifluorescence المجهز بكاميرا رقمية ، ويفضل أن يكون ذلك في تكبير 10x (الشكل 1H).
- قم بتحليل الأقسام باستخدام فئات تسجيل CAM-Delam التالية (الشكل 3):
- ابحث عن الصفيحة القاعدية السليمة دون تغييرات مرئية.
- ابحث عن الصفيحة القاعدية المعدلة ولكن غير التالفة.
- ابحث عن الصفيحة القاعدية التالفة دون غزو الخلايا.
- ابحث عن الصفيحة القاعدية التالفة مع غزو الخلايا.
النتائج
يعرض الشكل 1 الخطوات الرئيسية في فحص CAM-Delam7. أدى استخدام الغرف الرطبة الداخلية (الشكل 1C) إلى تحسين معدل بقاء أجنة الفرخ بشكل كبير من <50٪ إلى 90٪ في يوم الحضانة 10 ومن ~ 15٪ إلى 80٪ في يوم الحضانة 13 (الشكل 2).
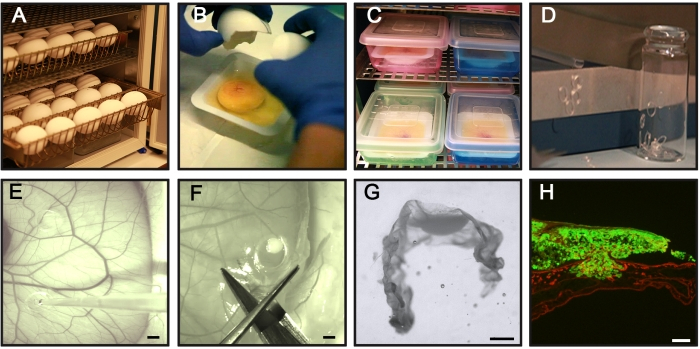
الشكل 1: الخطوات الرئيسية لفحص CAM-Delam . (أ) احتضان بيض الدجاج المخصب أفقيا دون دوران. (ب، ج) في اليوم 3 من الحضانة ، قم بتكسير البيض ووضعه في قوارب وزن معقمة (B) ، ووضع القوارب في غرفة رطبة داخلية لمزيد من الحضانة (C). (د) تحضير حلقات السيليكون. (ه) في اليوم 10 من الحضانة ، ضع حلقات السيليكون على CAM ، وزرع 1 × 106 خلايا سرطانية داخل الحلقات باستخدام ماصة. (F,G) في نقاط زمنية مختلفة (ساعات إلى أيام) ، تشريح CAM مع الخلايا السرطانية المرفقة ، (F) إصلاح في PFA ، وعلاج مع السكروز ، ووضعها في وسط القسم المجمد ، (G) وتجميدها في -80 درجة مئوية (H) مثال على CAM مقسم مع الخلايا السرطانية GFP + المرتبطة (الأخضر) و laminin تلطيخ الكيمياء المناعية (الأحمر). قضبان المقياس = 2 مم (E ، F) ، 1 مم (G) ، و 100 ميكرومتر (H). وهذا الرقم مأخوذ من Palaniappan et al.7. الاختصارات: CAM = غشاء chorioallantoic ؛ PFA = بارافورمالديهايد; GFP = بروتين الفلورسنت الأخضر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
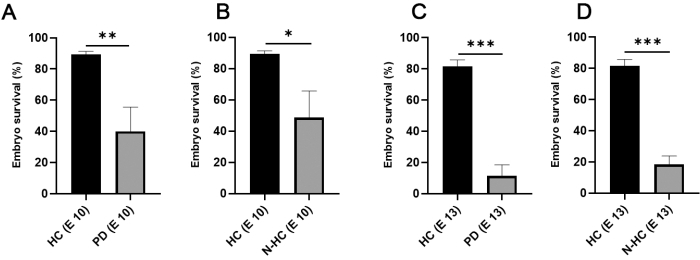
الشكل 2: بقاء جنين الدجاج على قيد الحياة فيما يتعلق بطريقة الحضانة. (A,B) في يوم الحضانة 10، تضاعف بقاء جنين الدجاج في HCs الداخلية (متوسط القيمة 89.33; N = 105) مقارنة بالحضانة في أطباق بتري (A؛ القيمة المتوسطة 40; N = 64) والغرف غير الرطبة (B؛ القيمة المتوسطة 48.67; N = 46). (ج، د) وفي يوم الحضانة 13، لوحظ ارتفاع معدل البقاء على قيد الحياة باستخدام HC (متوسط القيمة 81.67; N = 105)، في حين لوحظ انخفاض كبير في بقاء الجنين باستخدام PD (C؛ القيمة المتوسطة 11.33; N = 64)، وN-HC (D؛ القيمة المتوسطة 18.33; N = 46). تم اختبار الدلالة الإحصائية باستخدام اختبار t ثنائي الذيل غير مقترن. تشير أشرطة الخطأ إلى الانحراف المعياري. * ص < 0.05 ، ** ع < 0.01 ، *** ع < 0.001. وقد عدل هذا الرقم من Palaniappan et al.7. الاختصارات: HC = غرفة رطبة. PD = أطباق بتري. N-HC = غرفة غير رطبة ؛ E X = يوم الحضانة X. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تم الإبلاغ سابقا عن تحليلات خطوط الخلايا السرطانية المختلفة التي تعبر عن GFP (الورم الأرومي الدبقي U251 ، البروستاتا PC-3U ، القولون SW620 ، والرئة A549) باستخدام هذا البروتوكول من قبل Palaniappan et al.7. تشمل نتائج فحص CAM-Delam اختلافات في مورفولوجيا الصفيحة القاعدية ، التي اكتشفها اللامينين ، وغزو الخلايا السرطانية ، التي تعرف بأنها الخلايا التي عبرت طبقة الصفيحة القاعدية للكتكوت إلى طبقة الجلد المتوسط للكتكوت (الشكل 3). تظهر هذه النتائج أن قدرة الخلايا السرطانية على تحلل الصفيحة القاعدية وغزو اللحمة المتوسطة يمكن تسجيلها في واحدة من أربع فئات: 1) الصفيحة القاعدية السليمة دون تغيرات مرئية (الشكل 3B) ، 2) الصفيحة القاعدية المعدلة ولكن غير التالفة (الشكل 3C) ، 3) الصفيحة القاعدية التالفة دون غزو الخلايا (الشكل 3D) ، و 4) الصفيحة القاعدية التالفة مع غزو الخلايا (الشكل 3E) ). كانت الملاحظة الأخرى هي أنه عندما تسببت الخلايا السرطانية في صفيحة قاعدية متغيرة أو تالفة ، كان CAM سميكا أيضا مع زيادة تكوين الأوعية الدموية ، والتي تم تعريفها بواسطة تلطيخ الأجسام المضادة ضد عامل فون ويلبراند ، والذي يتم تصنيعه في الأوعية الدموية8 (الشكل 4C-H). لم يلاحظ هذان النمطان الظاهريان ، وهما CAM سميك وزيادة تكوين الأوعية الدموية ، عندما كان CAM سليما (الشكل 4A ، B).
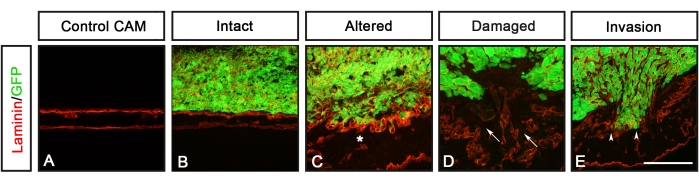
الشكل 3: تسجيل CAM-Delam. (A-E) مثال على تسجيل CAM-Delam استنادا إلى سلامة الصفيحة القاعدية CAM ، التي تصورها مضادات اللامينين (الحمراء) ، والغزو المحتمل للخلايا السرطانية المعبرة عن GFP (الأخضر). (أ) السيطرة على الطب التكميلي والبديل بدون خلايا سرطانية. (ب-هاء) في الاستجابات للخلايا السرطانية ، يمكن تسجيل أربع فئات تصف مورفولوجيا الصفيحة القاعدية: (B) laminin سليم ، (C) laminin متغير ولكن غير تالف (يشار إليه بعلامة نجمية) ، (D) laminin التالف ولكن بدون غزو الخلايا السرطانية (الأسهم) ، laminin التالف مع غزو الخلايا (رؤوس السهام). شريط المقياس = 100 ميكرومتر (A-E). وهذا الرقم مأخوذ من Palaniappan et al.7. الاختصارات: CAM = غشاء chorioallantoic ؛ GFP = بروتين الفلورسنت الأخضر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
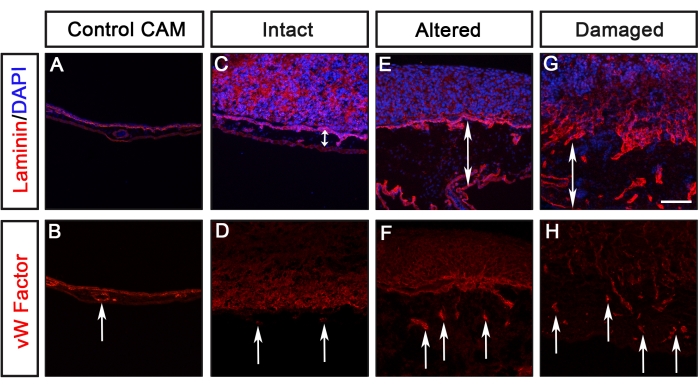
الشكل 4: تقييم سماكة الطب التكميلي والبديل وتكوين الأوعية الدموية. (أ-ح) مثال على تصور سماكة CAM وتكوين الأوعية الدموية ، التي تم اكتشافها بواسطة عامل مضاد لفون ويلبراند (أحمر) ، استجابة لصفيحة أنواع الخلايا السرطانية المختلفة. (أ، ب) السيطرة على الطب التكميلي والبديل بدون خلايا سرطانية. (ج، د) استجابة لخط الخلايا السرطانية غير النقيلي (سجل على أنه سليم) ، لم يتم الكشف عن سماكة واضحة للحمة المتوسطة أو زيادة تكوين الأوعية الدموية. (ه-ح) استجابة للخلايا السرطانية النقيلية التي تؤدي إلى تغيير أو تلف Laminin ، تم تكثيف اللحمة المتوسطة (المشار إليها برؤوس الأسهم المزدوجة) ولوحظ زيادة تكوين الأوعية الدموية (المشار إليها بالأسهم). شريط المقياس = 100 ميكرومتر. وقد عدل هذا الرقم من Palaniappan et al.7. الاختصارات: CAM = غشاء chorioallantoic ؛ GFP = بروتين الفلورسنت الأخضر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الورم الأرومي الدبقي U251 وخلايا سرطان البروستاتا PC-3U هما مثالان على خطوط الخلايا السرطانية ذات قدرات إزالة مختلفة تماما (الشكل 5). استحدثت خلايا PC-3U اللامينين التالف بعد 1.5 يوم ، مع غزو واضح بعد 2.5 يوم (الشكل 5A). وعلى النقيض من ذلك، فإن خلايا U251 لم تتسبب إلا في حدوث تغييرات طفيفة في اللامينين بعد 1.5-3.5 أيام ولكنها لم تسبب أبدا أي ضرر مرئي للأمينين (الشكل 5B).
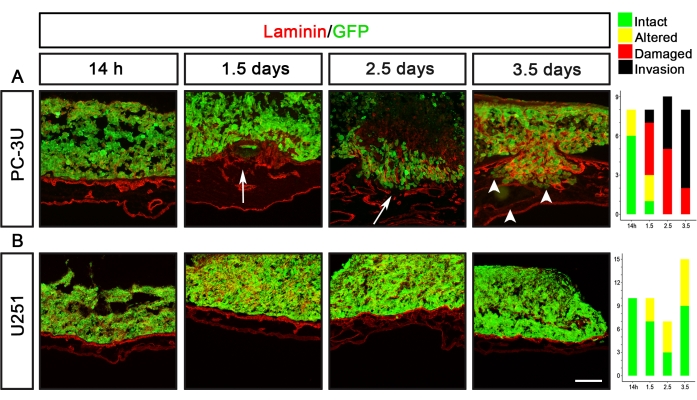
الشكل 5: تصور قدرة التفكيك للخلايا السرطانية للبروستاتا (PC-3U) والورم الأرومي الدبقي (U251). (A) تسببت خلايا PC-3U في تغيير طفيف في اللامينين بعد 14 ساعة ، وتلف اللامينين بعد 1.5 يوم (السهم) ، وبدء الغزو بعد 2.5 يوم ، والذي زاد بعد 3.5 أيام (رؤوس السهام). (ب) تسببت خلايا U251 في تغيير طفيف في اللامينين بعد 1.5-3.5 يوم. تعرض اللوحات اليمنى رسوما بيانية تمثل تسجيل CAM-Delam. يشير المحور y إلى عدد العينات ، ويشير المحور x إلى النقاط الزمنية للثقافة. شريط المقياس = 100 ميكرومتر (A,B). وقد عدل هذا الرقم من Palaniappan et al.7. الاختصارات: CAM = غشاء chorioallantoic ؛ GFP = بروتين الفلورسنت الأخضر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يمكن استخدام اختبار CAM-Delam لتحديد الآليات الجزيئية التي تنظم عملية التفكيك. أحد الأمثلة على ذلك هو استخدام علاج CoCl2 للحث على نقص الأكسجة مع أو بدون مزيج من تثبيط ميتالوبروتيناز المصفوفة (MMP) باستخدام مثبط MMP العريض GM6001 (الشكل 6). بعد علاج CoCl 2 ، اكتسبت الخلايا السرطانية غير النقيلية U251 القدرة على تحفيز إزالة الصفائح والخلايا الغازية ، والتي تم قمعها عندما تم دمج علاج CoCl2 مع مثبط MMP GM6001 (الشكل 6). وبالتالي ، يمكن أن يكون فحص CAM-Delam مفيدا عند تحديد الجزيئات والمسارات الجزيئية التي تؤثر على عملية التفكيك.
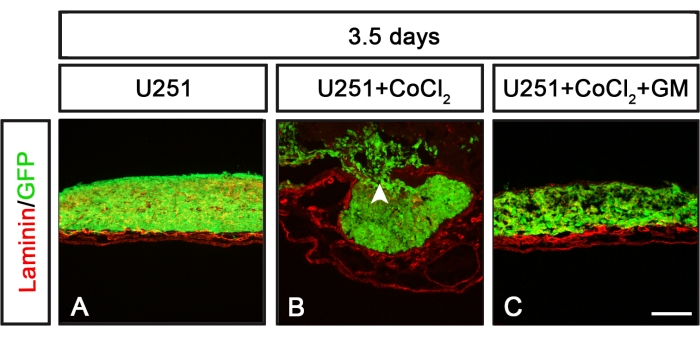
الشكل 6: أنماط التحلل استجابة لخلايا U251 المعرضة ل CoCl2 بمفردها أو مع مثبط MMP. (أ-ج) خلايا U251 المستزرعة لمدة 3.5 أيام على CAM خلال ظروف مختلفة. (أ) خلايا U251 المستزرعة وحدها لم تحفز أي ضرر للأمينين. (ب) خلايا U251 المستزرعة المعرضة مسبقا ل CoCl2 (24 ساعة) قبل الغسيل وبذر الخلايا على تلف اللامينين الناجم عن CAM وغزو الخلايا. (ج) المعالجة المسبقة بمثبط MMP واسع الطيف GM6001 (لمدة 1 ساعة) ، تليها التعرض ل CoCl 2 (24 ساعة) قبل غسل وبذر خلايا U251 على CAM ، قمعت تأثير علاج CoCl2 ، ولم يتم الكشف عن أي تلف واضح في الصفيحة أو غزو الخلايا السرطانية. شريط المقياس = 100 ميكرومتر (A-C). واللجنتان (باء) و (جيم) مأخوذتان من Palaniappan et al.7. الاختصارات: CAM = غشاء chorioallantoic ؛ GFP = بروتين الفلورسنت الأخضر; CoCl2 = كلوريد الكوبالت; MMP = مصفوفة ميتالوبروتيناز. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تصف هذه الورقة فحص CAM-Delam لتقييم العدوانية النقيلية للخلايا السرطانية ، والتي يتم تحديدها من خلال تسجيل تعديلات الصفيحة القاعدية وغزو الخلايا المحتمل في اللحمة المتوسطة في غضون ساعات إلى بضعة أيام. كانت المشكلة التقنية السابقة لمختلف فحوصات الطب التكميلي والبديل هي انخفاض بقاء أجنة الكتاكيت. تم حل هذه المشكلة عن طريق إدخال استخدام غرفة ترطيب داخلية أثناء حضانة الجنين ، مما زاد من بقاء الجنين من 10٪ -50٪ إلى 80٪ -90٪ 7. لذلك ، قد يكون استخدام غرفة رطبة داخلية ذا قيمة في اختبارات CAM بشكل عام ، وكذلك في تجارب الفرخ السابقة الأخرى.
تستند نقاط وقت التسجيل المقدمة عند 14 ساعة و 1.5 يوم و 2.5 يوم و 3.5 أيام بعد بذر 1 × 106 خلايا سرطانية على CAM إلى تطوير طريقة صارمة باستخدام ستة خطوط مختلفة للخلايا السرطانية وهي كافية لتمييز النطاق من قدرات خطوط الخلايا السرطانية غير المخففة إلى التصويب مع الغزو. يقترح استخدام أربع بيضات كحد أدنى مع ثلاث حلقات في كل نقطة زمنية ولكل خط خلية ، ويجب تكرار ذلك مرة واحدة على الأقل أو وفقا للتصاميم التجريبية والمتطلبات الإحصائية. تتمثل إحدى مزايا فحص CAM-Delam في الحصول على نتائج غنية بالمعلومات فيما يتعلق بقدرة الخلايا السرطانية على التفكيك في غضون أيام قليلة لتقدير عدوانية الخلايا السرطانية والمخاطر المحتملة لتشكيل ورم خبيث. يتم تسهيل التسليم السريع للنتائج من خلال مراقبة تدهور الصفيحة القاعدية بسبب الخلايا السرطانية الغازية والأورام الدقيقة اللاحقة / براعم الورم والنقائل العضوية. تقليديا ، تم استخدام نماذج CAM لتحليل تشكيل النقائل العضوية ، والتي تستغرق حوالي 2 أسابيع ليتم تحديدها9. باستخدام سبعة خطوط مختلفة للخلايا السرطانية ، قمنا سابقا بالتحقق من7 أن درجة التفكيك مرتبطة بقدرة الخلايا السرطانية على تكوين النقائل في نماذج القوارض10،11،12،13،14 ، والتي تدعم القيمة التنبؤية لفحص CAM-Delam. علاوة على ذلك ، تتطلب نماذج الفئران وقتا أطول ، من عدة أسابيع إلى أشهر ، قبل أن يمكن فحص النقائل15,16. باختصار ، فإن هذا الفحص المطور CAM-Delam ، الذي يركز على تسجيل قدرة التفكيك وليس على فحص تكوين الورم لاحقا في جنين الفرخ ، هو ، بالتالي ، مكمل جيد لغزو CAM الدجاج الحالي ونماذج ورم الفئران.
قد يكون أحد القيود في فحص CAM-Delam هو التصور غير الواضح للصفيحة القاعدية إذا كانت الخلايا السرطانية نفسها تعبر عن اللامينين. إذا كان الأمر كذلك ، يمكن استخدام علامات أخرى تشير إلى الصفيحة القاعدية ، مثل E-cadherin ،7. استخدمت دراسات غزو CAM الأخرى الكولاجين من النوع الرابع لتصور CAM و pan-cytokeratin و vimentin لتحديد الخلايا السرطانية الغازية وتشكيل الأورام الدقيقة / براعم الورم17,18.
التفكيك هو عملية خلوية طبيعية ، سواء أثناء التطور أو في وقت لاحق من الحياة ، مما يجعل من الممكن للخلايا مغادرة ظهارة والهجرة إلى أنسجة أخرى. أمثلة على الخلايا اللامعة أثناء التطور هي القمة العصبية والخلايا العصبية الرائدة الشمية19,20; في وقت لاحق من الحياة ، يعتمد التئام الجروح على التفكيك21. أثناء السرطان ، يتم تنظيم هذه العملية في الخلايا الخاطئة و / أو في الوقت الخطأ. وبالتالي ، يمكن أن تكون طريقة CAM-Delam مفيدة لكشف الآليات الجزيئية التي تنظم التفكيك ، والتي ستكون ذات أهمية لكل من المعرفة البيولوجية والمرضية الأساسية. وتشمل دراسات التفكيك هذه إضافة عوامل ذات أهمية للخلايا السرطانية المزروعة في الطب التكميلي والبديل أو دراسة الخلايا السرطانية المعدلة وراثيا. أحد الأمثلة المعروضة هنا هو المعالجة المسبقة ل CoCl2 لخط الخلايا غير النقيلي U251 للحث على نقص الأكسجة ، مما يؤدي إلى تحريض قدرة عدوانية نقلية يمكن قمعها بواسطة مثبط MMP واسع الطيف. وبالتالي ، فإن العثور على جزيئات رئيسية تتحكم في التفكيك يزيد من إمكانية تصميم مثبطات لقمع هذه العملية. فيما يتعلق بذلك ، هناك استخدام محتمل آخر لبروتوكول CAM-Delam في فحص الأدوية لقمع التفكيك وغزو الخلايا. علاوة على ذلك ، في العيادة ، يعد تقييم شدة السرطان عنصرا حاسما في التشخيص والتخطيط للعلاج والرعاية. حاليا ، نظام التدريج TNM (T ، حجم الورم; N ، العقدة - ما إذا كان السرطان قد انتشر إلى الغدد الليمفاوية ؛ M ، ورم خبيث بعيد) يستخدم لتقييم شدة السرطان22. يحدد فحص CAM-Delam نهجا مبتكرا لتقييم عدوانية الخلايا السرطانية والمخاطر المحتملة لتشكيل النقائل وقد يكون مكملا مفيدا لنظام التدريج TNM. ومن الجدير بالذكر أن تدريج TNM يعتمد على تحليلات عينات الأنسجة الثابتة ، في حين أن نهج CAM-Delam السريري المحتمل من شأنه أن يفحص الأنسجة الطازجة أو المجمدة الطازجة بالاقتران مع تقنيات إحياء الخلايا المجمدة23.
Disclosures
ليس لدى المؤلفين مصالح متنافسة للإفصاح عنها.
Acknowledgements
نشكر الباحثين التاليين في جامعة أوميا على مساعدتهم في خطوط الخلايا السرطانية ذات الصلة والأجسام المضادة: L. Carlsson (الجسم المضاد لعامل فون ويلبراند) ، J. Gilthorpe (U251) ، و M. Landström (PC-3U). كما نشكر Hauke Holthusen في مختبر Gilthorpe على توليد خط الخلايا المستقرة HEK293-TLR-AAVS1. تم دعم العمل في مختبر Gunhaga من قبل مؤسسة السرطان السويدية (18 0463) ، وحاضنة Umeå Biotech ، و Norrlands Cancerforskningsfond ، ومجلس البحوث السويدي (2017-01430) ، وكلية الطب في جامعة أوميا.
Materials
| Name | Company | Catalog Number | Comments |
| EQUIPMENT | |||
| Centrifuge | Rotanta 480 R, Hettich zentrifugen | ||
| Countess II FL Automated Cell Counter | Invitrogen | ||
| Cryostat | HM 505 E, Microm | ||
| Digital camera | Nikon DS-Ri1 | ||
| Dissection Microscope | Leica M10 | For CAM-sample dissection and positioning in molds | |
| Egg incubator | Fiem | Many other sources are available. Must be cleaned and sterilized with 70 % ethanol before each use | |
| Epifluorescence microscope | Nikon Eclipse, E800 | Equiped with a digital camera, for scoring delamination and cell invasion. | |
| Fine forceps | Many sources are available | Must be sterilized before use | |
| Freezer -80 °C | Thermo Fisher Scientific | 8600 Series | Model 817CV |
| Inverted microscope | Nikon Eclipse TS100 | For cell culture work | |
| Scissors (small) | Many sources are available | Must be sterilized before use | |
| MATERIALS | |||
| anti-Laminin-111 | Sigma-Aldrich | L9393 | Primary anti-rabbit antibody (1:400) |
| anti-rabbit Cy3 | Jackson Immuno Research | 111-165-003 | Secondary antibody (1:400) |
| anti-von Willebrand Factor | DAKO | P0226 | Primary antibody (1:100) |
Cobalt(II) chloride | Sigma-Aldrich | 232696-5G | CAUTION: moderate toxicity chemical. Handle with care only in fume hood. Follow manufacturers instructions |
| DAPI | Sigma-Aldrich | D9542-10MG | 4',6-diamidino-2-phenylindole, dihydrochloride (1:400) |
| Fertilized chicken eggs | Strömbäcks Ägg, Vännäs, Sweden | Any local egg supplyer | |
| Fetal bovine serum | Life Technologies | 10500-064 | |
| Fluorescence mounting medium | Allent Technologie | S302380-2 | Avoid bubble formation when mounting. Allow to dry at +4 °C |
| Glass chambers for silicon rings | Many sources are available | We used 15 mL glass chambers. Around 20 silicon rings fit in one chamber. Avoid crowding, since the rings may stick together and aggravate work. | |
| Glass coverslips | VWR International | 631-0165 | |
| GM6001 MMP Inhibitor | Sigma-Aldrich | CC1010 | |
| Microscope slides for immunohistochemistry | Fisher Scientific | 10149870 | |
| NEG-50 frozen medium | Cellab | 6506 | |
| Paraformaldehyde | Sigma-Aldrich | 30525-89-4 | CAUTION: highly toxic. Handle with care only in fume hood, follow manufacturers instructions. Use all protective clothing. |
Peel-A-Way Embedding Molds | Polysciences | 18985 | |
| Penicillin–streptomycin | Gibco | 15070063 | |
| Petri dishes | Sarstedt | 83.3903 | 15 cm in diameter for cell culture |
| Plastic box | Esclain | ||
| PureCol EZ Gel Collagen | Cellsystems | 5074-35ML | 5 mg/mL. Gelatinous material. Pipette very slowly and carefully to avoid cells being lost in the bubble formations. |
| RPMI medium | Thermo Fisher Scientific | 21875034 | |
| Silicon rings | VWR International | 228-1580 | Inner/outer diameter: 4/5 mm. Should be sterilized before use. Avoid repeated autoclaving of unused rings. |
| Trypan blue | Fisher Scientific | T10282 | |
| Trypsin | Life Technologi | 15400054 | 0.50% |
| Weighing boats | VWR International | 611-0094 | |
| SOLUTIONS | |||
| Collagen-RPMI media mixture (1 mL) | Compelete RPMI Media 750 µL | ||
| PureCol EZ Gel Collagen 250 µL | |||
| Mix and use immediately | |||
| Complete RPMI media (500 mL) | RPMI Media 445 mL | ||
| FBS 50 mL | |||
| Penicillin–streptomycin 5mL | |||
| Store at 4 °C | |||
| PB (0.2 M; 1 000 mL) | Na2HPO4 (MW 141.76) 21.9 g | ||
| NaH2PO4 (MW 137.99) 6.4 g | |||
| add deionized water up to final volume of 1000ml | |||
| Store in RT | |||
| PFA (4 %) in 0.1 M PB (100 mL) | Deionized water 50 mL | ||
| 0.2 M PB 50 mL | |||
| Paraformaldehyde (PFA) 4g | |||
| heat to 60 °C in water bath | |||
| add 5 M NaOH 25 µL | |||
| Stir to dissolve the PFA powder | |||
| Store at 4 °C | |||
| TBST (1 000 mL) | 50mM Tris pH 7,4 50 mL | ||
| 150mM NaCI 30 mL | |||
| 0,1% Triton X-100 10 mL | |||
| H2O (MQ) 900 mL | |||
| Trypsin (0.05 %; 10 mL) | 1x PBS 9 mL | ||
| 10x Trypsin (0.5 %) 1 mL | |||
| 10 mL in total, Store at 4 °C |
References
- Vasantharajan, S. S., et al. The epigenetic landscape of circulating tumour cells. Biochimica et Biophysica Acta - Reviews on Cancer. 1875 (2), 188514(2021).
- Acloque, H., Adams, M. S., Fishwick, K., Bronner-Fraser, M., Nieto, M. A. Epithelial-mesenchymal transitions: the importance of changing cell state in development and disease. Journal of Clinical Investigation. 119 (6), 1438-1449 (2009).
- Itoh, Y. Membrane-type matrix metalloproteinases: their functions and regulations. Matrix Biology. 44-46, 207-223 (2015).
- Przemyslaw, L., Boguslaw, H. A., Elzbieta, S., Malgorzata, S. M. ADAM and ADAMTS family proteins and their role in the colorectal cancer etiopathogenesis. BMB Reports. 46 (3), 139-150 (2013).
- Chu, P. Y., Koh, A. P., Antony, J., Huang, R. Y. Applications of the chick chorioallantoic membrane as an alternative model for cancer studies. Cells Tissues Organs. 211 (2), 222-237 (2021).
- MacDonald, I. C., Groom, A. C., Chambers, A. F. Cancer spread and micrometastasis development: quantitative approaches for in vivo models. Bioessays. 24 (10), 885-893 (2002).
- Palaniappan, T. K., Slekiene, L., Jonasson, A. K., Gilthorpe, J., Gunhaga, L. CAM-Delam: an in vivo approach to visualize and quantify the delamination and invasion capacity of human cancer cells. Scientific Reports. 10 (1), 10472(2020).
- Carrillo, M., Kim, S., Rajpurohit, S. K., Kulkarni, V., Jagadeeswaran, P. Zebrafish von Willebrand factor. Blood Cells, Molecules and Diseases. 45 (4), 326-333 (2010).
- Leupold, J. H., Patil, N., Allgayer, H. The chicken egg chorioallantoic membrane (CAM) model as an in vivo method for the investigation of the invasion and metastasis cascade of malignant tumor cells. Methods in Molecular Biology. 2294, 17-26 (2021).
- Jia, Y., et al. Recombinant human endostatin endostar inhibits tumor growth and metastasis in a mouse xenograft model of colon cancer. Pathology and Oncology Research. 18 (2), 315-323 (2012).
- Liu, B., et al. RNAi-mediated inhibition of presenilin 2 inhibits glioma cell growth and invasion and is involved in the regulation of Nrg1/ErbB signaling. Neuro-Oncology. 14 (8), 994-1006 (2012).
- Qin, T., et al. Tumor necrosis factor superfamily 15 promotes lymphatic metastasis via upregulation of vascular endothelial growth factor-C in a mouse model of lung cancer. Cancer Science. 109 (8), 2469-2478 (2018).
- Ren, L., et al. Characterization of the metastatic phenotype of a panel of established osteosarcoma cells. Oncotarget. 6 (30), 29469-29481 (2015).
- Zang, G., Mu, Y., Gao, L., Bergh, A., Landstrom, M. PKCzeta facilitates lymphatic metastatic spread of prostate cancer cells in a mice xenograft model. Oncogene. 38 (22), 4215-4231 (2019).
- Francia, G., Cruz-Munoz, W., Man, S., Xu, P., Kerbel, R. S. Mouse models of advanced spontaneous metastasis for experimental therapeutics. Nature Reviews Cancer. 11 (2), 135-141 (2011).
- Jung, J. Human tumor xenograft models for preclinical assessment of anticancer drug development. Toxicology Research. 30 (1), 1-5 (2014).
- Liu, M., et al. The histone methyltransferase EZH2 mediates tumor progression on the chick chorioallantoic membrane assay, a novel model of head and neck squamous cell carcinoma. Translational Oncology. 6 (3), 273-281 (2013).
- Steinmann, S., et al. DAPK1 loss triggers tumor invasion in colorectal tumor cells. Cell Death & Disease. 10 (12), 895(2019).
- Andrieu, C., et al. MMP14 is required for delamination of chick neural crest cells independently of its catalytic activity. Development. 147 (7), (2020).
- Palaniappan, T. K., Slekiene, L., Gunhaga, L., Patthey, C. Extensive apoptosis during the formation of the terminal nerve ganglion by olfactory placode-derived cells with distinct molecular markers. Differentiation. 110, 8-16 (2019).
- Thiery, J. P., Acloque, H., Huang, R. Y., Nieto, M. A. Epithelial-mesenchymal transitions in development and disease. Cell. 139 (5), 871-890 (2009).
- Pineros, M., et al. Essential TNM: a registry tool to reduce gaps in cancer staging information. The Lancet Oncology. 20 (2), 103-111 (2019).
- Walsh, A. J., Cook, R. S., Sanders, M. E., Arteaga, C. L., Skala, M. C. Drug response in organoids generated from frozen primary tumor tissues. Scientific Reports. 6, 18889(2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved