Method Article
CAM-Delam-Assay zur Bewertung metastasierender Eigenschaften durch Quantifizierung der Delaminations- und Invasionskapazität von Krebszellen
In diesem Artikel
Zusammenfassung
Der CAM-Delam-Assay zur Bewertung der metastasierenden Kapazität von Krebszellen ist relativ schnell, einfach und kostengünstig. Die Methode kann zur Entschlüsselung der molekularen Mechanismen, die die Metastasenbildung regulieren, und zum Drogenscreening eingesetzt werden. Ein optimierter Assay zur Analyse menschlicher Tumorproben könnte eine klinische Methode zur personalisierten Krebsbehandlung sein.
Zusammenfassung
Die Hauptursache für krebsbedingte Todesfälle ist die Metastasenbildung (d. H. Wenn sich Krebszellen vom Primärtumor auf entfernte Organe ausbreiten und Sekundärtumoren bilden). Delamination, definiert als der Abbau der Basallamina und der Basalmembran, ist der anfängliche Prozess, der die Transmigration und Ausbreitung von Krebszellen auf andere Gewebe und Organe erleichtert. Die Bewertung der Delaminationskapazität von Krebszellen würde das metastatische Potenzial dieser Zellen anzeigen.
Wir haben eine standardisierte Methode entwickelt, den ex ovo CAM-Delam Assay, um die Fähigkeit von Krebszellen, sich zu delaminieren und einzudringen, zu visualisieren und zu quantifizieren und so die metastatische Aggressivität beurteilen zu können. Kurz gesagt, die CAM-Delam-Methode beinhaltet die Aussaat von Krebszellen in Silikonringen auf der chorioallantoischen Membran (CAM) des Kükens am 10. Embryonaltag, gefolgt von einer Inkubation von Stunden bis zu einigen Tagen. Der CAM-Delam-Assay umfasst die Verwendung einer internen befeuchteten Kammer während der Inkubation von Kükenembryonen. Dieser neuartige Ansatz erhöhte das Überleben der Embryonen von 10%-50% auf 80%-90%, wodurch frühere technische Probleme mit niedrigen Überlebensraten der Embryonen in verschiedenen CAM-Assays gelöst wurden.
Als nächstes wurden die CAM-Proben mit assoziierten Krebszellclustern isoliert, fixiert und eingefroren. Schließlich wurden kryostatisch geschnittene Proben visualisiert und mittels Immunhistochemie auf Basalmembranschäden und Krebszellinvasion analysiert. Durch die Auswertung verschiedener bekannter metastasierender und nicht-metastasierender Krebszelllinien, die grün fluoreszierendes Protein (GFP) exprimieren sollen, zeigten die quantitativen CAM-Delam-Ergebnisse, dass die Delaminationskapazitätsmuster die metastatische Aggressivität widerspiegeln und in vier Kategorien eingeteilt werden können. Die zukünftige Verwendung dieses Assays, abgesehen von der Quantifizierung der Delaminationskapazität als Hinweis auf metastatische Aggressivität, besteht darin, die molekularen Mechanismen zu entschlüsseln, die Delamination, Invasion, die Bildung von Mikrometastasen und Veränderungen in der Tumormikroumgebung kontrollieren.
Einleitung
Etwa 90% der Mortalität bei Krebspatienten wird durch die Folgen der Krebsmetastasierung verursacht, bei der es sich um die Bildung von Sekundärtumoren in anderen Teilen des Körpers handelt, aus denen der Krebs ursprünglich stammt1. Es ist daher von Bedeutung, metastasierende Mechanismen zu identifizieren, um potenzielle Ziele zur Unterdrückung der Bildung von Tumormetastasen zu finden. Anschließend besteht Bedarf an Modellsystemen, in denen der metastatische Prozess evaluiert werden kann.
Während der Metastasierung durchlaufen Krebszellen einen epithelial-zu-mesenchymalen Übergang (EMT), einen normalen zellulären Prozess, bei dem Epithelzellen ihre Adhärenz- und Polaritätseigenschaften verlieren und stattdessen einen invasiven mesenchymalen Charakterannehmen 2. Delamination ist Teil des EMT-Prozesses und beinhaltet den Abbau von Laminin in der Basalmembran, was eine Voraussetzung dafür ist, dass Krebszellen den Primärtumor verlassen und in andere Gewebe eindringen können. Zu den Hauptfaktoren, die während der Metastasenbildung hochreguliert werden, gehören Matrix-Metalloproteinasen (MMPs), ADAM (Disintergin- und Metalloproteinase), ADAMTS (ADAM mit Thrombospondin-Motiven) und Membran-MMPs (MT-MMPs)3,4. Diese Faktoren bauen Moleküle wie Laminin ab, das in allen Basalmembranen exprimiert wird, um die Zellmigration und -invasion zu erleichtern.
Die chorioallantoische Membran (CAM) eines befruchteten Kükenies ist eine Art Basalmembran. Befruchtete Kükeneier wurden als metastasierende Modelle verwendet, in denen Krebszellen auf der extraembryonalen CAM- und späteren Metastasenbildung ausgesät wurden, die in den Kükenembryonen beobachtetwurde 5. Darüber hinaus werden häufig in vivo Maus-Metastasenmodelle verwendet, bei denen Krebszellen in die Mäuse implantiert und Metastasen in verschiedenen Organen analysiertwerden 6. Dieser Ansatz ist zeitaufwendig, teuer und kann den Tieren Unbehagen bereiten. Um dies zu beheben, haben wir den CAM-Delam-Assay entwickelt, ein schnelleres und kostengünstigeres Modell zur Bewertung der metastasierenden Aggressivität von Krebszellen. In diesem Modell wird die Fähigkeit von Krebszellen, das Küken-CAM abzubauen (z. B. die Delaminationskapazität), mit einer möglichen Invasion von Krebszellen in den Mesenchym kombiniert und als Maß für die metastatische Aggressivität verwendet.
Der vorliegende Artikel, der auf einer früheren Veröffentlichung7 basiert, beschreibt den CAM-Delam-Assay im Detail, von der Handhabung befruchteter Kükeneier, der Krebszellkultur und -aussaat, der Dissektion und Analyse von CAM-Proben bis hin zur Bewertung der Delaminationskapazität von Krebszellen in vier Kategorien: intakt, verändert, beschädigt und Invasion. Wir geben auch Beispiele dafür, wie dieser Assay verwendet werden kann, um die molekularen Mechanismen zu bestimmen, die den Delaminationsprozess regulieren.
Protokoll
Kurz gesagt, Abbildung 1 fasst die Gesamtschritte im CAM-Delam-Assay zusammen. Das folgende Protokoll basiert auf 30 kultivierten befruchteten Hühnereiern und der Verwendung von zwei verschiedenen Krebszelllinien, die separat in drei Ringen / Ei ausgesät und zu vier Zeitpunkten analysiert wurden.
1. Inkubation von Eiern
- Verwenden Sie befruchtete Kükeneier aus einer lokalen Brüterei, die eine Befruchtung von über 90% garantieren
HINWEIS: Die Eier sollten nicht länger als 4 Tage bei Raumtemperatur (RT) gelagert worden sein. In Schweden ist eine ethische Genehmigung für die experimentelle Verwendung von embryonalen Hühnern erst ab dem embryonalen Tag (E) 14 und darüber hinaus erforderlich. - Wischen Sie bei Bedarf Schmutz oder Federn auf den Eiern vorsichtig mit einem trockenen Papiertuch oder nass in Wasser ab.
- Reinigen und sterilisieren Sie den Eierinkubator vor Gebrauch (jedes Mal) mit 70% Ethanol.
- Die gewünschte Anzahl an Eiern in Eierschalen geben und die Kükeneier horizontal in einem Eierinkubator bei 37,5-38 °C bei 70% Luftfeuchtigkeit bebrüten. Betrachten Sie dies als Inkubationstag 0 (Abbildung 1A).
2. Vorbereitung von Wiegeboot, Kunststoffboxen und Dissektionsinstrumenten
- Verwenden Sie 70% Ethanol, um 30 Wiegeboote und 30 kleine Kunststoffboxen (~ 0,4 L) mit transparenten Kappen zu sterilisieren.
- Trocknen Sie die Wiegeboote und Boxen in einer Laminarhaube über Nacht (ON) und lagern Sie sie in einer geschlossenen Kunststoffbox bis zur weiteren Verwendung am Inkubationstag 3.
- Sterilisieren Sie 2 l destillierte oder deionisierteH2 Opro 30 inkubierte Eier.
- Sterilisieren Sie zwei Paar Scheren und drei Paar Pinzetten, indem Sie 70% Ethanol sprühen. Trocknen Sie die Instrumente an der Luft und lagern Sie sie dann bis zum Inkubationstag 3 in einer sterilisierten Box.
HINWEIS: Diese Aktionen (Schritte 2.1-2.4) können jeden Tag vor dem Inkubationstag 3 durchgeführt werden. Verwenden Sie Handschuhe, um eine Kontamination zu vermeiden.
3. Öffnen der Eier und Überführung in die interne befeuchtete Kammer
HINWEIS: Verwenden Sie Handschuhe und eine Gesichtsmaske, um eine Kontamination zu vermeiden.
- Den sterilisierten Kunststoffboxen werden ca. 50 ml sterilisiertesH2 Ohinzugefügt. Bewahren Sie die wassergefüllten Boxen mit geschlossenen Deckeln, um eine Kontamination zu vermeiden, bis zum Gebrauch bei RT auf.
- Knacken Sie am Inkubationstag 3 die Eierschale mit dem scharfen Teil der Schere und schneiden Sie eine gerade Öffnung in die Schale.
- Brechen Sie die Eierschale über einem Wiegeboot manuell auf und sammeln Sie das Eiweiß, das Eigelb und den angehängten gesunden Embryo im Wiegeboot (Abbildung 1B). Suchen Sie nach einem intakten Embryo mit einem schlagenden Herzen, intaktem Eigelb und entwickelten Blutgefäßen für das Experiment (>95% der inkubierten Eier). Entsorgen Sie Eier mit einem missgebildeten Embryo, einem Embryo ohne schlagendes Herz, einem gebrochenen Eigelb oder beschädigten Dotterblutgefäßen.
- Bringen Sie das Wiegeboot vorsichtig in eine interne befeuchtete Kammer.
HINWEIS: Arbeiten Sie bei den Schritten 3.2.-3.4. so schnell wie möglich, um eine Kontamination zu vermeiden, und verwenden Sie nach Möglichkeit eine laminare Haube. - Inkubieren Sie die innere befeuchtete Kammer im Eierinkubator (Abbildung 1C).
- Die schalenlosen Eier von Tag 3 bis Tag 10 vor der Verwendung im Eierinkubator ansiedeln (siehe Schritt 3.6.), und bei Bedarf Wasser in den Inkubator geben, um eine Luftfeuchtigkeit von 70% aufrechtzuerhalten.
- Überprüfen Sie die inneren befeuchteten Kammern durch den transparenten Kunststoffdeckel jeden Tag auf tote Embryonen oder kontaminierte schalenlose Eier und entfernen Sie sie aus dem Inkubator.
4. Herstellung von Silikonringen
- Zur Herstellung von Silikonringen wird ein Silikonrohr mit einem Innen- und Außendurchmesser von 4 mm bzw. 5 mm in ~1 mm Dicke geschnitten, vorzugsweise mit einem Papierschneider (Abbildung 1D).
- Die Silikonringe auf kleine Glasflaschen geben (Abbildung 1D), mit Metallfolie abdecken und mit einem Autoklaven o.ä. sterilisieren.
HINWEIS: Vermeiden Sie wiederholtes Autoklavieren von unbenutzten Silikonringen, die kontaminiert sein könnten, da eine solche Behandlung die Fähigkeit der Silikonringe, sich an der Membran zu befestigen, verringert, mit anschließendem Austreten der Krebszelle / Kollagen / RPMI-Lösung außerhalb der Ringe. - Lagern Sie die sterilen Silikonringe bei RT.
HINWEIS: Dieser Schritt kann jeden Tag vor dem Inkubationstag 10 durchgeführt werden.
5. Präparation von Krebszellen
HINWEIS: Lösungen wie Zellkulturmedium, Trypsin und 1x PBS werden bei 4 °C gelagert und sollten vor dem Hinzufügen zu den Zellen in einem Wasserbad auf 37 °C erhitzt werden. Nach dem Erhitzen die Flaschen in 70% Ethanol abspülen und vor Gebrauch trocknen.
- Die interessierenden Krebszelllinien in dem entsprechenden Kulturmedium in einem Zellkulturinkubator bei 37 °C in Gegenwart von 5% (v/v) CO2 zu kultivieren.
HINWEIS: Hier wurden U251-GFP-Glioblastom- und PC-3U-GFP-Prostatakrebszellen in vollständigem RPMI-Medium-RPMI-Medium kultiviert, ergänzt mit 10% (v/v) fetalem Rinderserum (FBS) und 1% (v/v) Penicillin-Streptomycin (PS). - Planen Sie die Kultur von Krebszellen so, dass etwa 50 ×10 6 Krebszellen am Inkubationstag 10 des CAM-Delam-Assays zur Ernte bereit sind.
- Wechseln Sie das Zellkulturmedium alle 2-3 Tage oder wenn sich die mittlere Farbe von Rosa zu Orange/Gelb ändert.
- Optional: Induzieren Sie Hypoxie, indem Sie die Krebszellen mit CoCl2 behandeln, um die molekularen mechanistischen Effekte auf die Delamination 1 Tag vor der Zellernte zu untersuchen.
ACHTUNG: CoCl2 hat eine moderate Toxizität. Behandeln Sie vorsichtig mit einem Abzug und befolgen Sie die Anweisungen des Herstellers.- Bereiten Sie frische 20 mM CoCl 2-Stammlösung vor, indem Sie 0,0258 g in 10 ml sterilisiertem destilliertem H20 in einem konischen15-ml-Rohr auflösen, das zum Schutz vor Licht mit Aluminiumfolie umwickelt ist.
- Mischen Sie in einem konischen 50-ml-Röhrchen 250 μL der 20 mM CoCl 2-Stammlösung in 25 mLRPMI-Medium , ergänzt mit 1% (v/v) PS (aber ohne FBS) pro Zellkulturschale mit 15 cm Durchmesser. Wirbel sanft.
- Entfernen Sie das gesamte RPMI-Medium aus den Zellkulturschalen.
- Waschen Sie die Zellen mit sterilisiertem 1x PBS 2x.
- Fügen Sie 25 ml RPMI-Medium mit 200 μM CoCl 2-Zell-Trypsinisierung hinzu (siehe Schritt 5.6).
- Am 10. Tag der Eizellinkubation werden 1 ml einer Kollagen/RPMI-Mischung (Verhältnis 1:3) hergestellt, die 250 μL Kollagen vom Typ I (5 mg/ml) und 750 μL Zellkultur-RPMI-Medium enthält, ergänzt mit 10% FBS und 1% (v/v) PS. Bewahren Sie die Kollagen/RPMI-Mischung auf Eis auf.
- Trypsinisieren Sie die Krebszellen, um die Zellen zu isolieren, indem Sie zuerst das Zellkulturmedium entfernen und 2x mit 1x PBS waschen.
- Fügen Sie 3 ml Trypsinlösung (0,05%) pro Zellkulturschale mit 15 cm Durchmesser hinzu und inkubieren Sie für 2-3 min in einem Zellkulturinkubator, bis sich die Zellen lösen. Verwenden Sie ein invertiertes Tischmikroskop, um die abgelösten Zellen zu sehen. Klopfen Sie bei Bedarf vorsichtig auf die Seite des Kolbens, um verbleibende gruppierte oder angehängte Zellen zu entfernen.
- Inaktivieren Sie Trypsin, indem Sie jeder Zellkulturschale 5 ml vollständiges RPMI-Medium hinzufügen und die Zellsuspension aus allen Zellkulturschalen in einem 50-ml-Schlauch sammeln.
- Zählen Sie die Krebszellen mit der Trypan Blue-Ausschlussmethode, um lebende von toten Zellen mit einem Zellzähler zu unterscheiden. Fügen Sie 10 μL der Zellsuspension zu 10 μL 0,4% trypanblauer Färbung hinzu. Mischen Sie die Probe, indem Sie einige Male nach oben und unten pipettieren, und laden Sie dann 10 μL der Zellmischung pro Kammer in den Probenobjektträger im Zellzähler. Wiederholen Sie die Zellzählung 3x, um die Zellzahl/ml zu überprüfen.
- Berechnen und zentrifen Sie die richtige Volumenzellkultursuspension mit 50 x 106 lebenden Krebszellen in einem 50-ml-Röhrchen bei 500 × g für 5 min.
- Verwerfen Sie den Überstand und mischen Sie das Zellpellet mit 1 ml der Kollagen/RPMI-Mischung. Da Kollagen ein gallertartiges Material ist, mischen Sie die Zellen sehr langsam und vorsichtig mit einer 1 ml Pipette, um zu vermeiden, dass Zellen bei der Bildung von Blasen verloren gehen.
- Bewahren Sie die vorbereitete Zellsuspension auf Eis auf und bringen Sie sie in den Arbeitsbereich der Eier.
HINWEIS: Vermeiden Sie es, die vorbereiteten Krebszellen zu lange auf Eis zu halten. Die vorbereiteten Krebszellen müssen innerhalb von 15-25 min auf das CAM gelegt werden.
6. Aussaat der Krebszellen auf dem CAM
HINWEIS: Verwenden Sie Handschuhe und eine Gesichtsmaske, um eine Kontamination zu vermeiden.
- Nehmen Sie am 10. Inkubationstag die inneren befeuchteten Kammern mit den bebrüteten schalenlosen Eiern aus dem Inkubator heraus.
HINWEIS: Ungefähr 90% der ursprünglichen Anzahl der bebrüteten Eier können verwendet werden; siehe Abbildung 2. - Öffnen Sie die interne befeuchtete Kammer und legen Sie mit sterilisierten Pinzetten bis zu sechs Silikonringe auf das CAM.
HINWEIS: Vermeiden Sie es, die Silikonringe nahe beieinander oder in der Nähe größerer Blutgefäße zu platzieren. - Mischen Sie die Krebszellsuspension durch Pipettieren, um eine gleichmäßige Verteilung der Krebszellen zu erhalten, und fügen Sie 20 μL (1 ×10 6 Zellen) der vorbereiteten Krebszellsuspension in einem Silikonring hinzu (Abbildung 1E). Halten Sie beim Hinzufügen der Zellen die Pipettenspitze über dem CAM, um sicherzustellen, dass die Membran nicht beschädigt wird.
HINWEIS: Nach früheren Erkenntnissen7 können verschiedene Krebszellen in separaten Ringen auf derselben CAM ausgesät werden. - Schließen Sie die innere befeuchtete Kammer und legen Sie sie in den Eierinkubator.
7. Isolierung des CAM mit assoziierten Krebszellen
- Nach 14 h, 1,5 Tagen, 2,5 Tagen und 3,5 Tagen Inkubation etwa sieben innere befeuchtete Kammern herausnehmen und die Deckel nacheinander öffnen.
- Sezieren Sie mit einer Schere die am CAM befestigten kultivierten Krebszellen (sogenannte CAM-Delam-Proben), indem Sie außerhalb des Silikonrings schneiden (Abbildung 1F).
- Die isolierte CAM-Delam-Probe wird sofort mit einer Pinzette auf 4% Paraformaldehyd (PFA) in 0,1 M Phosphatpuffer (PB) in einer Petrischale zur Fixierung des Gewebes überführt. 1 h auf Eis oder bei 4 °C aufbewahren.
HINWEIS: Lagern Sie 4% PFA-Lösung bei 4 °C für maximal 5 Tage. ACHTUNG: PFA ist giftig. Verwenden Sie beim Umgang mit PFA-Pulver und PFA-Lösungen eine Dunstabzugshaube und tragen Sie eine Gesichtsmaske und Handschuhe. Vermeiden Sie das Einatmen von Pulver- oder Lösungsdämpfen. Befolgen Sie die Anweisungen des Herstellers. - Enthaupten Sie die Hühnerembryonen und entsorgen Sie sie als biologischen Abfall in bestimmten Behältern.
- Entfernen Sie die 4%ige PFA-Lösung und fügen Sie den CAM-Delam-Proben 30 % Saccharose in 0,1 M PB hinzu und gleichen Sie sie bei 4 °C für 1 h aus.
- Entfernen Sie unter einem Seziermikroskop vorsichtig den Silikonring mit einer Pinzette. Schneiden Sie mit einer Schere die CAM-Delam-Probe in eine rechteckige Form mit den Krebszellen in der Mitte (Abbildung 1G).
- Mit einer Pinzette die CAM-Delam-Proben in gefrorenes Schnittmedium in einer Petrischale überführen, um überschüssige Saccharose zu entfernen, und dann in die Einbettung von Formen in gefrorenes Schnittmedium.
- Positionieren Sie unter einem Dissektionsmikroskop die CAM-Delam-Probe in einer U-Form in vertikaler Richtung in den Einbettungsformen mit einem beliebigen nadelartigen Instrument (Abbildung 1G).
- Die CAM-Delam-Proben werden eingefroren und bei −80 °C gelagert.
8. Schneiden von CAM-Delam Proben
- Schneiden Sie die gefrorenen CAM-Delam-Proben bei 10 μm auf 5-6 aufeinanderfolgenden Objektträgern mittels Kryosektion.
- Lagern Sie die Objektträger mit Schnitten bei −80 °C oder verwenden Sie sie direkt für die immunhistochemische Färbung.
9. Immunhistochemische Färbung
- Bringen Sie die Objektträger für 5 Minuten von -80 °C nach RT, bevor Sie mit dem Immunprotokoll beginnen.
- Machen Sie eine Linie mit einer hydrophoben Markierung auf den Folien, wo die Abschnitte enden. Lassen Sie sie einige Minuten trocknen.
- Legen Sie die Objektträger in eine befeuchtete (H2O) Kammer und bedecken Sie die Abschnitte mit ~200-500 μL Blockierlösung (10% fetales Kälberserum und 0,1% Natriumazid in Tris-gepufferter Kochsalzlösung mit 0,1% Triton X-100 [TBST]) und inkubieren Sie für 15-30 min.
HINWEIS: Lassen Sie die Dias ab diesem Schritt zu keinem Zeitpunkt trocknen. - Gießen Sie die blockierende Lösung ab und ersetzen Sie sie durch 100-150 μL des primären Antikörpers von Interesse, der in der blockierenden Lösung verdünnt ist, und inkubieren Sie ON bei 4 °C. Verwenden Sie vorzugsweise Kaninchen-Antilaminin-111-Antikörper, um die Basallamina zusammen mit einem Krebszellmarker zu definieren, wenn nicht GFP oder andere fluoreszierend markierte Krebszelllinien.
HINWEIS: Hier wurde auch ein Kaninchen-Anti-von-Willebrand-Faktor verwendet, um Blutgefäße im CAM zu erkennen. - Bereiten Sie drei Glasküvetten vor, die mit TBST-Puffer gefüllt sind.
- Gießen Sie die primäre Antikörperlösung ab, übertragen Sie die Objektträger auf die Glasküvetten und waschen Sie mindestens 3x für jeweils 5 Minuten in TBST.
- Entfernen Sie überschüssiges TBST aus dem Objektträger und aus dem hydrophoben Barrierebereich mit einem weichen Papiertuch.
- Bedecken Sie den Objektträger mit 100-150 μL eines geeigneten sekundären fluoreszierenden Antikörpers, der in Blockierlösung in Kombination mit 4',6-Diamidino-2-phenylindol, Dihydrochlorid (DAPI) verdünnt ist, und inkubieren Sie im Dunkeln bei RT für 1 h.
- Gießen Sie die sekundäre Antikörperlösung ab, übertragen Sie die Objektträger auf die Glasküvetten und waschen Sie mindestens 3x für jeweils 5 Minuten in TBST.
- Entfernen Sie überschüssiges TBST aus dem Objektträger und aus dem hydrophoben Barrierebereich mit einem weichen Papiertuch.
- Montieren Sie die Dias, indem Sie 1-2 Tropfen fluoreszierendes Montagemedium auf die Folie geben, und legen Sie vorsichtig einen Glasabdecker, um Luftblasen zu vermeiden.
- Lassen Sie die Dias vor dem Analysieren mindestens 1 h bei 4 °C trocknen und lagern Sie die Dias 4 °C.
10. Mikroskopie-Bildgebung und Delaminations-Scoring
- Fotografieren Sie die Schnitte mit einem Epifluoreszenzmikroskop, das mit einer Digitalkamera ausgestattet ist, vorzugsweise bei 10-facher Vergrößerung (Abbildung 1H).
- Analysieren Sie die Abschnitte mithilfe der folgenden CAM-Delam-Bewertungskategorien (Abbildung 3):
- Suchen Sie nach intakten Basallamina ohne sichtbare Veränderungen.
- Suchen Sie nach veränderten, aber unbeschädigten Basallamina.
- Suchen Sie nach beschädigten Basallamina ohne Zellinvasion.
- Suchen Sie nach beschädigten Basallamina mit Zellinvasion.
Ergebnisse
Abbildung 1 zeigt die wichtigsten Schritte im CAM-Delam Assay7. Die Verwendung von internen befeuchteten Kammern (Abbildung 1C) verbesserte die Überlebensrate der Kükenembryonen signifikant von <50% bis zu 90% am Inkubationstag 10 und von ~15% bis zu 80% am Inkubationstag 13 (Abbildung 2).
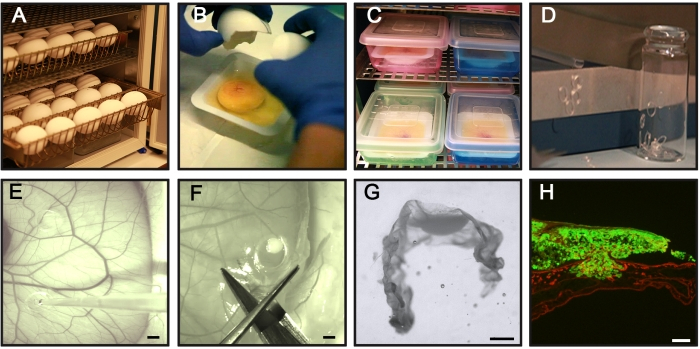
Abbildung 1: Wichtige Schritte des CAM-Delam-Assays . (A) Befruchtete Hühnereier horizontal ohne Rotation bebrüten. (B,C) Am Tag 3 der Inkubation knacken Sie die Eier und legen Sie sie in sterile Wiegeboote (B) und positionieren Sie die Boote in einer internen befeuchteten Kammer für die weitere Inkubation (C). (D) Silikonringe vorbereiten. (E) Legen Sie am Tag 10 der Inkubation die Silikonringe auf die CAM und säen Sie 1 x 10 6 Krebszellen mit einer Pipette in den Ringen. (F,G) Zu verschiedenen Zeitpunkten (Stunden bis Tage) das CAM mit angehängten Krebszellen sezieren, (F) PFA fixieren, mit Saccharose behandeln, in gefrorenem Schnittmedium positionieren (G) und bei −80 °C einfrieren. (H) Ein Beispiel für ein geschnittenes CAM mit assoziierten GFP+ -Krebszellen (grün) und laminin-immunhistochemischer Färbung (rot). Maßstabsstäbe = 2 mm (E,F), 1 mm (G) und 100 μm (H). Diese Figur stammt aus Palaniappan et al.7. Abkürzungen: CAM = chorioallantoische Membran; PFA = Paraformaldehyd; GFP = grün fluoreszierendes Protein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
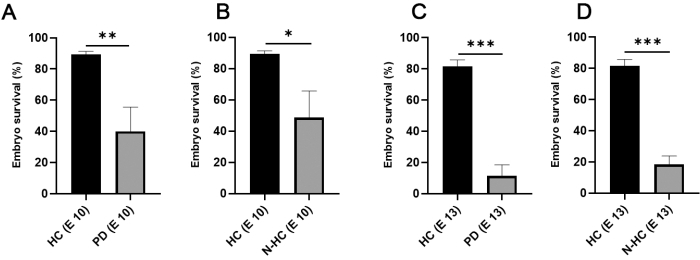
Abbildung 2: Überleben des Hühnerembryos in Bezug auf die Inkubationsmethode . (A,B) Am 10. Inkubationstag verdoppelte sich das Überleben des Hühnerembryos in internen HCs (Mittelwert 89,33; N = 105) im Vergleich zur Inkubation in Petrischalen (A; Mittelwert 40; N = 64) und nicht befeuchtete Kammern (B; Mittelwert 48,67; N = 46). (C,D) Am Inkubationstag 13 wurde noch eine hohe Überlebensrate unter Verwendung von HC (Mittelwert 81,67; N = 105), während eine starke Abnahme des Überlebens der Embryonen unter Verwendung von PD (C; Mittelwert 11,33; N = 64) und N-HC (D; Mittelwert 18,33; N = 46). Die statistische Signifikanz wurde mit einem ungepaarten zweiseitigen t-Test getestet. Die Fehlerbalken geben die Standardabweichung an. *p < 0,05, **p < 0,01, ***p < 0,001. Diese Figur wurde von Palaniappan et al.7 modifiziert. Abkürzungen: HC = befeuchtete Kammer; PD = Petrischale; N-HC = nicht befeuchtete Kammer; E X = Inkubationstag X. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Analysen verschiedener Krebszelllinien, die GFP (U251-Glioblastom, PC-3U-Prostata, SW620-Dickdarm und A549-Lunge) unter Verwendung dieses Protokolls exprimieren, wurden zuvor von Palaniappan et al.7 berichtet. Die Ergebnisse des CAM-Delam-Assays umfassen Unterschiede in der Morphologie der Basallamina, die durch Laminin nachgewiesen wurden, und die Invasion von Krebszellen, definiert als Zellen, die die Basallaminaschicht des Kükens in die mesodermale Schicht des Kükens gekreuzt haben (Abbildung 3). Diese Ergebnisse zeigen, dass die Fähigkeit von Krebszellen, Basallamina abzubauen und in das Mesenchym einzudringen, in eine von vier Kategorien eingeteilt werden kann: 1) intakte Basallamina ohne sichtbare Veränderungen (Abbildung 3B), 2) veränderte, aber unbeschädigte Basallamina (Abbildung 3C), 3) beschädigte Basallamina ohne Zellinvasion (Abbildung 3D) und 4) beschädigte Basallamina mit Zellinvasion (Abbildung 3E ). Eine weitere Beobachtung war, dass, wenn Krebszellen eine veränderte oder beschädigte Basallamina verursachten, das CAM auch mit einer Zunahme der Blutgefäßbildung verdickt wurde, definiert durch Antikörperfärbung gegen den von Willebrand-Faktor, der in Blutgefäßen8 synthetisiert wird (Abbildung 4C-H). Diese beiden Phänotypen, ein verdicktes CAM und eine erhöhte Bildung von Blutgefäßen, wurden nicht beobachtet, wenn das CAM intakt war (Abbildung 4A,B).
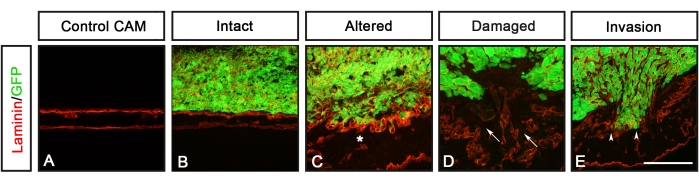
Abbildung 3: CAM-Delam-Bewertung. (A-E) Ein CAM-Delam-Scoring-Beispiel, basierend auf der Integrität der CAM-Basallamina, visualisiert durch Anti-Laminin (rot), und einer möglichen Invasion von GFP-exprimierenden Krebszellen (grün). (A) Kontrolle CAM ohne Krebszellen. (B-E) In den Reaktionen auf Krebszellen können vier Kategorien bewertet werden, die die Morphologie der Basallamina beschreiben: (B) intaktes Laminin, (C) verändertes, aber unbeschädigtes Laminin (gekennzeichnet durch ein Sternchen), (D) beschädigtes Laminin, aber ohne Krebszellinvasion (Pfeile), beschädigtes Laminin mit Zellinvasion (Pfeilspitzen). Maßstabsleiste = 100 μm (A-E). Diese Figur stammt aus Palaniappan et al.7. Abkürzungen: CAM = chorioallantoische Membran; GFP = grün fluoreszierendes Protein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
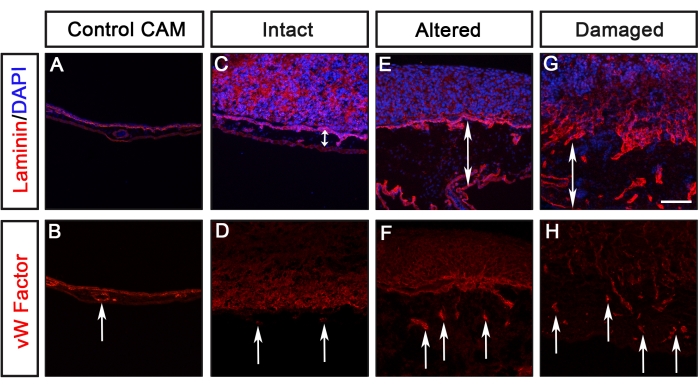
Abbildung 4: Bewertung der CAM-Verdickung und Blutgefäßbildung. (A-H) Ein Beispiel für die Visualisierung von CAM-Verdickung und Blutgefäßbildung, nachgewiesen durch Anti-Von-Willebrand-Faktor (rot), als Reaktion auf die Lamina verschiedener Krebszelltypen. (A,B) Kontrollieren Sie CAM ohne Krebszellen. (C,D) Als Reaktion auf eine nicht-metastasierende Krebszelllinie (bewertet als intakt) wurde keine offensichtliche Verdickung des Mesenchyms oder erhöhte Blutgefäßbildung festgestellt. (E-H) Als Reaktion auf metastasierende Krebszellen, die zu verändertem oder beschädigtem Laminin führten, wurde das Mesenchym verdickt (angezeigt durch doppelte Pfeilspitzen) und eine erhöhte Blutgefäßbildung wurde beobachtet (angezeigt durch Pfeile). Maßstabsleiste = 100 μm. Diese Figur wurde von Palaniappan et al.7 modifiziert. Abkürzungen: CAM = chorioallantoische Membran; GFP = grün fluoreszierendes Protein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
U251-Glioblastom- und PC-3U-Prostatakrebszellen sind zwei Beispiele für Krebszelllinien mit völlig unterschiedlichen Delaminationskapazitäten (Abbildung 5). PC-3U-Zellen induzierten beschädigtes Laminin nach 1,5 Tagen, mit klarer Invasion nach 2,5 Tagen (Abbildung 5A). Im Gegensatz dazu induzierten U251-Zellen nach 1,5-3,5 Tagen nur geringfügige Veränderungen von Laminin, verursachten aber nie sichtbare Schäden an Laminin (Abbildung 5B).
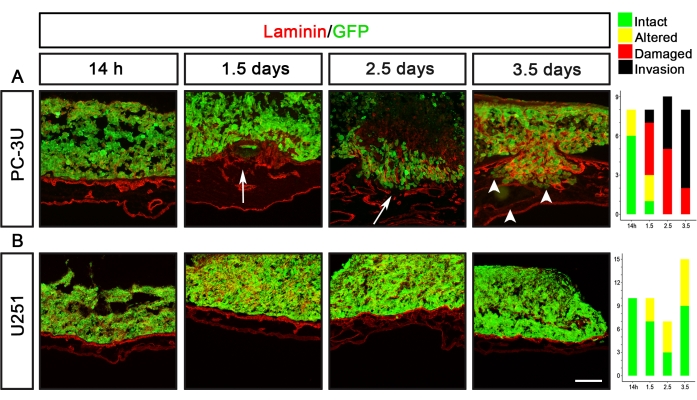
Abbildung 5: Visualisierung der Delaminationskapazität von Prostata- (PC-3U) und Glioblastom- (U251) Krebszellen. (A) PC-3U-Zellen induzierten eine geringfügige Veränderung von Laminin nach 14 h, eine Schädigung von Laminin nach 1,5 Tagen (Pfeil) und den Beginn der Invasion nach 2,5 Tagen, die nach 3,5 Tagen erhöht war (Pfeilspitzen). (B) U251-Zellen verursachten nach 1,5-3,5 Tagen eine geringfügige Veränderung von Laminin. Die rechten Felder zeigen Diagramme, die das CAM-Delam-Scoring darstellen. Die y-Achse gibt die Anzahl der Proben und die x-Achse die Zeitpunkte der Kultur an. Skalenbalken = 100 μm (A,B). Diese Figur wurde von Palaniappan et al.7 modifiziert. Abkürzungen: CAM = chorioallantoische Membran; GFP = grün fluoreszierendes Protein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Mit dem CAM-Delam-Assay können molekulare Mechanismen definiert werden, die den Delaminationsprozess regulieren. Ein Beispiel ist die Verwendung der CoCl2-Behandlung zur Induktion von Hypoxie mit oder ohne die Kombination von hemmenden Matrix-Metalloproteinasen (MMP) unter Verwendung des breiten MMP-Inhibitors GM6001 (Abbildung 6). Nach der Behandlung mit CoCl 2 erlangten die nicht-metastasierenden Krebszellen von U251 die Fähigkeit, Delamination und invasive Zellen zu induzieren, was unterdrückt wurde, wenn die CoCl2-Behandlung mit dem MMP-Inhibitor GM6001 kombiniert wurde (Abbildung 6). Daher kann der CAM-Delam-Assay bei der Definition von Molekülen und molekularen Signalwegen, die den Delaminationsprozess beeinflussen, nützlich sein.
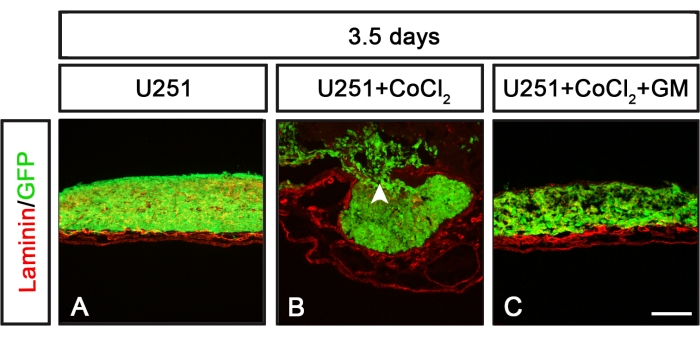
Abbildung 6: Delaminationsmuster als Reaktion auf U251-Zellen, die CoCl2 allein oder zusammen mit einem MMP-Inhibitor ausgesetzt sind. (A-C) U251-Zellen, die 3,5 Tage lang auf dem CAM unter verschiedenen Bedingungen kultiviert wurden. (A) U251-Zellen, die allein kultiviert wurden, verursachten keine Schäden an Laminin. (B) Kultivierte U251-Zellen, die vor dem Waschen und der Zellaussaat auf dem CAM-induzierten Lamininschaden und der Zellinvasion bei CoCl2 (24 h) vorexponiert wurden. (C) Die Vorbehandlung mit einem Breitband-MMP-Inhibitor GM6001 (für 1 h), gefolgt von einer CoCl2-Exposition(24 h) vor dem Waschen und Aussäen von U251-Zellen auf dem CAM, unterdrückte die Wirkung der CoCl2-Behandlung, und es wurde keine offensichtliche Lamininschädigung oder Krebszellinvasion festgestellt. Maßstabsleiste = 100 μm (A-C). Die Tafeln (B) und (C) stammen aus Palaniappan et al.7. Abkürzungen: CAM = chorioallantoische Membran; GFP = grün fluoreszierendes Protein; CoCl 2 = Kobaltchlorid; MMP = Matrix-Metalloproteinase. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Dieses Papier beschreibt den CAM-Delam-Assay zur Bewertung der metastasierenden Aggressivität von Krebszellen, die durch die Bewertung von Basallamina-Modulationen und potenzieller Zellinvasion in den Mesenchym innerhalb eines Zeitraums von Stunden bis zu einigen Tagen bestimmt wird. Ein früheres technisches Problem für verschiedene CAM-Assays war das geringe Überleben von Kükenembryonen. Dieses Problem wurde durch die Einführung einer internen befeuchteten Kammer während der Embryoneninkubation gelöst, die das Überleben des Embryos von 10% -50% auf 80% -90% erhöhte7. Die Verwendung einer internen befeuchteten Kammer kann daher in CAM-Assays im Allgemeinen sowie in anderen Ex-Ovo-Kükenexperimenten von Wert sein.
Die dargestellten Scoring-Zeitpunkte bei 14 h, 1,5 Tagen, 2,5 Tagen und 3,5 Tagen nach der Aussaat von 1 x 106 Krebszellen auf dem CAM basieren auf einer rigorosen Methodenentwicklung unter Verwendung von sechs verschiedenen Krebszelllinien und reichen aus, um den Bereich von nicht-delaminierenden bis hin zu Delaminierungs-mit-Invasionskapazitäten von Krebszelllinien zu unterscheiden. Es wird eine Mindestverwendung von vier Eiern mit jeweils drei Ringen pro Zeitpunkt und Zelllinie empfohlen, die mindestens einmal oder gemäß experimentellen Designs und statistischen Anforderungen wiederholt werden sollte. Ein Vorteil des CAM-Delam-Assays besteht darin, innerhalb weniger Tage aussagekräftige Ergebnisse über die Delaminationskapazität von Krebszellen zu erhalten, um die Aggressivität von Krebszellen und das potenzielle Risiko für die Bildung von Metastasen abzuschätzen. Die schnelle Lieferung von Ergebnissen wird durch die Überwachung des Abbaus der Basallamina aufgrund der eindringenden Krebszellen und der nachfolgenden Mikrotumoren / Tumorknospen und Organmetastasen erleichtert. Traditionell wurden CAM-Modelle verwendet, um die Bildung von Organmetastasen zu analysieren, die etwa 2 Wochen dauert, um bestimmt zuwerden 9. Durch die Verwendung von sieben verschiedenen Krebszelllinien haben wir zuvor7 verifiziert, dass das Delaminations-Scoring mit der Fähigkeit von Krebszellen verbunden ist, Metastasen in Nagetiermodellen 10,11,12,13,14 zu bilden, was den prädiktiven Wert des CAM-Delam-Assays unterstützt. Darüber hinaus benötigen Mausmodelle eine noch längere Zeit, mehrere Wochen bis Monate, bevor Metastasen untersucht werden können15,16. Kurz gesagt, dieser entwickelte CAM-Delam-Assay, der sich auf die Bewertung der Delaminationskapazität und nicht auf die Untersuchung der späteren Tumorbildung im Kükenembryo konzentriert, ist daher eine gute Ergänzung zu bestehenden Chicken CAM Invasion und Maustumormodellen.
Eine Einschränkung im CAM-Delam-Assay kann die unklare Visualisierung der Basallamina sein, wenn die Krebszellen selbst Laminin exprimieren. Wenn ja, könnten andere Markierungen, die die Basallamina anzeigen, wie E-Cadherin, verwendet werden7. Andere CAM-Invasionsstudien haben Typ-IV-Kollagen verwendet, um das CAM und Pan-Cytokeratin und Vimentin zu visualisieren, um eindringende Krebszellen und die Bildung von Mikrotumoren / Tumorknospen zu identifizieren17, 18.
Delamination ist ein normaler zellulärer Prozess, sowohl während der Entwicklung als auch später im Leben, der es Zellen ermöglicht, ein Epithel zu verlassen und in andere Gewebe zu wandern. Beispiele für delaminierende Zellen während der Entwicklung sind Neuralkamm und olfaktorische Pionierneuronen 19,20; Später im Leben hängt die Wundheilung von der Delaminationab 21. Bei Krebs wird dieser Prozess in den falschen Zellen und/oder zur falschen Zeit hochreguliert. So kann die CAM-Delam-Methode von Nutzen sein, um die molekularen Mechanismen zu entschlüsseln, die die Delamination regulieren, was sowohl für das biologische Grundwissen als auch für das Krankheitswissen von Bedeutung wäre. Solche Delaminationsstudien würden das Hinzufügen von Faktoren beinhalten, die für die auf dem CAM ausgesäten Krebszellen von Interesse sind, oder die Untersuchung genetisch veränderter Krebszellen. Ein hier vorgestelltes Beispiel ist die CoCl2-Vorbehandlung der nicht-metastatischen Zelllinie U251 zur Induktion von Hypoxie, die zur Induktion einer metastasierenden aggressiven Kapazität führt, die durch einen Breitband-MMP-Inhibitor unterdrückt werden könnte. Daher erhöht das Auffinden von Schlüsselmolekülen, die die Delamination kontrollieren, die Möglichkeit, Inhibitoren zu entwickeln, um diesen Prozess zu unterdrücken. In diesem Zusammenhang ist ein weiterer potenzieller Nutzen für das CAM-Delam-Protokoll das Drogenscreening zur Unterdrückung von Delamination und Zellinvasion. Darüber hinaus ist in der Klinik die Beurteilung der Krebsschwere eine kritische Komponente für die Diagnose, die Planung der Behandlung und die Pflege. Derzeit ist das TNM-Staging-System (T, Tumorgröße; N, Knoten - ob sich der Krebs auf die Lymphknoten ausgebreitet hat; M, Fernmetastasierung) wird verwendet, um die Schwere der Krebserkrankung zu beurteilen22. Der CAM-Delam-Assay definiert einen innovativen Ansatz zur Bewertung der Aggressivität von Krebszellen und des potenziellen Risikos für die Bildung von Metastasen und könnte eine nützliche Ergänzung zum TNM-Staging-System sein. Bemerkenswert ist, dass das TNM-Staging auf der Analyse von fixierten Gewebeproben basiert, während ein potenzieller klinischer CAM-Delam-Ansatz frisches oder frisch gefrorenes Gewebe in Kombination mit Techniken zur Wiederbelebung gefrorener Zellen untersuchenwürde 23.
Offenlegungen
Die Autoren haben keine konkurrierenden Interessen offenzulegen.
Danksagungen
Wir danken den folgenden Forschern der Universität Umeå für ihre Hilfe bei relevanten Krebszelllinien und Antikörpern: L. Carlsson (von Willebrand Factor Antikörper), J. Gilthorpe (U251) und M. Landström (PC-3U). Wir danken auch Hauke Holthusen im Labor Gilthorpe für die Generierung der stabilen Zelllinie HEK293-TLR-AAVS1. Die Arbeit im Gunhaga-Labor wurde von der Swedish Cancer Foundation (18 0463), dem Umeå Biotech Incubator, dem Norrlands Cancerforskningsfond, dem Swedish Research Council (2017-01430) und der Medizinischen Fakultät der Universität Umeå unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| EQUIPMENT | |||
| Centrifuge | Rotanta 480 R, Hettich zentrifugen | ||
| Countess II FL Automated Cell Counter | Invitrogen | ||
| Cryostat | HM 505 E, Microm | ||
| Digital camera | Nikon DS-Ri1 | ||
| Dissection Microscope | Leica M10 | For CAM-sample dissection and positioning in molds | |
| Egg incubator | Fiem | Many other sources are available. Must be cleaned and sterilized with 70 % ethanol before each use | |
| Epifluorescence microscope | Nikon Eclipse, E800 | Equiped with a digital camera, for scoring delamination and cell invasion. | |
| Fine forceps | Many sources are available | Must be sterilized before use | |
| Freezer -80 °C | Thermo Fisher Scientific | 8600 Series | Model 817CV |
| Inverted microscope | Nikon Eclipse TS100 | For cell culture work | |
| Scissors (small) | Many sources are available | Must be sterilized before use | |
| MATERIALS | |||
| anti-Laminin-111 | Sigma-Aldrich | L9393 | Primary anti-rabbit antibody (1:400) |
| anti-rabbit Cy3 | Jackson Immuno Research | 111-165-003 | Secondary antibody (1:400) |
| anti-von Willebrand Factor | DAKO | P0226 | Primary antibody (1:100) |
Cobalt(II) chloride | Sigma-Aldrich | 232696-5G | CAUTION: moderate toxicity chemical. Handle with care only in fume hood. Follow manufacturers instructions |
| DAPI | Sigma-Aldrich | D9542-10MG | 4',6-diamidino-2-phenylindole, dihydrochloride (1:400) |
| Fertilized chicken eggs | Strömbäcks Ägg, Vännäs, Sweden | Any local egg supplyer | |
| Fetal bovine serum | Life Technologies | 10500-064 | |
| Fluorescence mounting medium | Allent Technologie | S302380-2 | Avoid bubble formation when mounting. Allow to dry at +4 °C |
| Glass chambers for silicon rings | Many sources are available | We used 15 mL glass chambers. Around 20 silicon rings fit in one chamber. Avoid crowding, since the rings may stick together and aggravate work. | |
| Glass coverslips | VWR International | 631-0165 | |
| GM6001 MMP Inhibitor | Sigma-Aldrich | CC1010 | |
| Microscope slides for immunohistochemistry | Fisher Scientific | 10149870 | |
| NEG-50 frozen medium | Cellab | 6506 | |
| Paraformaldehyde | Sigma-Aldrich | 30525-89-4 | CAUTION: highly toxic. Handle with care only in fume hood, follow manufacturers instructions. Use all protective clothing. |
Peel-A-Way Embedding Molds | Polysciences | 18985 | |
| Penicillin–streptomycin | Gibco | 15070063 | |
| Petri dishes | Sarstedt | 83.3903 | 15 cm in diameter for cell culture |
| Plastic box | Esclain | ||
| PureCol EZ Gel Collagen | Cellsystems | 5074-35ML | 5 mg/mL. Gelatinous material. Pipette very slowly and carefully to avoid cells being lost in the bubble formations. |
| RPMI medium | Thermo Fisher Scientific | 21875034 | |
| Silicon rings | VWR International | 228-1580 | Inner/outer diameter: 4/5 mm. Should be sterilized before use. Avoid repeated autoclaving of unused rings. |
| Trypan blue | Fisher Scientific | T10282 | |
| Trypsin | Life Technologi | 15400054 | 0.50% |
| Weighing boats | VWR International | 611-0094 | |
| SOLUTIONS | |||
| Collagen-RPMI media mixture (1 mL) | Compelete RPMI Media 750 µL | ||
| PureCol EZ Gel Collagen 250 µL | |||
| Mix and use immediately | |||
| Complete RPMI media (500 mL) | RPMI Media 445 mL | ||
| FBS 50 mL | |||
| Penicillin–streptomycin 5mL | |||
| Store at 4 °C | |||
| PB (0.2 M; 1 000 mL) | Na2HPO4 (MW 141.76) 21.9 g | ||
| NaH2PO4 (MW 137.99) 6.4 g | |||
| add deionized water up to final volume of 1000ml | |||
| Store in RT | |||
| PFA (4 %) in 0.1 M PB (100 mL) | Deionized water 50 mL | ||
| 0.2 M PB 50 mL | |||
| Paraformaldehyde (PFA) 4g | |||
| heat to 60 °C in water bath | |||
| add 5 M NaOH 25 µL | |||
| Stir to dissolve the PFA powder | |||
| Store at 4 °C | |||
| TBST (1 000 mL) | 50mM Tris pH 7,4 50 mL | ||
| 150mM NaCI 30 mL | |||
| 0,1% Triton X-100 10 mL | |||
| H2O (MQ) 900 mL | |||
| Trypsin (0.05 %; 10 mL) | 1x PBS 9 mL | ||
| 10x Trypsin (0.5 %) 1 mL | |||
| 10 mL in total, Store at 4 °C |
Referenzen
- Vasantharajan, S. S., et al. The epigenetic landscape of circulating tumour cells. Biochimica et Biophysica Acta - Reviews on Cancer. 1875 (2), 188514(2021).
- Acloque, H., Adams, M. S., Fishwick, K., Bronner-Fraser, M., Nieto, M. A. Epithelial-mesenchymal transitions: the importance of changing cell state in development and disease. Journal of Clinical Investigation. 119 (6), 1438-1449 (2009).
- Itoh, Y. Membrane-type matrix metalloproteinases: their functions and regulations. Matrix Biology. 44-46, 207-223 (2015).
- Przemyslaw, L., Boguslaw, H. A., Elzbieta, S., Malgorzata, S. M. ADAM and ADAMTS family proteins and their role in the colorectal cancer etiopathogenesis. BMB Reports. 46 (3), 139-150 (2013).
- Chu, P. Y., Koh, A. P., Antony, J., Huang, R. Y. Applications of the chick chorioallantoic membrane as an alternative model for cancer studies. Cells Tissues Organs. 211 (2), 222-237 (2021).
- MacDonald, I. C., Groom, A. C., Chambers, A. F. Cancer spread and micrometastasis development: quantitative approaches for in vivo models. Bioessays. 24 (10), 885-893 (2002).
- Palaniappan, T. K., Slekiene, L., Jonasson, A. K., Gilthorpe, J., Gunhaga, L. CAM-Delam: an in vivo approach to visualize and quantify the delamination and invasion capacity of human cancer cells. Scientific Reports. 10 (1), 10472(2020).
- Carrillo, M., Kim, S., Rajpurohit, S. K., Kulkarni, V., Jagadeeswaran, P. Zebrafish von Willebrand factor. Blood Cells, Molecules and Diseases. 45 (4), 326-333 (2010).
- Leupold, J. H., Patil, N., Allgayer, H. The chicken egg chorioallantoic membrane (CAM) model as an in vivo method for the investigation of the invasion and metastasis cascade of malignant tumor cells. Methods in Molecular Biology. 2294, 17-26 (2021).
- Jia, Y., et al. Recombinant human endostatin endostar inhibits tumor growth and metastasis in a mouse xenograft model of colon cancer. Pathology and Oncology Research. 18 (2), 315-323 (2012).
- Liu, B., et al. RNAi-mediated inhibition of presenilin 2 inhibits glioma cell growth and invasion and is involved in the regulation of Nrg1/ErbB signaling. Neuro-Oncology. 14 (8), 994-1006 (2012).
- Qin, T., et al. Tumor necrosis factor superfamily 15 promotes lymphatic metastasis via upregulation of vascular endothelial growth factor-C in a mouse model of lung cancer. Cancer Science. 109 (8), 2469-2478 (2018).
- Ren, L., et al. Characterization of the metastatic phenotype of a panel of established osteosarcoma cells. Oncotarget. 6 (30), 29469-29481 (2015).
- Zang, G., Mu, Y., Gao, L., Bergh, A., Landstrom, M. PKCzeta facilitates lymphatic metastatic spread of prostate cancer cells in a mice xenograft model. Oncogene. 38 (22), 4215-4231 (2019).
- Francia, G., Cruz-Munoz, W., Man, S., Xu, P., Kerbel, R. S. Mouse models of advanced spontaneous metastasis for experimental therapeutics. Nature Reviews Cancer. 11 (2), 135-141 (2011).
- Jung, J. Human tumor xenograft models for preclinical assessment of anticancer drug development. Toxicology Research. 30 (1), 1-5 (2014).
- Liu, M., et al. The histone methyltransferase EZH2 mediates tumor progression on the chick chorioallantoic membrane assay, a novel model of head and neck squamous cell carcinoma. Translational Oncology. 6 (3), 273-281 (2013).
- Steinmann, S., et al. DAPK1 loss triggers tumor invasion in colorectal tumor cells. Cell Death & Disease. 10 (12), 895(2019).
- Andrieu, C., et al. MMP14 is required for delamination of chick neural crest cells independently of its catalytic activity. Development. 147 (7), (2020).
- Palaniappan, T. K., Slekiene, L., Gunhaga, L., Patthey, C. Extensive apoptosis during the formation of the terminal nerve ganglion by olfactory placode-derived cells with distinct molecular markers. Differentiation. 110, 8-16 (2019).
- Thiery, J. P., Acloque, H., Huang, R. Y., Nieto, M. A. Epithelial-mesenchymal transitions in development and disease. Cell. 139 (5), 871-890 (2009).
- Pineros, M., et al. Essential TNM: a registry tool to reduce gaps in cancer staging information. The Lancet Oncology. 20 (2), 103-111 (2019).
- Walsh, A. J., Cook, R. S., Sanders, M. E., Arteaga, C. L., Skala, M. C. Drug response in organoids generated from frozen primary tumor tissues. Scientific Reports. 6, 18889(2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten