Method Article
Kanser Hücrelerinin Delaminasyon ve İnvazyon Kapasitesini Ölçerek Metastatik Özellikleri Puanlamak için CAM-Delam Testi
Bu Makalede
Özet
Kanser hücrelerinin metastatik kapasitesini değerlendirmek için yapılan CAM-Delam testi nispeten hızlı, kolay ve ucuzdur. Yöntem, metastaz oluşumunu düzenleyen moleküler mekanizmaların çözülmesinde ve ilaç taramasında kullanılabilir. İnsan tümör örneklerini analiz etmek için optimize edilmiş bir tahlil, kişiselleştirilmiş kanser tedavisi için klinik bir yöntem olabilir.
Özet
Kansere bağlı ölümlerin başlıca nedeni metastaz oluşumudur (yani, kanser hücreleri birincil tümörden uzak organlara yayıldığında ve ikincil tümörler oluşturduğunda). Bazal lamina ve bazal membranın parçalanması olarak tanımlanan delaminasyon, kanser hücrelerinin diğer doku ve organlara geçişini ve yayılmasını kolaylaştıran ilk işlemdir. Kanser hücrelerinin delaminasyon kapasitesinin puanlanması, bu hücrelerin metastatik potansiyelini gösterecektir.
Kanser hücrelerinin delaminasyon ve istila etme yeteneğini görselleştirmek ve ölçmek için standartlaştırılmış bir yöntem olan ex ovo CAM-Delam testini geliştirdik, böylece metastatik saldırganlığı değerlendirebildik. Kısaca, CAM-Delam yöntemi, embriyonik 10. günde civciv koryoallantoik membran (CAM) üzerindeki silikon halkalarda kanser hücrelerinin tohumlanmasını ve ardından saatlerden birkaç güne kadar inkübasyonu içerir. CAM-Delam testi, civciv embriyo inkübasyonu sırasında dahili nemlendirilmiş bir odanın kullanımını içerir. Bu yeni yaklaşım, embriyo sağkalımını% 10-50'den% 80-90'a çıkarmış ve bu da farklı TAT testlerinde düşük embriyo sağkalım oranları ile ilgili önceki teknik sorunları çözmüştür.
Daha sonra, ilişkili kanser hücresi kümelerine sahip CAM örnekleri izole edildi, sabitlendi ve donduruldu. Son olarak, kriyostat kesitli örnekler görselleştirildi ve immünohistokimya kullanılarak bazal membran hasarı ve kanser hücresi invazyonu için analiz edildi. Yeşil floresan proteini (GFP) eksprese etmek için tasarlanmış bilinen çeşitli metastatik ve metastatik olmayan kanser hücre hatlarını değerlendirerek, CAM-Delam kantitatif sonuçları, delaminasyon kapasitesi modellerinin metastatik agresifliği yansıttığını ve dört kategoriye ayrılabileceğini göstermiştir. Bu tahlilin gelecekteki kullanımı, metastatik saldırganlığın bir göstergesi olarak delaminasyon kapasitesini ölçmenin yanı sıra, delaminasyonu, invazyonu, mikrometastazların oluşumunu ve tümör mikroortamındaki değişiklikleri kontrol eden moleküler mekanizmaları çözmektir.
Giriş
Kanser hastalarında mortalitenin yaklaşık% 90'ı, kanserin orijinal olarak ortaya çıktığı vücudun diğer bölgelerinde ikincil tümörlerin oluşumu olan kanser metastazının sonuçlarından kaynaklanır1. Bu nedenle, tümör metastazlarının oluşumunu baskılayacak potansiyel hedefleri bulmak için metastatik ilişkili mekanizmaların tanımlanması önemlidir. Daha sonra, metastatik sürecin değerlendirilebileceği model sistemlere ihtiyaç vardır.
Metastaz sırasında, kanser hücreleri, epitel hücrelerinin aderans ve polarite özelliklerini kaybettiği ve bunun yerine invaziv bir mezenkimal karakter2 kazandığı normal bir hücresel süreç olan epitel-mezenkimal geçişe (EMT) uğrar. Delaminasyon, EMT işleminin bir parçasıdır ve kanser hücrelerinin birincil tümörü terk etmesi ve diğer dokuları istila etmesi için bir ön koşul olan bazal membrandaki lamininin parçalanmasını içerir. Metastaz oluşumu sırasında yukarı regüle edilen başlıca faktörler matriks metalloproteinazlar (MMP'ler), ADAM (bir disintergin ve metalloproteinaz), ADAMTS (trombozpondin motifli ADAM) ve membran tipi MMP'lerdir (MT-MMP'ler)3,4. Bu faktörler, hücre göçünü ve invazyonunu kolaylaştırmak için tüm bazal membranlarda eksprese edilen laminin gibi molekülleri bozar.
Döllenmiş bir civciv yumurtasının koryoallantoik zarı (CAM) bir tür bazal membrandır. Döllenmiş civciv yumurtaları, kanser hücrelerinin ekstraembriyonik TAT üzerine tohumlandığı ve daha sonra civciv embriyolarında gözlenen metastaz oluşumunun olduğu metastatik modeller olarak kullanılmıştır5. Ayrıca, farelere kanser hücrelerinin implante edildiği ve çeşitli organlardaki metastazların analiz edildiği in vivo fare metastatik modelleri sıklıkla kullanılmaktadır6. Bu yaklaşım zaman alıcı, pahalıdır ve hayvanlar için rahatsızlığa neden olabilir. Bunu ele almak için, kanser hücrelerinin metastatik saldırganlığını değerlendirmek için daha hızlı ve daha ucuz bir model olan CAM-Delam testini geliştirdik. Bu modelde, kanser hücrelerinin civciv TAT'ını bozma yeteneği (örneğin, delaminasyon kapasitesi), mezenkimde potansiyel kanser hücresi invazyonu ile birleştirilir ve metastatik saldırganlığın bir ölçümü olarak kullanılır.
Bu makale, önceki bir yayın7'ye dayanarak, CAM-Delam tahlilini, döllenmiş civciv yumurtası işleme, kanser hücresi kültürü ve CAM örneklerinin tohumlanması, diseksiyonu ve analizlerinden, kanser hücrelerinin delaminasyon kapasitesinin dört kategoriye ayrılmasına kadar ayrıntılı olarak açıklamaktadır: bozulmamış, değiştirilmiş, hasar görmüş ve istila. Ayrıca, bu tahlilin delaminasyon işlemini düzenleyen moleküler mekanizmaları belirlemek için nasıl kullanılabileceğine dair örnekler de veriyoruz.
Protokol
Özetle, Şekil 1, CAM-Delam tahlilindeki genel adımları özetlemektedir. Aşağıdaki protokol, 30 kültürlü döllenmiş tavuk yumurtasına ve üç halka / yumurtada ayrı ayrı tohumlanmış ve dört zaman noktasında analiz edilen iki farklı kanser hücresi hattının kullanımına dayanmaktadır.
1. Yumurta inkübasyonu
- % 90'ın üzerinde gübrelemeyi garanti eden yerel bir kuluçkahaneden döllenmiş civciv yumurtaları kullanın
NOT: Yumurtalar oda sıcaklığında (RT) 4 günden fazla saklanmamalıdır. İsveç'te, embriyonik tavukların deneysel kullanımı için etik izin sadece embriyonik gün (E) 14 ve sonrasında gereklidir. - Gerekirse, kuru bir kağıt havlu kullanarak veya suda ıslatarak yumurtaların üzerindeki kir veya tüyleri dikkatlice mekanik olarak silin.
- Yumurta inkübatörünü kullanmadan önce% 70 etanol ile temizleyin ve sterilize edin (her seferinde).
- İstenilen sayıda yumurtayı yumurta tepsilerine yerleştirin ve civciv yumurtalarını yatay olarak bir yumurta inkübatöründe 37.5-38 ° C'de% 70 nem oranıyla inkübe edin. Bunu kuluçka günü 0 olarak düşünün (Şekil 1A).
2. Tartım teknesinin, plastik kutuların ve diseksiyon cihazlarının hazırlanması
- 30 tartım teknesini ve şeffaf kapaklı 30 küçük plastik kutuyu (~0,4 L) sterilize etmek için %70 etanol kullanın.
- Tartım teknelerini ve kutularını gece boyunca laminer bir davlumbazda (AÇIK) kurutun ve 3. kuluçka gününde bir sonraki kullanıma kadar kapalı plastik bir kutuda saklayın.
- 30 kuluçkalanmış yumurta başına 2 L damıtılmış veya deiyonizeH2O sterilize edin.
- % 70 etanol püskürterek iki çift makas ve üç çift forseps sterilize edin. Aletleri hava ile kurutun ve daha sonra inkübasyon 3. güne kadar sterilize edilmiş bir kutuda saklayın.
NOT: Bu eylemler (Adım 2.1-2.4) inkübasyon günü 3'ten önceki herhangi bir gün yapılabilir. Kirlenmeyi önlemek için eldiven kullanın.
3. Yumurtaların açılması ve iç nemlendirilmiş odaya aktarılması
NOT: Kontaminasyonu önlemek için eldiven ve yüz maskesi kullanın.
- Sterilize plastik kutulara yaklaşık 50 mL sterilizeH2O ekleyin. Kirlenmeyi önlemek için kapakları kapalı su dolu kutuları kullanıma kadar RT'de tutun.
- Kuluçka günü 3'te, makasın keskin kısmını kullanarak yumurta kabuğunu kırın ve kabukta düz bir açıklık kesin.
- Yumurta kabuğunu bir tartım teknesinin üzerinde manuel olarak kırın ve yumurta akını, yumurta sarısını ve ekli sağlıklı embriyosunu tartım teknesinde toplayın (Şekil 1B). Deney için atan bir kalbe, sağlam bir yumurta sarısına ve gelişmiş kan damarlarına sahip sağlam bir embriyo arayın (inkübe edilmiş yumurtaların% >95'i). Hatalı biçimlendirilmiş bir embriyoya sahip yumurtaları, atan kalbi olmayan bir embriyoyu, kırık bir yumurta sarısını veya hasarlı yumurta sarısı kan damarlarını atın.
- Tartım teknesini yavaşça nemlendirilmiş bir iç odaya aktarın.
NOT: Adım 3.2.-3.4. için, kontaminasyonu önlemek için mümkün olduğunca hızlı çalışın ve mümkünse laminer bir başlık kullanın. - Yumurta inkübatöründe iç nemlendirilmiş odayı inkübe edin (Şekil 1C).
- Kabuksuz yumurtaları kullanılmadan önce yumurta inkübatöründe 3. günden 10. güne kadar kültürleyin (bakınız Adım 3.6.) ve gerektiğinde,% 70 nemi korumak için inkübatöre su ekleyin.
- Dahili nemlendirilmiş odaları, ölü embriyolar veya kontamine kabuksuz yumurtalar için şeffaf plastik kapaktan her gün kontrol edin ve inkübatörden çıkarın.
4. Silikon halkaların hazırlanması
- Silikon halkalar hazırlamak için, tercihen bir kağıt kesici kullanarak, ~ 1 mm kalınlığında, sırasıyla 4 mm ve 5 mm iç ve dış çapa sahip bir silikon tüp kesin (Şekil 1D).
- Silikon halkaları küçük cam şişelere aktarın (Şekil 1D), metal folyo ile örtün ve bir otoklav veya benzeri bir şey kullanarak sterilize edin.
NOT: Kirlenmiş olabilecek kullanılmayan silikon halkaların tekrar tekrar otoklavlanmasından kaçının, çünkü bu tür bir işlem silikon halkaların membrana yapışma kapasitesini azaltır ve ardından kanser hücresi / kollajen / RPMI çözeltisinin halkaların dışına sızması. - Steril silikon halkaları RT'de saklayın.
NOT: Bu adım, inkübasyon günü 10'dan önceki herhangi bir gün yapılabilir.
5. Kanser hücrelerinin hazırlanması
NOT: Hücre kültürü ortamı, tripsin ve 1x PBS gibi çözeltiler 4 °C'de depolanır ve hücrelere eklenmeden önce bir su banyosunda 37 °C'ye ısıtılmalıdır. Isıtmadan sonra, şişeleri% 70 etanol içinde durulayın ve kullanmadan önce kurulayın.
- Kültür Kanser hücresi hatları, 37 ° C'de bir hücre kültürü inkübatöründe% 5 (v / v) CO2 varlığında ilgili kültür ortamına ilgi duyar.
NOT: Burada, U251-GFP glioblastoma ve PC-3U-GFP prostat kanseri hücreleri,% 10 (v / v) fetal sığır serumu (FBS) ve% 1 (v / v) penisilin-streptomisin (PS) ile desteklenmiş tam RPMI orta-RPMI ortamında kültürlendi. - Kanser hücrelerinin kültürünü, yaklaşık 50 × 106 kanser hücresinin CAM-Delam testinin kuluçka günü 10'unda hasat için hazır olacak şekilde planlayın.
- Hücre kültürü ortamını her 2-3 günde bir veya orta renk pembeden turuncu / sarıya değiştiğinde değiştirin.
- İsteğe bağlı: Hücre hasadından 1 gün önce delaminasyon üzerindeki moleküler mekanik etkileri araştırmak için kanser hücrelerini CoCl2 ile tedavi ederek hipoksiye neden olun.
DİKKAT: CoCl2 orta derecede toksisiteye sahiptir. Bir duman davlumbazında dikkatli bir şekilde kullanın ve üreticinin talimatlarını izleyin.- Işıktan korumak için alüminyum folyo ile sarılmış 15 mL konik bir tüp içinde 0,0258 g'ı 10 mL sterilize edilmiş damıtılmış H 2 0 0 içinde çözerek taze20mM CoCl 2stok çözeltisi hazırlayın.
- 50 mL'lik bir konik tüpte, 20 mM CoCl 2 stok çözeltisinin250 μL'sini, 15 cm çapında hücre kültürü kabı başına% 1 (v / v) PS (ancak FBS olmadan) ile desteklenmiş 25 mL RPMI ortamında karıştırın. Vorteks nazikçe girdap.
- RPMI ortamının tamamını hücre kültürü bulaşıklarından çıkarın.
- Hücreleri sterilize edilmiş 1x PBS 2x ile yıkayın.
- 200 μM CoCl 2 hücre tripsinizasyonu ile25 mL RPMI ortamı ekleyin (bkz. Adım 5.6).
- Yumurta kuluçka günü 10'da, 250 μL tip I kollajen (5 mg / mL) ve 750 μL hücre kültürü RPMI ortamı içeren% 10 FBS ve% 1 (v / v) PS ile desteklenmiş 1 mL kollajen / RPMI karışımı (oran 1: 3) hazırlayın.
- Önce hücre kültürü ortamını çıkararak hücreleri izole etmek için kanser hücrelerini tripsinize edin ve 2x'i 1x PBS ile yıkayın.
- 15 cm çapında hücre kültürü kabı başına 3 mL tripsin çözeltisi (% 0.05) ekleyin ve hücreler ayrılana kadar bir hücre kültürü inkübatöründe 2-3 dakika inkübe edin. Ayrılmış hücreleri görmek için masa üstü, ters çevrilmiş bir mikroskop kullanın. Gerekirse, kalan kümelenmiş veya bağlı hücreleri yerinden çıkarmak için şişenin yan tarafına hafifçe dokunun.
- Her hücre kültürü kabına 5 mL tam RPMI ortamı ekleyerek tripsini etkisiz hale getirin ve tüm hücre kültürü kaplarından hücre süspansiyonunu 50 mL'lik bir tüpe toplayın.
- Bir hücre sayacı kullanarak canlı hücreleri ölü hücrelerden ayırt etmek için Trypan Blue dışlama yöntemiyle kanser hücrelerini sayın. 10 μL hücre süspansiyonunu% 0.4 tripan mavisi lekesinin 10 μL'sine ekleyin. Numuneyi birkaç kez yukarı ve aşağı pipetleyerek, karıştırın ve ardından oda başına 10 μL hücre karışımını hücre sayacındaki numune slaytına yükleyin. Hücre numarasını/mL'yi doğrulamak için hücre sayımını 3x tekrarlayın.
- 50 dakika boyunca 500 × g'da 50 mL'lik bir tüpte 50 x 106 canlı kanser hücresi içeren doğru hacimli hücre kültürü süspansiyonunu hesaplayın ve santrifüj edin.
- Süpernatantı atın ve hücre peletini 1 mL kollajen / RPMI karışımı ile karıştırın. Kollajen jelatinimsi bir malzeme olduğundan, kabarcık oluşumunda hücreleri kaybetmemek için hücreleri 1 mL'lik bir pipetle çok yavaş ve dikkatli bir şekilde karıştırın.
- Hazırlanan hücre süspansiyonunu buz üzerinde tutun ve yumurta çalışma alanına getirin.
NOT: Hazırlanan kanser hücrelerini buz üzerinde çok uzun süre tutmaktan kaçının. Hazırlanan kanser hücreleri 15-25 dakika içinde TAT üzerine yerleştirilmelidir.
6. Kanser hücrelerinin CAM üzerine tohumlanması
NOT: Kontaminasyonu önlemek için eldiven ve yüz maskesi kullanın.
- Kuluçka günü 10'da, inkübatörden inkübe edilmiş kabuksuz yumurtalarla iç nemlendirilmiş odaları çıkarın.
NOT: Kuluçkalanan yumurtaların başlangıç sayısının yaklaşık% 90'ı kullanılabilir; Bkz. Şekil 2. - Dahili nemlendirilmiş odayı açın ve sterilize forseps kullanarak CAM üzerine altı adede kadar silikon halka yerleştirin.
NOT: Silikon halkaları birbirine yakın veya daha büyük kan damarlarına yakın yerleştirmekten kaçının. - Kanser hücrelerinin eşit dağılımını elde etmek için pipetleme ile kanser hücresi süspansiyonunu karıştırın ve hazırlanan kanser hücresi süspansiyonunun 20 μL'sini (1 × 106 hücre) bir silikon halka içine ekleyin (Şekil 1E). Hücreleri eklerken, membrana zarar vermediğinden emin olmak için pipet ucunu CAM'ın üzerinde tutun.
NOT: Önceki bulgulara göre7, farklı kanser hücreleri aynı TAT üzerinde ayrı halkalar halinde tohumlanabilir. - İç nemlendirilmiş odayı kapatın ve yumurta inkübatörüne koyun.
7. TAT'ın ilişkili kanser hücreleri ile izolasyonu
- 14 saat, 1,5 gün, 2,5 gün ve 3,5 günlük inkübasyondan sonra, yaklaşık yedi iç nemlendirilmiş odayı çıkarın ve kapakları birer birer açın.
- Bir çift makasla CAM'a bağlı kültürlenmiş kanser hücrelerini (CAM-Delam örnekleri olarak adlandırılır) silikon halkanın dışına keserek diseke edin (Şekil 1F).
- Forseps kullanarak izole edilmiş CAM-Delam numunesini, dokunun sabitlenmesi için bir Petri kabında 0.1 M fosfat tamponunda (PB) % 4 paraformaldehit'e (PFA) derhal aktarın. 1 saat boyunca buzda veya 4 ° C'de tutun.
NOT: %4 PFA çözeltisini maksimum 5 gün boyunca 4 °C'de saklayın. DİKKAT: PFA toksiktir. PFA tozu ve PFA çözeltilerini kullanırken, bir duman başlığı kullanın ve bir yüz maskesi ve eldiven takın. Toz veya çözelti buharlarını solumaktan kaçının. Üreticinin talimatlarını izleyin. - Tavuk embriyolarının kafasını kesin ve biyolojik atık olarak belirli kutulara atın.
- %4'lük PFA çözeltisini çıkarın ve CAM-Delam numunelerine 0,1 M PB'de %30 sakkaroz ekleyin ve 1 saat boyunca 4 °C'de dengeleyin.
- Bir diseksiyon mikroskobu altında, forseps kullanarak silikon halkayı dikkatlice çıkarın. Bir çift makasla CAM-Delam örneğini ortadaki kanser hücreleri ile dikdörtgen şeklinde kesin (Şekil 1G).
- Bir çift forseps ile, fazla sakkarozu çıkarmak için CAM-Delam numunelerini bir Petri kabındaki dondurulmuş kesit ortamına aktarın ve ardından kalıpları dondurulmuş kesit ortamına gömün.
- Bir diseksiyon mikroskobu altında, CAM-Delam numunesini, iğne benzeri herhangi bir alet kullanarak gömme kalıplarında dikey yönde bir U-şeklinde konumlandırın (Şekil 1G).
- CAM-Delam numunelerini dondurun ve −80 °C'de saklayın.
8. CAM-Delam örneklerinin bölümlenmesi
- Dondurulmuş CAM-Delam numunelerini kriyoseksiyon kullanarak 5-6 ardışık slaytta 10 μm'de kesitleyin.
- Slaytları kesitlerle -80 °C'de saklayın veya doğrudan immünohistokimya boyama için kullanın.
9. İmmünohistokimya boyama
- İmmünoprotokole başlamadan önce slaytları -80 °C'den RT'ye 5 dakika boyunca getirin.
- Bölümlerin bittiği slaytlarda hidrofobik bir işaretleyici ile bir çizgi oluşturun. Birkaç dakika kurumasını bekleyin.
- Slaytları nemlendirilmiş (H2O) bir odaya yerleştirin ve bölümleri ~ 200-500 μL bloke çözeltisi (% 10 fetal buzağı serumu ve% 0.1 Triton X-100 [TBST] ile Tris tamponlu salinde % 0.1 sodyum azid) ile örtün ve 15-30 dakika inkübe edin.
NOT: Bu adımdan itibaren, slaytların hiçbir zaman kurumasına izin vermeyin. - Bloke edici çözeltiyi dökün ve bloke edici çözeltide seyreltilmiş 100-150 μL birincil antikor ile değiştirin ve 4 ° C'de AÇIK'ı inkübe edin. GFP veya diğer floresan etiketli kanser hücre hatları kullanılmıyorsa, bazal laminayı bir kanser hücresi belirteci ile birlikte tanımlamak için tercihen tavşan anti-laminin-111 antikoru kullanın.
NOT: Burada, CAM'deki kan damarlarını tespit etmek için bir tavşan anti-von Willebrand Faktörü de kullanılmıştır. - TBST tamponu ile doldurulmuş üç cam küvet hazırlayın.
- Birincil antikor çözeltisini dökün, slaytları cam küvetlere aktarın ve TBST'de her biri 5 dakika boyunca en az 3x yıkayın.
- Fazla TBST'yi slayttan ve hidrofobik bariyer bölgesinden yumuşak bir kağıt mendille çıkarın.
- Slaytı, 4',6-diamidino-2-fenilindol, dihidroklorür (DAPI) ile kombine edilmiş blokaj çözeltisinde seyreltilmiş uygun bir ikincil floresan antikorun 100-150 μL ile örtün ve 1 saat boyunca RT'de karanlıkta inkübe edin.
- İkincil antikor çözeltisini dökün, slaytları cam küvetlere aktarın ve TBST'de her biri 5 dakika boyunca en az 3x yıkayın.
- Fazla TBST'yi slayttan ve hidrofobik bariyer bölgesinden yumuşak bir kağıt mendille çıkarın.
- Slaytın üzerine 1-2 damla floresan montaj ortamı koyarak slaytları monte edin ve hava kabarcıklarını önleyerek yavaşça bir cam kapak kayması yerleştirin.
- Analiz etmeden önce slaytları 4 °C'de en az 1 saat kurumaya bırakın ve slaytları 4 °C'de saklayın.
10. Mikroskopi görüntüleme ve delaminasyon skorlaması
- Bölümleri, tercihen 10x büyütmede dijital kamera ile donatılmış bir epifloresan mikroskop kullanarak fotoğraflayın (Şekil 1H).
- Aşağıdaki CAM-Delam puanlama kategorilerini kullanarak bölümleri analiz edin (Şekil 3):
- Gözle görülür değişiklikler olmadan sağlam bazal lamina arayın.
- Değişmiş ancak hasar görmemiş bazal laminayı arayın.
- Hücre invazyonu olmadan hasarlı bazal laminayı arayın.
- Hücre invazyonu ile hasarlı bazal lamina arayın.
Sonuçlar
Şekil 1 , CAM-Delam testi7'deki önemli adımları sunmaktadır. İç nemlendirilmiş odaların kullanımı (Şekil 1C), civciv embriyolarının hayatta kalma oranını inkübasyon 10. günde %<50'den %90'a ve kuluçka günü 13'te ~%15'ten %80'e kadar önemli ölçüde artırmıştır (Şekil 2).
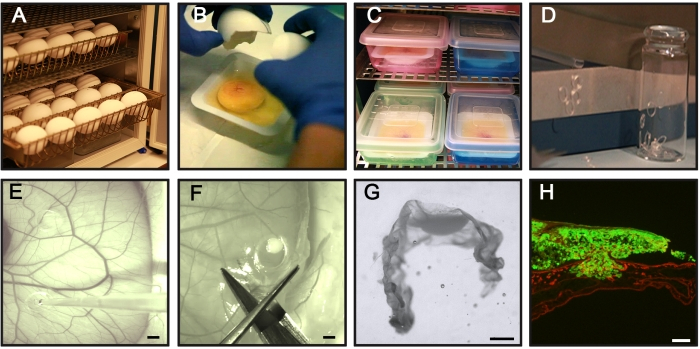
Şekil 1: CAM-Delam testinin temel adımları . (A) Döllenmiş tavuk yumurtalarını dönmeden yatay olarak inkübe edin. (B,C) Kuluçkanın 3. gününde, yumurtaları kırın ve steril tartım teknelerine (B) yerleştirin ve tekneleri daha fazla inkübasyon (C) için iç nemlendirilmiş bir odaya yerleştirin. (D) Silikon halkalar hazırlayın. (E) Kuluçkanın 10. gününde, silikon halkaları CAM'ın üzerine yerleştirin ve bir pipet kullanarak halkaların içine 1 x 106 kanser hücresi tohumlayın. (F,G) Farklı zaman noktalarında (saatler ila günler), TAT'ı bağlı kanser hücreleri ile diseke edin, (F) PFA'da sabitleyin, sakkaroz ile tedavi edin, dondurulmuş kesit ortamında pozisyon, (G) ve -80 ° C'de dondurun. (H) İlişkili GFP + kanser hücreleri (yeşil) ve laminin immünohistokimya boyaması (kırmızı) ile kesitlenmiş bir TAT örneği. Ölçek çubukları = 2 mm (E,F), 1 mm (G) ve 100 μm (H). Bu rakam Palaniappan ve ark.7'den alınmıştır. Kısaltmalar: CAM = koryoallantoik membran; PFA = paraformaldehit; GFP = yeşil floresan proteini. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
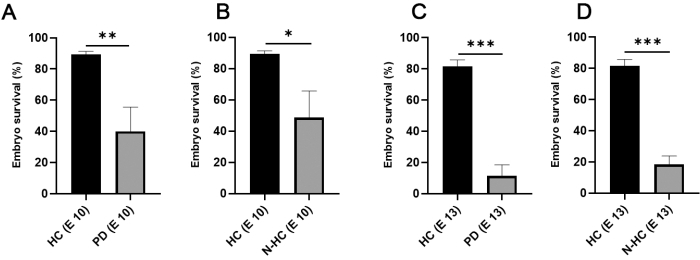
Şekil 2: Kuluçka yöntemine göre tavuk embriyosu sağkalımı . (A,B) Kuluçka günü 10'da, iç HC'lerde tavuk embriyosu sağkalımı iki katına çıktı (ortalama değer 89.33; N = 105) Petri kaplarındaki inkübasyonla karşılaştırıldığında (A; ortalama değer 40; N = 64) ve nemlendirilmemiş odalar (B; ortalama değer 48.67; N = 46). (C,D) Kuluçka 13. gününde, HC kullanılarak hala yüksek bir sağkalım oranı gözlenmiştir (ortalama değer 81.67; N = 105), PD kullanılarak embriyo sağkalımında büyük bir azalma fark edildi (C; ortalama değer 11.33; N = 64) ve N-HC (D; ortalama değer 18.33; N = 46). İstatistiksel anlamlılık, eşlenmemiş iki kuyruklu t-testi kullanılarak test edildi. Hata çubukları standart sapmayı gösterir. *p < 0,05, **p < 0,01, ***p < 0,001. Bu rakam Palaniappan ve ark.7'den değiştirilmiştir. Kısaltmalar: HC = nemlendirilmiş oda; PD = Petri tabakları; N-HC = nemlendirilmemiş oda; E X = Kuluçka günü X. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Bu protokolü kullanarak GFP'yi (U251 glioblastoma, PC-3U prostat, SW620 kolon ve A549 akciğer) eksprese eden farklı kanser hücre hatlarının analizleri daha önce Palaniappan ve ark.7 tarafından bildirilmiştir. CAM-Delam tahlilinden elde edilen sonuçlar, laminin tarafından tespit edilen bazal laminanın morfolojisindeki farklılıkları ve civciv bazal lamina tabakasını civciv mezodermal tabakasına geçen hücreler olarak tanımlanan kanser hücresi invazyonunu içerir (Şekil 3). Bu sonuçlar, kanser hücrelerinin bazal laminayı bozma ve mezenkimi istila etme kapasitesinin dört kategoriden birinde puanlanabileceğini göstermektedir: 1) görünür değişiklikler olmadan sağlam bazal lamina (Şekil 3B), 2) değiştirilmiş ancak hasar görmemiş bazal lamina (Şekil 3C), 3) hücre invazyonu olmadan hasarlı bazal lamina (Şekil 3D) ve 4) hücre invazyonu ile hasarlı bazal lamina (Şekil 3E) ). Başka bir gözlem, kanser hücreleri değişmiş veya hasar görmüş bir bazal laminaya neden olduğunda, TAT'ın, kan damarlarında sentezlenen von Willebrand Faktörüne karşı antikor boyaması ile tanımlanan kan damarı oluşumunun artmasıyla kalınlaştığıydı8 (Şekil 4C-H). Bu iki fenotip, kalınlaşmış bir TAT ve artmış kan damarı oluşumu, TAT sağlam olduğunda gözlenmedi (Şekil 4A, B).
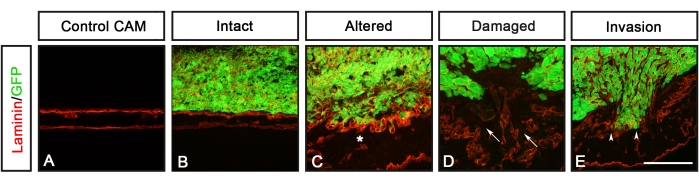
Şekil 3: CAM-Delam skorlaması. (A-E) ANTI-LAMININ (KıRMıZı) ile görselleştirilen CAM bazal laminanın bütünlüğüne ve GFP eksprese eden kanser hücrelerinin (yeşil) potansiyel invazyonuna dayanan bir CAM-Delam skorlama örneği. (A) Kanser hücreleri olmadan CAM'ı kontrol edin. (B-E) Kanser hücrelerine verilen yanıtlarda, bazal laminanın morfolojisini tanımlayan dört kategori puanlanabilir: (B) bozulmamış laminin, (C) değiştirilmiş ancak hasar görmemiş laminin (yıldız işareti ile gösterilir), (D) hasarlı laminin ancak kanser hücresi invazyonu olmadan (oklar), hücre invazyonu ile hasarlı laminin (ok uçları). Ölçek çubuğu = 100 μm (A-E). Bu rakam Palaniappan ve ark.7'den alınmıştır. Kısaltmalar: CAM = koryoallantoik membran; GFP = yeşil floresan proteini. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
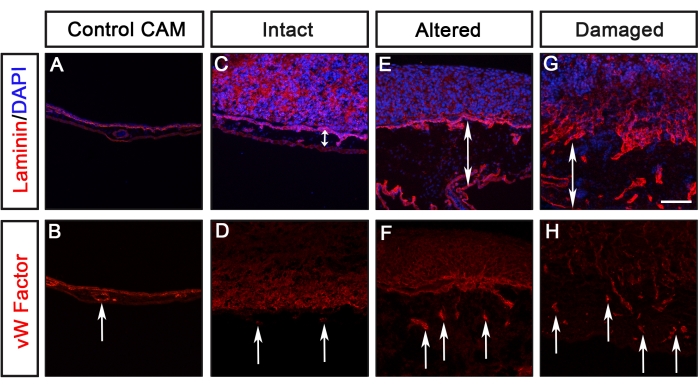
Şekil 4: TAT kalınlaşması ve kan damarı oluşumunun değerlendirilmesi. (A-H) Çeşitli kanser hücresi tiplerinin laminalarına yanıt olarak anti-Von Willebrand Faktörü (kırmızı) ile tespit edilen TAT kalınlaşmasının ve kan damarı oluşumunun görselleştirilmesine bir örnek. (A,B) Kanser hücreleri olmadan CAM'ı kontrol edin. (C,D) Metastatik olmayan bir kanser hücresi hattına yanıt olarak (Bozulmamış olarak puanlandı), mezenkimde belirgin bir kalınlaşma veya artmış kan damarı oluşumu tespit edilmedi. (E-H) Değişmiş veya hasar görmüş Laminin ile sonuçlanan metastatik kanser hücrelerine yanıt olarak, mezenkim kalınlaştırıldı (çift ok uçları ile belirtildi) ve artmış kan damarı oluşumu gözlendi (oklarla belirtildi). Ölçek çubuğu = 100 μm. Bu rakam Palaniappan ve ark.7'den değiştirilmiştir. Kısaltmalar: CAM = koryoallantoik membran; GFP = yeşil floresan proteini. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
U251 glioblastoma ve PC-3U prostat kanseri hücreleri, tamamen farklı delaminasyon kapasitelerine sahip kanser hücre hatlarının iki örneğidir (Şekil 5). PC-3U hücreleri 1.5 gün sonra hasarlı laminine neden oldu, 2.5 gün sonra açık invazyon ile (Şekil 5A). Buna karşılık, U251 hücreleri sadece 1.5-3.5 gün sonra lamininde küçük değişikliklere neden oldu, ancak lamininde hiçbir zaman gözle görülür bir hasara neden olmadı (Şekil 5B).
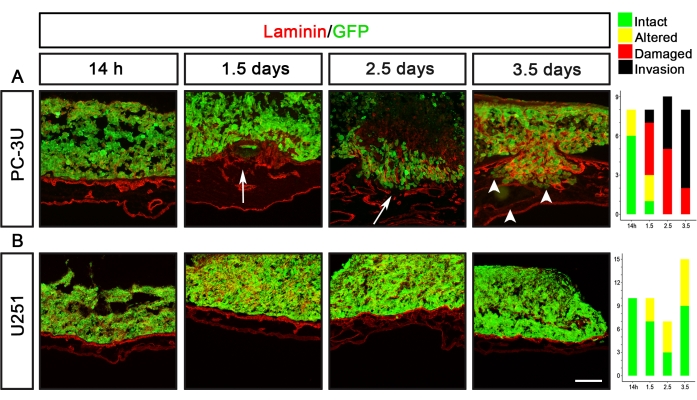
Şekil 5: Prostat (PC-3U) ve glioblastoma (U251) kanser hücrelerinin delaminasyon kapasitesinin görselleştirilmesi. (A) PC-3U hücreleri, 14 saat sonra lamininin küçük değişikliklerine, 1.5 gün sonra lamininin hasar görmesine (ok) ve 2.5 gün sonra invazyonun başlamasına neden oldu, bu da 3.5 gün sonra arttı (ok uçları). (B) U251 hücreleri 1.5-3.5 gün sonra lamininde küçük değişikliklere neden oldu. Sağ panellerde CAM-Delam puanlamasını temsil eden grafikler gösterilmektedir. Y ekseni numune sayısını, x ekseni ise kültürün zaman noktalarını gösterir. Ölçek çubuğu = 100 μm (A,B). Bu rakam Palaniappan ve ark.7'den değiştirilmiştir. Kısaltmalar: CAM = koryoallantoik membran; GFP = yeşil floresan proteini. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
CAM-Delam testi, delaminasyon işlemini düzenleyen moleküler mekanizmaları tanımlamak için kullanılabilir. Bir örnek, geniş MMP inhibitörü GM6001 kullanılarak inhibe edici matriks metalloproteinazların (MMP) kombinasyonu ile veya kombinasyonu olmadan hipoksi indüklemek için CoCl2 tedavisinin kullanılmasıdır (Şekil 6). CoCl2 tedavisinden sonra, U251 metastatik olmayan kanser hücreleri, CoCl2 tedavisi MMP inhibitörü GM6001 ile birleştirildiğinde baskılanan delaminasyon ve invaziv hücreleri indükleme yeteneğini kazanmıştır (Şekil 6). Bu nedenle, CAM-Delam testi, delaminasyon işlemini etkileyen molekülleri ve moleküler yolları tanımlarken yararlı olabilir.
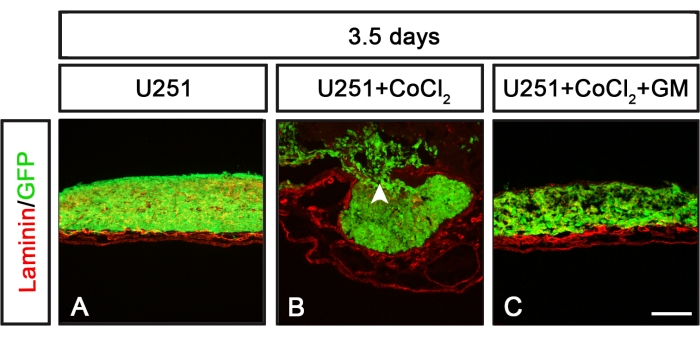
Şekil 6: Tek başına veya bir MMP inhibitörü ile birlikte CoCl 2'ye maruz kalanU251 hücrelerine yanıt olarak delaminasyon paternleri. (A-C) U251 hücreleri, çeşitli koşullar altında TAT üzerinde 3.5 gün boyunca kültürlenir. (A) Tek başına kültürlenen U251 hücreleri laminine herhangi bir zarar vermedi. (B) CAM kaynaklı laminin hasarı ve hücre invazyonu üzerinde yıkama ve hücre tohumlamasından önce CoCl2'ye (24 saat) önceden maruz kalan kültürlenmiş U251 hücreleri. (C) Geniş spektrumlu bir MMP inhibitörü GM6001 (1 saat boyunca) ile ön işlem, ardındanU251 hücrelerini CAM üzerinde yıkamadan ve tohumlamadan önce CoCl 2 maruziyeti (24 saat), CoCl 2 tedavisinin etkisini baskıladı ve belirgin bir laminin hasarı veya kanser hücresi invazyonu tespit edilmedi. Ölçek çubuğu = 100 μm (A-C). Paneller (B) ve (C) Palaniappan ve ark.7'dendir. Kısaltmalar: CAM = koryoallantoik membran; GFP = yeşil floresan protein; CoCl2 = kobalt klorür; MMP = matris metalloproteinaz. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu yazıda, bazal lamina modülasyonlarının ve potansiyel hücre invazyonunun mesenkimde birkaç saat ila birkaç gün içinde puanlanması ile belirlenen kanser hücrelerinin metastatik saldırganlığını değerlendirmek için CAM-Delam testi açıklanmaktadır. Çeşitli TAT testleri için önceki bir teknik sorun, civciv embriyolarının düşük hayatta kalması olmuştur. Bu sorun, embriyo inkübasyonu sırasında embriyo sağkalımını %10-50'den %80-%90'a çıkaran dahili nemlendirilmiş bir odanın kullanımı ile çözülmüştür7. Bu nedenle, iç nemlendirilmiş bir odanın kullanımı, genel olarak CAM testlerinde ve diğer ex ovo civciv deneylerinde değerli olabilir.
TAT üzerinde 1 x 106 kanser hücresinin tohumlanmasından sonra 14 saat, 1.5 gün, 2.5 gün ve 3.5 gün boyunca sunulan puanlama zaman noktaları, altı farklı kanser hücresi çizgisi kullanılarak titiz yöntem geliştirmeye dayanmaktadır ve kanser hücre hatlarının delaminasyon yapmamasından istila ile delaminasyon kapasitelerine kadar olan aralığı ayırt etmek için yeterlidir. Her seferinde bir zaman noktası ve hücre çizgisi başına üç halkalı en az dört yumurta kullanılması önerilmektedir ve bu en az bir kez veya deneysel tasarımlara ve istatistiksel gereksinimlere göre tekrarlanmalıdır. CAM-Delam testinin bir avantajı, kanser hücrelerinin agresifliğini ve metastaz oluşumu için potansiyel riski tahmin etmek için birkaç gün içinde kanser hücrelerinin delaminasyon kapasitesi hakkında bilgilendirici sonuçlar elde etmektir. Sonuçların hızlı bir şekilde verilmesi, invaziv kanser hücreleri ve ardından gelen mikrotümörler / tümör tomurcukları ve organ metastazları nedeniyle bazal laminanın bozulmasının izlenmesiyle kolaylaştırılır. Geleneksel olarak, CAM modelleri, belirlenmesi yaklaşık 2 hafta süren organ metastazlarının oluşumunu analiz etmek için kullanılmıştır9. Yedi farklı kanser hücresi çizgisi kullanarak, daha önce7'yi, delaminasyon skorlamasının, kanser hücrelerinin kemirgen modellerinde metastaz oluşturma kabiliyeti ile bağlantılı olduğunu doğruladık 10,11,12,13,14, bu da CAM-Delam testinin öngörücü değerini desteklemektedir. Dahası, fare modelleri, metastazların incelenebilmesi için aylara kadar birkaç hafta kadar daha uzun bir süre gerektirir15,16. Kısacası, civciv embriyosunda daha sonraki tümör oluşumunu incelemeye değil, delaminasyon kapasitesini puanlamaya odaklanan bu gelişmiş CAM-Delam testi, bu nedenle, mevcut tavuk CAM istilası ve fare tümörü modellerine iyi bir tamamlayıcıdır.
CAM-Delam tahlilindeki bir sınırlama, kanser hücrelerinin kendileri laminin eksprese ederse, bazal laminanın belirsiz bir şekilde görselleştirilmesi olabilir. Eğer öyleyse, E-kadherin gibi bazal laminayı gösteren diğer belirteçler kullanılabilir7. Diğer TAT invazyonu çalışmaları, TAT'ı görselleştirmek için tip IV kollajen ve istilacı kanser hücrelerini ve mikrotümörlerin / tümör tomurcuklarının oluşumunu tanımlamak için pan-sitokeratin ve vimentin kullanmıştır17,18.
Delaminasyon, hem gelişim sırasında hem de yaşamın ilerleyen dönemlerinde normal bir hücresel süreçtir, bu da hücrelerin bir epitelden ayrılmasını ve diğer dokulara göç etmesini mümkün kılar. Gelişim sırasında delaminasyon hücrelerinin örnekleri nöral tepe ve koku alma öncü nöronlarıdır19,20; Yaşamın ilerleyen dönemlerinde, yara iyileşmesi delaminasyona bağlıdır21. Kanser sırasında, bu süreç yanlış hücrelerde ve / veya yanlış zamanda yukarı regüle edilir. Bu nedenle, CAM-Delam yöntemi, hem temel biyolojik hem de hastalık bilgisi için önemli olacak olan delaminasyonu düzenleyen moleküler mekanizmaları çözmek için kullanılabilir. Bu tür delaminasyon çalışmaları, TAT üzerine tohumlanan kanser hücrelerine ilgi çekici faktörlerin eklenmesini veya genetiği değiştirilmiş kanser hücrelerinin incelenmesini içerecektir. Burada sunulan bir örnek, hipoksiyi indüklemek için metastatik olmayan hücre hattı U251'in CoCl2 ön tedavisidir, bu da geniş spektrumlu bir MMP inhibitörü tarafından baskılanabilecek metastatik agresif kapasitenin indüklenmesine yol açar. Bu nedenle, delaminasyonu kontrol eden anahtar moleküllerin bulunması, bu süreci baskılamak için inhibitörler tasarlama olasılığını arttırır. Bununla ilgili olarak, CAM-Delam protokolünün bir başka potansiyel kullanımı, delaminasyon ve hücre invazyonunun baskılanması için ilaç taramasıdır. Ayrıca, klinikte, kanser şiddetinin değerlendirilmesi tanı, tedavinin planlanması ve bakım için kritik bir bileşendir. Günümüzde TNM evreleme sistemi (T, tümör boyutu; N, düğüm-kanserin lenf düğümlerine yayılıp yayılmadığı; M, uzak metastaz) kanserin şiddetini değerlendirmek için kullanılır22. CAM-Delam testi, kanser hücrelerinin agresifliğini ve metastaz oluşumu için potansiyel riski değerlendirmek için yenilikçi bir yaklaşım tanımlar ve TNM evreleme sistemi için yararlı bir tamamlayıcı olabilir. Dikkate değer olan, TNM evrelemesinin sabit doku örneklerinin analizlerine dayanmasıdır, oysa potansiyel bir klinik CAM-Delam yaklaşımı, donmuş hücreleri canlandırma teknikleriyle birlikte taze veya taze dondurulmuş dokuları inceleyecektir23.
Açıklamalar
Yazarların ifşa etmek için rakip çıkarları yoktur.
Teşekkürler
UmeşÜniversitesi'ndeki aşağıdaki araştırmacılara ilgili kanser hücre hatları ve antikorları ile ilgili yardımları için teşekkür ederiz: L. Carlsson (von Willebrand Faktör antikoru), J. Gilthorpe (U251) ve M. Landström (PC-3U). Ayrıca HEK293-TLR-AAVS1 kararlı hücre hattının üretimi için Gilthorpe laboratuvarında Hauke Holthusen'e teşekkür ederiz. Gunhaga laboratuvarındaki çalışmalar İsveç Kanser Vakfı (18 0463), UmeşBiyoteknoloji İnkübatörü, Norrlands Cancerforskningsfond, İsveç Araştırma Konseyi (2017-01430) ve UmeşÜniversitesi Tıp Fakültesi tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| EQUIPMENT | |||
| Centrifuge | Rotanta 480 R, Hettich zentrifugen | ||
| Countess II FL Automated Cell Counter | Invitrogen | ||
| Cryostat | HM 505 E, Microm | ||
| Digital camera | Nikon DS-Ri1 | ||
| Dissection Microscope | Leica M10 | For CAM-sample dissection and positioning in molds | |
| Egg incubator | Fiem | Many other sources are available. Must be cleaned and sterilized with 70 % ethanol before each use | |
| Epifluorescence microscope | Nikon Eclipse, E800 | Equiped with a digital camera, for scoring delamination and cell invasion. | |
| Fine forceps | Many sources are available | Must be sterilized before use | |
| Freezer -80 °C | Thermo Fisher Scientific | 8600 Series | Model 817CV |
| Inverted microscope | Nikon Eclipse TS100 | For cell culture work | |
| Scissors (small) | Many sources are available | Must be sterilized before use | |
| MATERIALS | |||
| anti-Laminin-111 | Sigma-Aldrich | L9393 | Primary anti-rabbit antibody (1:400) |
| anti-rabbit Cy3 | Jackson Immuno Research | 111-165-003 | Secondary antibody (1:400) |
| anti-von Willebrand Factor | DAKO | P0226 | Primary antibody (1:100) |
Cobalt(II) chloride | Sigma-Aldrich | 232696-5G | CAUTION: moderate toxicity chemical. Handle with care only in fume hood. Follow manufacturers instructions |
| DAPI | Sigma-Aldrich | D9542-10MG | 4',6-diamidino-2-phenylindole, dihydrochloride (1:400) |
| Fertilized chicken eggs | Strömbäcks Ägg, Vännäs, Sweden | Any local egg supplyer | |
| Fetal bovine serum | Life Technologies | 10500-064 | |
| Fluorescence mounting medium | Allent Technologie | S302380-2 | Avoid bubble formation when mounting. Allow to dry at +4 °C |
| Glass chambers for silicon rings | Many sources are available | We used 15 mL glass chambers. Around 20 silicon rings fit in one chamber. Avoid crowding, since the rings may stick together and aggravate work. | |
| Glass coverslips | VWR International | 631-0165 | |
| GM6001 MMP Inhibitor | Sigma-Aldrich | CC1010 | |
| Microscope slides for immunohistochemistry | Fisher Scientific | 10149870 | |
| NEG-50 frozen medium | Cellab | 6506 | |
| Paraformaldehyde | Sigma-Aldrich | 30525-89-4 | CAUTION: highly toxic. Handle with care only in fume hood, follow manufacturers instructions. Use all protective clothing. |
Peel-A-Way Embedding Molds | Polysciences | 18985 | |
| Penicillin–streptomycin | Gibco | 15070063 | |
| Petri dishes | Sarstedt | 83.3903 | 15 cm in diameter for cell culture |
| Plastic box | Esclain | ||
| PureCol EZ Gel Collagen | Cellsystems | 5074-35ML | 5 mg/mL. Gelatinous material. Pipette very slowly and carefully to avoid cells being lost in the bubble formations. |
| RPMI medium | Thermo Fisher Scientific | 21875034 | |
| Silicon rings | VWR International | 228-1580 | Inner/outer diameter: 4/5 mm. Should be sterilized before use. Avoid repeated autoclaving of unused rings. |
| Trypan blue | Fisher Scientific | T10282 | |
| Trypsin | Life Technologi | 15400054 | 0.50% |
| Weighing boats | VWR International | 611-0094 | |
| SOLUTIONS | |||
| Collagen-RPMI media mixture (1 mL) | Compelete RPMI Media 750 µL | ||
| PureCol EZ Gel Collagen 250 µL | |||
| Mix and use immediately | |||
| Complete RPMI media (500 mL) | RPMI Media 445 mL | ||
| FBS 50 mL | |||
| Penicillin–streptomycin 5mL | |||
| Store at 4 °C | |||
| PB (0.2 M; 1 000 mL) | Na2HPO4 (MW 141.76) 21.9 g | ||
| NaH2PO4 (MW 137.99) 6.4 g | |||
| add deionized water up to final volume of 1000ml | |||
| Store in RT | |||
| PFA (4 %) in 0.1 M PB (100 mL) | Deionized water 50 mL | ||
| 0.2 M PB 50 mL | |||
| Paraformaldehyde (PFA) 4g | |||
| heat to 60 °C in water bath | |||
| add 5 M NaOH 25 µL | |||
| Stir to dissolve the PFA powder | |||
| Store at 4 °C | |||
| TBST (1 000 mL) | 50mM Tris pH 7,4 50 mL | ||
| 150mM NaCI 30 mL | |||
| 0,1% Triton X-100 10 mL | |||
| H2O (MQ) 900 mL | |||
| Trypsin (0.05 %; 10 mL) | 1x PBS 9 mL | ||
| 10x Trypsin (0.5 %) 1 mL | |||
| 10 mL in total, Store at 4 °C |
Referanslar
- Vasantharajan, S. S., et al. The epigenetic landscape of circulating tumour cells. Biochimica et Biophysica Acta - Reviews on Cancer. 1875 (2), 188514(2021).
- Acloque, H., Adams, M. S., Fishwick, K., Bronner-Fraser, M., Nieto, M. A. Epithelial-mesenchymal transitions: the importance of changing cell state in development and disease. Journal of Clinical Investigation. 119 (6), 1438-1449 (2009).
- Itoh, Y. Membrane-type matrix metalloproteinases: their functions and regulations. Matrix Biology. 44-46, 207-223 (2015).
- Przemyslaw, L., Boguslaw, H. A., Elzbieta, S., Malgorzata, S. M. ADAM and ADAMTS family proteins and their role in the colorectal cancer etiopathogenesis. BMB Reports. 46 (3), 139-150 (2013).
- Chu, P. Y., Koh, A. P., Antony, J., Huang, R. Y. Applications of the chick chorioallantoic membrane as an alternative model for cancer studies. Cells Tissues Organs. 211 (2), 222-237 (2021).
- MacDonald, I. C., Groom, A. C., Chambers, A. F. Cancer spread and micrometastasis development: quantitative approaches for in vivo models. Bioessays. 24 (10), 885-893 (2002).
- Palaniappan, T. K., Slekiene, L., Jonasson, A. K., Gilthorpe, J., Gunhaga, L. CAM-Delam: an in vivo approach to visualize and quantify the delamination and invasion capacity of human cancer cells. Scientific Reports. 10 (1), 10472(2020).
- Carrillo, M., Kim, S., Rajpurohit, S. K., Kulkarni, V., Jagadeeswaran, P. Zebrafish von Willebrand factor. Blood Cells, Molecules and Diseases. 45 (4), 326-333 (2010).
- Leupold, J. H., Patil, N., Allgayer, H. The chicken egg chorioallantoic membrane (CAM) model as an in vivo method for the investigation of the invasion and metastasis cascade of malignant tumor cells. Methods in Molecular Biology. 2294, 17-26 (2021).
- Jia, Y., et al. Recombinant human endostatin endostar inhibits tumor growth and metastasis in a mouse xenograft model of colon cancer. Pathology and Oncology Research. 18 (2), 315-323 (2012).
- Liu, B., et al. RNAi-mediated inhibition of presenilin 2 inhibits glioma cell growth and invasion and is involved in the regulation of Nrg1/ErbB signaling. Neuro-Oncology. 14 (8), 994-1006 (2012).
- Qin, T., et al. Tumor necrosis factor superfamily 15 promotes lymphatic metastasis via upregulation of vascular endothelial growth factor-C in a mouse model of lung cancer. Cancer Science. 109 (8), 2469-2478 (2018).
- Ren, L., et al. Characterization of the metastatic phenotype of a panel of established osteosarcoma cells. Oncotarget. 6 (30), 29469-29481 (2015).
- Zang, G., Mu, Y., Gao, L., Bergh, A., Landstrom, M. PKCzeta facilitates lymphatic metastatic spread of prostate cancer cells in a mice xenograft model. Oncogene. 38 (22), 4215-4231 (2019).
- Francia, G., Cruz-Munoz, W., Man, S., Xu, P., Kerbel, R. S. Mouse models of advanced spontaneous metastasis for experimental therapeutics. Nature Reviews Cancer. 11 (2), 135-141 (2011).
- Jung, J. Human tumor xenograft models for preclinical assessment of anticancer drug development. Toxicology Research. 30 (1), 1-5 (2014).
- Liu, M., et al. The histone methyltransferase EZH2 mediates tumor progression on the chick chorioallantoic membrane assay, a novel model of head and neck squamous cell carcinoma. Translational Oncology. 6 (3), 273-281 (2013).
- Steinmann, S., et al. DAPK1 loss triggers tumor invasion in colorectal tumor cells. Cell Death & Disease. 10 (12), 895(2019).
- Andrieu, C., et al. MMP14 is required for delamination of chick neural crest cells independently of its catalytic activity. Development. 147 (7), (2020).
- Palaniappan, T. K., Slekiene, L., Gunhaga, L., Patthey, C. Extensive apoptosis during the formation of the terminal nerve ganglion by olfactory placode-derived cells with distinct molecular markers. Differentiation. 110, 8-16 (2019).
- Thiery, J. P., Acloque, H., Huang, R. Y., Nieto, M. A. Epithelial-mesenchymal transitions in development and disease. Cell. 139 (5), 871-890 (2009).
- Pineros, M., et al. Essential TNM: a registry tool to reduce gaps in cancer staging information. The Lancet Oncology. 20 (2), 103-111 (2019).
- Walsh, A. J., Cook, R. S., Sanders, M. E., Arteaga, C. L., Skala, M. C. Drug response in organoids generated from frozen primary tumor tissues. Scientific Reports. 6, 18889(2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır