Method Article
تصور ديناميكيات اقتران الأكتين والأنابيب الدقيقة في المختبر بواسطة المجهر الكلي للتألق الداخلي (TIRF)
In This Article
Summary
هذا البروتوكول هو دليل لتصور الأكتين الديناميكي والأنابيب الدقيقة باستخدام الفحص المجهري الداخلي الكلي للتألق في المختبر (TIRF).
Abstract
تقليديا ، تمت دراسة الهياكل الخلوية للأكتين والأنابيب الدقيقة ككيانات منفصلة ، تقتصر على مناطق أو عمليات خلوية محددة ، وتنظمها مجموعات مختلفة من البروتينات الملزمة الفريدة لكل بوليمر. تظهر العديد من الدراسات الآن أن ديناميكيات كل من البوليمرات الخلوية الهيكلية متشابكة وأن هذا الحديث المتبادل مطلوب لمعظم السلوكيات الخلوية. تم بالفعل تحديد عدد من البروتينات المشاركة في تفاعلات الأكتين والأنابيب الدقيقة (أي تاو ، MACF ، GAS ، الفورمين ، وأكثر من ذلك) وهي تتميز بشكل جيد فيما يتعلق إما بالأكتين أو الأنابيب الدقيقة وحدها. ومع ذلك ، أظهرت دراسات قليلة نسبيا مقايسات تنسيق الأكتين والأنابيب الدقيقة مع الإصدارات الديناميكية من كلا البوليمرات. وهذا قد يحجب آليات الربط الناشئة بين الأكتين والأنابيب الدقيقة. هنا ، تسمح تقنية إعادة التشكيل في المختبر القائمة على التألق الداخلي الكلي للانعكاس الداخلي (TIRF) بتصور كل من ديناميكيات الأكتين والأنابيب الدقيقة من تفاعل كيميائي حيوي واحد. تحافظ هذه التقنية على ديناميكيات البلمرة إما لخيوط الأكتين أو الأنابيب الدقيقة بشكل فردي أو في وجود البوليمر الآخر. يستخدم بروتين تاو المتوفر تجاريا لتوضيح كيفية تغير سلوكيات الأكتين والأنابيب الدقيقة في وجود بروتين تقليدي متقاطع بين الهيكل الخلوي. يمكن أن توفر هذه الطريقة رؤى وظيفية وميكانيكية موثوقة حول كيفية تنسيق البروتينات التنظيمية الفردية لديناميكيات الأكتين والأنابيب الدقيقة بدقة خيوط مفردة أو مجمعات أعلى مرتبة.
Introduction
تاريخيا، كان ينظر إلى الأكتين والأنابيب الدقيقة على أنهما كيانان منفصلان، لكل منهما مجموعة خاصة به من البروتينات التنظيمية، والسلوكيات الديناميكية، والمواقع الخلوية المتميزة. تظهر الأدلة الوفيرة الآن أن بوليمرات الأكتين والأنابيب الدقيقة تشارك في آليات التداخل الوظيفية الضرورية لتنفيذ العديد من عمليات الخلايا بما في ذلك الهجرة وتحديد موضع المغزل الانقسامي والنقل داخل الخلايا ومورفولوجيا الخلية1،2،3،4. تعتمد السلوكيات المنسقة المتنوعة التي تكمن وراء هذه الأمثلة على توازن معقد بين عوامل الاقتران والإشارات والخصائص الفيزيائية. ومع ذلك ، فإن التفاصيل الجزيئية التي تدعم هذه الآليات لا تزال غير معروفة إلى حد كبير لأن معظم الدراسات تركز على بوليمر هيكلي خلوي واحد في وقتواحد 1،2،5.
الأكتين والأنابيب الدقيقة لا تتفاعل مباشرة6،7،8. يتم التوسط في الديناميكيات المنسقة للأكتين والأنابيب الدقيقة التي شوهدت في الخلايا بواسطة عوامل إضافية. تم تحديد العديد من البروتينات التي يعتقد أنها تنظم الأكتين والأنابيب الدقيقة المتقاطعة وتتميز أنشطتها بشكل جيد فيما يتعلق إما بالبوليمر الخلوي الهيكلي وحده 1,2. تشير الأدلة المتزايدة إلى أن نهج البوليمر الواحد هذا قد أخفى الوظائف المزدوجة لبعض البروتينات / المجمعات التي تمكن أحداث اقتران الأكتين والأنابيب الدقيقة7،8،9،10،11،12،13. التجارب التي يوجد فيها كلا البوليمرات نادرة وغالبا ما تحدد الآليات ذات البوليمر الديناميكي الواحد والنسخة المستقرة الثابتة من 6,8,9,10,11,14,15,16,17,18 الأخرى . وبالتالي ، هناك حاجة إلى طرق للتحقيق في الخصائص الناشئة للبروتينات المنسقة بين الأكتين والأنابيب الدقيقة التي قد لا تكون مفهومة تماما إلا في الأنظمة التجريبية التي تستخدم كلا البوليمرات الديناميكية.
تم تطبيق مزيج من أساليب وضع العلامات المباشرة على البروتين ، وعلامات التقارب المشفرة وراثيا ، والفحص المجهري الكلي للتألق الداخلي للانعكاس (TIRF) بنجاح كبير في أنظمة إعادة التشكيل الحيوي19،20،21،22،23. لا تحتوي العديد من المخططات من أسفل إلى أعلى على جميع العوامل التي تنظم البروتينات في الخلايا. ومع ذلك ، فإن تقنية "الكيمياء الحيوية على غطاء زجاجي" قد صقلت العديد من آليات ديناميكيات الأكتين والأنابيب الدقيقة على نطاقات مكانية وزمنية عالية ، بما في ذلك المكونات اللازمة لتجميع البوليمر أو تفكيكه ، وحركة بروتين المحرك5،12،23،24،25،26،27 . هنا يتم وصف نهج الحد الأدنى من المكون أحادي الخيط للتحقيق في اقتران الأكتين والأنابيب الدقيقة في المختبر. يمكن استخدام هذا البروتوكول مع البروتينات المتاحة تجاريا أو النقية للغاية ، والبروتينات ذات العلامات الفلورية ، وغرف التروية ، وتوسيعها إلى مخططات أكثر تعقيدا تحتوي على مستخلصات خلوية أو أنظمة اصطناعية. هنا ، يتم استخدام بروتين تاو المتاح تجاريا لتوضيح كيفية تغير ديناميكيات الهيكل الخلوي في وجود بروتين اقتران الأكتين والأنابيب الدقيقة ، ولكن يمكن استبداله بعوامل تنسيق الأكتين والأنابيب الدقيقة المفترضة الأخرى. الميزة الرئيسية لهذا النظام على النهج الأخرى هي القدرة على مراقبة ديناميكيات البوليمرات الخلوية الهيكلية المتعددة في وقت واحد في تفاعل واحد. كما يوفر هذا البروتوكول للمستخدمين أمثلة وأدوات بسيطة لتحديد التغيرات التي تطرأ على البوليمرات الهيكلية الخلوية. وبالتالي ، سينتج مستخدمو البروتوكول بيانات موثوقة وكمية وذات دقة أحادية الخيط لوصف الآليات التي تكمن وراء كيفية تنسيق البروتينات التنظيمية المتنوعة لديناميكيات الأكتين والأنابيب الدقيقة.
Protocol
1. غسل الأغطية
ملاحظة: غسل (24 مم × 60 مم ، # 1.5) أغطية وفقا ل Smith et al.، 201328.
- رتب أغطية في حاوية بريدية بلاستيكية.
- يغمر الغطاء بالتتابع في المحاليل التالية ويسونيك لمدة 30-60 دقيقة ، ويشطف ب ddH 2 O 10 مرات بينكل محلول: ddH2O مع قطرة واحدة من صابون الأطباق ؛ 0.1 م كوه. قم بتخزين الأغطية في الإيثانول بنسبة 100٪ لمدة تصل إلى 6 أشهر.
ملاحظة: لا تلمس الأسطح الزجاجية بأصابع غير محبوبة. استخدم الملقط بدلا من ذلك.
2. طلاء نظيفة (24 مم × 60 مم ، # 1.5) أغطية مع mPEG - و biotin-PEG-silane
ملاحظة: يستخدم هذا البروتوكول على وجه التحديد نظام البيوتين-ستربتافيدين لوضع الأكتين والأنابيب الدقيقة داخل مستوى التصوير TIRF. يمكن استخدام طلاءات وأنظمة أخرى (على سبيل المثال ، الأجسام المضادة ، بولي إل-ليسين ، نيم ميوسين ، إلخ).
- إذابة أليكوتس من مساحيق PEG-silane و البيوتين-PEG-silane.
- قم بإذابة مساحيق PEG في 80٪ من الإيثانول (الرقم الهيدروجيني 2.0) لتوليد محاليل مخزون الطلاء من 10 ملغ / مل mPEG-silane و 2-4 ملغ / مل البيوتين-PEG-silane ، قبل الاستخدام مباشرة.
ملاحظة: غالبا ما تظهر مساحيق PEG مذابة ولكنها قد لا تكون على المستوى المجهري. تستغرق إعادة التعليق المناسبة حوالي 1-2 دقيقة مع السحب المستمر. يتم تشجيع المستخدمين على ماصة 10 مرات إضافية بعد ظهور ذوبان المسحوق.
تحذير: ارتداء قفازات لحماية البشرة من حمض الهيدروكلوريك المركز عند صنع 80٪ من الإيثانول (الرقم الهيدروجيني 2.0). - قم بإزالة الغطاء النظيف (24 مم × 60 مم ، # 1.5) من تخزين الإيثانول باستخدام الملقط. يجف بغاز النيتروجين ويخزن في طبق بتري نظيف.
- أغطية المعطف مع 100 ميكرولتر من محلول الطلاء: خليط من 2 ملغ / مل mPEG-silane (MW 2,000) و 0.04 mg / mL biotin-PEG-silane (MW 3,400) في 80٪ من الإيثانول (الرقم الهيدروجيني 2.0).
ملاحظة: بالنسبة للطلاء المتناثر (مستحسن) ، استخدم 2 مجم / مل mPEG-silane و 0.04 mg / mL biotin-PEG-silane. للطلاء الكثيف ، استخدم 2 مجم / مل mPEG-silane ، 4 mg / mL biotin-PEG-silane. - احتضن الأغطية عند 70 درجة مئوية لمدة 18 ساعة على الأقل أو حتى الاستخدام.
ملاحظة: تتحلل الأغطية المطلية إذا تم تخزينها عند 70 درجة مئوية لأكثر من 2 أسابيع.
3. تجميع غرف تدفق التصوير
- اقطع 12 شريطا من الشريط المزدوج المدعوم على الوجهين بطول 24 مم. قم بإزالة جانب واحد من دعامة الشريط وقم بإصلاح قطع الشريط المجاورة للأخاديد الستة الموجودة على غرفة تصوير نظيفة.
ملاحظة: يجب أن يكون الشريط مسطحا للتجميع السليم ، وإلا ستتسرب غرف التصوير. قم بإزالة الجزء الخلفي من الشريط بعناية لتجنب المطبات. يوصى بانزلاق الغرف المسجلة على سطح نظيف لتنعيم جهات اتصال غرفة الشريط. - قم بإزالة القطعة الثانية من الشريط الخلفي لفضح الجانب اللزج من الشريط على طول كل أخدود غرفة. ضع شريط الحجرة جانبا على سطح نظيف.
- امزج راتنجات الايبوكسي وحلول التقوية 1: 1 (أو وفقا لتعليمات الشركة المصنعة) في قارب صغير الوزن.
- استخدم طرف P1000 لوضع قطرة من الإيبوكسي المختلط بين شرائط الشريط في نهاية كل أخدود غرفة تصوير (سهم أحمر; الشكل 1 ألف). ضع شريط الغرفة/الايبوكسي جانبيا لأعلى على سطح نظيف.
- قم بإزالة غطاء مغلف من حاضنة 70 درجة مئوية. اشطف الأسطح المطلية وغير المطلية من أغطية الغطاء باستخدام ddH2O ست مرات ، وجففها بغاز النيتروجين المصفى ، ثم قم بتثبيتها على غرفة التصوير مع جانب طلاء الغطاء نحو الشريط.
- استخدم طرف ماصة P200 أو P1000 للضغط على واجهة الشريط الزجاجي لضمان وجود ختم جيد بين الشريط والغطاء الزجاجي.
ملاحظة: مع ختم مناسب، يصبح الشريط على الوجهين شفافا. سوف تتسرب غرف التصوير التي تفتقر إلى جهات اتصال كافية لغرفة الشريط. - احتضان الغرف المجمعة في درجة حرارة الغرفة لمدة 5-10 دقائق على الأقل للسماح للإيبوكسي بإغلاق آبار الغرفة بالكامل قبل الاستخدام. تنتهي صلاحية غرف التروية في غضون 12-18 ساعة من التجميع.
ملاحظة: اعتمادا على موضع الشريط وسمك الشريط على الوجهين المستخدم ، سيكون للغرفة المجمعة حجم نهائي يتراوح بين 20 و 50 ميكرولتر.
4. تكييف غرف التروية
- استخدم مضخة التروية (تم ضبط السعر على 500 ميكرولتر / دقيقة) لتبادل حلول التكييف بالتتابع في غرفة التروية على النحو التالي:
- تدفق 50 ميكرولتر من 1٪ BSA لتجهيز غرفة التصوير. قم بإزالة المخزن المؤقت الزائد من خزان تركيب قفل Luer.
- تدفق 50 ميكرولتر من 0.005 ملغ / مل ستربتافيدين. حضانة لمدة 1-2 دقيقة في درجة حرارة الغرفة. إزالة المخزن المؤقت الزائد من الخزان.
- تدفق 50 ميكرولتر من 1٪ BSA لمنع الربط غير المحدد. احتضان لمدة 10-30 ثانية. إزالة المخزن المؤقت الزائد من الخزان.
- تدفق 50 ميكرولتر من المخزن المؤقت TIRF الدافئ (37 درجة مئوية) 1x (1x BRB80 ، 50 mM KCl ، 10 mM DTT ، 40 mM glucose ، 0.25٪ (v / v) methylcellulose (4,000 cp)).
ملاحظة: لا تقم بإزالة المخزن المؤقت الزائد من الخزان. هذا يمنع الغرفة من الجفاف ، والتي يمكن أن تدخل فقاعات الهواء في النظام. - اختياري: تدفق 50 ميكرولتر من بذور الأنابيب الدقيقة البيوتينيل المستقرةبنسبة 29 و 50٪ المخففة في مخزن مؤقت TIRF 1x.
ملاحظة: يجب تحديد التخفيف المناسب تجريبيا ويحتوي على تباين من دفعة إلى أخرى. يوصى باستخدام بروتوكولات من27,29 كنقاط انطلاق. يعمل التخفيف الذي ينتج عنه 10-30 بذرة لكل مجال عرض بشكل جيد مع هذا الإعداد.
5. إعداد المجهر
ملاحظة: يتم تصور / تنفيذ التفاعلات الكيميائية الحيوية التي تحتوي على خيوط الأكتين الديناميكية والأنابيب الدقيقة باستخدام مجهر فلورة الانعكاس الداخلي الكلي المقلوب (TIRF) المجهز بليزر الحالة الصلبة 120-150 ميجاوات ، وهدف TIRF لغمر الزيت المصحح بنسبة 63x ، وكاميرا EMCCD. يتم تصور البروتينات في هذا المثال عند الأطوال الموجية التالية: 488 نانومتر (الأنابيب الدقيقة) و 647 نانومتر (الأكتين).
- اضبط جهاز سخان المرحلة / الهدف للحفاظ على 35-37 درجة مئوية قبل 30 دقيقة على الأقل من تصوير أول تفاعل كيميائي حيوي.
- قم بتعيين معلمات الحصول على الصورة على النحو التالي:
- اضبط فترة الاكتساب على كل 5 ثوان لمدة 15-20 دقيقة.
- اضبط 488 و 647 تعرضا لليزر على 50-100 مللي ثانية عند طاقة 5٪ -10٪. تعيين زاوية TIRF المناسبة للمجهر.
ملاحظة: بغض النظر عن إعداد المجهر ، فإن أبسط طريقة لضبط طاقة الليزر والتعرض وزاوية TIRF هي إجراء تعديلات على صور أي من البوليمر وحده (انظر 5.2.2.1 و 5.2.2.2 ، أدناه). يتم تشجيع المستخدمين بشدة على استخدام أقل إعدادات طاقة الليزر والتعرض التي لا تزال تسمح بالكشف.- اضبط تفاعل البلمرة (الشكل 1C) لبدء تجميع خيوط الأكتين والحصول على صور عند 647 نانومتر. قم بإجراء التعديلات المناسبة.
- اضبط تفاعل البلمرة في بئر تروية مشروطة ثانية لبدء تجميع الأنابيب الدقيقة (الشكل 1C) وتصوره عند 488 نانومتر. قم بإجراء التعديلات المناسبة.
6. تحضير خلطات تفاعل البروتين
- إعداد محلول المخزون من توبولين المسمى بالفلورسنت.
- تحديد تركيز التوبولين محلي الصنع غير المسمى عن طريق قياس الطيف الضوئي عند Abs280 ، على النحو التالي:
- مقياس الطيف الضوئي الفارغ مع 1xBRB80 يفتقر إلى GTP.
- احسب تركيز التوبولين باستخدام معامل الانقراض المحدد البالغ 115000 M-1 cm-1 والصيغة التالية:
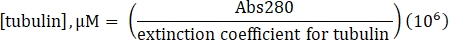
- أعد تعليق الليسين المجفف بالتجميد المصنوع تجاريا والذي يحمل علامة 488-توبولين إلى 10 ميكرومتر (1 ملغم / مل ؛ ملصق 100٪) مع 20 ميكرولتر من 1x BRB80 يفتقر إلى GTP.
- قم بإذابة 7.2 ميكرولتر من 100 ميكرومتر من التوبولين المعاد تدويره29 غير المسمى على الجليد.
ملاحظة: التوبولين المعاد تدويره أمر بالغ الأهمية لنجاح تجميع الأنابيب الدقيقة في المختبر لأنه يزيل الدايمرات غير الكفؤة للبلمرة التي تشكلت في مخزونات البروتين المجمدة29,30. - اجمع بين 3 ميكرولتر من 10 ميكرومتر 488-توبولين مع أليكوت 7.2 ميكرولتر من توبولين 100 ميكرومتر غير المسمى ، لا يزيد عن 15 دقيقة قبل الاستخدام.
- تحديد تركيز التوبولين محلي الصنع غير المسمى عن طريق قياس الطيف الضوئي عند Abs280 ، على النحو التالي:
- قم بإعداد محلول المخزون من الأكتين المسمى بالفلورسنت.
- بالنسبة للبروتينات محلية الصنع ، حدد تركيز الأكتين والنسبة المئوية للتسمية عبر قياس الطيف الضوئي Abs290 و Abs650 ، على النحو التالي:
- مقياس الطيف الضوئي الفارغ مع G-buffer.
- احسب تركيز الأكتين غير المسمى باستخدام معامل الانقراض المحدد البالغ 25,974 M-1 cm-1 والصيغة التالية:
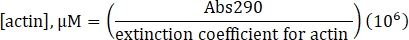
- احسب تركيز ليسين المسمى Alexa-647-actin باستخدام معامل الانقراض للأكتين غير المسمى ، وعامل تصحيح الفلور 0.03 ، والصيغة التالية:
[Alexa-647 actin]، μM = (Abs290 -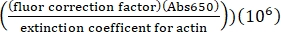
- احسب التسمية المئوية ل Alexa-647-actin باستخدام ε المحدد ل Alexa-647 البالغ 239000 M-1 cm-1 ، كما يلي:
٪ تسمية اليكسا-647-أكتين = (عبس290 - (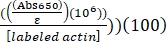
- إذابة واحد 2 ميكرولتر أليكوت من 3 ميكرومتر 100٪ المسمى البيوتين أكتين (المسمى على بقايا الليسين). تمييع 10 أضعاف عن طريق إضافة 18 ميكرولتر من G-buffer.
- الجمع بين 3 ميكرولتر من الأكتين البيوتينيل المخفف ، وكميات مناسبة من الأكتين غير المسمى والموسومة (أعلاه) بحيث يكون المزيج النهائي 12.5 ميكرومتر إجمالي الأكتين مع 10 ٪ -30 ٪ تسمية الفلورسنت.
ملاحظة: يمكن أن يؤدي أكثر من 30٪ من مونومرات الأكتين الفلورية (النهائية) إلى الإضرار بدقة التصوير حيث يصبح من الصعب تمييز الخيوط من الخلفية.
- بالنسبة للبروتينات محلية الصنع ، حدد تركيز الأكتين والنسبة المئوية للتسمية عبر قياس الطيف الضوئي Abs290 و Abs650 ، على النحو التالي:
- تحضير خلطات التفاعل (الشكل 1C).
- تحضير مزيج الهيكل الخلوي (الأنبوب A) عن طريق الجمع بين 2 ميكرولتر من مخزون مزيج الأكتين 12.5 ميكرومتر (6.2.3) مع مزيج مخزون توبولين (6.1.4) ، لا يزيد عن 15 دقيقة قبل التصوير. يحفظ على الثلج حتى الاستخدام.
- تحضير مزيج تفاعل البروتين (الأنبوب B) من خلال الجمع بين جميع المكونات والبروتينات التجريبية الأخرى ، بما في ذلك: 2x TIRF buffer ، ومضاد للتبييض ، والنيوكليوتيدات ، والمخازن المؤقتة ، والبروتينات الملحقة. ويرد مثال على ذلك في الشكل 1 جيم.
ملاحظة: ينتج عن التخفيف النهائي مخزن مؤقت TIRF 1x يحتوي على ATP و GTP والقوة الأيونية ضمن النطاق الفسيولوجي المقدر.
- احتضان الأنبوب A والأنبوب B بشكل منفصل عند 37 درجة مئوية لمدة 30-60 ثانية. لبدء التفاعل ، امزج وأضف محتويات الأنبوب B إلى الأنبوب A (أدناه).
7. صورة الأكتين وديناميكيات الأنابيب الدقيقة
- حالة التروية بشكل جيد (الشكل 1 ب ؛ الخطوة 4 ، أعلاه).
- ابدأ تجميع الأكتين والأنابيب الدقيقة في وقت واحد عن طريق إضافة محتويات الأنبوب B (مزيج التفاعل) إلى الأنبوب A (مزيج الهيكل الخلوي) (الشكل 1C).
- تدفق 50 ميكرولتر من التفاعل الذي يحتوي على مخزن مؤقت TIRF 1x مكمل ب 15 ميكرومتر توبولين حر ، و 1 mM GTP ، و 0.5 ميكرومتر من مونومرات الأكتين وأحجام مناسبة من عناصر التحكم في المخزن المؤقت.
- سجل فيلم الفاصل الزمني باستخدام برنامج المجهر للحصول على كل 5 ثوان لمدة 15-20 دقيقة.
ملاحظة: يحدث بدء ديناميكيات الأكتين والأنابيب الدقيقة في غضون 2-5 دقائق (الشكل 2). تشير التأخيرات الأطول إلى مشاكل في التحكم في درجة الحرارة أو مشاكل مرتبطة بتركيز البروتينات في مزيج التفاعل. - قم بتهيئة بئر تروية جديد (الخطوة 4) واستبدل حجم المخزن المؤقت بالبروتين (البروتينات) التنظيمية ذات الأهمية (أي Tau) وعناصر التحكم في المخزن المؤقت (الشكل 1C). الحصول على النحو المبين في الخطوة 7 (أعلاه) لتقييم البروتينات التنظيمية لوظائف الأكتين والأنابيب الدقيقة الناشئة.
8. معالجة وتحليل الصور باستخدام برنامج فيجي31
- افتح أفلام TIRF المحفوظة واعرضها كمركب.
- تحليل ديناميكيات الأنابيب الدقيقة (الشكل 3A) ، على النحو التالي:
- قم بإنشاء عرض Z أقصى يستند إلى الوقت من قائمة مكدسات الصور.
- مزامنة نافذة الإسقاط Z مع فيلم TIRF الأصلي من قائمة التحليل > الأدوات > مزامنة Windows .
- ارسم خطا باستخدام أداة الخط المستقيم على طول أنبوب دقيق ذي أهمية على الصورة المعروضة في الوقت المحدد.
- افتح مدير منطقة الاهتمام (ROI) من قائمة التحليل (تحليل> أدوات> إدارة عائد الاستثمار).
- احفظ مواقع الأنابيب الدقيقة الفردية عن طريق الضغط على "t". كرر لجميع الأنابيب الدقيقة ذات الاهتمام.
- ارسم kymographs للخطوط المحددة باستخدام "/" أو قم بتشغيل الماكرو متعدد kymo الذي يولد فيديو و kymograph لكل microtubule في مدير عائد الاستثمار31.
- أضف أشرطة مقياس الطول (ميكرومتر) والوقت (الحد الأدنى) إلى الكيموجراف من قائمة أشرطة القياس > أدوات التحليل> .
- قياس سرعات نمو الأنابيب الدقيقة من منحدرات الكيموغراف (الشكل 3A ، 1-2 ؛ منحدر الخطوط السوداء).
- عد أحداث الأنابيب الدقيقة الديناميكية (كارثة أو إعادة نمو) من الكيموجراف المتولد أو باستخدام وحدات ماكرو التحليل المتاحة5،8،18،25. تمثل الخطوط الحمراء المنقطة في الشكل 3 أ ، 1-2 أحداث الكوارث / التفكيك السريع.
- تحليل ديناميكيات الأكتين (الشكل 3B) ، على النحو التالي:
- قياس نواة الأكتين ، على النحو التالي:
- احسب عدد خيوط الأكتين الموجودة في مجال الرؤية 100 ثانية بعد بدء التفاعل وعبر عنها بالمنطقة (خيوط لكل ميكرومتر2).
- سجل البيانات واحفظها في مدير عائد الاستثمار، كما في الخطوة 8.2.3.1 أعلاه.
- قياس معدلات استطالة خيوط الأكتين (الشكل 3 باء)، على النحو التالي:
- ارسم خطا على طول خيوط أكتين ذات أهمية باستخدام أداة الخط المجزأ.
- أضف بندا إلى مدير عائد الاستثمار كما في الخطوة 8.2.3.1 أعلاه.
- كرر اتباع السطر (إضافة كل قياس إلى مدير عائد الاستثمار) لأربعة إطارات أفلام على الأقل.
ملاحظة: يوصى بقياس سبعة إلى ثمانية إطارات متتالية ، ولكن بعض الظروف تبطئ بلمرة الأكتين إلى ما دون الحد الذي يمكن اكتشافه والذي يمكن حله بواسطة إعدادات الهدف / المجهر. في مثل هذه الحالة ، يمكن إجراء القياسات على فترات منتظمة على إطارات غير متتالية ، (على سبيل المثال ، كل خمسة إطارات). - رسم قيم الطول المقاسة على مدى الوقت المنقضي. ميل الخط المتولد هو معدل استطالة الأكتين بالميكرون / ثانية.
- نقل المعدلات المحسوبة النهائية كوحدات فرعية s-1 μM-1 باستخدام عامل تصحيح قدره 370 وحدة فرعية لحساب عدد مونومرات الأكتين في ميكرون من الخيوط32.
- قياس نواة الأكتين ، على النحو التالي:
- قم بإجراء تحليل مرتبط لمناطق ارتباط الأكتين والأنابيب الدقيقة المتوازية (الشكل 3C) ، على النحو التالي:
- ارسم خطا على طول أنبوب دقيق ذي أهمية في نقطة زمنية محددة (أي 300 ثانية بعد بدء التفاعل) ، باستخدام أداة الخط المستقيم.
- أضف بندا إلى مدير عائد الاستثمار كما في الخطوة 8.2.3.1 أعلاه.
- ارسم كثافة التألق على طول الخط في كل قناة.
- حدد كل قناة باستخدام شريط تمرير الصورة وارسم الكثافات على طول الخط باستخدام "الأمر k".
- حفظ القيم أو تصديرها بالنقر فوق الزر "قائمة" في نافذة الإخراج.
- التعبير عن أحداث اقتران الأكتين والأنابيب الدقيقة كنسبة (الأكتين المتداخل مع الأنابيب الدقيقة) من الأحداث الفردية أو كعدد من الأحداث في مجال رؤية معين في نقطة زمنية متسقة (الشكل 3C).
- البديل: استخدم البرنامج لتحديد النسبة المئوية للتداخل بين القناتين 5,12.
- ارسم خطا على طول أنبوب دقيق ذي أهمية في نقطة زمنية محددة (أي 300 ثانية بعد بدء التفاعل) ، باستخدام أداة الخط المستقيم.
النتائج
مع الظروف الموضحة أعلاه (الشكل 1) ، يجب أن تكون بوليمرات الأكتين والأنابيب الدقيقة مرئية (وديناميكية) في غضون دقيقتين من الحصول على الصورة (الشكل 2). كما هو الحال مع أي بروتوكول قائم على الكيمياء الحيوية ، قد تكون هناك حاجة إلى التحسين للبروتينات التنظيمية المختلفة أو دفعات من البروتين. لهذه الأسباب ، يتم تعيين زاوية TIRF وتعرضات الصور أولا مع تفاعلات تحتوي على كل بوليمر فردي. هذا يؤكد أن البروتينات المخزنة وظيفية وأن هناك ما يكفي من البروتين المسمى للكشف. على الرغم من أنه ليس ضروريا دائما (ولا يتم تنفيذه هنا) ، إلا أنه يمكن استخدام المعالجة اللاحقة للأفلام (أي طرح الخلفية أو المتوسط أو تحويلات فورييه) لتحسين تباين الصورة (خاصة الأنابيب الدقيقة) 5،25،33. يدعم التصور المباشر لخيوط الأكتين المفردة والأنابيب الدقيقة التي يوفرها هذا الفحص التحديد الكمي لعدة مقاييس ديناميكية إما لمكون الهيكل الخلوي وحده أو معا ، بما في ذلك معلمات البلمرة (أي معدل النوى أو الاستطالة) ، ومعلمات التفكيك (أي معدلات الانكماش أو أحداث الكوارث) ، ومحاذاة / تداخل البوليمر (الشكل 3 ). علاوة على ذلك ، يمكن استخدام هذه التدابير كنقطة انطلاق لفك ارتباط أو تأثير الروابط التنظيمية مثل تاو (الشكل 3). يمكن إجراء العديد من القياسات لخيوط الأكتين المفردة أو الأنابيب الدقيقة من فيلم TIRF واحد. ومع ذلك ، نظرا للاختلافات في طلاء الغطاء ، والسحب ، وعوامل أخرى ، يجب أن تتضمن القياسات الموثوقة أيضا تفاعلات / أفلام متعددة للتكرار التقني.
يمكن تحديد العديد من جوانب ديناميكيات الأنابيب الدقيقة من أمثلة الكيموجراف بما في ذلك معدل استطالة الأنابيب الدقيقة ، وكذلك تواتر أحداث الكوارث والإنقاذ (الشكل 3A). إن استخدام الكيموغراف لقياس ديناميكيات الأكتين في هذا النظام ليس بهذه البساطة لأن خيوط الأكتين أكثر تعقيدا من الأنابيب الدقيقة. ونتيجة لذلك ، يتم قياس معلمات ديناميكيات خيوط الأكتين باليد ، وهو أمر يستغرق وقتا طويلا ويتطلب عمالة مكثفة. يتم قياس عدد النوى على أنه عدد خيوط الأكتين الموجودة في نقطة زمنية متسقة لجميع الظروف. تختلف هذه الأعداد على نطاق واسع عبر مجالات التصوير TIRF ، ولكن يمكن استخدامها مع العديد من النسخ المتماثلة أو لتكملة الملاحظات من اختبارات البلمرة الأخرى. يمكن أيضا استخدام تعداد النوى للأنابيب الدقيقة إذا كانت ظروف التجربة تفتقر إلى بذور الأنابيب الدقيقة المستقرة. يتم قياس معدلات استطالة خيوط الأكتين على أنها طول الخيوط بمرور الوقت من أربعة إطارات أفلام على الأقل. يتم نقل قيم المعدل لكل ميكرومولار أكتين مع عامل تصحيح قدره 370 وحدة فرعية لحساب عدد مونومرات الأكتين في ميكرون من خيوط (الشكل 3B)32. القياسات لتحديد السلوكيات المنسقة بين الأكتين والأنابيب الدقيقة أقل تحديدا. ومع ذلك ، تم تطبيق التحليلات المترابطة لقياس تزامن كل من البوليمرات بما في ذلك مسح الخطوط (الشكل 3C) أو البرامج المتداخلة5،11،34.
توافر البيانات:
وقد أودعت جميع مجموعات البيانات المرتبطة بهذا العمل في زينودو وهي متاحة بطلب معقول على العنوان التالي: 10.5281/zenodo.6368327.
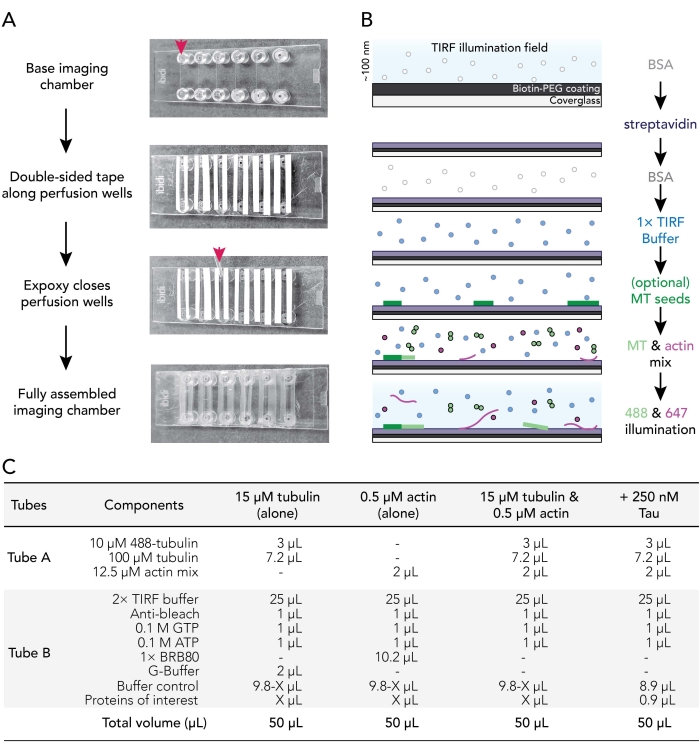
الشكل 1. المخططات التجريبية: تجميع غرفة التدفق للحصول على الصور. (أ) تجميع غرفة التصوير. من الأعلى إلى الأسفل: يتم تسجيل غرف التصوير IBIDI على طول آبار التروية (يشار إليها بالسهم) ؛ تتم إزالة الطبقة الثانية (البيضاء) من دعم الشريط (اليسار في الصورة الموضحة لتوجيه المستخدمين بشكل أفضل) ويتم تطبيق الإيبوكسي على حافة غرفة التروية (السهم). ملاحظة: لتوجيه المستخدمين بسهولة أكبر إلى مكان وضع الإيبوكسي، تم ترك الدعم الأبيض قيد التشغيل في هذه الصورة. يتم توصيل الغطاء النظيف والمطلي بغرفة التصوير مع جانب الطلاء المواجه للداخل من بئر التروية. (ب) مخطط انسيابي يوضح خطوات تكييف غرف التصوير للروابط بين البيوتين والستربتافيدين. (ج) أمثلة على التفاعلات المستخدمة للحصول على أفلام TIRF من الأنابيب الدقيقة الديناميكية وخيوط الأكتين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
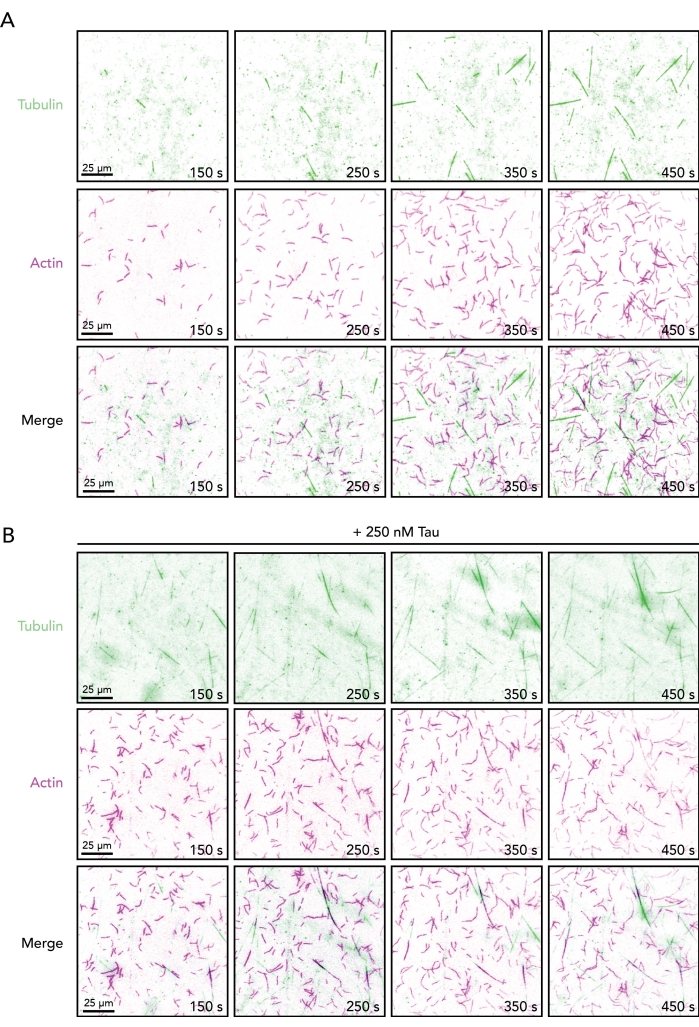
الشكل 2. تسلسل الصور لخيوط الأكتين المتنامية والأنابيب الدقيقة في غياب أو وجود تاو. مونتاج صور الفاصل الزمني من مقايسات TIRF التي تحتوي على 0.5 ميكرومتر من الأكتين (10٪ Alexa-647-actin و 0.09٪ البيوتين-أكتين الموسوم) و 15 ميكرومتر من التوبولين الحر (4٪ HiLyte-488 الموسوم) في غياب (A) أو وجود (B) من 250 نانومتر تاو. يظهر الوقت المنقضي من بدء التفاعل (خلط الأنبوب A والأنبوب B). أشرطة المقياس ، 25 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
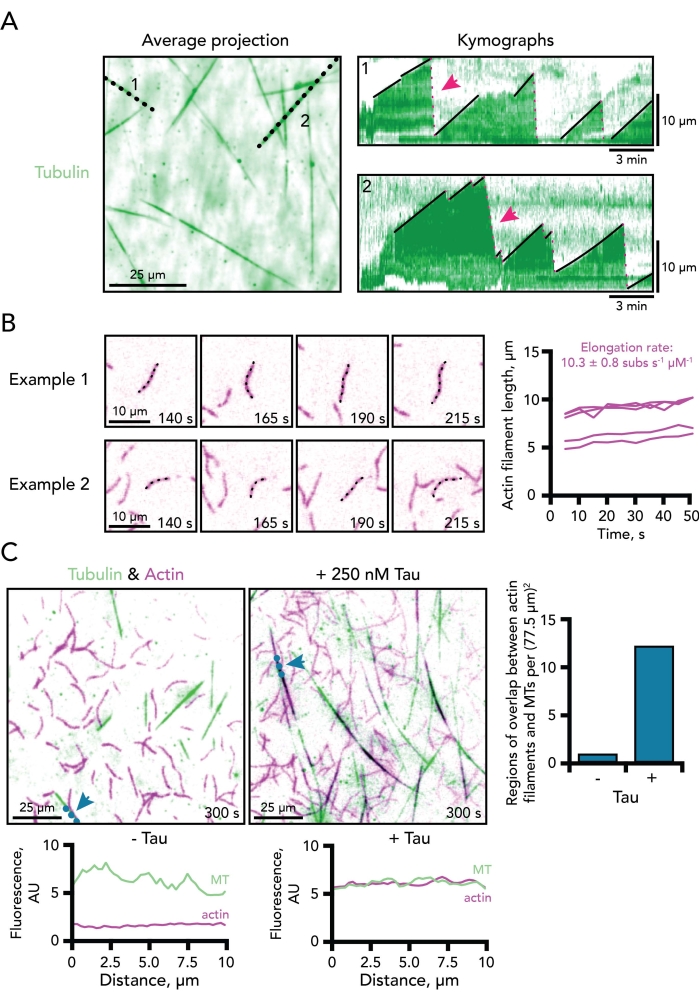
الشكل 3. مثال على قياسات الأنابيب الدقيقة وديناميكيات خيوط الأكتين. (أ) متوسط الإسقاط الزمني لقناة توبولين يصور بكفاءة إجمالي أطوال الأنابيب الدقيقة لمسح الخط المستخدم لإنشاء مخططات كيموجراف. تتوافق الخطوط السوداء المنقطة مع مثالين من الكيموغراف للأنابيب الدقيقة الديناميكية الموضحة على اليمين. يظهر النمو (الخطوط السوداء الصلبة) ومراحل التفكيك (الخطوط الوردية المنقطة ؛ اثنان يشار إليهما بأسهم وردية) للأنابيب الدقيقة على كل كيموجراف. شريط مقياس الوقت، 3 دقائق. شريط مقياس الطول ، 10 ميكرومتر. يحتوي التفاعل على 0.5 ميكرومتر من الأكتين (10٪ 647-label) و 15 ميكرومتر من التوبولين الحر (4٪ 488-HiLyte label). يتم عرض قناة tubulin فقط. (ب) مثالان على مونتاج الصور بفواصل زمنية يصوران خيوط أحادية الفعل تتبلمر بنشاط. يتم حساب معدلات الاستطالة على أنها ميل قطع الأراضي لطول خيوط الأكتين بمرور الوقت لكل أكتين ميكرومولار. وبالتالي ، يجب تطبيق عامل تصحيح من اثنين على تفاعلات الأكتين 0.5 ميكرومتر للمقارنة بين المعدلات التي تحدد عادة عند تركيز الأكتين 1 ميكرومتر. تظهر أمثلة من خمسة خيوط على اليمين. أشرطة المقياس ، 10 ميكرومتر. يحتوي التفاعل على 0.5 ميكرومتر من الأكتين (10٪ 647-label) و 15 ميكرومتر من التوبولين الحر (4٪ 488-HiLyte label). يتم عرض قناة أكتين فقط. (ج) صور TIRF للأنابيب الدقيقة الديناميكية (MT) (الخضراء) وخيوط الأكتين (الأرجواني) التي تتبلمر في غياب (يسار) أو وجود 250 نانومتر تاو (في الوسط). الخطوط الزرقاء المنقطة والأسهم تشير إلى المكان الذي تم فيه رسم خط لمخططات مسح الخط المقابلة لكل شرط (أسفل كل صورة). يمكن تسجيل التداخل بين الأنابيب الدقيقة ومناطق الأكتين (الموضحة باللون الأسود) في نقطة زمنية محددة لكل منطقة (يمين). قضبان المقياس ، 25 ميكرومتر. تحتوي التفاعلات على 0.5 ميكرومتر من الأكتين (10٪ 647-label) و 15 ميكرومتر من التوبولين الحر (4٪ 488-HiLyte label) مع أو بدون 250 نانومتر تاو. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
كان استخدام المجهر الفلوري للانعكاس الداخلي الكلي (TIRF) للبروتينات النقية المرئية نهجا مثمرا ومقنعا لتشريح الآليات الفريدة لتنظيم الهيكل الخلوي5،23،24،25،26،27،35. بالمقارنة مع المقايسات الكيميائية الحيوية التقليدية ، تتطلب تفاعلات TIRF كميات صغيرة جدا (50-100 ميكرولتر) ، ويمكن الحصول على قياسات كمية لديناميكيات الهيكل الخلوي من فحص فردي. تركز معظم دراسات ديناميكيات الهيكل الخلوي على نظام بوليمر واحد (أي خيوط الأكتين أو الأنابيب الدقيقة) ، وبالتالي ظلت القياسات التفصيلية للحديث المتبادل أو السلوكيات الناشئة بين خيوط الأكتين والأنابيب الدقيقة التي تظهر عادة في الخلايا بعيدة المنال ويصعب تلخيصها في أنبوب الاختبار. لحل هذه المشكلة ، يصف هذا البروتوكول نظام الفحص المجهري TIRF أحادي الخيط الذي يتيح التصور المباشر للأكتين الديناميكي وبوليمرات الأنابيب الدقيقة في نفس التفاعل الكيميائي الحيوي. وبالتالي ، فإن هذه الطريقة تتجاوز الفحوصات التقليدية التي تلخص السلوك الديناميكي لخيوط الأكتين أو الأنابيب الدقيقة وحدها. تم تنفيذ هذه التقنية أيضا مع تاو كمثال على كيفية تغير العديد من الخصائص الديناميكية في وجود عامل اقتران الهيكل الخلوي. يمكن استخدام هذا البروتوكول مع بروتينات إضافية معروفة أو يشتبه في أنها تنسق ديناميكيات الأكتين أو الأنابيب الدقيقة ، بما في ذلك (على سبيل المثال لا الحصر) MACF و GAS و formins والمزيد. وأخيرا، يمكن استخدام التحليلات المقدمة كدليل لتحديد كمية البيانات التي تم الحصول عليها باستخدام هذا البروتوكول.
"الرؤية هي الإيمان" هو سبب مقنع لإجراء الفحوصات القائمة على الفحص المجهري. ومع ذلك ، يلزم توخي الحذر في تنفيذ وتفسير تجارب الفحص المجهري TIRF. أحد التحديات الرئيسية لاختبارات التجميع المشترك للهيكل الخلوي هو أن العديد من ظروف التصوير الشائعة الاستخدام غير متوافقة مع كل بوليمر. عادة ما يكون للأنابيب الدقيقة والأكتين متطلبات مختلفة للعازل ودرجة الحرارة والملح والنيوكليوتيد والتركيز للبلمرة. الأكتين ، التوبولين ، البروتينات التنظيمية ذات الأهمية ، والمخازن المؤقتة المستخدمة في هذا البروتوكول حساسة لدورات التجميد والذوبان. لذلك ، من الضروري التعامل الدقيق مع البروتينات والمخازن المؤقتة لتنفيذ هذا البروتوكول بنجاح. للتخفيف من العديد من هذه المخاوف ، يوصى بشدة باستخدام توبولين معاد تدويره حديثا (مجمد لمدة <6 أسابيع) ، وإزالة الأكتينات المجمدة / المعاد تعليقها مسبقا عن طريق الطرد المركزي الفائق. تنطبق هذه الاعتبارات أيضا على عدد لا يحصى من البروتينات التنظيمية التي سيتم تقييمها باستخدام هذا الإجراء ، والتي قد تكون حساسة لدورات التجميد والذوبان أو تركيز الأملاح العازلة 5,11,36.
لسوء الحظ ، لا يوجد مخزن مؤقت واحد يناسب الجميع دون مقايضات تجريبية. لتخصيص المزيد من الحجم للبروتينات ذات التركيز المنخفض ، يمكن تضمين ATP و GTP في محلول المخزن المؤقت 2x TIRF (الشكل 1C). ومع ذلك ، نظرا لأن هذه النيوكليوتيدات حساسة للغاية لدورات التجميد والذوبان ، فلا ينصح بذلك. مركبات كسح الأكسجين المستخدمة هنا (أي الكاتالاز والجلوكوز أوكسيديز) ضرورية لتصور البروتينات لفترات طويلة من الزمن (دقائق إلى ساعات) ، ولكن من المعروف أنها تقيد بلمرة الأنابيب الدقيقة بتركيزات عالية5. فيما يتعلق بهذه الاعتبارات العازلة ، فإن أحد قيود هذا البروتوكول هو أن بعض البروتينات التنظيمية الأساسية المرتبطة بالأنابيب الدقيقة قد تتطلب ملحا أكثر أو أقل لتلخيص الوظائف الموجودة في الخلايا أو المقايسات باستخدام الأنابيب الدقيقة وحدها (بدون الأكتين). ومن المرجح أن يؤثر تغيير طبيعة الملح أو تركيزه لمعالجة هذه الشواغل على معدلات بلمرة خيوط الأكتين و/أو بارامترات ديناميات الأنابيب الدقيقة. مطلوب قياسات المعلمات الوصفية المتعددة (الحد الأدنى ، النوى ، معدلات الاستطالة ، والاستقرار) (الشكل 3) لتأكيد نجاح البروتوكول أو لتوثيق آثار المخازن المؤقتة المحددة أو البروتينات التنظيمية صراحة. على سبيل المثال ، يمكن أن يؤدي الكثير من بلمرة خيوط الأكتين إلى حجب أحداث اقتران الأكتين والأنابيب الدقيقة في غضون ثوان. وبالتالي ، فإن ضبط الظروف التجريبية عن طريق خفض التركيز الكلي للأكتين أو تضمين بروتينات إضافية لقمع نواة الأكتين (أي البروفيلين) سيمدد الفترة الإجمالية التي يمكن فيها رؤية أنشطة الأكتين - الأنابيب الدقيقة المنسقة بوضوح. تعد عناصر التحكم التي تتناول هذه المتطلبات الأساسية ، والتكرارات التقنية (خارج مجالات الرؤية المتعددة) ، أمرا بالغ الأهمية للمستخدمين لإنشاء نتائج موثوقة وقابلة للتكرار.
توفر الدراسات القائمة على الخلايا فرصة محدودة لمراقبة العلاقات المباشرة بين البروتين والبروتين أو عمل المجمعات التنظيمية. في المقابل ، فإن بعض الآليات المستقاة من الفحوصات المخبرية لا تعكس دائما السلوكيات الدقيقة للبروتينات التي شوهدت في الخلايا. يمكن معالجة هذه المعضلة الكلاسيكية في الكيمياء الحيوية في التطبيقات المستقبلية لهذه التقنية مع تعديلات محددة. على سبيل المثال ، تؤدي إضافة بروتينات اقتران وظيفية تحمل علامات الفلورسنت إلى توسيع هذه الطريقة من دراسات الخيوط المفردة إلى دراسات الجزيء الواحد. يمكن تعديل المقايسات بشكل أكبر لاستخدام مستخلصات الخلايا التي قد تضيف العوامل الرئيسية غير المعروفة "المفقودة" المطلوبة لتلخيص الظواهر الشبيهة بالخلايا. على سبيل المثال ، أعادت الفحوصات المستندة إلى TIRF باستخدام مستخلصات الخميرة أو Xenopus تشكيل حلقات الأكتوميوزين الانقباضية37 ، والمغزل الانقسامي 26,38 ، ومكونات تجميع الأكتين أو الأنابيب الدقيقة 39,40 ، وحتى الديناميكيات في السنتروسوم و kinetochores 36,41,42,43 . علاوة على ذلك ، قد تمهد هذه الأنظمة الطريق نحو أنظمة الخلايا الاصطناعية التي تحتوي على دهون أو عوامل إشارات موجودة44،45،46.
Disclosures
لا يوجد تضارب في المصالح للإفصاح عنه.
Acknowledgements
أنا ممتن لمارك ريديلا (إصلاح التقنيات الحيوية) وبراين هارر (جامعة ولاية نيويورك أبستيت) لتعليقاتهم المفيدة على هذا البروتوكول. تم دعم هذا العمل من قبل المعاهد الوطنية للصحة (GM133485).
Materials
| Name | Company | Catalog Number | Comments |
| 1% BSA (w/v) | Fisher Scientific | BP1600-100 | For this purpose (blocking TIRF chambers), BSA is resuspended in ddH20 and filtered through a 0.22 µm filter. |
| 1× BRB80 | Homemade | 80 mM PIPES, 1 mM MgCl2, 1 mM EGTA, pH 6.8 with KOH | |
| 10 mg/mL (1000 U) glucose oxidase | Sigma Aldrich Inc, St. Louis, MO | G2133-50KU | Combined with catalase, aliquot and store at -80 oC until use |
| 100 µM tubulin | Cytoskeleton Inc, Denver, CO | T240 | Homemade tubulins should be recycled before use to remove polymerization-incompetent tubulin (Hyman et al. (1992)29; Li and Moore (2020)30). Commercially available tubulins are often too dilute to recycle, but function well if resuspended according to manufacturer’s instructions and pre-cleared via ultracentrifugation (278,000 × g) for 60 min, before use. |
| 100 mM ATP | Gold Biotechnology Inc, Olivette, MO | A-081 | Resuspended in ddH20 (pH 7.5) and filter sterilized. |
| 100 mM GTP | Fisher Scientific | AC226250010 | Resuspended in 1× BRB80 (pH 6.8) and filter sterilized. |
| 120-150 mW solid-state lasers | Leica Microsystems | 11889151; 11889148 | |
| 2 mg/mL catalase | Sigma Aldrich Inc, St. Louis, MO | C40-100 | Combined with glucose oxidase, aliquot and store at -80 oC until use |
| 2× TIRF buffer | Homemade | 2× BRB80, 100 mM KCl, 20 mM DTT, 80 mM glucose, 0.5% (v/v) methylcellulose (4,000 cp); Note: 1 µL of 0.1M GTP and 1 µL of 0.1M ATP added separately to TIRF reactions to avoid repeated freeze-thaw cycles. | |
| 24 × 60 mm, #1.5 coverglass | Fisher Scientific, Waltham, MA | 22-266882 | Coverglass must be extensively washed before use (Smith et al. (2014)22) |
| 37 oC heatblock | |||
| 37 oC water bath | |||
| 5 mg/mL Streptavidin (600x stock) | Avantor, Philadelphia, PA | RLS000-01 | Resuspended in Tris-HCl (pH 8.8); dilute the aliquot to 1× in HEK buffer on day of use |
| 5 min Epoxy resin and hardener | Loctite, Rocky Hill, CT | 1365736 | Combined resin and hardener may take up to 30 min to cure. |
| 50% biotinylated-GpCpp microtubule seeds | Cytoskeleton Inc; Homemade | T333P | (optional) GppCpp or Taxol stabilized microtubule seeds can more efficiently mediate microtubule polymerization. Taxol and GppCpp stabilize microtubules in different ways that can affect the microtubule lattice structure and ability of certain regulatory proteins to bind to the stabilized portion of the microtubule. A method to make diverse kinds of microtubule seeds is outlined in Hyman et al. (1992). |
| 70 oC incubator | |||
| Actin mix stock | Homemade; this protocol | A 12.5 µM actin mix comprised of labeled (fluorescent and biotinylated) and unlabeled actin for up to six reactions. 2 µL of stock is used in the final TIRF reaction. The final concentration of actin used in each reaction is 0.5 µM (10% Alexa-647; 0.09% biotin-labeled). | |
| Appropriate buffer controls | Homemade | Combination of buffers from all proteins being assessed | |
| Biotin-PEG-silane (MW 3,400) | Laysan Bio Inc | biotin-PEG-SIL-3400 | Dispensed into 2-5 mg aliquots, backfilled with nitrogen, parafilmed closed, and stored at -20 oC with desiccant until use |
| Biotinylated actin | Cytoskeleton Inc; Homemade | AB07 | Biotin-actin is made by labeling on lysine residues and thus assumed to be at least 100% labeled, but varies with different lots/preparations. Optimal biotinylated actin concentrations must be empirically determined for particular uses/experimental designs. Higher concentrations permit more efficient tracking, but may impede polymerization or interactions with regulatory proteins. Here a small percentage (0.09% or 900 pM) biotinylated actin is present in the final TIRF reaction. |
| Dishsoap | Dawn, Procter and Gamble, Cincinnati, OH | For unknown reasons, the blue version cleans coverslips more efficiently than other available colors. | |
| Dry ice | |||
| FIJI Software | www.https://imagej.net/software/fiji/downloads | Schneider et al. (2012)31. | |
| Fluorescently labeled actin | Cytoskeleton Inc; Homemade | AR05 | Homemade fluorescently labeled actin is stored in G-buffer supplemented with 50% glycerol at -20 oC (Spudich et al. (1971)47; Liu et al. (2022)48). Fluorescently labeled actin is dialyzed against G-buffer and precleared via ultracentrifugation for 60 min at 278,000 × g before use. |
| Fluorescently labeled tubulin | Cytoskeleton Inc | TL488M, TLA590M, TL670M | Resuspended in 20 µL 1× BRB80 (10 µM final concentration) and pre-cleared via ultracentrifugation (278,000 × g) for 60 min, before use. |
| G-buffer | Homemade | 3 mM Tris-HCl (pH 8.0), 0.2 mM CaCl2, 0.5 mM DTT, 0.2 mM ATP | |
| HEK Buffer | Homemade | 20 mM HEPES (pH 7.5), 1 mM EDTA (pH 8.0), 50 mM KCl | |
| Ice | |||
| Ice bucket | |||
| Imaging chambers | IBIDI, Fitchburg, WI | 80666 | Order chambers with no bottom to utilize different coverslip coatings |
| iXon Life 897 EMCCD camera | Andor, Belfast, Northern Ireland | 8114137 | |
| LASX Premium microscope software | Leica Microsystems | 11640611 | |
| Methylcellulose (4,000 cp) | Sigma Aldrich Inc | M0512 | |
| Microscope base equipped with TIRF module | Leica Microsystems, Wetzlar, Germany | 11889146 | |
| mPEG-silane (MW 2,000) | Laysan Bio Inc, Arab, AL | mPEG-SIL-2000 | Dispensed into 10-15 mg aliquots, backfilled with nitrogen, parafilmed closed, and stored at -20 oC with desiccant until use |
| Objective heater and heated stage insert | OKO labs, Pozzioli, Italy | 8113569 | Set temperature controls to 35-37 oC. Use manufacturer suggestions for accurate calibration. |
| Perfusion pump | Harvard Apparatus, Holliston, MA | 704504 | A syringe and tubing can be substituted. |
| Petri Dish, 100 x 15 mm | Genesee Scientific, San Diego, CA | 32-107 | |
| Plastic slide mailer container | Fisher Scientific | HS15986 | |
| SA-S-1L-SecureSeal 0.12 mm thick | Grace Biolabs, Bend, OR | 620001 | Double-sided tape of precise manufactured dimensions is strongly recommended. |
| Small styrofoam container | Abcam, Cambridge, UK | Reused from shipping | |
| Small weigh boat | Fisher Scientific | 02-202-100 | |
| Spectrophotometer | |||
| Tau | Cytoskeleton Inc | TA01 | Three isoforms of Tau are present in the commercially available preparation of Tau. The concentration in this protocol was determined from the highest molecular weight band (14.3 µM, when resuspended per manufacturer’s recommendations with 50 µL of ddH20). |
| Temperature corrected 63× Plan Apo 1.47 N.A. oil immersion TIRF objective | Leica Microsystems | 11506319 | |
| Tubulin stock | Homemade; this protocol | A tubulin stock consisting of 7.2 µL recycled 100 µM unlabeled tubulin and 3 µL of 10 µM resuspended commercially available fluorescently labeled tubulin. One tubulin stock is used per reaction and thawed/stored on ice. The final concentration of free tubulin in each reaction is 15 µM (4% labeled). More than 15 µM tubulin will result in hyperstabilized (not dynamic) microtubules, whereas concentrations below 7.5 µM free tubulin do not polymerize well. Careful determination of protein concentration and handling is required. | |
| Unlabeled actin (dark) | Cytoskeleton Inc; Homemade | AKL99 | Actin nucleates are almost always present in commercially available (lyophilized) or frozen actins and contribute to variability in quantitative measurements (Spudich et al. (1971)47; Liu et al. (2022)48). Rabbit muscle actin is stored in G-buffer at -80 oC and precleared via ultracentrifugation for 60 min at 278,000 × g before use. Several actin stock solutions are made throughout the day (making no more than enough for six reactions at a time is strongly recommended). |
References
- Pimm, M. L., Henty-Ridilla, J. L. New twists in actin-microtubule interactions. Molecular Biology of the Cell. 32 (3), 211-217 (2021).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nature Reviews. Molecular Cell Biology. 20 (1), 38-54 (2019).
- Etienne-Manneville, S. Actin and microtubules in cell motility: which one is in control. Traffic. 5 (7), 470-477 (2004).
- Rodriguez, O. C., et al. Conserved microtubule-actin interactions in cell movement and morphogenesis. Nature Cell Biology. 5 (7), 599-609 (2003).
- Prezel, E., et al. TIRF assays for real-time observation of microtubules and actin coassembly: Deciphering tau effects on microtubule/actin interplay. Methods in Cell Biology. 141, 199-214 (2017).
- Griffith, L. M., Pollard, T. D. The interaction of actin filaments with microtubules and microtubule-associated proteins. The Journal of Biological Chemistry. 257 (15), 9143-9151 (1982).
- Henty-Ridilla, J. L., Rankova, A., Eskin, J. A., Kenny, K., Goode, B. L. Accelerated actin filament polymerization from microtubule plus ends. Science. 352 (6288), 1004 (2016).
- Elie, A., et al. Tau co-organizes dynamic microtubule and actin networks. Scientific Reports. 5 (1), 1-10 (2015).
- Preciado López, M., et al. Actin-microtubule coordination at growing microtubule ends. Nature Communications. 5 (1), 1-9 (2014).
- Oberhofer, A., et al. Molecular underpinnings of cytoskeletal cross-talk. Proceedings of the National Academy of Sciences of the United States of America. 117 (8), 3944-3952 (2020).
- Nakos, K., et al. Septins mediate a microtubule-actin crosstalk that enables actin growth on microtubules. bioRxiv. , (2022).
- Kučera, O., Gaillard, J., Guérin, C., Théry, M., Blanchoin, L. Actin-microtubule dynamic composite forms responsive active matter with memory. bioRxiv. , (2022).
- Kundu, T., Dutta, P., Nagar, D., Maiti, S., Ghose, A. Coupling of dynamic microtubules to F-actin by Fmn2 regulates chemotaxis of neuronal growth cones. Journal of Cell Science. 134 (13), 252916 (2021).
- Roth-Johnson, E. A., Vizcarra, C. L., Bois, J. S., Quinlan, M. E. Interaction between microtubules and the Drosophila formin Cappuccino and its effect on actin assembly. The Journal of Biological Chemistry. 289 (7), 4395-4404 (2014).
- Gaillard, J., et al. Differential interactions of the formins INF2, mDia1, and mDia2 with microtubules. Molecular Biology of the Cell. 22 (23), 4575-4587 (2011).
- Bartolini, F., et al. The formin mDia2 stabilizes microtubules independently of its actin nucleation activity. The Journal of Cell Biology. 181 (3), 523-536 (2008).
- Sider, J. R., et al. Direct observation of microtubule-F-actin interaction in cell free lysates. Journal of Cell Science. 112 (12), 1947-1956 (1999).
- Alkemade, C., et al. Cross-linkers at growing microtubule ends generate forces that drive actin transport. Proceedings of the National Academy of Sciences of the United States of America. 119 (11), 2112799119 (2022).
- Axelrod, D. Total internal reflection fluorescence microscopy in cell biology. Methods in Enzymology. 361, 1-33 (2003).
- Amann, K. J., Pollard, T. D. Direct real-time observation of actin filament branching mediated by Arp2/3 complex using total internal reflection fluorescence microscopy. Proceedings of the National Academy of Sciences of the United States of America. 98 (26), 15009-15013 (2001).
- Al-Bassam, J. Reconstituting dynamic microtubule polymerization regulation by TOG domain proteins. Methods in Enzymology. 540, 131-148 (2014).
- Smith, B. A., Gelles, J., Goode, B. L. Single-molecule studies of actin assembly and disassembly factors. Methods in Enzymology. 540, 95-117 (2014).
- Wioland, H., Jégou, A., Romet-Lemonne, G. Celebrating 20 years of live single-actin-filament studies with five golden rules. Proceedings of the National Academy of Sciences of the United States of America. 119 (3), 2109506119 (2022).
- Ganzinger, K. A., Schwille, P. More from less - bottom-up reconstitution of cell biology. Journal of Cell Science. 132 (4), (2019).
- Mahamdeh, M., Howard, J. Implementation of interference reflection microscopy for label-free, high-speed imaging of microtubules. Journal of Visualized Experiments. (150), e59520 (2019).
- King, M. R., Petry, S. Phase separation of TPX2 enhances and spatially coordinates microtubule nucleation. Nature Communications. 11 (1), 270 (2020).
- Ramirez-Rios, S., et al. A TIRF microscopy assay to decode how tau regulates EB's tracking at microtubule ends. Methods in Cell Biology. 141, 179-197 (2017).
- Smith, B. A., et al. Three-color single molecule imaging shows WASP detachment from Arp2/3 complex triggers actin filament branch formation. eLife. 2, 01008 (2013).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: information from a slowly hydrolyzable analogue GMPCPP. Molecular Biology of the Cell. 3 (10), 1155-1167 (1992).
- Li, G., Moore, J. K. Microtubule dynamics at low temperature: evidence that tubulin recycling limits assembly. Molecular Biology of the Cell. 31 (11), 1154-1166 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Pollard, T. D., Blanchoin, L., Mullins, R. D. Molecular mechanisms controlling actin filament dynamics in nonmuscle cells. Annual Review of Biophysics and Biomolecular Structure. 29, 545-576 (2000).
- Kapoor, V., Hirst, W. G., Hentschel, C., Preibisch, S., Reber, S. MTrack: Automated detection, tracking, and analysis of dynamic microtubules. Scientific Reports. 9 (1), 3794 (2019).
- Willige, D., et al. Cytolinker Gas2L1 regulates axon morphology through microtubule-modulated actin stabilization. EMBO reports. 20 (11), (2019).
- Hirst, W. G., Kiefer, C., Abdosamadi, M. K., Schäffer, E., Reber, S. In vitro reconstitution and imaging of microtubule dynamics by fluorescence and label-free microscopy. STAR Protocols. 1 (3), 100177 (2020).
- Farina, F., et al. The centrosome is an actin-organizing centre. Nature Cell Biology. 18 (1), 65-75 (2016).
- Mishra, M., et al. In vitro contraction of cytokinetic ring depends on myosin II but not on actin dynamics. Nature Cell Biology. 15 (7), 853-859 (2013).
- Groen, A. C., Ngyuen, P. A., Field, C. M., Ishihara, K., Mitchison, T. J. Glycogen-supplemented mitotic cytosol for analyzing Xenopus egg microtubule organization. Methods in Enzymology. 540, 417-433 (2014).
- Pollard, L. W., Garabedian, M. V., Alioto, S. L., Shekhar, S., Goode, B. L. Genetically inspired in vitro reconstitution of Saccharomyces cerevisiae actin cables from seven purified proteins. Molecular Biology of the Cell. 31 (5), 335-347 (2020).
- Bergman, Z. J., Wong, J., Drubin, D. G., Barnes, G. Microtubule dynamics regulation reconstituted in budding yeast lysates. Journal of Cell Science. 132 (4), 219386 (2018).
- Inoue, D., et al. Actin filaments regulate microtubule growth at the centrosome. The EMBO Journal. 38 (11), (2019).
- Colin, A., Singaravelu, P., Théry, M., Blanchoin, L., Gueroui, Z. Actin-network architecture regulates microtubule dynamics. Current Biology. 28 (16), 2647-2656 (2018).
- Torvi, J. R., et al. Reconstitution of kinetochore and microtubule dynamics reveals a role for a kinesin-8 in establishing end-on attachments. bioRxiv. , (2022).
- Nguyen, P. A., et al. Spatial organization of cytokinesis signaling reconstituted in a cell-free system. Science. 346 (6206), 244-247 (2014).
- Abu Shah, E., Keren, K. Symmetry breaking in reconstituted actin cortices. eLife. 3, 01433 (2014).
- Vendel, K. J. A., Alkemade, C., Andrea, N., Koenderink, G. H., Dogterom, M. In vitro reconstitution of dynamic co-organization of microtubules and actin filaments in emulsion droplets. Cytoskeleton Dynamics. 2101, 53-75 (2020).
- Spudich, J. A., Watt, S. The regulation of rabbit skeletal muscle contraction. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. The Journal of Biological Chemistry. 246 (15), 4866-4871 (1971).
- Liu, X., Pimm, M. L., Haarer, B., Brawner, A. T., Henty-Ridilla, J. L. Biochemical characterization of actin assembly mechanisms with ALS-associated profilin variants. European Journal of Cell Biology. 101 (2), 151212 (2022).
- Pimm, M. L., Liu, X., Tuli, F., Lojko, A., Henty-Ridilla, J. L. Visualizing functional human profilin in cells and in vitro applications. bioRxiv. , (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved