Method Article
액틴과 미세소관 커플링 다이내믹스 를 총 내부 반사 형광(TIRF) 현미경으로 시각화
요약
이 프로토콜은 시험관내 총 내부 형광 (TIRF) 현미경 분석을 사용하여 동적 액틴 및 미세 소관을 시각화하기위한 가이드입니다.
초록
전통적으로, 액틴 및 미세소관 세포골격은 별개의 독립체로서 연구되어 왔으며, 특정 세포 영역 또는 과정으로 제한되고, 각 중합체에 대해 고유한 결합 단백질의 상이한 스위트에 의해 조절된다. 많은 연구들은 이제 두 세포골격 중합체의 역학이 서로 얽혀 있으며, 이 누화는 대부분의 세포 행동에 필요하다는 것을 보여준다. 액틴-미세소관 상호작용에 관여하는 다수의 단백질(즉, 타우, MACF, GAS, 포르민 등)이 이미 확인되었으며, 액틴 또는 미세소관 단독과 관련하여 잘 특성화되어 있다. 그러나, 상대적으로 몇몇 연구는 두 중합체의 동적 버전과의 액틴-미세소관 조정의 검정을 보여주었다. 이것은 액틴과 미세 소관 사이의 창발적 연결 메커니즘을 막을 수 있습니다. 여기서, 전체 내부 반사 형광 (TIRF) 현미경-기반 시험관내 재구성 기술은 하나의 생화학적 반응으로부터 액틴 및 미세소관 역학 둘 다의 가시화를 허용한다. 이 기술은 액틴 필라멘트 또는 미세 소관의 중합 역학을 개별적으로 또는 다른 중합체의 존재하에 보존합니다. 상업적으로 입수가능한 타우 단백질은 고전적인 시토골격 가교 단백질의 존재하에서 액틴-미세소관 거동이 어떻게 변하는지를 입증하는데 사용된다. 이 방법은 개별 조절 단백질이 단일 필라멘트 또는 고차 복합체의 분해능에서 액틴-미세소관 역학을 어떻게 조정하는지에 대한 신뢰할 수 있는 기능적 및 기계론적 통찰력을 제공할 수 있다.
서문
역사적으로, 액틴과 미세소관은 각각 그들 자신의 조절 단백질, 역학 행동 및 뚜렷한 세포 위치를 가진 별개의 실체로 간주되어 왔다. 풍부한 증거는 이제 액틴 및 미세 소관 중합체가 이동, 유사분열 스핀들 위치, 세포 내 수송 및 세포 형태학 1,2,3,4를 포함한 수많은 세포 과정을 실행하는 데 필수적인 기능적 누화 메커니즘에 관여한다는 것을 보여줍니다. 이러한 예의 기초가되는 다양한 조정 된 행동은 결합 요인, 신호 및 물리적 특성의 복잡한 균형에 달려 있습니다. 그러나 이러한 메커니즘을 뒷받침하는 분자 세부 사항은 대부분의 연구가 한 번에 단일 세포 골격 중합체에 초점을 맞추기 때문에 여전히 크게 알려지지 않았습니다 1,2,5.
액틴과 미세소관은 6,7,8과 직접 상호작용하지 않는다. 세포에서 볼 수있는 액틴과 미세 소관의 조정 된 역학은 추가 요인에 의해 매개됩니다. 액틴-미세소관 누화를 조절하는 것으로 생각되는 많은 단백질들이 확인되었으며, 이들의 활성은 세포골격 중합체 단독 1,2와 관련하여 잘 특성화되어 있다. 이러한 단일 폴리머 접근법이 액틴-미세소관 결합 사건 7,8,9,10,11,12,13을 가능하게 하는 일부 단백질/복합체의 이중 기능을 은폐했다는 증거가 늘어나고 있다. 두 중합체가 모두 존재하는 실험은 드물며 종종 단일 동적 중합체 및 다른 6,8,9,10,11,14,15,16,17,18의 정적 안정화 된 버전으로 메커니즘을 정의합니다. . 따라서, 두 동적 중합체를 모두 사용하는 실험 시스템에서만 완전히 이해될 수 있는 액틴-미세소관 조정 단백질의 창발적 특성을 조사하기 위한 방법이 필요하다.
직접 단백질 표지 접근법, 유전적으로 인코딩된 친화성 태그 및 총 내부 반사 형광(TIRF) 현미경의 조합은 생체모방 재구성 시스템 19,20,21,22,23에서 큰 성공을 거두어 적용되었다. 많은 상향식 체계는 세포의 단백질을 조절하는 모든 인자를 포함하지 않습니다. 그러나 "커버 글래스 상의 생화학"기술은 폴리머 조립 또는 분해에 필요한 구성 요소와 모터 단백질 이동 5,12,23,24,25,26,27을 포함하여 높은 공간 및 시간적 규모에서 액틴 및 미세 소관 역학의 많은 메커니즘을 개선했습니다. . 여기에 최소 성분 단일-액틴-미세소관 커플링을 시험관내에서 조사하기 위한 단일 필라멘트 접근법이 기재되어 있다. 이 프로토콜은 상업적으로 입수가능하거나 고도로 순수한 정제된 단백질, 형광 표지된 단백질, 관류 챔버와 함께 사용될 수 있고, 세포 추출물 또는 합성 시스템을 함유하는 보다 복잡한 반응식으로 확장될 수 있다. 여기서, 상업적으로 입수가능한 타우 단백질은 액틴-미세소관 결합 단백질의 존재 하에서 세포골격 역학이 어떻게 변하는지를 입증하기 위해 사용되지만, 다른 추정적 액틴-미세소관 배위 인자를 대체할 수 있다. 다른 접근법에 비해이 시스템의 주요 장점은 한 반응에서 여러 세포 골격 중합체의 역학을 동시에 모니터링 할 수 있다는 것입니다. 이 프로토콜은 또한 사용자에게 세포 골격 중합체의 변화를 정량화하는 예제와 간단한 도구를 제공합니다. 따라서, 프로토콜 사용자는 신뢰할 수 있고, 정량적이며, 단일 필라멘트 분해능 데이터를 생성하여, 다양한 조절 단백질이 액틴-미세소관 역학을 어떻게 조정하는지에 기초를 둔 메카니즘을 기술할 것이다.
프로토콜
1. 커버슬립 세척
참고: Smith et al., 201328에 따라 세척(24mm x 60mm, #1.5) 커버슬립을 세척하십시오.
- 커버 슬립을 플라스틱 슬라이드 메일러 용기에 보관하십시오.
- 다음 용액에서 순차적으로 커버슬립을 잠수하고 30-60 분 동안 초음파 처리하고, 각 용액 사이에 ddH2O로 10 번 헹구십시오 : 접시 비누 한 방울로ddH2O; 0.1 M KOH. 커버슬립을 100% 에탄올에 최대 6개월 동안 보관하십시오.
참고: 사랑받지 못한 손가락으로 유리 표면을 만지지 마십시오. 대신 포셉을 사용하십시오.
2. mPEG- 및 비오틴-PEG-실란으로 코팅 세척(24mm x 60mm, #1.5) 커버슬립
참고: 이 프로토콜은 특히 비오틴-스트렙타비딘 시스템을 사용하여 TIRF 이미징 평면 내에 액틴 및 미세소관을 배치합니다. 다른 코팅 및 시스템 (예를 들어, 항체, 폴리-L-리신, NEM 미오신 등)이 사용될 수 있다.
- PEG-실란 및 비오틴-PEG-실란 분말의 분취량을 해동시킨다.
- PEG 분말을 80% 에탄올(pH 2.0)에 녹여 사용 직전에 10mg/mL mPEG-실란과 2-4mg/mL 비오틴-PEG-실란의 코팅 원액을 생성합니다.
참고 : PEG 분말은 종종 용해 된 것처럼 보이지만 현미경 수준에서는 그렇지 않을 수 있습니다. 적절한 재 서스펜션은 일정한 피펫팅으로 ~ 1-2 분이 걸립니다. 사용자는 분말 용해의 출현 후 추가로 10 번 피펫하는 것이 좋습니다.
주의: 80% 에탄올(pH 2.0)을 만들 때 농축된 HCl로부터 피부를 보호하기 위해 장갑을 착용하십시오. - 포셉을 사용하여 에탄올 보관에서 깨끗한 (24mm x 60mm, #1.5) 커버슬립을 제거하십시오. 질소 가스로 건조시키고 깨끗한 페트리 접시에 보관하십시오.
- 100 μL의 코팅 용액으로 코트 커버슬립: 80% 에탄올(pH 2.0)에 2mg/mL mPEG-실란(MW 2,000)과 0.04mg/mL 비오틴-PEG-실란(MW 3,400)의 혼합물.
참고: 희소 코팅(권장)의 경우 2mg/mL mPEG-실란 및 0.04mg/mL 비오틴-PEG-실란을 사용하십시오. 고밀도 코팅의 경우 2mg/mL mPEG-실란, 4mg/mL 비오틴-PEG-실란을 사용하십시오. - 커버슬립을 적어도 18시간 동안 또는 사용 전까지 70°C에서 인큐베이션한다.
참고: 코팅된 커버슬립은 70°C에서 2주 이상 보관하면 성능이 저하됩니다.
3. 이미징 흐름 챔버 조립
- 양면 테이프 12 스트립을 24mm 길이로 자릅니다. 테이프 백킹의 한쪽면을 제거하고 깨끗한 이미징 챔버에있는 여섯 개의 홈에 인접한 테이프 조각을 고정하십시오.
참고: 테이프는 적절한 조립을 위해 평평해야 하며, 그렇지 않으면 이미징 챔버가 누출됩니다. 충돌이 발생하지 않도록 테이프 백킹을 조심스럽게 제거하십시오. 테이프 챔버 접촉을 매끄럽게 하기 위해 깨끗한 표면에 테이핑 챔버를 슬라이딩하는 것이 좋습니다. - 테이프 백킹의 두 번째 부분을 분리하여 각 챔버 홈을 따라 테이프의 끈적끈적한 면을 노출시킵니다. 챔버 테이프 측면을 깨끗한 표면에 위로 놓습니다.
- 에폭시 수지와 경화제 용액 1:1 (또는 제조업체의 지침에 따라)을 작은 무게 보트에 섞으십시오.
- P1000 팁을 사용하여 각 이미징 챔버 홈의 끝에 테이프 스트립 사이에 혼합 에폭시 방울을 놓습니다 (빨간색 화살표; 그림 1A). 챔버 테이프 / 에폭시 측면을 깨끗한 표면에 올려 놓습니다.
- 코팅된 커버슬립을 70°C 인큐베이터에서 제거한다. 커버슬립의 코팅 및 코팅되지 않은 표면을ddH2O로 여섯 번 헹구고 여과된 질소 가스로 건조시킨 다음 커버슬립 코팅면을 테이프쪽으로 이미징 챔버에 부착합니다.
- P200 또는 P1000 피펫 팁을 사용하여 테이프-글라스 인터페이스에 압력을 가하여 테이프와 커버슬립 사이의 밀봉이 양호하도록 합니다.
주: 적절한 씰을 사용하면 양면 테이프가 반투명해집니다. 충분한 테이프 챔버 접점이 부족한 이미징 챔버가 누출됩니다. - 조립된 챔버를 실온에서 적어도 5-10분 동안 인큐베이트하여 에폭시가 사용 전에 챔버 웰을 완전히 밀봉할 수 있도록 한다. 관류 챔버는 조립 후 12-18 시간 이내에 만료됩니다.
참고: 테이프 배치 및 사용된 양면 테이프의 두께에 따라 조립된 챔버의 최종 부피는 20-50μL입니다.
4. 관류 챔버의 컨디셔닝
- 관류 펌프(500μL/min로 설정된 속도)를 사용하여 다음과 같이 관류 챔버에서 컨디셔닝 솔루션을 순차적으로 교환하십시오.
- 50 μL의 1% BSA를 흘려서 이미징 챔버를 프라이밍한다. Luer 잠금 피팅 저장소에서 과도한 버퍼를 제거합니다.
- 0.005 mg/mL 스트렙타비딘의 흐름 50 μL. 실온에서 1-2분 동안 인큐베이션한다. 저장소에서 과도한 버퍼를 제거합니다.
- 50 μL의 1% BSA를 유동시켜 비특이적 결합을 차단한다. 10-30 초 동안 배양하십시오. 저장소에서 과도한 버퍼를 제거합니다.
- 유동 50 μL의 가온 (37°C) 1x TIRF 완충액 (1x BRB80, 50 mM KCl, 10 mM DTT, 40 mM 글루코스, 0.25% (v/v) 메틸셀룰로스 (4,000 cp)).
주: 저장소에서 과도한 버퍼를 제거하지 마십시오. 이것은 챔버가 건조되는 것을 방지하여 시스템에 기포를 도입 할 수 있습니다. - 선택사항: 1x TIRF 완충액에 희석된 안정화된29 및 50% 비오티닐화 미세소관 종자의 흐름 50 μL.
참고: 적절한 희석은 경험적으로 결정되어야 하며 배치 대 배치 변동성을 포함해야 합니다. 27,29의 프로토콜을 시작점으로 사용하는 것이 좋습니다. 시야각당 10-30 개의 씨앗을 생성하는 희석은이 설정과 잘 작동합니다.
5. 현미경 준비
참고: 동적 액틴 필라멘트 및 미세소관을 포함하는 생화학 반응은 120-150mW 고체 레이저, 온도 보정된 63x 오일 침지 TIRF 목표 및 EMCCD 카메라가 장착된 반전된 총 내부 반사 형광(TIRF) 현미경을 사용하여 시각화/수행됩니다. 이 예에서 단백질은 다음과 같은 파장에서 시각화됩니다 : 488 nm (미세 소관) 및 647 nm (액틴).
- 첫 번째 생화학 반응을 이미징하기 최소 30 분 전에 35-37 ° C를 유지하도록 스테이지 / 대물 히터 장치를 설정하십시오.
- 이미지 획득 파라미터를 다음과 같이 설정한다.
- 획득 간격을 15-20분 동안 매 5초마다 설정합니다.
- 488 및 647 레이저 노출을 5%-10% 전력에서 50-100ms로 설정합니다. 현미경에 적합한 TIRF 각도를 설정합니다.
참고: 현미경 설정에 관계없이 레이저 출력, 노출 및 TIRF 각도를 설정하는 가장 간단한 방법은 두 폴리머 중 하나의 이미지만 조정하는 것입니다(아래 5.2.2.1 및 5.2.2.2 참조). 사용자는 여전히 감지를 허용하는 가장 낮은 레이저 출력 및 노출 설정을 사용하는 것이 좋습니다.- 중합 반응을 조정하고(도 1C) 액틴 필라멘트 조립을 개시하고 647nm에서 이미지를 획득한다. 적절하게 조정하십시오.
- 중합 반응을 두 번째 조건화된 관류 웰에서 조정하여 미세소관 조립을 개시하고(도 1C) 488nm에서 시각화한다. 적절하게 조정하십시오.
6. 단백질 반응 믹스의 제조
- 형광 라벨이 붙은 튜불린의 원액을 준비하십시오.
- Abs280에서 분광 광도법을 통해 수제 표지되지 않은 튜불린의 농도를 다음과 같이 결정하십시오.
- GTP가 부족한 1xBRB80의 빈 분광 광도계.
- 115,000 M-1 cm-1의 결정된 흡광 계수와 다음 공식을 사용하여 튜불린의 농도를 계산하십시오.
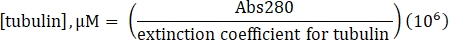
- 상업적으로 제조된 동결건조된 라이신 표지된 488-튜불린을 GTP가 결여된 1x BRB80 20 μL로 10 μM (1 mg/mL; 100% 라벨)로 재현탁시킨다.
- 100 μM의 7.2 μL 분취량을 표지되지 않은 재활용 튜불린29를 얼음 상에서 해동시킨다.
참고: 재활용 튜불린은 냉동 단백질 스톡29,30에서 형성된 중합 무능 이량체를 제거하기 때문에 시험관 내에서 성공적인 미세소관 조립에 매우 중요합니다. - 3 μL의 10 μM 488-튜불린을 100 μM 비표지된 튜불린의 7.2 μL 분취량과 함께 사용 전 15분 이내에 결합한다.
- Abs280에서 분광 광도법을 통해 수제 표지되지 않은 튜불린의 농도를 다음과 같이 결정하십시오.
- 형광 표지된 액틴의 원액을 준비한다.
- 수제 단백질의 경우, 다음과 같이 분광광도계 Abs290 및 Abs650을 통해 액틴의 농도와 퍼센트 라벨을 결정하십시오.
- G 버퍼가있는 빈 분광 광도계.
- 25,974 M-1 cm-1의 결정된 흡광 계수 및 다음 공식을 사용하여 표지되지 않은 액틴의 농도를 계산하십시오.
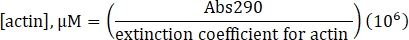
- 표지되지 않은 액틴의 흡광 계수, 0.03의 형광 보정 계수 및 다음 공식을 사용하여 알렉사-647-액틴으로 표지된 리신의 농도를 계산한다:
[알렉사-647 액틴], μM = (Abs290 -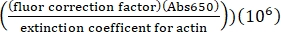
- 다음과 같이 239,000 M-1 cm-1의 Alexa-647에 대해 결정된 ε을 사용하여 Alexa-647-actin의 퍼센트 레이블을 계산합니다.
알렉사-647-액틴의 % 라벨 = (Abs290 - (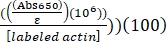
- 해동한 2 μL 분취량을 3 μM 100% 표지된 비오틴-액틴 (리신 잔기에 표지됨). 18 μL의 G 완충액을 첨가하여 10배 희석한다.
- 희석된 비오티닐화 액틴 3 μL, 표지되지 않은 및 표지된 액틴 (위)의 적절한 부피를 조합하여, 최종 혼합이 10%-30% 형광 표지와 12.5 μM 총 액틴이 될 것이다.
참고: 30% 이상의 형광 액틴 단량체(최종)는 필라멘트가 배경에서 식별하기 어려워짐에 따라 이미징 해상도를 손상시킬 수 있습니다.
- 수제 단백질의 경우, 다음과 같이 분광광도계 Abs290 및 Abs650을 통해 액틴의 농도와 퍼센트 라벨을 결정하십시오.
- 반응 믹스를 준비합니다(그림 1C).
- 12.5 μM 액틴 믹스 스톡(6.2.3)과 튜불린 스톡 믹스(6.1.4)의 2 μL를 조합하여, 이미징 15분 전에 세포골격 믹스(튜브 A)를 제조하였다. 사용할 때까지 얼음 위에 보관하십시오.
- 2x TIRF 버퍼, 안티-표백제, 뉴클레오티드, 완충액 및 부속 단백질을 포함한 다른 모든 실험 성분과 단백질을 조합하여 단백질 반응 믹스(튜브 B)를 준비한다. 그림 1C에 예가 나와 있습니다.
참고: 최종 희석은 추정된 생리학적 범위 내에 ATP, GTP 및 이온 강도를 포함하는 1x TIRF 버퍼를 생성합니다.
- 튜브 A 및 튜브 B를 37°C에서 30-60초 동안 별도로 인큐베이션한다. 반응을 시작하려면 튜브 B의 내용물을 혼합하여 튜브 A(아래)에 추가합니다.
7. 이미지 액틴과 미세 소관 역학
- 관류 우물 조건(도 1B; 단계 4, 상기).
- 튜브 B(반응 믹스)의 내용물을 튜브 A(세포골격 믹스)에 추가하여 액틴과 미세소관 조립을 동시에 시작합니다(그림 1C).
- 15 μM 유리 튜불린, 1 mM GTP 및 0.5 μM 액틴 단량체로 보충된 1x TIRF 완충액을 함유하는 50 μL의 반응 흐름 및 적절한 부피의 완충액 조절.
- 현미경 소프트웨어를 사용하여 타임랩스 동영상을 녹화하여 15-20분 동안 매 5초마다 획득할 수 있습니다.
참고: 액틴과 미세소관 역학의 개시는 2-5분 이내에 발생합니다(그림 2). 더 긴 지연은 반응 혼합물에서 단백질의 온도 조절 또는 농도 관련 문제에 대한 문제를 나타냅니다. - 새로운 관류 웰을 컨디셔닝하고(단계 4) 버퍼 부피를 관심있는 조절 단백질(들)(즉, 타우) 및 완충액 조절(도 1C)로 대체한다. 단계 7(상기)에 요약된 바와 같이 획득하여 액틴-미세소관 기능에 대한 조절 단백질을 평가한다.
8. FIJI 소프트웨어 31을 사용하여 이미지 처리 및 분석
- 저장된 TIRF 동영상을 열고 컴포지트로 봅니다.
- 다음과 같이 미세 소관 역학을 분석합니다 (그림 3A).
- 이미지 스택 메뉴에서 시간 기반 최대 Z 프로젝션을 생성합니다.
- Z 프로젝션 창을 분석> 도구> Windows 동기화 메뉴의 원본 TIRF 동영상과 동기화합니다.
- 시간 투영 된 이미지에 관심의 미세 소관을 따라 직선 도구를 사용하여 선을 그립니다.
- 분석 메뉴(분석> 도구> ROI 관리자)에서 관심 영역(ROI) 관리자를 엽니다.
- "t"를 눌러 개별 미세 소관 위치를 저장하십시오. 관심있는 모든 미세 소관에 대해 반복하십시오.
- "/"를 사용하여 선택된 라인의 키모그래프를 플롯하거나 ROI 관리자(31)에서 모든 미세소관에 대한 비디오 및 키모그래프를 생성하는 멀티-키모 매크로를 실행한다.
- 길이(μm) 및 시간(최소) 배율 막대를 모두 분석> 도구> 배율 막대 메뉴의 키모그래프에 추가합니다.
- 키모그래프 기울기에서 미세소관 성장 속도를 측정합니다(그림 3A, 1-2; 검은색 선의 기울기).
- 생성된 키모그래프로부터 동적 미세소관 사건(재앙 또는 재성장)을 계수하거나 이용가능한 분석 매크로 5,8,18,25를 사용한다. 그림 3A, 1-2의 빨간색 점선은 재앙/빠른 분해 사건을 나타냅니다.
- 액틴 역학을 분석(그림 3B)하면 다음과 같습니다.
- 액틴 핵화를 다음과 같이 측정하십시오.
- 반응의 개시 후 100 s 시야에 존재하는 액틴 필라멘트의 수를 카운트하고 그 면적에 의해 발현한다(필라멘트당μm2).
- 위의 8.2.3.1 단계와 같이 ROI 관리자에 데이터를 기록하고 저장합니다.
- 액틴 필라멘트 신장률(그림 3B)을 다음과 같이 측정한다.
- 세그먼트 라인 도구를 사용하여 관심있는 액틴 필라멘트를 따라 선을 그립니다.
- 위의 8.2.3.1 단계와 같이 ROI 관리자에 줄을 추가하십시오.
- 적어도 네 개의 동영상 프레임에 대해 줄 뒤를 따라(ROI 관리자에 각 측정 값 추가) 반복합니다.
참고: 일곱 개에서 여덟 개의 연속 프레임을 측정하는 것이 좋지만 일부 조건에서는 목표/현미경 설정으로 해결할 수 있는 감지 가능한 한계 미만으로 액틴 중합이 느려집니다. 이러한 경우에, 측정은 비연속적인 프레임들(예를 들어, 매 다섯 프레임마다)에 걸쳐 규칙적인 간격으로 이루어질 수 있다. - 경과 시간에 대한 측정된 길이 값을 플로팅합니다. 생성 된 선의 기울기는 미크론 / s의 액틴 신장률입니다.
- 최종 계산된 비율을 370 서브유닛의 보정 계수를 사용하여 서브유닛 s-1 μM-1 로서 전달하여 필라멘트32의 미크론 내의 액틴 단량체의 수를 설명한다.
- 액틴 핵화를 다음과 같이 측정하십시오.
- 다음과 같이 평행 액틴-미세소관 연관의 영역에 대한 상관관계 분석을 수행한다(도 3C).
- 직선 도구를 사용하여 특정 시점 (즉, 반응 개시 후 300 s)에서 관심있는 미세 소관을 따라 선을 그립니다.
- 위의 8.2.3.1 단계와 같이 ROI 관리자에 줄을 추가하십시오.
- 각 채널에서 선을 따라 형광 강도를 플로팅합니다.
- 이미지 슬라이더가 있는 각 채널을 선택하고 "명령 k"를 사용하여 선을 따라 강도를 플로팅합니다.
- 출력 창에서 "목록"버튼을 클릭하여 값을 저장하거나 내보냅니다.
- 액틴-미세소관 결합 이벤트를 개별 이벤트로부터의 비율(미세소관과 겹치는 액틴) 또는 일관된 시점에서의 주어진 시야에서의 이벤트의 카운트로서 표현한다(그림 3C).
- 대안: 소프트웨어를 사용하여 두 채널의 겹침 비율(5,12)을 결정합니다.
- 직선 도구를 사용하여 특정 시점 (즉, 반응 개시 후 300 s)에서 관심있는 미세 소관을 따라 선을 그립니다.
결과
위에서 설명한 조건(그림 1)을 사용하면 액틴 및 미세소관 중합체는 이미지 획득 후 2분 이내에 가시적(및 동적)이어야 합니다(그림 2). 임의의 생화학 기반 프로토콜과 마찬가지로, 최적화는 상이한 조절 단백질 또는 단백질 배치에 대해 요구될 수 있다. 이러한 이유로, TIRF 각도 및 이미지 노출은 각각의 개별 중합체를 포함하는 반응으로 먼저 설정된다. 이것은 저장된 단백질이 기능적이며 검출을 위해 충분한 표지 된 단백질이 존재한다는 것을 확인합니다. 항상 필요한 것은 아니지만(그리고 여기에서 수행되지는 않음), 영화의 사후 처리(즉, 배경 뺄셈, 평균화 또는 푸리에 변환)는 이미지 콘트라스트(특히 미세소관)5,25,33를 향상시키기 위해 사용될 수 있다. 이 분석법에 의해 제공되는 단일 액틴 필라멘트 및 미세소관의 직접적인 시각화는 중합 파라미터(즉, 핵 또는 신장률), 분해 파라미터(즉, 수축률 또는 파스트로페 사건) 및 폴리머 공정렬/중첩(그림 3)을 포함하여 세포 골격 성분을 단독으로 또는 함께 사용하는 몇 가지 동적 측정의 정량적 결정을 지원합니다. ). 또한, 이러한 측정은 타우와 같은 조절 리간드의 결합 또는 영향을 해독하기 위한 출발점으로 사용될 수 있다(도 3). 단일 액틴 필라멘트 또는 미세소관의 많은 측정은 하나의 TIRF 필름으로부터 이루어질 수 있다. 그러나 커버슬립 코팅, 피펫팅 및 기타 요인의 변화로 인해 신뢰할 수 있는 측정에는 여러 기술적 복제 반응/필름도 포함되어야 합니다.
미세 소관 역학의 많은 측면은 미세 소관 신장률뿐만 아니라 재앙 및 구조 사건의 빈도를 포함한 예제 kymographs에서 결정될 수 있습니다 (그림 3A). 이 시스템에서 액틴 역학을 측정하기 위해 kymographs를 사용하는 것은 액틴 필라멘트가 미세 소관보다 더 복잡하기 때문에 간단하지 않습니다. 결과적으로, 액틴 필라멘트 역학의 매개 변수는 손으로 측정되며, 이는 시간이 많이 걸리고 노동 집약적입니다. 핵 카운트는 모든 조건에 대해 일관된 시점에 존재하는 액틴 필라멘트의 수로서 측정된다. 이러한 카운트는 TIRF 이미징 분야에 따라 크게 다르지만 많은 반복실험과 함께 사용하거나 다른 중합 분석의 관찰을 보완하는 데 사용할 수 있습니다. 핵 계수는 시험 조건에 안정화 된 미세 소관 종자가 부족한 경우 미세 소관에도 사용될 수 있습니다. 액틴 필라멘트 신장률은 적어도 네 개의 무비 프레임으로부터 시간에 따른 필라멘트의 길이로서 측정된다. 레이트 값은 마이크로몰 액틴 당 370 서브유닛의 보정 계수를 갖는 전사되어 미크론의 필라멘트 내의 액틴 단량체의 수를 설명한다(도 3B)32). 액틴과 미세 소관 사이의 조정 된 행동을 정의하기위한 측정은 덜 잘 정의되어 있습니다. 그러나, 상관관계 분석은 라인 스캔(도 3C) 또는 중첩 소프트웨어(5,11,34)를 포함하는 두 폴리머의 우연성을 측정하기 위해 적용되었다.
데이터 가용성:
이 작업과 관련된 모든 데이터 세트는 Zenodo에 보관되었으며 10.5281 / zenodo.6368327에서 합리적인 요청으로 사용할 수 있습니다.
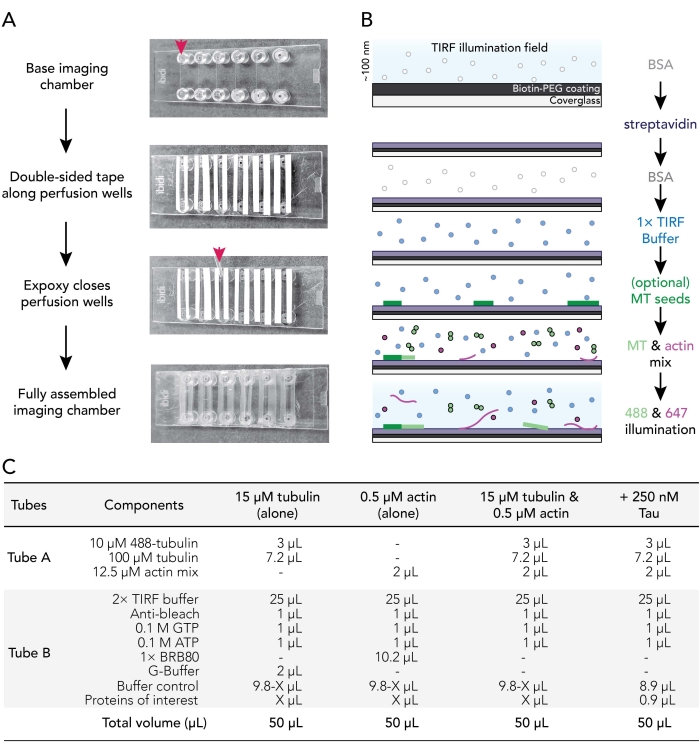
그림 1. 실험 회로도 : 이미지 수집을위한 흐름 챔버 어셈블리. (A) 이미징 챔버 어셈블리. 위에서 아래로: IBIDI 이미징 챔버는 관류 웰(화살표로 표시됨)을 따라 테이핑됩니다. 테이프 백킹의 두 번째 (흰색) 층 (더 나은 오리엔트 사용자에게 표시된 이미지에서 왼쪽)이 제거되고 에폭시가 관류 챔버 (화살표)의 가장자리에 적용됩니다. 참고: 사용자가 에폭시를 배치할 위치를 보다 쉽게 파악하기 위해 이 이미지에는 흰색 백킹이 남아 있습니다. 세척되고 코팅된 커버슬립은 코팅면이 관류의 내부를 잘 향하도록 이미징 챔버에 부착된다. (b) 비오틴-스트렙타비딘 결합을 위한 컨디셔닝 이미징 챔버를 위한 단계를 예시하는 흐름도. (c) 동적 미세소관 및 액틴 필라멘트의 TIRF 필름을 획득하는데 사용되는 반응의 예. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
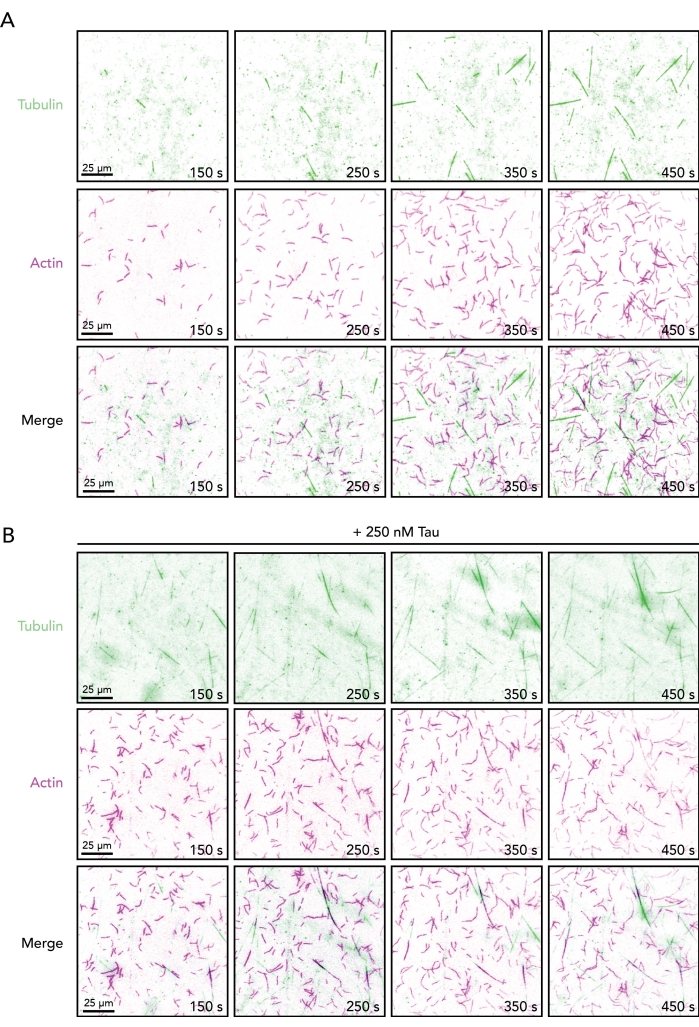
그림 2. 타우의 부재 또는 존재 하에 성장하는 액틴 필라멘트 및 미세소관의 이미지 서열. 250 nM 타우의 부재 (A) 또는 존재 (B)에서 0.5 μM 액틴 (10% 알렉사-647-액틴 및 0.09% 비오틴-액틴 표지됨) 및 15 μM 유리 튜불린 (4% HiLyte-488 표지됨)을 함유하는 TIRF 검정으로부터의 타임랩스 이미지 몽타주. 반응 개시(튜브 A와 튜브 B의 혼합)로부터 경과된 시간이 도시되어 있다. 스케일 바, 25 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
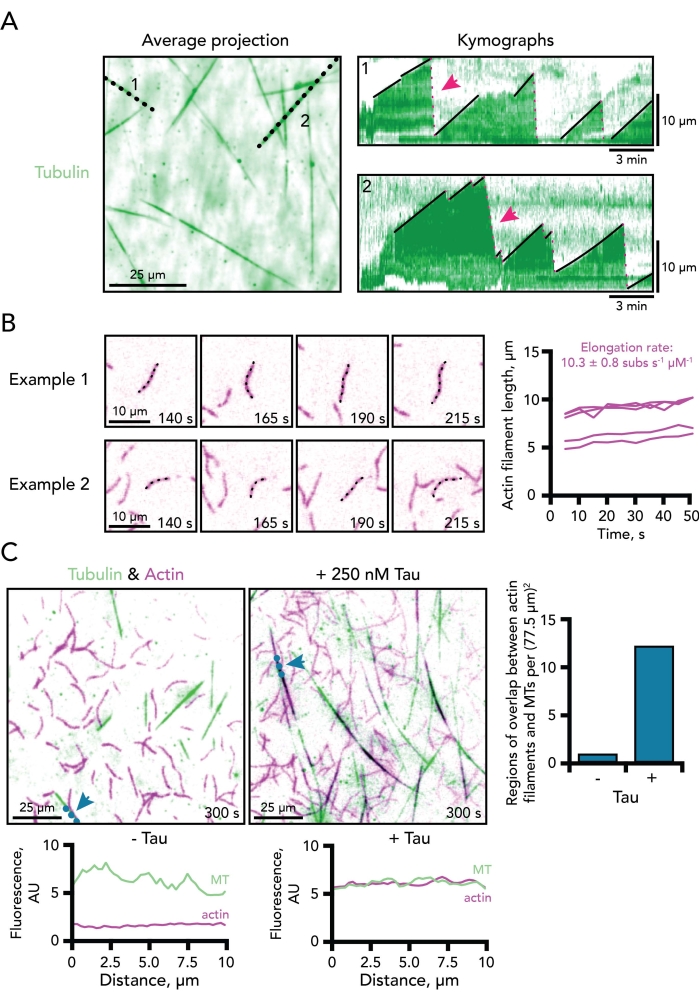
그림 3. 미세소관 및 액틴 필라멘트 역학의 실시예 측정. (A) 튜불린 채널의 평균 시간 투영은 키모그래프 플롯을 생성하는 데 사용되는 라인 스캔에 대한 총 미세소관 길이를 효율적으로 시각화합니다. 검은 점선은 오른쪽에 표시된 동적 미세 소관의 두 가지 예제 kymographs에 해당합니다. 미세소관의 성장 (실색 검은 선) 및 분해 단계 (점선 분홍색 선; 분홍색 화살표로 표시된 두 개)가 각 키모 그래프에 표시됩니다. 시간 척도 막대, 3분 길이 스케일 바, 10 μm. 반응물은 0.5 μM 액틴 (10% 647-라벨) 및 15 μM 유리 튜불린 (4% 488-HiLyte 라벨)을 함유한다. 튜불린 채널만 표시됩니다. (b) 능동적으로 중합하는 단일 액틴 필라멘트를 묘사하는 두 가지 예의 타임랩스 이미지 몽타주. 연신율은 마이크로몰 액틴 당 시간에 따른 액틴 필라멘트 길이의 플롯의 기울기로서 계산된다. 따라서, 두 개의 보정 인자는 1 μM 액틴 농도에서 전형적으로 결정된 비율에 대한 비교를 위해 0.5 μM 액틴 반응에 적용되어야 한다. 다섯 필라멘트의 예가 오른쪽에 표시됩니다. 스케일 바, 10 μm. 반응물은 0.5 μM 액틴 (10% 647-라벨) 및 15 μM 유리 튜불린 (4% 488-HiLyte 라벨)을 함유한다. 액틴 채널만 표시됩니다. (c) 250 nM 타우의 부재 (왼쪽) 또는 존재 (중간)에서 중합되는 동적 미세소관 (MT) (녹색) 및 액틴 필라멘트 (보라색)의 TIRF 이미지. 파란색 점선과 화살표는 각 조건(각 이미지 아래)에 해당하는 선 스캔 플롯에 대해 선이 그려진 위치를 표시합니다. 미세소관과 액틴 영역 사이의 중첩(검정으로 표시됨)은 영역당 설정된 시점(오른쪽)에서 점수화될 수 있다. 스케일 바, 25 μm. 반응은 250 nM 타우를 포함하거나 포함하지 않는 0.5 μM 액틴 (10% 647-라벨) 및 15 μM 유리 튜불린 (4% 488-HiLyte 라벨)을 함유한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
시각화 된 정제 된 단백질에 대한 총 내부 반사 형광 (TIRF) 현미경의 사용은 세포 골격 조절 5,23,24,25,26,27,35의 독특한 메커니즘을 해부하기위한 유익하고 매력적인 접근법이었습니다. 전통적인 생화학 적 분석과 비교할 때, TIRF 반응은 매우 작은 부피 (50-100 μL)를 필요로하며, 세포 골격 역학의 정량적 측정은 개별 분석에서 수집 될 수 있습니다. 세포골격 역학에 대한 대부분의 연구는 단일 중합체 시스템 (즉, 액틴 필라멘트 또는 미세 소관)에 초점을 맞추고, 따라서 세포에서 전형적으로 보이는 액틴 필라멘트와 미세 소관 사이의 누화 또는 창발적 행동의 상세한 측정은 시험관에서 재검토하기가 어렵고 애매한 채로 남아있다. 이 문제를 해결하기 위해, 이 프로토콜은 동일한 생화학 반응에서 동적 액틴 및 미세소관 중합체의 직접적인 시각화를 가능하게 하는 단일 필라멘트 TIRF 현미경 시스템을 기술한다. 따라서이 방법은 액틴 필라멘트 또는 미세 소관의 동적 거동을 재검토하는 전통적인 분석을 뛰어 넘습니다. 이 기술은 또한 세포 골격 결합 인자의 존재하에 몇 가지 동적 특성이 어떻게 변하는지에 대한 예로서 타우와 함께 수행되었다. 이러한 프로토콜은 액틴 또는 미세소관 역학을 조정하기 위해 알려져 있거나 의심되는 추가의 단백질과 함께 사용될 수 있으며, MACF, GAS, 포르민 등을 포함하되 이에 한정되지 않는다. 마지막으로, 제공된 예제 분석을 이 프로토콜로 획득한 데이터를 정량화하기 위한 지침으로 사용할 수 있습니다.
"보는 것은 믿는 것"은 현미경 기반 분석을 수행하는 강력한 이유입니다. 그러나 TIRF 현미경 실험의 실행 및 해석에는 주의가 필요합니다. 세포골격 공동조립 분석의 한 가지 주요 과제는 일반적으로 사용되는 많은 이미징 조건이 각 중합체와 양립할 수 없다는 것이다. 미세소관 및 액틴은 전형적으로 중합을 위한 상이한 완충액, 온도, 염, 뉴클레오티드 및 농도 요건을 갖는다. 액틴, 튜불린, 관심있는 조절 단백질 및 이 프로토콜에 사용되는 완충제는 동결-해동 사이클에 민감하다. 따라서이 프로토콜을 성공적으로 실행하려면 단백질과 버퍼를주의 깊게 처리해야합니다. 이러한 많은 우려를 완화하기 위해 갓 재활용 된 튜불린 (<6 주 동안 냉동)을 사용하고 초 원심분리를 통해 냉동 / 재현탁 액틴을 미리 제거하는 것이 좋습니다. 이러한 고려사항은 또한 동결-해동 주기 또는 완충액 염 5,11,36의 농도에 민감할 수 있는 이 절차와 함께 평가될 수 있는 무수한 조절 단백질에도 적용된다.
불행히도, 실험적 트레이드 오프가없는 모든 크기의 버퍼는 존재하지 않습니다. 더 낮은 농도의 단백질에 대해 더 많은 부피를 적절하게하기 위해, ATP 및 GTP는 2x TIRF 완충 용액에 포함될 수 있다(도 1C). 그러나, 이들 뉴클레오티드는 동결-해동 주기에 매우 민감하기 때문에, 권장되지 않는다. 여기에 사용된 산소 소거용 화합물(즉, 카탈라아제 및 글루코스-옥시다제)은 장기간(분에서 시간)동안 단백질을 시각화하는 데 필요하지만, 고농도에서 미세소관 중합을 제한하는 것으로 알려져 있다5. 이러한 완충액 고려사항과 관련하여, 이 프로토콜의 한계는 일부 정준 미세소관-관련 조절 단백질이 미세소관 단독(액틴 없이)을 사용하는 세포 또는 분석에서 발견되는 기능을 재검토하기 위해 더 많거나 적은 염을 필요로 할 수 있다는 것이다. 이러한 우려를 해결하기 위해 염의 성질 또는 농도를 변경하는 것은 액틴 필라멘트 중합 속도 및 / 또는 미세 소관 역학의 매개 변수에 영향을 줄 수 있습니다. 여러 설명 파라미터(최소, 핵형성, 신장률 및 안정성)의 측정(그림 3)은 프로토콜 성공을 확인하거나 특정 완충제 또는 조절 단백질의 효과를 명시적으로 문서화하는 데 필요합니다. 예를 들어, 너무 많은 액틴 필라멘트 중합은 수초 내에 액틴-미세소관 결합 이벤트를 흐리게 할 수 있다. 결과적으로, 액틴의 전체 농도를 낮추거나 액틴 핵생성을 억제하기 위한 추가적인 단백질(즉, 프로필린)을 포함함으로써 실험 조건을 미세 조정하면 액틴-미세소관 활동을 배위하는 전체 기간이 연장되어 명확하게 볼 수 있다. 이러한 필수 구성 요소를 다루는 컨트롤과 기술 반복실험(여러 보기 영역 이상)은 사용자가 안정적이고 재현 가능한 결과를 생성하는 데 매우 중요합니다.
세포 기반 연구는 직접적인 단백질-단백질 관계 또는 조절 복합체의 작용을 관찰할 수 있는 제한된 기회를 제공한다. 대조적으로, 시험관내 분석으로부터 수집된 메카니즘 중 일부는 항상 세포에서 보이는 단백질의 정확한 거동을 반영하지는 않는다. 이 고전적인 생화학자의 딜레마는 특정 수정으로이 기술의 향후 적용에서 해결 될 수 있습니다. 예를 들어, 기능적 형광 표지 결합 단백질을 추가하면 이 방법이 단일 필라멘트 연구에서 단일 분자 연구로 확장됩니다. 분석은 세포 유사 현상을 재촉하는 데 필요한 "누락된" 알려지지 않은 핵심 인자를 추가할 수 있는 세포 추출물을 사용하도록 추가로 변형될 수 있다. 예를 들어, 효모 또는 제노푸스 추출물을 사용하는 TIRF 기반 검정은 수축성 암토묘신 고리 37, 유사분열 스핀들 26,38, 액틴 또는 미세소관 어셈블리의 성분39,40, 심지어 센트로솜 및 키네토코레 36,41,42,43에서의 역학을 재구성하였다. . 더욱이, 이러한 시스템은 지질 또는 신호전달 인자가 존재하는 인공 세포 시스템(44,45,46)을 향한 길을 닦을 수 있다.
공개
공개 할 이해 상충은 없습니다.
감사의 말
Marc Ridilla (Repair Biotechnologies)와 Brian Haarer (SUNY Upstate)에게이 프로토콜에 대한 유용한 의견에 감사드립니다. 이 연구는 국립 보건원 (GM133485)의 지원을 받았다.
자료
| Name | Company | Catalog Number | Comments |
| 1% BSA (w/v) | Fisher Scientific | BP1600-100 | For this purpose (blocking TIRF chambers), BSA is resuspended in ddH20 and filtered through a 0.22 µm filter. |
| 1× BRB80 | Homemade | 80 mM PIPES, 1 mM MgCl2, 1 mM EGTA, pH 6.8 with KOH | |
| 10 mg/mL (1000 U) glucose oxidase | Sigma Aldrich Inc, St. Louis, MO | G2133-50KU | Combined with catalase, aliquot and store at -80 oC until use |
| 100 µM tubulin | Cytoskeleton Inc, Denver, CO | T240 | Homemade tubulins should be recycled before use to remove polymerization-incompetent tubulin (Hyman et al. (1992)29; Li and Moore (2020)30). Commercially available tubulins are often too dilute to recycle, but function well if resuspended according to manufacturer’s instructions and pre-cleared via ultracentrifugation (278,000 × g) for 60 min, before use. |
| 100 mM ATP | Gold Biotechnology Inc, Olivette, MO | A-081 | Resuspended in ddH20 (pH 7.5) and filter sterilized. |
| 100 mM GTP | Fisher Scientific | AC226250010 | Resuspended in 1× BRB80 (pH 6.8) and filter sterilized. |
| 120-150 mW solid-state lasers | Leica Microsystems | 11889151; 11889148 | |
| 2 mg/mL catalase | Sigma Aldrich Inc, St. Louis, MO | C40-100 | Combined with glucose oxidase, aliquot and store at -80 oC until use |
| 2× TIRF buffer | Homemade | 2× BRB80, 100 mM KCl, 20 mM DTT, 80 mM glucose, 0.5% (v/v) methylcellulose (4,000 cp); Note: 1 µL of 0.1M GTP and 1 µL of 0.1M ATP added separately to TIRF reactions to avoid repeated freeze-thaw cycles. | |
| 24 × 60 mm, #1.5 coverglass | Fisher Scientific, Waltham, MA | 22-266882 | Coverglass must be extensively washed before use (Smith et al. (2014)22) |
| 37 oC heatblock | |||
| 37 oC water bath | |||
| 5 mg/mL Streptavidin (600x stock) | Avantor, Philadelphia, PA | RLS000-01 | Resuspended in Tris-HCl (pH 8.8); dilute the aliquot to 1× in HEK buffer on day of use |
| 5 min Epoxy resin and hardener | Loctite, Rocky Hill, CT | 1365736 | Combined resin and hardener may take up to 30 min to cure. |
| 50% biotinylated-GpCpp microtubule seeds | Cytoskeleton Inc; Homemade | T333P | (optional) GppCpp or Taxol stabilized microtubule seeds can more efficiently mediate microtubule polymerization. Taxol and GppCpp stabilize microtubules in different ways that can affect the microtubule lattice structure and ability of certain regulatory proteins to bind to the stabilized portion of the microtubule. A method to make diverse kinds of microtubule seeds is outlined in Hyman et al. (1992). |
| 70 oC incubator | |||
| Actin mix stock | Homemade; this protocol | A 12.5 µM actin mix comprised of labeled (fluorescent and biotinylated) and unlabeled actin for up to six reactions. 2 µL of stock is used in the final TIRF reaction. The final concentration of actin used in each reaction is 0.5 µM (10% Alexa-647; 0.09% biotin-labeled). | |
| Appropriate buffer controls | Homemade | Combination of buffers from all proteins being assessed | |
| Biotin-PEG-silane (MW 3,400) | Laysan Bio Inc | biotin-PEG-SIL-3400 | Dispensed into 2-5 mg aliquots, backfilled with nitrogen, parafilmed closed, and stored at -20 oC with desiccant until use |
| Biotinylated actin | Cytoskeleton Inc; Homemade | AB07 | Biotin-actin is made by labeling on lysine residues and thus assumed to be at least 100% labeled, but varies with different lots/preparations. Optimal biotinylated actin concentrations must be empirically determined for particular uses/experimental designs. Higher concentrations permit more efficient tracking, but may impede polymerization or interactions with regulatory proteins. Here a small percentage (0.09% or 900 pM) biotinylated actin is present in the final TIRF reaction. |
| Dishsoap | Dawn, Procter and Gamble, Cincinnati, OH | For unknown reasons, the blue version cleans coverslips more efficiently than other available colors. | |
| Dry ice | |||
| FIJI Software | www.https://imagej.net/software/fiji/downloads | Schneider et al. (2012)31. | |
| Fluorescently labeled actin | Cytoskeleton Inc; Homemade | AR05 | Homemade fluorescently labeled actin is stored in G-buffer supplemented with 50% glycerol at -20 oC (Spudich et al. (1971)47; Liu et al. (2022)48). Fluorescently labeled actin is dialyzed against G-buffer and precleared via ultracentrifugation for 60 min at 278,000 × g before use. |
| Fluorescently labeled tubulin | Cytoskeleton Inc | TL488M, TLA590M, TL670M | Resuspended in 20 µL 1× BRB80 (10 µM final concentration) and pre-cleared via ultracentrifugation (278,000 × g) for 60 min, before use. |
| G-buffer | Homemade | 3 mM Tris-HCl (pH 8.0), 0.2 mM CaCl2, 0.5 mM DTT, 0.2 mM ATP | |
| HEK Buffer | Homemade | 20 mM HEPES (pH 7.5), 1 mM EDTA (pH 8.0), 50 mM KCl | |
| Ice | |||
| Ice bucket | |||
| Imaging chambers | IBIDI, Fitchburg, WI | 80666 | Order chambers with no bottom to utilize different coverslip coatings |
| iXon Life 897 EMCCD camera | Andor, Belfast, Northern Ireland | 8114137 | |
| LASX Premium microscope software | Leica Microsystems | 11640611 | |
| Methylcellulose (4,000 cp) | Sigma Aldrich Inc | M0512 | |
| Microscope base equipped with TIRF module | Leica Microsystems, Wetzlar, Germany | 11889146 | |
| mPEG-silane (MW 2,000) | Laysan Bio Inc, Arab, AL | mPEG-SIL-2000 | Dispensed into 10-15 mg aliquots, backfilled with nitrogen, parafilmed closed, and stored at -20 oC with desiccant until use |
| Objective heater and heated stage insert | OKO labs, Pozzioli, Italy | 8113569 | Set temperature controls to 35-37 oC. Use manufacturer suggestions for accurate calibration. |
| Perfusion pump | Harvard Apparatus, Holliston, MA | 704504 | A syringe and tubing can be substituted. |
| Petri Dish, 100 x 15 mm | Genesee Scientific, San Diego, CA | 32-107 | |
| Plastic slide mailer container | Fisher Scientific | HS15986 | |
| SA-S-1L-SecureSeal 0.12 mm thick | Grace Biolabs, Bend, OR | 620001 | Double-sided tape of precise manufactured dimensions is strongly recommended. |
| Small styrofoam container | Abcam, Cambridge, UK | Reused from shipping | |
| Small weigh boat | Fisher Scientific | 02-202-100 | |
| Spectrophotometer | |||
| Tau | Cytoskeleton Inc | TA01 | Three isoforms of Tau are present in the commercially available preparation of Tau. The concentration in this protocol was determined from the highest molecular weight band (14.3 µM, when resuspended per manufacturer’s recommendations with 50 µL of ddH20). |
| Temperature corrected 63× Plan Apo 1.47 N.A. oil immersion TIRF objective | Leica Microsystems | 11506319 | |
| Tubulin stock | Homemade; this protocol | A tubulin stock consisting of 7.2 µL recycled 100 µM unlabeled tubulin and 3 µL of 10 µM resuspended commercially available fluorescently labeled tubulin. One tubulin stock is used per reaction and thawed/stored on ice. The final concentration of free tubulin in each reaction is 15 µM (4% labeled). More than 15 µM tubulin will result in hyperstabilized (not dynamic) microtubules, whereas concentrations below 7.5 µM free tubulin do not polymerize well. Careful determination of protein concentration and handling is required. | |
| Unlabeled actin (dark) | Cytoskeleton Inc; Homemade | AKL99 | Actin nucleates are almost always present in commercially available (lyophilized) or frozen actins and contribute to variability in quantitative measurements (Spudich et al. (1971)47; Liu et al. (2022)48). Rabbit muscle actin is stored in G-buffer at -80 oC and precleared via ultracentrifugation for 60 min at 278,000 × g before use. Several actin stock solutions are made throughout the day (making no more than enough for six reactions at a time is strongly recommended). |
참고문헌
- Pimm, M. L., Henty-Ridilla, J. L. New twists in actin-microtubule interactions. Molecular Biology of the Cell. 32 (3), 211-217 (2021).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nature Reviews. Molecular Cell Biology. 20 (1), 38-54 (2019).
- Etienne-Manneville, S. Actin and microtubules in cell motility: which one is in control. Traffic. 5 (7), 470-477 (2004).
- Rodriguez, O. C., et al. Conserved microtubule-actin interactions in cell movement and morphogenesis. Nature Cell Biology. 5 (7), 599-609 (2003).
- Prezel, E., et al. TIRF assays for real-time observation of microtubules and actin coassembly: Deciphering tau effects on microtubule/actin interplay. Methods in Cell Biology. 141, 199-214 (2017).
- Griffith, L. M., Pollard, T. D. The interaction of actin filaments with microtubules and microtubule-associated proteins. The Journal of Biological Chemistry. 257 (15), 9143-9151 (1982).
- Henty-Ridilla, J. L., Rankova, A., Eskin, J. A., Kenny, K., Goode, B. L. Accelerated actin filament polymerization from microtubule plus ends. Science. 352 (6288), 1004 (2016).
- Elie, A., et al. Tau co-organizes dynamic microtubule and actin networks. Scientific Reports. 5 (1), 1-10 (2015).
- Preciado López, M., et al. Actin-microtubule coordination at growing microtubule ends. Nature Communications. 5 (1), 1-9 (2014).
- Oberhofer, A., et al. Molecular underpinnings of cytoskeletal cross-talk. Proceedings of the National Academy of Sciences of the United States of America. 117 (8), 3944-3952 (2020).
- Nakos, K., et al. Septins mediate a microtubule-actin crosstalk that enables actin growth on microtubules. bioRxiv. , (2022).
- Kučera, O., Gaillard, J., Guérin, C., Théry, M., Blanchoin, L. Actin-microtubule dynamic composite forms responsive active matter with memory. bioRxiv. , (2022).
- Kundu, T., Dutta, P., Nagar, D., Maiti, S., Ghose, A. Coupling of dynamic microtubules to F-actin by Fmn2 regulates chemotaxis of neuronal growth cones. Journal of Cell Science. 134 (13), 252916 (2021).
- Roth-Johnson, E. A., Vizcarra, C. L., Bois, J. S., Quinlan, M. E. Interaction between microtubules and the Drosophila formin Cappuccino and its effect on actin assembly. The Journal of Biological Chemistry. 289 (7), 4395-4404 (2014).
- Gaillard, J., et al. Differential interactions of the formins INF2, mDia1, and mDia2 with microtubules. Molecular Biology of the Cell. 22 (23), 4575-4587 (2011).
- Bartolini, F., et al. The formin mDia2 stabilizes microtubules independently of its actin nucleation activity. The Journal of Cell Biology. 181 (3), 523-536 (2008).
- Sider, J. R., et al. Direct observation of microtubule-F-actin interaction in cell free lysates. Journal of Cell Science. 112 (12), 1947-1956 (1999).
- Alkemade, C., et al. Cross-linkers at growing microtubule ends generate forces that drive actin transport. Proceedings of the National Academy of Sciences of the United States of America. 119 (11), 2112799119 (2022).
- Axelrod, D. Total internal reflection fluorescence microscopy in cell biology. Methods in Enzymology. 361, 1-33 (2003).
- Amann, K. J., Pollard, T. D. Direct real-time observation of actin filament branching mediated by Arp2/3 complex using total internal reflection fluorescence microscopy. Proceedings of the National Academy of Sciences of the United States of America. 98 (26), 15009-15013 (2001).
- Al-Bassam, J. Reconstituting dynamic microtubule polymerization regulation by TOG domain proteins. Methods in Enzymology. 540, 131-148 (2014).
- Smith, B. A., Gelles, J., Goode, B. L. Single-molecule studies of actin assembly and disassembly factors. Methods in Enzymology. 540, 95-117 (2014).
- Wioland, H., Jégou, A., Romet-Lemonne, G. Celebrating 20 years of live single-actin-filament studies with five golden rules. Proceedings of the National Academy of Sciences of the United States of America. 119 (3), 2109506119 (2022).
- Ganzinger, K. A., Schwille, P. More from less - bottom-up reconstitution of cell biology. Journal of Cell Science. 132 (4), (2019).
- Mahamdeh, M., Howard, J. Implementation of interference reflection microscopy for label-free, high-speed imaging of microtubules. Journal of Visualized Experiments. (150), e59520 (2019).
- King, M. R., Petry, S. Phase separation of TPX2 enhances and spatially coordinates microtubule nucleation. Nature Communications. 11 (1), 270 (2020).
- Ramirez-Rios, S., et al. A TIRF microscopy assay to decode how tau regulates EB's tracking at microtubule ends. Methods in Cell Biology. 141, 179-197 (2017).
- Smith, B. A., et al. Three-color single molecule imaging shows WASP detachment from Arp2/3 complex triggers actin filament branch formation. eLife. 2, 01008 (2013).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: information from a slowly hydrolyzable analogue GMPCPP. Molecular Biology of the Cell. 3 (10), 1155-1167 (1992).
- Li, G., Moore, J. K. Microtubule dynamics at low temperature: evidence that tubulin recycling limits assembly. Molecular Biology of the Cell. 31 (11), 1154-1166 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Pollard, T. D., Blanchoin, L., Mullins, R. D. Molecular mechanisms controlling actin filament dynamics in nonmuscle cells. Annual Review of Biophysics and Biomolecular Structure. 29, 545-576 (2000).
- Kapoor, V., Hirst, W. G., Hentschel, C., Preibisch, S., Reber, S. MTrack: Automated detection, tracking, and analysis of dynamic microtubules. Scientific Reports. 9 (1), 3794 (2019).
- Willige, D., et al. Cytolinker Gas2L1 regulates axon morphology through microtubule-modulated actin stabilization. EMBO reports. 20 (11), (2019).
- Hirst, W. G., Kiefer, C., Abdosamadi, M. K., Schäffer, E., Reber, S. In vitro reconstitution and imaging of microtubule dynamics by fluorescence and label-free microscopy. STAR Protocols. 1 (3), 100177 (2020).
- Farina, F., et al. The centrosome is an actin-organizing centre. Nature Cell Biology. 18 (1), 65-75 (2016).
- Mishra, M., et al. In vitro contraction of cytokinetic ring depends on myosin II but not on actin dynamics. Nature Cell Biology. 15 (7), 853-859 (2013).
- Groen, A. C., Ngyuen, P. A., Field, C. M., Ishihara, K., Mitchison, T. J. Glycogen-supplemented mitotic cytosol for analyzing Xenopus egg microtubule organization. Methods in Enzymology. 540, 417-433 (2014).
- Pollard, L. W., Garabedian, M. V., Alioto, S. L., Shekhar, S., Goode, B. L. Genetically inspired in vitro reconstitution of Saccharomyces cerevisiae actin cables from seven purified proteins. Molecular Biology of the Cell. 31 (5), 335-347 (2020).
- Bergman, Z. J., Wong, J., Drubin, D. G., Barnes, G. Microtubule dynamics regulation reconstituted in budding yeast lysates. Journal of Cell Science. 132 (4), 219386 (2018).
- Inoue, D., et al. Actin filaments regulate microtubule growth at the centrosome. The EMBO Journal. 38 (11), (2019).
- Colin, A., Singaravelu, P., Théry, M., Blanchoin, L., Gueroui, Z. Actin-network architecture regulates microtubule dynamics. Current Biology. 28 (16), 2647-2656 (2018).
- Torvi, J. R., et al. Reconstitution of kinetochore and microtubule dynamics reveals a role for a kinesin-8 in establishing end-on attachments. bioRxiv. , (2022).
- Nguyen, P. A., et al. Spatial organization of cytokinesis signaling reconstituted in a cell-free system. Science. 346 (6206), 244-247 (2014).
- Abu Shah, E., Keren, K. Symmetry breaking in reconstituted actin cortices. eLife. 3, 01433 (2014).
- Vendel, K. J. A., Alkemade, C., Andrea, N., Koenderink, G. H., Dogterom, M. In vitro reconstitution of dynamic co-organization of microtubules and actin filaments in emulsion droplets. Cytoskeleton Dynamics. 2101, 53-75 (2020).
- Spudich, J. A., Watt, S. The regulation of rabbit skeletal muscle contraction. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. The Journal of Biological Chemistry. 246 (15), 4866-4871 (1971).
- Liu, X., Pimm, M. L., Haarer, B., Brawner, A. T., Henty-Ridilla, J. L. Biochemical characterization of actin assembly mechanisms with ALS-associated profilin variants. European Journal of Cell Biology. 101 (2), 151212 (2022).
- Pimm, M. L., Liu, X., Tuli, F., Lojko, A., Henty-Ridilla, J. L. Visualizing functional human profilin in cells and in vitro applications. bioRxiv. , (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유