Method Article
Visualizando a dinâmica de acoplamento de actina e microtúbula in vitro por microscopia de fluorescência interna total (TIRF)
Neste Artigo
Resumo
Este protocolo é um guia para visualizar actina dinâmica e microtúbulos usando um ensaio de microscopia de fluorescência interna total in vitro (TIRF).
Resumo
Tradicionalmente, os citoesqueletos de actina e microtúbulos têm sido estudados como entidades separadas, restritos a regiões ou processos celulares específicos, e regulados por diferentes suítes de proteínas vinculantes únicas para cada polímero. Muitos estudos agora demonstram que a dinâmica de ambos os polímeros citoesqueléticos estão entrelaçadas e que este crosstalk é necessário para a maioria dos comportamentos celulares. Várias proteínas envolvidas nas interações actina-microtúbulos já foram identificadas (ou seja, Tau, MACF, GAS, formins e muito mais) e são bem caracterizadas apenas no que diz respeito à actina ou aos microtúbulos. No entanto, relativamente poucos estudos mostraram ensaios de coordenação actin-microtúbulo com versões dinâmicas de ambos os polímeros. Isso pode ocluir mecanismos de ligação emergentes entre actina e microtúbulos. Aqui, uma técnica de microscopia in vitro baseada em microscopia interna (TIRF) permite a visualização da dinâmica de actina e microtúbula a partir de uma reação bioquímica. Esta técnica preserva a dinâmica de polimerização de filamentos de actina ou microtúbulos individualmente ou na presença do outro polímero. A proteína Tau comercialmente disponível é usada para demonstrar como os comportamentos de actina-microtúbula mudam na presença de uma proteína citoesqueletal clássica de crosslinking. Este método pode fornecer insights funcionais e mecanicistas confiáveis sobre como as proteínas reguladoras individuais coordenam a dinâmica actin-microtúbula em uma resolução de filamentos únicos ou complexos de alta ordem.
Introdução
Historicamente, actina e microtúbulos têm sido vistos como entidades separadas, cada uma com seu próprio conjunto de proteínas regulatórias, comportamentos dinâmicos e locais celulares distintos. Evidências abundantes agora demonstram que polímeros de actina e microtúbulos se envolvem em mecanismos funcionais de crosstalk que são essenciais para executar numerosos processos celulares, incluindo migração, posicionamento de fuso místico, transporte intracelular e morfologiacelular 1,2,3,4. Os diversos comportamentos coordenados que fundamentam esses exemplos dependem de um intrincado equilíbrio de fatores de acoplamento, sinais e propriedades físicas. No entanto, os detalhes moleculares que sustentam esses mecanismos ainda são amplamente desconhecidos porque a maioria dos estudos se concentra em um único polímero citoesquelético de cada vez 1,2,5.
Actina e microtúbulos não interagem diretamente 6,7,8. A dinâmica coordenada de actina e microtúbulos vistos nas células é mediada por fatores adicionais. Muitas proteínas pensadas para regular o crosstalk actin-microtúbulo foram identificadas e suas atividades são bem caracterizadas no que diz respeito a qualquer polímero citoesquelético apenas 1,2. Evidências crescentes sugerem que essa abordagem de polímero único escondeu as duas funções de algumas das proteínas/complexos que permitem eventos de acoplamento actin-microtúbulo 7,8,9,10,11,12,13. Experimentos onde ambos os polímeros estão presentes são raros e muitas vezes definem mecanismos com um único polímero dinâmico e versão estabilizada estática dos outros 6,8,9,10,11,14,15,16,17,18 . Assim, são necessários métodos para investigar as propriedades emergentes das proteínas coordenadoras de actin-microtúbulos que só podem ser totalmente compreendidas em sistemas experimentais que empregam ambos os polímeros dinâmicos.
A combinação de abordagens diretas de rotulagem de proteínas, etiquetas de afinidade geneticamente codificadas e microscopia total de fluorescência interna (TIRF) tem sido aplicada com grande sucesso em sistemas de reconstituição biomimética 19,20,21,22,23. Muitos esquemas de baixo para cima não contêm todos os fatores que regulam proteínas nas células. No entanto, a tecnologia "bioquímica em um óculos de cobertura" refinou muitos mecanismos de dinâmica de actina e microtúbulos em altas escalas espaciais e temporais, incluindo os componentes necessários para montagem ou desmontagem de polímeros, e movimento de proteína motora 5,12,23,24,25,26,27 . Aqui é descrita uma abordagem de filamento único de componente mínimo para investigar o acoplamento actin-microtúbulo in vitro. Este protocolo pode ser usado com proteínas purificadas comercialmente disponíveis ou altamente puras, proteínas fluorescentes rotuladas, câmaras de perfusão e estendidas a esquemas mais complicados contendo extratos celulares ou sistemas sintéticos. Aqui, a proteína Tau comercialmente disponível é usada para demonstrar como a dinâmica citoesquelletal muda na presença de uma proteína de acoplamento actin-microtúbulo, mas pode ser substituída por outros fatores coordenadores putative actin-microtubula. A maior vantagem deste sistema em relação a outras abordagens é a capacidade de monitorar simultaneamente a dinâmica de múltiplos polímeros citoesqueléticos em uma reação. Este protocolo também fornece aos usuários exemplos e ferramentas simples para quantificar alterações em polímeros citoesqueléticos. Assim, os usuários do protocolo produzirão dados confiáveis, quantitativos e de resolução de filamentos únicos para descrever mecanismos que fundamentam a forma como diversas proteínas regulatórias coordenam a dinâmica actin-microtúbula.
Protocolo
1. Lavar as tampas
NOTA: Lavar (24 mm x 60 mm, #1,5) cobre clipes de acordo com Smith et al., 201328.
- Disponha as tampas em um recipiente de e-mail de slides de plástico.
- Submerge desliza sequencialmente nas seguintes soluções e sonicato por 30-60 min, enxaguando com ddH2O 10 vezes entre cada solução: ddH2O com uma gota de sabão de prato; 0,1 M KOH. A loja cobre deslizamentos em 100% de etanol por até 6 meses.
NOTA: Não toque em superfícies de vidro com dedos sem amor. Use fórceps em vez disso.
2. Revestimento limpo (24 mm x 60 mm, #1,5) tampas com mPEG- e biotina-PEG-silane
NOTA: Este protocolo usa especificamente um sistema biotina-streptavidina para posicionar actina e microtúbulos dentro do plano de imagem TIRF. Outros revestimentos e sistemas podem ser usados (por exemplo, anticorpos, poli-L-lysine, MIosina NEM, etc.).
- Descongelar alíquotas de pó de silano PEG-silano e biotina-PEG-silano.
- Dissolver os pós PEG em 80% de etanol (pH 2.0) para gerar soluções de estocagem de revestimento de 10 mg/mL mPEG-silane e 2-4 mg/mL biotina-PEG-silane, pouco antes do uso.
NOTA: Os pós PEG geralmente aparecem dissolvidos, mas podem não estar no nível microscópico. A ressuspensão adequada leva ~1-2 min com tubulação constante. Os usuários são encorajados a pipeta mais 10 vezes após o aparecimento da dissolução do pó.
ATENÇÃO: Use luvas para proteger a pele do HCl concentrado ao fazer 80% de etanol (pH 2.0). - Remova a tampa limpa (24 mm x 60 mm, #1.5) do armazenamento do etanol usando fórceps. Seque com gás nitrogênio e guarde em uma placa de Petri limpa.
- Tampas de revestimento com 100 μL de solução de revestimento: uma mistura de 2 mg/mL mPEG-silane (MW 2.000) e 0,04 mg/mL biotina-PEG-silane (MW 3.400) em 80% etanol (pH 2.0).
NOTA: Para revestimento esparso (recomendado) utilize 2 mg/mL mPEG-silane e 0,04 mg/mL biotina-PEG-silane. Para revestimento denso use 2 mg/mL mPEG-silane, 4 mg/mL biotin-PEG-silane. - Incubar tampas a 70 °C por pelo menos 18 h ou até o uso.
NOTA: As tampas revestidas degradam-se se armazenadas a 70 °C por mais de 2 semanas.
3. Montagem de câmaras de fluxo de imagem
- Corte 12 tiras de fita dupla faceda para um comprimento de 24 mm. Remova um lado do suporte da fita e corrija pedaços de fita adjacentes às seis ranhuras presentes em uma câmara de imagem limpa.
NOTA: A fita deve ser plana para o bom conjunto, caso contrário, as câmaras de imagem vazarão. Remova cuidadosamente o apoio da fita para evitar solavancos. Recomenda-se câmaras de corte deslizantes em uma superfície limpa para suavizar contatos de câmara de fita. - Remova o segundo pedaço de suporte da fita para expor o lado pegajoso da fita ao longo de cada ranhura da câmara. Coloque a fita da câmara de lado em uma superfície limpa.
- Misture as soluções de resina epóxi e endurecedor 1:1 (ou de acordo com as instruções do fabricante) em um pequeno barco de pesagem.
- Use uma ponta P1000 para colocar uma gota de epóxi misto entre as tiras de fita no final de cada ranhura de câmara de imagem (seta vermelha; Figura 1A). Coloque a fita da câmara/o lado epóxi em uma superfície limpa.
- Remova uma mancha revestida da incubadora de 70 °C. Enxágüe superfícies revestidas e não revestidas de tampas com ddH2O seis vezes, seque com gás nitrogênio filtrado e, em seguida, afixe na câmara de imagem com o lado de revestimento de deslizamento de tampa em direção à fita.
- Use uma ponta de pipeta P200 ou P1000 para aplicar pressão na interface de vidro de fita para garantir um bom selo entre a fita e o deslizamento de tampa.
NOTA: Com um selo adequado, a fita de dupla face torna-se translúcida. Câmaras de imagem sem contatos suficientes de câmara de fita vazarão. - Incubar câmaras montadas à temperatura ambiente por pelo menos 5-10 minutos para permitir que o epóxi veda totalmente os poços de câmara antes de usar. As câmaras de perfusão expiram dentro de 12-18 h de montagem.
NOTA: Dependendo da colocação da fita e da espessura da fita de dupla face utilizada, a câmara montada terá um volume final de 20-50 μL.
4. Condicionamento de câmaras de perfusão
- Use uma bomba de perfusão (taxa definida para 500 μL/min) para trocar sequencialmente soluções de condicionamento na câmara de perfusão da seguinte forma:
- Flua 50 μL de 1% BSA para preparar a câmara de imagem. Remova o excesso de tampão do reservatório de encaixe do bloqueio Luer.
- Fluxo 50 μL de 0,005 mg/mL streptavidin. Incubar por 1-2 min em temperatura ambiente. Remova o excesso de tampão do reservatório.
- Flua 50 μL de 1% BSA para bloquear a vinculação não específica. Incubar para 10-30 s. Remova o excesso de tampão do reservatório.
- Fluxo 50 μL de tampão de TIRF quente (37 °C) 1x (1x BRB80, 50 mM KCl, 10 mM DTT, 40 mM de glicose, 0,25% (v/v) metilcelulose (4.000 cp)).
NOTA: Não remova o excesso de tampão do reservatório. Isso impede que a câmara seque, o que pode introduzir bolhas de ar no sistema. - Opcional: Fluxo 50 μL de sementes de microtúbulo estabilizadasde 29 e 50% biotiniladas diluídas em 1x tampão TIRF.
NOTA: A diluição adequada deve ser determinada empiricamente e conter a variabilidade do lote. Protocolos a partir de27,29 são recomendados como pontos de partida. Uma diluição que produz 10-30 sementes por campo de visão funciona bem com esta configuração.
5. Preparação do microscópio
NOTA: As reações bioquímicas contendo filamentos e microtúbulos dinâmicos são visualizadas/realizadas usando um microscópio de Fluorescência De Reflexão Interna Total (TIRF) invertido equipado com lasers de estado sólido de 120-150 mW, um objetivo de imersão de óleo de 63x corrigido por 63x e uma câmera EMCCD. As proteínas neste exemplo são visualizadas nos seguintes comprimentos de onda: 488 nm (microtúbulos) e 647 nm (actina).
- Configure o dispositivo de aquecimento estágio/objetivo para manter 35-37 °C pelo menos 30 minutos antes de fotografar a primeira reação bioquímica.
- Defina os parâmetros de aquisição de imagem da seguinte forma:
- Definir intervalo de aquisição para cada 5 s para 15-20 min.
- Ajuste 488 e 647 exposições a laser a 50-100 ms com 5%-10% de potência. Defina o ângulo TIRF apropriado para microscópio.
NOTA: Independentemente da configuração do microscópio, a maneira mais simples de definir a potência do laser, exposição e ângulo TIRF é fazer ajustes em imagens apenas de polímeros (ver 5.2.2.1 e 5.2.2.2, abaixo). Os usuários são fortemente encorajados a usar as configurações de menor potência e exposição a laser que ainda permitem a detecção.- Ajuste a reação de polimerização (Figura 1C) para iniciar a montagem do filamento actin e adquirir imagens a 647 nm. Faça os ajustes apropriados.
- Ajuste a reação de polimerização em um segundo poço de perfusão condicionado para iniciar o conjunto de microtúbulos (Figura 1C) e visualize a 488 nm. Faça os ajustes apropriados.
6. Preparação de misturas de reação proteica
- Prepare a solução de estoque de tubulina fluorescentemente rotulada.
- Determine a concentração de tubulina não rotulada caseira através de espectrofotometria no Abs280, da seguinte forma:
- Espectrofotômetro em branco com 1xBRB80 sem GTP.
- Calcule a concentração de tubulina utilizando o coeficiente de extinção determinado de 115.000 M-1 cm-1 e a seguinte fórmula:
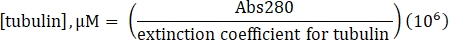
- Resuspend comercialmente fabricado lyophilized lysine-label 488-tubulin a 10 μM (1 mg/mL; 100% de rótulo) com 20 μL de 1x BRB80 carente de GTP.
- Descongele uma alíquota de 7,2 μL de 100 μM de tubulina recicladasem rótulo 29 no gelo.
NOTA: A tubulina reciclada é fundamental para o sucesso da montagem de microtúbulos in vitro porque remove dimers incompetentes de polimerização formados em estoques de proteínas congeladas29,30. - Combine 3 μL de 10 μM 488-tubulin com a alíquota de 7,2 μL de 100 μM de tubulina sem rótulo, não mais do que 15 minutos antes do uso.
- Determine a concentração de tubulina não rotulada caseira através de espectrofotometria no Abs280, da seguinte forma:
- Prepare a solução de estoque de actina fluorescentemente rotulada.
- Para proteínas caseiras, determine a concentração e o rótulo percentual de actina via espectrofotometria Abs290 e Abs650, da seguinte forma:
- Espectrofotômetro em branco com tampão G.
- Calcule a concentração de actina não rotulada utilizando o coeficiente de extinção determinado de 25.974 M-1 cm-1 e a seguinte fórmula:
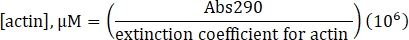
- Calcule a concentração de lisina rotulada Alexa-647-actin usando o coeficiente de extinção de actina não rotulada, o fator de correção do fluor de 0,03 e a seguinte fórmula:
[Alexa-647 actin], μM = (Abs290 -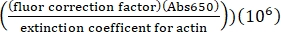
- Calcule o rótulo percentual de Alexa-647-actin usando o ε determinado para Alexa-647 de 239.000 M-1 cm-1, da seguinte forma:
% rótulo de Alexa-647-actin = (Abs290 - (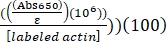
- Descongele uma alíquota de 2 μL de 3 μM 100% rotulada biotina-actina (rotulada em resíduos de lisina). Diluir 10 vezes adicionando 18 μL de buffer G.
- Combine 3 μL de actina biotinilada diluída, volumes apropriados de actina não rotulada e rotulada (acima) de forma que a mistura final será de 12,5 μM actin total com 10%-30% de rótulo fluorescente.
NOTA: Maiores de 30% de monômeros fluorescentes (finais) podem comprometer a resolução de imagens à medida que filamentos se tornam difíceis de discernir a partir do fundo.
- Para proteínas caseiras, determine a concentração e o rótulo percentual de actina via espectrofotometria Abs290 e Abs650, da seguinte forma:
- Prepare misturas de reação (Figura 1C).
- Prepare a mistura de citoesqueleto (Tubo A) combinando 2 μL do estoque de actin de 12,5 μM (6,2,3) com o mix de calção de tubulina (6.1.4), não mais do que 15 minutos antes da imagem. Guarde no gelo até o uso.
- Prepare a mistura de reação proteica (Tubo B) combinando todos os outros componentes e proteínas experimentais, incluindo: tampão de TIRF 2x, anti-alvejante, nucleotídeos, tampões e proteínas acessórias. Um exemplo é mostrado na Figura 1C.
NOTA: A diluição final resulta em um buffer de TIRF 1x que contém ATP, GTP e força iônica dentro da faixa fisiológica estimada.
- Incubar tubo A e tubo B separadamente a 37 °C para 30-60 s. Para iniciar a reação, misture e adicione o conteúdo do tubo B ao tubo A (abaixo).
7. Dinâmica de actina de imagem e microtúbulos
- Condição perfusão bem (Figura 1B; passo 4, acima).
- Inicie a actina e o conjunto de microtúbulos simultaneamente adicionando o conteúdo do tubo B (mix de reação) ao tubo A (mistura de citoesqueleto) (Figura 1C).
- Fluxo 50 μL de reação contendo 1x tampão TIRF suplementado com tubulina livre de 15 μM, 1 mM GTP e 0,5 μM de monômeros de actina e volumes apropriados de controles tampão.
- Gravar filme com lapso de tempo usando software de microscópio para adquirir cada 5 s por 15-20 min.
NOTA: O início da dinâmica da actina e dos microtúbulos ocorre dentro de 2-5 min (Figura 2). Atrasos mais longos indicam problemas com controle de temperatura ou problemas relacionados à concentração de proteínas na mistura de reação. - Condicionar um novo poço de perfusão (etapa 4) e substituir o volume tampão por proteínas regulatórias de interesse (ou seja, Tau) e controles tampão (Figura 1C). Adquira conforme descrito na etapa 7 (acima) para avaliar proteínas regulatórias para funções emergentes de actina-microtúbula.
8. Processar e analisar imagens usando o software FIJI31
- Abra filmes TIRF salvos e veja como um composto.
- Analisar a dinâmica dos microtúbulos (Figura 3A), da seguinte forma:
- Gere uma projeção Z máxima baseada no tempo a partir do menu de pilhas de imagens.
- Sincronizar a janela de projeção Z com o filme TIRF original do menu Analyze> Tools> Sincronizar o Windows .
- Desenhe uma linha usando a ferramenta em linha reta ao longo de um microtúbulo de interesse na imagem projetada no tempo.
- Abra o gerente da região de interesse (ROI) a partir do menu de análise (Analyze> Tools> Gerente de ROI).
- Salve locais de microtúbulos individuais pressionando "t". Repita para todos os microtúbulos de interesse.
- Plote kymographs de linhas selecionadas usando "/" ou execute a macro multi-kymo que gera um vídeo e um kymograph para cada microtúbulo no gerenciador de ROI31.
- Adicione barras de comprimento (μm) e tempo (min) a kymografos do menu de barras Analyze> Tools> Scale .
- Medir as velocidades de crescimento de microtúbulos a partir de encostas de kymógrafo (Figura 3A, 1-2; inclinação de linhas pretas).
- Conte eventos dinâmicos de microtúbulos (catástrofe ou recrescimento) do kymógrafo gerado ou utilizando macros de análise disponíveis 5,8,18,25. Linhas pontilhadas vermelhas na Figura 3A, 1-2 representam eventos de catástrofe/desmontagem rápida.
- Analisar a dinâmica actin (Figura 3B), da seguinte forma:
- Medir a nucleação de actina, da seguinte forma:
- Conte o número de filamentos actin presentes no campo de visão 100 s após o início da reação e expresso pela área (filamentos por μm2).
- Registo e salve dados no gerenciador de ROI, conforme a etapa 8.2.3.1, acima.
- Medir taxas de alongamento de filamentos (Figura 3B), da seguinte forma:
- Desenhe uma linha ao longo de um filamento actin de interesse usando a ferramenta de linha segmentada.
- Adicione linha ao gerenciador de ROI como na etapa 8.2.3.1, acima.
- Repita seguindo a linha (adicionando cada medição ao gerenciador de ROI) por pelo menos quatro quadros de filme.
NOTA: Recomenda-se medir de sete a oito quadros consecutivos, porém algumas condições retardam a polimerização da actina abaixo do limite detectável que pode ser resolvida por configurações objetivas/microscópios. Nesse caso, as medições podem ser feitas em intervalos regulares sobre quadros não consecutivos (por exemplo, a cada cinco quadros). - Plot mediu valores de comprimento ao longo do tempo decorrido. A inclinação da linha gerada é a taxa de alongamento de actina em microns/s.
- Transmitir taxas calculadas finais como subunidades s-1 μM-1 utilizando um fator de correção de 370 subunidades para contabilizar o número de monômeros de actina em um mícndo de filamento32.
- Medir a nucleação de actina, da seguinte forma:
- Realizar análises correlativas para regiões de associação atuaria-microtúbula paralela (Figura 3C), da seguinte forma:
- Desenhe uma linha ao longo de um microtúbulo de interesse em um ponto de tempo específico (ou seja, 300 s após o início da reação), usando a ferramenta de linha reta.
- Adicione linha ao gerenciador de ROI como na etapa 8.2.3.1, acima.
- Plote a intensidade da fluorescência ao longo da linha em cada canal.
- Selecione cada canal com o controle deslizante de imagem e plote as intensidades ao longo da linha usando "command k".
- Salvar ou exportar valores clicando no botão "listar" na janela de saída.
- Eventos expressos de acoplamento actin-microtúbulo como uma razão (actin sobreposto com microtúbulos) de eventos individuais ou como uma contagem de eventos em um determinado campo de visão em um ponto de tempo consistente (Figura 3C).
- Alternativa: Use software para determinar a sobreposição percentual de ambos os canais 5,12.
- Desenhe uma linha ao longo de um microtúbulo de interesse em um ponto de tempo específico (ou seja, 300 s após o início da reação), usando a ferramenta de linha reta.
Resultados
Com as condições descritas acima (Figura 1), os polímeros actin e microtúbulos devem ser visíveis (e dinâmicos) dentro de 2 min de aquisição de imagem (Figura 2). Como em qualquer protocolo baseado em bioquímica, a otimização pode ser necessária para diferentes proteínas regulatórias ou lotes de proteínas. Por essas razões, o ângulo TIRF e as exposições de imagem são definidos primeiro com reações contendo cada polímero individual. Isso confirma que as proteínas armazenadas são funcionais e proteínas rotuladas suficientes estão presentes para detecção. Embora nem sempre seja necessário (e não realizado aqui), o pós-processamento de filmes (ou seja, subtração de fundo, média ou transformações de Fourier) pode ser usado para melhorar o contraste da imagem (particularmente de microtúbulos)5,25,33. A visualização direta de filamentos e microtúbulos de actina único proporcionado por este ensaio apoia a determinação quantitativa de várias medidas dinâmicas para componentes citoesqueletos sozinhos ou juntos, incluindo parâmetros de polimerização (ou seja, taxa de nucleação ou alongamento), parâmetros de desmontagem (ou seja, taxas de encolhimento ou eventos de catástrofe) e coalignamento/sobreposição de polímeros (Figura 3 ). Além disso, essas medidas podem ser utilizadas como ponto de partida para decifrar a vinculação ou influência de ligantes regulatórios como Tau (Figura 3). Muitas medidas de filamentos ou microtúbulos de actin único podem ser feitas a partir de um filme TIRF. No entanto, devido a variações no revestimento de deslizamento de tampas, pipetação e outros fatores, as medidas confiáveis também devem incluir múltiplas reações/filmes de replicação técnica.
Muitas facetas da dinâmica dos microtúbulos podem ser determinadas a partir de címógrafos, incluindo a taxa de alongamento de microtúbulos, bem como a frequência de eventos de catástrofe e resgate (Figura 3A). O uso de kymógrafos para medir a dinâmica da actina neste sistema não é tão simples porque os filamentos de actin são mais complicados do que os microtúbulos. Como consequência, parâmetros da dinâmica do filamento actin são medidos manualmente, o que é demorado e intensivo em mão de obra. As contagens de núcleos são medidas como o número de filamentos actin presentes em um ponto de tempo consistente para todas as condições. Essas contagens variam amplamente entre os campos de imagem TIRF, mas podem ser usadas com muitas réplicas ou para complementar observações de outros ensaios de polimerização. As contagens de nucleação também podem ser usadas para microtúbulos se as condições de ensaio não forem sementes estabilizadas de microtúbulos. As taxas de alongamento de filamento actina são medidas como o comprimento do filamento ao longo do tempo de pelo menos quatro quadros de filme. Os valores da taxa são transmitidos por atolar micromolar com fator de correção de 370 subunidades para contabilizar o número de monômeros de actina em um mícndo de filamento (Figura 3B)32. As medidas para definir os comportamentos coordenados entre actina e microtúbulos são menos bem definidas. No entanto, análises correlativas foram aplicadas para medir a coincidência de ambos os polímeros, incluindo varreduras de linha (Figura 3C) ou sobreposição de software 5,11,34.
Disponibilidade de dados:
Todos os conjuntos de dados associados a este trabalho foram depositados no Zenodo e estão disponíveis com solicitação razoável em: 10.5281/zenodo.6368327.
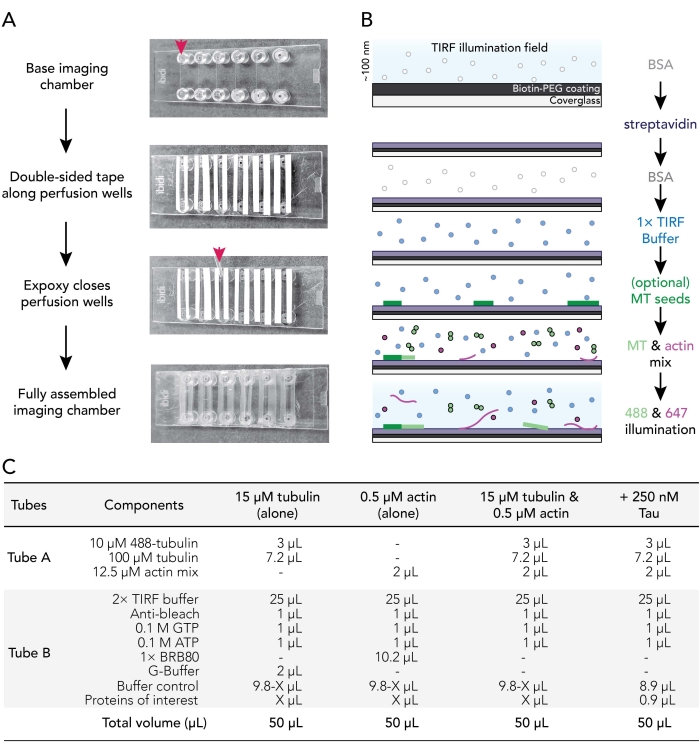
Figura 1. Esquemas experimentais: montagem da câmara de fluxo para aquisição de imagens. (A) Montagem da câmara de imagem. De cima para baixo: as câmaras de imagem IBIDI são coladas ao longo de poços de perfusão (denotadas por seta); a segunda camada (branca) de apoio à fita (deixada na imagem mostrada para usuários de melhor orientação) é removida e epóxi é aplicado na borda da câmara de perfusão (seta). Nota: Para orientar mais facilmente os usuários onde colocar o epóxi, o apoio branco foi deixado nesta imagem. O deslizamento de cobertura limpo e revestido é anexado à câmara de imagem com o lado do revestimento voltado para o interior do poço de perfusão. (B) Fluxograma ilustrando as etapas para condicionar câmaras de imagem para ligações biotina-streptavidina. (C) Exemplos de reações utilizadas para adquirir filmes TIRF de microtúbulos dinâmicos e filamentos de actin. Clique aqui para ver uma versão maior desta figura.
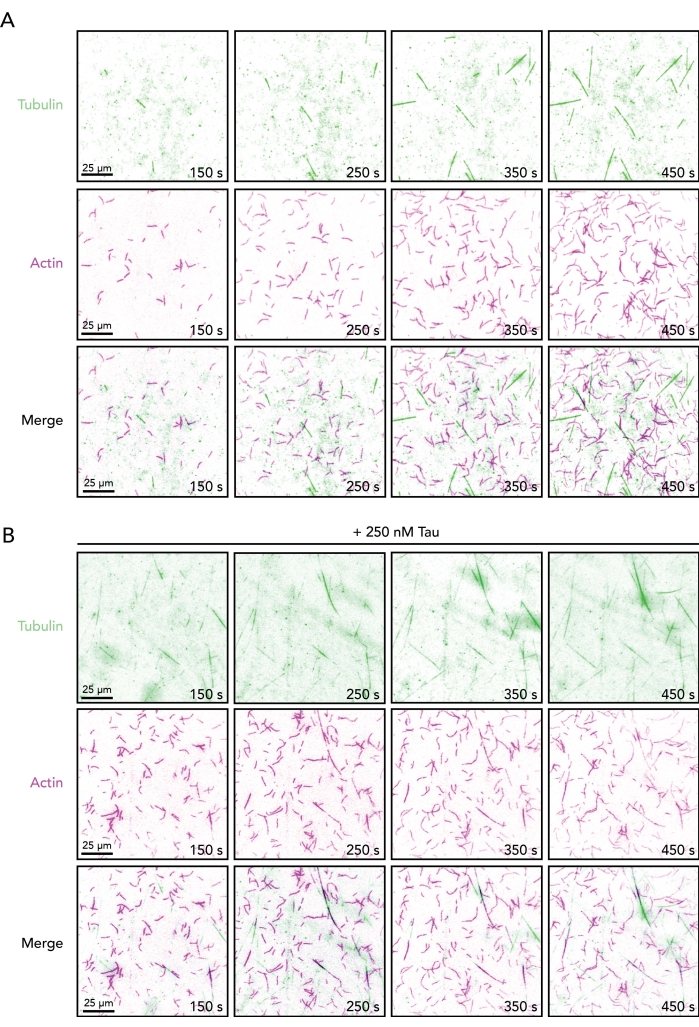
Figura 2. Sequências de imagens de filamentos e microtúbulos de actina crescentes na ausência ou presença de Tau. Montagem de imagem de lapso de tempo de ensaios TIRF contendo 0,5 μM actin (10% Alexa-647-actin e 0,09% biotina-actina rotulada) e 15 μM tubulina livre (4% HiLyte-488 rotulado) na ausência (A) ou presença (B) de 250 nM Tau. O tempo decorrido da iniciação da reação (mistura do tubo A e do tubo B) é mostrado. Barras de escala, 25 μm. Clique aqui para ver uma versão maior desta figura.
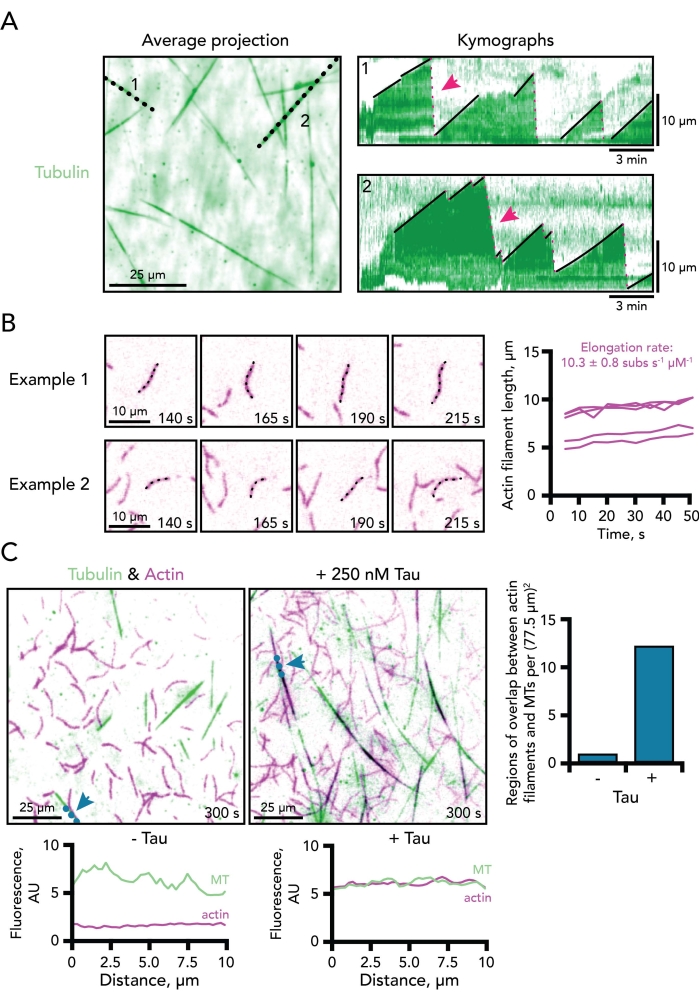
Figura 3. Exemplo de medições de microtúbulos e dinâmicas de filamentos actin. (A) A projeção de tempo médio do canal tubulina visualiza eficientemente os comprimentos totais de microtúbulos para as varreduras de linha usadas para gerar gráficos de kymograph. Linhas pontilhadas pretas correspondem aos dois exemplos de microtúbulos dinâmicos mostrados à direita. As fases de crescimento (linhas pretas sólidas) e desmontagem (linhas rosas pontiatadas; duas denotadas com setas rosas) de microtúbulos são mostradas em cada kymograph. Barra de escala de tempo, 3 min. Barra de escala de comprimento, 10 μm. A reação contém 0,5 μM de actina (10% 647 rótulos) e 15 μM de tubulina livre (4% 488-HiLyte). Apenas o canal tubulin é mostrado. (B) Duas montagens de imagens de lapso de tempo que retratam filamentos de ato único ativamente polimerizando. As taxas de alongamento são calculadas como a inclinação de parcelas do comprimento dos filamentos de actina ao longo do tempo por actina micromolar. Assim, um fator de correção de dois deve ser aplicado a reações de actina de 0,5 μM para comparação para taxas tipicamente determinadas na concentração de actina de 1 μM. Exemplos de cinco filamentos são mostrados à direita. Barras de escala, 10 μm. A reação contém 0,5 μM de actina (10% 647 rótulos) e 15 μM de tubulina livre (4% 488-HiLyte). Apenas o canal actin é mostrado. (C) Imagens TIRF de microtúbulos dinâmicos (MT) (verde) e filamentos de actina (roxo) polimerizando na ausência (esquerda) ou presença de 250 nM Tau (meio). Linhas pontilhadas azuis e setas marcam onde uma linha foi desenhada para os gráficos de varredura de linha correspondentes a cada condição (abaixo de cada imagem). A sobreposição entre microtúbulos e regiões de actina (mostrada como preta) pode ser pontuada em um ponto de tempo definido por área (à direita). Barras de escala, 25 μm. As reações contêm actina 0,5 μM (10% 647 rótulos) e 15 μM de tubulina livre (4% 488-HiLyte) com ou sem 250 nM Tau. Clique aqui para ver uma versão maior desta figura.
Discussão
O uso da microscopia de reflexão interna total (TIRF) para proteínas purificadas visualizadas tem sido uma abordagem frutífera e convincente para dissecar mecanismos únicos de regulação citoesquelética 5,23,24,25,26,27,35. Em comparação com os ensaios bioquímicos tradicionais, as reações de TIRF requerem volumes muito pequenos (50-100 μL), e medições quantitativas da dinâmica citoesquelética podem ser obtidas a partir de um ensaio individual. A maioria dos estudos da dinâmica citoesquelético se concentra em um único sistema de polímero (ou seja, filamentos de actina ou microtúbulos), assim medições detalhadas do crosstalk ou comportamentos emergentes entre filamentos de actina e microtúbulos tipicamente vistos em células têm permanecido evasivos e difíceis de recapitular no tubo de ensaio. Para resolver esse problema, este protocolo descreve um sistema de microscopia TIRF de filamento único que permite a visualização direta de polímeros dinâmicos de actina e microtúbulos na mesma reação bioquímica. Assim, esse método vai além dos ensaios tradicionais que recapitulam o comportamento dinâmico de filamentos ou microtúbulos actin. Esta técnica também foi realizada com Tau como um exemplo de como várias propriedades dinâmicas mudam na presença de um fator de acoplamento de citoesqueleto. Este protocolo pode ser usado com proteínas adicionais conhecidas ou suspeitas de coordenar dinâmicas de actina ou microtúbulos, incluindo (mas não se limitando a) MACF, GAS, formins e muito mais. Finalmente, desde que as análises de exemplo possam ser usadas como um guia para quantificar os dados adquiridos com este protocolo.
"Ver é acreditar" é uma razão convincente para realizar ensaios baseados em microscopia. No entanto, é necessário cautela na execução e interpretação dos experimentos de microscopia da TIRF. Um grande desafio dos ensaios de comontagem citoesquelético é que muitas condições de imagem comumente usadas não são compatíveis com cada polímero. Microtúbulos e actinas normalmente têm diferentes requisitos de tampão, temperatura, sal, nucleotídeo e concentração para polimerização. Actin, tubulin, proteínas regulatórias de interesse, e os buffers utilizados neste protocolo são sensíveis a ciclos de congelamento. Portanto, o manuseio cuidadoso de proteínas e tampões é necessário para executar com sucesso este protocolo. Para aliviar muitas dessas preocupações, o uso de tubulina recém-reciclada (congelada por <6 semanas) e actinas pré-limpadas congeladas/resuspended via ultracentrifugação é fortemente recomendado. Essas considerações também se aplicam à miríade de proteínas regulatórias a serem avaliadas com este procedimento, que pode ser sensível aos ciclos de congelamento ou à concentração de sais tampão 5,11,36.
Infelizmente, não existe um tampão de tamanho único sem trocas experimentais. Para se apropriar de mais volume para proteínas de menor concentração, ATP e GTP podem ser incluídos na solução tampão TIRF 2x (Figura 1C). No entanto, como esses nucleotídeos são extremamente sensíveis aos ciclos de congelamento, não é recomendado. Os compostos de limpeza de oxigênio utilizados aqui (ou seja, catalase e glicose-oxidase) são necessários para visualizar proteínas por longos períodos de tempo (minutos a horas), mas são conhecidos por restringir a polimerização de microtúbulos em altas concentrações5. Em relação a essas considerações tampão, uma limitação deste protocolo é que algumas proteínas regulatórias associadas a microtúbulos canônicos podem exigir mais ou menos sal para recapitular funções encontradas em células ou ensaios usando microtúbulos sozinhos (sem actina). Mudar a natureza ou concentração de sal para lidar com essas preocupações provavelmente influenciará as taxas de polimerização de filamentos de actina e/ou parâmetros da dinâmica do microtúbulo. Medidas de múltiplos parâmetros descritivos (minimamente, nucleação, taxas de alongamento e estabilidade) (Figura 3) são necessárias para confirmar o sucesso do protocolo ou documentar explicitamente os efeitos de buffers específicos ou proteínas regulatórias. Por exemplo, a polimerização de filamento de actina pode obscurecer eventos de acoplamento actin-microtúbulo em segundos. Consequentemente, o ajuste fino das condições experimentais, reduzindo a concentração geral de actina ou incluindo proteínas adicionais para suprimir a nucleação de actina (ou seja, profilin) estenderá o período global que as atividades coordenadas de actin-microtúbulos podem ser vistas claramente. Os controles que abordam esses pré-requisitos e as réplicas técnicas (além de vários campos de visão) são fundamentais para que os usuários gerem resultados confiáveis e reprodutíveis.
Estudos baseados em células oferecem oportunidade limitada para observar relações diretas proteína-proteína ou a ação de complexos regulatórios. Em contraste, alguns dos mecanismos obtidos a partir de ensaios in vitro nem sempre refletem os comportamentos exatos das proteínas vistas nas células. Este dilema bioquímico clássico pode ser abordado em aplicações futuras desta técnica com modificações específicas. Por exemplo, adicionar proteínas de acoplamento fluorescentes funcionais expande esse método de estudos de filamento único para estudos de molécula única. Os ensaios podem ser modificados para usar extratos celulares que podem adicionar os fatores-chave desconhecidos "ausentes" necessários para recapitular fenômenos semelhantes a células. Por exemplo, ensaios baseados em TIRF que empregam extratos de levedura ou Xenopus têm anéis de actomiosina constituídos37, fusos mitotísticos26,38, componentes da montagem de actina ou microtúbula39,40, e até mesmo dinâmicas nos centros e cinetochores36,41, 42,43 . Além disso, tais sistemas podem abrir caminho para sistemas celulares artificiais que tenham lipídios ou fatores de sinalização presentes 44,45,46.
Divulgações
Não há conflitos de interesse para revelar.
Agradecimentos
Sou grato a Marc Ridilla (Repair Biotechnologies) e Brian Haarer (SUNY Upstate) por comentários úteis sobre este protocolo. Este trabalho contou com o apoio dos Institutos Nacionais de Saúde (GM133485).
Materiais
| Name | Company | Catalog Number | Comments |
| 1% BSA (w/v) | Fisher Scientific | BP1600-100 | For this purpose (blocking TIRF chambers), BSA is resuspended in ddH20 and filtered through a 0.22 µm filter. |
| 1× BRB80 | Homemade | 80 mM PIPES, 1 mM MgCl2, 1 mM EGTA, pH 6.8 with KOH | |
| 10 mg/mL (1000 U) glucose oxidase | Sigma Aldrich Inc, St. Louis, MO | G2133-50KU | Combined with catalase, aliquot and store at -80 oC until use |
| 100 µM tubulin | Cytoskeleton Inc, Denver, CO | T240 | Homemade tubulins should be recycled before use to remove polymerization-incompetent tubulin (Hyman et al. (1992)29; Li and Moore (2020)30). Commercially available tubulins are often too dilute to recycle, but function well if resuspended according to manufacturer’s instructions and pre-cleared via ultracentrifugation (278,000 × g) for 60 min, before use. |
| 100 mM ATP | Gold Biotechnology Inc, Olivette, MO | A-081 | Resuspended in ddH20 (pH 7.5) and filter sterilized. |
| 100 mM GTP | Fisher Scientific | AC226250010 | Resuspended in 1× BRB80 (pH 6.8) and filter sterilized. |
| 120-150 mW solid-state lasers | Leica Microsystems | 11889151; 11889148 | |
| 2 mg/mL catalase | Sigma Aldrich Inc, St. Louis, MO | C40-100 | Combined with glucose oxidase, aliquot and store at -80 oC until use |
| 2× TIRF buffer | Homemade | 2× BRB80, 100 mM KCl, 20 mM DTT, 80 mM glucose, 0.5% (v/v) methylcellulose (4,000 cp); Note: 1 µL of 0.1M GTP and 1 µL of 0.1M ATP added separately to TIRF reactions to avoid repeated freeze-thaw cycles. | |
| 24 × 60 mm, #1.5 coverglass | Fisher Scientific, Waltham, MA | 22-266882 | Coverglass must be extensively washed before use (Smith et al. (2014)22) |
| 37 oC heatblock | |||
| 37 oC water bath | |||
| 5 mg/mL Streptavidin (600x stock) | Avantor, Philadelphia, PA | RLS000-01 | Resuspended in Tris-HCl (pH 8.8); dilute the aliquot to 1× in HEK buffer on day of use |
| 5 min Epoxy resin and hardener | Loctite, Rocky Hill, CT | 1365736 | Combined resin and hardener may take up to 30 min to cure. |
| 50% biotinylated-GpCpp microtubule seeds | Cytoskeleton Inc; Homemade | T333P | (optional) GppCpp or Taxol stabilized microtubule seeds can more efficiently mediate microtubule polymerization. Taxol and GppCpp stabilize microtubules in different ways that can affect the microtubule lattice structure and ability of certain regulatory proteins to bind to the stabilized portion of the microtubule. A method to make diverse kinds of microtubule seeds is outlined in Hyman et al. (1992). |
| 70 oC incubator | |||
| Actin mix stock | Homemade; this protocol | A 12.5 µM actin mix comprised of labeled (fluorescent and biotinylated) and unlabeled actin for up to six reactions. 2 µL of stock is used in the final TIRF reaction. The final concentration of actin used in each reaction is 0.5 µM (10% Alexa-647; 0.09% biotin-labeled). | |
| Appropriate buffer controls | Homemade | Combination of buffers from all proteins being assessed | |
| Biotin-PEG-silane (MW 3,400) | Laysan Bio Inc | biotin-PEG-SIL-3400 | Dispensed into 2-5 mg aliquots, backfilled with nitrogen, parafilmed closed, and stored at -20 oC with desiccant until use |
| Biotinylated actin | Cytoskeleton Inc; Homemade | AB07 | Biotin-actin is made by labeling on lysine residues and thus assumed to be at least 100% labeled, but varies with different lots/preparations. Optimal biotinylated actin concentrations must be empirically determined for particular uses/experimental designs. Higher concentrations permit more efficient tracking, but may impede polymerization or interactions with regulatory proteins. Here a small percentage (0.09% or 900 pM) biotinylated actin is present in the final TIRF reaction. |
| Dishsoap | Dawn, Procter and Gamble, Cincinnati, OH | For unknown reasons, the blue version cleans coverslips more efficiently than other available colors. | |
| Dry ice | |||
| FIJI Software | www.https://imagej.net/software/fiji/downloads | Schneider et al. (2012)31. | |
| Fluorescently labeled actin | Cytoskeleton Inc; Homemade | AR05 | Homemade fluorescently labeled actin is stored in G-buffer supplemented with 50% glycerol at -20 oC (Spudich et al. (1971)47; Liu et al. (2022)48). Fluorescently labeled actin is dialyzed against G-buffer and precleared via ultracentrifugation for 60 min at 278,000 × g before use. |
| Fluorescently labeled tubulin | Cytoskeleton Inc | TL488M, TLA590M, TL670M | Resuspended in 20 µL 1× BRB80 (10 µM final concentration) and pre-cleared via ultracentrifugation (278,000 × g) for 60 min, before use. |
| G-buffer | Homemade | 3 mM Tris-HCl (pH 8.0), 0.2 mM CaCl2, 0.5 mM DTT, 0.2 mM ATP | |
| HEK Buffer | Homemade | 20 mM HEPES (pH 7.5), 1 mM EDTA (pH 8.0), 50 mM KCl | |
| Ice | |||
| Ice bucket | |||
| Imaging chambers | IBIDI, Fitchburg, WI | 80666 | Order chambers with no bottom to utilize different coverslip coatings |
| iXon Life 897 EMCCD camera | Andor, Belfast, Northern Ireland | 8114137 | |
| LASX Premium microscope software | Leica Microsystems | 11640611 | |
| Methylcellulose (4,000 cp) | Sigma Aldrich Inc | M0512 | |
| Microscope base equipped with TIRF module | Leica Microsystems, Wetzlar, Germany | 11889146 | |
| mPEG-silane (MW 2,000) | Laysan Bio Inc, Arab, AL | mPEG-SIL-2000 | Dispensed into 10-15 mg aliquots, backfilled with nitrogen, parafilmed closed, and stored at -20 oC with desiccant until use |
| Objective heater and heated stage insert | OKO labs, Pozzioli, Italy | 8113569 | Set temperature controls to 35-37 oC. Use manufacturer suggestions for accurate calibration. |
| Perfusion pump | Harvard Apparatus, Holliston, MA | 704504 | A syringe and tubing can be substituted. |
| Petri Dish, 100 x 15 mm | Genesee Scientific, San Diego, CA | 32-107 | |
| Plastic slide mailer container | Fisher Scientific | HS15986 | |
| SA-S-1L-SecureSeal 0.12 mm thick | Grace Biolabs, Bend, OR | 620001 | Double-sided tape of precise manufactured dimensions is strongly recommended. |
| Small styrofoam container | Abcam, Cambridge, UK | Reused from shipping | |
| Small weigh boat | Fisher Scientific | 02-202-100 | |
| Spectrophotometer | |||
| Tau | Cytoskeleton Inc | TA01 | Three isoforms of Tau are present in the commercially available preparation of Tau. The concentration in this protocol was determined from the highest molecular weight band (14.3 µM, when resuspended per manufacturer’s recommendations with 50 µL of ddH20). |
| Temperature corrected 63× Plan Apo 1.47 N.A. oil immersion TIRF objective | Leica Microsystems | 11506319 | |
| Tubulin stock | Homemade; this protocol | A tubulin stock consisting of 7.2 µL recycled 100 µM unlabeled tubulin and 3 µL of 10 µM resuspended commercially available fluorescently labeled tubulin. One tubulin stock is used per reaction and thawed/stored on ice. The final concentration of free tubulin in each reaction is 15 µM (4% labeled). More than 15 µM tubulin will result in hyperstabilized (not dynamic) microtubules, whereas concentrations below 7.5 µM free tubulin do not polymerize well. Careful determination of protein concentration and handling is required. | |
| Unlabeled actin (dark) | Cytoskeleton Inc; Homemade | AKL99 | Actin nucleates are almost always present in commercially available (lyophilized) or frozen actins and contribute to variability in quantitative measurements (Spudich et al. (1971)47; Liu et al. (2022)48). Rabbit muscle actin is stored in G-buffer at -80 oC and precleared via ultracentrifugation for 60 min at 278,000 × g before use. Several actin stock solutions are made throughout the day (making no more than enough for six reactions at a time is strongly recommended). |
Referências
- Pimm, M. L., Henty-Ridilla, J. L. New twists in actin-microtubule interactions. Molecular Biology of the Cell. 32 (3), 211-217 (2021).
- Dogterom, M., Koenderink, G. H. Actin-microtubule crosstalk in cell biology. Nature Reviews. Molecular Cell Biology. 20 (1), 38-54 (2019).
- Etienne-Manneville, S. Actin and microtubules in cell motility: which one is in control. Traffic. 5 (7), 470-477 (2004).
- Rodriguez, O. C., et al. Conserved microtubule-actin interactions in cell movement and morphogenesis. Nature Cell Biology. 5 (7), 599-609 (2003).
- Prezel, E., et al. TIRF assays for real-time observation of microtubules and actin coassembly: Deciphering tau effects on microtubule/actin interplay. Methods in Cell Biology. 141, 199-214 (2017).
- Griffith, L. M., Pollard, T. D. The interaction of actin filaments with microtubules and microtubule-associated proteins. The Journal of Biological Chemistry. 257 (15), 9143-9151 (1982).
- Henty-Ridilla, J. L., Rankova, A., Eskin, J. A., Kenny, K., Goode, B. L. Accelerated actin filament polymerization from microtubule plus ends. Science. 352 (6288), 1004(2016).
- Elie, A., et al. Tau co-organizes dynamic microtubule and actin networks. Scientific Reports. 5 (1), 1-10 (2015).
- Preciado López, M., et al. Actin-microtubule coordination at growing microtubule ends. Nature Communications. 5 (1), 1-9 (2014).
- Oberhofer, A., et al. Molecular underpinnings of cytoskeletal cross-talk. Proceedings of the National Academy of Sciences of the United States of America. 117 (8), 3944-3952 (2020).
- Nakos, K., et al. Septins mediate a microtubule-actin crosstalk that enables actin growth on microtubules. bioRxiv. , (2022).
- Kučera, O., Gaillard, J., Guérin, C., Théry, M., Blanchoin, L. Actin-microtubule dynamic composite forms responsive active matter with memory. bioRxiv. , (2022).
- Kundu, T., Dutta, P., Nagar, D., Maiti, S., Ghose, A. Coupling of dynamic microtubules to F-actin by Fmn2 regulates chemotaxis of neuronal growth cones. Journal of Cell Science. 134 (13), 252916(2021).
- Roth-Johnson, E. A., Vizcarra, C. L., Bois, J. S., Quinlan, M. E. Interaction between microtubules and the Drosophila formin Cappuccino and its effect on actin assembly. The Journal of Biological Chemistry. 289 (7), 4395-4404 (2014).
- Gaillard, J., et al. Differential interactions of the formins INF2, mDia1, and mDia2 with microtubules. Molecular Biology of the Cell. 22 (23), 4575-4587 (2011).
- Bartolini, F., et al. The formin mDia2 stabilizes microtubules independently of its actin nucleation activity. The Journal of Cell Biology. 181 (3), 523-536 (2008).
- Sider, J. R., et al. Direct observation of microtubule-F-actin interaction in cell free lysates. Journal of Cell Science. 112 (12), 1947-1956 (1999).
- Alkemade, C., et al. Cross-linkers at growing microtubule ends generate forces that drive actin transport. Proceedings of the National Academy of Sciences of the United States of America. 119 (11), 2112799119(2022).
- Axelrod, D. Total internal reflection fluorescence microscopy in cell biology. Methods in Enzymology. 361, 1-33 (2003).
- Amann, K. J., Pollard, T. D. Direct real-time observation of actin filament branching mediated by Arp2/3 complex using total internal reflection fluorescence microscopy. Proceedings of the National Academy of Sciences of the United States of America. 98 (26), 15009-15013 (2001).
- Al-Bassam, J. Reconstituting dynamic microtubule polymerization regulation by TOG domain proteins. Methods in Enzymology. 540, 131-148 (2014).
- Smith, B. A., Gelles, J., Goode, B. L. Single-molecule studies of actin assembly and disassembly factors. Methods in Enzymology. 540, 95-117 (2014).
- Wioland, H., Jégou, A., Romet-Lemonne, G. Celebrating 20 years of live single-actin-filament studies with five golden rules. Proceedings of the National Academy of Sciences of the United States of America. 119 (3), 2109506119(2022).
- Ganzinger, K. A., Schwille, P. More from less - bottom-up reconstitution of cell biology. Journal of Cell Science. 132 (4), (2019).
- Mahamdeh, M., Howard, J. Implementation of interference reflection microscopy for label-free, high-speed imaging of microtubules. Journal of Visualized Experiments. (150), e59520(2019).
- King, M. R., Petry, S. Phase separation of TPX2 enhances and spatially coordinates microtubule nucleation. Nature Communications. 11 (1), 270(2020).
- Ramirez-Rios, S., et al. A TIRF microscopy assay to decode how tau regulates EB's tracking at microtubule ends. Methods in Cell Biology. 141, 179-197 (2017).
- Smith, B. A., et al. Three-color single molecule imaging shows WASP detachment from Arp2/3 complex triggers actin filament branch formation. eLife. 2, 01008(2013).
- Hyman, A. A., Salser, S., Drechsel, D. N., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: information from a slowly hydrolyzable analogue GMPCPP. Molecular Biology of the Cell. 3 (10), 1155-1167 (1992).
- Li, G., Moore, J. K. Microtubule dynamics at low temperature: evidence that tubulin recycling limits assembly. Molecular Biology of the Cell. 31 (11), 1154-1166 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Pollard, T. D., Blanchoin, L., Mullins, R. D. Molecular mechanisms controlling actin filament dynamics in nonmuscle cells. Annual Review of Biophysics and Biomolecular Structure. 29, 545-576 (2000).
- Kapoor, V., Hirst, W. G., Hentschel, C., Preibisch, S., Reber, S. MTrack: Automated detection, tracking, and analysis of dynamic microtubules. Scientific Reports. 9 (1), 3794(2019).
- Willige, D., et al. Cytolinker Gas2L1 regulates axon morphology through microtubule-modulated actin stabilization. EMBO reports. 20 (11), (2019).
- Hirst, W. G., Kiefer, C., Abdosamadi, M. K., Schäffer, E., Reber, S. In vitro reconstitution and imaging of microtubule dynamics by fluorescence and label-free microscopy. STAR Protocols. 1 (3), 100177(2020).
- Farina, F., et al. The centrosome is an actin-organizing centre. Nature Cell Biology. 18 (1), 65-75 (2016).
- Mishra, M., et al. In vitro contraction of cytokinetic ring depends on myosin II but not on actin dynamics. Nature Cell Biology. 15 (7), 853-859 (2013).
- Groen, A. C., Ngyuen, P. A., Field, C. M., Ishihara, K., Mitchison, T. J. Glycogen-supplemented mitotic cytosol for analyzing Xenopus egg microtubule organization. Methods in Enzymology. 540, 417-433 (2014).
- Pollard, L. W., Garabedian, M. V., Alioto, S. L., Shekhar, S., Goode, B. L. Genetically inspired in vitro reconstitution of Saccharomyces cerevisiae actin cables from seven purified proteins. Molecular Biology of the Cell. 31 (5), 335-347 (2020).
- Bergman, Z. J., Wong, J., Drubin, D. G., Barnes, G. Microtubule dynamics regulation reconstituted in budding yeast lysates. Journal of Cell Science. 132 (4), 219386(2018).
- Inoue, D., et al. Actin filaments regulate microtubule growth at the centrosome. The EMBO Journal. 38 (11), (2019).
- Colin, A., Singaravelu, P., Théry, M., Blanchoin, L., Gueroui, Z. Actin-network architecture regulates microtubule dynamics. Current Biology. 28 (16), 2647-2656 (2018).
- Torvi, J. R., et al. Reconstitution of kinetochore and microtubule dynamics reveals a role for a kinesin-8 in establishing end-on attachments. bioRxiv. , (2022).
- Nguyen, P. A., et al. Spatial organization of cytokinesis signaling reconstituted in a cell-free system. Science. 346 (6206), 244-247 (2014).
- Abu Shah, E., Keren, K. Symmetry breaking in reconstituted actin cortices. eLife. 3, 01433(2014).
- Vendel, K. J. A., Alkemade, C., Andrea, N., Koenderink, G. H., Dogterom, M. In vitro reconstitution of dynamic co-organization of microtubules and actin filaments in emulsion droplets. Cytoskeleton Dynamics. 2101, 53-75 (2020).
- Spudich, J. A., Watt, S. The regulation of rabbit skeletal muscle contraction. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. The Journal of Biological Chemistry. 246 (15), 4866-4871 (1971).
- Liu, X., Pimm, M. L., Haarer, B., Brawner, A. T., Henty-Ridilla, J. L. Biochemical characterization of actin assembly mechanisms with ALS-associated profilin variants. European Journal of Cell Biology. 101 (2), 151212(2022).
- Pimm, M. L., Liu, X., Tuli, F., Lojko, A., Henty-Ridilla, J. L. Visualizing functional human profilin in cells and in vitro applications. bioRxiv. , (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados