Method Article
العلاج من تعاطي المخدرات عن طريق القسطرة الوريدية المركزية في نموذج الفأر من Angiotensin II الناجم عن تمدد الأوعية الدموية الأبهري البطني والمراقبة عن طريق الموجات فوق الصوتية 3D
In This Article
Summary
يصف هذا البروتوكول الزرع المتتالي لمضخة تناضحية للحث على تمدد الأوعية الدموية الأبهري البطني عن طريق إطلاق الأنجيوتنسين II في الفئران الناقصة في البروتين الشحمي E (ApoE) ومنفذ الوصول الوعائي مع قسطرة الوريد الوداجي للعلاج الدوائي المتكرر. يتم إجراء مراقبة تطور تمدد الأوعية الدموية بواسطة الموجات فوق الصوتية 3D بشكل فعال على الرغم من الغرسات الظهرية.
Abstract
نظرا لعدم وجود خيارات العلاج الصيدلاني في الإدارة السريرية لتمدد الأوعية الدموية الأبهري البطني (AAA) ، يتم تطبيق النماذج الحيوانية ، وخاصة نماذج الفئران ، لتعزيز فهم التسبب في المرض وتحديد الأهداف العلاجية المحتملة. يتطلب اختبار الأدوية المرشحة الجديدة لمنع نمو AAA في هذه النماذج عموما تكرار إعطاء الدواء خلال الفترة الزمنية للتجربة. هنا ، نصف بروتوكولا مترجما لتحريض AAA ، وإدخال قسطرة في الوريد لتسهيل العلاج لفترات طويلة ، ومراقبة AAA التسلسلية بواسطة الموجات فوق الصوتية 3D. يتم تحفيز تمدد الأوعية الدموية في الفئران التي تعاني من نقص البروتين الشحمي E (ApoE) عن طريق إطلاق الأنجيوتنسين II على مدار 28 يوما من المضخات الصغيرة التناضحية المزروعة تحت الجلد في ظهر الفأر. بعد ذلك ، يتم إجراء الإجراء الجراحي لقسطرة الوريد الوداجي الخارجي للسماح بالعلاج الدوائي اليومي عن طريق الوريد أو أخذ عينات الدم المتكررة عبر زر الوصول إلى الأوعية الدموية تحت الجلد. على الرغم من الغرستين الظهريتين ، يتم تسهيل مراقبة تطور AAA بسهولة من خلال التحليل بالموجات فوق الصوتية 3D شبه الآلي المتسلسل ، والذي ينتج عنه معلومات شاملة عن توسع قطر الأبهر وحجمه وعن مورفولوجيا تمدد الأوعية الدموية ، كما هو موضح في الأمثلة التجريبية.
Introduction
تمدد الأوعية الدموية الأبهري البطني (AAA) هو توسع مرضي في الأوعية الدموية بسبب العمليات الالتهابية والمدمرة للأنسجة في جدار الأبهر والتي قد تؤدي في النهاية إلى تمزق ووفاة المريض. على الرغم من الإنجازات الكبيرة في إصلاح AAA الجراحي ، إلا أن العلاج الدوائي المحافظ لمنع تطور تمدد الأوعية الدموية وربما تقليل خطر التمزق مفقود حتى الآن. تم تطوير نماذج حيوانية لتوضيح محفزات المرض ووسطائه واختبار أساليب جديدة للعلاج. يتم تطبيق نماذج الفئران من AAA على نطاق واسع وتغطي الملاحظات المختلفة من الأنسجة البشرية. نظرا لاختلافاتها الباثومية ، غالبا ما يتم تطبيق أكثر من نموذج واحد للتحقيق في الوظيفة الخاصة للجزيئات / المسارات أو فعالية الأدوية العلاجية المحتملة 1,2. من بين النماذج الأكثر استخداما لتحريض AAA هو إعطاء الأنجيوتنسين-II (Ang-II) في الفئران الشحمية E الناقصة (ApoE KO)3 ، والتي لديها المزيد من الإمراض الشبيهة بالمزمنة مقارنة بالنماذج التي تعتمد على تكوين تمدد الأوعية الدموية من إهانة حادة إلى جدار الأبهر 4,5. وهكذا ، يبدو نموذج Ang-II مناسبا بشكل خاص لرصد تطور المرض وقد ثبت مؤخرا أنه يشبه إلى حد كبير مرض AAA البشري فيما يتعلق بالاستجابات الأيضية والالتهابية6. والجدير بالذكر أن نموذج Ang-II لا يتميز فقط بتطوير AAA ولكن أيضا تكوين تمدد الأوعية الدموية الصدري ، وكذلك تشريح الأبهر مع تكوين الجلطة داخل الجدارية.
قد يكون للعلاجات التي تهدف إلى استهداف تطور AAA المعمول به بالفعل بدلا من منع بدء المرض قيمة انتقالية أعلى حيث أن المرضى الذين يعانون من حالة موجودة مسبقا تتطلب العلاج 7,8. للحصول على تصميم تجريبي قابل للمقارنة، يجب مراقبة حجم الأبهر قبل وبعد تحريض AAA لتحديد عتبة تطور المرض وربما تقسيم الفئران إلى مجموعات علاجية.
يعتمد أسلوب إدارة الدواء على امتصاص واستقرار المادة المعنية. غالبا ما تستخدم الحقن داخل الصفاق (i.p) بسبب سهولة تطبيقها ، ولا تتطلب مخدرا ، وعدم وجود قيود على حجم الحقن9. ومع ذلك ، يجب النظر في الحرائك الدوائية عند اختيار طريق الإعطاء ، حيث يتم امتصاص المواد التي يتم إعطاؤها i.p. في المقام الأول من خلال دوران البوابة الكبدية وقد تخضع لعملية التمثيل الغذائي للكبد قبل الوصول إلى الدورة الدموية ، مما قد يؤدي إلى تركيزات مختلفة من البلازما اعتمادا على تأثير المرور الأول10. ينتج عن الحقن الوريدي (i.v) أعلى توافر بيولوجي للمواد ، ويمكن التغلب على التحدي المتمثل في الوصول المتكرر إلى i.v. عن طريق استخدام القسطرة ومنافذ الوصول الوعائية للإعطاء اليومي 11،12،13. وفيما يتعلق بإعداد AAA، فإن توزيع الأدوية في الدورة الدموية يسهل التعرض المباشر لتمدد الأوعية الدموية بتركيزات محددة.
هنا ، نصف سير عمل لتحفيز AAA في نموذج الماوس Ang-II عبر الزرع تحت الجلد لمضخة تناضحية ، للعلاج الدوائي اليومي عبر منفذ وصول الأوعية الدموية المتصل بقسطرة مدرجة في الوريد الوداجي الخارجي ، وكذلك لمراقبة حجم تمدد الأوعية الدموية عبر الموجات فوق الصوتية ثلاثية الأبعاد14 على الرغم من وجود اثنين من الغرسات الظهرية.
Protocol
تمت الموافقة على التجارب على الحيوانات من قبل لجنة الأخلاقيات المحلية ووزارة العلوم النمساوية (BMWFW-66.009/0355-WF/V/3b/2016) ، بما يتوافق مع التوجيه الأوروبي 2010/63/EU بشأن حماية الحيوانات المستخدمة للأغراض العلمية وقانون التجارب الحيوانية النمساوي لعام 2012. تم تعيين نقاط النهاية الإنسانية على النحو التالي: فقدان وزن الجسم بنسبة ≥15٪ ، وتجنب تناول الطعام و / أو الماء ، وانخفاض النشاط (نقص الحركة) أو خلل الحركة ، أو الاهتزاز لفترات طويلة ، أو الخدش ، أو التنفس الشاق ، أو الموقف المنحني على الرغم من إدارة الألم / الأعراض. إذا لزم الأمر ، يتم القتل الرحيم للحيوان تحت التخدير العميق ، أي مزيج جرعة زائدة من الكيتامين (حوالي 100 مجم / كجم) و xylazine (حوالي 5 مجم / كجم) ، أو عن طريق خلع عنق الرحم. بالنسبة للعمليات الجراحية ، يتم استخدام تقنية التعقيم والقفازات المعقمة / النظيفة في جميع الأنحاء.
1. زرع مضخة
- تخدير
- حافظ على الفئران التي تعاني من نقص ApoE (B6.129P2-Apoetm1Unc / J) على نظام غذائي طبيعي ويفضل تضمين الحيوانات الذكور التي تتراوح أعمارها بين 12 و 14 أسبوعا في التجارب لتمثيل غلبة الذكور في الأمراض البشرية3.
- قبل يوم واحد من الجراحة (d-1 ، pre-OP) ، قم بإعداد وملء المضخات الأسموزية بالتركيز المطلوب من الأنجيوتنسين II وفقا لوزن الماوس وفقا لبروتوكول الشركة المصنعة واحتضان المضخات في محلول ملحي عند 37 درجة مئوية بين عشية وضحاها15.
مثال: بالنسبة لفأرة سعة 25 جم، باستخدام مضخات تناضحية (انظر جدول المواد) بمعدل توصيل 1000 نانوغرام/كجم/دقيقة ومعدل مضخة 0.25 ميكرولتر/ساعة لمدة 28 يوما، قم بإذابة 1.8 ملغ من Ang-II في 300 ميكرولتر من المياه المالحة (تركيز 6000 نانوغرام/ميكرولتر لتوصيل 1500 نانوغرام/ساعة من Ang-II). قم بتحميل المحلول بإبرة التعبئة الحادة في المضخة ثم أدخل وسيط التدفق لإغلاق المضخة. - ضع الفأر في غرفة التخدير بنسبة 3٪ -4٪ أيسوفلوران ممزوج ب 2 لتر / دقيقة O2 حتى فاقد الوعي. حرك الماوس إلى طاولة ساخنة (37 درجة مئوية) في وضع عرضة وحافظ على تخدير الأيزوفلوران بنسبة 1.8٪ -2٪ من خلال مخروط الأنف.
- ضعي مواد تشحيم العين على كلتا العينين لمنع الجفاف.
- حقن الفأر مع 2.5 ٪ من البوبرينورفين في محلول ملحي عند 10 ميكرولتر / غرام من الفأر تحت الجلد والتحقق من عمق التخدير عن طريق قرصة إصبع القدم.
- احلق منطقة صغيرة على الجانب الأيسر العلوي من الماوس مرة أخرى فوق شفرة الكتف. تطبيق 10٪ (ث / v) محلول البوفيدون اليود لتطهير المنطقة المحلوقة.
- إدخال المضخة (5-7 دقائق، يتم بدون مجهر)
- تحقق من أن الماوس مخدر بالكامل عن طريق قرصة إصبع القدم وقم بعمل شق عرضي 1 سم في جلد الجزء العلوي من الظهر باستخدام مشرط بين منتصف العمود الفقري وخط الكتف الأيسر.
- امسك الجلد بالملقط واستخدم مقص حاد ومنحني لصنع جيب تحت الجلد عن طريق الدفع نحو الطرف الخلفي الأيسر. افتح المقص ، واسحب المقص المفتوح من القطع وكرر ذلك لتوسيع الجيب.
- أدخل المضخة برفق في الجيب باستخدام منظم التدفق نحو الذيل (لتقليل التداخل المحتمل لإطلاق Ang-II بواسطة موقع الشق).
ملاحظة: يجب ألا يكون الجيب واسعا بما يكفي لإدخال المضخة فحسب ، بل يجب أن يكون الجلد مشدودا حول المضخة ، ويجب أن يكون هناك 5 مم على الأقل بين المضخة وموقع الشق للسماح بالتئام الجروح الأمثل. - أغلق الجرح بخيوط متقطعة قابلة للامتصاص 4-0.
- حقن الماوس مع 10٪ الجلوكوز في محلول ملحي عند 10 ميكرولتر / غرام من الماوس تحت الجلد.
- ضع رذاذ الجرح البوفيدون واليود على الجرح المغلق واسمح للفأر باستعادة الوعي تحت مصباح التدفئة ، ثم أعده إلى القفص مع 7.5 ملغ من بيريتراميد (لإدارة الألم الممتدة) و 20 مل من الجلوكوز بنسبة 5٪ في 200 مل من مياه الشرب لمدة 3 أيام بعد العملية.
- تحقق من الفئران عدة مرات في اليوم بحثا عن علامات الألم أو الضيق.
ملاحظة: نظرا لأن تمزق الأبهر يحدث بمعدل 20٪ -40٪ وفي الغالب خلال أول 3-10 أيام بعد العملية ، يجب تقليل خطر الألم الشديد أو الضيق لفترات طويلة من خلال المراقبة المتكررة للحيوانات. تشمل المؤشرات الرئيسية للتمزق الوشيك ما يلي: الانفصال عن المجموعة ، والموقف المنحني ، وانخفاض الحركة (إلى حد شلل الأطراف الخلفية) ، وانخفاض أو عدم الاستجابة أثناء التعامل.
2. قسطرة الوريد الوداجي
ملاحظة: يتطلب هذا الإجراء الجراحي مجهرا مع تكبير 8x-10x.
- باستخدام نظام الوصول إلى الأوعية الدموية (انظر جدول المواد) ، قم بإعداد القسطرة عن طريق قطع جانب 3Fr إلى الطول المطلوب (~ 5-7 مم قبل مرساة السيليكون) ودفع القسطرة فوق الموصل المعدني 22 G لنظام الوصول إلى الأوعية الدموية (VAS) مع تداخل 3 مم على الأقل. ضع غطاء الألومنيوم على الزر لحماية المنفذ.
- تحضير 1-1.5 سم طول 6-0 أربطة حريرية.
- ضع الفأر في غرفة التخدير بنسبة 3٪ -4٪ أيسوفلوران ممزوج ب 2 لتر / دقيقة O2 حتى فاقد الوعي.
- حرك الماوس إلى طاولة ساخنة (37 درجة مئوية) في وضع ضعيف وحافظ على تخدير الأيزوفلوران بنسبة 1.8٪ -2٪ من خلال مخروط الأنف.
- ضعي مواد تشحيم العين على كلتا العينين لمنع الجفاف.
- حقن الماوس مع 2.5٪ البوبرينورفين في محلول ملحي عند 10 ميكرولتر / غرام من الماوس تحت الجلد.
- حلق الفراء من الجانب الأيمن من الرقبة على الجانب البطني وعلى الجانب الأيمن من الجزء العلوي من الظهر (سيكون للجانب الأيسر المضخة الأسموزية المزروعة).
- ضع محلول البوفيدون واليود لتطهير المنطقة المحلوقة.
- تحقق من أن الماوس مخدر بالكامل عن طريق قرصة إصبع القدم.
- إعداد الوريد الوداجي (5-10 دقائق ، يتم إجراؤه تحت المجهر)
- قم بعمل شق جلدي عرضي فوق الترقوة بحجم 0.5 سم في الجانب الأيمن من الرقبة فوق الترقوة اليمنى.
- استخدم ملاقط الجراحة المجهرية الحادة لفصل النسيج الضام والدهون ، مما يعرض الوريد الوداجي الخارجي. تجنب تمزيق الأوعية الدموية الصغيرة في الدهون.
- عزل ما لا يقل عن 5 ملم من الوعاء ، بالقرب من العضلات الصدرية.
- تشريح الأنسجة تحت الوريد باستخدام ملاقط دقيقة عازمة وتمرير من خلال 2-3 من الأربطة 6-0.
ملاحظة: إذا تم تحديد أي فروع جانبية في منطقة الاهتمام ، فيجب إما إدخال الرباط ليكون ذيليا في الفرع الجانبي أو يجب ربط الفرع الجانبي بشكل دائم عن طريق العزل والربط برباط 6-0. - ثني في الأربطة وإضافة قطرة من المياه المالحة إلى الموقع.
- زرع الزر (5-7 دقائق ، يتم إجراؤه بدون مجهر)
- اقلب الماوس وضعه في وضع الانبطاح ؛ تحقق من عمق التخدير عن طريق قرصة إصبع القدم وتطبيق محلول البوفيدون واليود لتطهير المنطقة المحلوقة.
- قم بعمل شق سهمي 1 سم في الجزء العلوي من الظهر باستخدام مشرط بين خطوط منتصف العمود الفقري وخطوط الكتف اليمنى.
- استخدم مقص منحني حاد لصنع جيب دائري أكبر قليلا من حجم VAS حول موقع الشق عن طريق التشريح الحاد.
- استخدم المقص المنحني الحاد للنفق القحفي فوق الكتف الأيمن نحو الشق البطني عند الرقبة عن طريق فتح المقص قليلا ، ثم سحب المقص المفتوح للخارج ، وتكرار الإجراء أثناء دفعه إلى الداخل.
ملاحظة: يمكن تشغيل الماوس على جانبه الأيسر لهذه الخطوة. - بمجرد وصول النفق إلى الشق البطني ، مرر عبر المشابك الجراحية من البطني إلى الشق الظهري.
- قم بتوصيل طرف 3Fr من القسطرة بالمشبك واسحب القسطرة عبر النفق بحيث تكون خارج شق الرقبة البطني ويكون VAS في مكانه عند الشق الظهري.
- أدخل قرص اللباد الجراحي الخاص ب VAS تحت الجلد في الشق الموجود في الخلف.
- قم بفك القسطرة واغسلها بمحلول ملحي أو محمر مخزن بالفوسفات بدون الكالسيوم والمغنيسيوم (PBS-/-) ، وتحقق من المباح باستخدام الطرف الشوكي لأداة المناولة لإزالة غطاء الألومنيوم الواقي ، ثم استخدم الطرف المغناطيسي للاحتفاظ بالزر وحقنه بحقنة 1 مل متصلة بالحاقن المقابل حتى يتسرب السائل من نهاية 1Fr.
ملاحظة: يمكن إجراء التنظيف بالقسطرة بدلا من ذلك في الخطوة 2.1. - اضغط على الزر بشكل سببي في الجيب وأغلق الجلد فوق القرص اللباد في VAS ، تحت شفة VAS ، مع ما لا يقل عن اثنين من الغرز المتقطعة 4-0 في الجمجمة.
ملاحظة: تأكد من عدم وجود توتر على الجلد حول الزر.
- قسطرة الوريد (7-10 دقائق، تجرى تحت المجهر)
- اقلب الماوس مرة أخرى إلى وضع الاستلقاء ، وتحقق من عمق التخدير بواسطة قرصة إصبع القدم ، وأضف قطرة من المحلول الملحي إلى موقع القطع.
- اربط الرباط الأول حول القسطرة والوريد الوداجي بعقد 2-3 إلى أقصى حد ممكن من الجمجمة لربط الوريد وتثبيت القسطرة إلى الخارج. حرك الرباط الثاني أقرب ما يمكن إلى العضلات الصدرية.
- قم بتقصير القسطرة إلى الطول المطلوب بحيث يكون ~ 3-5 مم من القسطرة في الوريد عن طريق القطع بمقص دقيق بزاوية قطرية لإنشاء نهاية حادة.
- اخترق ثقبا في الوريد باستخدام إبرة 27 جم متصلة بحقنة 1 مل مملوءة بالمحلول الملحي عن طريق سحب الرباط القحفي الآمن ودفع الإبرة بالتوازي مع الوريد.
ملاحظة: إذا تسرب الدم من التدفق العكسي من الوريد، فاستخدم قطعة قطن للضغط حتى يتوقف النزيف. - أدخل القسطرة في الوريد بنفس الطريقة عن طريق سحب الرباط القحفي الآمن وتحريك القسطرة إلى الوريد باستخدام الملقط المنحني. ادفع القسطرة حتى تتماشى مع الوريد.
- اربط الرباط الثاني فوق المنطقة التي يتم فيها إدخال القسطرة في الوريد ب 2-3 عقدة وتحقق من عدم وجود تسرب للدم. يمكن استخدام الرباط الثالث وبعض الأنسجة الدهنية المحلية لتأمين القسطرة بشكل إضافي.
- قطع الطرف الزائد من كل من الأربطة مع مقص دقيق وإضافة قطرة من المياه المالحة.
- أغلق الجلد ب 4-0 خيوط متقطعة قابلة للامتصاص.
- حقن الماوس مع 10٪ الجلوكوز في محلول ملحي عند 10 ميكرولتر / غرام من الماوس تحت الجلد.
- حقن الماوس بالحجم المطلوب من المثبط أو PBS / المالحة باستخدام نهاية الشوكة لأداة المناولة لإزالة غطاء الألومنيوم الواقي ثم الطرف المغناطيسي للاحتفاظ بالزر وحقنه بحقنة 1 مل متصلة بالحاقن.
ملاحظة: تأكد من عدم وجود هواء أو فقاعات هواء في حقنة الحقن عن طريق الضغط على المكبس حتى تخرج قطرة من السائل قبل الحقن. حافظ على الضغط الإيجابي على المكبس أثناء فصل المحقنة عن الحاقن من VAS لمنع سحب الدم إلى طرف القسطرة والتسبب في انسداد القسطرة. - ضع رذاذ جرح البوفيدون واليود على الجرح المغلق واسمح للفأر باستعادة الوعي تحت مصباح التدفئة ، ثم أعده إلى القفص مع 7.5 ملغ من بيريتراميد (لإدارة الألم الطويلة) و 20 مل من الجلوكوز بنسبة 5٪ في 200 مل من مياه الشرب لمدة 3 أيام بعد العملية.
- تحقق من الفئران عدة مرات في اليوم بحثا عن علامات الألم أو الضيق.
- الحقن اليومية (<5 دقائق)
- بالنسبة للحقن اليومي ، ضع الفأر في غرفة التخدير بنسبة 3٪ -4٪ أيسوفلوران ممزوج ب 2 لتر / دقيقة O 2 حتى يصبح فاقدا للوعي ويتباطأ معدل تنفسه ، ثم حقن كما في الخطوة 2.12.10. تحقق من الرقبة بحثا عن علامات تورم بعد الحقن ، مما يشير إلى أن القسطرة لم تعد تدخل في الوريد. لاحظ أيضا أن الحقن لن يكون ممكنا إذا كانت القسطرة مسدودة.
ملاحظة: 10 ميكرولتر / غرام من وزن الفأر 1x يوميا حقن جيد التحمل من قبل الفئران.
- بالنسبة للحقن اليومي ، ضع الفأر في غرفة التخدير بنسبة 3٪ -4٪ أيسوفلوران ممزوج ب 2 لتر / دقيقة O 2 حتى يصبح فاقدا للوعي ويتباطأ معدل تنفسه ، ثم حقن كما في الخطوة 2.12.10. تحقق من الرقبة بحثا عن علامات تورم بعد الحقن ، مما يشير إلى أن القسطرة لم تعد تدخل في الوريد. لاحظ أيضا أن الحقن لن يكون ممكنا إذا كانت القسطرة مسدودة.
3.3D الموجات فوق الصوتية
- قم بإعداد نظام التصوير بالموجات فوق الصوتية ، وطاولة التدفئة ، ودفء الجل ، وقم بتوصيل محول الطاقة بالنظام ، وقم بإعداده فوق المرحلة في وضع عرضي (أي عمودي على العمود الفقري للماوس).
- باستخدام برنامج الموجات فوق الصوتية ، اضبط الإعدادات للحصول على 30 ديسيبل ، وعمق الصورة 9.0 مم ، وعرض الصورة 8.08 مم.
- ضع الفأر في غرفة التخدير بنسبة 3٪ -4٪ أيسوفلوران ممزوج ب 2 لتر / دقيقة O2 حتى فاقد الوعي. حرك الماوس إلى طاولة ساخنة (37 درجة مئوية) في وضع الاستلقاء وحافظ على تخدير الأيزوفلوران بنسبة 1.8٪ -2٪ من خلال مخروط الأنف.
- ضعي مواد تشحيم العين على كلتا العينين لمنع الجفاف.
- حلق الفراء على بطن الماوس. ضعي كريم إزالة الشعر لمدة 1 دقيقة إذا لزم الأمر، ثم امسحيه ونظفيه بشاش رطب.
- أضف قطرة من هلام القطب الكهربائي إلى كل من أقطاب تخطيط القلب الكهربائي الأربعة (ECG) على المسرح وقم بربط أطراف الماوس بها.
- انشر هلام الموجات فوق الصوتية الدافئ على بطن الفأر واخفض جهاز الإرسال لضبطه على اتصال بالحيوان.
- حدد الشريان الأورطي كوعاء دائري سريع النبض.
ملاحظة: سيتم وضع الوريد الأجوف السفلي (IVC) بجوار الشريان الأورطي ، وإذا تم الضغط على المسبار لأسفل بإحكام ، ضغط IVC بينما يظل الشريان الأورطي مستقرا. يمكن الحصول على تأكيد أن الوعاء الذي تم تحليله هو الشريان الأورطي بدلا من IVC باستخدام دوبلر موجة النبض (وضع PW) ، بزاوية 65 درجة. سيكون للشريان الأورطي سرعة موجة نبض عالية. - حدد موقع الشريان الكلوي الأيسر وامسح المنطقة يدويا حتى 12 مم قحفيا لضمان عدم وجود تداخل في منطقة الاهتمام (أي الشريان الأورطي فوق الكلوي). العودة إلى الشريان الكلوي الأيسر ثم تعيين المسبار على 6 ملم قحفيا من الشريان الكلوي الأيسر.
ملاحظة: ستقوم الموجات فوق الصوتية ثلاثية الأبعاد بتسجيل الطول المحدد (أي 12 مم) بدءا من منتصف الطريق (6 مم) بشكل سببي من نقطة المنشأ وحتى الطول المحدد (12 مم) في الجمجمة. تتضمن خطوات استكشاف الأخطاء وإصلاحها للتداخل الضغط لأسفل قليلا باستخدام الترجام ، ورفع المحول ثم خفضه مرة أخرى ، وتطبيق المزيد من هلام الموجات فوق الصوتية ، وإمالة زاوية المرحلة. - 3D اكتساب الموجات فوق الصوتية
- اضبط بوابة الجهاز التنفسي على تأخير بنسبة 25٪ ونافذة بنسبة 50٪ ومشغل ECG (T1) على 50 مللي ثانية (لتسجيل ذروة التمدد الانقباضي للشريان الأورطي).
ملاحظة: يمكن تحسين بوابة التنفس لكل بناء على معدل التنفس والجهد المبذول لضمان إزالة القطع الأثرية الحركية. - من خيارات 3D ، اضبط مسافة المسح الضوئي على 11.96 مم بحجم خطوة يبلغ 0.076 مم ، مما ينتج عنه 157 إطارا.
- سيحصل البرنامج تلقائيا على إطارات 157 في حوالي 1-2 دقيقة. مرر لأسفل للتحقق من جودة الصورة، وكرر ذلك إذا كان دون المستوى، ثم احفظ الصورة.
- اضبط بوابة الجهاز التنفسي على تأخير بنسبة 25٪ ونافذة بنسبة 50٪ ومشغل ECG (T1) على 50 مللي ثانية (لتسجيل ذروة التمدد الانقباضي للشريان الأورطي).
- 2D اكتساب القطر
- أوقف تشغيل بوابة الجهاز التنفسي وزناد تخطيط القلب، وحدد موقع المنطقة ذات القطر الأكبر يدويا في امتداد الشريان الأورطي فوق الكلوي البالغ 12 مم.
- احصل على صورة في الوضع B16.
- بالإضافة إلى ذلك، وبدون تحريك محول الطاقة، احصل على صورة تصور كيلوهرتز (EKV) ببوابات تخطيط القلب (ECG) مع الإعدادات القياسية للنظام في نفس الموقع.
- إنهاء الفحص
- امسح هلام الموجات فوق الصوتية من البطن وأعد الماوس إلى قفصه. راقب الماوس حتى يتعافى تماما.
4. تحليل الموجات فوق الصوتية
- تحليل الحجم
- في برنامج التحليل ، افتح صورة 3D Mode ، وضمن قائمة معالجة الصور ، اضغط على تحميل في 3D ، والتي ستقوم بتجميع إطارات 157 2D في صورة ثلاثية الأبعاد (أي مكعب).
- في قائمة قياس مستوى الصوت ، اختر الطرق المتوازية والدورانية، ثم سيعرض البرنامج صورة 3D في جزء واحد.
- ضمن مستوى الصوت، اضغط على ابدأ، وارسم الكفاف الأول حول الجدار الداخلي للشريان الأورطي بالنقر لإضافة النقطة الأولى، وتحريك المؤشر حول الشريان الأورطي، ثم النقر بزر الماوس الأيمن لإكمال الكفاف.
- تخطي 9-10 إطارات (0.75-1 مم) ، ثم ارسم كفافا آخر بنفس الطريقة. كرر هذه الخطوات حتى يتم الوصول إلى الإطار الأخير. هذا يجب أن يؤدي إلى 16-17 ملامح.
ملاحظة: يجب أن يكون للإطارين الأول والأخير ملامح مرسومة حتى يتم حساب الحجم الصحيح الذي يزيد عن 12 مم. - حدد الكفاف الأول من القائمة واختر تنقية. سيؤدي ذلك إلى بدء خوارزمية اكتشاف الحافة لتناسب الخط عن كثب مع جدار السفينة. حرك النقاط الموجودة على الكفاف عن طريق سحبها إلى موضع جديد بحيث يبطن الكفاف بدقة حافة الجدار الداخلي للشريان الأورطي.
ملاحظة: في نموذج Ang-II ، قد تكون هناك خثرة داخل الجدارية. نظرا لأن هذه سمة شائعة في هذا النموذج ، يجب أن يتضمن قياس الحجم الجلطة. - قم بتحسين جميع الخطوط واضغط على إنهاء لحفظ التحليل. سيتم عرض الحجم المحسوب في الزاوية السفلية اليسرى.
- تحليل القطر
ملاحظة: يمكن إجراء قياسات القطر من الجدار الداخلي إلى الجدار أو الجدار الخارجي إلى الخارجي أو الجدار الداخلي إلى الخارجي ولكن يجب أن تكون متسقة مع جميع القياسات. ومع ذلك ، في نموذج Ang-II ، قد تكون هناك خثرة داخل الجدارية ، والتي ينبغي إدراجها في التحليل.- من صورة وضع 3D: تقييم إطارات 157 لتحديد الحد الأقصى للقطر عن طريق الفحص البصري. ثم، من قائمة القياس ، اختر خطي وارسم خطوطا متعددة عبر الشريان الأورطي لتحديد أكبر قطر.
- من الوضع B أو صورة EKV (تصور الكيلوهرتز ببوابات تخطيط القلب): في الحلقة السينمائية، حدد الحد الأقصى لتوسع الشريان الأورطي (عند الانقباض) عن طريق الفحص البصري. ثم، من قائمة القياس ، اختر خطي وارسم خطوطا متعددة عبر الشريان الأورطي لتحديد أكبر قطر.
ملاحظة: يمكن استخدام تخطيط كهربية القلب لتحديد دورة القلب، ولكن التعرف البصري يعطي نتائج دقيقة.
النتائج
تظهر النتائج التمثيلية تطور وتطور تمدد الأوعية الدموية فوق الكلوية كما ترصده الموجات فوق الصوتية عند خط الأساس واليوم 8 واليوم 27 (الشكل 1A). توضح بقعة ثلاثية الألوان (الشكل 1B) من الشريان الأورطي 27 في الشكل 1A أيضا مورفولوجيا تمدد الأوعية الدموية المتشكل مع تشريح الجدار والجلطة الداخلية. تم تحديد حجم الأبهر (مم3) على امتداد 12 مم14 ، وتم قياس أقصى قطر للأبهر بالإضافة إلى ذلك من صور EKV. تم تحديد عتبة نمو حجم 125٪ من خط الأساس إلى اليوم 8 لتحديد تطور تمدد الأوعية الدموية الأولي. استنادا إلى البيانات التي تم جمعها على مدى عامين (2020-2021 ، n = 157) ، فشل 9٪ فقط من الحيوانات في تكوين AAA وفقا لهذا القطع. ومع ذلك ، عانى 35٪ من الفئران من تمزق الأبهر (الصدري أو البطني) قبل زرع القسطرة في اليوم 9 ، مما أدى إلى ما مجموعه 56٪ من الحيوانات المتبقية المصابة بمرض AAA الراسخ القابل للتقسيم الطبقي إلى مجموعات علاجية (الشكل 1C). تجدر الإشارة إلى أنه من بين عناصر التحكم التاريخية في PBS (n = 21) ، تطورت تمدد الأوعية الدموية بدرجات متفاوتة (النطاق: 128٪ -314٪ ، يعني 199٪ ± 55٪ نمو حجم الأبهر SD في اليوم 8). الأهم من ذلك ، لوحظ وجود علاقة عكسية بين التوسع الأولي والمزيد من تطور المرض ، أي أن 55٪ من تمدد الأوعية الدموية سريع التقدم (>200٪ نمو الحجم في اليوم 8) لم يتقدم أكثر حتى اليوم 27 ، في حين أن 80٪ من تمدد الأوعية الدموية الأخرى (>125٪ و <200٪ نمو الحجم في اليوم 8) استمرت في التوسع حتى نهاية التجربة (الشكل 1D).
كما تم الإبلاغ مؤخرا عن 14,17 ، تم إنشاء الطرق الموصوفة بنجاح والتحقق من صحتها وتنفيذها ، على سبيل المثال ، لتوثيق التأثير العلاجي لمثبط سيترولين هيستون (GSK484 ، لتثبيط تكوين فخ العدلات خارج الخلية) في منع تطور AAA المعمول به. تلقت الفئران الناقصة ApoE Ang-II عند 1000 نانوغرام / كجم / دقيقة بواسطة مضخات تناضحية مزروعة تحت الجلد على مدار 28 يوما. تم تقسيم الحيوانات إلى طبقات 1: 1 إلى GSK484 (0.2 ميكروغرام / غرام / يوم) أو علاج PBS بناء على حجم الأبهر الذي تم قياسه في اليوم 8 وخضعت لإجراء قسطرة الوريد الوداجي في اليوم 9. تم إجراء حقن المخدرات يوميا بحجم 10 ميكرولتر / غرام من وزن الفأر حتى نهاية الدراسة17. يوضح الشكل 2 نتائج الموجات فوق الصوتية المثالية (n = 2 / group) (المسار الزمني لتوسع الحجم أو القطر المطلق والنسبي) ، مما يكشف عن أن علاج GSK484 يمنع تقدم AAA ، بينما استمرت تمدد الأوعية الدموية في التوسع في الفئران الضابطة.
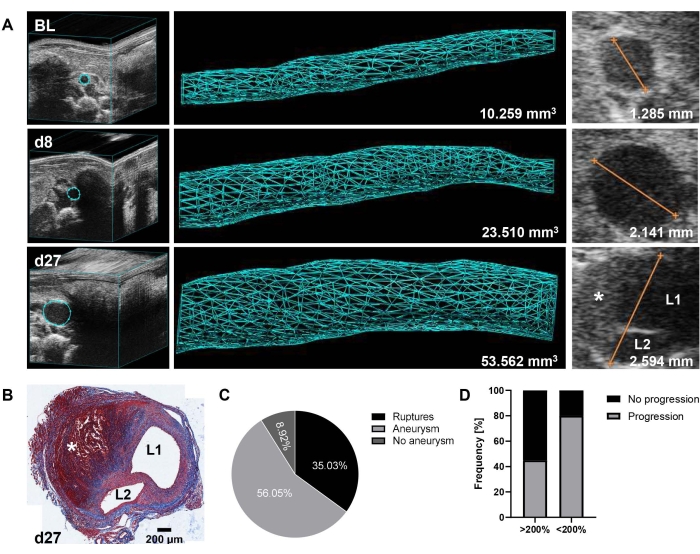
الشكل 1: تكوين AAA والتقدم في نموذج الماوس Ang-II كما تم اكتشافه بواسطة الموجات فوق الصوتية ثلاثية الأبعاد. (A) تمت مراقبة الشريان الأورطي فوق الكلوي بواسطة الموجات فوق الصوتية ثلاثية الأبعاد عند خط الأساس (BL) ، واليوم 8 (d8) ، واليوم 27 (d27) بعد زرع مضخة Ang-II. تم قياس الحجم على امتداد 12 مم من الشريان الأورطي فوق الكلوي (157 إطارا) استنادا إلى صورة ثلاثية الأبعاد أعيد بناؤها. تم تحديد الحد الأقصى لقطر الأبهر من صور EKV. (ب) بقعة تريكروم في مقطع عرضي من الشريان الأورطي 27 بعد التضحية بالفأر وجمع الأعضاء. يشار إلى وجود تشريح الشريان الأورطي بواسطة L1 / L2 (التجويف 1 والتجويف 2) ، ويرمز إلى الجلطة داخل الجدارية ب * في A و B. (ج) معدل حدوث AAA (>125٪ نمو حجم الأبهر من BL) في اليوم 8 وتمزق الأبهر خلال أول 9 أيام (الصدر أو البطن) من مجموعة بيانات تم جمعها على مدى عامين (n = 157). (د) تواتر التقدم من اليوم 8 إلى اليوم 27 من التشكل السريع الأولي (>200٪ نمو حجم الأبهر من BL إلى اليوم 8) مقابل النمو المعتدل (>125٪ و <200٪ نمو حجم الأبهر من BL إلى اليوم 8) تمدد الأوعية الدموية في الفئران المعالجة بالتحكم PBS (n = 21). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
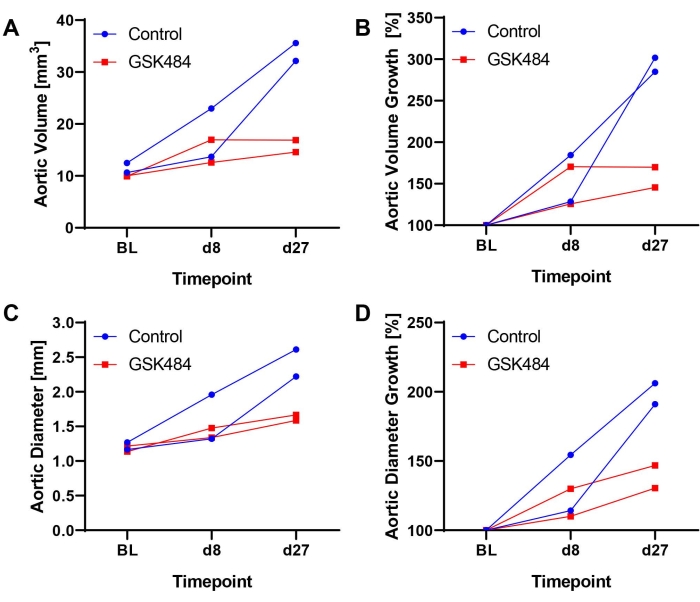
الشكل 2: نتائج مثالية من تثبيط سيترولين الهيستون لمنع تطور AAA في نموذج Ang-II عن طريق الحقن الوريدي ل GSK484 أو PBS عبر زر الوصول إلى الأوعية الدموية . (A) حجم الأبهر (مم3) كما تم قياسه على امتداد 12 مم من الشريان الأورطي فوق الكلوي. (ب) نمو حجم الأبهر المحسوب من خط الأساس (BL = 100٪). (ج) أقصى قطر للأبهر على النحو المحدد من صور EKV. (د) تم استخراج نمو القطر الأبهري المحسوب من بيانات BL. GSK484 من دراسةنشرت سابقا 17. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
نموذج Ang-II هو واحد من نماذج الماوس الأكثر استخداما من AAA بسبب متطلباته التقنية المنخفضة وميزاته الخاصة التي تشبه الأمراض البشرية 3,6. يبلغ وقت الجراحة حوالي 10 دقائق لكل ، ويتم تحمل زرع المضخة تحت الجلد بشكل جيد من قبل الفئران إذا كان الجيب تحت الجلد واسعا بما فيه الكفاية ويوضع منخفضا على ظهر الحيوان ، بعيدا عن موقع الشق ، حتى لا يتداخل مع التئام الجروح. عندما يكون الجلد مشدودا حول المضخة، قد يحدث تهيج في الأنسجة، مما قد يسبب التهابا وجلبا وربما يعطل آلية إطلاق المضخة عن طريق الضغط الاسموزي. إن قياس حجم Ang-II المتبقي في المضخة في وقت التضحية بالحيوان يعطي نظرة ثاقبة حول ما إذا كان Ang-II قد تم إطلاقه بنجاح على مدار 28 يوما.
تم اقتراح نموذج Ang-II مؤخرا ليكون مناسبا تماما لدراسة تمدد الأوعية الدموية الأبهري وتطور التشريح لأنه يظهر تشابها مع السمات البشرية لكل من6. الأهم من ذلك ، أن اختبار الأدوية المرشحة لمنع توسع الأبهر وإعادة تشكيل التأثير من شأنه أن يتطابق مع الطلب السريري الحالي. في إعدادنا التجريبي ، تم تحديد حد فاصل لتشكيل تمدد الأوعية الدموية قبل بدء العلاج بناء على نمو الحجم بنسبة 125٪ في اليوم 8 فيما يتعلق بخط الأساس ، والذي يمثل التباين الطبيعي في حجم الشريان الأورطي المطلق في الفئران. تم اشتقاق العتبة والنقطة الزمنية من دورة زمنية أولية أكدت تدمير جدار الشريان الأورطي في علم الأنسجة (البيانات غير معروضة) وأسفرت عن تمزق بنسبة 35٪ و 56٪ ملاحظة AAAs قبل زرع القسطرة. في حين تم تطبيق عتبة دنيا للمرض الثابت لإدراج الدراسة ، لوحظ لاحقا أن المدى العالي من توسع الشريان الأورطي الأولي قد يحد أيضا من التطبيق التجريبي. تمدد الأوعية الدموية الذي تقدم بسرعة إلى حجم >200٪ بحلول اليوم 8 لم ينمو أكثر من هذا الحجم في 55٪ من الحالات (الشكل 1D). يجب أن يؤخذ هذا في الاعتبار أثناء التصميم التجريبي وحساب حجم العينة ، لأنه يمكن أن يخفي التأثير الحقيقي للعلاج. جانب آخر من هذا النموذج هو تمزق الأبهر المتكرر (الصدر أو البطن) ، الذي يحدث بمعدلات 20٪ -40٪ ومعظمها خلال الأيام العشرة الأولى بعد زرع مضخة Ang-II 3,18,19. وهكذا ، من خلال اختيار بداية العلاج لتكون اليوم 9 ، تم تحقيق معدل عال من تمدد الأوعية الدموية الراسخ ، وتم إجراء قسطرة الوريد الوداجي بشكل أساسي على الفئران التي كان من المتوقع أن تبقى على قيد الحياة حتى نهاية التجربة (فقط 3/24 فئران في مجموعتنا الضابطة التاريخية تمزقت بعد اليوم 9) ، وبالتالي الحفاظ على الوقت والجهد ، والتكلفة.
وبصرف النظر عن تمزق الشريان الأورطي، الذي يشكل حالة خطيرة، فإن الزرع المتزامن للقسطرة مع زر الوصول إلى الأوعية الدموية والمضخة الأسموزية كان جيد التحمل من قبل الفئران، مع عدم وجود تأثير ملحوظ على الحركة أو السلوك بعد الشفاء من الجراحة. يجب أن يستغرق إجراء قسطرة الوريد الوداجي حوالي 30 دقيقة للباحثين المدربين. يجب الحفاظ على مدة التعرض للتخدير (isoflurane) إلى الحد الأدنى ، ويجب مراقبة معدل تنفس الحيوان عن كثب لمنع اكتئاب التنفس ، مما قد يؤدي إلى نتيجة قاتلة إذا لم يتم حلها20. يمكن أن يحدث فقدان الدم بعد ثقب الوريد الوداجي لإدخال القسطرة - مما يؤدي إلى وفاة الحيوانات إذا كان كبيرا - عندما لا يتم ربط الوريد الوداجي بشكل صحيح بالجمجمة أو لا يتم إغلاق فرع جانبي يغذي المنطقة المعزولة من الوعاء. في هذه الحالة ، يجب تطبيق الضغط باستخدام قطعة قطن على موقع الثقب حتى يتباطأ تسرب الدم أو يتوقف ، ثم يجب أن يتم إدخال القسطرة وربطها في أسرع وقت ممكن ؛ يمكن استخدام قطعة صغيرة من ضمادات جرح الكولاجين مؤقتا للمساعدة في الإرقاء.
تعد مباح القسطرة أحد أهم العوامل ، حيث يؤدي فصل القسطرة عن الوريد أو زر الوصول إلى توصيل الدواء بشكل غير صحيح حيث يتسرب الدواء إلى الفضاء تحت الجلد. بناء على توصية الشركة المصنعة بتداخل لا يقل عن 3 مم بين القسطرة والموصل المعدني ، تم تسجيل حالة واحدة فقط من فصل القسطرة على جانب الزر (يشار إليها بالسائل المحقون المتسرب من موقع الشق في الزر) على مدار 3 سنوات في هذا النموذج (2020-2021 ، n = 73) ، والتي تم إصلاحها عن طريق فتح الجرح وإعادة إنشاء الاتصال في الجراحة. بالإضافة إلى ذلك ، تم تجربة معدل فشل مباح القسطرة البالغ حوالي 10٪ في مجموعتنا الضابطة التاريخية PBS (2/21) إما بسبب انسداد القسطرة (مما يجعل من المستحيل حقنها) ، أو انفصال القسطرة عن الوريد (يشار إليه بتورم واضح في الرقبة أثناء الحقن) ، أو مضاعفات التئام الجروح. قد تكون هذه المشكلات مرتبطة بالإصابات الذاتية ، أي خدوش الماوس أو لدغاته. والجدير بالذكر أن العلاجات الدوائية التي تتداخل مع التئام الجروح قد ترفع معدلات الفشل. تتضمن خطوات استكشاف الأخطاء وإصلاحها لتحسين معدل المباح زيادة طول القسطرة التي يتم إدخالها في الوريد ، وضمان عقد الأربطة بإحكام حول القسطرة والوريد ، وتطبيق تقنية الضغط الإيجابي وفقا لتوصية الشركة المصنعة ، كما هو موضح في الخطوة 2.12.10 ، أثناء الحقن. بالإضافة إلى ذلك ، يجب التحقق من مباح القسطرة في وقت التضحية بالحيوان عن طريق التشريح والفحص البصري تحت المجهر. تجدر الإشارة إلى أنه يجب النظر بعناية في الحجم اليومي لمحلول المخدرات عن طريق الحقن. نظرا لأن حجم البلازما ينظم ضغط الدم ، فقد يؤثر حجم الحقن على توسع AAA ، وبالتالي ، تحتاج التحكم إلى تلقي الإجراء الزائف مع حجم الناقل. استنادا إلى تجربتنا (والملاحظات غير المنشورة) ، يبدو أن كمية يومية تصل إلى 250 ميكرولتر من PBS جيدة التحمل. أخيرا ، على غرار زرع المضخة ، يمكن أن يحدث تهيج الجلد حول زر الوصول إلى الأوعية الدموية المزروعة. إذا لوحظ التهاب مصحوب بأنسجة غير حيوية أو نخرية ، فيجب إجراء تنضير الجرح عن طريق إزالة الأنسجة غير القابلة للحياة (غالبا ما تنفصل الأنسجة الميتة بشكل طبيعي عن الجرح) ، ويجب خياطة الجلد إذا لزم الأمر ؛ إذا كان الالتهاب والنخر واسعين ، فيجب النظر في رفاهية الحيوان ونقاط النهاية الإنسانية وفقا للمبادئ التوجيهية.
لم تتداخل عملية الزرع الظهري المفردة والمزدوجة للمضخة الأسموزية و / أو VAS مع إشارة الموجات فوق الصوتية ولا مع تأمين الماوس في وضع مناسب على مرحلة الموجات فوق الصوتية. إن الاقتناء الآلي ل 157 إطارا يزيد عن 12 مم لتقديم صورة ثلاثية الأبعاد للشريان الأورطي لقياس الحجم هو إجراء بسيط وسريع14 ، والذي يتطلب فقط ضمان خلو الشريان الأورطي من التداخل على منطقة الاهتمام. أحد المزالق في هذا السياق هو تطبيق الكثير من الضغط مع الترجام أثناء محاولة مسح صورة التداخل ، مما قد يقطع القياس الآلي إذا تأثر معدل التنفس بضغط الأضلاع عند تسجيل صور الطرف القحفي للشريان الأورطي البطني. يتم قياس القطر تقليديا في الصور التي يتم الحصول عليها باستخدام الوضع B من قبل المشغل الذي يبحث يدويا عن منطقة القطر الأقصى أثناء إجراء تحليل الموجات فوق الصوتية. التقدم في صور الوضع B هو صور EKV ، والتي يمكنها حل حركات الأبهر الصغيرة لإنتاج صورة عالية الجودة وبطيئة للشريان الأورطي النابض. علاوة على ذلك ، يمكن تحديد الحد الأقصى لقطر الأبهر من إطارات 3D المكتسبة ، حيث تقدم الصور ال 157 نظرة عامة شاملة على الشريان الأورطي المأخوذ في الانقباض (بسبب مشغل ECG المحدد).
في الختام ، يوفر البروتوكول المترجم المقدم سير عمل موثوقا به وقابلا للتكرار لإدارة الدواء i.v. في نموذج الماوس من AAA الناجم عن Ang-II ولمراقبة حجم الأبهر بواسطة الموجات فوق الصوتية 3D. يمكن تعديل النقاط الزمنية للمراقبة والتشغيل وفقا للاحتياجات المحددة ، ويمكن إجراء قسطرة الوريد الوداجي بشكل منفصل لأي إعداد تجريبي يتطلب توصيل مواد محددة عن طريق حقن i.v. يمكن استخدام VAS بدلا من ذلك لأخذ عينات الدم المتكررة إذا تم استخدام محلول قفل القسطرة لمنع التخثر. يمكن تكييف إجراء الموجات فوق الصوتية 3D الموصوف لقياس الشريان الأورطي المقطعي ، حيث تتطور تمدد الأوعية الدموية عند الإهانة الحادة في نماذج الفئران القائمة على elastase أو CaCl2 من AAA. في حين أن اكتساب الموجات فوق الصوتية 3D يحمل ميزة إعطاء نظرة عامة على منطقة الشريان الأورطي المصابة ومورفولوجيا تمدد الأوعية الدموية ، فإن الحصول على الصورة أكثر استهلاكا للوقت ، وبالتالي ، قد يكون أكثر كثافة من حيث التكلفة. هناك قيد آخر للبروتوكول يجب الاعتراف به وهو الحاجة إلى تخدير الحيوانات لفترة وجيزة للحقن في الوريد ، في حين يتم إجراء الإدارة داخل الصفاق بشكل عام على الفئران الواعية.
Disclosures
ليس لدى المؤلفين أي إفصاحات.
Acknowledgements
نود أن نشكر فريقي البروفيسور بوديسر والبروفيسور إلماير (قسم البحوث الطبية الحيوية والمرفق الأساسي لتربية وتربية الحيوانات المختبرية ، جامعة فيينا الطبية) على المساعدة في التجارب على الحيوانات. تم إجراء تلطيخ AAA trichrome بلطف من قبل مونيكا فايس والبروفيسور بيتر بيتزلباور (قسم الأمراض الجلدية ، جامعة فيينا الطبية). تم دعم هذا العمل من قبل صندوق العلوم النمساوي [مشروع SFB F 5409-B21]. مارك بيلي مدعوم شخصيا من مؤسسة القلب البريطانية [FS/18/12/33270].
Materials
| Name | Company | Catalog Number | Comments |
| 4-0 Polysorb sutures | Covidien | GL-46-MG | Braided absorbable suture CV-23 Taper |
| 6-0 Silk sutures | Ethicon | 639H | PERMA-HAND Silk |
| ALZET 2004 osmotic pumps | DURECT Corp | 298 | Osmotic mini pumps |
| Angiotensin-II | Bachem | 4006473.0100 | Angiotensin II acetate |
| Aquasonic Clear Ultrasound Transmission Gel | Parker Labs | PUSG-0308 | Ultrasound gel |
| Betadona Wound Spray | Mundipharma | Wound disinfectant spray (povidone-iodine spray) | |
| Betaisodona Solution | Mundipharma | 15973 | Wound disinfectant solution (povidone-iodine solution) |
| Catheter for mouse femoral vein/artery | Instech Laboratories Inc | C10PU-MFV1301 | 1 to 3Fr, 10.5 cm, collar @1.2 cm. Fits 22 G |
| Hair removal cream | |||
| Handling tool | Instech Laboratories Inc | VABMG | Handling tool for magnetic mouse Vascular Access Buttons |
| HYLO NIGHT Eye Oinment | URSAPHARM | 538922 | Eye lubricant cream |
| Needles and syringes of various sizes | 1 mL and 5 mL syringes, 27 G and 30 G needles | ||
| Olympus SZ51 Stereo microscope | Olympus Corporation | Dissection and inspection microscope | |
| PinPort injectors | Instech Laboratories Inc | PNP3M-50 | Injector for vascular access button |
| Protective aluminum cap | Instech Laboratories Inc | VABM1C | Protective aluminum cap for magnetic 1 channel mouse VAB |
| Signa Electrode Ultrasound Gel | Parker Labs | PE-1560 | Electrode gel |
| Small electric shaver | |||
| Surigcal and microsurgical equipment | |||
| Suprasorb C | Lohmann & Rauscher | 20482 | Collagen wound dressing |
| Vascular access button (VAB) | Instech Laboratories Inc | VABM1B/22 | Vascular Access Button for mouse, magnetic, 1 channel 22 G, injector |
| Vevo 3100 Imaging System | FUJIFILM VisualSonics Inc | 51073-51 | Ultrasound system |
| Vevo Lab 5.6.1 software | FUJIFILM VisualSonics Inc | Ultrasound analysis software | |
| Vevo MX550D transducer | FUJIFILM VisualSonics Inc | Linear Array Transducer For Vevo 3100 system | |
| Vevo Mouse Handling Table | FUJIFILM VisualSonics Inc | 11436 | Mouse heating, mouse core temperature capture and ECG pads for physiological monitoring |
References
- Busch, A., et al. Translating mouse models of abdominal aortic aneurysm to the translational needs of vascular surgery. JVS-Vascular Science. 2, 219-234 (2021).
- Golledge, J., Krishna, S. M., Wang, Y. Mouse models for abdominal aortic aneurysm. British Journal of Pharmacology. 179 (5), 792-810 (2022).
- Daugherty, A., Manning, M. W., Cassis, L. A. Angiotensin II promotes atherosclerotic lesions and aneurysms in apolipoprotein E-deficient mice. Journal of Clinical Investigation. 105 (11), 1605-1612 (2000).
- Bhamidipati, C. M., et al. Development of a novel murine model of aortic aneurysms using peri-adventitial elastase. Surgery. 152 (2), 238-246 (2012).
- Phillips, E. H., et al. Morphological and biomechanical differences in the elastase and AngII apoE -/- rodent models of abdominal aortic aneurysms. BioMed Research International. 2015, 413189 (2015).
- Gäbel, G., et al. Parallel murine and human aortic wall genomics reveals metabolic reprogramming as key driver of abdominal aortic aneurysm progression. Journal of the American Heart Association. 10 (17), 20231 (2021).
- Phie, J., Thanigaimani, S., Golledge, J. Systematic review and meta-analysis of interventions to slow progression of abdominal aortic aneurysm in mouse models. Arteriosclerosis, Thrombosis, and Vascular Biology. 41 (4), 1504-1517 (2021).
- Lu, H. S., Owens, A. P., Liu, B., Daugherty, A. Illuminating the importance of studying interventions on the propagation phase of experimental mouse abdominal aortic aneurysms. Arteriosclerosis, Thrombosis, and Vascular Biology. 41 (4), 1518-1520 (2021).
- Al Shoyaib, A., Archie, S. R., Karamyan, V. T. Intraperitoneal route of drug administration: Should it be used in experimental animal studies. Pharmaceutical Research. 37 (1), 1-17 (2020).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: Routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science. 50 (5), 600-613 (2011).
- Derde, S., et al. Use of a central venous line for fluids, drugs and nutrient administration in a mouse model of critical illness. Journal of Visualized Experiments. (123), e55553 (2017).
- Lu, W., et al. Microsurgical skills of establishing permanent jugular vein cannulation in rats for serial blood sampling of orally administered drug. Journal of Visualized Experiments. (178), e63167 (2021).
- Jespersen, B., Knupp, L., Northcott, C. A. Femoral arterial and venous catheterization for blood sampling, drug administration and conscious blood pressure and heart rate measurements. Journal of Visualized Experiments. (59), e3496 (2012).
- Waduud, M. A., et al. High-frequency three-dimensional lumen volume ultrasound is a sensitive method to detect early aneurysmal change in elastase-induced murine abdominal aortic aneurysm. Aorta. 9 (6), 215-220 (2020).
- Lu, H., et al. Subcutaneous angiotensin II infusion using osmotic pumps induces aortic aneurysms in mice. Journal of Visualized Experiments. (103), e53191 (2015).
- Sawada, H., et al. Ultrasound imaging of the thoracic and abdominal aorta in mice to determine aneurysm dimensions. Journal of Visualized Experiments. (145), e59013 (2019).
- Eilenberg, W., et al. Histone citrullination as a novel biomarker and target to inhibit progression of abdominal aortic aneurysms. Translational Research. 233, 32-46 (2021).
- Saraff, K., Babamusta, F., Cassis, L. A., Daugherty, A. Aortic dissection precedes formation of aneurysms and atherosclerosis in angiotensin II-infused, apolipoprotein E-deficient mice. Arteriosclerosis, Thrombosis, and Vascular Biology. 23 (9), 1621-1626 (2003).
- Trachet, B., Fraga-Silva, R. A., Jacquet, P. A., Stergiopulos, N., Segers, P. Incidence, severity, mortality, and confounding factors for dissecting AAA detection in angiotensin II-infused mice: A meta-analysis. Cardiovascular Research. 108 (1), 159-170 (2015).
- Cesarovic, N., et al. Isoflurane and sevoflurane provide equally effective anaesthesia in laboratory mice. Laboratory Animals. 44 (4), 329-336 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved