Method Article
血管紧张素II诱导的腹主动脉瘤小鼠模型中中心静脉导管的药物治疗及3D超声监测
摘要
该协议描述了在载脂蛋白E(ApoE)缺陷小鼠中通过血管紧张素II释放连续植入渗透泵以诱导腹主动脉瘤,以及使用颈静脉导管的血管通路端口进行重复药物治疗。尽管进行了背侧植入物,但通过 3D 超声可有效监测动脉瘤的发展。
摘要
由于腹主动脉瘤(AAA)的临床管理缺乏药物治疗方案,因此应用动物模型,特别是小鼠模型,以推进对疾病发病机制的理解并确定潜在的治疗靶点。在这些模型中测试新的候选药物以阻断AAA生长通常需要在实验过程中重复给药。在这里,我们描述了AAA诱导的汇编方案,插入静脉导管以促进延长治疗时间,以及通过3D超声进行连续AAA监测。动脉瘤在载脂蛋白E(ApoE)缺陷小鼠中通过血管紧张素II从皮下植入小鼠背部的渗透性迷你泵释放28天来诱导。随后,进行颈外静脉导管插入术的外科手术,以允许每日静脉药物治疗或通过皮下血管通路按钮重复血液采样。尽管有两个背侧植入物,但连续半自动3D超声分析很容易促进对AAA发育的监测,该分析可获得有关主动脉直径和体积膨胀以及动脉瘤形态的全面信息,如实验示例所示。
引言
腹主动脉瘤 (AAA) 是由于主动脉壁的炎症和组织破坏性过程导致血管的病理性扩张,最终可能导致破裂和患者死亡。尽管在手术 AAA 修复方面取得了相当大的成就,但迄今为止仍缺少一种保守药物治疗来阻断动脉瘤扩张的进展并可能降低破裂风险。已经开发了动物模型来阐明疾病的触发因素和介质,并测试新的治疗方法。AAA的小鼠模型被广泛应用,涵盖了人体组织的不同观察结果。由于它们的病理机制差异,通常应用多个模型来研究分子/途径的特定功能或潜在治疗药物的功效1,2。AAA诱导最常用的模型之一是在载脂蛋白E缺陷(ApoE KO)小鼠3中施用血管紧张素II(Ang-II),与依赖于从急性损伤到主动脉壁的动脉瘤形成的模型相比,它具有更多的慢性样发病机制4,5。因此,Ang-II模型似乎特别适合监测疾病进展,并且最近被证明在代谢和炎症反应方面与人类AAA疾病非常相似6。值得注意的是,Ang-II模型不仅具有AAA发展的特征,而且还具有胸动脉瘤形成的特征,以及具有壁内血栓形成的主动脉夹层。
旨在针对已建立的AAA的进展而不是防止疾病开始的治疗可能具有更高的转化价值,因为患者患有需要治疗的原有疾病7,8。对于类似的实验设计,需要在AAA诱导之前和之后监测主动脉大小,以确定疾病发展的阈值,并可能将小鼠分层为治疗组。
药物给药方式取决于相应物质的摄取和稳定性。腹膜内(i.p.)注射最常使用,因为它们易于应用,不需要麻醉,并且缺乏注射量限制9.然而,在选择给药途径时,必须考虑药代动力学,因为施用的物质i.p.主要通过肝门循环吸收,并且在达到循环之前可能经历肝脏代谢,这可能导致根据首次通过效应10而改变血浆浓度。静脉注射(静脉注射)产生物质的最高生物利用度,并且可以通过使用导管和血管通路端口进行日常给药来规避重复静脉通路的挑战11,12,13。就 AAA 环境而言,药物在流通中的分布有助于在规定浓度下直接暴露于动脉瘤。
在这里,我们描述了通过皮下植入渗透泵在Ang-II小鼠模型中诱导AAA的工作流程,通过连接到插入颈外静脉的导管的血管通路端口进行日常静脉药物治疗,以及尽管存在两个背侧植入物,但通过3D超声14 监测动脉瘤大小。
研究方案
动物实验由当地伦理委员会和奥地利科学部批准(BMWFW-66.009/0355-WF/V/3b/2016),符合欧洲指令2010/63/EU关于保护用于科学目的的动物和2012年奥地利动物实验法。人道终点设定如下:体重减轻≥15%,避免食物和/或水的摄入,活动减少(运动功能减退)或运动障碍,或长时间摇晃,抓挠,呼吸困难或蜷缩的姿势,尽管疼痛/症状管理。如有必要,在深度麻醉下对动物实施安乐死,即过量的氯胺酮(约100毫克/千克)和甲苯噻嗪(约5毫克/千克)鸡尾酒,或通过颈椎脱位。对于外科手术,整个过程使用无菌技术和无菌/清洁手套。
1. 泵植入
- 麻醉
- 将ApoE缺陷小鼠(B6.129P2-Apoetm1Unc / J)保持在正常饮食中,并且优选在实验中包括12-14周龄的雄性动物,以代表雄性在人类疾病中占主导地位3。
- 手术前1天(d-1,OP前),根据小鼠体重,按照制造商的方案,准备并用所需浓度的血管紧张素II填充渗透泵,并将泵在37°C的盐水中孵育过夜15。
示例:对于25g小鼠,使用渗透泵(参见 材料表)以1000ng / kg / min的输送速率和0.25μL / h的泵速28天,将1.8mg Ang-II溶解在300μL盐水中(6000ng / μL浓度用于输送1500ng / h的Ang-II)。用钝灌装针将溶液装入泵中,然后插入流量减速剂以关闭泵。 - 将小鼠置于麻醉室中,以3%-4%异氟醚与2 L / min O2 混合,直到失去知觉。将鼠标移动到俯卧位的加热台(37°C),并通过鼻锥将异氟醚麻醉保持在1.8%-2%。
- 将眼部润滑剂涂抹在双眼上,以防止干燥。
- 皮下注射2.5%丁丙诺啡盐水中的10μL / g小鼠,并通过脚趾捏合验证麻醉深度。
- 将鼠标左上侧的一小块区域剃过肩胛骨。使用10%(w / v)聚维酮碘溶液对剃须区域进行消毒。
- 泵插入(5-7分钟,无需显微镜进行)
- 检查脚趾捏住鼠标是否完全麻醉,并在上背部皮肤上用手术刀在中肩胛骨线和左肩胛骨线之间做一个1厘米的横向切口。
- 用镊子将皮肤撑起,用钝的弯曲剪刀向左后肢推,制成皮下口袋。打开剪刀,将打开的剪刀从切口中拉出,然后重复以扩大口袋。
- 将泵轻轻插入口袋中,使流量减速剂朝向尾部(以尽量减少切口部位对Ang-II释放的潜在干扰)。
注意:口袋不仅应该足够宽,以便泵插入,而且应该使皮肤在泵周围不紧绷,并且泵和切口部位之间应至少有5毫米,以便获得最佳的伤口愈合。 - 用4-0个可吸收的中断缝合线关闭伤口。
- 皮下注射10%葡萄糖在盐水中以10μL / g小鼠皮下注射。
- 将聚维酮碘伤口喷雾剂涂抹在闭合的伤口上,让小鼠在加热灯下恢复意识,然后在手术后3天内用7.5mg吡立胺(用于延长疼痛管理)和20mL 5%葡萄糖在200mL饮用水中将其放回笼子中。
- 每天检查几次小鼠是否有疼痛或痛苦的迹象。
注意:由于主动脉破裂的发生率为20%-40%,并且主要发生在手术后的前3-10天内,因此需要通过频繁的动物监测来最大限度地降低长期剧烈疼痛或痛苦的风险。即将破裂的主要指征包括:与组分离,驼背姿势,活动性降低(达到后肢瘫痪的程度),以及处理过程中反应性降低或无反应。
2. 颈静脉导管插入术
注意:此外科手术需要放大倍率为8x-10x的显微镜。
- 使用血管通路系统(参见 材料表),通过将3Fr侧切割到所需长度(硅胶锚前约5-7毫米)并将导管推过具有至少3毫米重叠的血管通路系统(VAS)的22 G金属连接器来准备导管。将铝盖放在按钮上以保护端口。
- 准备1-1.5厘米长的6-0条丝绸结扎。
- 将小鼠置于麻醉室中,以3%-4%异氟醚与2 L / min O2 混合,直到失去知觉。
- 将鼠标移动到仰卧位的加热台(37°C),并通过鼻锥将异氟醚麻醉保持在1.8%-2%。
- 将眼部润滑剂涂抹在双眼上,以防止干燥。
- 皮下注射2.5%丁丙诺啡盐水中的小鼠10μL / g。
- 从颈部右侧的腹侧和上背部的右侧剃除毛皮(左侧将有植入的渗透泵)。
- 使用聚维酮碘溶液对剃须区域进行消毒。
- 检查鼠标是否被脚趾捏住完全麻醉。
- 颈静脉准备(5-10分钟,在显微镜下进行)
- 在颈部右侧右锁骨上方做一个0.5厘米的横蒺锁骨上皮肤切口。
- 使用钝性显微外科镊子分离结缔组织和脂肪,暴露颈外静脉。避免撕裂脂肪中的小血管。
- 隔离至少5毫米的血管,靠近胸肌。
- 使用弯曲的微镊子切除静脉下的钝性解剖组织,并通过6-0个结扎中的2-3个。
注意:如果在感兴趣的区域中发现任何侧分支,则应将结扎插入尾部到侧分支,或者通过隔离并用6-0结扎来永久连接侧分支。 - 塞入结扎,并向该部位添加一滴盐水。
- 按钮植入(5-7分钟,无需显微镜即可进行)
- 将鼠标翻转过来并将其放在俯卧位置;通过捏脚趾来验证麻醉深度,并应用聚维酮碘溶液对剃须区域进行消毒。
- 在上背部用手术刀在中肩胛骨和右肩胛骨线之间做一个1厘米的矢状切口。
- 使用钝的弯曲剪刀,通过钝性解剖使切口部位周围的VAS大小略大的圆形口袋。
- 使用钝的弯曲剪刀,通过稍微打开剪刀,然后将打开的剪刀拉出,并在进一步推入时重复动作,将右肩向颈部的腹侧切口进行隧道。
注意:对于此步骤,可以在鼠标左侧打开鼠标。 - 一旦隧道到达腹侧切口,通过从腹侧到背切口的手术钳。
- 将导管的3Fr端连接到夹具上,并将导管拉过隧道,使其脱离腹侧颈部切口,VAS在背切口处就位。
- 将 VAS 的手术毡椎间盘皮下插入后部切口处。
- 松开导管并用不含钙和镁的盐水或磷酸盐缓冲盐水(PBS-/-)冲洗,使用处理工具的前叉端取下保护性铝盖检查通畅性,然后使用磁性端握住按钮并用连接到相应注射器的1mL注射器注射,直到液体从1Fr端泄漏。
注意:导管冲洗也可以在步骤2.1中进行。 - 在口袋中用尾部按下按钮,并将皮肤闭合在VAS的毡盘上,在VAS的法兰下,颅侧至少有两个4-0中断的缝合线。
注:确保按钮周围的皮肤没有张力。
- 静脉导管插入术(7-10分钟,在显微镜下进行)
- 将鼠标翻转回仰卧位,通过捏脚趾来验证麻醉深度,然后在切割部位添加一滴盐水。
- 将导管和颈静脉周围的第一条结扎,颅骨尽可能远2-3节,以连接静脉并将导管固定在外面。将第二条结扎线尽可能靠近胸肌。
- 将导管缩短到所需的长度,以便通过用微剪刀以对角线切割以形成锋利的末端,使导管的约3-5毫米在静脉中。
- 使用连接到充满盐水的1 mL注射器的27G针头刺穿静脉中的孔,方法是拉动固定的颅骨结扎并将针头平行于静脉。
注意:如果回流的血液从静脉泄漏,请使用棉签施加压力,直到出血停止。 - 通过拉动固定的颅骨结扎并使用弯曲的镊子将导管滑入静脉,以相同的方式将导管插入静脉。推动导管,直到它与静脉对齐。
- 将第二条结扎在导管插入静脉的区域上,以2-3节的速度,并检查是否有血液泄漏。第三条结扎和一些局部脂肪组织可用于另外固定导管。
- 用微剪刀剪掉两个结扎的多余末端,并加入一滴盐水。
- 用4-0个可吸收的中断缝合线关闭皮肤。
- 皮下注射10%葡萄糖在盐水中以10μL / g小鼠皮下注射。
- 通过使用处理工具的叉端取下保护性铝盖,然后使用磁性端握住按钮并用连接到注射器的1 mL注射器注射,向小鼠注射所需体积的抑制剂或PBS / 盐水。
注意:在注射前,通过按压柱塞直到一滴液体流出,确保注射器中没有空气或气泡。保持柱塞上的正压,同时断开注射器与VAS的注射器,以防止将血液吸入导管尖端并导致导管堵塞。 - 将聚维酮 - 碘伤口喷雾剂施用于闭合的伤口,让小鼠在加热灯下恢复意识,然后在手术后3天内用7.5mg吡立特胺(用于延长疼痛管理)和20mL 5%葡萄糖在200mL饮用水中将其放回笼子中。
- 每天检查几次小鼠是否有疼痛或痛苦的迹象。
- 每日注射(<5分钟)
- 对于日常注射,将小鼠置于麻醉室中,以3%-4%异氟醚与2 L / min O2 混合,直到其失去知觉并且其呼吸速度减慢,然后按照步骤2.12.10进行注射。检查颈部是否有注射后肿胀的迹象,这表明导管不再插入静脉。另外,请注意,如果导管被阻塞,将无法进行注射。
注意:10μL / g小鼠体重每天注射1x,小鼠耐受性良好。
- 对于日常注射,将小鼠置于麻醉室中,以3%-4%异氟醚与2 L / min O2 混合,直到其失去知觉并且其呼吸速度减慢,然后按照步骤2.12.10进行注射。检查颈部是否有注射后肿胀的迹象,这表明导管不再插入静脉。另外,请注意,如果导管被阻塞,将无法进行注射。
3.3D超声波
- 准备超声成像系统,加热台和凝胶加热器,将换能器连接到系统,并在载物台上方以横向位置(即垂直于小鼠脊柱)设置。
- 使用超声软件,将设置调整为增益为30 dB,图像深度为9.0 mm,图像宽度为8.08 mm。
- 将小鼠置于麻醉室中,以3%-4%异氟醚与2 L / min O2 混合,直到失去知觉。将鼠标移动到仰卧位的加热台(37°C),并通过鼻锥将异氟醚麻醉保持在1.8%-2%。
- 将眼部润滑剂涂抹在双眼上,以防止干燥。
- 剃掉老鼠腹部的毛皮。如果需要,涂抹脱毛霜1分钟,然后擦拭并用湿纱布清洁。
- 向载物台上的四个心电图(ECG)电极中的每一个电极添加一滴电极凝胶,并将小鼠肢体贴在它们上面。
- 将温热的超声凝胶涂抹在小鼠的腹部,然后放下发射器以使其与动物接触。
- 将主动脉识别为圆形快速脉动血管。
注意:下腔静脉(IVC)将位于主动脉旁边,如果探针被牢牢按下,IVC将被压缩,而主动脉保持稳定。使用脉冲波多普勒(PW模式)可以确认分析的血管是主动脉而不是IVC,角度为65°。主动脉将具有高脉搏波速度。 - 定位左肾动脉并手动测量该区域,直至颅骨 12 mm,以确保感兴趣的区域(即肾上主动脉)没有干扰。返回左肾动脉,然后将探针置于距左肾动脉 6 mm 处。
注意:3D超声将记录指定长度(即12毫米),从原点开始的半尾(6毫米)到颅骨上指定的长度(12毫米)。干扰的故障排除步骤包括轻轻按下探头,再次抬起然后降低探头,应用更多的超声凝胶以及倾斜载物台的角度。 - 3D 超声采集
- 将呼吸门控设置为 25% 延迟和 50% 的窗口,将心电图触发 (T1) 设置为 50 ms(以记录主动脉收缩期扩张峰)。
注意:可以根据呼吸频率和努力针对每只动物优化呼吸门控,以确保消除运动伪影。 - 在 3D 选项中,将扫描距离设置为 11.96 mm,步长为 0.076 mm,生成 157 帧。
- 程序将在大约1-2分钟内自动获取157帧。滚动以检查图像质量,如果低于标准,请重复此操作,然后保存图像。
- 将呼吸门控设置为 25% 延迟和 50% 的窗口,将心电图触发 (T1) 设置为 50 ms(以记录主动脉收缩期扩张峰)。
- 2D 直径采集
- 关闭呼吸门控和心电图触发器,手动定位肾上主动脉12 mm拉伸中直径最大的区域。
- 获取B模式图像16。
- 此外,在不移动传感器的情况下,在同一地点获取具有系统标准设置的ECG门控千赫兹可视化(EKV)图像。
- 结束扫描
- 擦拭腹部的超声凝胶,然后将鼠标放回笼子里。监视鼠标,直到它完全恢复。
4. 超声分析
- 成交量分析
- 在分析软件中,打开3D模式图像,然后在 "图像处理 "菜单下,按 "加载到3D",这会将157个2D帧编译为3D图像(即立方体)。
- 在" 体积测量 "菜单中,选择" 并行和旋转方法",然后软件将在单个窗格中显示 3D 图像。
- 在" 体积"下,按 "开始",然后通过单击以添加第一个点,在主动脉周围移动光标,然后右键单击以完成轮廓,围绕主动脉内壁绘制第一个轮廓。
- 跳过 9-10 帧 (0.75-1 mm),然后以相同的方式绘制另一个轮廓。重复这些步骤,直到到达最后一帧。这应该导致16-17个轮廓。
注意:第一帧和最后一帧必须绘制轮廓,才能计算出超过 12 mm 的正确体积。 - 从菜单中选择第一个轮廓,然后选择 "精炼"。这将启动边缘检测算法,使管线与容器壁紧密拟合。通过将等高线上的点拖动到新位置来移动这些点,以便等值线准确地衬砌主动脉的内壁边缘。
注意:在Ang-II模型中,可能存在壁内血栓。由于这是该模型的共同特征,体积测量应包括血栓。 - 细化所有轮廓并按 "完成" 以保存分析。计算出的交易量将显示在左下角。
- 直径分析
注意:直径测量可以进行从内壁、外壁到外壁或从内壁到外壁,但所有测量值必须一致。然而,在Ang-II模型中,可能存在壁内血栓,应将其包含在分析中。- 从3D模式图像:评估157帧,通过目视检查确定最大直径。然后,从" 测量 "菜单中,选择" 线性 "并在主动脉上绘制多条线以确定最大直径。
- 从B模式或EKV(ECG门控千赫兹可视化)图像:在电影回路中,通过目视检查确定主动脉(收缩期)的最大膨胀。然后,从" 测量 "菜单中,选择" 线性 "并在主动脉上绘制多条线以确定最大直径。
注意:心电图可用于确定心动周期,但视觉识别产生准确的结果。
结果
代表性结果显示基线,第8天和第27天超声监测肾上动脉瘤的发展和进展(图1A)。图1A中第27天主动脉的三铬染色(图1B)进一步说明了形成的动脉瘤的形态,伴有壁夹层和壁内血栓。在12 mm14的拉伸范围内确定主动脉体积(mm3),并从EKV图像中额外测量最大主动脉直径。从基线到第8天,将容量增长的阈值设置为125%,用于定义初始动脉瘤发展。根据2年(2020-2021年,n = 157)收集的数据,只有9%的动物未能根据此截止时间形成AAA。然而,在第9天植入导管之前,35%的小鼠经历了主动脉破裂(胸部或腹部),从而导致总共56%的已建立的AAA疾病的动物适合分层为治疗组(图1C)。值得注意的是,在我们历史上的PBS对照组(n = 21),动脉瘤发展程度不同(范围:128%-314%,平均199%±55%SD主动脉体积增长在第8天)。重要的是,在初始扩张和进一步疾病进展之间观察到相反的关系,即55%的快速进展动脉瘤(第8天>200%的体积增长)直到第27天才进一步发展,而80%的其他动脉瘤(第8天的>125%和<200%体积增长)继续扩张直到实验结束(图1D)。
正如最近报道的14,17,所描述的方法已经成功建立,验证和实施,例如,记录组蛋白瓜氨酸化抑制剂(GSK484,用于抑制中性粒细胞胞外圈闭器形成)在阻断已建立的AAA的进展中的治疗作用。ApoE缺陷小鼠通过皮下植入的渗透泵在28天内以1000ng / kg / min的速度接受Ang-II。根据第8天测量的主动脉容积,将动物分层1:1至GSK484(0.2μg/g/d)或PBS治疗,并在第9天进行颈静脉导管插入术。每天以10μL / g小鼠重量的体积进行药物注射,直到研究结束17。 图2 显示了示例性(n = 2 /组)超声结果(绝对和相对体积或直径膨胀的时间过程),揭示了GSK484治疗抑制了AAA进展,而动脉瘤在对照小鼠中继续扩大。
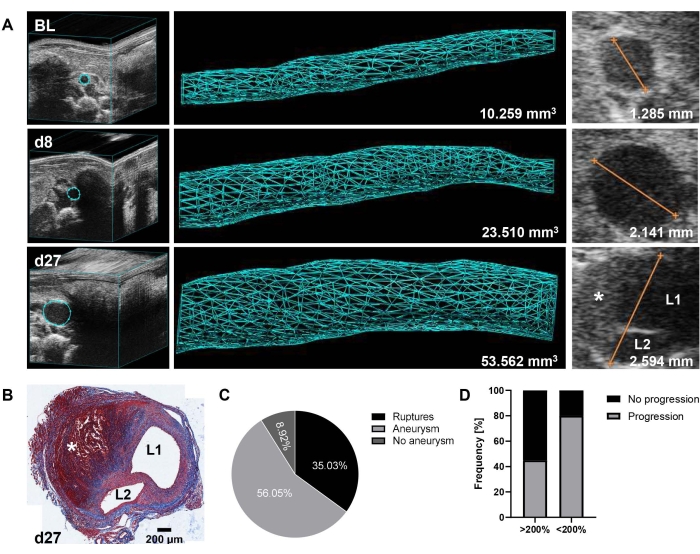
图1:3D超声检测到的Ang-II小鼠模型中的AAA形成和进展 (A)在基线(BL),第8天(d8)和第27天(d27)植入后,肾上主动脉由3D超声监测。基于3D重建图像测量肾上主动脉(157帧)12 mm拉伸的体积。最大主动脉直径由EKV图像确定。(B)三色染色的横断面为第27天主动脉,小鼠处死和器官采集后。主动脉夹层的存在由L1 / L2(管腔1和腔2)表示,壁内血栓在 A 和 B中用*表示。(C) 从 2 年内收集的数据集中,第 8 天 AAA(> BL 主动脉容积增长 125%) 和前 9 天内主动脉破裂(胸部或腹部)的发生率(n = 157)。(D)PBS对照治疗小鼠(n = 21)动脉瘤从最初快速形成(从BL到第8天的>200%主动脉体积增长)与中度增长(从BL到第8天>125%和<200%主动脉体积增长)的进展频率。 请点击此处查看此图的大图。
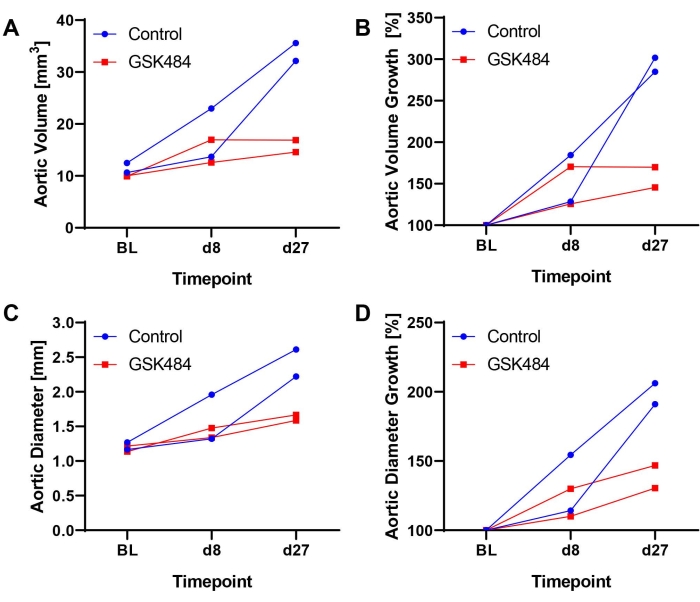
图2:通过血管通路按钮静脉注射GSK484或PBS来抑制组蛋白瓜氨酸化以阻断Ang-II模型中AAA进展的示例性结果。(B) 从基线(BL = 100%)计算的主动脉容量增长。(C) 根据EKV图像确定的最大主动脉直径。GSK484数据是从先前发表的研究17中提取的。。请点击此处查看此图的大图。
讨论
Ang-II模型是AAA最常用的小鼠模型之一,因为它的技术要求低,并且具有类似于人类疾病的特殊特征3,6。每只动物的手术时间约为10分钟,如果皮下袋足够宽并且放置在动物背部的低处,远离切口部位,则小鼠对皮下泵植入具有良好的耐受性,以免干扰伤口愈合。当泵周围的皮肤紧绷时,可能会发生组织刺激,这可能导致炎症和结痂,并可能通过渗透压破坏泵的释放机制。测量动物献祭时泵中剩余的Ang-II的体积可以深入了解Ang-II是否在28天内成功释放。
最近提出Ang-II模型非常适合研究主动脉瘤和解剖进展,因为它表现出与6的人类特征相似。重要的是,测试候选药物以阻断主动脉扩张并影响重塑将与当前的临床需求相匹配。在我们的实验环境中,在治疗开始之前,基于第8天相对于基线的125%体积增长,定义了动脉瘤形成的临界值,这解释了小鼠绝对主动脉大小的自然变化。阈值和时间点来自初始时间过程,该时间过程证实了组织学中的主动脉壁破坏(数据未显示),并导致35%的破裂和56%的导管植入前观察到AA。虽然研究纳入应用了已确诊疾病的最小阈值,但随后观察到,高度的初始主动脉扩张也可能限制实验适用性。在第8天迅速发展到>200%体积的动脉瘤在55%的病例中没有进一步超过该大小(图1D)。在实验设计和样本量计算过程中必须考虑到这一点,因为它可能会掩盖治疗的真实效果。该模型的另一个方面是频繁的主动脉破裂(胸部或腹部),发生率为20%-40%,并且主要发生在Ang-II泵植入后的前10天内3,18,19。因此,通过选择第9天的治疗开始,实现了高率的已建立的动脉瘤,并且颈静脉导管插入术基本上是在预期存活到实验结束时的小鼠上进行的(在我们的历史对照组中,只有3/24的小鼠在第9天后破裂),从而节省了时间,精力, 和成本。
除了构成严重疾病的主动脉破裂外,小鼠同时植入带有血管通路按钮的导管和渗透泵具有良好的耐受性,对手术后的活动性或行为没有显着影响。对于训练有素的研究人员,颈静脉导管插入术应花费约30分钟。暴露于(异氟醚)麻醉的持续时间应保持在最低限度,并且必须密切监测动物的呼吸速率以防止呼吸抑制,如果不解决,可能导致致命的结果20。穿刺颈静脉进行导管插入后失血 - 如果主要导致动物死亡 - 可能发生在颈静脉未正确连接颅骨或进入血管孤立区域的侧支未关闭时。在这种情况下,应用棉签对穿刺部位施加压力,直到血液泄漏减慢或停止,然后应尽快进行导管插入和结扎;可以暂时使用一小块胶原蛋白伤口敷料来帮助止血。
导管通畅性是最重要的因素之一,因为导管与静脉或通路按钮断开连接会导致药物输送不当,药物泄漏到皮下腔。根据制造商的建议,导管和金属连接器之间至少有3毫米的重叠,在该模型中,只有一例导管断开在按钮侧(由从按钮的切口处泄漏的注入液体表示)超过3年(2020-2021,n = 73),这是通过打开伤口并在手术中重新建立连接来固定的。此外,在我们的历史PBS对照组(2/21)中,由于导管闭塞(使其无法注射),导管与静脉断开(由注射期间颈部明显肿胀表示)或伤口愈合并发症,导管通畅性失败率约为10%。这些问题可能与自我伤害有关,即老鼠抓伤或咬伤。值得注意的是,干扰伤口愈合的药物治疗可能会提高失败率。提高通畅率的故障排除步骤包括增加插入静脉的导管的长度,确保结扎在导管和静脉周围紧密打结,以及在注射时按照制造商的建议应用正压技术,如步骤2.12.10中所述。此外,应在动物处死时通过解剖和显微镜下的目视检查来验证导管通畅性。值得注意的是,注射药物溶液的每日体积必须仔细考虑。由于血浆体积调节血压,注射量可能会影响AAA的扩张,因此,对照动物需要接受带有载体体积的假手术。根据我们的经验(和未发表的观察结果),每日高达250μL的PBS似乎耐受性良好。最后,与泵植入类似,皮肤刺激可能发生在植入的血管通路按钮周围。如果观察到伴有失活或坏死组织的炎症,应通过去除非活组织(坏死组织通常会自然地与伤口分离)进行伤口清创,如果需要,应缝合皮肤;如果炎症和坏死很广泛,则必须根据指南考虑动物的福利和人道终点。
渗透泵和/或VAS的单背和双背植入不会干扰超声信号,也不会将小鼠固定在超声台上的适当位置。自动采集12 mm的157帧以渲染主动脉的3D图像以进行体积测量是一个简单而快速的过程14,只需要确保主动脉在感兴趣区域上没有干扰。在这种情况下,一个陷阱是在试图清除干扰图像时对传感器施加太大的压力,如果在记录腹主动脉颅端图像时呼吸频率受到肋骨压缩的影响,则可能会中断自动测量。传统上,直径是在使用B模式获取的图像中测量的,由操作员在进行超声分析时手动搜索最大直径的区域。B模式图像的一个进步是EKV图像,它可以解析小的主动脉运动,以产生脉动主动脉的高质量,减慢的图像。此外,最大主动脉直径可以从获取的3D帧中确定,其中157张图像提供了收缩期拍摄的主动脉的全面概述(由于设置了ECG触发器)。
总之,所提出的编译方案为Ang-II诱导的AAA小鼠模型中的静脉药物给药以及通过3D超声监测主动脉大小提供了可靠且可重复的工作流程。监测和操作的时间点可以根据特定需求进行调整,并且颈静脉导管插入术可以单独进行,用于需要通过静脉注射输送特定物质的任何实验装置。如果使用导管锁定溶液来防止凝血,则 VAS 也可用于重复采血。所描述的3D超声程序可以适用于测量肾下主动脉,其中动脉瘤在弹性蛋白酶或基于CaCl2的AAA小鼠模型中的急性损伤时发展。虽然3D超声采集具有提供受影响主动脉区域和动脉瘤形态概述的优势,但图像采集更耗时,因此可能更具成本。应该承认的方案的另一个限制是需要对动物进行短暂的麻醉以进行静脉注射,而腹膜内给药通常在有意识的小鼠上进行。
披露声明
作者没有披露。
致谢
我们要感谢Podesser教授和Ellmeier教授的团队(维也纳医科大学生物医学研究系和实验室动物育种和饲养核心设施)在动物实验方面的帮助。AAA三色染色由莫妮卡·韦斯和彼得·佩策鲍尔教授(维也纳医科大学皮肤病学系)精心进行。这项工作得到了奥地利科学基金[SFB项目F 5409-B21]的支持。马克·贝利个人得到了英国心脏基金会的支持[FS/18/12/33270]。
材料
| Name | Company | Catalog Number | Comments |
| 4-0 Polysorb sutures | Covidien | GL-46-MG | Braided absorbable suture CV-23 Taper |
| 6-0 Silk sutures | Ethicon | 639H | PERMA-HAND Silk |
| ALZET 2004 osmotic pumps | DURECT Corp | 298 | Osmotic mini pumps |
| Angiotensin-II | Bachem | 4006473.0100 | Angiotensin II acetate |
| Aquasonic Clear Ultrasound Transmission Gel | Parker Labs | PUSG-0308 | Ultrasound gel |
| Betadona Wound Spray | Mundipharma | Wound disinfectant spray (povidone-iodine spray) | |
| Betaisodona Solution | Mundipharma | 15973 | Wound disinfectant solution (povidone-iodine solution) |
| Catheter for mouse femoral vein/artery | Instech Laboratories Inc | C10PU-MFV1301 | 1 to 3Fr, 10.5 cm, collar @1.2 cm. Fits 22 G |
| Hair removal cream | |||
| Handling tool | Instech Laboratories Inc | VABMG | Handling tool for magnetic mouse Vascular Access Buttons |
| HYLO NIGHT Eye Oinment | URSAPHARM | 538922 | Eye lubricant cream |
| Needles and syringes of various sizes | 1 mL and 5 mL syringes, 27 G and 30 G needles | ||
| Olympus SZ51 Stereo microscope | Olympus Corporation | Dissection and inspection microscope | |
| PinPort injectors | Instech Laboratories Inc | PNP3M-50 | Injector for vascular access button |
| Protective aluminum cap | Instech Laboratories Inc | VABM1C | Protective aluminum cap for magnetic 1 channel mouse VAB |
| Signa Electrode Ultrasound Gel | Parker Labs | PE-1560 | Electrode gel |
| Small electric shaver | |||
| Surigcal and microsurgical equipment | |||
| Suprasorb C | Lohmann & Rauscher | 20482 | Collagen wound dressing |
| Vascular access button (VAB) | Instech Laboratories Inc | VABM1B/22 | Vascular Access Button for mouse, magnetic, 1 channel 22 G, injector |
| Vevo 3100 Imaging System | FUJIFILM VisualSonics Inc | 51073-51 | Ultrasound system |
| Vevo Lab 5.6.1 software | FUJIFILM VisualSonics Inc | Ultrasound analysis software | |
| Vevo MX550D transducer | FUJIFILM VisualSonics Inc | Linear Array Transducer For Vevo 3100 system | |
| Vevo Mouse Handling Table | FUJIFILM VisualSonics Inc | 11436 | Mouse heating, mouse core temperature capture and ECG pads for physiological monitoring |
参考文献
- Busch, A., et al. Translating mouse models of abdominal aortic aneurysm to the translational needs of vascular surgery. JVS-Vascular Science. 2, 219-234 (2021).
- Golledge, J., Krishna, S. M., Wang, Y. Mouse models for abdominal aortic aneurysm. British Journal of Pharmacology. 179 (5), 792-810 (2022).
- Daugherty, A., Manning, M. W., Cassis, L. A. Angiotensin II promotes atherosclerotic lesions and aneurysms in apolipoprotein E-deficient mice. Journal of Clinical Investigation. 105 (11), 1605-1612 (2000).
- Bhamidipati, C. M., et al. Development of a novel murine model of aortic aneurysms using peri-adventitial elastase. Surgery. 152 (2), 238-246 (2012).
- Phillips, E. H., et al. Morphological and biomechanical differences in the elastase and AngII apoE -/- rodent models of abdominal aortic aneurysms. BioMed Research International. 2015, 413189 (2015).
- Gäbel, G., et al. Parallel murine and human aortic wall genomics reveals metabolic reprogramming as key driver of abdominal aortic aneurysm progression. Journal of the American Heart Association. 10 (17), 20231 (2021).
- Phie, J., Thanigaimani, S., Golledge, J. Systematic review and meta-analysis of interventions to slow progression of abdominal aortic aneurysm in mouse models. Arteriosclerosis, Thrombosis, and Vascular Biology. 41 (4), 1504-1517 (2021).
- Lu, H. S., Owens, A. P., Liu, B., Daugherty, A. Illuminating the importance of studying interventions on the propagation phase of experimental mouse abdominal aortic aneurysms. Arteriosclerosis, Thrombosis, and Vascular Biology. 41 (4), 1518-1520 (2021).
- Al Shoyaib, A., Archie, S. R., Karamyan, V. T. Intraperitoneal route of drug administration: Should it be used in experimental animal studies. Pharmaceutical Research. 37 (1), 1-17 (2020).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: Routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science. 50 (5), 600-613 (2011).
- Derde, S., et al. Use of a central venous line for fluids, drugs and nutrient administration in a mouse model of critical illness. Journal of Visualized Experiments. (123), e55553 (2017).
- Lu, W., et al. Microsurgical skills of establishing permanent jugular vein cannulation in rats for serial blood sampling of orally administered drug. Journal of Visualized Experiments. (178), e63167 (2021).
- Jespersen, B., Knupp, L., Northcott, C. A. Femoral arterial and venous catheterization for blood sampling, drug administration and conscious blood pressure and heart rate measurements. Journal of Visualized Experiments. (59), e3496 (2012).
- Waduud, M. A., et al. High-frequency three-dimensional lumen volume ultrasound is a sensitive method to detect early aneurysmal change in elastase-induced murine abdominal aortic aneurysm. Aorta. 9 (6), 215-220 (2020).
- Lu, H., et al. Subcutaneous angiotensin II infusion using osmotic pumps induces aortic aneurysms in mice. Journal of Visualized Experiments. (103), e53191 (2015).
- Sawada, H., et al. Ultrasound imaging of the thoracic and abdominal aorta in mice to determine aneurysm dimensions. Journal of Visualized Experiments. (145), e59013 (2019).
- Eilenberg, W., et al. Histone citrullination as a novel biomarker and target to inhibit progression of abdominal aortic aneurysms. Translational Research. 233, 32-46 (2021).
- Saraff, K., Babamusta, F., Cassis, L. A., Daugherty, A. Aortic dissection precedes formation of aneurysms and atherosclerosis in angiotensin II-infused, apolipoprotein E-deficient mice. Arteriosclerosis, Thrombosis, and Vascular Biology. 23 (9), 1621-1626 (2003).
- Trachet, B., Fraga-Silva, R. A., Jacquet, P. A., Stergiopulos, N., Segers, P. Incidence, severity, mortality, and confounding factors for dissecting AAA detection in angiotensin II-infused mice: A meta-analysis. Cardiovascular Research. 108 (1), 159-170 (2015).
- Cesarovic, N., et al. Isoflurane and sevoflurane provide equally effective anaesthesia in laboratory mice. Laboratory Animals. 44 (4), 329-336 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。