Method Article
Medikamentöse Behandlung mittels zentralvenösem Katheter in einem Mausmodell des Angiotensin-II-induzierten Bauchaortenaneurysmas und Überwachung mittels 3D-Ultraschall
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die konsekutive Implantation einer osmotischen Pumpe zur Induktion eines Bauchaortenaneurysmas durch Angiotensin-II-Freisetzung bei Mäusen mit Apolipoprotein E (ApoE)-Mangel und eines vaskulären Zugangsports mit einem Jugularvenenkatheter zur wiederholten medikamentösen Behandlung. Die Überwachung der Aneurysmaentwicklung durch 3D-Ultraschall wird trotz dorsaler Implantate effektiv durchgeführt.
Zusammenfassung
Da es bei der klinischen Behandlung des Bauchaortenaneurysmas (AAA) an pharmazeutischen Behandlungsmöglichkeiten mangelt, werden Tiermodelle, insbesondere Mausmodelle, eingesetzt, um das Verständnis der Krankheitspathogenese voranzutreiben und potenzielle therapeutische Ziele zu identifizieren. Das Testen neuartiger Arzneimittelkandidaten, um das AAA-Wachstum in diesen Modellen zu blockieren, erfordert in der Regel eine wiederholte Medikamentenverabreichung während des Experimentverlaufs. Hier beschreiben wir ein zusammengestelltes Protokoll für die AAA-Induktion, das Einführen eines intravenösen Katheters zur Erleichterung einer längeren Therapie und die serielle AAA-Überwachung durch 3D-Ultraschall. Aneurysmen werden bei Mäusen mit Apolipoprotein E (ApoE)-Mangel durch Angiotensin-II-Freisetzung über 28 Tage aus osmotischen Minipumpen induziert, die subkutan in den Mausrücken implantiert werden. Anschließend wird der chirurgische Eingriff zur externen Jugularvenenkatheterisierung durchgeführt, um eine tägliche intravenöse medikamentöse Behandlung oder wiederholte Blutentnahme über einen subkutanen Gefäßzugangsknopf zu ermöglichen. Trotz der beiden dorsalen Implantate wird die Überwachung der AAA-Entwicklung durch die sequentielle halbautomatische 3D-Ultraschallanalyse erleichtert, die umfassende Informationen über die Ausdehnung von Aortendurchmesser und -volumen sowie über die Aneurysmamorphologie liefert, wie experimentelle Beispiele zeigen.
Einleitung
Ein Bauchaortenaneurysma (AAA) ist eine pathologische Erweiterung eines Gefäßes aufgrund entzündlicher und gewebezerstörender Prozesse in der Aortenwand, die letztlich zu Ruptur und Patiententod führen können. Trotz erheblicher Erfolge bei der chirurgischen AAA-Reparatur fehlt bisher eine konservative medikamentöse Behandlung, um das Fortschreiten der Aneurysmaexpansion zu blockieren und möglicherweise das Risiko einer Ruptur zu senken. Tiermodelle wurden entwickelt, um Auslöser und Mediatoren der Erkrankung aufzuklären und neuartige Therapieansätze zu testen. Mausmodelle von AAA sind weit verbreitet und decken die verschiedenen Beobachtungen von menschlichem Gewebe ab. Aufgrund ihrer pathomechanistischen Unterschiede wird oft mehr als ein Modell angewendet, um die besondere Funktion von Molekülen/Signalwegen oder die Wirksamkeit potenzieller therapeutischer Medikamente zu untersuchen 1,2. Zu den am häufigsten verwendeten Modellen der AAA-Induktion gehört die Verabreichung von Angiotensin-II (Ang-II) in Apolipoprotein E deficient (ApoE KO) Mäusen3, die im Vergleich zu Modellen, die auf einer Aneurysmabildung von einer akuten Beleidigung der Aortenwand beruhen, eine chronischere Pathogenese aufweist 4,5. Daher scheint das Ang-II-Modell besonders geeignet für die Überwachung des Krankheitsverlaufs zu sein und wurde kürzlich gezeigt, dass es der menschlichen AAA-Erkrankung in Bezug auf metabolische und entzündliche Reaktionen sehr ähnlich ist6. Insbesondere zeichnet sich das Ang-II-Modell nicht nur durch die AAA-Entwicklung, sondern auch durch die Bildung eines thorakalen Aneurysmas sowie durch eine Aortendissektion mit intramuraler Thrombusbildung aus.
Behandlungen, die darauf abzielen, das Fortschreiten der bereits etablierten AAA anzustreben, anstatt die Entstehung der Krankheit zu verhindern, können einen höheren translationalen Wert haben, da Patienten mit einer Vorerkrankung auftreten, die eine Behandlung erfordert 7,8. Für ein vergleichbares experimentelles Design muss die Aortengröße vor und nach der AAA-Induktion überwacht werden, um eine Schwelle für die Krankheitsentwicklung zu definieren und Mäuse möglicherweise in Behandlungsgruppen einzuteilen.
Die Art der Arzneimittelverabreichung hängt von der Aufnahme und Stabilität der jeweiligen Substanz ab. Intraperitoneale (i.p.) Injektionen werden am häufigsten aufgrund ihrer einfachen Anwendung, der fehlenden Anästhesie und des Fehlens von Injektionsvolumenbeschränkungen verwendet9. Bei der Wahl des Verabreichungsweges muss jedoch die Pharmakokinetik berücksichtigt werden, da die i.p. verabreichten Substanzen in erster Linie über den hepatischen Pfortaderkreislauf resorbiert werden und vor dem Erreichen des Kreislaufs einen Leberstoffwechsel durchlaufen können, was je nach First-Pass-Effekt zu unterschiedlichen Plasmakonzentrationen führen kann10. Die intravenöse (i.v.) Injektion führt zur höchsten Bioverfügbarkeit von Substanzen, und die Herausforderung des wiederholten intravenösen Zugangs kann durch die Verwendung von Kathetern und vaskulären Zugangsöffnungen für die tägliche Verabreichung umgangen werden11,12,13. In Bezug auf die AAA-Einstellung erleichtert die Arzneimittelverteilung im Umlauf eine direkte Aneurysma-Exposition bei definierten Konzentrationen.
Hier beschreiben wir einen Workflow zur Induktion von AAA im Ang-II-Mausmodell über die subkutane Implantation einer osmotischen Pumpe, für die tägliche intravenöse medikamentöse Behandlung über einen vaskulären Zugangsport, der mit einem in die äußeren Halsvene eingeführten Katheter verbunden ist, sowie für die Überwachung der Aneurysmagröße mittels 3D-Ultraschall14 trotz des Vorhandenseins von zwei dorsalen Implantaten.
Protokoll
Tierversuche wurden von der lokalen Ethikkommission und dem österreichischen Wissenschaftsministerium (BMWFW-66.009/0355-WF/V/3b/2016) in Übereinstimmung mit der europäischen Richtlinie 2010/63/EU zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere und dem österreichischen Tierversuchsgesetz 2012 genehmigt. Humane Endpunkte wurden wie folgt festgelegt: Verlust von ≥15% Körpergewicht, Vermeidung von Nahrungs- und/oder Wasseraufnahme, verminderte Aktivität (Hypokinesie) oder Dyskinesie oder längeres Zittern, Kratzen, mühsame Atmung oder gebeugte Haltung trotz Schmerz-/Symptommanagement. Bei Bedarf wird ein Tier unter tiefer Narkose, d.h. einem Überdosis-Cocktail aus Ketamin (ca. 100 mg/kg) und Xylazin (ca. 5 mg/kg), oder durch zervikale Dislokation eingeschläfert. Für chirurgische Eingriffe werden durchgehend aseptische Technik und sterile/saubere Handschuhe verwendet.
1. Pumpenimplantation
- Anästhesie
- Halten Sie ApoE-defiziente Mäuse (B6.129P2-Apoetm1Unc/J) auf normaler Diät und beziehen vorzugsweise 12-14 Wochen alte männliche Tiere in die Experimente ein, um die männliche Vorherrschaft bei menschlichen Krankheiten darzustellen3.
- 1 Tag vor der Operation (d-1, prä-OP) die osmotischen Pumpen mit der gewünschten Konzentration von Angiotensin II entsprechend dem Mausgewicht nach Herstellerprotokoll vorbereiten und füllen und die Pumpen in Kochsalzlösung bei 37 °C über Nachtinkubieren 15.
Beispiel: Bei einer 25-g-Maus werden 28 Tage lang mit osmotischen Pumpen (siehe Materialtabelle) mit einer Förderleistung von 1000 ng/kg/min und einer Pumprate von 0,25 μl/h 1,8 mg Ang-II in 300 μL Kochsalzlösung (6000 ng/μL Konzentration für die Abgabe von 1500 ng/h Ang-II) gelöst. Laden Sie die Lösung mit der stumpfen Füllnadel in die Pumpe und setzen Sie dann den Strömungsmoderator ein, um die Pumpe zu schließen. - Legen Sie die Maus in die Anästhesiekammer bei 3% -4% Isofluran, gemischt mit 2 L / minO2 , bis sie bewusstlos ist. Bewegen Sie die Maus in Bauchlage auf einen beheizten Tisch (37 °C) und halten Sie die Isoflurananästhesie bei 1,8% -2% durch einen Nasenkegel.
- Tragen Sie Augengleitmittel auf beide Augen auf, um Trockenheit zu vermeiden.
- Injizieren Sie der Maus 2,5% Buprenorphin in Kochsalzlösung bei 10 μl / g Maus subkutan und überprüfen Sie die Tiefe der Anästhesie durch eine Zehenklemme.
- Rasieren Sie einen kleinen Bereich auf der oberen linken Seite der Maus über das Schulterblatt. Tragen Sie 10% (w/v) Povidon-Jod-Lösung zur Desinfektion des rasierten Bereichs auf.
- Pumpeneinführung (5-7 min, ohne Mikroskop)
- Überprüfen Sie, ob die Maus vollständig durch Zehenklemmen betäubt ist, und machen Sie einen 1 cm langen Querschnitt in der Haut des oberen Rückens mit einem Skalpell zwischen der Mittelwirbelsäule und der linken Skapulierlinie.
- Halten Sie die Haut mit einer Pinzette hoch und verwenden Sie eine stumpfe, gebogene Schere, um eine Unterhauttasche zu machen, indem Sie in Richtung der linken Hinterbein drücken. Öffnen Sie die Schere, ziehen Sie die geöffnete Schere aus dem Schnitt und wiederholen Sie den Vorgang, um die Tasche zu erweitern.
- Führen Sie die Pumpe vorsichtig mit dem Strömungsmoderator in Richtung Schwanz in die Tasche ein (um eine mögliche Störung der Ang-II-Freisetzung durch die Inzisionsstelle zu minimieren).
HINWEIS: Die Tasche sollte nicht nur breit genug sein, damit die Pumpe eingeführt werden kann, sondern auch, dass die Haut nicht eng um die Pumpe herum ist, und es sollte mindestens 5 mm zwischen der Pumpe und der Inzisionsstelle sein, um eine optimale Wundheilung zu ermöglichen. - Schließen Sie die Wunde mit 4-0 resorbierbaren unterbrochenen Nähten.
- Injizieren Sie der Maus 10% Glukose in Kochsalzlösung bei 10 μL/g Maus subkutan.
- Tragen Sie Povidon-Jod-Wundspray auf die geschlossene Wunde auf und lassen Sie die Maus das Bewusstsein unter einer Heizlampe wiederherstellen, dann bringen Sie es mit 7,5 mg Piritramid (für eine verlängerte Schmerzbehandlung) und 20 ml 5% Glukose in 200 ml Trinkwasser für 3 Tage nach der Operation in den Käfig.
- Überprüfen Sie die Mäuse mehrmals täglich auf Anzeichen von Schmerzen oder Stress.
HINWEIS: Da Aortenrupturen mit einer Rate von 20% -40% und überwiegend innerhalb der ersten 3-10 Tage nach der Operation auftreten, muss das Risiko längerer starker Schmerzen oder Ängste durch häufige Tierüberwachung minimiert werden. Die Hauptindikationen für eine bevorstehende Ruptur sind: Trennung von der Gruppe, gebeugte Haltung, verminderte Beweglichkeit (bis zum Ausmaß der Lähmung der Hintergliedmaßen) und verminderte oder nicht ansprechende Fähigkeit während der Handhabung.
2. Jugularvenenkatheteruntersuchung
HINWEIS: Dieser chirurgische Eingriff erfordert ein Mikroskop mit 8-facher Vergrößerung.
- Bereiten Sie den Katheter mit dem Gefäßzugangssystem (siehe Materialtabelle) vor, indem Sie die 3Fr-Seite auf die gewünschte Länge schneiden (~5-7 mm vor dem Silikonanker) und den Katheter über den 22 G Metallverbinder des Gefäßzugangssystems (VAS) mit mindestens 3 mm Überlappung schieben. Setzen Sie die Aluminiumkappe auf den Knopf, um den Anschluss zu schützen.
- Bereiten Sie 1-1,5 cm lange 6-0 Seidenligaturen vor.
- Legen Sie die Maus in die Anästhesiekammer bei 3% -4% Isofluran, gemischt mit 2 L / minO2 , bis sie bewusstlos ist.
- Bewegen Sie die Maus in Rückenlage auf einen beheizten Tisch (37 °C) und halten Sie die Isoflurananästhesie bei 1,8%-2% durch einen Nasenkegel.
- Tragen Sie Augengleitmittel auf beide Augen auf, um Trockenheit zu vermeiden.
- Injizieren Sie der Maus 2,5% Buprenorphin in Kochsalzlösung bei 10 μL/g Maus subkutan.
- Rasieren Sie das Fell von der rechten Seite des Halses auf der ventralen Seite und auf der rechten Seite des oberen Rückens (die linke Seite hat die implantierte osmotische Pumpe).
- Tragen Sie die Povidon-Jod-Lösung zur Desinfektion des rasierten Bereichs auf.
- Überprüfen Sie, ob die Maus vollständig durch Zehenklemmen betäubt ist.
- Jugularvenenpräparation (5-10 min, unter dem Mikroskop durchgeführt)
- Machen Sie einen 0,5 cm transversalen supraklavikulären Hautschnitt an der rechten Seite des Halses über dem rechten Schlüsselbein.
- Verwenden Sie eine stumpfe mikrochirurgische Pinzette, um Bindegewebe und Fett zu trennen und die äußere Halsvene freizulegen. Vermeiden Sie es, kleine Blutgefäße im Fett auseinander zu reißen.
- Isolieren Sie mindestens 5 mm des Gefäßes in der Nähe der Brustmuskeln.
- Stumpfes Gewebe unter der Vene mit gebogenen Mikropinzetten sezieren und 2-3 der 6-0 Ligaturen passieren.
HINWEIS: Wenn Seitenäste im interessierenden Bereich identifiziert werden, sollte entweder die Ligatur so eingeführt werden, dass sie kaudal zum Seitenast ist, oder der Seitenast sollte dauerhaft durch Isolieren und Abbinden mit einer 6-0-Ligatur ligiert werden. - Stecken Sie die Ligaturen ein und fügen Sie der Website einen Tropfen Kochsalzlösung hinzu.
- Knopfimplantation (5-7 min, ohne Mikroskop)
- Drehen Sie die Maus um und bringen Sie sie in die Bauchlage. Überprüfen Sie die Tiefe der Anästhesie durch eine Zehenklemme und tragen Sie die Povidon-Jod-Lösung auf, um den rasierten Bereich zu desinfizieren.
- Machen Sie einen 1 cm langen sagittalen Schnitt am oberen Rücken mit einem Skalpell zwischen der Mittelwirbelsäule und der rechten Skapulierlinie.
- Verwenden Sie eine stumpf gebogene Schere, um eine kreisförmige Tasche zu machen, die nur geringfügig größer ist als die Größe des VAS um die Inzisionsstelle durch stumpfe Dissektion.
- Verwenden Sie die stumpf gebogene Schere, um kranial über die rechte Schulter in Richtung des ventralen Einschnitts am Hals zu tunneln, indem Sie die Schere leicht öffnen, dann die geöffnete Schere herausziehen und die Aktion wiederholen, während sie weiter hineingeschoben wird.
HINWEIS: Die Maus kann für diesen Schritt auf der linken Seite gedreht werden. - Sobald der Tunnel den ventralen Schnitt erreicht hat, gehen Sie durch chirurgische Klemmen von der ventralen zur dorsalen Inzision.
- Befestigen Sie das 3Fr-Ende des Katheters an der Klemme und ziehen Sie den Katheter durch den Tunnel, so dass er aus dem ventralen Halsschnitt heraus ist und das VAS am dorsalen Schnitt vorhanden ist.
- Führen Sie die chirurgische Filzscheibe des VAS subkutan am Schnitt am Rücken ein.
- Lösen Sie den Katheter und spülen Sie ihn mit Kochsalzlösung oder phosphatgepufferter Kochsalzlösung ohne Kalzium und Magnesium (PBS-/-), überprüfen Sie die Durchgängigkeit, indem Sie das Gabelende des Handhabungswerkzeugs verwenden, um die schützende Aluminiumkappe zu entfernen, und verwenden Sie dann das magnetische Ende, um den Knopf zu halten, und injizieren Sie mit einer 1-ml-Spritze, die am entsprechenden Injektor befestigt ist, bis die Flüssigkeit aus dem 1Fr-Ende austritt.
HINWEIS: Die Katheterspülung kann alternativ in Schritt 2.1 durchgeführt werden. - Drücken Sie den Knopf kaudal in der Tasche und schließen Sie die Haut über der Filzscheibe des VAS, unter dem Flansch des VAS, mit mindestens zwei 4-0 unterbrochenen Nähten kranial.
HINWEIS: Stellen Sie sicher, dass keine Spannung auf der Haut um den Knopf herum entsteht.
- Venenkatheteruntersuchung (7-10 min, unter dem Mikroskop durchgeführt)
- Drehen Sie die Maus zurück in die Rückenlage, überprüfen Sie die Tiefe der Anästhesie durch eine Zehenklemme und fügen Sie der Schnittstelle einen Tropfen Kochsalzlösung hinzu.
- Binden Sie die erste Ligatur um den Katheter und die Halsvene mit 2-3 Knoten so weit wie möglich kraniell, um die Vene zu ligieren und den Katheter außen zu verankern. Bewegen Sie die zweite Ligatur so nah wie möglich an die Brustmuskeln.
- Kürzen Sie den Katheter auf die erforderliche Länge, so dass ~3-5 mm des Katheters in der Vene sind, indem Sie mit einer Mikroschere in einem diagonalen Winkel schneiden, um ein scharfes Ende zu erzeugen.
- Durchstechen Sie ein Loch in die Vene mit einer 27-G-Nadel, die an einer mit Kochsalzlösung gefüllten 1-ml-Spritze befestigt ist, indem Sie an der gesicherten Schädelligatur ziehen und die Nadel parallel zur Vene drücken.
HINWEIS: Wenn Blut aus dem Rückfluss aus der Vene austritt, verwenden Sie ein Wattestäbchen, um Druck auszuüben, bis die Blutung aufhört. - Führen Sie den Katheter auf die gleiche Weise in die Vene ein, indem Sie an der gesicherten Schädelligatur ziehen und den Katheter mit der gebogenen Pinzette in die Vene schieben. Drücken Sie den Katheter, bis er mit der Vene ausgerichtet ist.
- Binden Sie die zweite Ligatur mit 2-3 Knoten über die Region, in der der Katheter in die Vene eingeführt wird, und überprüfen Sie, ob kein Blut austritt. Eine dritte Ligatur und ein Teil des lokalen Fettgewebes können verwendet werden, um den Katheter zusätzlich zu sichern.
- Schneiden Sie das überschüssige Ende beider Ligaturen mit einer Mikroschere ab und fügen Sie einen Tropfen Kochsalzlösung hinzu.
- Verschließen Sie die Haut mit 4-0 resorbierbaren unterbrochenen Nähten.
- Injizieren Sie der Maus 10% Glukose in Kochsalzlösung bei 10 μL/g Maus subkutan.
- Injizieren Sie der Maus das gewünschte Volumen an Inhibitor oder PBS / Kochsalzlösung, indem Sie das Gabelende des Handhabungswerkzeugs verwenden, um die schützende Aluminiumkappe und dann das magnetische Ende zu entfernen, um den Knopf zu halten, und injizieren Sie mit einer 1-ml-Spritze, die am Injektor befestigt ist.
HINWEIS: Stellen Sie sicher, dass sich keine Luft oder Luftblasen in der Injektionsspritze befinden, indem Sie den Kolben drücken, bis vor der Injektion ein Tropfen Flüssigkeit austritt. Halten Sie den Überdruck auf den Kolben aufrecht, während Sie die Spritze mit dem Injektor vom VAS trennen, um zu verhindern, dass Blut in die Katheterspitze gezogen wird und eine Katheterverstopfung verursacht wird. - Tragen Sie ein Povidon-Jod-Wundspray auf die geschlossene Wunde auf und lassen Sie die Maus unter einer Heizlampe das Bewusstsein wiederherstellen, dann bringen Sie es mit 7,5 mg Piritramid (für eine verlängerte Schmerzbehandlung) und 20 ml 5% Glukose in 200 ml Trinkwasser für 3 Tage nach der Operation in den Käfig.
- Überprüfen Sie die Mäuse mehrmals täglich auf Anzeichen von Schmerzen oder Stress.
- Tägliche Injektionen (<5 min)
- Zur täglichen Injektion die Maus bei 3%-4% Isofluran, gemischt mit 2 l/min O2, in die Anästhesiekammer legen, bis sie bewusstlos ist und ihre Atemfrequenz verlangsamt ist, dann injizieren wie in Schritt 2.12.10. Überprüfen Sie den Hals nach der Injektion auf Anzeichen von Schwellungen, die darauf hinweisen würden, dass der Katheter nicht mehr in die Vene eingeführt wird. Beachten Sie auch, dass eine Injektion nicht möglich ist, wenn der Katheter verschlossen ist.
HINWEIS: Eine 10 μL/g Mausgewicht 1x pro Tag Injektion wird von den Mäusen gut vertragen.
- Zur täglichen Injektion die Maus bei 3%-4% Isofluran, gemischt mit 2 l/min O2, in die Anästhesiekammer legen, bis sie bewusstlos ist und ihre Atemfrequenz verlangsamt ist, dann injizieren wie in Schritt 2.12.10. Überprüfen Sie den Hals nach der Injektion auf Anzeichen von Schwellungen, die darauf hinweisen würden, dass der Katheter nicht mehr in die Vene eingeführt wird. Beachten Sie auch, dass eine Injektion nicht möglich ist, wenn der Katheter verschlossen ist.
3.3D Ultraschall
- Bereiten Sie das Ultraschallbildgebungssystem, den Heiztisch und den Gelwärmer vor, befestigen Sie den Schallkopf am System und stellen Sie ihn über dem Tisch in einer Querposition (d. H. Senkrecht zur Mauswirbelsäule) auf.
- Passen Sie die Einstellungen mithilfe der Ultraschallsoftware auf eine Verstärkung von 30 dB, eine Bildtiefe von 9,0 mm und eine Bildbreite von 8,08 mm an.
- Legen Sie die Maus in die Anästhesiekammer bei 3% -4% Isofluran, gemischt mit 2 L / minO2 , bis sie bewusstlos ist. Bewegen Sie die Maus in Rückenlage auf einen beheizten Tisch (37 °C) und halten Sie die Isoflurananästhesie bei 1,8%-2% durch einen Nasenkegel.
- Tragen Sie Augengleitmittel auf beide Augen auf, um Trockenheit zu vermeiden.
- Rasieren Sie das Fell am Mäusebauch. Bei Bedarf eine Haarentfernungscreme für 1 Minute auftragen, dann abwischen und mit feuchter Gaze reinigen.
- Fügen Sie einen Tropfen Elektrodengel zu jeder der vier Elektrokardiogramm-Elektroden (EKG) auf der Bühne hinzu und kleben Sie die Extremitäten der Maus an sie.
- Verteilen Sie warmes Ultraschallgel auf den Bauch der Maus und senken Sie den Sender, um ihn mit dem Tier in Kontakt zu bringen.
- Identifizieren Sie die Aorta als kreisförmiges, schnell pulsierendes Gefäß.
HINWEIS: Die untere Hohlvene (IVC) befindet sich neben der Aorta, und wenn die Sonde fest nach unten gedrückt wird, wird die IVC komprimiert, während die Aorta stabil bleibt. Die Bestätigung, dass das analysierte Gefäß die Aorta und nicht die IVC ist, kann mit dem Pulswellen-Doppler (PW-Modus) mit einem Winkel von 65° erhalten werden. Die Aorta wird eine hohe Pulswellengeschwindigkeit haben. - Lokalisieren Sie die linke Nierenarterie und untersuchen Sie den Bereich manuell bis zu 12 mm kranial, um sicherzustellen, dass es keine Störungen im interessierenden Bereich (d. H. Nebenrenale Aorta) gibt. Kehren Sie zur linken Nierenarterie zurück und stellen Sie die Sonde auf 6 mm kranial von der linken Nierenarterie ein.
HINWEIS: Der 3D-Ultraschall zeichnet die angegebene Länge (d. H. 12 mm) auf, beginnend auf halbem Weg (6 mm) kaudal vom Ursprungspunkt und bis zur angegebenen Länge (12 mm) kranial. Zu den Schritten zur Fehlerbehebung bei Interferenzen gehören leichtes Herunterdrücken mit dem Schallkopf, Anheben und Wiederabsenken des Schallkopfes, Auftragen von mehr Ultraschallgel und Kippen des Winkels der Bühne. - 3D-Ultraschallerfassung
- Stellen Sie das respiratorische Gating auf 25% Verzögerung und ein Fenster von 50% und den EKG-Trigger (T1) auf 50 ms ein (um die maximale systolische Dilatation der Aorta aufzuzeichnen).
HINWEIS: Das Atem-Gating kann für jedes Tier basierend auf der Atemfrequenz und dem Aufwand optimiert werden, um sicherzustellen, dass Bewegungsartefakte entfernt werden. - Stellen Sie in den 3D-Optionen den Scanabstand auf 11,96 mm mit einer Schrittweite von 0,076 mm ein, was 157 Bilder ergibt.
- Das Programm erfasst automatisch die 157 Bilder in ca. 1-2 Minuten. Scrollen Sie durch, um die Bildqualität zu überprüfen, wiederholen Sie, wenn unterdurchschnittlich, und speichern Sie dann das Bild.
- Stellen Sie das respiratorische Gating auf 25% Verzögerung und ein Fenster von 50% und den EKG-Trigger (T1) auf 50 ms ein (um die maximale systolische Dilatation der Aorta aufzuzeichnen).
- 2D-Durchmessererfassung
- Schalten Sie den Atem-Gating- und EKG-Auslöser aus und lokalisieren Sie manuell den Bereich mit dem größten Durchmesser in der 12-mm-Strecke der Nebennierenaorta.
- Erfassen Sie ein B-Mode-Bild16.
- Darüber hinaus können Sie, ohne den Schallkopf zu bewegen, ein EKG-gesteuertes EKV-Bild (EKG-gesteuerte Kilohertz-Visualisierung) mit den Standardeinstellungen des Systems am selben Ort erfassen.
- Beenden des Scans
- Wischen Sie das Ultraschallgel aus dem Bauch und bringen Sie die Maus in ihren Käfig zurück. Überwachen Sie die Maus, bis sie vollständig wiederhergestellt ist.
4. Ultraschallanalyse
- Volumenanalyse
- Öffnen Sie in der Analysesoftware das Bild im 3D-Modus und drücken Sie im Menü Bildverarbeitung auf In 3D laden, wodurch die 157 2D-Frames zu einem 3D-Bild (d. H. Würfel) kompiliert werden.
- Wählen Sie im Menü Volumenmessung die Option Parallel- und Rotationsmethoden, und die Software zeigt das 3D-Bild in einem einzigen Bereich an.
- Drücken Sie unter Lautstärke auf Start, und zeichnen Sie die erste Kontur um die Innenwand der Aorta, indem Sie den ersten Punkt hinzufügen, den Cursor um die Aorta bewegen und dann mit der rechten Maustaste klicken, um die Kontur abzuschließen.
- Überspringen Sie 9-10 Rahmen (0,75-1 mm) und zeichnen Sie dann auf die gleiche Weise eine andere Kontur. Wiederholen Sie diese Schritte, bis der letzte Frame erreicht ist. Dies sollte 16-17 Konturen ergeben.
HINWEIS: Für den ersten und letzten Rahmen müssen Konturen gezeichnet werden, damit das korrekte Volumen über 12 mm berechnet werden kann. - Wählen Sie die erste Kontur aus dem Menü aus und wählen Sie Verfeinern. Dadurch wird der Kantenerkennungsalgorithmus initiiert, um die Linie eng an die Gefäßwand anzupassen. Verschieben Sie die Punkte auf der Kontur, indem Sie sie an eine neue Position ziehen, so dass die Kontur die innere Wandkante der Aorta genau auskleidet.
HINWEIS: Im Ang-II-Modell kann ein intramuraler Thrombus vorhanden sein. Da dies ein gemeinsames Merkmal dieses Modells ist, sollte die Volumenmessung den Thrombus einschließen. - Verfeinern Sie alle Konturen und drücken Sie Fertig stellen , um die Analyse zu speichern. Das berechnete Volumen wird in der unteren linken Ecke angezeigt.
- Durchmesseranalyse
HINWEIS: Durchmessermessungen können von der Innen-Innen-Wand, von außen zur Außenwand oder von der Innen-Außen-Wand durchgeführt werden, müssen jedoch für alle Messungen konsistent sein. Im Ang-II-Modell könnte jedoch ein intramuraler Thrombus vorhanden sein, der in die Analyse einbezogen werden sollte.- Aus dem Bild des 3D-Modus: Werten Sie die 157 Rahmen aus, um den maximalen Durchmesser durch visuelle Inspektion zu ermitteln. Wählen Sie dann im Menü Messung die Option Linear und zeichnen Sie mehrere Linien über die Aorta, um den größten Durchmesser zu bestimmen.
- Aus dem B-Mode- oder EKV-Bild (ECG-gated kilohertz visualization): Identifizieren Sie in der Cine-Schleife die maximale Ausdehnung der Aorta (bei Systole) durch visuelle Inspektion. Wählen Sie dann im Menü Messung die Option Linear und zeichnen Sie mehrere Linien über die Aorta, um den größten Durchmesser zu bestimmen.
HINWEIS: Das EKG kann verwendet werden, um den Herzzyklus zu bestimmen, aber die visuelle Identifizierung liefert genaue Ergebnisse.
Ergebnisse
Repräsentative Ergebnisse zeigen die Entwicklung und das Fortschreiten der suprarenalen Aneurysmen, wie sie durch Ultraschall zu Studienbeginn, Tag 8 und Tag 27 überwacht werden (Abbildung 1A). Eine trichrome Färbung (Abbildung 1B) der Aorta des Tages 27 in Abbildung 1A veranschaulicht die Morphologie des gebildeten Aneurysmas mit Wanddissektion und intramuralem Thrombus. Das Aortenvolumen (mm3) wurde über eine Strecke von 12 mm14 bestimmt, und der maximale Aortendurchmesser wurde zusätzlich aus den EKV-Bildern gemessen. Für die Definition der anfänglichen Aneurysmaentwicklung wurde ein Schwellenwert von 125% Volumenwachstum vom Ausgangswert bis zum 8. Tag festgelegt. Basierend auf Daten, die über einen Zeitraum von 2 Jahren (2020-2021, n = 157) erhoben wurden, konnten nur 9% der Tiere keine AAA gemäß diesem Cutoff bilden. Bei 35 % der Mäuse kam es jedoch vor der Katheterimplantation am 9. Tag zu Aortenrupturen (thorakal oder abdominal), so dass insgesamt 56 % der verbleibenden Tiere mit etablierter AAA-Erkrankung in Behandlungsgruppen eingeteilt werden konnten (Abbildung 1C). Bemerkenswert ist, dass sich unter unseren historischen PBS-Kontrollen (n = 21) Aneurysmen unterschiedlich stark entwickelten (Bereich: 128%-314%, Mittelwert 199% ± 55% SD-Aortenvolumenwachstum an Tag 8). Wichtig ist, dass eine umgekehrte Beziehung zwischen der anfänglichen Expansion und dem weiteren Fortschreiten der Erkrankung beobachtet wurde, d.h. 55% der schnell fortschreitenden Aneurysmen (>200% Volumenwachstum am Tag 8) entwickelten sich erst am Tag 27 weiter, während 80% der anderen Aneurysmen (>125% und <200% Volumenwachstum am Tag 8) bis zum Ende des Experiments weiter zunahmen (Abbildung 1D).
Wie kürzlich berichtet 14,17, wurden die beschriebenen Methoden erfolgreich etabliert, validiert und implementiert, z.B. um die therapeutische Wirkung eines Histon-Citrullinierungsinhibitors (GSK484, zur Hemmung der neutrophilen extrazellulären Fallenbildung) bei der Blockierung des Fortschreitens der etablierten AAA zu dokumentieren. ApoE-defiziente Mäuse erhielten Ang-II bei 1000 ng/kg/min durch subkutan implantierte osmotische Pumpen über 28 Tage. Die Tiere wurden 1:1 bis GSK484 (0,2 μg/g/Tag) oder PBS-Behandlung basierend auf dem am Tag 8 gemessenen Aortenvolumen stratifiziert und am Tag 9 der Jugularvenenkatheterisierung unterzogen. Arzneimittelinjektionen wurden täglich in einem Volumen von 10 μL/g Mausgewicht bis zum Ende der Studie durchgeführt17. Abbildung 2 zeigt beispielhafte (n = 2/Gruppe) Ultraschallergebnisse (Zeitverlauf der absoluten und relativen Volumen- oder Durchmesserausdehnung), die zeigen, dass die Behandlung mit GSK484 die AAA-Progression hemmt, während sich die Aneurysmen bei Kontrollmäusen weiter vergrößern.
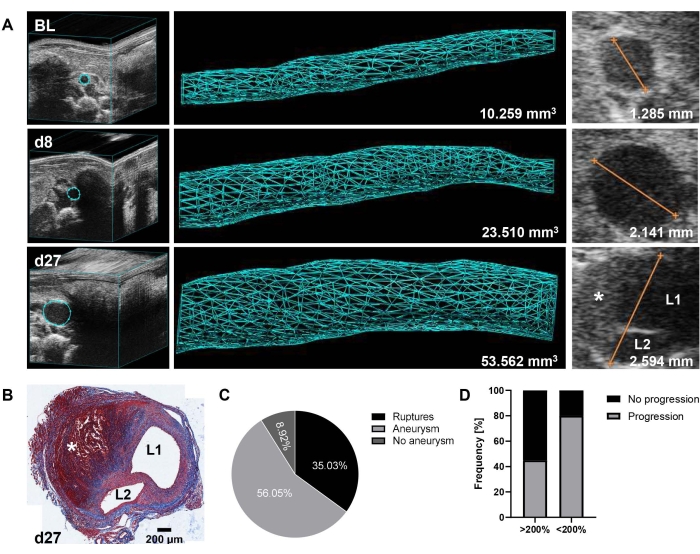
Abbildung 1: AAA-Bildung und -Progression im Ang-II-Mausmodell, wie mittels 3D-Ultraschall detektiert . (A) Die suprarenale Aorta wurde durch 3D-Ultraschall zu Studienbeginn (BL), Tag 8 (d8) und Tag 27 (d27) nach Ang-II-Pumpimplantation überwacht. Das Volumen wurde über eine Strecke von 12 mm der Nebennierenaorta (157 Bilder) auf der Grundlage eines 3D-rekonstruierten Bildes gemessen. Der maximale Aortendurchmesser wurde aus EKV-Bildern bestimmt. (B) Trichrome Färbung eines Querschnitts der Aorta des Tages 27 nach Mäuseopfer und Organentnahme. Das Vorhandensein einer Aortendissektion wird durch L1/L2 (Lumen 1 und Lumen 2) angezeigt, und der intramurale Thrombus wird mit * in A und B bezeichnet. (C) Inzidenzrate von AAA (>125% Aortenvolumenwachstum von BL) an Tag 8 und Aortenrupturen innerhalb der ersten 9 Tage (thorakal oder abdominal) aus einem Datensatz, der über 2 Jahre gesammelt wurde (n = 157). (D) Progressionshäufigkeit von Tag 8 bis Tag 27 von anfänglich schnell bildenden (>200% Aortenvolumenwachstum von BL bis Tag 8) versus mäßig wachsendes (>125% und <200% Aortenvolumenwachstum von BL bis Tag 8) Aneurysmen bei PBS-kontrollierten Mäusen (n = 21). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
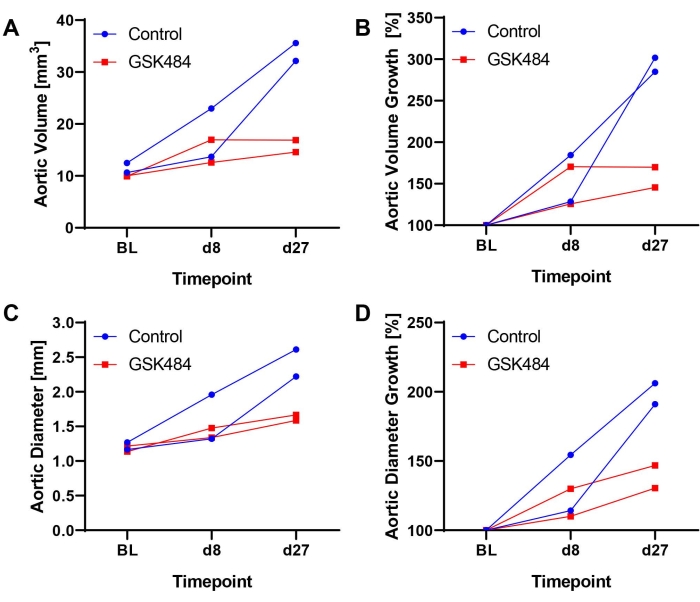
Abbildung 2: Beispielhafte Ergebnisse aus der Hemmung der Histon-Citrullinierung zur Blockierung der AAA-Progression im Ang-II-Modell durch intravenöse Injektion von GSK484 oder PBS über einen vaskulären Zugangsknopf . (A) Aortenvolumen (mm3), gemessen über einen Abschnitt der Nebennierenaorta von 12 mm. (B) Berechnetes Aortenvolumenwachstum gegenüber dem Ausgangswert (BL = 100%). (C) Maximaler Aortendurchmesser, bestimmt anhand von EKV-Bildern. (D) Berechnetes Aortendurchmesserwachstum aus BL. GSK484-Daten wurden aus einer zuvor veröffentlichten Studieextrahiert 17. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Das Ang-II-Modell ist eines der am häufigsten verwendeten Mausmodelle von AAA aufgrund seiner geringen technischen Anforderungen und besonderen Merkmale, die der menschlichen Krankheit ähneln 3,6. Die Operationszeit beträgt etwa 10 Minuten pro Tier, und die subkutane Pumpenimplantation wird von den Mäusen gut vertragen, wenn die subkutane Tasche ausreichend breit ist und tief auf dem Rücken des Tieres platziert ist, weg von der Inzisionsstelle, um die Wundheilung nicht zu stören. Wenn die Haut um die Pumpe gespannt ist, kann es zu Gewebereizungen kommen, die Entzündungen und Schorfbildung verursachen und möglicherweise den Freisetzungsmechanismus der Pumpe durch osmotischen Druck stören können. Die Messung des Volumens von Ang-II, das zum Zeitpunkt des Tieropfers in der Pumpe verblieben ist, gibt Aufschluss darüber, ob der Ang-II über die 28 Tage erfolgreich freigesetzt wurde.
Das Ang-II-Modell wurde kürzlich als gut geeignet für die Untersuchung des Aortenaneurysmas und der Dissektionsprogression vorgeschlagen, da es Ähnlichkeit mit menschlichen Merkmalen beider aufweist6. Wichtig ist, dass das Testen von Medikamentenkandidaten zur Blockierung der Aortenexpansion und zur Beeinflussung des Umbaus der aktuellen klinischen Nachfrage entsprechen würde. In unserer experimentellen Umgebung wurde vor Beginn der Behandlung ein Cutoff für die Bildung von Aneurysmen definiert, basierend auf einem Volumenwachstum von 125% am Tag 8 im Vergleich zum Ausgangswert, was die natürliche Variation der absoluten Aortengröße bei Mäusen erklärt. Die Schwelle und der Zeitpunkt wurden aus einem anfänglichen Zeitverlauf abgeleitet, der die Zerstörung der Aortenwand in der Histologie bestätigte (Daten nicht gezeigt) und zu 35% Rupturen und 56% beobachteten AAAs vor der Katheterimplantation führte. Während eine Mindestschwelle der etablierten Erkrankung für den Studieneinschluss angewendet wurde, wurde anschließend beobachtet, dass ein hohes Ausmaß der anfänglichen Aortenexpansion auch die experimentelle Anwendbarkeit einschränken kann. Aneurysmen, die am 8. Tag schnell auf >200% Volumen anwuchsen, wuchsen in 55% der Fälle nicht weiter über diese Größe hinaus (Abbildung 1D). Dies muss bei der experimentellen Planung und der Berechnung der Stichprobengröße berücksichtigt werden, da dies die wahre Wirkung einer Behandlung verschleiern könnte. Eine weitere Facette dieses Modells sind die häufigen Aortenrupturen (thorakal oder abdominal), die mit Raten von 20%-40% und meist innerhalb der ersten 10 Tage nach Ang-II-Pumpimplantation auftreten 3,18,19. So wurde durch die Wahl des Behandlungsbeginns als Tag 9 eine hohe Rate etablierter Aneurysmen erreicht, und die Jugularvenenkatheterisierung wurde im Wesentlichen an Mäusen durchgeführt, von denen erwartet wurde, dass sie bis zum Ende des Experiments überleben würden (nur 3/24 Mäuse in unserer historischen Kontrollgruppe rissen nach Tag 9), wodurch Zeit, Mühe, und Kosten.
Abgesehen von den Aortenrupturen, die eine schwere Erkrankung darstellen, wurde die gleichzeitige Implantation des Katheters mit Gefäßzugangsknopf und der osmotischen Pumpe von den Mäusen gut vertragen, ohne nennenswerte Auswirkungen auf die Mobilität oder das Verhalten nach der Genesung von der Operation. Die Jugularvenenkatheterisierung sollte für ausgebildete Forscher etwa 30 Minuten dauern. Die Dauer der Exposition gegenüber (Isofluran-) Anästhesie sollte auf ein Minimum beschränkt werden, und die Atemfrequenz des Tieres muss engmaschig überwacht werden, um eine Atemdepression zu verhindern, die zu einem tödlichen Ausgang führen kann, wenn sie nicht gelöst wird20. Blutverlust nach Punktion der Halsvene für das Einführen des Katheters - was zum Tod des Tieres führt, wenn es schwerwiegend ist - kann möglicherweise auftreten, wenn die Halsvene nicht richtig kranial ligiert ist oder ein Seitenast, der in den isolierten Bereich des Gefäßes einspeist, nicht verschlossen ist. In diesem Fall sollte Druck mit einem Wattestäbchen auf die Einstichstelle ausgeübt werden, bis sich der Blutverlust verlangsamt oder stoppt, dann sollte das Einführen und die Ligatur des Katheters so schnell wie möglich erfolgen; Ein kleines Stück der Kollagenwundauflage kann vorübergehend verwendet werden, um bei der Hämostase zu helfen.
Die Katheterdurchgängigkeit ist einer der wichtigsten Faktoren, da die Kathetertrennung von der Vene oder dem Zugangsknopf zu einer unsachgemäßen Medikamentenabgabe führt, bei der das Medikament in den subkutanen Raum austritt. Nach der Empfehlung des Herstellers einer Überlappung von mindestens 3 mm zwischen Katheter und Metallanschluss wurde bei diesem Modell über 3 Jahre (2020-2021, n = 73) nur ein Fall von Kathetertrennung an der Knopfseite (angezeigt durch die injizierte Flüssigkeit, die aus der Inzisionsstelle am Knopf austritt) aufgezeichnet, der durch Öffnen der Wunde und Wiederherstellung der Verbindung in der Operation behoben wurde. Darüber hinaus kam es in unserer historischen PBS-Kontrollgruppe (2/21) zu einer Katheter-Durchgängigkeitsversagensrate von etwa 10% aufgrund eines Katheterverschlusses (der eine Injektion unmöglich machte), einer Kathetertrennung von der Vene (angezeigt durch eine offensichtliche Schwellung im Hals während der Injektion) oder aufgrund von Wundheilungskomplikationen. Diese Probleme können mit selbst zugefügten Verletzungen zusammenhängen, z. B. Mauskratzern oder Bissen. Insbesondere medikamentöse Behandlungen, die die Wundheilung beeinträchtigen, können die Ausfallraten erhöhen. Zu den Schritten zur Fehlerbehebung zur Verbesserung der Durchgängigkeitsrate gehören die Erhöhung der Länge des in die Vene eingeführten Katheters, die Sicherstellung, dass die Ligaturen fest um Katheter und Vene geknotet sind, und die Anwendung der Überdrucktechnik gemäß der Empfehlung des Herstellers, wie in Schritt 2.12.10. beschrieben, während der Injektion. Die Durchgängigkeit des Katheters sollte zusätzlich zum Zeitpunkt des Tieropfers durch Sezieren und visuelle Inspektion unter dem Mikroskop überprüft werden. Bemerkenswert ist, dass die tägliche Menge der injizierten Arzneimittellösung sorgfältig berücksichtigt werden muss. Da das Plasmavolumen den Blutdruck reguliert, kann das Injektionsvolumen die AAA-Expansion beeinflussen, und daher müssen Kontrolltiere das Scheinverfahren mit Trägervolumen erhalten. Basierend auf unseren Erfahrungen (und unveröffentlichten Beobachtungen) scheint eine tägliche Menge von bis zu 250 μL PBS gut verträglich zu sein. Schließlich können, ähnlich wie bei der Pumpimplantation, Hautreizungen um den implantierten Gefäßzugangsknopf auftreten. Wenn eine Entzündung beobachtet wird, die von devitalisiertem oder nekrotischem Gewebe begleitet wird, sollte das Wunddebridement durchgeführt werden, indem nicht lebensfähiges Gewebe entfernt wird (nekrotisches Gewebe trennt sich oft auf natürliche Weise von der Wunde), und die Haut sollte bei Bedarf genäht werden; Sind Entzündungen und Nekrosen großflächig, müssen das Wohlergehen und die humanen Endpunkte des Tieres richtlinienkonform berücksichtigt werden.
Die einfache und doppelte dorsale Implantation der osmotischen Pumpe und/oder des VAS störte weder das Ultraschallsignal noch die Sicherung der Maus in einer geeigneten Position auf dem Ultraschalltisch. Die automatisierte Erfassung von 157 Bildern über 12 mm zur Erstellung eines 3D-Bildes der Aorta für die Volumenmessung ist ein einfaches und schnelles Verfahren14, bei dem nur sichergestellt werden muss, dass die Aorta frei von Störungen über den interessierenden Bereich ist. Ein Fallstrick in diesem Zusammenhang ist die Anwendung von zu viel Druck mit dem Schallkopf beim Versuch, das Bild von Störungen zu befreien, was die automatisierte Messung unterbrechen kann, wenn die Atemfrequenz durch die Kompression der Rippen beeinflusst wird, wenn Bilder des Schädelendes der Bauchaorta aufgezeichnet werden. Der Durchmesser wird traditionell in Bildern gemessen, die im B-Modus aufgenommen wurden, indem der Bediener während der Ultraschallanalyse manuell nach dem Bereich mit maximalem Durchmesser sucht. Eine Weiterentwicklung der B-Mode-Bilder sind die EKV-Bilder, die kleine Aortenbewegungen auflösen können, um ein qualitativ hochwertiges, verlangsamtes Bild der pulsierenden Aorta zu erzeugen. Darüber hinaus kann der maximale Aortendurchmesser aus den aufgenommenen 3D-Frames bestimmt werden, wobei die 157 Bilder einen umfassenden Überblick über die an der Systole aufgenommene Aorta bieten (aufgrund des eingestellten EKG-Triggers).
Zusammenfassend bietet das vorgestellte kompilierte Protokoll einen zuverlässigen und reproduzierbaren Workflow für die intravenöse Medikamentenverabreichung in einem Mausmodell von Ang-II-induzierter AAA und für die Überwachung der Aortengröße durch 3D-Ultraschall. Die Zeitpunkte der Überwachung und des Betriebs können an die spezifischen Bedürfnisse angepasst werden, und die Jugularvenenkatheterisierung kann separat für jeden Versuchsaufbau durchgeführt werden, der die Abgabe spezifischer Substanzen über intravenöse Injektionen erfordert. Das VAS kann alternativ zur wiederholten Blutentnahme verwendet werden, wenn eine Kathetersperrlösung verwendet wird, um eine Gerinnung zu verhindern. Das beschriebene 3D-Ultraschallverfahren kann angepasst werden, um die infrarenale Aorta zu messen, wo sich Aneurysmen bei akuter Beleidigung in Elastase- oder CaCl2-basierten Mausmodellen von AAA entwickeln. Während die 3D-Ultraschallaufnahme den Vorteil hat, einen Überblick über die betroffene Aortenregion und die Aneurysmamorphologie zu geben, ist die Bildaufnahme zeitaufwendiger und kann daher kostenintensiver sein. Eine weitere Einschränkung des Protokolls, die anerkannt werden sollte, ist die Notwendigkeit, dass die Tiere für intravenöse Injektionen kurz betäubt werden, während die intraperitoneale Verabreichung im Allgemeinen an bewussten Mäusen durchgeführt wird.
Offenlegungen
Die Autoren haben keine Angaben.
Danksagungen
Wir danken den Teams von Prof. Podesser und Prof. Ellmeier (Department of Biomedical Research and Core Facility for Laboratory Animal Breeding and Husbandry, Medizinische Universität Wien) für die Unterstützung bei den Tierversuchen. Die AAA-Trichromfärbung wurde freundlicherweise von Monika Weiss und Prof. Peter Petzelbauer (Universitätsklinik für Dermatologie, Medizinische Universität Wien) durchgeführt. Diese Arbeit wurde vom Fonds zur Förderung der wissenschaftlichen Forschung gefördert [SFB-Projekt F 5409-B21]. Marc Bailey wird persönlich unterstützt von der British Heart Foundation [FS/18/12/33270].
Materialien
| Name | Company | Catalog Number | Comments |
| 4-0 Polysorb sutures | Covidien | GL-46-MG | Braided absorbable suture CV-23 Taper |
| 6-0 Silk sutures | Ethicon | 639H | PERMA-HAND Silk |
| ALZET 2004 osmotic pumps | DURECT Corp | 298 | Osmotic mini pumps |
| Angiotensin-II | Bachem | 4006473.0100 | Angiotensin II acetate |
| Aquasonic Clear Ultrasound Transmission Gel | Parker Labs | PUSG-0308 | Ultrasound gel |
| Betadona Wound Spray | Mundipharma | Wound disinfectant spray (povidone-iodine spray) | |
| Betaisodona Solution | Mundipharma | 15973 | Wound disinfectant solution (povidone-iodine solution) |
| Catheter for mouse femoral vein/artery | Instech Laboratories Inc | C10PU-MFV1301 | 1 to 3Fr, 10.5 cm, collar @1.2 cm. Fits 22 G |
| Hair removal cream | |||
| Handling tool | Instech Laboratories Inc | VABMG | Handling tool for magnetic mouse Vascular Access Buttons |
| HYLO NIGHT Eye Oinment | URSAPHARM | 538922 | Eye lubricant cream |
| Needles and syringes of various sizes | 1 mL and 5 mL syringes, 27 G and 30 G needles | ||
| Olympus SZ51 Stereo microscope | Olympus Corporation | Dissection and inspection microscope | |
| PinPort injectors | Instech Laboratories Inc | PNP3M-50 | Injector for vascular access button |
| Protective aluminum cap | Instech Laboratories Inc | VABM1C | Protective aluminum cap for magnetic 1 channel mouse VAB |
| Signa Electrode Ultrasound Gel | Parker Labs | PE-1560 | Electrode gel |
| Small electric shaver | |||
| Surigcal and microsurgical equipment | |||
| Suprasorb C | Lohmann & Rauscher | 20482 | Collagen wound dressing |
| Vascular access button (VAB) | Instech Laboratories Inc | VABM1B/22 | Vascular Access Button for mouse, magnetic, 1 channel 22 G, injector |
| Vevo 3100 Imaging System | FUJIFILM VisualSonics Inc | 51073-51 | Ultrasound system |
| Vevo Lab 5.6.1 software | FUJIFILM VisualSonics Inc | Ultrasound analysis software | |
| Vevo MX550D transducer | FUJIFILM VisualSonics Inc | Linear Array Transducer For Vevo 3100 system | |
| Vevo Mouse Handling Table | FUJIFILM VisualSonics Inc | 11436 | Mouse heating, mouse core temperature capture and ECG pads for physiological monitoring |
Referenzen
- Busch, A., et al. Translating mouse models of abdominal aortic aneurysm to the translational needs of vascular surgery. JVS-Vascular Science. 2, 219-234 (2021).
- Golledge, J., Krishna, S. M., Wang, Y. Mouse models for abdominal aortic aneurysm. British Journal of Pharmacology. 179 (5), 792-810 (2022).
- Daugherty, A., Manning, M. W., Cassis, L. A. Angiotensin II promotes atherosclerotic lesions and aneurysms in apolipoprotein E-deficient mice. Journal of Clinical Investigation. 105 (11), 1605-1612 (2000).
- Bhamidipati, C. M., et al. Development of a novel murine model of aortic aneurysms using peri-adventitial elastase. Surgery. 152 (2), 238-246 (2012).
- Phillips, E. H., et al. Morphological and biomechanical differences in the elastase and AngII apoE -/- rodent models of abdominal aortic aneurysms. BioMed Research International. 2015, 413189(2015).
- Gäbel, G., et al. Parallel murine and human aortic wall genomics reveals metabolic reprogramming as key driver of abdominal aortic aneurysm progression. Journal of the American Heart Association. 10 (17), 20231(2021).
- Phie, J., Thanigaimani, S., Golledge, J. Systematic review and meta-analysis of interventions to slow progression of abdominal aortic aneurysm in mouse models. Arteriosclerosis, Thrombosis, and Vascular Biology. 41 (4), 1504-1517 (2021).
- Lu, H. S., Owens, A. P., Liu, B., Daugherty, A. Illuminating the importance of studying interventions on the propagation phase of experimental mouse abdominal aortic aneurysms. Arteriosclerosis, Thrombosis, and Vascular Biology. 41 (4), 1518-1520 (2021).
- Al Shoyaib, A., Archie, S. R., Karamyan, V. T. Intraperitoneal route of drug administration: Should it be used in experimental animal studies. Pharmaceutical Research. 37 (1), 1-17 (2020).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: Routes of administration and factors to consider. Journal of the American Association for Laboratory Animal Science. 50 (5), 600-613 (2011).
- Derde, S., et al. Use of a central venous line for fluids, drugs and nutrient administration in a mouse model of critical illness. Journal of Visualized Experiments. (123), e55553(2017).
- Lu, W., et al. Microsurgical skills of establishing permanent jugular vein cannulation in rats for serial blood sampling of orally administered drug. Journal of Visualized Experiments. (178), e63167(2021).
- Jespersen, B., Knupp, L., Northcott, C. A. Femoral arterial and venous catheterization for blood sampling, drug administration and conscious blood pressure and heart rate measurements. Journal of Visualized Experiments. (59), e3496(2012).
- Waduud, M. A., et al. High-frequency three-dimensional lumen volume ultrasound is a sensitive method to detect early aneurysmal change in elastase-induced murine abdominal aortic aneurysm. Aorta. 9 (6), 215-220 (2020).
- Lu, H., et al. Subcutaneous angiotensin II infusion using osmotic pumps induces aortic aneurysms in mice. Journal of Visualized Experiments. (103), e53191(2015).
- Sawada, H., et al. Ultrasound imaging of the thoracic and abdominal aorta in mice to determine aneurysm dimensions. Journal of Visualized Experiments. (145), e59013(2019).
- Eilenberg, W., et al. Histone citrullination as a novel biomarker and target to inhibit progression of abdominal aortic aneurysms. Translational Research. 233, 32-46 (2021).
- Saraff, K., Babamusta, F., Cassis, L. A., Daugherty, A. Aortic dissection precedes formation of aneurysms and atherosclerosis in angiotensin II-infused, apolipoprotein E-deficient mice. Arteriosclerosis, Thrombosis, and Vascular Biology. 23 (9), 1621-1626 (2003).
- Trachet, B., Fraga-Silva, R. A., Jacquet, P. A., Stergiopulos, N., Segers, P. Incidence, severity, mortality, and confounding factors for dissecting AAA detection in angiotensin II-infused mice: A meta-analysis. Cardiovascular Research. 108 (1), 159-170 (2015).
- Cesarovic, N., et al. Isoflurane and sevoflurane provide equally effective anaesthesia in laboratory mice. Laboratory Animals. 44 (4), 329-336 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten