A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تقييم تنشيط الكاسباز لتقييم موت الخلايا المناعية الفطرية
In This Article
Summary
يصف هذا البروتوكول طريقة شاملة لتقييم تنشيط الكاسباز (caspase-1 و caspase-3 و caspase-7 و caspase-8 و caspase-9 و caspase-11) استجابة لكل من النماذج في المختبر وفي الجسم الحي (في الفئران) للعدوى والشتائم العقيمة والسرطان لتحديد بدء مسارات موت الخلايا ، مثل pyroptosis ، موت الخلايا المبرمج ، necroptosis ، و PANoptosis.
Abstract
توفر المناعة الفطرية خط الدفاع الأول الحاسم استجابة لمسببات الأمراض والإهانات العقيمة. أحد المكونات الميكانيكية الرئيسية لهذه الاستجابة هو بدء موت الخلايا المبرمج المناعي الفطري (PCD) للقضاء على الخلايا المصابة أو التالفة ونشر الاستجابات المناعية. ومع ذلك ، يرتبط PCD الزائد بالالتهاب وعلم الأمراض. لذلك ، فإن فهم تنشيط وتنظيم PCD هو جانب مركزي لتوصيف الاستجابات المناعية الفطرية وتحديد أهداف علاجية جديدة عبر طيف المرض.
يوفر هذا البروتوكول طرقا لتوصيف تنشيط PCD المناعي الفطري من خلال مراقبة caspases ، وهي عائلة من البروتياز المعتمد على السيستين والتي غالبا ما ترتبط بمسارات PCD المتنوعة ، بما في ذلك موت الخلايا المبرمج ، pyroptosis ، necroptosis ، و PANoptosis. وصفت التقارير الأولية caspase-2 و caspase-8 و caspase-9 و caspase-10 على أنها كاسباس بادئ و caspase-3 و caspase-6 و caspase-7 ككاسباز مستجيب في موت الخلايا المبرمج ، بينما وجدت الدراسات اللاحقة أن caspases الالتهابية ، caspase-1 ، caspase-4 ، caspase-5 ، و caspase-11 ، تدفع pyroptosis. من المعروف الآن أن هناك تقاطعا مكثفا بين الكاسباس وجزيئات المناعة وموت الخلايا الفطرية الأخرى عبر مسارات PCD المحددة سابقا ، مما يحدد فجوة معرفية رئيسية في الفهم الميكانيكي للمناعة الفطرية و PCD ويؤدي إلى توصيف PANoptosis. PANoptosis هو مسار التهابي فطري فريد من نوعه ينظمه مجمعات PANoptosome ، والتي تدمج المكونات ، بما في ذلك caspases ، من مسارات موت الخلايا الأخرى.
هنا ، يتم توفير طرق لتقييم تنشيط caspases استجابة للمنبهات المختلفة. تسمح هذه الطرق بتوصيف مسارات PCD في كل من المختبر والجسم الحي ، حيث تخضع الكاسباز المنشطة لانقسام بروتيني يمكن تصوره عن طريق النشاف الغربي باستخدام الأجسام المضادة المثلى وظروف النشاف. تم إنشاء بروتوكول وتدفق عمل النشاف الغربي الذي يسمح بتقييم تنشيط كاسباز متعددة من نفس المجموعة الخلوية ، مما يوفر توصيفا شاملا لعمليات PCD. يمكن تطبيق هذه الطريقة عبر مجالات البحث في التنمية ، والتوازن ، والعدوى ، والالتهابات ، والسرطان لتقييم مسارات PCD عبر العمليات الخلوية في الصحة والمرض.
Introduction
يعمل جهاز المناعة الفطري كخط دفاع أول أثناء العدوى واستجابة للمثيرات العقيمة، مثل إصابة الأنسجة والتغيرات في الاتزان الداخلي. تستجيب المستشعرات المناعية الفطرية على سطح الخلية وفي السيتوبلازم للأنماط الجزيئية المرتبطة بمسببات الأمراض أو الضرر (PAMPs أو DAMPs ، على التوالي) لتحفيز مسارات الإشارات الالتهابية والاستجابات الخلوية. تتمثل إحدى العمليات الرئيسية للاستجابة المناعية الفطرية في تحريض موت الخلايا لإزالة الخلايا المصابة أو التالفة وتحفيز المزيد من الاستجابات المناعية الفطرية والتكيفية. موت الخلايا المبرمج (PCD) هو عملية محفوظة للغاية عبر الأنواع ، مما يسلط الضوء على أهميتها التطورية كآلية مناعية فطرية.
هناك العديد من مسارات PCD المناعية الفطرية التي يمكن تنشيطها في جميع أنواع الخلايا. Caspases هي عائلة رئيسية من البروتياز المحفوظة للغاية ، داخل الخلايا ، والتي تعتبر حاسمة عبر العديد من مسارات PCD ، بما في ذلك مسار موت الخلايا المبرمج غير الالتهابي تقليديا ، بالإضافة إلى مسارات PCD الالتهابية مثل pyroptosis و necroptosis و PANoptosis1،2،3،4،5 . هناك 11 كاسباس بشري و 10 فأر محددة جيدا ، بالإضافة إلى كاسباس زائف قد يكون وظيفيا ، ويتم التعبير عن معظمها بشكل أساسي على أنها أحادي غير نشط أو ثنائي الكاسباز المؤيد للكاسباس الذي يتطلب انقساما للتنشيط 6,7. تحتوي Caspases أيضا على مجالات مهمة لتجنيد وتشكيل مجمعات متعددة البروتينات. وتشمل هذه المجالات مجال التنشيط والتوظيف caspase (CARD) ، والذي يمكن العثور عليه في caspase-1 و caspase-2 و caspase-4 و caspase-5 و caspase-9 و caspase-11 ، أو مجال مستجيب الموت (DED) ، الموجود في caspase-8 و caspase-10. من خلال كل من نشاطها المحلل للبروتين وقدرتها على تكوين مجمعات متعددة البروتينات ، تعد الكاسباز محركات حاسمة ل PCD المناعي الفطري.
تم تحديد دور caspases في PCD المناعي الفطري لأول مرة في موت الخلايا المبرمج ، حيث يقوم caspases البادئ ، caspase-2 ، caspase-8 ، caspase-9 ، و caspase-10 ، بتنشيط caspases الجلاد ، caspase-3 ، caspase-6 ، و caspase-7 ، لدفع موت الخلايا8،9،10،11،12. يمكن تنشيط كاسباس البادئ بواسطة شلالات إشارات متنوعة ؛ ينشط المسار الخارجي Caspase-8 من خلال إشارات مستقبلات الموت التي يسببها الرباط خارج الخلية ، وينشط المسار الداخلي Caspase-9 من خلال تعطيل سلامة الميتوكوندريا13. تقوم كاسباس البادئ المنشط بشق الرابط الذي يفصل بين الوحدات الفرعية التحفيزية الكبيرة والصغيرة لكاسباس الجلاد لإنتاج أشكالها النشطة. ثم يقوم الجلاد بشق ركائزه لتفكيك الخلية ، مما يؤدي إلى تدهور الحمض النووي ، وتفجير الغشاء ، والتجزئة النووية ، وإطلاق أجسام موت الخلايا المبرمج14,15. تنتهي هذه العملية عادة بشكل غير لاتيني وغير التهابي من موت الخلايا عندما تقترن بالإزالة الفورية للخلايا الميتة عن طريق كثرة الخلايا الفعالة16. ومع ذلك ، يمكن أن تؤدي العيوب في كثرة الخلايا أو نقص الخلايا البلعمية إلى تراكم الخلايا المبرمج ، والتي تخضع بعد ذلك لموت الخلايا الانحلالية والالتهابية17,18.
تم اكتشاف أن الكاسباس الالتهابي ، بما في ذلك caspase-1 (الإنسان والفأر) ، caspase-4 و caspase-5 (الإنسان) ، و caspase-11 (الفأر) ، يتم تنشيطه خلال شكل من أشكال التهاب المناعة الفطرية PCD (III-PCD) يسمى pyroptosis. يرتبط تنشيط Caspase-1 بتكوين الالتهابات ، وهي مجمعات متعددة البروتينات تحتوي على مستشعر مناعي فطري خلوي ، وجزيء محول (بروتين شبيه بالبقع مرتبط بموت الخلايا المبرمج يحتوي على CARD [ASC]) ، و caspase-1. يسمح تكوين هذا المركب للكاسباز -1 بالخضوع للتحلل الذاتي بوساطة القرب لإطلاق شكله النشط ، والذي يمكن أن يشق الركائز المستهدفة بما في ذلك السيتوكينات المؤيدة للالتهابات إنترلوكين (IL) -1β و IL-18 وجزيء Gasdermin D المكون للمسام (GSDMD) 19،20،21،22،23 . يمكن ل Caspase-11 و caspase-4 و caspase-5 أيضا تنشيط GSDMD دون تكوين المنبع للالتهابات بعد استشعار PAMPs مثل عديد السكاريد الدهني (LPS) 19,20. تخضع هذه الكاسباز للتثبيط متبوعا بقليل القلة والانقسام الذاتي للتنشيط عند الارتباط ب LPS الخلوي ، مما يؤدي إلى تنشيط التهابي غير قانوني 24،25،26 وتنشيط caspase-1 بطريقة جوهرية للخلية للحث على نضوج IL-1β و IL-1820. إن نضوج وإطلاق هذه السيتوكينات المؤيدة للالتهابات يميز هذه الكاسباس بأنها "التهابية". بالإضافة إلى ذلك ، تم العثور على كاسباز -8 موت الخلايا المبرمج لتوطين إلى الالتهاب ، مما يوفر صلة بين عمليات موت الخلايا المبرمج والبيروبتوبوتيك. وقد وجدت الدراسات أن موت الخلايا المبرمج caspase-8 أمر بالغ الأهمية أيضا لتنظيم شكل آخر من أشكال PCD يسمى necroptosis. يؤدي فقدان caspase-8 إلى تنشيط السودوكيناز المختلط الشبيه بمجال كيناز السلالة المختلطة (MLKL) بوساطة مستقبلات سيرين ثريونين 3 (RIPK3) لقيادة مسار III-PCD للنخر27،28،29،30،31،32،33،34،35.
في حين تم تصنيف الكاسباس تاريخيا على أنه "غير أبوبتويتي" أو "التهابي" بناء على نوع موت الخلايا الذي يبدأه ، تشير الأدلة المتزايدة إلى وجود تداخل مكثف بين مسارات PCD المناعية الفطرية من خلال caspases 3,4. على سبيل المثال ، يشق caspase-1 الالتهابي من الالتهابات caspase-7 المبرمج في موقع التنشيط الكنسي34. يمكن أن يؤدي تنشيط Caspase-1 أيضا إلى انقسام ركائز موت الخلايا المبرمج مثل بوليميراز بوليميراز 1 (ADP-ribose) 1 (PARP1) 36. في الخلايا التي تفتقر إلى GSDMD ، يمكن أن يشق caspase-1 أيضا caspase-337,38. بالإضافة إلى ذلك ، يمكن ل caspase-3 المبرمج قانونا أن يشق gasdermin E (GSDME) للحث على PCD17,18 ويعالج أيضا GSDMD في شكل غير نشط40. علاوة على ذلك ، لوحظ تجنيد caspase-8 في المجمع الالتهابي 39،40،41،42،43،44،45 ، و caspase-8 هو منظم رئيسي للتنشيط الالتهابي الكنسي وغير الكنسي 39. هناك أيضا أدوار متداخلة وزائدة عن الحاجة ل caspase-8 و caspase-1 في العديد من الحالات الالتهابية ، ويحدث PCD المناعي الفطري الذي يتميز بتنشيط المكونات النارية واللافتوتيكية والميتة عبر طيف المرض39،46،47،48،49،50.
بناء على هذا الحديث المتبادل بين الكاسباس الالتهابي وموت الخلايا المبرمج ، تم تحديد فجوة رئيسية في الفهم الميكانيكي للمناعة الفطرية و PCD ، مما أدى إلى اكتشاف PANoptosis. PANoptosis هو شكل فريد من أشكال III-PCD يتم تنشيطه استجابة لمسببات الأمراض ، PAMPs ، DAMPs ، والتغيرات في التوازن ويتم تنظيمه بواسطة PANoptosomes - مجمعات جزيئية متعددة الأوجه تدمج مكونات من مسارات موت الخلايا الأخرى 44،50،51،52،53،54،55 . لا يمكن حساب مجمل التأثيرات البيولوجية في PANoptosis بشكل فردي عن طريق pyroptosis أو موت الخلايا المبرمج أو necroptosis وحده 3،4،35،36،39،46،47،48 ، حيث يتميز PANoptosis بتنشيط caspases متعددة ، بما في ذلك caspase-1 و caspase-11 و caspase-8 و caspase-9 و caspase-3 و / أو caspase-7 ، اعتمادا على السياق 44،48،49،50،51،52،53،54،56،57،58،59،60،61،62 . لقد تورط PANoptosis بشكل متزايد في الأمراض المعدية والالتهابية ، وكذلك في السرطانات وعلاجات السرطان3،4،35،36،39،44،46،47،48،49،50،51،52،53 ,54,56
,57,58,59,60,61,62,63,64,65,66.
نظرا للدور الأساسي للكاسباز عبر مسارات موت الخلايا ، بما في ذلك موت الخلايا المبرمج ، وداء البروبتوسيس ، والتنخر ، و PANoptosis ، من المهم تطوير تقنيات لتوصيف تنشيطها وفهم التعقيد الكامل لمسارات PCD. يوضح البروتوكول هنا طريقة لتحفيز الخلايا وقياس التنشيط اللاحق للكاسباز (الشكل 1). تستفيد هذه الطريقة من الانقسام المحلل للبروتين للكاسباس ، وهو أمر مطلوب بشكل عام لتنشيطها ، كوسيلة لدراستها. من خلال النشاف الغربي ، يمكن تحديد أحجام البروتين ، مما يسمح بالتصور الواضح والتمايز بين pro-caspases غير النشطة وأشكالها المشقوقة المنشطة.
تتمثل المزايا الرئيسية لهذا البروتوكول في 1) قدرته على تقييم تنشيط كاسباس متعددة بالتوازي من مجموعة واحدة من الخلايا الداخلية لتحديد تنشيط PCD بشكل أكثر دقة و 2) استخدام تقنيات معملية بسيطة نسبيا لا تتطلب تدريبا مكثفا أو معدات باهظة الثمن. استخدمت البروتوكولات السابقة النشاف الغربي ، أو مراسلي الفلورسنت ، أو تلطيخ الأجسام المضادة لمراقبة تنشيط الكاسباز في طافات الثقافة ، والخلايا والأنسجة المحللة ، والخلايا الكاملة عن طريق الفحص المجهري ، وفي الجسم الحي67،68،69،70،71 ، ولكن هذه التقنيات بشكل عام تراقب فقط واحد أو اثنين من caspases في العينة. علاوة على ذلك ، في حين تم استخدام ركائز الببتيد الاصطناعية التي تحتوي على مواقع انشقاق الكاسباز التي تتألق عند الانقسام لمراقبة تنشيط الكاسباز في الخلية أو الأنسجة المحللة69 ، يمكن في كثير من الأحيان شق هذه الركائز بأكثر من كاسباز واحد ، مما يجعل من الصعب تحديد التنشيط المحدد للكاسباز الفردي في هذا النظام. بالإضافة إلى ذلك ، فإن استخدام النشاف الغربي بدلا من استخدام مراسلي الفلورسنت أو الطرق الأخرى القائمة على العلامات يسمح للباحثين باستخدام الخلايا الداخلية بدلا من إنشاء خطوط خلايا محددة مع جينات المراسل. هناك مزايا متعددة لاستخدام الخلايا الداخلية ، بما في ذلك حقيقة أن العديد من خطوط الخلايا الخالدة تعاني من نقص في جزيئات موت الخلايا الرئيسية72,73 ، مما قد يؤثر على النتائج. بالإضافة إلى ذلك ، يسمح استخدام الخلايا الداخلية بتقييم أنواع الخلايا المتنوعة ، مثل الضامة والخلايا الظهارية والخلايا البطانية ، بدلا من سلالة واحدة. النشاف الغربي هو أيضا تقنية بسيطة نسبيا وفعالة من حيث التكلفة يمكن تنفيذها في المختبرات في جميع أنحاء العالم دون الحاجة إلى معدات كبيرة ومكلفة أو إعدادات معقدة.
هذا البروتوكول قابل للتطبيق على نطاق واسع عبر علم الأحياء لفهم كل من وظائف الكاسباس المعتمدة على موت الخلايا والمستقلة عن موت الخلايا ، بما في ذلك أدوارها ووظائفها في السقالات في مسارات الإشارات الالتهابية الأخرى74. يسمح تطبيق هذه الطريقة باتباع نهج موحد في دراسة مسارات PCD المناعية الفطرية والإشارات الالتهابية عبر الأمراض والظروف ، ويمكن استخدام هذا البروتوكول لتحديد العمليات التنظيمية الحرجة والروابط الميكانيكية التي ستفيد في تطوير الاستراتيجيات العلاجية المستقبلية.
Protocol
تمت الموافقة على استخدام الحيوانات وإجراءاتها من قبل لجنة مستشفى سانت جود لأبحاث الأطفال حول استخدام الحيوانات ورعايتها.
1. إعداد الحلول
- قم بإعداد الوسائط المكيفة L929.
- اللوحة 1 × 106 خلايا L929 (انظر جدول المواد) في دورق زراعة الأنسجة 182 سم2 يحتوي على 50 مل من وسائط الاستزراع L929 (انظر الجدول 1 لإعداد الوسائط).
- تنمو الخلايا في حاضنة مرطبة عند 37 درجة مئوية مع 5٪ CO2.
- بعد 7 أيام ، اجمع المادة الطافية وقم بالتصفية باستخدام مرشح 0.45 ميكرومتر. تحضير 50 مل من القسومات (قم بتخزين القسوم المجمدة عند -80 درجة مئوية لمدة تصل إلى 1 سنة).
- تحضير 500 مل من وسائط زراعة البلاعم المشتقة من نخاع العظم (BMDM) (الجدول 1).
- تحضير 500 مل من وسائط تحفيز BMDM (الجدول 1).
- تحضير 500 مل من الوسائط للعدوى (الجدول 1).
- تحضير 100 مل من 1 متر عازلة تريس (الجدول 1).
- تحضير 4x كبريتات دوديسيل الصوديوم (SDS) العازلة (الجدول 1).
- تحضير 1 مل من 1 م 1،4-ديثيوثريتول (DTT ، الجدول 1).
- تحضير 40 مل من محلول تحلل الكاسباز (الجدول 1).
- تحضير 100 مل من 1.5 متر عازلة تريس (الجدول 1).
- تحضير 100 مل من محلول SDS بنسبة 10٪ (بالوزن / الحجم) (الجدول 1).
- تحضير 50 مل من مخزن مؤقت لمقايسة الترسيب المناعي الإشعاعي (RIPA) 2x (الجدول 1).
- تحضير محلول LPS 5 ملغ / مل (الجدول 1).
- تحضير محلول ATP 0.5 M (الجدول 1).
- تحضير حلول النشاف الغربية.
- تحضير 1 لتر من 5x تشغيل المخزون المؤقت (الجدول 1).
- تحضير 1 لتر من مخزون احتياطي النقل 10x (الجدول 1).
- تحضير 1 لتر من محلول ملحي مخزن تريس مع توين 20 (TBST ، الجدول 1).
- تحضير 100 مل من محلول حجب الحليب الخالي من الدسم 5٪ (بالوزن / الحجم) (الجدول 1).
- تحضير حلول الأجسام المضادة الأولية.
- تحضير 10 مل من الجسم المضاد الأولي caspase-1 (الجدول 1).
- تحضير 10 مل من الجسم المضاد الأولي caspase-11 (الجدول 1).
- تحضير 10 مل من الجسم المضاد الأولي caspase-3 (الجدول 1).
- تحضير 10 مل من الجسم المضاد الأولي caspase-7 (الجدول 1).
- تحضير 10 مل من الجسم المضاد الأولي caspase-8 (الجدول 1).
- تحضير 10 مل من الجسم المضاد الأولي caspase-9 (الجدول 1).
- تحضير 10 مل من الأجسام المضادة الأولية المترافقة β-أكتين (الجدول 1).
- تحضير حلول الأجسام المضادة الثانوية.
- تحضير 10 مل من الأجسام المضادة الثانوية المضادة للأرانب (الجدول 1).
- تحضير 10 مل من الأجسام المضادة الثانوية المضادة للفأر (الجدول 1).
- تحضير 10 مل من الأجسام المضادة الثانوية المضادة للفئران (الجدول 1).
2. عزل البلاعم المشتقة من نخاع العظم
ملاحظة: بالنسبة لهذا البروتوكول ، يمكن استخدام الفئران البرية من النوع الذي يتراوح عمره بين 6 و 10 أسابيع مع مسارات PCD سليمة أو الفئران الطافرة مع منظمات PCD أو المستجيبات أو الجزيئات ذات الأهمية المحذوفة أو المعدلة.
- القتل الرحيم للفأرفي غرفة ثاني أكسيد الكربون بمعدل تدفق يزيح 10٪ -30٪ من حجم القفص في الدقيقة لمدة 2-3 دقائق. بعد ذلك ، قم بإجراء طريقة القتل الرحيم الثانوية ، مثل خلع عنق الرحم. اتبع جميع الإرشادات واللوائح الإضافية الخاصة بالمنشأة والمؤسسات والحكومة حيثما ينطبق ذلك.
- تشريح الماوس لاسترداد عظام الساق الخلفية.
- ثبت الماوس على ظهره حتى يتعرض البطن. رش بالإيثانول بنسبة 70٪ (حجم / حجم) لتعقيم الساقين الخلفيتين والبطن.
تنبيه: الإيثانول قابل للاشتعال. احفظه بعيدا عن اللهب المكشوف. - استخدام مقص لجعل شق في خط الوسط من البطن; استمر في القطع نحو الساقين لجعل عظم الفخذ مرئيا.
- خذ الساق الخلفية اليمنى واسحب الجلد بعيدا عن الجسم باتجاه خط الوسط. فصل الساق عن الجسم عن طريق قطع العضلات المقربة نحو خط الوسط ؛ ثم قطع الساق بين مفصل الورك والعمود الفقري. بعد ذلك ، قم بقطع المخلب البعيد حتى الكاحل ، وإزالة الأنسجة الزائدة من العظم عن طريق تقشير الجلد واستخدام مقص مفتوح قليلا لتجريد أنسجة الساق.
- ضع الساق على منشفة مبللة بالإيثانول بنسبة 70٪ (المجلد / الحجم) وقم بتشريح الساق وعظم الفخذ.
- قفل الساق وعظم الفخذ مع مجموعة منفصلة من ملقط. اضغط برفق على الساق ضد الاتجاه الطبيعي لمفصل الركبة ؛ سيؤدي ذلك إلى كسر الساق عند الركبة.
- استخدم الملقط ومقص التشريح إذا لزم الأمر لإزالة أي مناديل معلقة متبقية. احفظ الساق لاستخدامها لاحقا عن طريق وضعها على منشفة مبللة بالإيثانول.
- جمع عظم الفخذ بنفس الطريقة ، عن طريق قطع الركبة.
- كرر الخطوتين 3 و 4 أعلاه للساق اليسرى لإزالتها من الجسم وتشريح الساق وعظم الفخذ.
- رش العظام بنسبة 70٪ (حجم / حجم) من الإيثانول.
- نظف العظام عن طريق وضعها على منشفة نظيفة مبللة بالإيثانول بنسبة 70٪ (حجم / حجم) ، والضغط على الجزء اللحمي في المنشفة ، وفرك المنشفة على العظم لإزالة الأنسجة الزائدة.
- ثبت الماوس على ظهره حتى يتعرض البطن. رش بالإيثانول بنسبة 70٪ (حجم / حجم) لتعقيم الساقين الخلفيتين والبطن.
- بمجرد تنظيف كل من عظم الفخذ وكلا القصبة ، قم برش جميع العظام الأربعة بنسبة 70٪ (حجم / حجم) من الإيثانول. اجمع العظام في طبق بتري معقم واشطفها ب 10 مل من وسائط زراعة BMDM عن طريق تحريك الوسائط في الطبق برفق.
- املأ حقنة سعة 10 مل ب 10 مل من وسائط زراعة BMDM الطازجة وأرفق إبرة 25 جراما.
- التقاط الساق باستخدام ملقط. ثم ، قم بقطع مفصل الكاحل بزاوية ~ 45 درجة.
- اغسل نخاع العظم من الظنبوب.
- أمسك الظنبوب فوق أنبوب سعة 50 مل ، مع توجيه الطرف الضيق للساق لأسفل. قم بتوزيع الوسائط فوق الساق من المحقنة المملوءة.
- أدخل الإبرة (برفق في البداية) في الطرف العلوي من النخاع ووزع الوسائط.
- أزل الإبرة ثم أدخلها مرة أخرى. استخدم دفعات قصيرة عالية الضغط لتوزيع الوسائط وتحريك الإبرة في النخاع.
- بمجرد أن تبدأ الوسائط في التدفق من أسفل العظم ، استخدم دفعات قصيرة عالية الضغط لمواصلة طرد الخلايا. راقب لون العظم أثناء هذه العملية ، وعندما يكون العظم أبيض ، تخلص منه.
- افعل هذا لكل من الظنبيط.
- كرر الخطوتين 5 و 6 أعلاه لعظم الفخذ ، وقطع مفصل الورك حيث تم قطع الساق في مفصل الكاحل. استخدم نفس الأنبوب سعة 50 مل لجمع وسائط زراعة BMDM أثناء شطف النخاع.
- بمجرد مسح العظام الأربعة ، قم بشفط النخاع والوسائط من الأنبوب سعة 50 مل لأعلى ولأسفل 3 مرات من خلال إبرة 18 جم على حقنة سعة 10 مل ، مع شطف جوانب الأنبوب في كل مرة لتفريق النخاع.
- اضبط الحجم النهائي في الأنبوب سعة 50 مل إلى 30 مل باستخدام وسائط زراعة BMDM ، وتأكد من تعليق الخلايا تماما.
- استخدم مصفاة خلية 70 ميكرومتر لتصفية وسائط زراعة BMDM من أنبوب 50 مل.
- لوحة تعليق الخلية الناتجة ، والتي تحتوي على الخلايا السلفية نخاع العظم ، في ثلاثة أطباق زراعة الأنسجة 150 ملم عن طريق إضافة 10 مل (أو ~ 20 × 106 خلايا) لكل منها. ثم أضف 10 مل إضافية من وسائط زراعة BMDM إلى كل طبق. احتضان في حاضنة مرطبة عند 37 درجة مئوية.
3. التفريق بين BMDMs والطلاء للتجارب
- احتضان الخلايا السلفية لنخاع العظم المطلي عند 37 درجة مئوية لمدة 3 أيام. ثم قم بإزالة كل طبق ، وأضف 5-8 مل إضافية من وسائط زراعة BMDM (الجدول 1). العودة إلى الحاضنة عند 37 درجة مئوية.
- في اليوم الخامس بعد الطلاء الأولي ، قم بإزالة كل طبق ، وأضف 5 مل إضافية من وسائط زراعة BMDM. العودة إلى الحاضنة عند 37 درجة مئوية.
- في اليوم 6 ، قم بإزالة كل طبق ، وتجاهل الوسائط. ثم أضف 10 مل من البرد (مخزنة في 4 درجات مئوية) PBS لغسلها مرة واحدة. تخلص من 10 مل من غسول PBS البارد. ثم أضف 10 مل من برنامج تلفزيوني طازج وبارد إلى كل طبق ، واحتضن كل طبق على الثلج لمدة 5 دقائق.
- باستخدام مكشطة الخلايا ، اكشط الخلايا برفق من الأطباق الثلاثة في أنبوب واحد سعة 50 مل. قم بتدوير الخلايا برفق عند 270 × جم عند 4 درجات مئوية لمدة 5 دقائق ؛ ثم تخلص من المادة الطافية.
- أضف 20 مل من وسائط زراعة BMDM ، ماصة لأعلى ولأسفل لإعادة تعليق الحبيبات ، وعد الخلايا.
ملاحظة: من المتوقع أن ينتج كل ماوس ما يقرب من 60 × 10 6-100 × 106 خلايا. - خطط لتخطيط اللوحة المكونة من 12 بئرا لمقايسة تحفيز موت / التهاب الخلايا المختبرية المطلوبة. خطة للوحة 1 × 106 خلايا لكل بئر. لكل تحفيز مخطط له ، قم بتضمين ما لا يقل عن ثلاث نسخ بيولوجية ، ولوحة واحدة من الآبار التي سيتم حصادها في مخزن تحلل الكاسباز ومجموعة ثانية من الآبار التي سيتم حصادها في مخزن RIPA.
- اللوحة 1 × 106 خلايا في 1 مل من وسائط زراعة BMDM لكل بئر في 12 لوحة بئر. استزرع طوال الليل في حاضنة مرطبة عند 37 درجة مئوية قبل الشروع في تقييم موت / التهاب الخلايا. بعد الحضانة طوال الليل ، قم بإزالة الوسائط وإضافة 1 مل من برنامج تلفزيوني دافئ (37 درجة مئوية) إلى كل بئر لغسل الخلايا.
- قم بإزالة غسول PBS ، وأضف 500 ميكرولتر من وسائط تحفيز BMDM مع المضادات الحيوية (في حالة إجراء التحفيز غير البكتيري) أو وسائط تحفيز BMDM بدون مضادات حيوية (في حالة إجراء التحفيز البكتيري) (الجدول 1). احتضان لمدة 2 ساعة قبل الانتقال إلى الخطوة 4 للتحفيز / العدوى في المختبر .
4. تحفيز أو إصابة الخلايا
تنبيه: من المحتمل أن تكون العوامل المدرجة في هذا البروتوكول مسببة للأمراض وينبغي التعامل معها بالاحتياطات المناسبة في مرفق من المستوى 2 للسلامة الأحيائية (BSL2) بموافقة السلطات المؤسسية والحكومية ذات الصلة.
- تحفيز BMDMs لتنشيط موت الخلايا مع الزناد من الاهتمام.
ملاحظة: لأغراض هذا البروتوكول ، فيروس الأنفلونزا A (IAV) ، فيروس الهربس البسيط 1 (HSV1) ، Francisella novicida، و LPS + ATP للتوضيح ، ولكن يمكن استخدام مشغلات أخرى.- مثال التحفيز 1: العدوى ب IAV (A / Puerto Rico / 8/34 ، H1N1 [PR8]) (تم إنشاؤها وفقا ل Hoffmann et al.75 ؛ يتم حساب العيار الفيروسي لتحديد تعدد العدوى [MOI] بواسطة مقايسة اللويحات في خلايا MDCK):
- احسب حجم الفيروس اللازم للعدوى عند تعدد العدوى (MOI) ل 20 وحدة تشكيل لوحة (PFU) باستخدام المعادلة (1) والمعادلة (2):

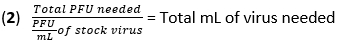

- قم بإزالة الوسائط من BMDMs واغسل الخلايا مرة واحدة باستخدام 500 ميكرولتر من PBS. أضف 450 ميكرولتر من IAV (20 MOI) في DMEM عالي الجلوكوز بدون تنشيط الحرارة (HI) -FBS إلى كل بئر. احتضان الألواح عند 37 درجة مئوية لمدة 1 ساعة في حاضنة مرطبة للسماح بالامتصاص.
- قم بإزالة الألواح وإضافة 50 ميكرولتر من HI-FBS. أعد الألواح إلى الحاضنة عند 37 درجة مئوية. احتضان لمدة 12 ساعة.
- احسب حجم الفيروس اللازم للعدوى عند تعدد العدوى (MOI) ل 20 وحدة تشكيل لوحة (PFU) باستخدام المعادلة (1) والمعادلة (2):
- مثال التحفيز 2: العدوى بفيروس HSV1 (سلالة HF ؛ مستزرعة كما هو موضح سابقا44 ؛ يتم حساب العيار الفيروسي لتحديد MOI بواسطة مقايسة البلاك في خلايا Vero):
- احسب حجم الفيروس اللازم للعدوى عند MOI من 10 PFU باستخدام المعادلة (1) والمعادلة (2) من الخطوة 1 في قسم عدوى IAV أعلاه.

- قم بإزالة الوسائط من BMDMs. أضف 450 ميكرولتر من HSV1 (MOI 10) في DMEM عالي الجلوكوز بدون HI-FBS إلى كل بئر. احتضان الألواح عند 37 درجة مئوية لمدة 1 ساعة في حاضنة مرطبة للسماح بالامتصاص.
- قم بإزالة الألواح وإضافة 50 ميكرولتر من HI-FBS. أعد الألواح إلى الحاضنة عند 37 درجة مئوية. احتضان لمدة 12 ساعة.
- احسب حجم الفيروس اللازم للعدوى عند MOI من 10 PFU باستخدام المعادلة (1) والمعادلة (2) من الخطوة 1 في قسم عدوى IAV أعلاه.
- مثال التحفيز 3: العدوى ب F. novicida (سلالة U112 ؛ مستنبتة كما هو موضح سابقا44 تحت الظروف الهوائية عند 37 درجة مئوية في BBL Trypticase Soy Broth المكمل ب 0.2٪ L-cysteine طوال الليل. بعد ذلك ، قم بزراعة البكتيريا بنسبة 1:10 عند 37 درجة مئوية لمدة 4 ساعات أخرى في وسط جديد قبل أخذ الكثافة الضوئية (OD) عند 600 نانومتر باستخدام الوسط الطازج كفارغ. قيمة OD 1 تساوي 1 × 109 وحدات تشكيل مستعمرة (CFU) لكل مل.)
- احسب حجم F. novicida اللازم للعدوى عند MOI من 50 CFU باستخدام المعادلة (3) والمعادلة (4):

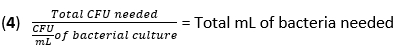
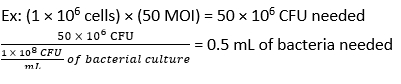
- قم بإزالة الوسائط من BMDMs. أضف 500 ميكرولتر من F. novicida (MOI 50) في وسائط تحفيز BMDM بدون مضادات حيوية لكل بئر. احتضان الألواح عند 37 درجة مئوية لمدة 4 ساعات في حاضنة مرطبة للسماح بالامتصاص.
- اغسل الخلايا ثلاث مرات باستخدام برنامج تلفزيوني دافئ (37 درجة مئوية) وأضف 500 ميكرولتر من وسائط تحفيز BMDM التي تحتوي على 50 ميكروغرام / مل جنتاميسين. أعد الألواح إلى الحاضنة عند 37 درجة مئوية. احتضان بين عشية وضحاها (16 ساعة).
- احسب حجم F. novicida اللازم للعدوى عند MOI من 50 CFU باستخدام المعادلة (3) والمعادلة (4):
- مثال التحفيز 4: تحفيز مع LPS + ATP.
- قم بإزالة الوسائط من BMDMs. أضف 500 ميكرولتر من وسائط تحفيز BMDM بالمضادات الحيوية (الجدول 1) تحتوي على 100 نانوغرام / مل LPS لكل بئر. احتضان الألواح عند 37 درجة مئوية لمدة 3.5 ساعة في حاضنة مرطبة.
- أضف 5 ميكرولتر من محلول مخزون ATP 0.5 M (الجدول 1) إلى كل بئر. أعد الألواح إلى الحاضنة عند 37 درجة مئوية. احتضان لمدة 30 دقيقة.
- مثال التحفيز 1: العدوى ب IAV (A / Puerto Rico / 8/34 ، H1N1 [PR8]) (تم إنشاؤها وفقا ل Hoffmann et al.75 ؛ يتم حساب العيار الفيروسي لتحديد تعدد العدوى [MOI] بواسطة مقايسة اللويحات في خلايا MDCK):
5. جمع المواد الطافية والبروتين مجتمعة لاستخدامها في بقع الكاسباز الغربية
- بعد 4 ساعات أو 12 ساعة أو 16 ساعة من الحضانة (يعتمد التوقيت المحدد على الزناد المستخدم) ، قم بإزالة اللوحة من الحاضنة.
- إزالة 150 ميكرولتر من الطاف. تجاهل أو حفظ هذا لتحليلات طافية أخرى (على سبيل المثال ، مقايسة الممتز المناعي المرتبط بالإنزيم [ELISA]). لا تقم بإزالة المادة الطافية المتبقية.
- قم بإنشاء محلول جمع البروتين من خلال الجمع بين 50 ميكرولتر من محلول تحلل الكاسباز + 100 ميكرولتر من 4x SDS buffer لكل بئر (الجدول 1). ثم أضف 150 ميكرولتر من المزيج إلى كل بئر.
- لكل بئر ، ماصة الخليط صعودا وهبوطا لجمع الخلايا المحللة والطاف. أثناء السحب ، قم أيضا بكشط قاع البئر بطرف الماصة لتعطيل الخلايا. بعد الكشط والسحب، اجمع البروتين المحللي في أنابيب سعة 1.5 مل.
- استخدم كتلة حرارية لتسخين جميع الأنابيب إلى 100 درجة مئوية لمدة 12 دقيقة.
- قم بإذابة أي مكونات غير قابلة للذوبان عن طريق الطرد المركزي عند 14500 × جم لمدة 30 ثانية في درجة حرارة الغرفة.
ملاحظة: هذه نقطة توقف مؤقت - يمكن استخدام البروتين من المواد الطافية ومحللات البروتين مجتمعة على الفور أو تخزينها في -20 درجة مئوية لمدة تصل إلى شهرين أو عند -80 درجة مئوية لمدة تصل إلى 6 أشهر حتى تصبح جاهزة للاستخدام.
6. جمع البروتين المحللة لاستخدامها في بقع الكاسباز الغربية
- بعد 4 ساعات أو 12 ساعة أو 16 ساعة من الحضانة (يعتمد التوقيت المحدد على الزناد المستخدم) ، قم بإزالة اللوحة من الحاضنة. إزالة كل طاف. تجاهل أو حفظ هذا لتحليلات طافية أخرى (على سبيل المثال ، ELISA).
- قم بإنشاء المخزن المؤقت 1x RIPA عن طريق تخفيف محلول مخزون 2x RIPA (الجدول 1) في حجم متساو من الماء منزوع الأيونات. ثم أضف قرصا مثبطا للفوسفاتيز وقرصا مثبطا للبروتياز ، واتركهما يذوبان. أضف 150 ميكرولتر من 1x RIPA buffer و 50 ميكرولتر من 4x SDS إلى كل بئر.
- لكل بئر ، ماصة الخليط صعودا وهبوطا لجمع الخلايا المحللة. أثناء السحب ، قم أيضا بكشط قاع البئر بطرف الماصة لتعطيل الخلايا. بعد الكشط والسحب، اجمع البروتين المحللي في أنابيب سعة 1.5 مل.
- استخدم كتلة حرارية لتسخين جميع الأنابيب إلى 100 درجة مئوية لمدة 12 دقيقة.
- قم بإذابة أي مكونات غير قابلة للذوبان عن طريق الطرد المركزي عند 14500 × جم لمدة 30 ثانية في درجة حرارة الغرفة.
ملاحظة: هذه نقطة توقف مؤقت - يمكن استخدام محللات البروتين على الفور أو تخزينها في -20 درجة مئوية أو -80 درجة مئوية حتى تصبح جاهزة للاستخدام.
7. إجراء النشاف الغربي باستخدام المحللات التي تم جمعها من BMDMs باتباع الخطوات المذكورة أعلاه أو من تجانس الأنسجة
ملاحظة: في حالة استخدام الأنسجة ، يمكن تجانسها يدويا أو من خلال خالط الأنسجة الذي يعمل بالطاقة. يوفر بروتوكول Simpson76 وصفا مفصلا لتجانس الأنسجة.
- تحضير 1x تشغيل العازلة: الجمع بين 200 مل من المخزون العازلة 5x تشغيل (الجدول 1) و 800 مل من الماء منزوع الأيونات. اجعل هذا المخزن المؤقت قيد التشغيل 1x قبل كل تجربة مباشرة.
- تحضير جهاز الكهربائي مع 12 ٪ (الوزن / الحجم) هلام بولي أكريلاميد مع 10 آبار. املأ جهاز الرحلان الكهربائي بمخزن مؤقت تشغيل 1x. ثم قم بإزالة مشط الجل.
ملاحظة: لتحليل caspase-1 و caspase-11 و caspase-3 و caspase-7 و caspase-8 و caspase-9 لكل عينة ، ستكون هناك حاجة إلى ستة مواد هلامية. - بالنسبة لبقع caspase-1 و caspase-3 و caspase-7 و caspase-8 ، خطط لاستخدام 30 ميكرولتر من محلول الخلايا الطافية والبروتين مجتمعة في محلول تحلل الكاسباز أو تجانس الأنسجة. بالنسبة لبقع caspase-11 و caspase-9 ، خطط لاستخدام 20 ميكرولتر من البروتين المحللة في محلول RIPA أو تجانس الأنسجة. إذا تم تخزين العينات في -20 درجة مئوية أو -80 درجة مئوية ، فقم بإذابتها على الجليد أولا.
- بالنسبة لجميع العينات ، قم بالتسخين إلى 100 درجة مئوية لمدة 5 دقائق ، وأجهزة الطرد المركزي عند 14500 × جم لمدة 30 ثانية عند 4 درجات مئوية قبل التحميل. بعد ذلك ، قم بتحميل 20 أو 30 ميكرولتر من العينة ببطء في كل حارة. تجنب وجود أي عينة تفيض في الممرات الأخرى. لتقييم جميع caspases الستة في وقت واحد ، استخدم نفس الإجراء لتحميل العينات المناسبة في كل من المواد الهلامية الستة.
- قم بتوصيل جهاز الرحلان الكهربائي بمصدر الطاقة. بعد ذلك ، اضبط الطاقة على 80 فولت لمدة 20 دقيقة لبدء تشغيل الهلام ، ثم اضبط الطاقة على 130 فولت لمدة 45-60 دقيقة.
- راقب مقدمة الصبغة بعناية ، وقم بإيقاف تشغيل الطاقة عندما تكون مقدمة الصبغة في الجزء السفلي من الجل ولكن لم يتم دفعها بعد خارج الجل.
- أثناء تشغيل الجل ، قم بإعداد مخزن مؤقت لنقل 1x من خلال الجمع بين 700 مل من الماء منزوع الأيونات ، و 100 مل من مخزون احتياطي النقل 10x (الجدول 1) ، و 200 مل من الميثانول. اجعل حل 1x جديدا في كل مرة.
ملاحظة: توخ الحذر لأن الميثانول قابل للاشتعال. قم بإعداد المخزن المؤقت للنقل بعيدا عن اللهب المكشوف. - قم بإزالة الجل من جهاز الرحلان الكهربائي برفق باستخدام محرر الجل.
- قم بإعداد مكدس نقل واحد لكل هلام.
- قم بتنشيط غشاء PVDF عن طريق نقعه في الميثانول لمدة 1 دقيقة.
- بلل قطعتين من ورق الترشيح والهلام وغشاء PVDF مسبقا في محلول النقل لمدة 5 دقائق. احتفظ بغشاء PVDF والهلام في حاويات منفصلة خلال هذه الحضانة التي تستغرق 5 دقائق.
- قم بتجميع مكدس النقل على النظام شبه الجاف. بدءا من جانب الأنود البلاتيني السفلي ، ضع قطعة واحدة من ورق الترشيح ، وغشاء PVDF ، والهلام ، وأخيرا قطعة واحدة من ورق الترشيح. قم بتدوير فقاعات الهواء أو الضغط عليها برفق بين الطبقات ، وأغلق الجزء العلوي من النظام. تأكد من تأمين غطاء الأمان قبل المضي قدما.
- اتصل بمصدر الطاقة. اضبط الطاقة على 25 فولت لمدة 45 دقيقة.
- بعد اكتمال النقل ، قم بتفكيك مكدس النقل وجمع الغشاء ؛ ضعه في طبق بتري مربع (صينية حضانة).
- إجراء حجب الغشاء عن طريق إضافة 15 مل من محلول الحليب الخالي من الدسم 5٪ (الوزن / الحجم) (الجدول 1). احتضان الغشاء على شاكر هزاز في 50 دورة في الدقيقة إلى 70 دورة في الدقيقة في درجة حرارة الغرفة لمدة 1 ساعة.
ملاحظة: هذه نقطة توقف مؤقت - يمكن إزالة الغشاء بعد 1 ساعة أو تخزينه في محلول مانع عند 4 درجات مئوية طوال الليل. - بعد 1 ساعة أو الحضانة بين عشية وضحاها ، قم بإزالة محلول الحظر. أضف 10 مل من محلول الأجسام المضادة المخففة (الجسم المضاد للكاسباز-1 ، والجسم المضاد للكاسباز -11 ، والجسم المضاد للكاسباز -3 والجسم المضاد للكاسباز -3 ، والجسم المضاد للكاسباز -7 والجسم المضاد للشق -7 ، أو الجسم المضاد للكاسباز-8 والجسم المضاد للكاسباس-8 ، أو الجسم المضاد للكاسباز-9) (الجدول 1). ضعه على شاكر هزاز عند 50 دورة في الدقيقة إلى 70 دورة في الدقيقة لاحتضانه في درجة حرارة الغرفة لمدة 2 ساعة أو عند 4 درجات مئوية طوال الليل (16 ساعة).
- اجمع محلول الأجسام المضادة (أعد استخدام ما يصل إلى 3x أو تخلص منه) ، واغسله بإضافة 15 مل من TBST (الجدول 1) إلى الغشاء على شاكر هزاز عند 50 دورة في الدقيقة إلى 70 دورة في الدقيقة في درجة حرارة الغرفة لمدة 10 دقائق. تجاهل TBST.
- كرر الغسيل مع 15 مل من TBST باتباع الخطوة 14 بإجمالي 3x.
- أضف 10 مل من محلول الأجسام المضادة المترافق الثانوي المخفف HRP (مضاد للأرانب للبقع الملطخة بالأجسام المضادة الأولية ضد caspase-3 أو caspase-7 أو caspase-8 أو caspase-9 ؛ مضاد للفأر للبقع الملطخة بالجسم المضاد الأولي ضد caspase-1 ؛ مضاد للفئران للبقع الملطخة بالأجسام المضادة الأولية ضد caspase-11) (الجدول 1). احتضان على شاكر هزاز في 50 دورة في الدقيقة إلى 70 دورة في الدقيقة في درجة حرارة الغرفة لمدة 1 ساعة.
- قم بإزالة محلول الأجسام المضادة ، واغسله بإضافة 15 مل من TBST إلى الغشاء على شاكر هزاز عند 50 دورة في الدقيقة إلى 70 دورة في الدقيقة في درجة حرارة الغرفة لمدة 10 دقائق. تجاهل TBST.
- كرر الغسيل مع 15 مل من TBST باتباع الخطوة 17 بإجمالي 3x.
- أضف 10 مل من ركيزة HRP عالية الحساسية إلى الغشاء. اتركه في درجة حرارة الغرفة في الظلام لمدة 1 دقيقة.
- إزالة الغشاء من الركيزة. انتقل مباشرة إلى التصوير ، باستخدام جهاز تصوير التلألؤ الكيميائي مع إدخال درج trans الأبيض الملحق في الموضع السفلي. فضح الغشاء باستخدام وضع التعرض التلقائي (بشكل عام ~ 1-2 دقيقة من وقت التعرض).
- باستخدام الغشاء من نشاف caspase-9 أو caspase-11 (أي غشاء به عينات محللة RIPA) ، أضف 10 مل من محلول التجريد ، واحتضن على شاكر هزاز عند 50 دورة في الدقيقة إلى 70 دورة في الدقيقة في درجة حرارة الغرفة لمدة 5 دقائق.
- تخلص من المخزن المؤقت للتجريد ، واغسله بإضافة 15 مل من TBST إلى الغشاء على شاكر هزاز عند 50 دورة في الدقيقة إلى 70 دورة في الدقيقة في درجة حرارة الغرفة لمدة 10 دقائق. تجاهل TBST.
- كرر الغسيل مع 15 مل من TBST باتباع الخطوة 22 بإجمالي 3x.
- قم بإجراء حجب الغشاء بإضافة 15 مل من محلول الحليب الخالي من الدسم بنسبة 5٪ (وزن / حجم). احتضان الغشاء على شاكر هزاز في 50 دورة في الدقيقة إلى 70 دورة في الدقيقة في درجة حرارة الغرفة لمدة 1 ساعة.
ملاحظة: هذه نقطة توقف مؤقت - يمكن إزالة الغشاء بعد 1 ساعة أو تخزينه في محلول مانع عند 4 درجات مئوية طوال الليل. - بعد 1 ساعة أو الحضانة بين عشية وضحاها ، قم بإزالة محلول الحظر. أضف 10 مل من محلول الأجسام المضادة المخفف المضاد ل β الأكتين (HRP-conjugated). ضعه على شاكر هزاز عند 50 دورة في الدقيقة إلى 70 دورة في الدقيقة لاحتضانه في درجة حرارة الغرفة لمدة 1.5 ساعة.
- قم بإزالة محلول الجسم المضاد واغسله بإضافة 15 مل من TBST إلى الغشاء على شاكر هزاز عند 50 دورة في الدقيقة إلى 70 دورة في الدقيقة في درجة حرارة الغرفة لمدة 10 دقائق. تجاهل TBST.
- كرر الغسيل مع 15 مل من TBST باتباع الخطوة 26 بإجمالي 3x.
- أضف 10 مل من ركيزة HRP ذات الحساسية القياسية إلى الغشاء. اتركه في درجة حرارة الغرفة في الظلام لمدة 1 دقيقة.
- انتقل مباشرة إلى التصوير ، باستخدام جهاز تصوير التلألؤ الكيميائي مع إدخال درج trans الأبيض الملحق في الموضع السفلي. فضح الغشاء باستخدام وضع التعرض التلقائي (بشكل عام <1 دقيقة من وقت التعرض).
النتائج
لوحظ PANoptosis استجابة للعديد من الالتهابات البكتيرية والفيروسية والفطرية والمحفزات الالتهابية الأخرى ، وكذلك في الخلايا السرطانية 44،48،49،50،51،52،53،54،56،57،58،60،<...
Discussion
توفر مراقبة انقسام الكاسباز وتنشيطه واحدة من أكثر الصور شمولا لتنشيط PCD المناعي الفطري كجزء من الاستجابة المناعية الفطرية. يوضح البروتوكول الموصوف هنا استراتيجية لمراقبة تنشيط الكاسباز استجابة لعدوى IAV و HSV1 و F. novicida والزناد المعقم LPS + ATP ، ولكن العديد من المحفزات الأخرى يمكن أن تحفز PC...
Disclosures
T.-D.K. هو مستشار لشركة فايزر.
Acknowledgements
نشكر أعضاء مختبر Kanneganti على تعليقاتهم واقتراحاتهم ، ونشكر J. Gullett ، دكتوراه ، على دعم التحرير العلمي. يتم دعم العمل في مختبرنا من خلال منح المعاهد الوطنية للصحة (NIH) AI101935 و AI124346 و AI160179 و AR056296 و CA253095 (إلى T.-D.K.) والجمعيات الخيرية الأمريكية اللبنانية السورية (إلى T.-D.K.). المحتوى هو مسؤولية المؤلفين وحدهم ولا يمثل بالضرورة الآراء الرسمية للمعاهد الوطنية للصحة.
Materials
| Name | Company | Catalog Number | Comments |
| 0.45 μm filter | Millipore | SCHVU05RE | |
| 10 mL syringe | BD Biosciences | 309604 | |
| 12% polyacrylamide gel with 10 wells | Bio-Rad | 4561043 | |
| 12-well plate | Corning | 07-200-82 | |
| 18 G needle | BD Biosciences | 305195 | |
| 25 G needle | BD Biosciences | 305122 | |
| 50 mL tube | Fisher Scientific | 50-809-218 | |
| 70 μm cell strainer | Corning | 431751 | |
| 150 mm tissue culture dishes | Corning | 430597 | |
| 182-cm2 tissue culture flask | Genesee Scientific | 25-211 | |
| Accessory white trans tray | Cytiva | 29-0834-18 | |
| Anti–caspase-1 antibody | AdipoGen | AG-20B-0042-C100 | |
| Anti–caspase-11 antibody | Novus Biologicals | NB120-10454 | |
| Anti–caspase-3 antibody | Cell Signaling Technology | 9662 | |
| Anti–caspase-7 antibody | Cell Signaling Technology | 9492 | |
| Anti–caspase-8 antibody | Cell Signaling Technology | 4927 | |
| Anti–caspase-9 antibody | Cell Signaling Technology | 9504 | |
| Anti–cleaved caspase-3 antibody | Cell Signaling Technology | 9661 | |
| Anti–cleaved caspase-7 antibody | Cell Signaling Technology | 9491 | |
| Anti–cleaved caspase-8 antibody | Cell Signaling Technology | 8592 | |
| Anti-mouse HRP-conjugated secondary antibody | Jackson ImmunoResearch Laboratories | 315-035-047 | |
| Anti-rabbit HRP-conjugated secondary antibody | Jackson ImmunoResearch Laboratories | 111-035-047 | |
| Anti-rat HRP-conjugated secondary antibody | Jackson ImmunoResearch Laboratories | 112-035-003 | |
| Anti–β-Actin antibody (C4) HRP | Santa Cruz | sc-47778 HRP | |
| ATP | InvivoGen | tlrl-atpl | |
| BBL Trypticase Soy Broth | BD Biosciences | 211768 | |
| Bead bath | Chemglass Life Sciences | CLS-4598-009 | |
| Biophotometer D30 | Eppendorf | 6133000010 | |
| BME | Sigma | M6250 | |
| Bromophenol blue | Sigma | BO126 | |
| Cell scrapers | CellTreat Scientific Products | 229315 | |
| Chemiluminescence imager (Amersham 600) | Cytiva | 29083461 | |
| CO2 chamber | VetEquip | 901703 | |
| Cuvettes | Fisher Scientific | 14-955-129 | |
| Dissecting scissors | Thermo Fisher Scientific | 221S | |
| DMEM | Thermo Fisher Scientific | 11995-073 | |
| DTT | Sigma | 43815 | |
| Eelectrophoresis apparatus | Bio-Rad | 1658004 | |
| Ethanol | Pharmco | 111000200 | |
| Fetal bovine serum | Biowest | S1620 | |
| Filter paper | Bio-Rad | 1703965 | |
| Forceps | Fisher Scientific | 22-327379 | |
| Francisella novicida (U112 strain) | BEI Resources | NR-13 | |
| Gel releaser | Bio-Rad | 1653320 | |
| Gentamycin | Gibco | 15750060 | |
| Glycerol | Sigma | G7893 | |
| Glycine | Sigma | G8898 | |
| HCl | Sigma | H9892 | |
| Heat block | Fisher Scientific | 23-043-160 | |
| Herpes simplex virus 1 (HF strain) | ATCC | VR-260 | |
| High glucose DMEM | Sigma | D6171 | |
| Human anti–caspase-1 antibody | R&D Systems | MAB6215 | |
| Human anti–caspase-8 antibody | Enzo | ALX-804-242 | |
| Humidified incubator | Thermo Fisher Scientific | 51026282 | |
| Image analysis software | ImageJ | v1.53a | |
| IMDM | Thermo Fisher Scientific | 12440-053 | |
| Influenza A virus (A/Puerto Rico/8/34, H1N1 [PR8]) | constructed per Hoffmann et al. | ||
| L929 cells | ATCC | CCL-1 | cell line for creating L929-conditioned media |
| L-cysteine | Thermo Fisher Scientific | BP376-100 | |
| Luminata Forte Western HRP substrate | Millipore | WBLUF0500 | standard-sensitivity HRP substrate |
| MDCK cells | ATCC | CCL-34 | cell line for determining IAV viral titer |
| Methanol | Sigma | 322415 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002401 | |
| Non-essential amino acids | Gibco | 11140050 | |
| Nonfat dried milk powder | Kroger | ||
| NP-40 solution | Sigma | 492016 | |
| PBS | Thermo Fisher Scientific | 10010023 | |
| Penicillin and streptomycin | Sigma | P4333 | |
| Petri dish | Fisher Scientific | 07-202-011 | |
| PhosSTOP | Roche | PHOSS-RO | |
| Power source | Bio-Rad | 164-5052 | |
| Protease inhibitor tablet | Sigma | S8820 | |
| PVDF membrane | Millipore | IPVH00010 | |
| Rocking shaker | Labnet | S2035-E | |
| SDS | Sigma | L3771 | |
| Sodium chloride | Sigma | S9888 | |
| Sodium deoxycholate | Sigma | 30970 | |
| Sodium hydroxide | Sigma | 72068 | |
| Sodium pyruvate | Gibco | 11360-070 | |
| Square Petri dish | Fisher Scientific | FB0875711A | |
| Stripping buffer | Thermo Fisher Scientific | 21059 | |
| Super Signal Femto HRP substrate | Thermo Fisher Scientific | 34580 | high-sensitivity HRP substrate |
| Tabletop centrifuge | Thermo Fisher Scientific | 75004524 | |
| Trans-Blot semi-dry system | Bio-Rad | 170-3940 | |
| Tris | Sigma | TRIS-RO | |
| Tween 20 | Sigma | P1379 | |
| Ultrapure lipopolysaccharide (LPS) from E. coli 0111:B4 | InvivoGen | tlrl-3pelps | |
| Vero cells | ATCC | CCL-81 | cell line for determining HSV1 viral titer |
References
- Alnemri, E. S., et al. Human ICE/CED-3 protease nomenclature. Cell. 87 (2), 171 (1996).
- Man, S. M., Kanneganti, T. D. Converging roles of caspases in inflammasome activation, cell death and innate immunity. Nature Reviews Immunology. 16 (1), 7-21 (2016).
- Gullett, J. M., Tweedell, R. E., Kanneganti, T. D. It's all in the PAN: Crosstalk, plasticity, redundancies, switches, and interconnectedness encompassed by PANoptosis underlying the totality of cell death-associated biological effects. Cells. 11 (9), 1495 (2022).
- Pandian, N., Kanneganti, T. D. PANoptosis: A unique innate immune inflammatory cell death modality. Journal of Immunology. 209 (9), 1625-1633 (2022).
- Galluzzi, L., et al. Molecular mechanisms of cell death recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death & Differentiation. 25 (3), 486-541 (2018).
- Shi, Y. Caspase activation: Revisiting the induced proximity model. Cell. 117 (7), 855-858 (2004).
- Galluzzi, L., Lopez-Soto, A., Kumar, S., Kroemer, G. Caspases connect cell-death signaling to organismal homeostasis. Immunity. 44 (2), 221-231 (2016).
- Fernandes-Alnemri, T., Litwack, G., Alnemri, E. S. CPP32, a novel human apoptotic protein with homology to Caenorhabditis elegans cell death protein Ced-3 and mammalian interleukin-1 beta-converting enzyme. Journal of Biological Chemistry. 269 (49), 30761-30764 (1994).
- Tewari, M., et al. Yama/CPP32 beta, a mammalian homolog of CED-3, is a CrmA-inhibitable protease that cleaves the death substrate poly(ADP-ribose) polymerase. Cell. 81 (5), 801-809 (1995).
- Nicholson, D. W., et al. Identification and inhibition of the ICE/CED-3 protease necessary for mammalian apoptosis. Nature. 376 (6535), 37-43 (1995).
- Stennicke, H. R., et al. Pro-caspase-3 is a major physiologic target of caspase-8. Journal of Biological Chemistry. 273 (42), 27084-27090 (1998).
- Twiddy, D., Cohen, G. M., Macfarlane, M., Cain, K. Caspase-7 is directly activated by the approximately 700-kDa apoptosome complex and is released as a stable XIAP-caspase-7 approximately 200-kDa complex. Journal of Biological Chemistry. 281 (7), 3876-3888 (2006).
- Kesavardhana, S., Malireddi, R. K. S., Kanneganti, T. D. Caspases in cell death, inflammation, and pyroptosis. Annual Reviews of Immunology. 38, 567-595 (2020).
- Kerr, J. F., Wyllie, A. H., Currie, A. R. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. British Journal of Cancer. 26 (4), 239-257 (1972).
- Taylor, R. C., Cullen, S. P., Martin, S. J. Apoptosis: Controlled demolition at the cellular level. Nature Reviews Molecular Cell Biology. 9 (3), 231-241 (2008).
- Morioka, S., Maueröder, C., Ravichandran, K. S. Living on the edge: Efferocytosis at the interface of homeostasis and pathology. Immunity. 50 (5), 1149-1162 (2019).
- Wang, Y., et al. Chemotherapy drugs induce pyroptosis through caspase-3 cleavage of a gasdermin. Nature. 547 (7661), 99-103 (2017).
- Rogers, C., et al. Cleavage of DFNA5 by caspase-3 during apoptosis mediates progression to secondary necrotic/pyroptotic cell death. Nature Communications. 8, 14128 (2017).
- Kayagaki, N., et al. Caspase-11 cleaves gasdermin D for non-canonical inflammasome signalling. Nature. 526 (7575), 666-671 (2015).
- Shi, J., Gao, W., Shao, F. Pyroptosis: Gasdermin-mediated programmed necrotic cell death. Trends in Biochemical Sciences. 42 (4), 245-254 (2017).
- Sborgi, L., et al. GSDMD membrane pore formation constitutes the mechanism of pyroptotic cell death. EMBO Journal. 35 (16), 1766-1778 (2016).
- Aglietti, R. A., et al. GsdmD p30 elicited by caspase-11 during pyroptosis forms pores in membranes. Proceedings of the National Academy of Sciences of the United States of America. 113 (28), 7858-7863 (2016).
- Hagar, J. A., Powell, D. A., Aachoui, Y., Ernst, R. K., Miao, E. A. Cytoplasmic LPS activates caspase-11: implications in TLR4-independent endotoxic shock. Science. 341 (6151), 1250-1253 (2013).
- Kayagaki, N., et al. Noncanonical inflammasome activation by intracellular LPS independent of TLR4. Science. 341 (6151), 1246-1249 (2013).
- Shi, J., et al. Inflammatory caspases are innate immune receptors for intracellular LPS. Nature. 514 (7521), 187-192 (2014).
- Lamkanfi, M., et al. Targeted peptidecentric proteomics reveals caspase-7 as a substrate of the caspase-1 inflammasomes. Molecular & Cellular Proteomics. 7 (12), 2350-2363 (2008).
- Kalai, M., et al. Tipping the balance between necrosis and apoptosis in human and murine cells treated with interferon and dsRNA. Cell Death & Differentiation. 9 (9), 981-994 (2002).
- Li, C., et al. Development of atopic dermatitis-like skin disease from the chronic loss of epidermal caspase-8. Proceedings of the National Academy of Sciences of the United States of America. 107 (51), 22249-22254 (2010).
- Kovalenko, A., et al. Caspase-8 deficiency in epidermal keratinocytes triggers an inflammatory skin disease. Journal of Experimental Medicine. 206 (10), 2161-2177 (2009).
- Kang, T. B., et al. Caspase-8 serves both apoptotic and nonapoptotic roles. Journal of Immunology. 173 (5), 2976-2984 (2004).
- Oberst, A., et al. Catalytic activity of the caspase-8-FLIP(L) complex inhibits RIPK3-dependent necrosis. Nature. 471 (7338), 363-367 (2011).
- Kaiser, W. J., et al. RIP3 mediates the embryonic lethality of caspase-8-deficient mice. Nature. 471 (7338), 368-372 (2011).
- Zhang, H., et al. Functional complementation between FADD and RIP1 in embryos and lymphocytes. Nature. 471 (7338), 373-376 (2011).
- Shi, J., et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 526 (7575), 660-665 (2015).
- Hitomi, J., et al. Identification of a molecular signaling network that regulates a cellular necrotic cell death pathway. Cell. 135 (7), 1311-1323 (2008).
- Malireddi, R. K., Ippagunta, S., Lamkanfi, M., Kanneganti, T. D. Cutting edge: Proteolytic inactivation of poly(ADP-ribose) polymerase 1 by the Nlrp3 and Nlrc4 inflammasomes. Journal of Immunology. 185 (6), 3127-3130 (2010).
- Tsuchiya, K., et al. Caspase-1 initiates apoptosis in the absence of gasdermin D. Nature Communications. 10 (1), (2019).
- Taabazuing, C. Y., Okondo, M. C., Bachovchin, D. A. Pyroptosis and apoptosis pathways engage in bidirectional crosstalk in monocytes and macrophages. Cell Chemical Biology. 24 (4), 507-514 (2017).
- Gurung, P., et al. FADD and caspase-8 mediate priming and activation of the canonical and noncanonical Nlrp3 inflammasomes. Journal of Immunology. 192 (4), 1835-1846 (2014).
- Man, S. M., et al. Inflammasome activation causes dual recruitment of NLRC4 and NLRP3 to the same macromolecular complex. Proceedings of the National Academy of Sciences of the United States of America. 111 (20), 7403-7408 (2014).
- Man, S. M., et al. Salmonella infection induces recruitment of Caspase-8 to the inflammasome to modulate IL-1beta production. Journal of Immunology. 191 (10), 5239-5246 (2013).
- Van Opdenbosch, N., et al. Caspase-1 engagement and TLR-induced c-FLIP expression suppress ASC/caspase-8-dependent apoptosis by inflammasome sensors NLRP1b and NLRC4. Cell Reports. 21 (12), 3427-3444 (2017).
- Pierini, R., et al. AIM2/ASC triggers caspase-8-dependent apoptosis in Francisella-infected caspase-1-deficient macrophages. Cell Death & Differentiation. 19 (10), 1709-1721 (2012).
- Lee, S., et al. AIM2 forms a complex with pyrin and ZBP1 to drive PANoptosis and host defence. Nature. 597 (7876), 415-419 (2021).
- Sagulenko, V., et al. AIM2 and NLRP3 inflammasomes activate both apoptotic and pyroptotic death pathways via ASC. Cell Death & Differentiation. 20 (9), 1149-1160 (2013).
- Lukens, J. R., et al. Dietary modulation of the microbiome affects autoinflammatory disease. Nature. 516 (7530), 246-249 (2014).
- Gurung, P., Burton, A., Kanneganti, T. D. NLRP3 inflammasome plays a redundant role with caspase 8 to promote IL-1beta-mediated osteomyelitis. Proceedings of the National Academy of Sciences of the United States of America. 113 (16), 4452-4457 (2016).
- Kuriakose, T., et al. ZBP1/DAI is an innate sensor of influenza virus triggering the NLRP3 inflammasome and programmed cell death pathways. Science Immunology. 1 (2), (2016).
- Malireddi, R. K. S., et al. TAK1 restricts spontaneous NLRP3 activation and cell death to control myeloid proliferation. Journal of Experimental Medicine. 215 (4), 1023-1034 (2018).
- Malireddi, R. K. S., et al. Innate immune priming in the absence of TAK1 drives RIPK1 kinase activity-independent pyroptosis, apoptosis, necroptosis, and inflammatory disease. Journal of Experimental Medicine. 217 (3), (2020).
- Christgen, S., et al. Identification of the PANoptosome: A molecular platform triggering pyroptosis, apoptosis, and necroptosis (PANoptosis). Frontiers in Cellular and Infection Microbiology. 10, 237 (2020).
- Malireddi, R. K. S., et al. RIPK1 distinctly regulates Yersinia-induced inflammatory cell death, PANoptosis. Immunohorizons. 4 (12), 789-796 (2020).
- Zheng, M., Karki, R., Vogel, P., Kanneganti, T. D. Caspase-6 is a key regulator of innate immunity, inflammasome activation, and host defense. Cell. 181 (3), 674-687 (2020).
- Karki, R., et al. ADAR1 restricts ZBP1-mediated immune response and PANoptosis to promote tumorigenesis. Cell Reports. 37 (3), 109858 (2021).
- Wang, Y., et al. Single cell analysis of PANoptosome cell death complexes through an expansion microscopy method. Cellular and Molecular Life Sciences. 79 (10), 531 (2022).
- Malireddi, R. K. S., et al. Inflammatory cell death, PANoptosis, mediated by cytokines in diverse cancer lineages inhibits tumor growth. Immunohorizons. 5 (7), 568-580 (2021).
- Kesavardhana, S., et al. The Zα2 domain of ZBP1 is a molecular switch regulating influenza-induced PANoptosis and perinatal lethality during development. Journal of Biological Chemistry. 295 (24), 8325-8330 (2020).
- Banoth, B., et al. ZBP1 promotes fungi-induced inflammasome activation and pyroptosis, apoptosis, and necroptosis (PANoptosis). Journal of Biological Chemistry. 295 (52), 18276-18283 (2020).
- Karki, R., et al. Interferon regulatory factor 1 regulates PANoptosis to prevent colorectal cancer. JCI Insight. 5 (12), 136720 (2020).
- Zheng, M., et al. Impaired NLRP3 inflammasome activation/pyroptosis leads to robust inflammatory cell death via caspase-8/RIPK3 during coronavirus infection. Journal of Biological Chemistry. 295 (41), 14040-14052 (2020).
- Karki, R., et al. Synergism of TNF-α and IFN-γ triggers inflammatory cell death, tissue damage, and mortality in SARS-CoV-2 infection and cytokine shock syndromes. Cell. 184 (1), 149-168 (2021).
- Karki, R., et al. ZBP1-dependent inflammatory cell death, PANoptosis, and cytokine storm disrupt IFN therapeutic efficacy during coronavirus infection. Science Immunology. 7 (74), (2022).
- Jiang, W., Deng, Z., Dai, X., Zhao, W. PANoptosis: A new insight into oral infectious diseases. Frontiers in Immunology. 12, 789610 (2021).
- Chi, D., et al. Real-time induction of macrophage apoptosis, pyroptosis, and necroptosis by Enterococcus faecalis OG1RF and two root canal isolated strains. Frontiers in Cellular and Infection Microbiology. 11, 720147 (2021).
- Lin, J. F., et al. Phosphorylated NFS1 weakens oxaliplatin-based chemosensitivity of colorectal cancer by preventing PANoptosis. Signal Transduction and Targeted Therapy. 7 (1), 54 (2022).
- Song, M., et al. Self-assembled polymeric nanocarrier-mediated co-delivery of metformin and doxorubicin for melanoma therapy. Drug Delivery. 28 (1), 594-606 (2021).
- Boucher, D., Chan, A., Ross, C., Schroder, K. Quantifying caspase-1 activity in murine macrophages. Methods in Molecular Biology. 1725, 163-176 (2018).
- Boucher, D., Duclos, C., Denault, J. B. General in vitro caspase assay procedures. Methods in Molecular Biology. 1133, 3-39 (2014).
- Kaushal, V., Herzog, C., Haun, R. S., Kaushal, G. P. Caspase protocols in mice. Methods in Molecular Biology. 1133, 141-154 (2014).
- Swacha, P., Gekara, N. O., Erttmann, S. F. Biochemical and microscopic analysis of inflammasome complex formation. Methods in Enzymology. 625, 287-298 (2019).
- Talley, S., et al. A caspase-1 biosensor to monitor the progression of inflammation in vivo. Journal of Immunology. 203 (9), 2497-2507 (2019).
- Pelegrin, P., Barroso-Gutierrez, C., Surprenant, A. P2X7 receptor differentially couples to distinct release pathways for IL-1beta in mouse macrophage. Journal of Immunology. 180 (11), 7147-7157 (2008).
- Yu, J. W., et al. Cryopyrin and pyrin activate caspase-1, but not NF-kappaB, via ASC oligomerization. Cell Death & Differentiation. 13 (2), 236-249 (2006).
- Henry, C. M., Martin, S. J. Caspase-8 acts in a non-enzymatic role as a scaffold for assembly of a pro-inflammatory "FADDosome" complex upon TRAIL stimulation. Molecular Cell. 65 (4), 715-729 (2017).
- Hoffmann, E., Neumann, G., Kawaoka, Y., Hobom, G., Webster, R. G. A DNA transfection system for generation of influenza A virus from eight plasmids. Proceedings of the National Academy of Sciences of the United States of America. 97 (11), 6108-6113 (2000).
- Simpson, R. J. Homogenization of mammalian tissue. Cold Spring Harbor Protocols. (7), (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved