JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
선천면역세포사멸을 평가하기 위한 카스파아제 활성화 평가
요약
이 프로토콜은 시험관 내 및 생체 내 (마우스내) 감염, 무균 손상 및 암 모델 모두에 대한 반응으로 카스파제 활성화(카스파제-1, 카스파제-3, 카스파제-7, 카스파제-8, 카스파제-9 및 카스파제-11)를 평가하여 파이롭토시스, 세포자멸사, 괴사 및 PANoptosis와 같은 세포 사멸 경로의 개시를 결정합니다.
초록
선천성 면역은 병원균과 무균 모욕에 대응하여 중요한 첫 번째 방어선을 제공합니다. 이 반응의 주요 기계적 구성 요소는 감염되거나 손상된 세포를 제거하고 면역 반응을 전파하기 위한 선천성 면역 프로그램 세포 사멸(PCD)의 시작입니다. 그러나 과도한 PCD는 염증 및 병리와 관련이 있습니다. 따라서 PCD의 활성화 및 조절을 이해하는 것은 선천성 면역 반응을 특성화하고 질병 스펙트럼 전반에 걸쳐 새로운 치료 표적을 식별하는 데 핵심적인 측면입니다.
이 프로토콜은 세포자멸사, 파이롭토시스, 괴사증 및 PANoptosis를 포함하는 다양한 PCD 경로와 종종 연관되는 시스테인 의존성 프로테아제 계열인 카스파제를 모니터링하여 선천성 면역 PCD 활성화를 특성화하는 방법을 제공합니다. 초기 보고서에서는 카스파제-2, 카스파제-8, 카스파제-9 및 카스파제-10을 개시제 카스파제로, 카스파제-3, 카스파제-6 및 카스파제-7을 세포자멸사에서 이펙터 카스파제로 특성화한 반면, 이후 연구에서는 염증성 카스파제, 카스파제-1, 카스파제-4, 카스파제-5 및 카스파제-11이 파이롭토시스를 유발합니다. 이전에 정의된 PCD 경로 전반에 걸쳐 카스파제와 기타 선천성 면역 및 세포 사멸 분자 사이에 광범위한 누화가 있는 것으로 알려져 있으며, 선천성 면역 및 PCD에 대한 기계론적 이해에서 핵심 지식 격차를 식별하고 PANoptosis의 특성화로 이어집니다. PANoptosis는 다른 세포 사멸 경로에서 카스파제를 포함한 구성 요소를 통합하는 PANoptosome 복합체에 의해 조절되는 독특한 선천성 면역 염증 PCD 경로입니다.
여기서, 다양한 자극에 반응하여 카스파제의 활성화를 평가하기 위한 방법이 제공된다. 이러한 방법은 활성화된 카스파제가 최적의 항체 및 블로팅 조건을 사용하여 웨스턴 블로팅으로 시각화할 수 있는 단백질 분해 절단을 거치기 때문에 시험관 내 및 생체 내 모두에서 PCD 경로의 특성화를 허용합니다. 동일한 세포 집단에서 여러 카스파제의 활성화를 평가할 수 있는 프로토콜 및 웨스턴 블로팅 워크플로우가 확립되어 PCD 프로세스의 포괄적인 특성화를 제공합니다. 이 방법은 발달, 항상성, 감염, 염증 및 암의 연구 영역 전반에 걸쳐 적용하여 건강 및 질병의 세포 과정 전반에 걸쳐 PCD 경로를 평가할 수 있습니다.
서문
선천성 면역 체계는 감염 중 및 조직 손상 및 항상성 변화와 같은 무균 자극에 대한 반응으로 첫 번째 방어선 역할을 합니다. 세포 표면과 세포질의 선천성 면역 센서는 병원체 또는 손상 관련 분자 패턴(각각 PAMP 또는 DAMP)에 반응하여 염증 신호 전달 경로 및 세포 반응을 유발합니다. 선천성 면역 반응의 핵심 과정 중 하나는 감염되거나 손상된 세포를 제거하고 추가 선천성 및 적응성 면역 반응을 유도하기 위한 세포 사멸을 유도하는 것입니다. 프로그램된 세포 사멸(PCD)은 종 전반에 걸쳐 고도로 보존된 과정으로, 타고난 면역 메커니즘으로서의 진화적 중요성을 강조합니다.
모든 세포 유형에서 활성화될 수 있는 몇 가지 선천성 면역 PCD 경로가 있습니다. 카스파제는 고도로 보존된 세포내 시스테인 의존성 프로테아제의 핵심 계열로, 전통적으로 비염증성 세포자멸사 경로뿐만 아니라 파이롭토시스, 괴사증 및 PANoptosis와 같은 염증성 PCD 경로를 포함한 많은 PCD 경로에서 중요합니다 1,2,3,4,5 . 잘 정의 된 11 개의 인간 카스파제와 10 개의 뮤린 카스파제뿐만 아니라 기능적 일 수있는 유사 카스파제가 있으며, 대부분은 활성화를 위해 절단을 필요로하는 비활성 단량체 또는 이량체 프로 카스파제로 구성 적으로 표현됩니다 6,7. 카스파제는 또한 다단백질 복합체의 모집 및 형성을 위한 중요한 영역을 포함합니다. 여기에는 카스파제-1, 카스파제-2, 카스파제-4, 카스파제-5, 카스파제-9 및 카스파제-11에서 찾을 수 있는 카스파아제 활성화 및 모집 도메인(CARD) 또는 카스파제-8 및 카스파제-10에서 발견되는 사멸 이펙터 도메인(DED)이 포함됩니다. 단백질 분해 활성과 다단백질 복합체 형성 능력을 통해 카스파제는 선천성 면역 PCD의 중요한 동인입니다.
선천성 면역 PCD에서 카스파제의 역할은 세포자멸사에서 처음 확인되었으며, 개시제 카스파제, 카스파제-2, 카스파제-8, 카스파제-9 및 카스파제-10이 사형집행자 카스파제, 카스파제-3, 카스파제-6 및 카스파제-7을 활성화시켜 세포 사멸을 유도합니다 8,9,10,11,12. 개시제 카스파제는 다양한 신호 캐스케이드에 의해 활성화될 수 있습니다. 외인성 경로는 세포외 리간드 유도 사멸 수용체 신호전달을 통해 카스파제-8을 활성화시키고, 내인성 경로는 미토콘드리아 완전성의 파괴를 통해 카스파제-9를 활성화한다13. 활성화된 개시제 카스파제는 링커를 절단하여 사형집행인 카스파제의 크고 작은 촉매 서브유닛을 분리하여 활성 형태를 생성합니다. 그런 다음 사형 집행인 카스파제는 기질을 쪼개어 세포를 분해하여 DNA 분해, 막 블레빙, 핵 단편화 및 세포자멸사 방출을 초래합니다14,15. 이 과정은 전형적으로 비용해성 및 비염증성 형태의 세포 사멸로 끝나며, 이는 efferocytosis에 의한 죽어가는 세포의 즉각적인 제거와 결합될 때 이루어진다16. 그러나, efferocytosis의 결함 또는 식세포의 부족은 세포 사멸 세포의 축적으로 이어질 수 있으며, 이는 용해 및 염증 세포 사멸을 겪는다17,18.
카스파제-1(인간 및 마우스), 카스파제-4 및 카스파제-5(인간), 카스파제-11(마우스)을 포함한 염증성 카스파제는 파이롭토시스라고 하는 염증성 선천성 면역 PCD(III-PCD)의 한 형태 동안 활성화되는 것으로 밝혀졌습니다. 카스파제-1 활성화는 세포질 선천성 면역 센서, 어댑터 분자(CARD[ASC]를 포함하는 세포자멸사 관련 반점 유사 단백질) 및 카스파제-1을 포함하는 다단백질 복합체인 인플라마솜의 형성과 관련이 있습니다. 이 복합체의 형성은 카스파제-1이 근접 매개 자가단백질 분해를 거쳐 활성 형태를 방출할 수 있도록 하며, 이는 전염증성 사이토카인인 인터루킨(IL)-1β 및 IL-18과 기공 형성 분자 gasdermin D(GSDMD)19,20,21,22,23를 포함한 표적 기질을 절단할 수 있습니다 . 카스파제-11, 카스파제-4 및 카스파제-5는 또한 지질다당류(LPS)19,20와 같은 PAMP를 감지한 후 인플라마솜의 상류 형성 없이 GSDMD를 활성화할 수 있습니다. 이들 카스파제는 이량체화에 이어 세포질 LPS에 결합할 때 활성화를 위한 올리고머화 및 자가절단을 거치며, 이는 IL-1β 및 IL-18 성숙을 유도하기 위해 세포 내재적 방식으로 비정준 인플라마좀 활성화 24,25,26 및 카스파제-1 활성화를 유도한다 20. 이러한 전염증성 사이토카인의 성숙과 방출은 이러한 카스파제를 "염증성"으로 특징짓습니다. 또한, 아폽토시스 카스파제-8은 인플라마솜에 국한되어 아폽토시스와 파이롭토시스 과정 사이의 연관성을 제공하는 것으로 밝혀졌습니다. 연구에 따르면 아폽토시스 카스파제-8은 괴사라고 하는 또 다른 형태의 PCD를 조절하는 데에도 중요합니다. 카스파제-8의 손실은 자발적인 수용체 상호작용 세린-트레오닌 키나아제 3(RIPK3) 매개 혼합 계통 키나아제 도메인 유사 슈도키나아제(MLKL) 활성화를 초래하여 괴사 27,28,29,30,31,32,33,34,35의 III-PCD 경로를 구동합니다.
카스파제는 역사적으로 카스파제에서 발생하는 세포 사멸 유형에 따라 "세포사멸" 또는 "염증성"으로 분류되어 왔지만, 카스파제를 통한 선천성 면역 PCD 경로 사이에 광범위한 혼선이 있음을 시사하는 증거가 늘어나고 있습니다 3,4. 예를 들어, inflammasomes의 염증성 카스파제-1은 표준 활성화 부위34에서 세포사멸 카스파제-7을 절단합니다. 카스파제-1 활성화는 또한 폴리(ADP-리보스) 중합효소 1 (PARP1)36과 같은 아폽토시스 기질의 절단을 유도할 수 있다. GSDMD가 결핍된 세포에서 카스파제-1은 또한 카스파제-337,38을 절단할 수 있습니다. 추가적으로, 정준적으로 아폽토시스 카스파제-3은 가스더민 E(GSDME)를 절단하여 PCD17,18을 유도할 수 있고, 또한 GSDMD를 비활성 형태40으로 처리할 수 있다. 또한, 인플라마좀 복합체에 대한 카스파제-8 모집은 39,40,41,42,43,44,45로 관찰되었으며, 카스파제-8은 정준 및 비정준 인플라마좀 활성화의 핵심 조절자이다 39. 또한 많은 염증 조건에서 카스파제-8 및 카스파제-1에 대한 중복되고 중복된 역할이 존재하며, 발열, 세포사멸 및 괴사 성분의 활성화를 특징으로 하는 선천성 면역 PCD는 질병 스펙트럼 39,46,47,48,49,50에 걸쳐 발생합니다.
염증성 카스파제와 세포자멸사 카스파제 사이의 이러한 혼선을 기반으로 선천성 면역과 PCD에 대한 기계론적 이해의 주요 격차가 확인되어 PANoptosis의 발견으로 이어졌습니다. PANoptosis는 병원체, PAMP, DAMP 및 항상성의 변화에 반응하여 활성화되는 독특한 형태의 III-PCD이며 다른 세포 사멸 경로의 구성 요소를 통합하는 다면적 거대분자 복합체인 PANoptosomes에 의해 조절됩니다 44,50,51,52,53,54,55 . PANoptosis는 카스파제-1, 카스파제-11, 카스파제-8, 카스파제-9, 카스파제-3 및/또는 카스파제-7을 포함한 다중 카스파제의 활성화를 특징으로 하기 때문에 PANoptosis에서 생물학적 효과의 총체는 pyroptosis, apoptosis또는 necroptosis 단독으로 개별적으로 설명될 수 없습니다 3,4,35,36,39,46,47,48, 문맥에 따라 44,48,49,50,51,52,53,54,56,57,58,59,60,61,62 . PANoptosis는 감염성 및 염증성 질환뿐만 아니라 암 및 암 치료법에 점점 더 연루되어 왔습니다 3,4,35,36,39,44,46,47,48,49,50,51,52,53 ,54,56
,57,58,59,60,61,62,63,64,65,66.
세포자멸사, 파이롭토시스, 괴사증 및 PANoptosis를 포함한 세포 사멸 경로 전반에 걸쳐 카스파제의 필수적인 역할을 감안할 때, 카스파제의 활성화를 특성화하고 PCD 경로의 전체 복잡성을 이해하는 기술을 개발하는 것이 중요합니다. 이 프로토콜은 세포를 자극하고 카스파제의 후속 활성화를 측정하는 방법을 자세히 설명합니다(그림 1). 이 방법은 일반적으로 활성화에 필요한 카스파제의 단백질 분해 절단을 연구 수단으로 활용합니다. 웨스턴 블로팅을 통해 단백질 크기를 측정할 수 있으며, 이를 통해 비활성 프로카스파제와 활성화된 절단 형태를 명확하게 시각화하고 구별할 수 있습니다.
이 프로토콜의 주요 이점은 1) PCD 활성화를 보다 정확하게 결정하기 위해 내인성 세포의 단일 집단에서 병렬로 여러 카스파제의 활성화를 평가하는 능력과 2) 광범위한 교육이나 값비싼 장비가 필요하지 않은 비교적 간단한 실험실 기술의 사용입니다. 이전 프로토콜은 배양 상층액, 세포 및 조직 용해물, 현미경을 통한 전체 세포 및 생체 내 67,68,69,70,71에서 카스파아제 활성화를 모니터링하기 위해 웨스턴 블로팅, 형광 리포터 또는 항체 염색을 사용했지만 이러한 기술은 일반적으로 샘플에서 하나 또는 두 개의 카스파제만 모니터링합니다. 또한, 절단 시 형광을 발하는 카스파제 절단 부위를 함유하는 합성 펩타이드 기질이 세포 또는 조직 용해물에서 카스파제 활성화를 모니터링하기 위해 사용되어 왔지만(69), 이들 기질은 종종 하나 이상의 카스파제에 의해 절단될 수 있어, 이 시스템에서 개별 카스파제의 특이적 활성화를 결정하기 어렵게 만든다. 또한 형광 리포터 또는 기타 태그 기반 방법을 사용하는 대신 웨스턴 블로팅을 사용하면 연구자가 리포터 유전자로 특정 세포주를 만드는 대신 내인성 세포를 사용할 수 있습니다. 내인성 세포를 사용하는 데에는 많은 불멸화 된 세포주가 주요 세포 사멸 분자72,73이 결핍되어 결과에 영향을 미칠 수 있다는 사실을 포함하여 여러 가지 이점이 있습니다. 또한 내인성 세포를 사용하면 단일 계통이 아닌 대식세포, 상피 세포 및 내피 세포와 같은 다양한 세포 유형을 평가할 수 있습니다. 웨스턴 블로팅은 또한 크고 값비싼 장비나 복잡한 설정 없이 전 세계 실험실에서 수행할 수 있는 비교적 간단하고 비용 효율적인 기술입니다.
이 프로토콜은 다른 염증 신호 전달 경로에서의 스캐폴딩 역할 및 기능을 포함하여 카스파제의 세포 사멸 의존성 및 세포 사멸 비의존적 기능을 모두 이해하기 위해 생물학 전반에 걸쳐 광범위하게 적용할 수 있습니다74. 이 방법을 적용하면 질병 및 상태 전반에 걸친 선천성 면역 PCD 경로 및 염증 신호 연구에서 통합된 접근 방식이 가능하며, 이 프로토콜은 미래 치료 전략의 개발을 알릴 중요한 조절 과정과 기계론적 연결을 식별하는 데 사용할 수 있습니다.
프로토콜
동물 사용 및 절차는 동물 사용 및 관리에 관한 세인트 주드 아동 연구 병원 위원회의 승인을 받았습니다.
1. 솔루션 준비
- L929 컨디셔닝 미디어를 준비합니다.
- 플레이트 1 ×10 6 개의 L929 세포 ( 재료의 표 참조)를 50 mL의 L929 배양 배지를 함유하는 182cm2 조직 배양 플라스크 (배지의 제조에 대해서는 표 1 참조)에 넣었다.
- 37°C의 가습된 인큐베이터에서 5%CO2로 세포를 성장시킨다.
- 7일 후, 상층액을 수집하고, 0.45 μm 필터를 이용하여 여과한다. 분취량 50mL를 준비합니다(냉동 분취량은 -80°C에서 최대 1년 동안 보관).
- 골수유래 대식세포(BMDM) 배양액 500mL를 준비한다(표 1).
- 500mL의 BMDM 자극 매체를 준비합니다(표 1).
- 감염을 위해 500mL의 배지를 준비합니다(표 1).
- 100mL의 1M Tris 완충액을 준비합니다(표 1).
- 4x 소듐 도데실 설페이트(SDS) 완충액을 준비합니다(표 1).
- 1 mL의 1 M 1,4-디티오트레이톨을 준비한다(DTT, 표 1).
- 40mL의 카스파제 용해 완충액을 준비합니다(표 1).
- 1.5 M Tris 완충액 100 mL를 준비한다(표 1).
- 100%(wt/vol) SDS 용액 10mL를 준비합니다(표 1).
- 50mL의 2x 방사성 면역침전 분석법(RIPA) 완충액을 준비합니다(표 1).
- 5mg/mL LPS 용액을 준비합니다(표 1).
- 0.5 M ATP 용액을 준비한다(표 1).
- 웨스턴 블로팅 용액을 준비합니다.
- 1L의 5x 러닝 버퍼 스톡을 준비합니다(표 1).
- 1L의 10x 전사 버퍼 스톡을 준비합니다(표 1).
- Tween 20(TBST, 표 1)으로 1L의 트리스 완충 식염수를 준비합니다.
- 100%(wt/vol) 탈지유 차단 용액 5mL를 준비합니다(표 1).
- 1차 항체 용액을 준비합니다.
- 10mL의 카스파제-1차 항체를 준비합니다(표 1).
- 10mL의 카스파제-11 1차 항체를 준비한다(표 1).
- 10mL의 카스파제-3 1차 항체를 준비합니다(표 1).
- 10mL의 카스파제-7 1차 항체를 준비합니다(표 1).
- 10mL의 카스파제-8 1차 항체를 준비합니다(표 1).
- 10mL의 카스파제-9 1차 항체를 준비합니다(표 1).
- HRP-conjugated β-actin primary antibody 10 mL를 준비한다(표 1).
- 2차 항체 용액을 준비한다.
- 항-토끼 2차 항체 10mL를 준비한다(표 1).
- 10mL의 항-마우스 2차 항체를 준비한다(표 1).
- 10mL의 항쥐 2차 항체를 준비합니다(표 1).
2. 골수 유래 대식세포 분리
참고: 이 프로토콜의 경우 PCD 경로가 손상되지 않은 6-10주령 야생형 마우스 또는 PCD 조절자, 이펙터 또는 관심 분자가 결실 또는 변경된 돌연변이 마우스를 사용할 수 있습니다.
- 2-3분 동안 분당 케이지 부피의 10%-30%를 대체하는 유속으로CO2 챔버에서 마우스를 안락사시킵니다. 그런 다음 자궁 경부 탈구와 같은 2 차 안락사 방법을 수행하십시오. 해당되는 경우 모든 추가 시설, 기관 및 정부별 지침과 규정을 따르십시오.
- 마우스를 해부하여 뒷다리 뼈를 회수합니다.
- 복부가 노출되도록 마우스를 등에 고정합니다. 뒷다리와 복부를 소독하기 위해 70%(vol/vol) 에탄올을 뿌립니다.
주의 : 에탄올은 가연성입니다. 화기에 가까이 두지 마십시오. - 가위를 사용하여 복부 정중선을 절개합니다. 대퇴골이 보이도록 다리 쪽으로 계속 자릅니다.
- 오른쪽 뒷다리를 잡고 피부를 몸에서 정중선 쪽으로 당깁니다. 내전근을 정중선 쪽으로 절단하여 다리를 몸에서 분리합니다. 그런 다음 고관절과 척추 사이의 다리를 자릅니다. 다음으로 발목 말단에서 발을 잘라내고 피부를 벗겨내고 살짝 열린 가위를 사용하여 종아리 조직을 벗겨냄으로써 뼈에서 과도한 조직을 제거합니다.
- 70%(vol/vol) 에탄올에 적신 수건에 다리를 놓고 경골과 대퇴골을 해부합니다.
- 경골과 대퇴골을 각각 별도의 집게 세트로 고정합니다. 무릎 관절의 자연스러운 방향에 대해 경골을 부드럽게 누르십시오. 이로 인해 경골이 무릎에서 부러집니다.
- 필요한 경우 집게와 해부 가위를 사용하여 남아 있는 매달린 조직을 제거합니다. 나중에 사용할 수 있도록 경골을 에탄올에 적신 수건 위에 올려 놓으십시오.
- 무릎을 꺾어 같은 방법으로 대퇴골을 모으십시오.
- 왼쪽 다리에 대해 위의 3단계와 4단계를 반복하여 몸에서 제거하고 경골과 대퇴골을 해부합니다.
- 뼈에 70%(vol/vol) 에탄올을 뿌립니다.
- 깨끗한 70%(vol/vol) 에탄올에 적신 수건에 뼈를 놓고 수건의 살점을 짜낸 다음 수건을 뼈에 문질러 과도한 조직을 제거하여 뼈를 닦아냅니다.
- 복부가 노출되도록 마우스를 등에 고정합니다. 뒷다리와 복부를 소독하기 위해 70%(vol/vol) 에탄올을 뿌립니다.
- 대퇴골과 경골이 모두 깨끗해지면 4개의 뼈 모두에 70%(vol/vol) 에탄올을 뿌립니다. 멸균된 페트리 접시에 뼈를 모으고 접시에 있는 배지를 부드럽게 휘저어 BMDM 배양 배지 10mL로 헹굽니다.
- 10mL 주사기에 10mL의 신선한 BMDM 배양 배지를 채우고 25G 바늘을 부착합니다.
- 집게를 사용하여 경골을 집어 올리십시오. 그런 다음 발목 관절을 ~45° 각도로 자릅니다.
- 경골에서 골수를 씻어냅니다.
- 경골의 좁은 끝이 아래를 향하도록 50mL 튜브 위에 경골을 고정합니다. 채워진 주사기에서 경골 위에 미디어를 분배합니다.
- 골수의 상단 끝에 바늘을 삽입하고(처음에는 부드럽게) 배지를 분배합니다.
- 바늘을 제거한 다음 다시 삽입하십시오. 짧고 고압으로 밀어 배지를 분배하고 바늘을 골수로 옮깁니다.
- 배지가 뼈의 바닥에서 흘러 나오기 시작하면 짧고 고압으로 밀어서 세포를 계속 씻어냅니다. 이 과정에서 뼈의 색깔을 모니터링하고 뼈가 하얗게 되면 버립니다.
- 두 경골 모두에 대해 이것을하십시오.
- 대퇴골에 대해 위의 5단계와 6단계를 반복하여 발목 관절에서 경골을 절단할 때 고관절을 절단합니다. 골수를 세척할 때 동일한 50mL 튜브를 사용하여 BMDM 배양 배지를 수집합니다.
- 4개의 뼈가 모두 세척되면 50mL 튜브의 골수와 배지를 10mL 주사기의 18G 바늘을 통해 위아래로 3회 흡인하고 매번 튜브의 측면을 헹구어 골수를 분산시킵니다.
- BMDM 배양 배지를 사용하여 50mL 튜브의 최종 부피를 30mL로 조정하고 세포가 완전히 현탁되었는지 확인합니다.
- 70μm 세포 여과기를 사용하여 50mL 튜브에서 BMDM 배양 배지를 필터링합니다.
- 골수 전구 세포를 포함하는 생성된 세포 현탁액을 각각 10mL(또는 ~20 × 106 세포) 를 추가하여 3개의 150mm 조직 배양 접시에 플레이트합니다. 그런 다음 각 접시에 BMDM 배양 배지 10mL를 추가합니다. 37°C의 가습 인큐베이터에서 배양합니다.
3. 실험을 위한 BMDM 및 도금 감별
- 플레이팅된 골수 전구세포를 37°C에서 3일 동안 인큐베이션한다. 이어서, 각 디쉬를 제거하고, 추가로 5-8 mL의 BMDM 배양 배지를 첨가하였다(표 1). 37°C에서 인큐베이터로 돌아갑니다.
- 초기 플레이팅 후 5일째에 각 접시를 제거하고 BMDM 배양 배지 5mL를 추가로 추가합니다. 37°C에서 인큐베이터로 돌아갑니다.
- 6일째 되는 날, 각 접시를 꺼내고 미디어를 버립니다. 그 후, 10 mL의 차가운 (4 °C에서 저장) PBS를 첨가하여 한번 세척한다. 차가운 PBS 세척액 10 mL를 버린다. 그런 다음 각 접시에 신선하고 차가운 PBS 10mL를 넣고 각 접시를 얼음에서 5분 동안 배양합니다.
- 세포 스크레이퍼를 사용하여 세 접시 모두에서 세포를 하나의 50mL 튜브에 부드럽게 긁어냅니다. 세포를 270 × g 에서 4°C에서 5분 동안 부드럽게 스핀다운시키고; 그런 다음 상청액을 버립니다.
- BMDM 배양액 20mL를 추가하고 위아래로 피펫을 사용하여 펠릿을 재현탁하고 세포 수를 계산합니다.
참고: 각 마우스는 약 60 × 10 6-100 × 10 6 세포를 생성할 것으로 예상됩니다. - 원하는 시험관 내 세포 사멸/염증 자극 분석을 위한 12웰 플레이트 레이아웃을 계획합니다. 웰당 1 ×10 6 세포를 플레이트할 계획입니다. 계획된 각 자극에 대해 최소 3개의 생물학적 복제물을 포함하고 카스파제 용해 완충액에서 수확할 웰 1세트와 RIPA 완충액에서 수확할 웰 2세트를 플레이트에 넣습니다.
- 플레이트 1 × 12-웰 플레이트 내의 1 mL의 BMDM 배양 배지 중6 개의 세포. 세포 사멸/염증 평가를 진행하기 전에 37°C의 가습 배양기에서 밤새 배양합니다. 하룻밤 배양 후, 배지를 제거하고, 1 mL의 따뜻한 (37°C) PBS를 각각의 웰에 첨가하여 세포를 세척하였다.
- PBS 세척을 제거하고 항생제가 있는 BMDM 자극 매체(비박테리아 자극을 수행하는 경우) 또는 항생제가 없는 BMDM 자극 매체(박테리아 자극을 수행하는 경우) 500μL를 추가합니다(표 1). 시험관 내 자극/감염을 위해 4단계로 이동하기 전에 2시간 동안 배양합니다.
4. 세포 자극 또는 감염
주의 : 이 프로토콜에 포함된 약제는 잠재적으로 병원성이며 관련 기관 및 정부 당국의 승인을 받아 생물안전 레벨 2(BSL2) 시설에서 적절한 예방 조치를 취하여 취급해야 합니다.
- 관심 트리거로 세포 사멸을 활성화하기 위해 BMDM을 자극합니다.
참고: 이 프로토콜의 목적을 위해 인플루엔자 A 바이러스(IAV), 단순 포진 바이러스 1(HSV1), Francisella novicida, 및 LPS + ATP가 설명에 사용되지만 다른 트리거를 사용할 수 있습니다.- 자극 1 예: IAV(A/Puerto Rico/8/34, H1N1[PR8])로 감염(Hoffmann et al.75에 따라 구성됨, 감염 다중도[MOI] 결정에 대한 바이러스 역가는 MDCK 세포의 플라크 분석에 의해 계산됨):
- 방정식 (1)과 방정식 (2)를 사용하여 20개의 플라크 형성 단위(PFU)의 감염 다중도(MOI)에서 감염에 필요한 바이러스의 양을 계산합니다.

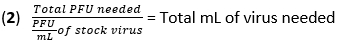

- BMDM에서 배지를 제거하고 500μL의 PBS로 세포를 한 번 세척합니다. 열 비활성화(HI)-FBS가 없는 고혈당 DMEM에 450μL의 IAV(20MOI)를 각 웰에 추가합니다. 플레이트를 37°C에서 1시간 동안 가습된 인큐베이터에서 배양하여 흡수를 허용합니다.
- 플레이트를 제거하고 50 μL의 HI-FBS를 추가합니다. 플레이트를 37°C의 인큐베이터로 되돌립니다. 총 12시간 동안 배양합니다.
- 방정식 (1)과 방정식 (2)를 사용하여 20개의 플라크 형성 단위(PFU)의 감염 다중도(MOI)에서 감염에 필요한 바이러스의 양을 계산합니다.
- 예시 자극 2: HSV1로 감염 (HF 균주; 앞서 기술한 바와 같이 배양됨44; MOI 결정을 위한 바이러스 역가는 Vero 세포에서 플라크 분석에 의해 계산됨):
- 위 IAV 감염 섹션의 1단계에서 방정식 (1) 및 방정식 (2)를 사용하여 10PFU의 MOI에서 감염에 필요한 바이러스의 양을 계산합니다.

- BMDM에서 매체를 제거하십시오. HI-FBS가 없는 고혈당 DMEM에 450μL의 HSV1(MOI 10)을 각 웰에 추가합니다. 플레이트를 37°C에서 1시간 동안 가습된 인큐베이터에서 배양하여 흡수를 허용합니다.
- 플레이트를 제거하고 50 μL의 HI-FBS를 추가합니다. 플레이트를 37°C의 인큐베이터로 되돌립니다. 총 12시간 동안 배양합니다.
- 위 IAV 감염 섹션의 1단계에서 방정식 (1) 및 방정식 (2)를 사용하여 10PFU의 MOI에서 감염에 필요한 바이러스의 양을 계산합니다.
- 자극 실시예 3: F. novicida (U112 균주; 0.2% L-시스테인이 보충된 BBL 트립티카제 대두 브로스에서 37°C에서 호기성 조건 하에44일 이전에 기술된 바와 같이 배양됨)로 하룻밤 동안 감염시킨다. 이어서, 박테리아를 37°C에서 1:10의 비율로 새로운 배지에서 또 다른 4시간 동안 계대배양한 후 새로운 배지를 사용하여 600 nm에서 광학 밀도(OD)를 블랭크로 취하였다. OD 값 1은 mL당 1 ×10 9 집락 형성 단위(CFU)와 같습니다.)
- 방정식 (3)과 방정식 (4)를 사용하여 50CFU의 MOI에서 감염에 필요한 F. novicida의 부피를 계산합니다.

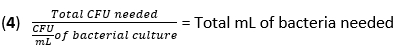
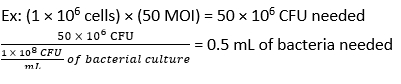
- BMDM에서 매체를 제거합니다. 항생제가 없는 BMDM 자극 배지에 500μL의 F. novicida (MOI 50)를 각 웰에 추가합니다. 플레이트를 37°C에서 4시간 동안 가습된 인큐베이터에서 배양하여 흡수를 허용합니다.
- 가온(37°C) PBS로 세포를 3회 세척하고 50μg/mL 겐타마이신이 포함된 BMDM 자극 배지 500μL를 추가합니다. 플레이트를 37°C의 인큐베이터로 되돌립니다. 하룻밤 동안 배양합니다 (16 시간).
- 방정식 (3)과 방정식 (4)를 사용하여 50CFU의 MOI에서 감염에 필요한 F. novicida의 부피를 계산합니다.
- 자극 예시 4: LPS + ATP로 자극합니다.
- BMDM에서 매체를 제거합니다. 100ng/mL LPS가 포함된 항생제(표 1)와 함께 500μL의 BMDM 자극 배지를 각 웰에 추가합니다. 플레이트를 가습 인큐베이터에서 3.5시간 동안 37°C에서 배양합니다.
- 5 μL의 0.5 M ATP 원액(표 1)을 각 웰에 첨가한다. 플레이트를 37°C의 인큐베이터로 되돌립니다. 30분 동안 배양합니다.
- 자극 1 예: IAV(A/Puerto Rico/8/34, H1N1[PR8])로 감염(Hoffmann et al.75에 따라 구성됨, 감염 다중도[MOI] 결정에 대한 바이러스 역가는 MDCK 세포의 플라크 분석에 의해 계산됨):
5. 카스파아제 웨스턴 블롯에 사용할 상층액과 단백질 용해물을 조합하여 수집
- 4시간, 12시간 또는 16시간의 배양 후(특정 시기는 사용된 방아쇠에 따라 다름) 배양기에서 플레이트를 제거합니다.
- 상청액 150 μL를 제거하고; 다른 상층액 분석(예: 효소 결합 면역흡착 분석[ELISA])을 위해 폐기하거나 저장합니다. 나머지 상층액을 제거하지 마십시오.
- 웰당 50 μL의 카스파제 용해 완충액 + 100 μL의 4x SDS 완충액을 조합하여 단백질 수집 용액을 만듭니다(표 1). 그런 다음 혼합물 150μL를 각 웰에 추가합니다.
- 각 웰에 대해, 용해된 세포 및 상청액을 수집하기 위해 혼합물을 위아래로 피펫팅한다. 피펫팅하는 동안 피펫 팁으로 웰 바닥을 긁어 세포를 파괴합니다. 긁어내고 피펫팅한 후 단백질 용해물을 라벨이 붙은 1.5mL 튜브에 수집합니다.
- 열 블록을 사용하여 모든 튜브를 100°C로 12분 동안 가열합니다.
- 실온에서 30초 동안 14,500× g 에서 원심분리하여 불용성 성분을 펠렛화합니다.
참고: 이것은 일시 중지 지점입니다 – 결합된 상층액과 단백질 용해물의 단백질은 즉시 사용하거나 -20°C에서 최대 2개월 동안 또는 -80°C에서 사용할 준비가 될 때까지 최대 6개월 동안 보관할 수 있습니다.
6. 카스파아제 웨스턴 블롯에 사용할 단백질 용해물 수집
- 4시간, 12시간 또는 16시간의 배양 후(특정 시기는 사용된 방아쇠에 따라 다름) 배양기에서 플레이트를 제거합니다. 모든 상청액을 제거하십시오. 다른 상층액 분석(예: ELISA)을 위해 이를 폐기하거나 저장합니다.
- 동일한 부피의 탈이온수에 2x RIPA 원액(표 1)을 희석하여 1x RIPA 버퍼를 만듭니다. 그런 다음 포스파타제 억제제 정제 1개와 프로테아제 억제제 정제 1개를 추가하고 용해시킵니다. 150μL의 1x RIPA 버퍼와 50μL의 4x SDS를 각 웰에 추가합니다.
- 각 웰에 대해 혼합물을 위아래로 피펫팅하여 용해된 세포를 수집합니다. 피펫팅하는 동안 피펫 팁으로 웰 바닥을 긁어 세포를 파괴합니다. 긁어내고 피펫팅한 후 단백질 용해물을 라벨이 붙은 1.5mL 튜브에 수집합니다.
- 열 블록을 사용하여 모든 튜브를 100°C로 12분 동안 가열합니다.
- 실온에서 30초 동안 14,500× g 에서 원심분리하여 불용성 성분을 펠렛화합니다.
참고: 이것은 일시 중지 지점입니다 – 단백질 용해물은 즉시 사용하거나 사용할 준비가 될 때까지 -20 °C 또는 -80 °C에서 보관할 수 있습니다.
7. 위의 단계에 따라 BMDM에서 수집된 용해물 또는 조직 균질액에서 수집한 용해물을 사용하여 웨스턴 블롯팅을 수행합니다
참고: 조직을 사용하는 경우 손으로 또는 동력 구동 조직 균질화기를 통해 균질화할 수 있습니다. Simpson76의 프로토콜은 조직 균질화에 대한 자세한 설명을 제공합니다.
- 1x 러닝 버퍼 준비: 200mL의 5x 러닝 버퍼 스톡(표 1)과 800mL의 탈이온수를 결합합니다. 각 실험 직전에 이 1x 실행 버퍼를 만듭니다.
- 10웰의 12%(wt/vol) 폴리아크릴아미드 겔로 전기영동 장치를 준비합니다. 전기영동 장치를 1x 러닝 버퍼로 채웁니다. 그런 다음 젤 빗을 제거합니다.
참고: 각 샘플에 대해 카스파제-1, 카스파제-11, 카스파제-3, 카스파제-7, 카스파제-8 및 카스파제-9를 분석하려면 6개의 젤이 필요합니다. - 카스파제-1, 카스파제-3, 카스파제-7 및 카스파제-8 블롯의 경우 카스파제 용해 완충액 또는 조직 균질액에서 결합된 상층액과 단백질 용해물 30μL을 사용할 계획입니다. 카스파제-11 및 카스파제-9 얼룩의 경우 RIPA 완충액 또는 조직 균질액에서 단백질 용해물 20μL를 사용할 계획입니다. 샘플이 -20 °C 또는 -80 °C에서 보관 된 경우 먼저 얼음에서 해동하십시오.
- 모든 샘플에 대해 100°C로 5분 동안 가열하고 로딩하기 전에 4°C에서 30초 동안 14,500× g 에서 원심분리합니다. 그런 다음 20 또는 30 μL의 샘플을 각 레인에 천천히 로드합니다. 샘플이 다른 레인으로 넘치지 않도록 하십시오. 6개의 카스파제를 한 번에 모두 평가하려면 동일한 절차를 사용하여 적절한 샘플을 6개의 젤 각각에 로드합니다.
- 전기 영동 장치를 전원에 연결하십시오. 그런 다음 전원을 80분 동안 20V로 설정하여 젤 실행을 시작한 다음 130-45분 동안 60V로 전원을 조정합니다.
- 염료 전면을 주의 깊게 관찰하고 염료 전면이 젤 바닥에 있지만 아직 젤 밖으로 밀려나지 않은 경우 전원을 끕니다.
- 겔이 실행되는 동안 700mL의 탈이온수, 100mL의 10x 전사 완충액 스톡(표 1) 및 200mL의 메탄올을 결합하여 1x 전사 완충액을 준비합니다. 매번 1x 용액을 신선하게 만드십시오.
알림: 메탄올은 가연성이므로 주의하십시오. 화염에서 멀리 떨어진 곳에서 전사 버퍼 준비를 수행하십시오. - 겔 방출기를 사용하여 전기영동 장치로부터 겔을 부드럽게 제거한다.
- 각 젤에 대해 하나의 전사 스택을 설정합니다.
- PVDF 멤브레인을 메탄올에 1분 동안 담가 활성화합니다.
- 두 조각의 여과지, 겔 및 PVDF 멤브레인을 전사 완충액에 5분 동안 미리 적십니다. 이 5분 배양 동안 PVDF 멤브레인과 젤을 별도의 용기에 보관하십시오.
- 세미 드라이 시스템에서 이송 스택을 조립합니다. 하단 백금 양극 쪽에서 시작하여 여과지 한 장, PVDF 멤브레인, 젤, 마지막으로 여과지 한 장을 놓습니다. 레이어 사이의 기포를 부드럽게 굴리거나 누르고 시스템 상단을 닫습니다. 계속 진행하기 전에 안전 덮개가 고정되어 있는지 확인하십시오.
- 전원에 연결합니다. 25분 동안 전원을 45V로 설정합니다.
- 이송이 완료된 후 이송 스택을 분해하고 멤브레인을 수집합니다. 정사각형 페트리 접시 (배양 트레이)에 넣으십시오.
- 5%(wt/vol) 탈지유 용액 15mL를 추가하여 막 차단을 수행합니다(표 1). 멤브레인을 실온에서 50 rpm 내지 70 rpm으로 1시간 동안 흔들리는 진탕 상에서 인큐베이션한다.
참고: 이것은 일시 중지 지점입니다 – 멤브레인은 1시간 후에 제거하거나 4°C의 차단 용액에 밤새 보관할 수 있습니다. - 1시간 또는 하룻밤 배양 후 블로킹 용액을 제거합니다. 희석된 항체 용액(항-카스파제-1 항체, 항-카스파제-11 항체, 결합된 항-카스파제-3 및 항-절단 카스파제-3 항체, 결합된 항-카스파제-7 및 항-절단된 카스파제-7 항체, 결합된 항-카스파제-8 및 항-절단된 카스파제-8 항체 또는 항-카스파제-9 항체) 10mL를 추가합니다(표 1). 50 rpm 내지 70 rpm의 흔들리는 진탕기에 올려 실온에서 2 시간 동안 또는 4 °C에서 밤새 (16 시간) 배양한다.
- 항체 용액을 수집하고(최대 3배 재사용 또는 폐기), 실온에서 50rpm에서 70rpm으로 10분 동안 흔들리는 쉐이커에서 멤브레인에 15mL의 TBST(표 1)를 추가하여 세척합니다. TBST를 폐기하십시오.
- 14단계 후 TBST 15mL로 총 3회 세척을 반복합니다.
- 희석된 2차 HRP-접합 항체 용액 10mL를 추가합니다(카스파제-3, 카스파제-7, 카스파제-8 또는 카스파제-9에 대한 1차 항체로 염색된 블롯에 대한 항-토끼, 카스파제-1에 대한 1차 항체로 염색된 블롯에 대한 항-마우스, 카스파제-11에 대한 1차 항체로 염색된 블롯에 대한 항-쥐). 실온에서 50 rpm에서 70 rpm으로 1 시간 동안 흔들리는 쉐이커에서 배양합니다.
- 항체 용액을 제거하고, 15 mL의 TBST를 실온에서 70 rpm으로 50 rpm에서 70 rpm으로 쉐이킹 쉐이커에서 멤브레인에 첨가하여 10분 동안 세척한다. TBST를 폐기하십시오.
- 17단계 후 TBST 15mL로 총 3회 세척을 반복합니다.
- 고감도 HRP 기질 10mL를 멤브레인에 추가합니다. 어두운 곳에서 실온에 1분 동안 두십시오.
- 기판에서 멤브레인을 제거합니다. 액세서리 흰색 트랜스 트레이가 아래쪽 위치에 삽입된 화학발광 이미저를 사용하여 이미징을 직접 진행합니다. 자동 노출 모드 (일반적으로 노출 시간의 ~1-2분)를 사용하여 멤브레인을 노출시킵니다.
- 카스파제-9 또는 카스파제-11 블롯팅으로부터의 멤브레인 (즉, RIPA 용해물 샘플이 있는 멤브레인)을 이용하여, 10 mL의 스트리핑 완충액을 첨가하고, 실온에서 5 분 동안 50 rpm 내지 70 rpm의 로킹 쉐이커 상에서 인큐베이션한다.
- 스트리핑 버퍼를 버리고, 15 mL의 TBST를 실온에서 50 rpm 내지 70 rpm으로 10분 동안 흔들리는 쉐이커 상에서 멤브레인에 첨가하여 세척한다. TBST를 폐기하십시오.
- 22단계 후 TBST 15mL로 총 3회 세척을 반복합니다.
- 15%(wt/vol) 탈지유 용액 5mL를 추가하여 막 차단을 수행합니다. 멤브레인을 실온에서 50 rpm 내지 70 rpm으로 1시간 동안 흔들리는 진탕 상에서 인큐베이션한다.
참고: 이것은 일시 중지 지점입니다 – 멤브레인은 1시간 후에 제거하거나 4°C의 차단 용액에 밤새 보관할 수 있습니다. - 1시간 또는 하룻밤 배양 후 블로킹 용액을 제거합니다. 희석된 항-β-액틴(HRP-접합) 항체 용액 10mL를 추가합니다. 50 rpm 내지 70 rpm의 흔들 쉐이커에 올려 실온에서 1.5 시간 동안 배양한다.
- 항체 용액을 제거하고 실온에서 50 rpm에서 70 rpm으로 10분 동안 흔들리는 쉐이커에서 멤브레인에 TBST 15 mL를 가하여 세척합니다. TBST를 폐기하십시오.
- 26단계 후 TBST 15mL로 총 3회 세척을 반복합니다.
- 10mL의 표준 감도 HRP 기질을 멤브레인에 추가합니다. 어두운 곳에서 실온에 1분 동안 두십시오.
- 액세서리 흰색 트랜스 트레이가 아래쪽 위치에 삽입된 화학발광 이미저를 사용하여 이미징을 직접 진행합니다. 자동 노출 모드 (일반적으로 노출 시간 <1분)를 사용하여 멤브레인을 노출시킵니다.
결과
PANoptosis는 수많은 박테리아, 바이러스 및 곰팡이 감염 및 기타 염증 자극뿐만 아니라 암세포에서도관찰되었습니다 44,48,49,50,51,52,53,54,56,57,58,60,61,62
토론
카스파제 절단 및 활성화를 모니터링하면 선천성 면역 반응의 일부로서 선천성 면역 PCD 활성화에 대한 가장 포괄적인 사진 중 하나를 얻을 수 있습니다. 여기에 기술된 프로토콜은 IAV, HSV1 및 F. novicida 감염 및 멸균 트리거 LPS + ATP에 대한 반응으로 카스파제 활성화를 모니터링하는 전략을 보여주지만, 다수의 다른 자극이 PCD를 유도할 수 있고, 여러 간행물 44,48,49,50,51,52,53,54,56에
공개
T.-D.K.는 화이자의 컨설턴트입니다.
감사의 말
의견과 제안을 해주신 Kanneganti 연구실 구성원들에게 감사드리며, 과학 편집 지원을 해주신 J. Gullett 박사님께도 감사드립니다. 우리 연구실의 작업은 국립 보건원 (NIH) 보조금 AI101935, AI124346, AI160179, AR056296 및 CA253095 (T.-D.K.) 및 미국 레바논 시리아 연합 자선 단체 (T.-D.K.). 내용은 전적으로 저자의 책임이며 반드시 국립 보건원의 공식 견해를 나타내는 것은 아닙니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.45 μm filter | Millipore | SCHVU05RE | |
| 10 mL syringe | BD Biosciences | 309604 | |
| 12% polyacrylamide gel with 10 wells | Bio-Rad | 4561043 | |
| 12-well plate | Corning | 07-200-82 | |
| 18 G needle | BD Biosciences | 305195 | |
| 25 G needle | BD Biosciences | 305122 | |
| 50 mL tube | Fisher Scientific | 50-809-218 | |
| 70 μm cell strainer | Corning | 431751 | |
| 150 mm tissue culture dishes | Corning | 430597 | |
| 182-cm2 tissue culture flask | Genesee Scientific | 25-211 | |
| Accessory white trans tray | Cytiva | 29-0834-18 | |
| Anti–caspase-1 antibody | AdipoGen | AG-20B-0042-C100 | |
| Anti–caspase-11 antibody | Novus Biologicals | NB120-10454 | |
| Anti–caspase-3 antibody | Cell Signaling Technology | 9662 | |
| Anti–caspase-7 antibody | Cell Signaling Technology | 9492 | |
| Anti–caspase-8 antibody | Cell Signaling Technology | 4927 | |
| Anti–caspase-9 antibody | Cell Signaling Technology | 9504 | |
| Anti–cleaved caspase-3 antibody | Cell Signaling Technology | 9661 | |
| Anti–cleaved caspase-7 antibody | Cell Signaling Technology | 9491 | |
| Anti–cleaved caspase-8 antibody | Cell Signaling Technology | 8592 | |
| Anti-mouse HRP-conjugated secondary antibody | Jackson ImmunoResearch Laboratories | 315-035-047 | |
| Anti-rabbit HRP-conjugated secondary antibody | Jackson ImmunoResearch Laboratories | 111-035-047 | |
| Anti-rat HRP-conjugated secondary antibody | Jackson ImmunoResearch Laboratories | 112-035-003 | |
| Anti–β-Actin antibody (C4) HRP | Santa Cruz | sc-47778 HRP | |
| ATP | InvivoGen | tlrl-atpl | |
| BBL Trypticase Soy Broth | BD Biosciences | 211768 | |
| Bead bath | Chemglass Life Sciences | CLS-4598-009 | |
| Biophotometer D30 | Eppendorf | 6133000010 | |
| BME | Sigma | M6250 | |
| Bromophenol blue | Sigma | BO126 | |
| Cell scrapers | CellTreat Scientific Products | 229315 | |
| Chemiluminescence imager (Amersham 600) | Cytiva | 29083461 | |
| CO2 chamber | VetEquip | 901703 | |
| Cuvettes | Fisher Scientific | 14-955-129 | |
| Dissecting scissors | Thermo Fisher Scientific | 221S | |
| DMEM | Thermo Fisher Scientific | 11995-073 | |
| DTT | Sigma | 43815 | |
| Eelectrophoresis apparatus | Bio-Rad | 1658004 | |
| Ethanol | Pharmco | 111000200 | |
| Fetal bovine serum | Biowest | S1620 | |
| Filter paper | Bio-Rad | 1703965 | |
| Forceps | Fisher Scientific | 22-327379 | |
| Francisella novicida (U112 strain) | BEI Resources | NR-13 | |
| Gel releaser | Bio-Rad | 1653320 | |
| Gentamycin | Gibco | 15750060 | |
| Glycerol | Sigma | G7893 | |
| Glycine | Sigma | G8898 | |
| HCl | Sigma | H9892 | |
| Heat block | Fisher Scientific | 23-043-160 | |
| Herpes simplex virus 1 (HF strain) | ATCC | VR-260 | |
| High glucose DMEM | Sigma | D6171 | |
| Human anti–caspase-1 antibody | R&D Systems | MAB6215 | |
| Human anti–caspase-8 antibody | Enzo | ALX-804-242 | |
| Humidified incubator | Thermo Fisher Scientific | 51026282 | |
| Image analysis software | ImageJ | v1.53a | |
| IMDM | Thermo Fisher Scientific | 12440-053 | |
| Influenza A virus (A/Puerto Rico/8/34, H1N1 [PR8]) | constructed per Hoffmann et al. | ||
| L929 cells | ATCC | CCL-1 | cell line for creating L929-conditioned media |
| L-cysteine | Thermo Fisher Scientific | BP376-100 | |
| Luminata Forte Western HRP substrate | Millipore | WBLUF0500 | standard-sensitivity HRP substrate |
| MDCK cells | ATCC | CCL-34 | cell line for determining IAV viral titer |
| Methanol | Sigma | 322415 | |
| Microcentrifuge | Thermo Fisher Scientific | 75002401 | |
| Non-essential amino acids | Gibco | 11140050 | |
| Nonfat dried milk powder | Kroger | ||
| NP-40 solution | Sigma | 492016 | |
| PBS | Thermo Fisher Scientific | 10010023 | |
| Penicillin and streptomycin | Sigma | P4333 | |
| Petri dish | Fisher Scientific | 07-202-011 | |
| PhosSTOP | Roche | PHOSS-RO | |
| Power source | Bio-Rad | 164-5052 | |
| Protease inhibitor tablet | Sigma | S8820 | |
| PVDF membrane | Millipore | IPVH00010 | |
| Rocking shaker | Labnet | S2035-E | |
| SDS | Sigma | L3771 | |
| Sodium chloride | Sigma | S9888 | |
| Sodium deoxycholate | Sigma | 30970 | |
| Sodium hydroxide | Sigma | 72068 | |
| Sodium pyruvate | Gibco | 11360-070 | |
| Square Petri dish | Fisher Scientific | FB0875711A | |
| Stripping buffer | Thermo Fisher Scientific | 21059 | |
| Super Signal Femto HRP substrate | Thermo Fisher Scientific | 34580 | high-sensitivity HRP substrate |
| Tabletop centrifuge | Thermo Fisher Scientific | 75004524 | |
| Trans-Blot semi-dry system | Bio-Rad | 170-3940 | |
| Tris | Sigma | TRIS-RO | |
| Tween 20 | Sigma | P1379 | |
| Ultrapure lipopolysaccharide (LPS) from E. coli 0111:B4 | InvivoGen | tlrl-3pelps | |
| Vero cells | ATCC | CCL-81 | cell line for determining HSV1 viral titer |
참고문헌
- Alnemri, E. S., et al. Human ICE/CED-3 protease nomenclature. Cell. 87 (2), 171 (1996).
- Man, S. M., Kanneganti, T. D. Converging roles of caspases in inflammasome activation, cell death and innate immunity. Nature Reviews Immunology. 16 (1), 7-21 (2016).
- Gullett, J. M., Tweedell, R. E., Kanneganti, T. D. It's all in the PAN: Crosstalk, plasticity, redundancies, switches, and interconnectedness encompassed by PANoptosis underlying the totality of cell death-associated biological effects. Cells. 11 (9), 1495 (2022).
- Pandian, N., Kanneganti, T. D. PANoptosis: A unique innate immune inflammatory cell death modality. Journal of Immunology. 209 (9), 1625-1633 (2022).
- Galluzzi, L., et al. Molecular mechanisms of cell death recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death & Differentiation. 25 (3), 486-541 (2018).
- Shi, Y. Caspase activation: Revisiting the induced proximity model. Cell. 117 (7), 855-858 (2004).
- Galluzzi, L., Lopez-Soto, A., Kumar, S., Kroemer, G. Caspases connect cell-death signaling to organismal homeostasis. Immunity. 44 (2), 221-231 (2016).
- Fernandes-Alnemri, T., Litwack, G., Alnemri, E. S. CPP32, a novel human apoptotic protein with homology to Caenorhabditis elegans cell death protein Ced-3 and mammalian interleukin-1 beta-converting enzyme. Journal of Biological Chemistry. 269 (49), 30761-30764 (1994).
- Tewari, M., et al. Yama/CPP32 beta, a mammalian homolog of CED-3, is a CrmA-inhibitable protease that cleaves the death substrate poly(ADP-ribose) polymerase. Cell. 81 (5), 801-809 (1995).
- Nicholson, D. W., et al. Identification and inhibition of the ICE/CED-3 protease necessary for mammalian apoptosis. Nature. 376 (6535), 37-43 (1995).
- Stennicke, H. R., et al. Pro-caspase-3 is a major physiologic target of caspase-8. Journal of Biological Chemistry. 273 (42), 27084-27090 (1998).
- Twiddy, D., Cohen, G. M., Macfarlane, M., Cain, K. Caspase-7 is directly activated by the approximately 700-kDa apoptosome complex and is released as a stable XIAP-caspase-7 approximately 200-kDa complex. Journal of Biological Chemistry. 281 (7), 3876-3888 (2006).
- Kesavardhana, S., Malireddi, R. K. S., Kanneganti, T. D. Caspases in cell death, inflammation, and pyroptosis. Annual Reviews of Immunology. 38, 567-595 (2020).
- Kerr, J. F., Wyllie, A. H., Currie, A. R. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. British Journal of Cancer. 26 (4), 239-257 (1972).
- Taylor, R. C., Cullen, S. P., Martin, S. J. Apoptosis: Controlled demolition at the cellular level. Nature Reviews Molecular Cell Biology. 9 (3), 231-241 (2008).
- Morioka, S., Maueröder, C., Ravichandran, K. S. Living on the edge: Efferocytosis at the interface of homeostasis and pathology. Immunity. 50 (5), 1149-1162 (2019).
- Wang, Y., et al. Chemotherapy drugs induce pyroptosis through caspase-3 cleavage of a gasdermin. Nature. 547 (7661), 99-103 (2017).
- Rogers, C., et al. Cleavage of DFNA5 by caspase-3 during apoptosis mediates progression to secondary necrotic/pyroptotic cell death. Nature Communications. 8, 14128 (2017).
- Kayagaki, N., et al. Caspase-11 cleaves gasdermin D for non-canonical inflammasome signalling. Nature. 526 (7575), 666-671 (2015).
- Shi, J., Gao, W., Shao, F. Pyroptosis: Gasdermin-mediated programmed necrotic cell death. Trends in Biochemical Sciences. 42 (4), 245-254 (2017).
- Sborgi, L., et al. GSDMD membrane pore formation constitutes the mechanism of pyroptotic cell death. EMBO Journal. 35 (16), 1766-1778 (2016).
- Aglietti, R. A., et al. GsdmD p30 elicited by caspase-11 during pyroptosis forms pores in membranes. Proceedings of the National Academy of Sciences of the United States of America. 113 (28), 7858-7863 (2016).
- Hagar, J. A., Powell, D. A., Aachoui, Y., Ernst, R. K., Miao, E. A. Cytoplasmic LPS activates caspase-11: implications in TLR4-independent endotoxic shock. Science. 341 (6151), 1250-1253 (2013).
- Kayagaki, N., et al. Noncanonical inflammasome activation by intracellular LPS independent of TLR4. Science. 341 (6151), 1246-1249 (2013).
- Shi, J., et al. Inflammatory caspases are innate immune receptors for intracellular LPS. Nature. 514 (7521), 187-192 (2014).
- Lamkanfi, M., et al. Targeted peptidecentric proteomics reveals caspase-7 as a substrate of the caspase-1 inflammasomes. Molecular & Cellular Proteomics. 7 (12), 2350-2363 (2008).
- Kalai, M., et al. Tipping the balance between necrosis and apoptosis in human and murine cells treated with interferon and dsRNA. Cell Death & Differentiation. 9 (9), 981-994 (2002).
- Li, C., et al. Development of atopic dermatitis-like skin disease from the chronic loss of epidermal caspase-8. Proceedings of the National Academy of Sciences of the United States of America. 107 (51), 22249-22254 (2010).
- Kovalenko, A., et al. Caspase-8 deficiency in epidermal keratinocytes triggers an inflammatory skin disease. Journal of Experimental Medicine. 206 (10), 2161-2177 (2009).
- Kang, T. B., et al. Caspase-8 serves both apoptotic and nonapoptotic roles. Journal of Immunology. 173 (5), 2976-2984 (2004).
- Oberst, A., et al. Catalytic activity of the caspase-8-FLIP(L) complex inhibits RIPK3-dependent necrosis. Nature. 471 (7338), 363-367 (2011).
- Kaiser, W. J., et al. RIP3 mediates the embryonic lethality of caspase-8-deficient mice. Nature. 471 (7338), 368-372 (2011).
- Zhang, H., et al. Functional complementation between FADD and RIP1 in embryos and lymphocytes. Nature. 471 (7338), 373-376 (2011).
- Shi, J., et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 526 (7575), 660-665 (2015).
- Hitomi, J., et al. Identification of a molecular signaling network that regulates a cellular necrotic cell death pathway. Cell. 135 (7), 1311-1323 (2008).
- Malireddi, R. K., Ippagunta, S., Lamkanfi, M., Kanneganti, T. D. Cutting edge: Proteolytic inactivation of poly(ADP-ribose) polymerase 1 by the Nlrp3 and Nlrc4 inflammasomes. Journal of Immunology. 185 (6), 3127-3130 (2010).
- Tsuchiya, K., et al. Caspase-1 initiates apoptosis in the absence of gasdermin D. Nature Communications. 10 (1), (2019).
- Taabazuing, C. Y., Okondo, M. C., Bachovchin, D. A. Pyroptosis and apoptosis pathways engage in bidirectional crosstalk in monocytes and macrophages. Cell Chemical Biology. 24 (4), 507-514 (2017).
- Gurung, P., et al. FADD and caspase-8 mediate priming and activation of the canonical and noncanonical Nlrp3 inflammasomes. Journal of Immunology. 192 (4), 1835-1846 (2014).
- Man, S. M., et al. Inflammasome activation causes dual recruitment of NLRC4 and NLRP3 to the same macromolecular complex. Proceedings of the National Academy of Sciences of the United States of America. 111 (20), 7403-7408 (2014).
- Man, S. M., et al. Salmonella infection induces recruitment of Caspase-8 to the inflammasome to modulate IL-1beta production. Journal of Immunology. 191 (10), 5239-5246 (2013).
- Van Opdenbosch, N., et al. Caspase-1 engagement and TLR-induced c-FLIP expression suppress ASC/caspase-8-dependent apoptosis by inflammasome sensors NLRP1b and NLRC4. Cell Reports. 21 (12), 3427-3444 (2017).
- Pierini, R., et al. AIM2/ASC triggers caspase-8-dependent apoptosis in Francisella-infected caspase-1-deficient macrophages. Cell Death & Differentiation. 19 (10), 1709-1721 (2012).
- Lee, S., et al. AIM2 forms a complex with pyrin and ZBP1 to drive PANoptosis and host defence. Nature. 597 (7876), 415-419 (2021).
- Sagulenko, V., et al. AIM2 and NLRP3 inflammasomes activate both apoptotic and pyroptotic death pathways via ASC. Cell Death & Differentiation. 20 (9), 1149-1160 (2013).
- Lukens, J. R., et al. Dietary modulation of the microbiome affects autoinflammatory disease. Nature. 516 (7530), 246-249 (2014).
- Gurung, P., Burton, A., Kanneganti, T. D. NLRP3 inflammasome plays a redundant role with caspase 8 to promote IL-1beta-mediated osteomyelitis. Proceedings of the National Academy of Sciences of the United States of America. 113 (16), 4452-4457 (2016).
- Kuriakose, T., et al. ZBP1/DAI is an innate sensor of influenza virus triggering the NLRP3 inflammasome and programmed cell death pathways. Science Immunology. 1 (2), (2016).
- Malireddi, R. K. S., et al. TAK1 restricts spontaneous NLRP3 activation and cell death to control myeloid proliferation. Journal of Experimental Medicine. 215 (4), 1023-1034 (2018).
- Malireddi, R. K. S., et al. Innate immune priming in the absence of TAK1 drives RIPK1 kinase activity-independent pyroptosis, apoptosis, necroptosis, and inflammatory disease. Journal of Experimental Medicine. 217 (3), (2020).
- Christgen, S., et al. Identification of the PANoptosome: A molecular platform triggering pyroptosis, apoptosis, and necroptosis (PANoptosis). Frontiers in Cellular and Infection Microbiology. 10, 237 (2020).
- Malireddi, R. K. S., et al. RIPK1 distinctly regulates Yersinia-induced inflammatory cell death, PANoptosis. Immunohorizons. 4 (12), 789-796 (2020).
- Zheng, M., Karki, R., Vogel, P., Kanneganti, T. D. Caspase-6 is a key regulator of innate immunity, inflammasome activation, and host defense. Cell. 181 (3), 674-687 (2020).
- Karki, R., et al. ADAR1 restricts ZBP1-mediated immune response and PANoptosis to promote tumorigenesis. Cell Reports. 37 (3), 109858 (2021).
- Wang, Y., et al. Single cell analysis of PANoptosome cell death complexes through an expansion microscopy method. Cellular and Molecular Life Sciences. 79 (10), 531 (2022).
- Malireddi, R. K. S., et al. Inflammatory cell death, PANoptosis, mediated by cytokines in diverse cancer lineages inhibits tumor growth. Immunohorizons. 5 (7), 568-580 (2021).
- Kesavardhana, S., et al. The Zα2 domain of ZBP1 is a molecular switch regulating influenza-induced PANoptosis and perinatal lethality during development. Journal of Biological Chemistry. 295 (24), 8325-8330 (2020).
- Banoth, B., et al. ZBP1 promotes fungi-induced inflammasome activation and pyroptosis, apoptosis, and necroptosis (PANoptosis). Journal of Biological Chemistry. 295 (52), 18276-18283 (2020).
- Karki, R., et al. Interferon regulatory factor 1 regulates PANoptosis to prevent colorectal cancer. JCI Insight. 5 (12), 136720 (2020).
- Zheng, M., et al. Impaired NLRP3 inflammasome activation/pyroptosis leads to robust inflammatory cell death via caspase-8/RIPK3 during coronavirus infection. Journal of Biological Chemistry. 295 (41), 14040-14052 (2020).
- Karki, R., et al. Synergism of TNF-α and IFN-γ triggers inflammatory cell death, tissue damage, and mortality in SARS-CoV-2 infection and cytokine shock syndromes. Cell. 184 (1), 149-168 (2021).
- Karki, R., et al. ZBP1-dependent inflammatory cell death, PANoptosis, and cytokine storm disrupt IFN therapeutic efficacy during coronavirus infection. Science Immunology. 7 (74), (2022).
- Jiang, W., Deng, Z., Dai, X., Zhao, W. PANoptosis: A new insight into oral infectious diseases. Frontiers in Immunology. 12, 789610 (2021).
- Chi, D., et al. Real-time induction of macrophage apoptosis, pyroptosis, and necroptosis by Enterococcus faecalis OG1RF and two root canal isolated strains. Frontiers in Cellular and Infection Microbiology. 11, 720147 (2021).
- Lin, J. F., et al. Phosphorylated NFS1 weakens oxaliplatin-based chemosensitivity of colorectal cancer by preventing PANoptosis. Signal Transduction and Targeted Therapy. 7 (1), 54 (2022).
- Song, M., et al. Self-assembled polymeric nanocarrier-mediated co-delivery of metformin and doxorubicin for melanoma therapy. Drug Delivery. 28 (1), 594-606 (2021).
- Boucher, D., Chan, A., Ross, C., Schroder, K. Quantifying caspase-1 activity in murine macrophages. Methods in Molecular Biology. 1725, 163-176 (2018).
- Boucher, D., Duclos, C., Denault, J. B. General in vitro caspase assay procedures. Methods in Molecular Biology. 1133, 3-39 (2014).
- Kaushal, V., Herzog, C., Haun, R. S., Kaushal, G. P. Caspase protocols in mice. Methods in Molecular Biology. 1133, 141-154 (2014).
- Swacha, P., Gekara, N. O., Erttmann, S. F. Biochemical and microscopic analysis of inflammasome complex formation. Methods in Enzymology. 625, 287-298 (2019).
- Talley, S., et al. A caspase-1 biosensor to monitor the progression of inflammation in vivo. Journal of Immunology. 203 (9), 2497-2507 (2019).
- Pelegrin, P., Barroso-Gutierrez, C., Surprenant, A. P2X7 receptor differentially couples to distinct release pathways for IL-1beta in mouse macrophage. Journal of Immunology. 180 (11), 7147-7157 (2008).
- Yu, J. W., et al. Cryopyrin and pyrin activate caspase-1, but not NF-kappaB, via ASC oligomerization. Cell Death & Differentiation. 13 (2), 236-249 (2006).
- Henry, C. M., Martin, S. J. Caspase-8 acts in a non-enzymatic role as a scaffold for assembly of a pro-inflammatory "FADDosome" complex upon TRAIL stimulation. Molecular Cell. 65 (4), 715-729 (2017).
- Hoffmann, E., Neumann, G., Kawaoka, Y., Hobom, G., Webster, R. G. A DNA transfection system for generation of influenza A virus from eight plasmids. Proceedings of the National Academy of Sciences of the United States of America. 97 (11), 6108-6113 (2000).
- Simpson, R. J. Homogenization of mammalian tissue. Cold Spring Harbor Protocols. (7), (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유