A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تقييم صحة الميتوكوندريا في الخلايا الليفية المرتبطة بالسرطان المعزولة من كرويات ورم الرئة متعدد الخلايا 3D
* These authors contributed equally
In This Article
Summary
تم تحضير كرويات الورم 3D متعددة الخلايا مع خلايا الورم الغدي الرئوي ، والخلايا الليفية ، والوحيدات ، تليها عزل الخلايا الليفية المرتبطة بالسرطان (CAFs) من هذه الكرويات. تمت مقارنة CAFs المعزولة مع الخلايا الليفية الطبيعية لتقييم صحة الميتوكوندريا من خلال دراسة إمكانات الغشاء عبر الميتوكوندريا ، وأنواع الأكسجين التفاعلية ، والأنشطة الأنزيمية.
Abstract
تعد الخلايا الليفية المرتبطة بالسرطان (CAFs) من بين الخلايا اللحمية الأكثر وفرة الموجودة في البيئة المكروية للورم ، مما يسهل نمو الورم وتطوره. التعقيد داخل البيئة المكروية للورم ، بما في ذلك إفراز الورم ، والالتهاب منخفض الدرجة ، ونقص الأكسجة ، وعدم توازن الأكسدة والاختزال ، يعزز التفاعل غير المتجانس ويسمح بتحويل الخلايا الليفية المقيمة غير النشطة لتصبح CAFs نشطة. يتم تمييز CAFs الأيضية عن الخلايا الليفية العادية (NFs) لأنها أكثر نشاطا من الناحية السكرية ، وتنتج مستويات أعلى من أنواع الأكسجين التفاعلية (ROS) ، وتفرط في التعبير عن مصدر اللاكتات MCT-4 ، مما يؤدي إلى فتح المسام الانتقالية لنفاذية الميتوكوندريا (MPTP). هنا تم وصف طريقة لتحليل صحة الميتوكوندريا من CAFs المنشط المعزولة من كرويات الورم 3D متعددة الخلايا التي تتألف من خلايا الورم الغدي الرئوي البشري (A549) ، وحيدات الإنسان (THP-1) ، وخلايا الخلايا الليفية الرئوية البشرية (MRC5). تم تفكك الأجسام الكروية السرطانية على فترات زمنية مختلفة ومن خلال فرز الخلايا المنشطة مغناطيسيا ، تم عزل CAFs. تم تقييم إمكانات غشاء الميتوكوندريا ل CAFs باستخدام صبغة JC-1 ، وإنتاج ROS بواسطة تلطيخ ثنائي أسيتات ثنائي كلورو ثنائي هيدروفلوريسئين (DCFDA) 2',7'-dichlorodihydrofluorescein (DCFDA) ، ونشاط الإنزيم في CAFs المعزولة. يوفر تحليل صحة الميتوكوندريا ل CAFs المعزولة فهما أفضل لتأثير Warburg العكسي ويمكن أيضا تطبيقه لدراسة عواقب تغيرات الميتوكوندريا CAF ، مثل التدفقات الأيضية والآليات التنظيمية المقابلة على عدم تجانس سرطان الرئة. وبالتالي ، تدعو الدراسة الحالية إلى فهم تفاعلات الورم والسدى على صحة الميتوكوندريا. سيوفر منصة للتحقق من الأدوية المرشحة الخاصة بالميتوكوندريا للتأكد من فعاليتها ضد CAFs كعلاجات محتملة في البيئة المكروية للورم ، وبالتالي منع تورط CAF في تطور سرطان الرئة.
Introduction
تتكون الأورام الصلبة من مجموعات خلايا غير متجانسة تسترشد بالبيئة المكروية للورم (TME) ، ومع ذلك ، لم يتم اكتشاف أصل معظم الخلايا بعد. تعكس الخلايا اللحمية والمناعية بشكل أساسي (الخلايا الليفية ، الخلايا البطانية ، الخلايا الوحيدة ، الضامة ، الخلايا المتغصنة ، الخلايا البائية ، الخلايا التائية ، ومجموعاتها الفرعية) عدم تجانس الورم في سرطانات الرئة والثدي والكلى وغيرها من السرطانات الصلبة1،2،3. إن فهم أصل كل نوع فرعي وإمكانية التمايز العابر له حاجة ماسة لتطوير علاجات متقدمة ضد هذه السرطانات. يقدم تحليل هذه المجموعة المتنوعة من الخلايا في الخزعات البشرية نفسه أمام العديد من التحديات بسبب نوع الورم والموقع والمرحلة والحد من كمية العينة والمتغيرات الخاصة بالمريض4. وبالتالي ، هناك حاجة إلى نموذج تجريبي ، وهو ليس موثوقا به فحسب ، بل يمكنه أيضا محاكاة حالة الورم في الجسم الحي ، مما يثبت أنه مثالي لدراسة الحديث المتبادل بين الورم وسدى الورم ومشاركته في الفيزيولوجيا المرضية للمرض.
تعد ثقافات الورم الكروية ثلاثية الأبعاد (3D) متعددة الخلايا (MCTS) مفيدة في نظام نموذج المختبر للأورام بسبب تشابهها مع نظيراتها الطبيعية. يمكن ل MCTS تكرار جوانب الأورام الصلبة بشكل أفضل من نماذج زراعة الخلايا 2D ، بما في ذلك بنيتها المكانية ، والاستجابات الفسيولوجية ، وإطلاق الوسطاء القابل للذوبان ، وأنماط التعبير الجيني ، وآليات مقاومة الأدوية. علاوة على ذلك ، تتمثل إحدى المزايا الرئيسية ل MCTS في أنه يمكن استخدامه لدراسة عدم تجانس الورم والبيئة المكروية للورم (TME). طريقة التعليق والإفلات هي الأداة الأكثر استخداما لتطوير وتحليل MCTS5. في هذه الطريقة ، يتم تعليق الخلايا المختلفة ذات الوسائط في شكل قطرات ، مما يسمح بنموها بطريقة مجمعة 3D متماسكة ويسهل الوصول إليها للفحص. هذه التقنية واضحة. لا يتطلب العديد من الخلايا ويلغي الحاجة إلى ركيزة متخصصة مثل الأغاروز لتطوير كروي6. ميزة إضافية لهذه الطريقة تكمن في استنساخ تقنيتها. علاوة على ذلك ، تم استخدام هذه الطريقة أيضا للمشاركة في زراعة مجموعات الخلايا المختلطة ، مثل الخلايا البطانية والخلايا السرطانية ، لمحاكاة تكوين الأوعية الدموية المبكرةللورم 7.
في هذه الدراسة ، تم تحضير كرويات ورم الرئة 3D متعددة الخلايا مع خلايا الورم الغدي الرئوي ، والخلايا الليفية ، والوحيدات باستخدام طريقة القطرة المعلقة التي تحاكي البيئة المكروية لورم الرئة. ثم تم عزل السكان الليفية المرتبطة بالسرطان (CAF) للتحقيق في صحة الميتوكوندريا. الفكرة الرئيسية وراء تطوير هذه الكرويات هي عزل CAFs لأن الحديث المتبادل بين الخلايا في الأجسام الكروية يمكن أن يحول الخلايا الليفية إلى حالة CAF نشطة تشبه الخلايا الليفية العضلية. ثانيا ، قد تصور هذه الدراسة أيضا كيف أن إنتاج أنواع الأكسجين التفاعلية الشاذ واختلال الميتوكوندريا يدفع الخلايا الليفية الطبيعية نحو النمط الظاهري CAF الأكثر عدوانية. وقد وجد أن الخلايا الليفية المجمعة داخل كرويات الورم اكتسبت خصائص الخلايا الليفية العضلية مع زيادة نشاط أنواع الأكسجين التفاعلية وتحريض التعبير الجيني الأيضي. يسلط هذا البروتوكول الضوء على أهمية البيئة المكروية للورم في تنشيط CAF ويمكن أن يكون نموذجا ممتازا للتوليد في المختبر ودراسة خصائص النمط الظاهري CAF.
Protocol
1. ثقافة الخلية
- زراعة خط خلايا الورم الغدي الرئوي البشري A549 ، وخط الخلايا أحادية الخلية البشرية THP-1 في وسائط RPMI1640 المكملة بنسبة 10٪ FBS و 1٪ بنسلين-ستربتومايسين عند 37 درجة مئوية في غرفة مرطبة بنسبة 5٪ CO2.
- زراعة خلايا الخلايا الليفية الرئوية البشرية MRC-5 في وسط DMEM تستكمل بمحلول 10٪ FBS و 1٪ بنسلين-ستربتومايسين عند 37 درجة مئوية في غرفة مرطبة مع 5٪ CO2.
2. تحضير كرويات الورم متعدد الخلايا باستخدام خط خلايا الورم الغدي الرئوي A549 ، والخلايا الليفية MRC5 ، والخلايا الوحيدة THP-1
ملاحظة: تم تحضير الكرويات ثلاثية الأبعاد متعددة الخلايا السرطانية وغير السرطانية باستخدام طريقة القطرة المعلقة في طبق زراعة الخلايا 90 مم. ويرد أدناه وصف مفصل لتطور هذه الأجسام الكروية. يجب تسخين جميع كواشف زراعة الخلايا مثل الوسط الكامل و PBS ومحلول التربسين-EDTA بنسبة 0.25٪ عند 37 درجة مئوية قبل الاستخدام ما لم ينص على خلاف ذلك.
- إعداد تعليق الخلية
- تنمو الخلايا الملتصقة A549 و MRC5 (5 × 106 خلايا لكل منهما) في وسط نمو كامل DMEM (وسط النسر المعدل من Dulbecco [DMEM] + 10٪ مصل بقري جنيني [FBS] + 1٪ بنسلين-ستربتومايسين) في قوارير T25 عند 37 درجة مئوية في غرفة مرطبة بنسبة 5٪ CO2.
- بالنسبة لخلايا THP-1 ، قم بتنمية تعليق الخلية (5 × 106 خلايا) في وسط نمو كامل (RPMI1640 + 10٪ FBS + 1٪ بنسلين-ستربتومايسين) في قوارير T25. لتحقيق نمو أفضل ، ضع قوارير T25 عند 37 درجة مئوية في غرفة مرطبة مع 5٪ CO2 في وضع الوقوف.
- بعد 3 أيام ، عند التقاء 80٪ -85٪ ، اغسل خلايا A549 و MRC5 بمحلول ملحي خال من الكالسيوم والمغنيسيوم (محلول ملحي عازل للفوسفات) بإضافة 1 مل من PBS (25-30 درجة مئوية) في كل قارورة لمدة دقيقة واحدة واستنشاقها.
- احصد خلايا A549 و MRC5 من القارورة عن طريق احتضانها ب 500 ميكرولتر من محلول التربسين-EDTA بنسبة 0.25٪ لمدة 5 دقائق عند 37 درجة مئوية في حاضنة مرطبة بنسبة 5٪ CO2. بعد ذلك مباشرة ، أضف 4 مل من وسائط النمو الكاملة لتعطيل التربسين.
- اجمع معلق الخلية من دورق T25 في أنبوب سعة 15 مل وقم بتكبيله لأسفل عند 125 × جم لمدة 5 دقائق. قم بإزالة المادة الطافية وأعد تعليق الخلايا في 5 مل من وسط النمو الكامل.
- إنشاء كرويات الورم متعدد الخلايا
ملاحظة: يجب تنفيذ جميع خطوات تكوين الورم الكروي داخل خزانة السلامة الحيوية من أجل الحفاظ على ظروف معقمة. تم توحيد الحد الأقصى لحجم تعليق الخلية كقطرة قدرها 25 ميكرولتر لإعداد قطرة بحيث لا تسقط أثناء قلب الأغطية.- عد أرقام الخلايا A549 و MRC5 و THP-1 باستخدام عداد خلايا. لكل قطرة كروية (25 ميكرولتر) تحافظ على أرقام الخلايا التالية: 5000 خلية A549 و 4000 خلية MRC5 و 1000 خلية THP-1 ، باتباع البروتوكول الذي وصفه Arora et al.7. احسب أرقام الخلايا وفقا لذلك لحجم 1 مل.
ملاحظة: تم تحضير الأجسام الكروية في البداية بثلاثة أعداد خلايا مختلفة لكل كروية (أي 5000 و 8000 و 10000). أيضا ، تم فحص نسب الخلايا المختلفة للخلايا السرطانية / الخلايا الليفية / الخلايا الوحيدة (1: 1: 1 ، 2: 2: 1 ، 4: 2: 1 ، 5: 2: 1 ، و 5: 4: 1). أخيرا ، شوهد تكوين كروي متعدد الخلايا ثلاثي الأبعاد ناجح بنسبة 5: 4: 1 وتم استخدامه للدراسة. تم زيادة تركيز الخلايا الليفية بناء على نسبتها في البيئة المكروية للورم ، مما زاد من صلابة الكرويات الورمية. تم الإبلاغ عن الإجراء التفصيلي في منشور حديث من قبل Arora et al.7. - قم بإعداد تعليق الخلية بنسبة 5 (A549 ، 2 × 10 5 خلايا / مل) إلى 4 (MRC5 ، 1.6 × 10 5 خلايا / مل) إلى 1 (THP-1 ،5 × 104 خلايا / مل) وقم بتكوين الحجم إلى 1 مل باستخدام DMEM الكامل.
- ضع قطرة من 25 ميكرولتر من خليط معلق الخلية على غطاء طبق استزراع 90 مم (حوالي 50 قطرة / طبق 90 مم). املأ الجزء السفلي من طبق الثقافة 90 مم ب 10 مل من الماء المعقم.
- اقلب الغطاء بعناية فوق غرفة الترطيب المملوءة بالماء وضع الطبق في حاضنة زراعة الخلايا لمدة 3 أيام.
- راقب الأجسام الكروية تحت المجهر عند تكبير 10x في اليوم 4. للحصول على الصور ، قم بتشغيل مفتاح الطاقة ، ضع الطبق مقاس 60 مم بعناية على المسرح ، وحدد التكبير (10x). اضبط العدسات وافحص الخلايا لتحليل تجمع الخلايا وتكاثرها. اضغط على زري التجميد والحفظ المتوفرين على المجهر لالتقاط الصورة.
- قم بتغيير وسائط النمو في اليوم 4 عن طريق استنشاق 20 ميكرولتر من الوسط بعناية من كل قطرة واستبدالها بوسط نمو كامل جديد.
- عد أرقام الخلايا A549 و MRC5 و THP-1 باستخدام عداد خلايا. لكل قطرة كروية (25 ميكرولتر) تحافظ على أرقام الخلايا التالية: 5000 خلية A549 و 4000 خلية MRC5 و 1000 خلية THP-1 ، باتباع البروتوكول الذي وصفه Arora et al.7. احسب أرقام الخلايا وفقا لذلك لحجم 1 مل.
3. تحليل الأحياء والموتى من كرويات الورم
- في اليومين 7 و 10 ، اقلب الطبق 90 مم بعناية في خزانة السلامة الحيوية واستخدم ماصة 200 ميكرولتر لجمع الأجسام الكروية من كل قطرة. اجمع خمسة كرويات كل منها في أنبوب سعة 1.5 مل.
- أضف 500 ميكرولتر من 1x PBS إلى أنبوب 1.5 مل يحتوي على كرويات وأجهزة طرد مركزي عند 125 × جم لمدة 5 دقائق. تخلص من المادة الطافية بعناية وأعد تعليق الأجسام الكروية في 200 ميكرولتر من 1x PBS. لا ماصة بدقة لتجنب التفكك الكروي.
- ماصة خارج كرويات باستخدام ماصة 200 ميكرولتر على طبق 60 مم لتلطيخ الكالسيين-AM ويوديد البروبيديوم.
- ضع 5 ميكرولتر من محلول كالسيين AM 1 ميكرومتر و 5 ميكرولتر من محلول يوديد البروبيديوم 2 مجم / مل على الأجسام الكروية. احتضان لمدة 10 دقائق. بعد الانتهاء من فترة الحضانة ، اغسل الكرويات برفق باستخدام 1x PBS مرتين.
- ضع الطبق مقاس 60 مم الذي يحتوي على كرويات تحت المجهر المقلوب الفلوري ، وراقب والتقط الصور بتكبير 10x عن طريق تحديد خيار التألق في برنامج المجهر وتحديد FITC (قناة مضان خضراء ؛ إثارة 490 نانومتر ، انبعاث 515 نانومتر) للكالسيين وقناة تكساس الحمراء (TXR ؛ الإثارة 535 نانومتر ، الانبعاث 617 نانومتر).
- للحصول على الصورة ، قم بتشغيل Ctr Adv ، وهو المفتاح 1 ، متبوعا بتشغيل وحدة المعالجة المركزية. انتظر حتى يتم تمهيد نظام البرنامج. عند التمهيد ، ضع الطبق 60 مم بعناية على المسرح وحدد التكبير (10x) وقنوات الفلورسنت (FITC ، TXR). اضبط العدسات وامسح الصورة.
- لعرض الصورة في النظام ، حدد الخيار مباشر وعرض الصورة. اضبط شدة التألق من أجل التحسين المناسب. احفظ الصورة بالنقر فوق الزر حفظ .
ملاحظة: في هذه المرحلة ، ستكون الأجسام الكروية مرئية بالعين المجردة. تحت المجهر الضوئي ، ستظهر الأجسام الكروية على شكل كرات مستديرة صلبة عند تكبير 10x. يمكن جمع العديد من الأجسام الكروية في وقت واحد باستخدام ماصة 200 ميكرولتر.
4. تفكك وتعليق الخلايا من كرويات الورم
- اجمع 200 كرة كروية للورم في كل يوم 7 و 10 ، باستخدام ماصة سعة 1 مل في أنبوب سعة 15 مل.
ملاحظة: قبل التجميع ، تحقق بعناية من شكل وشكل كروي واحد بعد نقله إلى شريحة مجهرية أو على طبق 30 مم ولاحظ تحت المجهر. - بيليه الكروية عن طريق الطرد المركزي في 125 × غرام لمدة 5 دقائق. نضح الطافية بعناية دون إزعاج كرويات الورم.
- اغسل الكرات الكروية بعناية باستخدام 200 ميكرولتر من PBS ، وأجهزة الطرد المركزي عند 125 × جم لمدة 5 دقائق ، وتخلص بحذر من المادة الطافية.
- للتفكك الكروي ، أضف 400 ميكرولتر من محلول التربسين-EDTA بنسبة 0.25٪ واحتفظ به عند 37 درجة مئوية لمدة 10 دقائق. أداء ماصة قوية للتفكك الكامل للكرويات.
- تحييد التربسين عن طريق إضافة 1 مل من وسط نمو DMEM الكامل. جهاز طرد مركزي عند 125 × جم لمدة 5 دقائق وتخلص من المادة الطافية بعناية.
- أعد تعليق الحبيبات في 1 مل من وسط DMEM الكامل واحسب العدد الإجمالي للخلايا.
5. عزل الخلايا الليفية المرتبطة بالسرطان (CAF) من خلال الميكروبيدات
- لعزل CAFs من كرويات الورم ، أعد تعليق 1 × 10 7 خلايا في 80 ميكرولتر من المخزن المؤقت لفرز الخلايا المنشطة المغناطيسي البارد (MACS) (PBS عند الرقم الهيدروجيني7.2 الذي يحتوي على 0.5٪ ألبومين مصل البقر [BSA] و 2 mM حمض رباعي الخليك الإيثيلين ديامين [EDTA]).
- احتضان تعليق الخلية (يحتوي على 1 × 107 خلايا) مع 20 ميكرولتر من الميكروبيدات المضادة للخلايا الليفية. تخلط جيدا عن طريق النقر برفق على الأنبوب واحتضانه لمدة 30 دقيقة في درجة حرارة الغرفة.
- اغسل الخلايا ب 1 مل من المخزن المؤقت البارد MACS ، وأجهزة الطرد المركزي عند 125 × جم لمدة 5 دقائق ، واستنشاق المادة الطافية. أعد تعليق الخلايا في 500 ميكرولتر من المخزن المؤقت MACS.
- لفصل الخلايا القائمة على الخرزة المغناطيسية ، قم بإعداد عمود MACS عن طريق شطفه ب 3 مل من المخزن المؤقت MACS.
- ضع معلق الخلية في العمود متبوعا بمجموعة التدفق التي تحتوي على عدد الخلايا غير المصنف.
- اغسل العمود ثلاث مرات باستخدام 3 مل من المخزن المؤقت MACS. أخرج العمود من الفاصل وضعه على أنبوب التجميع.
- اجمع الخلايا الموسومة بالميكروبيدات المضادة للخلايا الليفية عن طريق إضافة 5 مل من المخزن المؤقت MACS ودفع المكبس بإحكام إلى العمود.
- أجهزة الطرد المركزي للخلايا المسماة عند 125 × جم لمدة 5 دقائق. المضي قدما مع الخلايا الليفية المعزولة لتطبيقات المصب.
6. التحليل القائم على قياس التدفق الخلوي لتعبير ACTA2 في CAFs المعزولة
- احسب عدد CAFs المعزولة واستخدم ما يقرب من 6 × 104 خلايا. اغسل الخلايا مرة واحدة باستخدام PBS ، وأجهزة الطرد المركزي بسرعة 125 × جم لمدة 5 دقائق ، واستنشاق المادة الطافية.
- أضف 100 ميكرولتر من المخزن المؤقت لنفاذية الخلية (PBS + 0.5٪ BSA + 0.3٪ v / v Triton X-100) واحتضان الخلايا عند 4 درجات مئوية لمدة 30 دقيقة.
- دوامة الخلايا بشكل متقطع للحفاظ على تعليق خلية واحدة. أجهزة الطرد المركزي وإعادة تعليق الخلايا في 100 ميكرولتر من المخزن المؤقت لنفاذية الخلية.
- أضف 2 ميكرولتر من الجسم المضاد ل APC المضاد ل α-SMA المترافق مع الإنسان واحتضانه عند 4 درجات مئوية لمدة 45 دقيقة. بعد الحضانة ، أضف 1 مل من المخزن المؤقت للنفاذية وأجهزة الطرد المركزي عند 125 × جم لمدة 5 دقائق لإزالة الأجسام المضادة الزائدة.
- أعد تعليق الحبيبات في 400 ميكرولتر من المخزن المؤقت للنفاذية لتحليل التدفق الخلوي. الحصول على إجمالي 10000 حدث لكل عينة في مقياس التدفق الخلوي. حدد الخلايا الموجبة ACTA2 بعد التمييز بين مجموعات الخلايا بناء على تشتتها الأمامي والجانبي ، واختيار السكان المفردة متبوعا بتحديد الخلايا الموجبة ACTA2 التي تظهر كقمة واحدة على الرسم البياني للمعلمة المفردة.
7. تلطيخ JC-1 لتحديد إمكانات غشاء الميتوكوندريا
- احسب عدد CAFs المعزولة واستخدم ما يقرب من 6 × 104 خلايا لتلطيخ 5،5،6،6'-رباعي كلورو-1،1'،3،3' رباعي إيثيل بنزيمي-دازويل كاربوسيانين يوديد (JC-1) باستخدام قياس التدفق الخلوي.
- اغسل الخلايا جيدا باستخدام PBS ، وأجهزة الطرد المركزي عند 125 × جم لمدة 5 دقائق ، واستنشاق المادة الطافية ، وإضافة 100 ميكرولتر من المخزن المؤقت لتلطيخ الخلية.
- أضف صبغة JC-1 بتركيز عمل 2 ميكرومتر واحتضانها في درجة حرارة الغرفة لمدة 30 دقيقة. عند إنهاء الحضانة ، اغسل الخلايا باستخدام PBS ، وأجهزة الطرد المركزي عند 125 × جم لمدة 5 دقائق ، وأعد تعليقها في حجم نهائي يبلغ 400 ميكرولتر.
- الحصول على ما مجموعه 20000 حدث لكل عينة في مقياس التدفق الخلوي. حدد إمكانات غشاء الميتوكوندريا عن طريق قياس مجاميع JC-1 ذات الإزاحة الحمراء على قناة FL-2 والمونومرات الخضراء على قناة FL-1.
8. تلطيخ DCFDA لتقدير مستويات أنواع الأكسجين التفاعلية الخلوية (ROS)
- استخدم الكرات الكروية الكاملة (50 رقما) بالإضافة إلى CAFs المعزولة (6 × 104 خلايا) من الكرات الكروية لتلطيخ ثنائي أسيتات ثنائي الأسيتات 2',7'-dichlorodihydrofluorescein (DCFDA).
- اغسل الخلايا جيدا باستخدام PBS ، وأجهزة الطرد المركزي عند 125 × جم لمدة 5 دقائق ، واستنشاق المادة الطافية ، وإضافة 100 ميكرولتر من المخزن المؤقت لتلطيخ الخلية.
- تضاف صبغة DCFDA بتركيز عمل 1 ميكرومتر وتحتضنها في درجة حرارة الغرفة لمدة 30 دقيقة. اغسل الخلايا مرتين باستخدام PBS ، وأجهزة الطرد المركزي عند 125 × جم لمدة 5 دقائق ، ثم أعد تعليقها في الحجم النهائي 400 ميكرولتر.
- الحصول على ما مجموعه 20000 حدث لكل عينة في مقياس التدفق الخلوي. قم بتقييم مستويات ROS عن طريق قياس التألق في اليوم 7 واليوم 10 للكرويات وكذلك CAFs المعزولة.
9. تحليل RT-qPCR لعلامات CAF والجينات المحللة للسكر
- استخرج الحمض النووي الريبي من CAFs التي تم فرزها باستخدام مجموعة تحلل أحادية الخلية باتباع بروتوكول الشركة المصنعة. قم بإعداد cDNA من 100 نانوغرام من الحمض النووي الريبي باستخدام مجموعة توليف cDNA باتباع إرشادات الشركة المصنعة.
- قم بإجراء RT-qPCR لتحليل علامات CAF النسبية (ACTA2 8 و COL1A29) وتعبير جين تحلل السكر (GLUT1 10 و MCT4 11). قم بإجراء تحليل منحنى الذوبان بعد التمديد النهائي لضمان خصوصية المنتجات. تطبيع البيانات باستخدام التعبير عن GAPDH كجين مرجعي. يتم سرد تسلسلات التمهيدي المستخدمة في RT-qPCR في الجدول التكميلي 1.
10. استخراج وقياس البروتين الخلوي من CAFs
ملاحظة: نفذ جميع خطوات استخراج البروتين على الثلج لتجنب تدهور البروتين.
- أعد تعليق ما يقرب من 4 × 106 خلايا CAF في 100 ميكرولتر من محلول تحلل RIPA المثلج البارد (يحتوي على 30 mM HEPES و 150 mM NaCl و 1٪ NP-40 و 0.1٪ SDS و 0.5٪ ديوكسي كولات الصوديوم مع 5 mM من كوكتيل مثبط البروتياز والفوسفاتيز Halt ، و 5 mM من EDTA عند درجة الحموضة 7.4).
- دوامة صارمة لتحلل الخلايا السليم. قم بتسخين تعليق الخلية بتردد 20 هرتز ، وسعة 20٪ لمدة 15 ثانية ، ونبضة 3x.
- بعد صوتنة ، الطرد المركزي استخراج البروتين في 13000 × غرام لمدة 15 دقيقة في 4 °C. انقل المادة الطافية إلى أنبوب 1.5 مل مبرد مسبقا. قم بإجراء فحص بروتين BCA لتحديد البروتين.
11. التحليل الطيفي للأنشطة الأنزيمية في CAFs
ملاحظة: يتم تحليل أنشطة الإنزيم التالية في CAFs المشتقة من الورم الكروي.
- قياس نشاط نازعة هيدروجين السكسينات
- لتقييم نشاط نازعة هيدروجين السكسينات (SDH) في CAFs ، قم بإعداد مخزن SHE المؤقت مع 250 mM من السكروز ، و 10 mM 4- (2-hydroxyethyl) -1-piperazineethanesulfonic acid (HEPES) ، و 1 mM من جلايكول إيثيلين مكرر (β-aminoethyl ether) -N ، N ، N ′ ، N′-حمض رباعي الخليك (EGTA) واضبط الرقم الهيدروجيني إلى 7.3. أضف 0.4 مللي مول فينازين ميثوسلفات (PMS) ، 0.2 مللي مول 2،6-ثنائي كلورويندوفينول (DCPIP) ، 50 مللي متر MgCl2 ، 0.02٪ Triton X-100 ، و 1 ملي مول سيانيد في مخزن SHE المؤقت واحتفظ به عند 37 درجة مئوية.
- استخرج البروتين الخلوي من CAFs كما هو موضح في الخطوة 10 (2 × 106 خلايا). في كل بئر من صفيحة 96 بئرا ، احتضن 100 ميكرولتر من 0.1 مجم من البروتين الخلوي مع 100 ميكرولتر من خليط تفاعل SHE عند 37 درجة مئوية لمدة 15 دقيقة.
- لبدء النشاط الأنزيمي ، أضف 10 mM succinate12. احسب نشاط الإنزيم بالنانومتر / دقيقة / مل عن طريق قياس التغيرات في الامتصاص عند 600 نانومتر.
- عامل التحويل ل DCIP هو 0.0215 A / nM بناء على معامل الانقراض المولي12. احسب النشاط النسبي ل SDH باستخدام الصيغة المذكورة:
النشاط النسبي (نانومتر / دقيقة / مل / إنزيم) =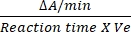 X X
X X  V
V
حيث ΔA / min = معدل التفاعل الأنزيمي (A الأولي- A النهائي) / (الوقتالنهائي- A / minالأولي) ، Ve = حجم العينة ، و V = حجم التفاعل.
- تقدير نشاط السيتوكروم ج أوكسيديز
- لتقييم نشاط السيتوكروم سي أوكسيديز (COX) في CAFs ، أضف 0.2 مجم / مل من البروتين الخلوي في محلول عازل تفاعل KME يحتوي على محلول KME (125 mM KCl ، 20 mM 3- (N-morpholino) حمض البروبان السلفونيك [MOPS] ، و 1 mM EGTA ، درجة الحموضة 7.4) ، 0.02٪ Triton X-100 ، و 5 mM أسكوربات الصوديوم.
- في أنبوب منفصل ، امزج 50 ميكرومتر من السيتوكروم ج قلب الحصان مع 5 مليمتر من أسكوربات الصوديوم واحتضنها عند 37 درجة مئوية لمدة 5 دقائقو 13. بعد الحضانة ، أضف 20 ميكرولتر من السيتوكروم المختزل c إلى 500 ميكرولتر من محلول عازلة تفاعل KME يحتوي على البروتين الخلوي.
- احسب نشاط الإنزيم بالوحدات / ميكرولتر عن طريق قياس التغيرات في الامتصاص عند 550 نانومتر. يتغير امتصاص السيتوكروم ج عند 550 نانومتر مع حالة الأكسدة. الفرق في معاملات الانقراض (mM) بين السيتوكروم المختزل والمؤكسد c هو 21.84 عند 550 نانومتر14. احسب مقدار نشاط الإنزيم في المحللة الخلوية على النحو التالي:
الوحدات / ميكرولتر =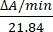
حيث ΔA / min = A / minعينة - A / minفارغة و 21.84 = ΔtmM بين السيتوكروم المؤكسد c والسيتوكروم المختزل c عند 550 نانومتر
- تقييم نشاط نازعة هيدروجين اللاكتات
- قم بإجراء فحص نازعة هيدروجين اللاكتات (LDH) باستخدام مجموعة مقايسة خلايا نازعة هيدروجين اللاكتات باتباع تعليمات الشركة المصنعة.
- أضف كاشف اختبار LDH (10 ميكرولتر) إلى 0.5 مجم / مل من البروتينات الخلوية واحتضانه لمدة 5 دقائق عند 37 درجة مئوية. عند إنهاء الحضانة ، قم بقياس الامتصاص عند 45 نانومتر كل 1 دقيقة لمدة 8 دقائق.
- إعداد معايير NADH للكشف اللوني باستخدام 0 (فارغ) و 2.5 و 5 و 7.5 و 10 و 12.5 نانومتر / بئر من NADH متبوعا بإضافة كاشف اختبار LDH إلى الحجم النهائي البالغ 50 ميكرولتر.
- ارسم الاختلافات في الامتصاص بين Tالأولي و Tالنهائي إلى منحنى NADH القياسي لتحديد مقدار توليد NADH. تقييم نشاط LDH باستخدام الصيغة المذكورة:
نشاط LDH =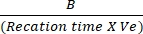 عامل تخفيف العينة X
عامل تخفيف العينة X
حيث B = كمية (nmole) من NADH المتولدة بين T الأولي و T النهائي ، وقت رد الفعل = Tالنهائي - Tالأولي (دقيقة) ، و Ve = حجم العينة (مل) المضافة إلى البئر.
النتائج
يوضح الشكل 1 تطور كرويات الورم متعددة الخلايا باستخدام ثلاث مجموعات مختلفة من الخلايا - A549 (سرطان الرئة الغدي) ، MRC-5 (الخلايا الليفية) ، و THP-1 (وحيدات) - من خلال طريقة القطرة المعلقة كما لوحظ في اليوم 7 واليوم 10 تحت المجهر. في اليوم السابع ، كانت الكرويات مضغوطة وصلبة بقطر 260 ± 5.3 ?...
Discussion
تقدم الدراسة الحالية تطور كرويات الورم متعددة الخلايا التي تضم الخلايا السرطانية ، وعدد الخلايا اللحمية (أي الخلايا الليفية) ، وعدد الخلايا المناعية (أي الخلايا الوحيدة) باستخدام طريقة إسقاط معلقة معدلة. تعد الخلايا الليفية والوحيدات / البلاعم من بين أهم المجموعات السكانية التي تشكل البي...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
تم دعم هذا العمل من قبل مشروع جائزة التميز للمرأة الصربية ، الهند (SB / WEA-02/2017) ومشروع جائزة SERB-Early Career Research ، الهند (ECR / 2017 / 000892) إلى DP. يعترف المؤلفون ، LA و SR ب IIT Ropar و MHRD لزمالاتهم البحثية. تعترف MK ب ICMR لزمالتها البحثية.
Materials
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| APC anti-human α-SMA | R&D systems | Cat# IC1420A | |
| Anti-fibroblast microbeads | Miltenyi Biotec | Cat# 130-050-601 | |
| Cell lines | |||
| A549 lung adenocarcinoma cells | NCCS Pune | - | |
| MRC-5 fetal lung fibroblasts | ATCC | CCL-171 | |
| THP-1 Human monocytes | NCCS Pune | - | |
| Chemicals | |||
| BSA | Himedia | Cat# 9048-46-8 | |
| 2,6-dichloroindophenol (DCPIP) | SRL | Cat# 55287 | |
| Calcein-AM | Thermo Fisher Scientific | Cat# C3099 | |
| DAPI | Thermo Fisher Scientific | Cat# D1306 | |
| DCFDA | Sigma | Cat# D6883 | |
| DMEM | Gibco | Cat# 11995073 | |
| DPBS | Gibco | Cat# 14190-144 | |
| EDTA | Thermo fisher scientific | Cat# 17892 | |
| EGTA | SRL | Cat# 62858 | |
| EZcoun Lactate Dehydrogenase Cell Assay Kit | HiMedia | Cat# CCK036 | |
| FBS | Gibco | Cat# 10082147 | |
| Halt Protease and Phosphatase Inhibitor Cocktail (100X) | Thermo Fisher Scientific | Cat# 87786 | |
| HEPES | Thermo Fisher Scientific | Cat# 15630080 | |
| Horse heart Cytochrome c | SRL | Cat# 81551 | |
| Image-iT Red hypoxia reagent | Thermo Fisher Scientific | Cat# H10498 | |
| JC-1 Dye | Thermo Fisher Scientific | Cat# T3168 | |
| KCl | Merck | Cat# P9541 | |
| MgCl2 | Merck | Cat# M8266 | |
| MOPS | Thermo Fisher Scientific | Cat# 69824 | |
| Nacl | Sigma-Aldrich | Cat# S9888 | |
| NADH MB Grade | SRL | Cat# 54941 | |
| NP-40 | Thermo Fisher Scientific | Cat# 85124 | |
| Penicillin/Streptomycin | Gibco | Cat# 15140122 | |
| Phenazine methosulfate (PMS) | SRL | Cat# 55782 | |
| Propidium iodide | Thermo fisher scientific | Cat# P1304MP | |
| RPMI 1640 | Gibco | Cat# 11875093 | |
| Single Cell Lysis Kit | Thermo Fisher Scientific | Cat# 4458235 | |
| Sodium ascorbate | Merck | Cat# A7631 | |
| Sodium cyanide | Sigma | Cat# 205222 | |
| Sodium Deoxycholate | Thermo Fisher Scientific | Cat# 89904 | |
| Sodium dodecyl sulphate | Sigma-Aldrich | Cat# L3771 | |
| Sodium succinate hexahydrate | SRL | Cat# 36313 | |
| Sucrose | Sigma | Cat# S0389 | |
| SuperScript VILO cDNA synthesis kit | Thermo Fisher Scientific | Cat# 11754-050 | |
| Triton X-100 | Sigma | Cat# T8787 | |
| Trypsin 0.25% EDTA | Gibco | Cat# 25200072 | |
| Universal SYBR Green Supermix | BIO-RAD | Cat# 172-5124 | |
| Plasticware | |||
| MACS LS Columns | Miltenyi Biotec | Cat# 130-042-401 | |
| Equipment | |||
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | Cat# AMQAF1000 | |
| EVOS XL core imaging system | Thermo Fisher Scientific | Serial Number F0518-1727-0191 | |
| LAS X software | Leica Microsystems | ||
| Leica fluorescent inverted microscope | s | DMi8 automated S/N 424150) | |
| Midi MACS separator | Miltenyi Biotec | Cat# 130-042-302 |
References
- Kim, N., et al. Single-cell RNA sequencing demonstrates the molecular and cellular reprogramming of metastatic lung adenocarcinoma. Nature Communications. 11 (1), 1-5 (2020).
- Davidson, S., et al. Single-cell RNA sequencing reveals a dynamic stromal niche that supports tumor growth. Cell Reports. 31 (7), 107628 (2020).
- Zhang, Y., et al. Single-cell analyses of renal cell cancers reveal insights into tumor microenvironment, cell of origin, and therapy response. Proceedings of the National Academy of Sciences. 118 (24), (2021).
- Bray, L. J., Hutmacher, D. W., Bock, N. Addressing patient specificity in the engineering of tumor models. Frontiers in Bioengineering and Biotechnology. 7, 217 (2019).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Tissue Engineering. , 141-151 (2007).
- Dituri, F., et al. Complex tumor spheroid formation and one-step cancer-associated fibroblasts purification from hepatocellular carcinoma tissue promoted by inorganic surface topography. Nanomaterials. 11 (12), 3233 (2021).
- Arora, L., et al. Development of a multicellular 3D tumor model to study cellular heterogeneity and plasticity in NSCLC tumor microenvironment. Frontiers in Oncology. 12, 881207 (2022).
- Nurmik, M., Ullmann, P., Rodriguez, F., Haan, S., Letellier, E. In search of definitions: Cancer-associated fibroblasts and their markers. International Journal of Cancer. 146 (4), 895-905 (2020).
- Zhang, Y., et al. HIF-1α is necessary for activation and tumour-promotion effect of cancer-associated fibroblasts in lung cancer. Journal of Cellular and Molecular Medicine. 25 (12), 5457-5469 (2021).
- Bu, L., et al. Biological heterogeneity and versatility of cancer-associated fibroblasts in the tumor microenvironment. Oncogene. 38 (25), 4887-4901 (2019).
- Whitaker-Menezes, D., et al. Evidence for a stromal-epithelial "lactate shuttle" in human tumors: MCT4 is a marker of oxidative stress in cancer-associated fibroblasts. Cell cycle. 10 (11), 1772-1783 (2011).
- Mandujano-Tinoco, E. A., Gallardo-Pérez, J. C., Marín-Hernández, A., Moreno-Sánchez, R., Rodríguez-Enríquez, S. Anti-mitochondrial therapy in human breast cancer multi-cellular spheroids. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research. 1833 (3), 541-551 (2013).
- Bregman, A. A. . Laboratory Investigations in Cell and Molecular Biology. , (2002).
- Berry, E. A., Trumpower, B. L. Simultaneous determination of hemes a, b, and c from pyridine hemochrome spectra. Analytical Biochemistry. 161 (1), 1-15 (1987).
- Avagliano, A., et al. Metabolic reprogramming of cancer associated fibroblasts: the slavery of stromal fibroblasts. BioMed Research International. , (2018).
- Lorusso, G., Rüegg, C. The tumor microenvironment and its contribution to tumor evolution toward metastasis. Histochemistry and Cell Biology. 130 (6), 1091-1103 (2008).
- Liu, T., Zhou, L., Li, D., Andl, T., Zhang, Y. Cancer-associated fibroblasts build and secure the tumor microenvironment. Frontiers in Cell and Developmental Biology. 7, 60 (2019).
- Sebastian, A., et al. Single-cell transcriptomic analysis of tumor-derived fibroblasts and normal tissue-resident fibroblasts reveals fibroblast heterogeneity in breast cancer. Cancers. 12 (5), 1307 (2020).
- Elyada, E., et al. Cross-species single-cell analysis of pancreatic ductal adenocarcinoma reveals antigen-presenting cancer-associated fibroblasts. Cancer Discovery. 9 (8), 1102-1123 (2019).
- Ganguly, D., et al. Cancer-associated fibroblasts: Versatile players in the tumor microenvironment. Cancers. 12 (9), 2652 (2020).
- Harryvan, T. J., Verdegaal, E. M., Hardwick, J. C., Hawinkels, L. J., vander Burg, S. H. Targeting of the cancer-associated fibroblast-T-cell axis in solid malignancies. Journal of Clinical Medicine. 8 (11), 1989 (2019).
- Santi, A., Kugeratski, F. G., Zanivan, S. Cancer associated fibroblasts: the architects of stroma remodeling. Proteomics. 18 (5-6), 1700167 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved