このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
3D多細胞肺腫瘍スフェロイドから分離された癌関連線維芽細胞におけるミトコンドリアの健康評価
要約
多細胞3D腫瘍スフェロイドを肺腺癌細胞、線維芽細胞、および単球を用いて調製し、続いてこれらのスフェロイドから癌関連線維芽細胞(CAF)を単離した。単離されたCAFを正常な線維芽細胞と比較し、ミトコンドリアの膜貫通電位、活性酸素種、および酵素活性を研究することにより、ミトコンドリアの健康状態を評価しました。
要約
がん関連線維芽細胞(CAF)は、腫瘍微小環境に存在する最も豊富な間質細胞の1つであり、腫瘍の成長と進行を促進します。腫瘍セクレトーム、軽度の炎症、低酸素症、酸化還元の不均衡など、腫瘍微小環境内の複雑さは、ヘテロタイプ相互作用を促進し、不活性な常在線維芽細胞を活性CAFに変換することを可能にします。CAFは、解糖活性が高く、活性酸素種(ROS)のレベルが高く、乳酸エクスポーターMCT-4を過剰発現し、ミトコンドリア透過性遷移孔(MPTP)が開くため、代謝的に正常な線維芽細胞(NF)と区別されます。ここでは、ヒト肺腺癌細胞(A549)、ヒト単球(THP-1)、およびヒト肺線維芽細胞(MRC5)からなる多細胞3D腫瘍スフェロイドから単離された活性化CAFのミトコンドリアの健康状態を分析する方法が記載されている。腫瘍スフェロイドは異なる時間間隔で崩壊し、磁気活性化細胞選別によってCAFを単離した。CAFのミトコンドリア膜電位は、JC-1色素、2',7'-ジクロロジヒドロフルオレセインジアセテート(DCFDA)染色によるROS産生、および単離されたCAFにおける酵素活性を用いて評価されました。単離されたCAFのミトコンドリアの健康状態を分析することで、逆ウォーバーグ効果をよりよく理解でき、代謝フラックスや肺がんの不均一性に対する対応する調節メカニズムなど、CAFミトコンドリアの変化の結果を研究するためにも適用できます。したがって、本研究は、ミトコンドリアの健康に対する腫瘍間質相互作用の理解を提唱しています。これは、腫瘍微小環境における潜在的な治療薬としてのCAFに対するミトコンドリア特異的薬剤候補の有効性をチェックするためのプラットフォームを提供し、それによって肺がんの進行へのCAFの関与を防ぎます。
概要
固形腫瘍は、腫瘍微小環境(TME)によって導かれる不均一な細胞集団で構成されていますが、ほとんどの細胞の起源はまだ発見されていません。主に間質細胞および免疫細胞(線維芽細胞、内皮細胞、単球、マクロファージ、樹状細胞、B細胞、T細胞、およびそれらのサブセット)は、肺癌、乳癌、腎臓癌、およびその他の固形癌における腫瘍の不均一性を反映しています1、2、3。各サブタイプの起源とその分化転換の可能性を理解することは、これらの癌に対する高度な治療法を開発するために最も必要です。ヒト生検におけるこの多様な細胞集団の分析は、腫瘍の種類、部位、病期、サンプル量の制限、および患者固有のばらつきのために、いくつかの課題を提示します4。したがって、信頼性の高いだけでなく、in vivo腫瘍の状態をシミュレートできる実験モデルが必要であり、腫瘍間質クロストークとその疾患病態生理学への関与を研究するのに理想的であることが証明されています。
三次元(3D)多細胞腫瘍スフェロイド(MCTS)培養は、天然の対応物に類似しているため、腫瘍の有利な in vitro モデルシステムです。MCTSは、空間構造、生理学的応答、可溶性メディエーターの放出、遺伝子発現パターン、薬剤耐性メカニズムなど、固形腫瘍の側面を2D細胞培養モデルよりも適切に再現できます。さらに、MCTSの主な利点の1つは、腫瘍の不均一性および腫瘍微小環境(TME)の研究に使用できることです。ハンギングドロップ法は、MCTS5 の開発と分析に最も一般的に使用されるツールです。この方法では、培地を含むさまざまな細胞が液滴の形で懸濁されているため、一貫した3D凝集体での成長が可能になり、検査のために簡単にアクセスできます。テクニックは簡単です。多くの細胞を必要とせず、スフェロイド発生のためのアガロースのような特殊な基質の必要性を排除します6。この方法のさらなる利点は、その技術の再現性にある。さらに、この方法は、内皮細胞と腫瘍細胞などの混合細胞集団を共培養して、初期の腫瘍血管新生をシミュレートするためにも使用されています7。
本研究では、肺腫瘍微小環境を模倣したハンギングドロップ法を用いて、肺腺癌細胞、線維芽細胞、単球を用いて多細胞3D肺腫瘍スフェロイドを作製した。次に、ミトコンドリアの健康を調べるために、癌関連線維芽細胞(CAF)集団を分離しました。これらのスフェロイドの開発の背後にある主なアイデアは、スフェロイド内の細胞間のクロストークが線維芽細胞を筋線維芽細胞様活性化CAF状態に変換する可能性があるため、CAFを分離することです。第二に、この研究はまた、異常なROS産生とミトコンドリア機能障害が正常な線維芽細胞をより攻撃的なCAF表現型に駆り立てる方法を示している可能性があります。腫瘍スフェロイド内に集合した線維芽細胞は、ROS活性の増加と代謝遺伝子発現の誘導により筋線維芽細胞の特徴を獲得することがわかりました。このプロトコルは、CAFの活性化における腫瘍微小環境の重要性を強調しており、 in vitro での生成とCAF表現型の特徴の研究のための優れたモデルになる可能性があります。
プロトコル
1. 細胞培養
- ヒト肺腺癌細胞株A549、およびヒト単球細胞株THP-1を、10%FBSおよび1%ペニシリン・ストレプトマイシンを添加したRPMI1640培地中で、5%CO2を含む加湿チャンバー内で37°Cで培養した。
- MRC-5ヒト肺線維芽細胞を、10%FBSおよび1%ペニシリン-ストレプトマイシン溶液を添加したDMEM培地中で、5%CO2を含む加湿チャンバー内で37°Cで培養する。
2. A549肺腺癌細胞株、MRC5線維芽細胞、THP-1単球を用いた多細胞腫瘍スフェロイドの作製
注:多細胞造腫瘍性および非腫瘍原性の3Dスフェロイドは、90 mm細胞培養皿でハンギングドロップ法を使用して調製されました。これらのスフェロイドの発生の詳細な説明を以下に示します。完全培地、PBS、0.25%トリプシン-EDTA溶液などのすべての細胞培養試薬は、特に明記されていない限り、使用前に37°Cで事前に温めておく必要があります。
- 細胞懸濁液の調製
- A549およびMRC5接着細胞(それぞれ5 x 106 細胞)をDMEM完全増殖培地(ダルベッコ改変イーグル培地[DMEM] + 10%ウシ胎児血清[FBS] + 1%ペニシリン-ストレプトマイシン)で、5%CO2を含む加湿チャンバー内で37°CのT25フラスコで増殖させます。
- THP-1細胞の場合、T25フラスコ内の完全増殖培地(RPMI1640 + 10%FBS + 1%ペニシリン-ストレプトマイシン)中で細胞懸濁液(5 x 106 細胞)を増殖させる。より良い成長のために、T25フラスコを37°Cで5%CO2 を入れた加湿チャンバーに入れ、静置位置に置きます。
- 3日後、80%〜85%のコンフルエントで、A549およびMRC5細胞をカルシウムおよびマグネシウムを含まないPBS(リン酸緩衝生理食塩水)で洗浄し、各フラスコに1 mLのPBS(25〜30°C)を1分間加えて吸引します。
- フラスコからA549およびMRC5細胞を回収し、500 μLの0.25%トリプシン-EDTA溶液とともに、5%CO2 を含む加湿インキュベーター内で37°Cで5分間インキュベートします。直後に、4 mLの完全増殖培地を加えてトリプシンを不活性化します。
- 細胞懸濁液をT25フラスコから15 mLチューブに集め、125 x g で5分間ペレット化します。上清を除去し、細胞を5 mLの完全増殖培地に再懸濁します。
- 多細胞腫瘍スフェロイドの樹立
注:腫瘍スフェロイド形成のすべてのステップは、無菌状態を維持するためにバイオセーフティキャビネット内で実行する必要があります。細胞懸濁液の最大容量は、蓋を反転させながら落下しないように液滴を調製するために25μLの滴として標準化されています。- セルカウンターを使用してA549、MRC5、およびTHP-1細胞数をカウントします。各スフェロイド液滴(25μL)について、Aroraら7によって記載されたプロトコルに従って、5,000個のA549細胞、4,000個のMRC5細胞、および1,000個のTHP-1細胞を維持する。それに応じて、1 mLの容量の細胞数を計算します。
注:スフェロイドは当初、スフェロイドごとに3つの異なる細胞数(すなわち、5000、8000、および10,000)で調製されました。また、腫瘍細胞/線維芽細胞/単球の細胞比の違い(1:1:1、2:2:1、4:2:1、5:2:1、5:4:1)も確認した。最後に、5:4:1の比率で成功した3D多細胞スフェロイド形成が見られ、研究に使用されました。線維芽細胞濃度は、腫瘍微小環境におけるその割合に基づいて増加し、腫瘍スフェロイドの剛性をさらに高めた。詳細な手順は、Aroraらによる最近の出版物で報告されています7。 - 5(A549、2 x 10 5細胞/mL)から4(MRC5、1.6 x 10 5細胞/mL)から1(THP-1、5 x 104細胞/mL)の比率で細胞懸濁液を調製し、完全なDMEMで容量を1 mLに構成します。
- 細胞懸濁液25 μLの混合物を90 mm培養皿(約50滴/90 mmディッシュ)のカバーに置きます。90 mmの培養皿の底に10 mLの滅菌水を入れます。
- 水で満たされたハイドレーションチャンバーの蓋を慎重にひっくり返し、皿を細胞培養インキュベーターに3日間置きます。
- 4日目に顕微鏡下でスフェロイドを10倍の倍率で監視します。画像を取得するには、電源スイッチを入れ、60mmの皿を慎重にステージに置き、倍率(10倍)を選択します。レンズを調整し、細胞を調べて細胞の凝集と増殖を分析します。顕微鏡にある フリーズ ボタンと 保存 ボタンを押して、画像をキャプチャします。
- 4日目に、各液滴から20 μLの培地を注意深く吸引し、新鮮な完全な増殖培地と交換して、増殖培地を交換します。
- セルカウンターを使用してA549、MRC5、およびTHP-1細胞数をカウントします。各スフェロイド液滴(25μL)について、Aroraら7によって記載されたプロトコルに従って、5,000個のA549細胞、4,000個のMRC5細胞、および1,000個のTHP-1細胞を維持する。それに応じて、1 mLの容量の細胞数を計算します。
3. 腫瘍スフェロイドの生死解析
- 7日目と10日目に、バイオセーフティキャビネット内の90 mmディッシュを慎重に反転させ、200 μLピペットを使用して各液滴からスフェロイドを収集します。1.5 mLチューブにそれぞれ5つのスフェロイドを収集します。
- スフェロイドを含む1.5 mLチューブに500 μLの1x PBSを加え、125 x g で5分間遠心分離します。上清を注意深く廃棄し、スフェロイドを200 μLの1x PBSに再懸濁します。スフェロイド崩壊を避けるために厳密にピペットしないでください。
- カルセインAMおよびヨウ化プロピジウム染色用の60 mmディッシュ上で200 μLのピペットを使用してスフェロイドをピペットで取り出します。
- 5 μLの1 μLカルセインAM溶液と5 μLの2 mg/mLヨウ化プロピジウム溶液をスフェロイドに入れます。10分間インキュベートします。インキュベーション期間の終了後、スフェロイドを1x PBSで2回穏やかに洗浄します。
- スフェロイドを含む60 mmディッシュを蛍光倒立顕微鏡下に置き、顕微鏡ソフトウェアで蛍光オプションを選択し、カルセインの場合はFITC(緑色蛍光チャンネル、励起490 nm、発光515 nm)を選択し、テキサスレッドチャンネル(TXR、励起535 nm、発光617 nm)を選択して、10倍の倍率で画像を観察およびキャプチャします。
- 画像を取得するには、スイッチ1である Ctr Advをオンにしてから、CPUをオンにします。ソフトウェアシステムが起動するのを待ちます。起動したら、60 mmディッシュをステージに注意深く置き、倍率(10倍)と蛍光チャンネル(FITC、TXR)を選択します。レンズを調整し、画像をスキャンします。
- システムで画像を表示するには、[ ライブ ]オプションを選択して画像を表示します。適切な最適化のために蛍光の強度を調整します。[ 保存 ]ボタンをクリックして画像を保存します。
注:この段階では、回転楕円体は肉眼で見ることができます。光学顕微鏡では、スフェロイドは10倍の倍率で丸い硬い球体として表示されます。200 μLピペットを使用して複数のスフェロイドを一度に収集できます。
4. 腫瘍スフェロイドの崩壊と細胞懸濁
- 7日目と10日目に、15 mLチューブに入った1 mLピペットを使用して、それぞれ200個の腫瘍スフェロイドを収集します。
注:収集する前に、顕微鏡スライドまたは30 mm皿に移した後、単一の回転楕円体の形状と形状を注意深く確認し、顕微鏡で観察してください。 - 125 x g で5分間遠心分離することにより、スフェロイドをペレット化します。腫瘍スフェロイドを乱すことなく上清を注意深く吸引する。
- スフェロイドを200 μLのPBSで慎重に洗浄し、125 x g で5分間遠心分離し、上清を慎重に廃棄します。
- スフェロイド崩壊のために、400 μLの0.25%トリプシン-EDTA溶液を加え、37°Cで10分間保ちます。スフェロイドを完全に崩壊させるために、激しいピペッティングを行います。
- 1 mLの完全DMEM増殖培地を加えてトリプシンを中和します。125 x g で5分間遠心分離し、上清を注意深く廃棄します。
- ペレットを1 mLの完全なDMEM培地に再懸濁し、細胞の総数を数えます。
5.マイクロビーズによるがん関連線維芽細胞(CAF)の分離
- 腫瘍スフェロイドからCAFを単離するには、1 x 10 7細胞を80 μLの冷磁気活性化細胞ソーティング(MACS)バッファー(0.5%ウシ血清アルブミン[BSA]および2 mMエチレンジアミン四酢酸[EDTA]を含むpH7.2 のPBS)に再懸濁します。
- 細胞懸濁液(1 x 107 細胞を含む)を20 μLの抗線維芽細胞マイクロビーズでインキュベートします。チューブを軽くたたいてよく混ぜ、室温で30分間インキュベートします。
- 細胞を1 mLの冷たいMACSバッファーで洗浄し、125 x g で5分間遠心分離し、上清を吸引します。細胞を500 μLのMACSバッファーに再懸濁します。
- 磁気ビーズベースの細胞分離の場合は、3 mLのMACSバッファーでMACSカラムをリンスして調製します。
- 細胞懸濁液をカラムに入れ、続いて非標識細胞集団を含むフロースルーのコレクションを入れます。
- カラムを3 mLのMACSバッファーで3回洗浄します。カラムをセパレーターから取り外し、収集チューブの上に置きます。
- 5 mLのMACSバッファーを加え、プランジャーをカラムにしっかりと押し込んで、抗線維芽細胞マイクロビーズ標識細胞を回収します。
- 標識した細胞を125 x g で5分間遠心分離します。ダウンストリームアプリケーション用に単離された線維芽細胞を進めます。
6. フローサイトメトリーによる単離CAFにおける ACTA2 発現解析
- 分離されたCAFの数を数え、約6 x 104 セルを使用します。細胞をPBSで1回洗浄し、125 x g で5分間遠心分離し、上清を吸引します。
- 100 μLの細胞透過処理バッファー(PBS + 0.5% BSA + 0.3% v/v Triton X-100)を加え、細胞を4°Cで30分間インキュベートします。
- 細胞を断続的にボルテックスして、単一の細胞懸濁液を維持する。細胞を遠心分離し、100 μLの細胞透過処理バッファーに再懸濁します。
- 2 μLのAPC結合抗ヒトα-SMA抗体を添加し、4°Cで45分間インキュベートします。インキュベーション後、1 mLの透過処理バッファーを加え、125 x g で5分間遠心分離して、過剰な抗体を除去します。
- フローサイトメトリー分析のために、ペレットを400 μLの透過処理バッファーに再懸濁します。フローサイトメーターで各サンプルの合計10,000イベントを取得します。前方散乱と側方散乱に基づいて細胞の集団を区別した後、ACTA2陽性細胞を選択し、一重項集団を選択してから、単一パラメータヒストグラム上に単一のピークとして現れるACTA2陽性細胞を選択します。
7. JC-1染色によるミトコンドリア膜電位測定
- 単離されたCAFの数を数え、フローサイトメトリーを使用した5,5,6,6'-テトラクロロ-1,1',3,3'テトラエチルベンズイミド-ダゾイルカルボシアニンヨーダイド(JC-1)染色に約6 x 104 細胞を使用します。
- 細胞をPBSで十分に洗浄し、125 x g で5分間遠心分離し、上清を吸引し、100 μLの細胞染色バッファーを加えます。
- JC-1色素を2 μMの使用濃度で添加し、室温で30分間インキュベートします。インキュベーションが終了したら、細胞をPBSで洗浄し、125 x g で5分間遠心分離し、最終容量400 μLで再懸濁します。
- フローサイトメーターで各サンプルの合計20,000イベントを取得します。FL-2チャネル上の赤方偏移JC-1凝集体とFL-1チャネル上の緑シフトモノマーを測定することにより、ミトコンドリア膜電位を定量化します。
8. 細胞活性酸素種(ROS)レベルを推定するためのDCFDA染色
- スフェロイド全体(50個の数字)とスフェロイドから分離されたCAF(6 x 104 セル)を2',7'-ジクロロジヒドロフルオレセインジアセテート(DCFDA)染色に使用します。
- 細胞をPBSで十分に洗浄し、125 x g で5分間遠心分離し、上清を吸引し、100 μLの細胞染色バッファーを加えます。
- DCFDA色素を1 μMの作業濃度で添加し、室温で30分間インキュベートします。細胞をPBSで2回洗浄し、125 x g で5分間遠心分離した後、最終容量400 μLで再懸濁します。
- フローサイトメーターで各サンプルの合計20,000イベントを取得します。スフェロイドと単離されたCAFの7日目と10日目の蛍光を測定することにより、ROSレベルを評価します。
9. CAFマーカーおよび解糖系遺伝子のRT-qPCR解析
- メーカーのプロトコルに従って、シングルセル溶解キットを使用して、選別されたCAFからRNAを抽出します。メーカーのガイドラインに従って、cDNA合成キットを使用して100 ngのRNAからcDNAを調製します。
- RT-qPCRを実行して、相対的なCAFマーカー(ACTA2 8およびCOL1A29)および解糖系遺伝子(GLUT110およびMCT411)発現を分析します。最終延長後にメルトカーブ分析を実行して、製品の特異性を確認します。GAPDHの発現を基準遺伝子としてデータを正規化する。RT-qPCRに用いたプライマー配列を付表1に示します。
10. CAFからの細胞タンパク質の抽出と定量
注意: タンパク質分解を避けるために、氷上でタンパク質抽出のすべてのステップを実行してください。
- 約4 x 106 CAF細胞を100 μLの氷冷RIPA溶解バッファー(30 mM HEPES、150 mM NaCl、1% NP-40、0.1% SDS、および0.5%デオキシコール酸ナトリウム、5 mMのハルトプロテアーゼおよびホスファターゼ阻害剤カクテル、およびpH 7.4で5 mMのEDTAを含む)に再懸濁します。
- 適切な細胞溶解のために厳密にボルテックスします。20Hzの周波数、15秒間の20%振幅、および3倍のパルスで細胞懸濁液を超音波処理します。
- 超音波処理後、タンパク質抽出物を13,000 x g で4°Cで15分間遠心分離します。 上清を予め冷却した1.5 mLチューブに移します。BCAタンパク質アッセイを実行して、タンパク質を定量します。
11. CAFにおける酵素活性の吸光光度分析
注:以下の酵素活性は、腫瘍スフェロイド由来CAFで分析されます。
- コハク酸デヒドロゲナーゼ活性の測定
- CAFにおけるコハク酸デヒドロゲナーゼ(SDH)の活性を評価するには、250 mMスクロース、10 mM 4-(2-ヒドロキシエチル)-1-ピペラジンエタンスルホン酸(HEPES)、および1 mMエチレングリコール-ビス(β-アミノエチルエーテル)-N,N,N′,N′-四酢酸(EGTA)を含むSHEバッファーを調製し、pHを7.3に調整します。SHEバッファーに0.4 mMフェナジンメトサルフェート(PMS)、0.2 mM 2,6-ジクロロインドフェノール(DCPIP)、50 mM MgCl2、0.02%トリトンX-100、および1 mMシアン化物を加え、37°Cに保ちます。
- ステップ10(2 x 106 細胞)に記載されるようにCAFから細胞タンパク質を抽出する。96ウェルプレートの各ウェルで、100 μLの0.1 mg細胞タンパク質を100 μLのSHE反応混合物とともに37°Cで15分間インキュベートします。
- 酵素活性を開始するには、10 mMのコハク酸12を追加します。600 nmでの吸光度の変化を測定することにより、酵素活性をnM/min/mLで計算します。
- DCIPの変換係数は、モル吸光係数12に基づいて0.0215 A / nMです。上記の式を使用してSDHの相対活性を計算します。
相対活性 (nM/分/mL/酵素) =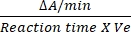 X
X  X V
X V
ここで、ΔA/min = 酵素反応の速度(A 初期 -最終A)/(最終時間 - A/分初期)、Ve = サンプルの量、V = 反応の量。
- シトクロムcオキシダーゼ活性の推定
- CAFのシトクロムcオキシダーゼ(COX)活性を評価するには、KMEバッファー(125 mM KCl、20 mM 3-(N-モルホリノ)プロパンスルホン酸[MOPS]、および1 mM EGTA、pH 7.4)、0.02 %トリトンX-100、および5 mMアスコルビン酸ナトリウムを含むKME反応バッファー溶液に0.2 mg/mLの細胞タンパク質を追加します。
- 別のチューブで、50 μMのウマ心臓シトクロムcと5 mMのアスコルビン酸ナトリウムを混合し、37°Cで5分間インキュベートします13。インキュベーション後、細胞タンパク質を含む500 μLのKME反応緩衝液に20 μLの還元シトクロムcを加えます。
- 550 nmでの吸光度の変化を測定することにより、酵素活性を単位/μLで計算します。550 nmでのシトクロムcの吸収は、その酸化状態とともに変化します。還元型シトクロムcと酸化型シトクロムcの吸光係数(mM)の差は、550 nm14で21.84である。細胞ライセート中の酵素活性量を次のように計算します。
単位/μL =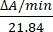
ここで、550 nmにおける酸化シトクロムcと還元型シトクロムcの間のΔA/min = A/minサンプルA/分ブランクおよび21.84 = ΔґmM
- 乳酸デヒドロゲナーゼ活性の評価
- 乳酸デヒドロゲナーゼ(LDH)アッセイは、製造元の指示に従って乳酸デヒドロゲナーゼ細胞アッセイキットを使用して実行します。
- LDH試験試薬(10 μL)を0.5 mg/mLの細胞タンパク質に加え、37°Cで5分間インキュベートします。 インキュベーションの終了時に、45 nmの吸光度を1分ごとに8分間測定します。
- 0(ブランク)、2.5、5、7.5、10、および12.5 nM/ウェルのNADHを使用した比色検出用のNADH標準を準備し、その後、最終容量50 μLにLDH試験試薬を添加します。
- T初期 とT最終 の吸光度の差をNADH標準曲線にプロットし、NADH生成量を決定します。上記の式を使用してLDHの活性を評価します。
LDH活性 =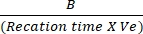 X サンプル希釈係数
X サンプル希釈係数
ここで、B = T初期とT最終との間に生成されたNADHの量(nmol)、反応時間=T最終-T初期(分)、およびVe =サンプル容量(mL)をウェルに添加する。
結果
図1は、A549(肺腺癌)、MRC-5(線維芽細胞)、THP-1(単球)の3つの異なる細胞集団を用いた多細胞腫瘍スフェロイドの発達を、顕微鏡下で観察したハンギングドロップ法によるものです。7日目のスフェロイドは直径260 ± 5.3 μmのコンパクトで剛性があり、10日目のスフェロイドは直径480 ± 7.5 μmでした(図1A上パネル、図1B-D)?...
ディスカッション
本研究では、腫瘍細胞、間質細胞集団(線維芽細胞)、免疫細胞集団(単球)からなる多細胞腫瘍スフェロイドの開発について、改変ハンギングドロップ法を用いて紹介する。線維芽細胞と単球/マクロファージは、腫瘍微小環境(TME)を構成する最も重要な集団の1つであり、それらの存在はしばしば患者の予後不良と関連しています16。TME中に存在するとき、線維芽細胞は形質転換...
開示事項
著者は開示する利益相反を持っていません。
謝辞
この研究は、インドのSERB-Women Excellence Award Project(SB/WEA-02/2017)およびSERB-Early Career Research Award Project、India(ECR/2017/000892)からDPへの支援を受けた。著者、LAとSRは、IITロパーとMHRDの研究フェローシップを認めています。MKはICMRの研究フェローシップを認めています。
資料
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| APC anti-human α-SMA | R&D systems | Cat# IC1420A | |
| Anti-fibroblast microbeads | Miltenyi Biotec | Cat# 130-050-601 | |
| Cell lines | |||
| A549 lung adenocarcinoma cells | NCCS Pune | - | |
| MRC-5 fetal lung fibroblasts | ATCC | CCL-171 | |
| THP-1 Human monocytes | NCCS Pune | - | |
| Chemicals | |||
| BSA | Himedia | Cat# 9048-46-8 | |
| 2,6-dichloroindophenol (DCPIP) | SRL | Cat# 55287 | |
| Calcein-AM | Thermo Fisher Scientific | Cat# C3099 | |
| DAPI | Thermo Fisher Scientific | Cat# D1306 | |
| DCFDA | Sigma | Cat# D6883 | |
| DMEM | Gibco | Cat# 11995073 | |
| DPBS | Gibco | Cat# 14190-144 | |
| EDTA | Thermo fisher scientific | Cat# 17892 | |
| EGTA | SRL | Cat# 62858 | |
| EZcoun Lactate Dehydrogenase Cell Assay Kit | HiMedia | Cat# CCK036 | |
| FBS | Gibco | Cat# 10082147 | |
| Halt Protease and Phosphatase Inhibitor Cocktail (100X) | Thermo Fisher Scientific | Cat# 87786 | |
| HEPES | Thermo Fisher Scientific | Cat# 15630080 | |
| Horse heart Cytochrome c | SRL | Cat# 81551 | |
| Image-iT Red hypoxia reagent | Thermo Fisher Scientific | Cat# H10498 | |
| JC-1 Dye | Thermo Fisher Scientific | Cat# T3168 | |
| KCl | Merck | Cat# P9541 | |
| MgCl2 | Merck | Cat# M8266 | |
| MOPS | Thermo Fisher Scientific | Cat# 69824 | |
| Nacl | Sigma-Aldrich | Cat# S9888 | |
| NADH MB Grade | SRL | Cat# 54941 | |
| NP-40 | Thermo Fisher Scientific | Cat# 85124 | |
| Penicillin/Streptomycin | Gibco | Cat# 15140122 | |
| Phenazine methosulfate (PMS) | SRL | Cat# 55782 | |
| Propidium iodide | Thermo fisher scientific | Cat# P1304MP | |
| RPMI 1640 | Gibco | Cat# 11875093 | |
| Single Cell Lysis Kit | Thermo Fisher Scientific | Cat# 4458235 | |
| Sodium ascorbate | Merck | Cat# A7631 | |
| Sodium cyanide | Sigma | Cat# 205222 | |
| Sodium Deoxycholate | Thermo Fisher Scientific | Cat# 89904 | |
| Sodium dodecyl sulphate | Sigma-Aldrich | Cat# L3771 | |
| Sodium succinate hexahydrate | SRL | Cat# 36313 | |
| Sucrose | Sigma | Cat# S0389 | |
| SuperScript VILO cDNA synthesis kit | Thermo Fisher Scientific | Cat# 11754-050 | |
| Triton X-100 | Sigma | Cat# T8787 | |
| Trypsin 0.25% EDTA | Gibco | Cat# 25200072 | |
| Universal SYBR Green Supermix | BIO-RAD | Cat# 172-5124 | |
| Plasticware | |||
| MACS LS Columns | Miltenyi Biotec | Cat# 130-042-401 | |
| Equipment | |||
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | Cat# AMQAF1000 | |
| EVOS XL core imaging system | Thermo Fisher Scientific | Serial Number F0518-1727-0191 | |
| LAS X software | Leica Microsystems | ||
| Leica fluorescent inverted microscope | s | DMi8 automated S/N 424150) | |
| Midi MACS separator | Miltenyi Biotec | Cat# 130-042-302 |
参考文献
- Kim, N., et al. Single-cell RNA sequencing demonstrates the molecular and cellular reprogramming of metastatic lung adenocarcinoma. Nature Communications. 11 (1), 1-5 (2020).
- Davidson, S., et al. Single-cell RNA sequencing reveals a dynamic stromal niche that supports tumor growth. Cell Reports. 31 (7), 107628 (2020).
- Zhang, Y., et al. Single-cell analyses of renal cell cancers reveal insights into tumor microenvironment, cell of origin, and therapy response. Proceedings of the National Academy of Sciences. 118 (24), (2021).
- Bray, L. J., Hutmacher, D. W., Bock, N. Addressing patient specificity in the engineering of tumor models. Frontiers in Bioengineering and Biotechnology. 7, 217 (2019).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Tissue Engineering. , 141-151 (2007).
- Dituri, F., et al. Complex tumor spheroid formation and one-step cancer-associated fibroblasts purification from hepatocellular carcinoma tissue promoted by inorganic surface topography. Nanomaterials. 11 (12), 3233 (2021).
- Arora, L., et al. Development of a multicellular 3D tumor model to study cellular heterogeneity and plasticity in NSCLC tumor microenvironment. Frontiers in Oncology. 12, 881207 (2022).
- Nurmik, M., Ullmann, P., Rodriguez, F., Haan, S., Letellier, E. In search of definitions: Cancer-associated fibroblasts and their markers. International Journal of Cancer. 146 (4), 895-905 (2020).
- Zhang, Y., et al. HIF-1α is necessary for activation and tumour-promotion effect of cancer-associated fibroblasts in lung cancer. Journal of Cellular and Molecular Medicine. 25 (12), 5457-5469 (2021).
- Bu, L., et al. Biological heterogeneity and versatility of cancer-associated fibroblasts in the tumor microenvironment. Oncogene. 38 (25), 4887-4901 (2019).
- Whitaker-Menezes, D., et al. Evidence for a stromal-epithelial "lactate shuttle" in human tumors: MCT4 is a marker of oxidative stress in cancer-associated fibroblasts. Cell cycle. 10 (11), 1772-1783 (2011).
- Mandujano-Tinoco, E. A., Gallardo-Pérez, J. C., Marín-Hernández, A., Moreno-Sánchez, R., Rodríguez-Enríquez, S. Anti-mitochondrial therapy in human breast cancer multi-cellular spheroids. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research. 1833 (3), 541-551 (2013).
- Bregman, A. A. . Laboratory Investigations in Cell and Molecular Biology. , (2002).
- Berry, E. A., Trumpower, B. L. Simultaneous determination of hemes a, b, and c from pyridine hemochrome spectra. Analytical Biochemistry. 161 (1), 1-15 (1987).
- Avagliano, A., et al. Metabolic reprogramming of cancer associated fibroblasts: the slavery of stromal fibroblasts. BioMed Research International. , (2018).
- Lorusso, G., Rüegg, C. The tumor microenvironment and its contribution to tumor evolution toward metastasis. Histochemistry and Cell Biology. 130 (6), 1091-1103 (2008).
- Liu, T., Zhou, L., Li, D., Andl, T., Zhang, Y. Cancer-associated fibroblasts build and secure the tumor microenvironment. Frontiers in Cell and Developmental Biology. 7, 60 (2019).
- Sebastian, A., et al. Single-cell transcriptomic analysis of tumor-derived fibroblasts and normal tissue-resident fibroblasts reveals fibroblast heterogeneity in breast cancer. Cancers. 12 (5), 1307 (2020).
- Elyada, E., et al. Cross-species single-cell analysis of pancreatic ductal adenocarcinoma reveals antigen-presenting cancer-associated fibroblasts. Cancer Discovery. 9 (8), 1102-1123 (2019).
- Ganguly, D., et al. Cancer-associated fibroblasts: Versatile players in the tumor microenvironment. Cancers. 12 (9), 2652 (2020).
- Harryvan, T. J., Verdegaal, E. M., Hardwick, J. C., Hawinkels, L. J., vander Burg, S. H. Targeting of the cancer-associated fibroblast-T-cell axis in solid malignancies. Journal of Clinical Medicine. 8 (11), 1989 (2019).
- Santi, A., Kugeratski, F. G., Zanivan, S. Cancer associated fibroblasts: the architects of stroma remodeling. Proteomics. 18 (5-6), 1700167 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved