Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Bewertung der mitochondrialen Gesundheit in krebsassoziierten Fibroblasten, die aus 3D-multizellulären Lungentumor-Sphäroiden isoliert wurden
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Multizelluläre 3D-Tumorsphäroide wurden mit Lungenadenokarzinomzellen, Fibroblasten und Monozyten hergestellt, gefolgt von der Isolierung von Krebs-assoziierten Fibroblasten (CAFs) aus diesen Sphäroiden. Isolierte CAFs wurden mit normalen Fibroblasten verglichen, um die mitochondriale Gesundheit zu beurteilen, indem das mitochondriale Transmembranpotential, reaktive Sauerstoffspezies und enzymatische Aktivitäten untersucht wurden.
Zusammenfassung
Krebsassoziierte Fibroblasten (CAFs) gehören zu den am häufigsten vorkommenden Stromazellen in der Tumormikroumgebung und erleichtern das Tumorwachstum und die Progression. Die Komplexität innerhalb der Tumormikroumgebung, einschließlich Tumorsekretom, niedriggradiger Entzündung, Hypoxie und Redox-Ungleichgewicht, fördert die heterotypische Interaktion und ermöglicht die Umwandlung inaktiver residenter Fibroblasten in aktive CAFs. CAFs unterscheiden sich metabolisch von normalen Fibroblasten (NFs), da sie glykolytisch aktiver sind, höhere Konzentrationen an reaktiven Sauerstoffspezies (ROS) produzieren und den Laktatexporteur MCT-4 überexprimieren, was zur Öffnung der mitochondrialen Permeabilitätsübergangspore (MPTP) führt. Hier wurde eine Methode beschrieben, um die mitochondriale Gesundheit von aktivierten CAFs zu analysieren, die aus den multizellulären 3D-Tumorsphäroiden isoliert wurden, die aus menschlichen Lungenadenokarzinomzellen (A549), menschlichen Monozyten (THP-1) und menschlichen Lungenfibroblastenzellen (MRC5) bestehen. Tumor-Sphäroide wurden in unterschiedlichen Zeitintervallen zerfallen und durch magnetisch aktivierte Zellsortierung wurden CAFs isoliert. Das mitochondriale Membranpotenzial von CAFs wurde unter Verwendung des JC-1-Farbstoffs, der ROS-Produktion durch 2',7'-Dichlordihydrofluoresceindiacetat (DCFDA)-Färbung und der Enzymaktivität in den isolierten CAFs bewertet. Die Analyse der mitochondrialen Gesundheit von isolierten CAFs ermöglicht ein besseres Verständnis des umgekehrten Warburg-Effekts und kann auch angewendet werden, um die Folgen von mitochondrialen Veränderungen der CAF, wie z.B. metabolische Flüsse und die entsprechenden Regulationsmechanismen auf die Heterogenität von Lungenkrebs, zu untersuchen. Daher befürwortet die vorliegende Studie ein Verständnis der Tumor-Stroma-Wechselwirkungen auf die mitochondriale Gesundheit. Es würde eine Plattform bieten, um mitochondrial-spezifische Medikamentenkandidaten auf ihre Wirksamkeit gegen CAFs als potenzielle Therapeutika in der Tumormikroumgebung zu überprüfen und so die Beteiligung von CAF an der Progression von Lungenkrebs zu verhindern.
Einleitung
Solide Tumoren bestehen aus heterogenen Zellpopulationen, die von der Tumormikroumgebung (TME) gesteuert werden, jedoch ist der Ursprung der meisten Zellen noch nicht entdeckt. Hauptsächlich Stroma- und Immunzellen (Fibroblasten, Endothelzellen, Monozyten, Makrophagen, dendritische Zellen, B-Zellen, T-Zellen und deren Untergruppen) spiegeln die Tumorheterogenität bei Lungen-, Brust-, Nieren- und anderen soliden Krebsartenwider 1,2,3. Das Verständnis des Ursprungs jedes Subtyps und seines Transdifferenzierungspotenzials ist von größter Bedeutung für die Entwicklung neuartiger Therapien gegen diese Krebsarten. Die Analyse dieser vielfältigen Zellpopulation in humanen Biopsien stellt aufgrund des Tumortyps, der Lokalisation, des Stadiums, der Begrenzung der Probenmenge und der patientenspezifischen Variabilität mehrere Herausforderungen dar4. Daher wird ein experimentelles Modell benötigt, das nicht nur zuverlässig ist, sondern auch den in vivo Tumorzustand simulieren kann und sich als ideal für die Untersuchung des Tumor-Stroma-Crosstalks und seiner Beteiligung an der Krankheitspathophysiologie erweist.
Dreidimensionale (3D) mehrzellige Tumor-Sphäroid-Kulturen (MCTS) sind aufgrund ihrer Ähnlichkeit mit natürlichen Gegenstücken ein vorteilhaftes In-vitro-Modellsystem von Tumoren. MCTS kann Aspekte solider Tumore besser replizieren als 2D-Zellkulturmodelle, einschließlich ihrer räumlichen Architektur, physiologischer Reaktionen, der Freisetzung löslicher Mediatoren, Genexpressionsmuster und Arzneimittelresistenzmechanismen. Darüber hinaus besteht ein Hauptvorteil von MCTS darin, dass es zur Untersuchung der Tumorheterogenität und der Tumormikroumgebung (TME) eingesetzt werden kann. Die Hanging-Drop-Methode ist das am häufigsten eingesetzte Werkzeug zur Entwicklung und Analyse von MCTS5. Bei dieser Methode werden die verschiedenen Zellen mit Medien in Form von Tröpfchen suspendiert, was ihr Wachstum in einer kohärenten 3D-Aggregatform ermöglicht und für die Untersuchung leicht zugänglich ist. Die Technik ist einfach; Es benötigt nicht viele Zellen und eliminiert die Notwendigkeit eines spezialisierten Substrats wie Agarose für die Sphäroidentwicklung6. Ein weiterer Vorteil dieser Methode liegt in der Reproduzierbarkeit ihrer Technik. Darüber hinaus wurde diese Methode auch verwendet, um gemischte Zellpopulationen, wie Endothelzellen und Tumorzellen, zu kokulturieren, um eine frühe Tumorangiogenese zu simulieren7.
In dieser Studie wurden multizelluläre 3D-Lungentumor-Sphäroide mit Lungenadenokarzinomzellen, Fibroblasten und Monozyten unter Verwendung der Hanging-Drop-Methode hergestellt, die die Mikroumgebung des Lungentumors nachahmt. Dann wurde die krebsassoziierte Fibroblastenpopulation (CAF) isoliert, um die mitochondriale Gesundheit zu untersuchen. Die Hauptidee hinter der Entwicklung dieser Sphäroide besteht darin, die CAFs zu isolieren, da der Austausch zwischen den Zellen in Sphäroiden die Fibroblasten in einen myo-fibroblastenähnlichen aktivierten CAF-Zustand umwandeln könnte. Zweitens könnte diese Studie auch zeigen, wie anomale ROS-Produktion und mitochondriale Dysfunktion die normalen Fibroblasten in Richtung des aggressiveren CAF-Phänotyps treiben. Es wurde festgestellt, dass Fibroblasten, die in Tumorsphäroiden zusammengesetzt sind, myofibroblastische Eigenschaften mit erhöhter ROS-Aktivität und der Induktion der metabolischen Genexpression erhielten. Dieses Protokoll unterstreicht die Bedeutung der Tumormikroumgebung bei der Aktivierung von CAF und könnte ein hervorragendes Modell für die In-vitro-Generierung und Untersuchung von phänotypischen CAF-Merkmalen sein.
Protokoll
1. Zellkultur
- Kultur der humanen Lungenadenokarzinom-Zelllinie A549 und der humanen monozytären Zelllinie THP-1 in RPMI1640-Medien, ergänzt mit 10% FBS und 1% Penicillin-Streptomycin bei 37 °C in einer befeuchteten Kammer mit 5%CO2.
- Kultur MRC-5 humaner Lungenfibroblastenzellen in DMEM-Medium, ergänzt mit 10% FBS und 1% Penicillin-Streptomycin-Lösung bei 37 °C in einer befeuchteten Kammer mit 5%CO2.
2. Herstellung von mehrzelligen Tumor-Sphäroiden unter Verwendung der A549-Lungenadenokarzinom-Zelllinie, MRC5-Fibroblasten und THP-1-Monozyten
HINWEIS: Die multizellulären tumorigenen und nicht-tumorigenen 3D-Sphäroide wurden mit der Hanging-Drop-Methode in einer 90-mm-Zellkulturschale hergestellt. Im Folgenden wird die Entwicklung dieser Sphäroide detailliert beschrieben. Sofern nicht anders angegeben, sollten alle Zellkulturreagenzien wie vollständiges Medium, PBS und 0,25%ige Trypsin-EDTA-Lösung vor Gebrauch bei 37 °C vorgewärmt werden.
- Herstellung der Zellsuspension
- A549- und MRC5-adhärente Zellen (je 5 x 106 Zellen) werden in DMEM-Wachstumsmedium (modifiziertes Adlermedium von Dulbecco [DMEM] + 10 % fetales Rinderserum [FBS] + 1 % Penicillin-Streptomycin) in T25-Kolben bei 37 °C in einer befeuchteten Kammer mit 5 %CO2 gezüchtet.
- Für THP-1-Zellen wird die Zellsuspension (5 x 106 Zellen) in vollständigem Wachstumsmedium (RPMI1640 + 10% FBS + 1% Penicillin-Streptomycin) in T25-Flaschen gezüchtet. Für ein besseres Wachstum stellen Sie die T25-Kolben bei 37 °C in eine befeuchtete Kammer mit 5%CO2 im Stehen.
- Nach 3 Tagen, bei 80%-85% Konfluenz, waschen Sie die A549- und MRC5-Zellen mit kalzium- und magnesiumfreiem PBS (Phosphatpufferkochsalzlösung), indem Sie 1 ml PBS (25-30 °C) für 1 Minute in jeden Kolben geben und absaugen.
- Die A549- und MRC5-Zellen werden aus dem Kolben entnommen, indem sie mit 500 μL 0,25%iger Trypsin-EDTA-Lösung für 5 min bei 37 °C in einem befeuchteten Inkubator mit 5 %CO2 inkubiert werden. Unmittelbar danach fügen Sie 4 ml vollständiges Wachstumsmedium hinzu, um das Trypsin zu inaktivieren.
- Die Zellsuspension aus dem T25-Kolben wird in ein 15-ml-Röhrchen gegeben und 5 Minuten lang bei 125 x g pelletiert. Entfernen Sie den Überstand und resuspendieren Sie die Zellen in 5 ml vollständigem Wachstumsmedium.
- Etablierung von mehrzelligen Tumor-Sphäroiden
HINWEIS: Alle Schritte der Tumorsphäroidbildung sollten innerhalb der Biosicherheitswerkbank durchgeführt werden, um sterile Bedingungen zu erhalten. Das maximale Volumen der Zellsuspension wurde auf einen Tropfen von 25 μL standardisiert, um ein Tröpfchen so herzustellen, dass es beim Umdrehen der Lider nicht herunterfällt.- Zählen Sie die Zellnummern A549, MRC5 und THP-1 mit einem Zellzähler. Für jedes Sphäroidtröpfchen (25 μL) wird die folgende Zellzahl beibehalten: 5.000 A549-Zellen, 4.000 MRC5-Zellen und 1.000 THP-1-Zellen, gemäß dem von Arora et al.7 beschriebenen Protokoll. Berechnen Sie die Zellzahlen entsprechend für ein Volumen von 1 ml.
HINWEIS: Sphäroide wurden ursprünglich mit drei verschiedenen Zellzahlen pro Sphäroid (d.h. 5000, 8000 und 10.000) hergestellt. Außerdem wurden verschiedene Zellverhältnisse von Tumorzellen/Fibroblasten/Monozyten (1:1:1, 2:2:1, 4:2:1, 5:2:1 und 5:4:1) überprüft. Schließlich wurde eine erfolgreiche 3D-Multizellulär-Sphäroidbildung mit einem Verhältnis von 5:4:1 beobachtet und für die Studie verwendet. Die Fibroblastenkonzentration wurde aufgrund ihres Anteils in der Tumormikroumgebung erhöht, was die Steifigkeit der Tumorsphäroide weiter erhöhte. Über das detaillierte Verfahren wurde in einer kürzlich erschienenen Veröffentlichung von Arora et al.7 berichtet. - Bereiten Sie die Zellsuspension in einem Verhältnis von 5 (A549, 2 x 10 5 Zellen/ml) zu 4 (MRC5, 1,6 x 10 5 Zellen/ml) zu 1 (THP-1,5 x 104 Zellen/ml) vor und füllen Sie das Volumen mit vollständigem DMEM auf 1 ml auf.
- Einen Tropfen von 25 μl Zellsuspensionsgemisch auf den Deckel einer 90-mm-Kulturschale (ca. 50 Tropfen/90-mm-Schale) geben. Füllen Sie den Boden der 90-mm-Kulturschale mit 10 ml sterilem Wasser.
- Drehen Sie den Deckel vorsichtig über die mit Wasser gefüllte Trinkkammer und stellen Sie die Schale für 3 Tage in einen Zellkultur-Inkubator.
- Überwachen Sie die Sphäroide unter dem Mikroskop bei 10-facher Vergrößerung am 4. Tag. Um Bilder aufzunehmen, schalten Sie den Netzschalter ein, stellen Sie die 60-mm-Schüssel vorsichtig auf die Bühne und wählen Sie die Vergrößerung (10-fach). Passen Sie die Linsen an und untersuchen Sie die Zellen, um die Zellaggregation und -proliferation zu analysieren. Drücken Sie die Schaltflächen Einfrieren und Speichern am Mikroskop, um das Bild aufzunehmen.
- Wechseln Sie das Nährmedium am Tag 4, indem Sie vorsichtig 20 μL Medium aus jedem Tröpfchen absaugen und durch ein frisches, vollständiges Nährmedium ersetzen.
- Zählen Sie die Zellnummern A549, MRC5 und THP-1 mit einem Zellzähler. Für jedes Sphäroidtröpfchen (25 μL) wird die folgende Zellzahl beibehalten: 5.000 A549-Zellen, 4.000 MRC5-Zellen und 1.000 THP-1-Zellen, gemäß dem von Arora et al.7 beschriebenen Protokoll. Berechnen Sie die Zellzahlen entsprechend für ein Volumen von 1 ml.
3. Lebend-tote Analyse von Tumor-Sphäroiden
- An Tag 7 und 10 die 90-mm-Schale vorsichtig in der Biosicherheitswerkbank umdrehen und mit einer 200-μl-Pipette Sphäroide aus jedem Tröpfchen auffangen. Sammeln Sie jeweils fünf Sphäroide in einem 1,5-ml-Röhrchen.
- Geben Sie 500 μL 1x PBS in das 1,5-ml-Röhrchen mit den Sphäroiden und zentrifugieren Sie bei 125 x g für 5 min. Der Überstand wird vorsichtig verworfen und die Sphäroide in 200 μL 1x PBS resuspendiert. Pipettieren Sie nicht rigoros, um einen Zerfall des Sphäroids zu vermeiden.
- Pipettieren Sie die Sphäroide mit einer 200-μl-Pipette auf einer 60-mm-Schale für die Calcein-AM- und Propidiumiodid-Färbung.
- 5 μl 1 μM Calcein-AM-Lösung und 5 μl 2 mg/ml Propidiumiodidlösung auf die Sphäroide geben. 10 Min. inkubieren. Nach Beendigung der Inkubationszeit die Sphäroide zweimal vorsichtig mit 1x PBS waschen.
- Legen Sie die 60-mm-Schüssel mit den Sphäroiden unter das fluoreszierende inverse Mikroskop, beobachten und nehmen Sie Bilder mit 10-facher Vergrößerung auf, indem Sie die Fluoreszenzoption in der Mikroskopsoftware auswählen und den FITC (grüner Fluoreszenzkanal; Anregung 490 nm, Emission 515 nm) für Calcein und Texas Red Channel (TXR; Anregung 535 nm, Emission 617 nm) auswählen.
- Um das Bild zu erfassen, schalten Sie Ctr Adv ein, was Schalter 1 ist, gefolgt vom Einschalten der CPU. Warten Sie, bis das Softwaresystem gestartet ist. Stellen Sie die 60-mm-Schüssel nach dem Booten vorsichtig auf die Bühne und wählen Sie die Vergrößerung (10x) und die Leuchtstoffkanäle (FITC, TXR) aus. Stellen Sie die Objektive ein und scannen Sie nach dem Bild.
- Um das Bild im System anzuzeigen, wählen Sie die Option Live und Bild anzeigen. Passen Sie die Intensität der Fluoreszenz für eine entsprechende Optimierung an. Speichern Sie das Bild, indem Sie auf die Schaltfläche Speichern klicken.
HINWEIS: In diesem Stadium sind Sphäroide mit bloßem Auge sichtbar. Unter dem Lichtmikroskop erscheinen Sphäroide bei 10-facher Vergrößerung als runde, starre Kugeln. Mit einer 200-μL-Pipette können mehrere Sphäroide gleichzeitig gesammelt werden.
4. Zerfall und Zellsuspension von Tumorsphäroiden
- Sammeln Sie an Tag 7 und 10 jeweils 200 Tumorsphäroide mit einer 1-ml-Pipette in einem 15-ml-Röhrchen.
HINWEIS: Überprüfen Sie vor der Entnahme sorgfältig die Form und Form eines einzelnen Sphäroids, nachdem Sie es auf einen mikroskopischen Objektträger oder auf eine 30-mm-Schale übertragen haben, und beobachten Sie es unter dem Mikroskop. - Die Sphäroide werden durch Zentrifugation bei 125 x g für 5 min pelletiert. Saugen Sie den Überstand vorsichtig ab, ohne die Tumorsphäroide zu stören.
- Die Sphäroide vorsichtig mit 200 μL PBS waschen, 5 min bei 125 x g zentrifugieren und den Überstand vorsichtig entsorgen.
- Für den Zerfall des Sphäroids werden 400 μl 0,25%ige Trypsin-EDTA-Lösung hinzugefügt und 10 min bei 37 °C gelagert. Führen Sie kräftiges Pipettieren durch, um die Sphäroide vollständig zu zerfallen.
- Neutralisieren Sie Trypsin durch Zugabe von 1 ml vollständigem DMEM-Wachstumsmedium. Bei 125 x g 5 min zentrifugieren und den Überstand vorsichtig entsorgen.
- Resuspendieren Sie das Pellet in 1 ml vollständigem DMEM-Medium und zählen Sie die Gesamtzahl der Zellen.
5. Isolierung von Krebs-assoziierten Fibroblasten (CAF) durch Mikroperlen
- Zur Isolierung von CAFs aus den Tumorsphäroiden werden 1 x 10 7 Zellen in 80 μl kaltem MACS-Puffer (Cold Magnetic Activated Cell Sorting (MACS) resuspendiert (PBS bei pH7,2 mit 0,5 % Rinderserumalbumin [BSA] und 2 mM Ethylendiamintetraessigsäure [EDTA]).
- Inkubieren Sie die Zellsuspension (mit 1 x 107 Zellen) mit 20 μL Anti-Fibroblasten-Mikrokügelchen. Durch vorsichtiges Klopfen auf das Röhrchen gut mischen und 30 min bei Raumtemperatur inkubieren.
- Die Zellen werden mit 1 ml kaltem MACS-Puffer gewaschen, bei 125 x g für 5 min zentrifugiert und der Überstand abgesaugt. Resuspendieren Sie die Zellen in 500 μL MACS-Puffer.
- Für die magnetische Zelltrennung auf Basis von Kügelchen bereiten Sie die MACS-Säule vor, indem Sie sie mit 3 ml MACS-Puffer spülen.
- Legen Sie die Zellsuspension in die Säule, gefolgt von der Sammlung des Durchflusses, der die unmarkierte Zellpopulation enthält.
- Waschen Sie die Säule dreimal mit 3 ml MACS-Puffer. Entfernen Sie die Säule aus dem Separator und legen Sie sie auf das Auffangrohr.
- Sammeln Sie die mit Anti-Fibroblasten-Mikroperlen markierten Zellen, indem Sie 5 ml MACS-Puffer hinzufügen und den Kolben fest in die Säule drücken.
- Zentrifugieren Sie die markierten Zellen bei 125 x g für 5 min. Fahren Sie mit den isolierten Fibroblasten für nachgeschaltete Anwendungen fort.
6. Durchflusszytometrie-basierte Analyse der ACTA2-Expression in isolierten CAFs
- Zählen Sie die Anzahl der isolierten CAFs und verwenden Sie ca. 6 x 104 Zellen. Die Zellen einmal mit PBS waschen, bei 125 x g für 5 min zentrifugieren und den Überstand absaugen.
- Fügen Sie 100 μL Zellpermeabilisierungspuffer (PBS + 0,5% BSA + 0,3% v/v Triton X-100) hinzu und inkubieren Sie die Zellen bei 4 °C für 30 Minuten.
- Wirbeln Sie die Zellen intermittierend, um eine einzelne Zellsuspension aufrechtzuerhalten. Zentrifugieren und resuspendieren Sie die Zellen in 100 μL Zellpermeabilisierungspuffer.
- Fügen Sie 2 μL APC-konjugierten Anti-Human-α-SMA-Antikörper hinzu und inkubieren Sie bei 4 °C für 45 min. Nach der Inkubation 1 ml Permeabilisierungspuffer zugeben und bei 125 x g für 5 min zentrifugieren, um überschüssige Antikörper zu entfernen.
- Resuspendieren Sie das Pellet in 400 μl Permeabilisierungspuffer für die durchflusszytometrische Analyse. Erfassen Sie insgesamt 10.000 Ereignisse jeder Probe in einem Durchflusszytometer. Wählen Sie ACTA2-positive Zellen aus, nachdem Sie die Zellpopulationen anhand ihrer Vorwärts- und Seitenstreuung unterschieden haben, indem Sie die Singulett-Population auswählen, gefolgt von der Auswahl der ACTA2-positiven Zellen, die als einzelner Peak auf dem Einzelparameterhistogramm erscheinen.
7. JC-1-Färbung zur Bestimmung des mitochondrialen Membranpotentials
- Zählen Sie die Anzahl der isolierten CAFs und verwenden Sie ca. 6 x 104 Zellen für die 5,5,6,6'-Tetrachlor-1,1',3,3'-Tetraethylbenzimi-dazoylcarbocyaniniodid (JC-1)-Färbung mittels Durchflusszytometrie.
- Waschen Sie die Zellen gründlich mit PBS, zentrifugieren Sie bei 125 x g für 5 min, saugen Sie den Überstand ab und fügen Sie 100 μL Zellfärbepuffer hinzu.
- JC-1-Farbstoff mit einer Arbeitskonzentration von 2 μM zugeben und bei Raumtemperatur für 30 min inkubieren. Nach Beendigung der Inkubation werden die Zellen mit PBS gewaschen, 5 Minuten lang bei 125 x g zentrifugiert und in einem Endvolumen von 400 μl resuspendiert.
- Erfassen Sie insgesamt 20.000 Ereignisse jeder Probe in einem Durchflusszytometer. Quantifizieren Sie das mitochondriale Membranpotenzial durch Messung der rotverschobenen JC-1-Aggregate auf dem FL-2-Kanal und der grünverschobenen Monomere auf dem FL-1-Kanal.
8. DCFDA-Färbung zur Schätzung des Gehalts an zellulären reaktiven Sauerstoffspezies (ROS)
- Verwenden Sie die ganzen Sphäroide (50 Zahlen) sowie die isolierten CAFs (6 x 104 Zellen) aus den Sphäroiden für die 2',7'-Dichlordihydrofluoresceindiacetat (DCFDA) Färbung.
- Waschen Sie die Zellen gründlich mit PBS, zentrifugieren Sie bei 125 x g für 5 min, saugen Sie den Überstand ab und fügen Sie 100 μL Zellfärbepuffer hinzu.
- Fügen Sie DCFDA-Farbstoff mit einer Arbeitskonzentration von 1 μM hinzu und inkubieren Sie ihn bei Raumtemperatur für 30 Minuten. Die Zellen zweimal mit PBS waschen, bei 125 x g für 5 min zentrifugieren und dann in einem Endvolumen von 400 μL resuspendieren.
- Erfassen Sie insgesamt 20.000 Ereignisse jeder Probe in einem Durchflusszytometer. Beurteilen Sie die ROS-Konzentrationen durch Messung der Fluoreszenz an Tag 7 und Tag 10 sowohl für die Sphäroide als auch für die isolierten CAFs.
9. RT-qPCR-Analyse von CAF-Markern und glykolytischen Genen
- Extrahieren Sie RNA aus den sortierten CAFs mit einem Einzelzell-Lyse-Kit nach dem Protokoll des Herstellers. Bereiten Sie cDNA aus 100 ng RNA mit einem cDNA-Synthesekit gemäß den Richtlinien des Herstellers vor.
- Führen Sie RT-qPCR durch, um die relativen CAF-Marker (ACTA2 8 und COL1A29) und die glykolytische Genexpression (GLUT1 10 und MCT411) zu analysieren. Führen Sie nach der letzten Erweiterung eine Schmelzkurvenanalyse durch, um die Spezifität der Produkte sicherzustellen. Normalisieren Sie die Daten mit der Expression von GAPDH als Referenzgen. Die für die RT-qPCR verwendeten Primer-Sequenzen sind in der Ergänzungstabelle 1 aufgeführt.
10. Extraktion und Quantifizierung des zellulären Proteins aus CAFs
HINWEIS: Führen Sie alle Schritte der Proteinextraktion auf Eis durch, um einen Proteinabbau zu vermeiden.
- Resuspendieren Sie ca. 4 x 106 CAF-Zellen in 100 μL eiskaltem RIPA-Lysepuffer (enthält 30 mM HEPES, 150 mM NaCl, 1% NP-40, 0,1% SDS und 0,5% Natriumdeoxycholat mit 5 mM Halt-Protease- und Phosphatase-Inhibitor-Cocktail und 5 mM EDTA bei pH 7,4).
- Wirbeln Sie rigoros für die richtige Zelllyse. Beschallen Sie die Zellsuspension bei einer Frequenz von 20 Hz, einer Amplitude von 20 % für 15 s und einem 3-fachen Impuls.
- Nach der Beschallung wird der Proteinextrakt bei 13.000 x g für 15 min bei 4 °C zentrifugiert. Überführen Sie den Überstand in ein vorgekühltes 1,5-ml-Röhrchen. Führen Sie den BCA-Protein-Assay durch, um das Protein zu quantifizieren.
11. Spektrophotometrische Analyse enzymatischer Aktivitäten in CAFs
HINWEIS: Die folgenden Enzymaktivitäten werden in Tumor-Sphäroid-abgeleiteten CAFs analysiert.
- Messung der Succinat-Dehydrogenase-Aktivität
- Um die Aktivität der Succinatdehydrogenase (SDH) in CAFs zu bewerten, wird ein RWA-Puffer mit 250 mM Saccharose, 10 mM 4-(2-Hydroxyethyl)-1-piperazinethansulfonsäure (HEPES) und 1 mM Ethylenglykol-bis(β-aminoethylether)-N,N,N′,N′-Tetraessigsäure (EGTA) hergestellt und der pH-Wert auf 7,3 eingestellt. 0,4 mM Phenazinmethosulfat (PMS), 0,2 mM 2,6-Dichlorindophenol (DCPIP), 50 mM MgCl2, 0,02% Triton X-100 und 1 mM Cyanid in den RWA-Puffer geben und bei 37 °C aufbewahren.
- Extrahieren Sie das zelluläre Protein aus den CAFs, wie in Schritt 10 beschrieben (2 x 106 Zellen). In jeder Vertiefung einer 96-Well-Platte werden 100 μl 0,1 mg zelluläres Protein mit 100 μl RWA-Reaktionsgemisch bei 37 °C für 15 min inkubiert.
- Um die enzymatische Aktivität zu starten, fügen Sie 10 mM Succinat12 hinzu. Berechnen Sie die Enzymaktivität in nM/min/ml, indem Sie die Änderungen der Absorption bei 600 nm messen.
- Der Umrechnungsfaktor für DCIP beträgt 0,0215 A/nM, basierend auf dem molaren Extinktionskoeffizienten12. Berechnen Sie die relative Aktivität von SDH mit der genannten Formel:
Relative Aktivität (nM/min/ml/Enzym) =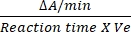 X X
X X  V
V
Dabei gilt: ΔA/min = Geschwindigkeit der enzymatischen Reaktion (A-Initial-A-Endling)/(Endzeit-A/min-Initiale), Ve = Probenvolumen und V = Reaktionsvolumen.
- Abschätzung der Cytochrom-c-Oxidase-Aktivität
- Um die Aktivität der Cytochrom-c-Oxidase (COX) in CAFs zu bewerten, werden 0,2 mg/ml zelluläres Protein in eine KME-Reaktionspufferlösung gegeben, die KME-Puffer (125 mM KCl, 20 mM 3-(N-morpholino)propansulfonsäure [MOPS] und 1 mM EGTA, pH 7,4), 0,02 % Triton X-100 und 5 mM Natriumascorbat enthält.
- In einem separaten Röhrchen werden 50 μM Cytochrom c des Pferdeherzens mit 5 mM Natriumascorbat gemischt und bei 37 °C für 5 min13 inkubiert. Nach der Inkubation werden 20 μl reduziertes Cytochrom c auf 500 μl KME-Reaktionspufferlösung, die zelluläres Protein enthält, gegeben.
- Berechnen Sie die Enzymaktivität in Einheiten/μL, indem Sie die Änderungen der Absorption bei 550 nm messen. Die Absorption von Cytochrom c bei 550 nm ändert sich mit seiner Oxidationsstufe. Die Differenz der Extinktionskoeffizienten (mM) zwischen reduziertem und oxidiertem Cytochrom c beträgt 21,84 bei 550 nm14. Berechnen Sie die Menge der Enzymaktivität im zellulären Lysat als:
Einheiten/μL =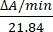
Dabei gilt: ΔA/min = A/minProbe-A/minLeerprobe und 21,84 = ΔmM zwischen oxidiertem Cytochrom c und reduziertem Cytochrom c bei 550 nm
- Beurteilung der Laktatdehydrogenase-Aktivität
- Führen Sie einen Laktatdehydrogenase-Test (LDH) mit einem Laktatdehydrogenase-Zell-Assay-Kit gemäß den Anweisungen des Herstellers durch.
- LDH-Testreagenz (10 μl) zu 0,5 mg/ml zellulärer Proteine zugeben und 5 min bei 37 °C inkubieren. Nach Beendigung der Inkubation wird die Extinktion bei 45 nm alle 1 min für 8 min gemessen.
- Bereiten Sie die NADH-Standards für die kolorimetrische Detektion unter Verwendung von 0 (Leerwert), 2,5, 5, 7,5, 10 und 12,5 nM/Well NADH vor, gefolgt von der Zugabe von LDH-Testreagenz zu einem Endvolumen von 50 μL.
- Zeichnen Sie die Unterschiede in der Absorption zwischen Tinitial und Tfinal auf die NADH-Standardkurve auf, um die Menge der NADH-Erzeugung zu bestimmen. Bewerten Sie die Aktivität von LDH mit der genannten Formel:
LDH-Aktivität =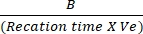 X-Probenverdünnungsfaktor
X-Probenverdünnungsfaktor
Dabei gilt: B = Menge (nmole) des NADH, das zwischenT initial und T final erzeugt wird, Reaktionszeit = Tfinal - Tinitial (min) und Ve = Probenvolumen (ml) zu Vertiefung addiert.
Ergebnisse
Abbildung 1 zeigt die Entwicklung von mehrzelligen Tumor-Sphäroiden unter Verwendung von drei verschiedenen Zellpopulationen - A549 (Lungenadenokarzinom), MRC-5 (Fibroblasten) und THP-1 (Monozyten) - durch die Hanging-Drop-Methode, wie sie an Tag 7 und Tag 10 unter dem Mikroskop beobachtet wurden. An Tag 7 waren die Sphäroide kompakt und starr mit einem Durchmesser von 260 ± 5,3 μm, und an Tag 10 hatten die Sphäroide einen Durchmesser von 480 ± 7,5 μm (Abbildung 1...
Diskussion
Die vorliegende Studie stellt die Entwicklung von mehrzelligen Tumorsphäroiden vor, die Tumorzellen, Stromazellpopulation (d.h. Fibroblasten) und Immunzellpopulation (d.h. Monozyten) unter Verwendung einer modifizierten Hanging-Drop-Methode umfassen. Fibroblasten und Monozyten/Makrophagen gehören zu den wichtigsten Populationen, die die Tumormikroumgebung (TME) bilden, und ihr Vorhandensein ist oft mit einer schlechten Prognose der Patienten verbunden16. Wenn sie in der TME vorhanden sind, trans...
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde durch das SERB-Women Excellence Award Project, Indien (SB/WEA-02/2017) und das SERB-Early Career Research Award Project, Indien (ECR/2017/000892) an die DP unterstützt. Die Autoren, LA und SR, würdigen IIT Ropar und MHRD für ihre Forschungsstipendien. MK dankt ICMR für ihr Forschungsstipendium.
Materialien
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| APC anti-human α-SMA | R&D systems | Cat# IC1420A | |
| Anti-fibroblast microbeads | Miltenyi Biotec | Cat# 130-050-601 | |
| Cell lines | |||
| A549 lung adenocarcinoma cells | NCCS Pune | - | |
| MRC-5 fetal lung fibroblasts | ATCC | CCL-171 | |
| THP-1 Human monocytes | NCCS Pune | - | |
| Chemicals | |||
| BSA | Himedia | Cat# 9048-46-8 | |
| 2,6-dichloroindophenol (DCPIP) | SRL | Cat# 55287 | |
| Calcein-AM | Thermo Fisher Scientific | Cat# C3099 | |
| DAPI | Thermo Fisher Scientific | Cat# D1306 | |
| DCFDA | Sigma | Cat# D6883 | |
| DMEM | Gibco | Cat# 11995073 | |
| DPBS | Gibco | Cat# 14190-144 | |
| EDTA | Thermo fisher scientific | Cat# 17892 | |
| EGTA | SRL | Cat# 62858 | |
| EZcoun Lactate Dehydrogenase Cell Assay Kit | HiMedia | Cat# CCK036 | |
| FBS | Gibco | Cat# 10082147 | |
| Halt Protease and Phosphatase Inhibitor Cocktail (100X) | Thermo Fisher Scientific | Cat# 87786 | |
| HEPES | Thermo Fisher Scientific | Cat# 15630080 | |
| Horse heart Cytochrome c | SRL | Cat# 81551 | |
| Image-iT Red hypoxia reagent | Thermo Fisher Scientific | Cat# H10498 | |
| JC-1 Dye | Thermo Fisher Scientific | Cat# T3168 | |
| KCl | Merck | Cat# P9541 | |
| MgCl2 | Merck | Cat# M8266 | |
| MOPS | Thermo Fisher Scientific | Cat# 69824 | |
| Nacl | Sigma-Aldrich | Cat# S9888 | |
| NADH MB Grade | SRL | Cat# 54941 | |
| NP-40 | Thermo Fisher Scientific | Cat# 85124 | |
| Penicillin/Streptomycin | Gibco | Cat# 15140122 | |
| Phenazine methosulfate (PMS) | SRL | Cat# 55782 | |
| Propidium iodide | Thermo fisher scientific | Cat# P1304MP | |
| RPMI 1640 | Gibco | Cat# 11875093 | |
| Single Cell Lysis Kit | Thermo Fisher Scientific | Cat# 4458235 | |
| Sodium ascorbate | Merck | Cat# A7631 | |
| Sodium cyanide | Sigma | Cat# 205222 | |
| Sodium Deoxycholate | Thermo Fisher Scientific | Cat# 89904 | |
| Sodium dodecyl sulphate | Sigma-Aldrich | Cat# L3771 | |
| Sodium succinate hexahydrate | SRL | Cat# 36313 | |
| Sucrose | Sigma | Cat# S0389 | |
| SuperScript VILO cDNA synthesis kit | Thermo Fisher Scientific | Cat# 11754-050 | |
| Triton X-100 | Sigma | Cat# T8787 | |
| Trypsin 0.25% EDTA | Gibco | Cat# 25200072 | |
| Universal SYBR Green Supermix | BIO-RAD | Cat# 172-5124 | |
| Plasticware | |||
| MACS LS Columns | Miltenyi Biotec | Cat# 130-042-401 | |
| Equipment | |||
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | Cat# AMQAF1000 | |
| EVOS XL core imaging system | Thermo Fisher Scientific | Serial Number F0518-1727-0191 | |
| LAS X software | Leica Microsystems | ||
| Leica fluorescent inverted microscope | s | DMi8 automated S/N 424150) | |
| Midi MACS separator | Miltenyi Biotec | Cat# 130-042-302 |
Referenzen
- Kim, N., et al. Single-cell RNA sequencing demonstrates the molecular and cellular reprogramming of metastatic lung adenocarcinoma. Nature Communications. 11 (1), 1-5 (2020).
- Davidson, S., et al. Single-cell RNA sequencing reveals a dynamic stromal niche that supports tumor growth. Cell Reports. 31 (7), 107628 (2020).
- Zhang, Y., et al. Single-cell analyses of renal cell cancers reveal insights into tumor microenvironment, cell of origin, and therapy response. Proceedings of the National Academy of Sciences. 118 (24), (2021).
- Bray, L. J., Hutmacher, D. W., Bock, N. Addressing patient specificity in the engineering of tumor models. Frontiers in Bioengineering and Biotechnology. 7, 217 (2019).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Tissue Engineering. , 141-151 (2007).
- Dituri, F., et al. Complex tumor spheroid formation and one-step cancer-associated fibroblasts purification from hepatocellular carcinoma tissue promoted by inorganic surface topography. Nanomaterials. 11 (12), 3233 (2021).
- Arora, L., et al. Development of a multicellular 3D tumor model to study cellular heterogeneity and plasticity in NSCLC tumor microenvironment. Frontiers in Oncology. 12, 881207 (2022).
- Nurmik, M., Ullmann, P., Rodriguez, F., Haan, S., Letellier, E. In search of definitions: Cancer-associated fibroblasts and their markers. International Journal of Cancer. 146 (4), 895-905 (2020).
- Zhang, Y., et al. HIF-1α is necessary for activation and tumour-promotion effect of cancer-associated fibroblasts in lung cancer. Journal of Cellular and Molecular Medicine. 25 (12), 5457-5469 (2021).
- Bu, L., et al. Biological heterogeneity and versatility of cancer-associated fibroblasts in the tumor microenvironment. Oncogene. 38 (25), 4887-4901 (2019).
- Whitaker-Menezes, D., et al. Evidence for a stromal-epithelial "lactate shuttle" in human tumors: MCT4 is a marker of oxidative stress in cancer-associated fibroblasts. Cell cycle. 10 (11), 1772-1783 (2011).
- Mandujano-Tinoco, E. A., Gallardo-Pérez, J. C., Marín-Hernández, A., Moreno-Sánchez, R., Rodríguez-Enríquez, S. Anti-mitochondrial therapy in human breast cancer multi-cellular spheroids. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research. 1833 (3), 541-551 (2013).
- Bregman, A. A. . Laboratory Investigations in Cell and Molecular Biology. , (2002).
- Berry, E. A., Trumpower, B. L. Simultaneous determination of hemes a, b, and c from pyridine hemochrome spectra. Analytical Biochemistry. 161 (1), 1-15 (1987).
- Avagliano, A., et al. Metabolic reprogramming of cancer associated fibroblasts: the slavery of stromal fibroblasts. BioMed Research International. , (2018).
- Lorusso, G., Rüegg, C. The tumor microenvironment and its contribution to tumor evolution toward metastasis. Histochemistry and Cell Biology. 130 (6), 1091-1103 (2008).
- Liu, T., Zhou, L., Li, D., Andl, T., Zhang, Y. Cancer-associated fibroblasts build and secure the tumor microenvironment. Frontiers in Cell and Developmental Biology. 7, 60 (2019).
- Sebastian, A., et al. Single-cell transcriptomic analysis of tumor-derived fibroblasts and normal tissue-resident fibroblasts reveals fibroblast heterogeneity in breast cancer. Cancers. 12 (5), 1307 (2020).
- Elyada, E., et al. Cross-species single-cell analysis of pancreatic ductal adenocarcinoma reveals antigen-presenting cancer-associated fibroblasts. Cancer Discovery. 9 (8), 1102-1123 (2019).
- Ganguly, D., et al. Cancer-associated fibroblasts: Versatile players in the tumor microenvironment. Cancers. 12 (9), 2652 (2020).
- Harryvan, T. J., Verdegaal, E. M., Hardwick, J. C., Hawinkels, L. J., vander Burg, S. H. Targeting of the cancer-associated fibroblast-T-cell axis in solid malignancies. Journal of Clinical Medicine. 8 (11), 1989 (2019).
- Santi, A., Kugeratski, F. G., Zanivan, S. Cancer associated fibroblasts: the architects of stroma remodeling. Proteomics. 18 (5-6), 1700167 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten