A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הערכה של בריאות המיטוכונדריה בפיברובלסטים הקשורים לסרטן שבודדו מספרואידים של גידולי ריאה רב-תאיים תלת-ממדיים
* These authors contributed equally
In This Article
Summary
ספרואידים רב-תאיים של גידולים תלת-ממדיים הוכנו עם תאי אדנוקרצינומה של הריאה, פיברובלסטים ומונוציטים, ולאחר מכן בידוד של פיברובלסטים הקשורים לסרטן (CAFs) מהספרואידים האלה. CAFs מבודדים הושוו לפיברובלסטים רגילים כדי להעריך את בריאות המיטוכונדריה על-ידי חקירת הפוטנציאל הטרנס-ממברני של המיטוכונדריה, מיני חמצן תגובתי ופעילויות אנזימטיות.
Abstract
פיברובלסטים הקשורים לסרטן (CAFs) הם בין התאים הסטרומליים הנפוצים ביותר הקיימים במיקרו-סביבה של הגידול, מה שמקל על צמיחת הגידול והתקדמותו. המורכבות בתוך המיקרו-סביבה של הגידול, כולל הפרשת הגידול, דלקת בדרגה נמוכה, היפוקסיה וחוסר איזון חמצון-חיזור, מעודדת אינטראקציה הטרוטיפית ומאפשרת לטרנספורמציה של פיברובלסטים לא פעילים להפוך ל-CAFs פעילים. CAFs נבדלים מטבולית מפיברובלסטים רגילים (NFs) מכיוון שהם פעילים יותר מבחינה גליקוליטית, מייצרים רמות גבוהות יותר של מיני חמצן תגובתי (ROS), ויצואן לקטט בעל ביטוי יתר MCT-4, מה שמוביל לפתיחת נקבובית המעבר לחדירות מיטוכונדריאלית (MPTP). כאן תוארה שיטה לניתוח בריאות המיטוכונדריה של CAFs פעילים שבודדו מהספרואידים הרב-תאיים של גידולים תלת-ממדיים המורכבים מתאי אדנוקרצינומה של ריאה אנושית (A549), מונוציטים אנושיים (THP-1) ותאי פיברובלסטים של ריאה אנושית (MRC5). ספרואידים סרטניים התפרקו במרווחי זמן שונים ובאמצעות מיון תאים המופעל על ידי מגנט, CAFs בודדו. פוטנציאל הממברנה המיטוכונדריאלית של CAFs הוערך באמצעות צביעת JC-1, ייצור ROS על ידי צביעת 2',7'-dichlorodihydrofluorescein diacetate (DCFDA) ופעילות אנזים ב-CAFs המבודדים. ניתוח בריאות המיטוכונדריה של CAFs מבודדים מספק הבנה טובה יותר של אפקט ורבורג ההפוך וניתן ליישם אותו גם כדי לחקור את ההשלכות של שינויים מיטוכונדריאליים של CAF, כגון שטפי חילוף החומרים והמנגנונים הרגולטוריים המתאימים על הטרוגניות סרטן הריאות. לפיכך, המחקר הנוכחי דוגל בהבנה של אינטראקציות גידול-סטרומה על בריאות המיטוכונדריה. היא תספק פלטפורמה לבדיקת מועמדים לתרופות ספציפיות למיטוכונדריה על יעילותן מול CAFs כטיפולים פוטנציאליים במיקרו-סביבה של הגידול, ובכך למנוע מעורבות CAF בהתקדמות סרטן הריאות.
Introduction
גידולים מוצקים מורכבים מאוכלוסיות תאים הטרוגניות אשר מונחות על ידי מיקרו-סביבה של הגידול (TME), אולם מקורם של רוב התאים טרם התגלה. בעיקר תאים סטרומליים ותאי חיסון (פיברובלסטים, תאי אנדותל, מונוציטים, מקרופאגים, תאים דנדריטיים, תאי B, תאי T ותת-הקבוצות שלהם) משקפים את ההטרוגניות של הגידול בסרטן הריאה, השד, הכליות וסוגי סרטן מוצקים אחרים 1,2,3. הבנת מקורו של כל תת-סוג ופוטנציאל הטרנס-דיפרנציאציה שלו היא בעלת צורך עליון בפיתוח טיפולים מתקדמים נגד סוגי סרטן אלה. הניתוח של אוכלוסיית תאים מגוונת זו בביופסיות אנושיות מציב בפניו מספר אתגרים בגלל סוג הגידול, האתר, השלב, הגבלת כמות הדגימה, והשונות הספציפית למטופל4. לפיכך, יש צורך במודל ניסיוני, שהוא לא רק אמין אלא יכול גם לדמות את מצב הגידול in vivo, ולהוכיח את עצמו כאידיאלי לחקר הצלבת גידול-סטרומה ומעורבותו בפתופיזיולוגיה של מחלות.
תרביות תלת-ממדיות (3D) של גידולים רב-תאיים (MCTS) הן מערכת מודלים חוץ-גופית של גידולים בשל הדמיון שלהם למקביליהם הטבעיים. MCTS יכול לשכפל טוב יותר היבטים של גידולים מוצקים מאשר מודלים של תרביות תאים דו-ממדיות, כולל הארכיטקטורה המרחבית שלהם, תגובות פיזיולוגיות, שחרור מתווכים מסיסים, דפוסי ביטוי גנים ומנגנוני עמידות לתרופות. יתר על כן, אחד היתרונות העיקריים של MCTS הוא שניתן להשתמש בו כדי לחקור את ההטרוגניות של הגידול ואת המיקרו-סביבה של הגידול (TME). שיטת התלייה-טיפה היא הכלי הנפוץ ביותר לפיתוח וניתוח MCTS5. בשיטה זו, התאים השונים עם המדיה תלויים בצורה של טיפות, המאפשרת את צמיחתה בצורה מצרפית תלת-ממדית קוהרנטית ופשוטה לגישה לבדיקה. הטכניקה פשוטה; זה לא דורש תאים רבים ומבטל את הדרישה של מצע מיוחד כמו agarose לפיתוח ספרואידים6. יתרון נוסף של שיטה זו טמון בשחזור הטכניקה שלה. יתר על כן, שיטה זו שימשה גם לתרבית משותפת של אוכלוסיות תאים מעורבים, כגון תאי אנדותל ותאי גידול, כדי לדמות אנגיוגנזה מוקדמת של הגידול7.
במחקר זה הוכנו ספרואידים תלת-ממדיים של גידולי ריאה רב-תאיים עם תאי אדנוקרצינומה של הריאה, פיברובלסטים ומונוציטים בשיטת הטיפה התלויה, המחקה את המיקרו-סביבה של גידולי הריאה. לאחר מכן בודדה אוכלוסיית הפיברובלסטים הקשורים לסרטן (CAF) כדי לחקור את בריאות המיטוכונדריה. הרעיון המרכזי מאחורי פיתוח הספרואידים האלה הוא לבודד את ה-CAFs, שכן ההצלבה בין התאים בספרואידים יכולה להפוך את הפיברובלסטים למצב CAF מופעל דמוי מיו-פיברובלסט. שנית, מחקר זה עשוי גם לתאר כיצד ייצור חריג של ROS ותפקוד לקוי של המיטוכונדריה מניעים את הפיברובלסטים הרגילים לעבר פנוטיפ CAF אגרסיבי יותר. נמצא כי פיברובלסטים המורכבים בתוך ספרואידים סרטניים קיבלו מאפיינים מיופיברובלסטיים עם פעילות ROS מוגברת והשראת ביטוי גנים מטבוליים. פרוטוקול זה מדגיש את החשיבות של מיקרו-סביבה של הגידול בהפעלת CAF ויכול להיות מודל מצוין לייצור במבחנה ולחקר מאפיינים פנוטיפיים של CAF.
Protocol
1. תרבית תאים
- תרבית ריאה אנושית אדנוקרצינומה קו תאי A549, וקו תאים מונוציטים אנושיים THP-1 במדיה RPMI1640 בתוספת 10% FBS ו-1% פניצילין-סטרפטומיצין בטמפרטורה של 37 מעלות צלזיוס בתא לח עם 5% CO2.
- תרבית MRC-5 תאי פיברובלסט של ריאה אנושית במדיום DMEM בתוספת 10% FBS ותמיסת פניצילין-סטרפטומיצין בטמפרטורה של 37 מעלות צלזיוס בחדר לח עם 5% CO2.
2. הכנת ספרואידים סרטניים רב-תאיים באמצעות קו תאי אדנוקרצינומה ריאה A549, פיברובלסטים MRC5 ומונוציטים THP-1
הערה: הספרואידים התלת-ממדיים הרב-תאיים והלא-סרטניים הוכנו בשיטת הטיפה התלויה בצלחת תרבית תאים בקוטר 90 מ"מ. תיאור מפורט של התפתחות הספרואידים הללו מובא להלן. יש לחמם מראש את כל הריאגנטים של תרביות תאים, כגון מדיום שלם, PBS ותמיסת טריפסין-EDTA של 0.25% לפני השימוש, אלא אם כן צוין אחרת.
- הכנת השעיית התא
- לגדל תאים דבקים A549 ו-MRC5 (5 x 106 תאים כל אחד) במדיום גדילה מלא של DMEM (מדיום הנשר המעובד של דולבקו [DMEM] + 10% סרום בקר עוברי [FBS] + 1% פניצילין-סטרפטומיצין) בבקבוקי T25 בטמפרטורה של 37 מעלות צלזיוס בתא לח עם 5% CO2.
- עבור תאי THP-1, הגדל את תרחיף התאים (5 x 106 תאים ) במדיום גדילה מלא (RPMI1640 + 10% FBS + 1% פניצילין-סטרפטומיצין) בבקבוקי T25. לצמיחה טובה יותר, מקם את צלוחיות T25 בטמפרטורה של 37 מעלות צלזיוס בתא לח עם 5% CO2 במצב עמידה.
- לאחר 3 ימים, בטמפרטורה של 80%-85%, שטפו את תאי A549 ו-MRC5 עם PBS (מלח פוספט) נטול סידן ומגנזיום על ידי הוספת 1 מ"ל של PBS (25-30 מעלות צלזיוס) בכל בקבוקון למשך דקה אחת ושאיפתו.
- קצור את תאי A549 ו- MRC5 מהבקבוקון על ידי דגירה שלהם עם 500 μL של תמיסת טריפסין-EDTA של 0.25% למשך 5 דקות ב 37 °C באינקובטור לח עם 5% CO2. מיד לאחר מכן, הוסף 4 מ"ל של מדיית צמיחה מלאה כדי להשבית את הטריפסין.
- אסוף את מתלה התא מבקבוק T25 לתוך צינור 15 מ"ל וגלגל אותו למטה ב 125 x g במשך 5 דקות. הסר את supernatant ו resuse את התאים ב 5 מ"ל של מדיום צמיחה מלאה.
- הקמת ספרואידים סרטניים רב תאיים
הערה: כל השלבים של היווצרות הספרואידים של הגידול צריכים להתבצע בתוך ארון הבטיחות הביולוגית על מנת לשמור על תנאים סטריליים. הנפח המרבי של השעיית התא תוקן כטיפה של 25 μL כדי להכין טיפה כך שהיא לא תיפול למטה בעת היפוך המכסים.- ספירת מספרי תאים A549, MRC5 ו- THP-1 באמצעות מונה תאים. עבור כל טיפת ספרואידים (25 μL) שמור על מספרי התאים הבאים: 5,000 תאי A549, 4,000 תאי MRC5 ו-1,000 תאי THP-1, בהתאם לפרוטוקול שתואר על ידי Arora et al.7. חשב את מספרי התאים בהתאם עבור נפח של 1 מ"ל.
הערה: הספרואידים הוכנו בתחילה עם שלוש ספירות תאים שונות לכל ספרואיד (כלומר, 5000, 8000 ו-10,000). כמו כן, נבדקו יחסי תאים שונים של תאי גידול/פיברובלסטים/מונוציטים (1:1:1, 2:2:1, 4:2:1, 5:2:1 ו-5:4:1). לבסוף, נצפתה יצירת ספרואידים רב-תאית תלת-ממדית מוצלחת ביחס של 5:4:1 ושימשה למחקר. ריכוז הפיברובלסטים הוגדל בהתבסס על חלקו במיקרו-סביבה של הגידול, מה שהגביר עוד יותר את קשיחות הספרואידים של הגידול. הנוהל המפורט דווח בפרסום שפורסם לאחרונה על ידי Arora et al.7. - הכן את תרחיף התאים ביחס של 5 (A549, 2 x 10 5 תאים למ"ל) ל-4 (MRC5, 1.6 x 10 5 תאים/מ"ל) ל-1 (THP-1, 5 x 104 תאים/מ"ל) והשלם את הנפח ל-1 מ"ל עם DMEM מלא.
- הניחו טיפה של 25 μL של תערובת תרחיף תאים על הכיסוי של צלחת תרבית בקוטר 90 מ"מ (כ-50 טיפות/צלחת בקוטר 90 מ"מ). ממלאים את החלק התחתון של צלחת תרבית 90 מ"מ עם 10 מ"ל של מים סטריליים.
- בזהירות להפוך את המכסה מעל תא הידרציה מלא במים ומניחים את המנה באינקובטור תרבית תאים במשך 3 ימים.
- עקוב אחר הספרואידים מתחת למיקרוסקופ בהגדלה של פי 10 ביום 4. כדי להשיג תמונות, הפעל את מתג ההפעלה, הנח את צלחת ה- 60 מ"מ בזהירות על הבמה ובחר את ההגדלה (10x). התאימו את העדשות ובחנו את התאים כדי לנתח את צבירת התאים והתפשטותם. לחץ על הלחצנים הקפאה ושמירה המופיעים במיקרוסקופ כדי ללכוד את התמונה.
- שנה את מדיית הצמיחה ביום הרביעי על ידי שאיפה זהירה של 20 מיקרון לליטר של מדיום מכל טיפה והחלפתה במדיום צמיחה שלם ורענן.
- ספירת מספרי תאים A549, MRC5 ו- THP-1 באמצעות מונה תאים. עבור כל טיפת ספרואידים (25 μL) שמור על מספרי התאים הבאים: 5,000 תאי A549, 4,000 תאי MRC5 ו-1,000 תאי THP-1, בהתאם לפרוטוקול שתואר על ידי Arora et al.7. חשב את מספרי התאים בהתאם עבור נפח של 1 מ"ל.
3. ניתוח חי ומת של ספרואידים סרטניים
- ביום 7 וביום ה-10, הפכו בזהירות את צלחת ה-90 מ"מ בארון הביו-ספטי והשתמשו בפיפטה של 200 מיקרו-ליטר כדי לאסוף ספרואידים מכל טיפה. לאסוף חמישה spheroids כל אחד בצינור 1.5 מ"ל.
- הוסף 500 μL של 1x PBS לצינור 1.5 מ"ל המכיל ספרואידים וצנטריפוגה ב 125 x g במשך 5 דקות. השליכו בזהירות את הסופר-נאטנט והחזירו את הספרואידים ב-200 μL של PBS אחד. אין לקטר בקפדנות כדי למנוע התפוררות ספרואידים.
- הוציאו את הספרואידים באמצעות פיפטה של 200 μL על צלחת בקוטר 60 מ"מ להכתמת קלצין-AM ופרופידיום יודיד.
- שים 5 μL של 1 μM calcein-AM תמיסה ו 5 μL של 2 מ"ג / מ"ל פרופידיום יודיד פתרון על הספרואידים. דגירה במשך 10 דקות. לאחר סיום תקופת הדגירה, יש לשטוף את הספרואידים בעדינות עם PBS 1x פעמיים.
- הניחו את צלחת ה-60 מ"מ המכילה ספרואידים מתחת למיקרוסקופ ההפוך הפלואורסצנטי, צפו ותפסו תמונות בהגדלה של פי 10 על ידי בחירת אפשרות הפלואורסצנציה בתוכנת המיקרוסקופ ובחירת FITC (ערוץ פלואורסצנציה ירוק; עירור 490 ננומטר, פליטה 515 ננומטר) עבור קלצ'ין ותעלה אדומה טקסס (TXR; עירור 535 ננומטר, פליטה 617 ננומטר).
- לרכישת התמונה, הפעל את Ctr Adv, שהוא מתג 1, ואחריו הפעלת המעבד. המתן עד שמערכת התוכנה תאתחל. בעת האתחול, הנח את צלחת ה- 60 מ"מ בזהירות על הבמה ובחר את ההגדלה (10x) ואת ערוצי הפלואורסצנט (FITC, TXR). התאם את העדשות וסרוק את התמונה.
- כדי להציג את התמונה במערכת, בחר באפשרות Live והצג את התמונה. התאם את עוצמת הפלואורסצנציה לאופטימיזציה מתאימה. שמור את התמונה על ידי לחיצה על להציל לחצן.
הערה: בשלב זה, ספרואידים יהיו גלויים דרך העין בלתי מזוינת. תחת מיקרוסקופ האור, ספרואידים יופיעו ככדורים עגולים וקשיחים בהגדלה של פי 10. ניתן לאסוף ספרואידים מרובים בבת אחת באמצעות פיפטה של 200 μL.
4. התפוררות והשעיית תאים של ספרואידים סרטניים
- אסוף 200 ספרואידים סרטניים כל אחד ביום 7 ו -10, באמצעות פיפטה של 1 מ"ל בצינור של 15 מ"ל.
הערה: לפני האיסוף, בדוק היטב את הצורה והצורה של ספרואיד יחיד לאחר העברתו לשקופית מיקרוסקופית או על צלחת 30 מ"מ והתבונן מתחת למיקרוסקופ. - גלולו את הספרואידים על ידי צנטריפוגה ב 125 x גרם במשך 5 דקות. שאפו את הסופרנטנט בזהירות מבלי להפריע לספרואידים של הגידול.
- שטפו בזהירות את הספרואידים עם 200 μL של PBS, צנטריפוגה בגודל 125 x g למשך 5 דקות, והשליכו בזהירות את הסופרנטנט.
- להתפרקות הספרואידים, יש להוסיף 400 μL של תמיסת טריפסין-EDTA של 0.25% ולשמור על טמפרטורה של 37 מעלות צלזיוס למשך 10 דקות. בצע פיפטינג נמרץ להתפוררות מוחלטת של הספרואידים.
- נטרול טריפסין על ידי הוספת 1 מ"ל של מדיום גידול DMEM מלא. צנטריפוגה ב 125 x גרם במשך 5 דקות ולהשליך את supernatant בזהירות.
- יש להשעות את הכדור ב-1 מ"ל של מדיום DMEM שלם ולספור את המספר הכולל של התאים.
5. בידוד פיברובלסטים הקשורים לסרטן (CAF) באמצעות מיקרובים
- לבידוד של CAFs מהספרואידים של הגידול, יש לתלות 1 x 10 7 תאים ב-80 μL של חיץמיון תאים מופעל מגנטית קרה (MACS) (PBS ב-pH 7.2 המכיל 0.5% אלבומין בסרום בקר [BSA] ו-2 mM חומצה טטראצטית אתילנדיאמין [EDTA]).
- דגירה של תרחיף התא (המכיל 1 x 107 תאים ) עם 20 μL של מיקרובים אנטי-פיברובלסטים. מערבבים היטב על ידי הקשה עדינה על הצינור ודגירה במשך 30 דקות בטמפרטורת החדר.
- לשטוף את התאים עם 1 מ"ל של חיץ MACS קר, צנטריפוגה ב 125 x גרם במשך 5 דקות, ולשאף את supernatant. השהה את התאים ב-500 μL של מאגר MACS.
- להפרדת תאים מבוססת חרוזים מגנטיים, הכינו את עמודת ה-MACS על ידי שטיפתה עם 3 מ"ל של מאגר MACS.
- מקם את מתלה התא בעמודה ואחריו אוסף של זרימה דרך המכיל את אוכלוסיית התאים ללא תווית.
- לשטוף את העמודה שלוש פעמים עם 3 מ"ל של מאגר MACS. הסר את העמודה מהמפריד והנח אותה על צינור האיסוף.
- אסוף את התאים המסומנים במיקרובורדים נגד פיברובלסטים על ידי הוספת 5 מ"ל של חיץ MACS ודחיפת הבוכנה בחוזקה לתוך העמודה.
- צנטריפוגה של התאים המסומנים ב 125 x גרם במשך 5 דקות. המשך עם הפיברובלסטים המבודדים עבור יישומים במורד הזרם.
6. ניתוח מבוסס ציטומטריה של זרימה של ביטוי ACTA2 ב- CAFs מבודדים
- ספרו את מספר ה-CAFs המבודדים והשתמשו בכ-6 x 104 תאים . לשטוף את התאים פעם אחת עם PBS, צנטריפוגה ב 125 x גרם במשך 5 דקות, ולשאוף supernatant.
- הוסף 100 μL של מאגר חלחול התא (PBS + 0.5% BSA + 0.3% v/v Triton X-100) ודגירה של התאים ב 4 °C במשך 30 דקות.
- מערבבים את התאים לסירוגין כדי לשמור על תרחיף של תא בודד. צנטריפוגה וחידוש התאים ב-100 μL של מאגר חלחול תאים.
- יש להוסיף 2 μL של נוגדן α-SMA אנטי-אנושי מצומד APC ולדגור ב-4 מעלות צלזיוס למשך 45 דקות. לאחר הדגירה, יש להוסיף 1 מ"ל של חיץ חלחול וצנטריפוגה ב-125 x g למשך 5 דקות כדי להסיר נוגדנים עודפים.
- יש לתלות את הכדור ב-400 μL של מאגר חלחול לצורך ניתוח ציטומטרי של זרימה. רכוש סך של 10,000 אירועים של כל דגימה בציטומטר זרימה. בחר תאים חיוביים של ACTA2 לאחר הבחנה בין אוכלוסיות התאים בהתבסס על הפיזור הקדמי והצדדי שלהם, בחירת אוכלוסיית הסינגלט ולאחר מכן בחירת התאים החיוביים של ACTA2 המופיעים כשיא יחיד בהיסטוגרמה של פרמטר יחיד.
7. צביעת JC-1 לקביעת פוטנציאל קרום המיטוכונדריה
- ספרו את מספר ה-CAFs המבודדים והשתמשו בכ-6 x 104 תאים עבור 5,5,6,6'-טטרהכלורו-1,1',3,3' tetraethylbenzimi-dazoylcarbocyanine יודיד (JC-1) מכתים באמצעות ציטומטריה של זרימה.
- שטפו את התאים ביסודיות עם PBS, צנטריפוגה בגודל 125 x גרם למשך 5 דקות, שאפו את הסופר-נאטנט והוסיפו 100 μL של חיץ מכתים תאים.
- יש להוסיף צבע JC-1 בריכוז עבודה של 2 מיקרומטר ולדגור בטמפרטורת החדר למשך 30 דקות. עם סיום הדגירה, לשטוף את התאים עם PBS, צנטריפוגה ב 125 x גרם במשך 5 דקות, ו resuse בנפח סופי של 400 μL.
- רכוש סך של 20,000 אירועים של כל דגימה בציטומטר זרימה. כמת את פוטנציאל הממברנה המיטוכונדריאלית על-ידי מדידת אגרגטים JC-1 עם הזזה אדומה בערוץ FL-2 והמונומרים המוזרזים בירוק בערוץ FL-1.
8. מכתים DCFDA כדי להעריך את רמות החמצן הריאקטיבי התאי (ROS)
- השתמש בכל הספרואידים (50 מספרים) כמו גם ב- CAFs המבודדים (6 x 104 תאים ) מהספרואידים עבור צביעה של 2',7'-dichlorodihydrofluorescein diacetate (DCFDA).
- שטפו את התאים ביסודיות עם PBS, צנטריפוגה בגודל 125 x גרם למשך 5 דקות, שאפו את הסופר-נאטנט והוסיפו 100 μL של חיץ מכתים תאים.
- יש להוסיף צבע DCFDA בריכוז עבודה של 1 μM ולדגור בטמפרטורת החדר למשך 30 דקות. לשטוף את התאים פעמיים עם PBS, צנטריפוגה ב 125 x גרם במשך 5 דקות, ולאחר מכן ressuped בנפח סופי של 400 μL.
- רכוש סך של 20,000 אירועים של כל דגימה בציטומטר זרימה. הערך את רמות ה- ROS על ידי מדידת הפלואורסצנציה ביום 7 וביום 10 עבור הספרואידים, כמו גם עבור ה- CAFs המבודדים.
9. ניתוח RT-qPCR של סמני CAF וגנים גליקוליטיים
- חלץ RNA מה- CAFs הממוינים באמצעות ערכת תסיסה חד-תאית בהתאם לפרוטוקול היצרן. הכן cDNA מ-100 ננוגרם של RNA באמצעות ערכת סינתזה של cDNA בהתאם להנחיות היצרן.
- בצע RT-qPCR כדי לנתח את סמני ה-CAF היחסיים (ACTA2 8 ו-COL1A29) ואת ביטוי הגן הגליקוליטי (GLUT1 10 ו-MCT411). בצע ניתוח עקומת התכה לאחר ההרחבה הסופית כדי להבטיח את הספציפיות של המוצרים. לנרמל את הנתונים באמצעות הביטוי של GAPDH כגן הייחוס. רצפי הפריימרים המשמשים עבור RT-qPCR מפורטים בטבלה משלימה 1.
10. מיצוי וכימות החלבון התאי מ-CAFs
הערה: בצע את כל השלבים של מיצוי חלבון על קרח כדי למנוע פירוק חלבון.
- יש להשתמש בכ-4 x 106 תאי CAF ב-100 מיקרו-ליטר של חיץ ליזה RIPA קר כקרח (המכיל 30 mM HEPES, 150 mM NaCl, 1% NP-40, 0.1% SDS ו-0.5% נתרן דאוקסיכולאט עם 5 mM של קוקטייל מעכבי פרוטאז ופוספטאז, ו-5 mM של EDTA ב-pH 7.4).
- מערבולת בקפדנות לתזה נכונה של תאים. סוניקו את מתלה התא בתדר 20 הרץ, משרעת של 20% למשך 15 שניות ופולס פי 3.
- לאחר סוניקציה, צנטריפוגה תמצית חלבון ב 13,000 x גרם במשך 15 דקות ב 4 מעלות צלזיוס. העבירו את הסופרנטנט לצינור מקורר מראש של 1.5 מ"ל. בצעו את בדיקת חלבון ה-BCA כדי לכמת חלבון.
11. ניתוח ספקטרופוטומטרי של פעילויות אנזימטיות ב- CAFs
הערה: פעילויות האנזים הבאות מנותחות ב-CAFs שמקורם בכדוריות גידוליות.
- מדידת פעילות סוקסינט דהידרוגנאז
- כדי להעריך את הפעילות של סוקצינאט דהידרוגנאז (SDH) ב-CAFs, הכינו חיץ SHE עם סוכרוז של 250 mM, 10 mM 4-(2-הידרוקסיאתיל)-1-פיפרזינהאתאנסולפונית חומצה (HEPES), ו-1 mM אתילן גליקול-ביס(β-אמינואתיל אתר)-N,N,N′,N′-חומצה טטראאצטית (EGTA) והתאימו את ה-pH ל-7.3. יש להוסיף 0.4 mM פנזין מתוקסולפט (PMS), 0.2 mM 2,6-דיכלורואינדופנול (DCPIP), 50 mM MgCl2, 0.02% טריטון X-100 וציאניד 1 mM במאגר SHE ולשמור על טמפרטורה של 37 °C.
- חלצו את החלבון התאי מה-CAFs כמתואר בשלב 10 (2 x 106 תאים ). בכל באר של צלחת 96 באר, לדגור 100 μL של 0.1 מ"ג חלבון תאי עם 100 μL של תערובת תגובה SHE ב 37 מעלות צלזיוס במשך 15 דקות.
- כדי להתחיל את הפעילות האנזימטית, הוסף 10 mM succinate12. חשב את פעילות האנזים ב-nM/min/mL על-ידי מדידת השינויים בספיגה ב-600 ננומטר.
- מקדם ההמרה של DCIP הוא 0.0215 A/nM בהתבסס על מקדם ההכחדה הטוחנות שלו12. חשב את הפעילות היחסית של SDH באמצעות הנוסחה שהוזכרה:
פעילות יחסית (nM/min/mL/אנזים) =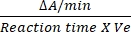 X
X  X V
X V
כאשר ΔA/min = קצב התגובה האנזימטית (A ראשוני- A סופי)/(זמןסופי -A/min ראשוני), Ve = נפח הדגימה, ו- V = נפח התגובה.
- הערכה של פעילות ציטוכרום c אוקסידאז
- כדי להעריך את פעילות הציטוכרום c אוקסידאז (COX) ב-CAFs, יש להוסיף 0.2 מ"ג/מ"ל של חלבון תאי בתמיסת מאגר תגובה של KME המכילה חיץ KME (125 mM KCl, 20 mM 3-(N-morpholino)פרופאן חומצה סולפונית [MOPS], ו-1 mM EGTA, pH 7.4), 0.02% Triton X-100 ו-5 mM נתרן אסקורבט.
- בצינור נפרד, יש לערבב ציטוכרום c של לב סוס 50 μM עם נתרן אסקורבט של 5 mM ולדגור בטמפרטורה של 37 מעלות צלזיוס למשך 5 דקות13. לאחר הדגירה, יש להוסיף 20 μL של ציטוכרום c מופחת ל-500 μL של תמיסת מאגר התגובה KME המכילה חלבון תאי.
- חשב את פעילות האנזים ביחידות/μL על-ידי מדידת השינויים בספיגה ב-550 ננומטר. ספיגת הציטוכרום c ב-550 ננומטר משתנה עם מצב החמצון שלו. ההבדל במקדמי הכחדה (mM) בין ציטוכרום c מופחת ומחומצן הוא 21.84 ב-550 ננומטר14. חשב את כמות פעילות האנזים בליזאט התאי כ:
יחידות/μL =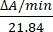
כאשר ΔA/min = A/minדגימה-A/minריק ו-21.84 = ΔԑmM בין ציטוכרום c מחומצן וציטוכרום c מופחת ב-550 ננומטר
- הערכה של פעילות לקטט דהידרוגנאז
- בצע בדיקת לקטט דהידרוגנאז (LDH) באמצעות ערכת בדיקה של תאי לקטט דהידרוגנאז בהתאם להוראות היצרן.
- הוסף מגיב בדיקת LDH (10 μL) ל-0.5 מ"ג/מ"ל של חלבונים תאיים ודגירה במשך 5 דקות ב-37 מעלות צלזיוס. עם סיום הדגירה, מדוד את הספיגה ב 45 ננומטר כל 1 דקה במשך 8 דקות.
- הכן את תקני NADH לזיהוי צבעים באמצעות 0 (ריק), 2.5, 5, 7.5, 10 ו- 12.5 ננומטר/באר של NADH ולאחר מכן הוספת מגיב בדיקת LDH לנפח סופי של 50 μL.
- התווה את ההבדלים בספיגה ביןT ראשוני ל- T סופי לעקומה הסטנדרטית של NADH כדי לקבוע את כמות יצירת NADH. הערך את הפעילות של LDH באמצעות הנוסחה שהוזכרה:
פעילות LDH =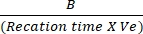 גורם דילול מדגם X
גורם דילול מדגם X
כאשר B = כמות (nmole) של NADH שנוצרת ביןT ראשוני ל- Tסופי, זמן תגובה = Tסופי - Tראשוני (דקות), ו- Ve = נפח דגימה (mL) נוסף היטב.
תוצאות
איור 1 מראה התפתחות של ספרואידים סרטניים רב-תאיים באמצעות שלוש אוכלוסיות תאים שונות - A549 (אדנוקרצינומה של הריאה), MRC-5 (פיברובלסטים) ו-THP-1 (מונוציטים) - בשיטת הטיפה התלויה כפי שנצפתה ביום 7 וביום 10 תחת המיקרוסקופ. ביום השביעי, הספרואידים היו קומפקטיים ונוקשים בקוטר של 260 ± 5.3 מיקר...
Discussion
המחקר הנוכחי מציג את התפתחותם של ספרואידים סרטניים רב-תאיים הכוללים תאי גידול, אוכלוסיית תאים סטרומליים (כלומר, פיברובלסטים) ואוכלוסיית תאי מערכת החיסון (כלומר, מונוציטים) בשיטת טיפה תלויה שונה. פיברובלסטים ומונוציטים/מקרופאגים הם בין האוכלוסיות המשמעותיות ביותר המהוות את המיקרו-סביבה ש...
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי פרויקט פרס המצוינות של SERB-Women, הודו (SB/WEA-02/2017) ופרויקט פרס SERB-Early Career Research, הודו (ECR/2017/000892) ל-DP. המחברים, LA ו-SR מודים ל-IIT Ropar ול-MHRD על מלגות המחקר שלהם. ח"כ מודה ל-ICMR על מלגת המחקר שלה.
Materials
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| APC anti-human α-SMA | R&D systems | Cat# IC1420A | |
| Anti-fibroblast microbeads | Miltenyi Biotec | Cat# 130-050-601 | |
| Cell lines | |||
| A549 lung adenocarcinoma cells | NCCS Pune | - | |
| MRC-5 fetal lung fibroblasts | ATCC | CCL-171 | |
| THP-1 Human monocytes | NCCS Pune | - | |
| Chemicals | |||
| BSA | Himedia | Cat# 9048-46-8 | |
| 2,6-dichloroindophenol (DCPIP) | SRL | Cat# 55287 | |
| Calcein-AM | Thermo Fisher Scientific | Cat# C3099 | |
| DAPI | Thermo Fisher Scientific | Cat# D1306 | |
| DCFDA | Sigma | Cat# D6883 | |
| DMEM | Gibco | Cat# 11995073 | |
| DPBS | Gibco | Cat# 14190-144 | |
| EDTA | Thermo fisher scientific | Cat# 17892 | |
| EGTA | SRL | Cat# 62858 | |
| EZcoun Lactate Dehydrogenase Cell Assay Kit | HiMedia | Cat# CCK036 | |
| FBS | Gibco | Cat# 10082147 | |
| Halt Protease and Phosphatase Inhibitor Cocktail (100X) | Thermo Fisher Scientific | Cat# 87786 | |
| HEPES | Thermo Fisher Scientific | Cat# 15630080 | |
| Horse heart Cytochrome c | SRL | Cat# 81551 | |
| Image-iT Red hypoxia reagent | Thermo Fisher Scientific | Cat# H10498 | |
| JC-1 Dye | Thermo Fisher Scientific | Cat# T3168 | |
| KCl | Merck | Cat# P9541 | |
| MgCl2 | Merck | Cat# M8266 | |
| MOPS | Thermo Fisher Scientific | Cat# 69824 | |
| Nacl | Sigma-Aldrich | Cat# S9888 | |
| NADH MB Grade | SRL | Cat# 54941 | |
| NP-40 | Thermo Fisher Scientific | Cat# 85124 | |
| Penicillin/Streptomycin | Gibco | Cat# 15140122 | |
| Phenazine methosulfate (PMS) | SRL | Cat# 55782 | |
| Propidium iodide | Thermo fisher scientific | Cat# P1304MP | |
| RPMI 1640 | Gibco | Cat# 11875093 | |
| Single Cell Lysis Kit | Thermo Fisher Scientific | Cat# 4458235 | |
| Sodium ascorbate | Merck | Cat# A7631 | |
| Sodium cyanide | Sigma | Cat# 205222 | |
| Sodium Deoxycholate | Thermo Fisher Scientific | Cat# 89904 | |
| Sodium dodecyl sulphate | Sigma-Aldrich | Cat# L3771 | |
| Sodium succinate hexahydrate | SRL | Cat# 36313 | |
| Sucrose | Sigma | Cat# S0389 | |
| SuperScript VILO cDNA synthesis kit | Thermo Fisher Scientific | Cat# 11754-050 | |
| Triton X-100 | Sigma | Cat# T8787 | |
| Trypsin 0.25% EDTA | Gibco | Cat# 25200072 | |
| Universal SYBR Green Supermix | BIO-RAD | Cat# 172-5124 | |
| Plasticware | |||
| MACS LS Columns | Miltenyi Biotec | Cat# 130-042-401 | |
| Equipment | |||
| Countess II FL Automated Cell Counter | Thermo Fisher Scientific | Cat# AMQAF1000 | |
| EVOS XL core imaging system | Thermo Fisher Scientific | Serial Number F0518-1727-0191 | |
| LAS X software | Leica Microsystems | ||
| Leica fluorescent inverted microscope | s | DMi8 automated S/N 424150) | |
| Midi MACS separator | Miltenyi Biotec | Cat# 130-042-302 |
References
- Kim, N., et al. Single-cell RNA sequencing demonstrates the molecular and cellular reprogramming of metastatic lung adenocarcinoma. Nature Communications. 11 (1), 1-5 (2020).
- Davidson, S., et al. Single-cell RNA sequencing reveals a dynamic stromal niche that supports tumor growth. Cell Reports. 31 (7), 107628 (2020).
- Zhang, Y., et al. Single-cell analyses of renal cell cancers reveal insights into tumor microenvironment, cell of origin, and therapy response. Proceedings of the National Academy of Sciences. 118 (24), (2021).
- Bray, L. J., Hutmacher, D. W., Bock, N. Addressing patient specificity in the engineering of tumor models. Frontiers in Bioengineering and Biotechnology. 7, 217 (2019).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Tissue Engineering. , 141-151 (2007).
- Dituri, F., et al. Complex tumor spheroid formation and one-step cancer-associated fibroblasts purification from hepatocellular carcinoma tissue promoted by inorganic surface topography. Nanomaterials. 11 (12), 3233 (2021).
- Arora, L., et al. Development of a multicellular 3D tumor model to study cellular heterogeneity and plasticity in NSCLC tumor microenvironment. Frontiers in Oncology. 12, 881207 (2022).
- Nurmik, M., Ullmann, P., Rodriguez, F., Haan, S., Letellier, E. In search of definitions: Cancer-associated fibroblasts and their markers. International Journal of Cancer. 146 (4), 895-905 (2020).
- Zhang, Y., et al. HIF-1α is necessary for activation and tumour-promotion effect of cancer-associated fibroblasts in lung cancer. Journal of Cellular and Molecular Medicine. 25 (12), 5457-5469 (2021).
- Bu, L., et al. Biological heterogeneity and versatility of cancer-associated fibroblasts in the tumor microenvironment. Oncogene. 38 (25), 4887-4901 (2019).
- Whitaker-Menezes, D., et al. Evidence for a stromal-epithelial "lactate shuttle" in human tumors: MCT4 is a marker of oxidative stress in cancer-associated fibroblasts. Cell cycle. 10 (11), 1772-1783 (2011).
- Mandujano-Tinoco, E. A., Gallardo-Pérez, J. C., Marín-Hernández, A., Moreno-Sánchez, R., Rodríguez-Enríquez, S. Anti-mitochondrial therapy in human breast cancer multi-cellular spheroids. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research. 1833 (3), 541-551 (2013).
- Bregman, A. A. . Laboratory Investigations in Cell and Molecular Biology. , (2002).
- Berry, E. A., Trumpower, B. L. Simultaneous determination of hemes a, b, and c from pyridine hemochrome spectra. Analytical Biochemistry. 161 (1), 1-15 (1987).
- Avagliano, A., et al. Metabolic reprogramming of cancer associated fibroblasts: the slavery of stromal fibroblasts. BioMed Research International. , (2018).
- Lorusso, G., Rüegg, C. The tumor microenvironment and its contribution to tumor evolution toward metastasis. Histochemistry and Cell Biology. 130 (6), 1091-1103 (2008).
- Liu, T., Zhou, L., Li, D., Andl, T., Zhang, Y. Cancer-associated fibroblasts build and secure the tumor microenvironment. Frontiers in Cell and Developmental Biology. 7, 60 (2019).
- Sebastian, A., et al. Single-cell transcriptomic analysis of tumor-derived fibroblasts and normal tissue-resident fibroblasts reveals fibroblast heterogeneity in breast cancer. Cancers. 12 (5), 1307 (2020).
- Elyada, E., et al. Cross-species single-cell analysis of pancreatic ductal adenocarcinoma reveals antigen-presenting cancer-associated fibroblasts. Cancer Discovery. 9 (8), 1102-1123 (2019).
- Ganguly, D., et al. Cancer-associated fibroblasts: Versatile players in the tumor microenvironment. Cancers. 12 (9), 2652 (2020).
- Harryvan, T. J., Verdegaal, E. M., Hardwick, J. C., Hawinkels, L. J., vander Burg, S. H. Targeting of the cancer-associated fibroblast-T-cell axis in solid malignancies. Journal of Clinical Medicine. 8 (11), 1989 (2019).
- Santi, A., Kugeratski, F. G., Zanivan, S. Cancer associated fibroblasts: the architects of stroma remodeling. Proteomics. 18 (5-6), 1700167 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved