A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عزل بصيلات ما قبل البقرية الصغيرة من المبيض البقري باستخدام مزيج من التجزئة والتجانس والترشيح التسلسلي
In This Article
Summary
يتطلب التقدم في دراسة تكوين الجريب قبل الكثبان طرقا فعالة لعزل الجريب عن المبايض المفردة. يظهر هنا بروتوكول ميكانيكي مبسط لعزل الجريب عن المبايض البقري باستخدام مروحية الأنسجة والخالط. تسمح هذه الطريقة بجمع عدد كبير من بصيلات preantral القابلة للحياة من مبيض واحد.
Abstract
يعد فهم العملية الكاملة لتكوين الجريب في الثدييات أمرا بالغ الأهمية لتحسين تقنيات الإنجاب المساعدة في الماشية والبشر والأنواع المهددة بالانقراض. اقتصرت الأبحاث في الغالب على الجريبات الغارية والكبيرة بسبب صعوبة عزل البصيلات قبل الغريبة الأصغر ، خاصة في الثدييات الكبيرة مثل أنواع الأبقار. يقدم هذا العمل نهجا فعالا لاسترداد أعداد كبيرة من الجريبات الصغيرة من مبيض بقري واحد. تم تقطيع قشرة المبيضين البقري الفردي إلى مكعبات 500 ميكرومتر باستخدام مفرمة الأنسجة ومتجانسة لمدة 6 دقائق عند 9000-11000 دورة في الدقيقة باستخدام مسبار 10 مم. تم فصل الحطام الكبير عن التجانس باستخدام قطعة قماش جبن ، يليه ترشيح تسلسلي من خلال مصافي خلايا 300 ميكرومتر و 40 ميكرومتر. تم شطف المحتويات المحتفظ بها في مصفاة 40 ميكرومتر في طبق بحث ، حيث تم تحديد البصيلات وجمعها في قطرة من المتوسط. تم اختبار صلاحية البصيلات التي تم جمعها عن طريق تلطيخ التريبان الأزرق. تتيح هذه الطريقة عزل عدد كبير من البصيلات الصغيرة القابلة للحياة من مبيض بقري واحد في حوالي 90 دقيقة. الأهم من ذلك ، أن هذه الطريقة ميكانيكية بالكامل وتتجنب استخدام الإنزيمات لفصل الأنسجة ، مما قد يؤدي إلى تلف البصيلات. يمكن استخدام البصيلات التي تم الحصول عليها باستخدام هذا البروتوكول للتطبيقات النهائية مثل عزل الحمض النووي الريبي ل RT-qPCR ، والتموضع المناعي لبروتينات معينة ، والثقافة في المختبر .
Introduction
جريبات المبيض هي الوحدات الوظيفية للمبيض ، المسؤولة عن إنتاج الأمشاج (البويضة) وكذلك الهرمونات الضرورية للوظيفة الإنجابية والصحة العامة. تتشكل بصيلات بدائية في المبيض أثناء نمو الجنين أو في فترة حديثي الولادة اعتمادا على الأنواع1 ، وتشكل احتياطي مبيض الأنثى. يبدأ النمو المسامي بتنشيط البصيلات البدائية التي تغادر بركة الراحة وتدخل مرحلة النمو. تكوين الجريبات قبل الغار ، الذي يشمل جميع مراحل الجريب قبل تطور الغار ، هو عملية ديناميكية للغاية تتطلب تغييرات مورفولوجية واستقلابية متزامنة في البويضة والخلايا الحبيبية المحيطة بها ، مدفوعة باتصال وثيق بين هذين النوعين من الخلايا 2,3. تشكل الجريبات قبل النطرية غالبية الوحدات المسامية الموجودة في المبيض فيأي وقت 4. يقدر التطور خلال المراحل السابقة لتكوين الجريبات بعدة أسابيع أطول من التطور الغاري 5,6 ، وهذه المرة ضرورية للخلايا البيضية والجسدية لاكتساب النضج الكافي لدخول المرحلة النهائية من التطور (أي المرحلة الغارية) ، والاستعداد للإباضة والإخصاب والتطور الجنيني 7,8,9.
يأتي الكثير من المعرفة الحالية حول تكوين جريبات المبيض قبل الحلق من نماذج الفئران10،11،12،13 ، ويرجع ذلك جزئيا إلى سهولة استعادة عدد كبير من هذه البصيلات من مبيض أصغر وأقل ليفية. على الرغم من أن التقارير عن عزل أعداد كبيرة من الجريبات قبل الجريبات من المبيضين البقري تعود إلى ما يقرب من 30 عاما14 ، إلا أن الفهم الأكثر اكتمالا حول العمليات التي تنظم تطور هذه البصيلات في المراحل المبكرة ظل غير محقق ، ويرجع ذلك إلى حد كبير إلى عدم وجود طرق محسنة وفعالة وقابلة للتكرار لاسترداد أعداد كافية من بصيلات ما قبل البكرات القابلة للحياة ، خاصة في المراحل المبكرة من التطور. مع الاهتمام المتزايد بالحفاظ على احتياطي المبيض للاستخدام المستقبلي في المساعدة على الإنجاب في البشر ، تصبح الأبقار نموذجا جذابا بسبب بنية المبيض الأكثر تشابها15. ومع ذلك ، فإن المبيض البقري أكثر ثراء بشكل ملحوظ في الكولاجين مقارنة بمبيض الفأر16 ، مما يجعل العزل الميكانيكي باستخدام الطرق الموصوفة للفأر غير فعال للغاية. تشمل الجهود المبذولة لتوسيع تقنيات الحفاظ على الخصوبة النمو الكامل في المختبر للجريبات قبل الغريبة إلى المرحلة الغارية ، يليها النضج في المختبر (IVM) للبويضات المغلقة ، والتخصيب في المختبر (IVF) ، وإنتاج الأجنة ونقلها17. حتى الآن ، تم تحقيق هذه العملية برمتها فقط في الفئران18. في الماشية ، يقتصر التقدم نحو نمو الجريب في المختبر على عدد قليل من التقارير مع مراحل جريب متغيرة في بداية الاستزراع ، بالإضافة إلى طول متغير للثقافة بين البروتوكولات17،19.
استخدمت الطرق الموضحة في الأدبيات لحصاد بصيلات ما قبل البقر من المبيض البقري في الغالب تقنيات ميكانيكية وإنزيمية ، إما معزولة أو مجتمعة2،14،17،20. استخدم التقرير الأول لبروتوكول عزل الجريب البقري خالط الأنسجة والترشيح التسلسلي لمعالجة المبايض الكاملة20. تبعت هذه الدراسة تقارير تجمع بين الإجراءات الميكانيكية والأنزيمية التي استخدمت كولاجيناز14. الموضوع المتكرر عند استخدام كولاجيناز لهضم أنسجة المبيض هو الخطر المحتمل لتلف الغشاء القاعدي المسامي ، مما قد يضر بصلاحية الجريب14،21،22،23. لذلك ، تم استخدام مجموعات مختلفة من الطرق الميكانيكية ، مثل استخدام مفرمة الأنسجة والماصات المتكررة أو مفرمة الأنسجة جنبا إلى جنب مع التجانس20،24،25،26. هناك تقنية ميكانيكية أخرى تم وصفها تستخدم الإبر لتشريح بصيلات ما قبل الجريبات مباشرة من أنسجة المبيض ، وهي مفيدة بشكل خاص لعزل بصيلات ثانوية أكبر (>200 ميكرومتر). ومع ذلك ، فإن هذه العملية تستغرق وقتا طويلا ، وغير فعالة لعزل بصيلات ما قبل البكرات الأصغر ، وتعتمد على مجموعة المهارات عند تجربتها في المبايض البقري19،27،28.
بالاستفادة من التقنيات المختلفة الموضحة في الأدبيات ، يهدف هذا البروتوكول إلى تحسين عزل بصيلات ما قبل البقران من المبايض المفردة بطريقة بسيطة ومتسقة وفعالة تتجنب الحضانة في المحاليل الأنزيمية. سيوفر تحسين طرق عزل الجريبات قبل الجريبية فرصة لتعزيز فهم هذه المرحلة من تكوين الجريب وتمكين تطوير أنظمة استزراع فعالة لتطوير بصيلات ما قبل الجريبات إلى المرحلة الغارية. ستكون الإجراءات التفصيلية الموضحة هنا لعزل البصيلات قبل الجريبة من الثدييات الكبيرة مثل الأنواع البقرية حيوية للباحثين الذين يهدفون إلى دراسة تكوين الجريبات المبكر في الأنواع غير الفئران التي يمكن ترجمتها إلى البشر.
Protocol
تم الحصول على المبايض البقري (Bos taurus) من مسلخ محلي ونقلها إلى المختبر في غضون 6 ساعات من التجميع. نظرا للعدد الكبير من الحيوانات التي تتم معالجتها في المنشأة ، فإن عمر وسلالة ومرحلة دورة شبق الحيوانات غير معروفة. نظرا لعدم استخدام أي حية في هذه التجارب ، لم يكن هناك حاجة إلى بروتوكول معتمد لرعاية الحيوانات واستخدامها.
1. إعداد المعدات والكواشف
- قم بتغطية قسم بعرض 2 قدم من مقعد المختبر بورق مقاعد البدلاء.
- الحصول على مقبض مشرط ، شفرة مشرط معقمة ، مرقئ ، زوج من ملقط تشريح ، حقنة قفل 20 مل ، إبرة 18 غرام ، كأسين 200 مل ، قارورة Erlenmeyer 500 مل ، قمع بلاستيكي قطره 104 مم ، لوح تقطيع بلاستيكي ، طبقة واحدة 22 سم2 من القماش القطني (يمكن تعقيم القماش القطني عن طريق التعقيم قبل الاستخدام) لكل مبيض تتم معالجته ، مصفاة خلية 300 ميكرومتر ، ومصفاة خلية 40 ميكرومتر (انظر جدول المواد).
- انقل جميع المعدات إلى ورقة الطاولة.
- استخدم مرقئ لفتح شفرة المشرط على مقبض المشرط. قم بمحاذاة القاعدة الزاوية للشفرة مع المؤشر المائل على المقبض، ثم حرك الشفرة في أخدود المقبض.
- ضع القمع في قارورة Erlenmeyer وقم بتغطية فتحة القمع بالقماش القطني.
- ضع أنبوبا مخروطيا واحدا سعة 50 مل لكل مبيض لتتم معالجته في حمام مائي أو خرزي مضبوط على 38.5 درجة مئوية.
- ضع طبق بتري مربع 100 مم × 15 مم لكل مبيض تتم معالجته على جهاز تسخين منزلق مضبوط على 38.5 درجة مئوية.
- أضف 10 مل من البنسلين ستربتومايسين (PenStrep ؛ 10000 وحدة / مل بنسلين و 10000 ميكروغرام / مل ستربتومايسين) إلى 1 لتر من 1x محلول ملحي مخزن بالفوسفات (PBS). قم بتسخين PBS + PenStrep في حمام مائي أو خرزي مضبوط على 38.5 درجة مئوية قبل 2 ساعة على الأقل من معالجة المبيض.
ملاحظة: يعد محلول PBS + PenStrep ضروريا لغسل المبايض عند زراعة البصيلات المعزولة ، ولا يزال يوصى به لأي تجارب في المراحل النهائية للتخفيف من التلوث الميكروبي. - لجمع ترشيح المبيض المعالج ، استخدم وسط غسل الجريب (FWM) الذي يتكون من TCM199 مع أملاح هانك (انظر جدول المواد) التي تحتوي على 3 مجم / مل من ألبومين مصل البقر (BSA) ، و 25 مللي مول من محلول HEPES ، و 100 وحدة دولية من البنسلين / 100 ميكروغرام / مل من الستربتومايسين ، و 1 مللي مول من بيروفات الصوديوم (NaPyr) ، و 100 نانومتر من الأحماض الأمينية غير الأساسية (NEAA).
- انقل TCM199 المعقم ، وزجاجة سعة 250 مل ، وأسطوانة متدرجة سعة 100 مل إلى خزانة السلامة الحيوية (BSC). انقل 194 مل من TCM199 إلى الزجاجة.
- قم بإزالة دورق TCM199 من BSC واحضره إلى طبق التحريك. أضف 600 مجم من BSA ، و 1.19 جم من محلول HEPES ، وقضيب تقليب معقم إلى الزجاجة وحركه حتى يذوب.
- بمجرد أن يذوب المخزن المؤقت BSA و HEPES تماما ، أضف 1 N هيدروكسيد الصوديوم (NaOH) إلى الوسط حتى يصل إلى درجة حموضة 7.6-7.8 ، كما تم قياسه بواسطة مقياس الأس الهيدروجيني.
- امسح زجاجة الوسط ، وجهاز الترشيح الفراغي ، وأربعة أنابيب مخروطية سعة 50 مل ، وزجاجات PenStrep و NaPyr و NEAA بنسبة 70٪ من الإيثانول قبل نقلها إلى BSC.
- أضف 2 مل لكل من PenStrep (10000 وحدة / مل بنسلين و 10000 ميكروغرام / مل ستربتومايسين) ، 100 مللي متر NaPyr ، و 100x NEAA إلى زجاجة TCM199 + 3 مجم / مل BSA + 25 مللي مول HEPES. قم بتصفية الوسط النهائي والقسمة المعقمة في الأنابيب المخروطية سعة 50 مل. تخزين الوسط في 4 °C لمدة تصل إلى 2 أسابيع.
- قم بتسخين أنبوب مخروطي واحد سعة 50 مل من الوسط لكل مبيضين في حمام خرزي مضبوط على 38.5 درجة مئوية قبل 1 ساعة على الأقل من معالجة المبيض.
2. إعداد المروحية الأنسجة
- تأكد من توصيل مفرمة الأنسجة (انظر جدول المواد) وتشغيلها.
- اضبط سمك الشريحة على 500 ميكرومتر ، ومقبض التحكم في قوة الشفرة على 20 درجة ، ومقبض التحكم في السرعة على 90 درجة وفقا لمواصفات الشركة المصنعة.
- أدخل طبق بتري بلاستيكي مقاس 60 مم في حامل اللوحة وأدخل حامل اللوحة على خشبة المسرح.
- ارفع ذراع التقطيع إلى أعلى مستوى ممكن عن طريق تدوير مقبض التشغيل اليدوي في اتجاه عقارب الساعة.
- باستخدام الملقط ، ضع شفرة حلاقة ذات حدين (انظر جدول المواد) على المسمار الذي تم إدخاله في ذراع التقطيع. ضع مشبك الشفرة فوق الشفرة وقم بتثبيته بالغسالة والجوز. اترك الجوز ربع يتحرر.
- قم بتدوير مقبض التشغيل اليدوي حتى يستقر ذراع التقطيع الشفرة بشكل مسطح على طبق بتري. شد الجوز بقية الطريق باستخدام مفك البندق.
- ارفع ذراع التقطيع إلى أعلى مستوى باستخدام مقبض التشغيل اليدوي. حرك مقبض تحرير الطاولة بالكامل إلى اليسار حتى يستقر في مكانه.
3. إعداد المبيض
- نقل المبايض في المختبر لتدفئة (38.5 درجة مئوية) PBS معقمة + PenStrep.
ملاحظة: يوصى بمعالجة المبايض لعزل الجريب بمجرد أن يكون ذلك ممكنا بعد إزالته من الحيوان. في هذا البروتوكول ، تمت معالجة المبايض في غضون 6 ساعات من الحصاد. تم نقل المبايض من المسلخ إلى المختبر في الترمس الذي يحتوي على محلول ملحي معقم بنسبة 0.9٪ عند حوالي 38.5 درجة مئوية. - إذا أمكن ، حدد مبايض صغيرة (≤ 4 سم × 3 سم × 3 سم) تحتوي على بصيلات غارية صغيرة (3-5 مم) ، ولا توجد بصيلات غارية كبيرة (≥8 مم) ، ولا يوجد جسم أصفر بارز (الشكل 1). يوصى بهذه المعايير لضمان تضمين الحد الأدنى من الحطام غير الجريب ، مثل الخلايا اللحمية والمصفوفة خارج الخلية ، في الطبق المربع الناتج الذي يحتوي على بصيلات معزولة.
ملاحظة: يمكن تحديد الجريبات الغارية على أنها هياكل حويصلية كروية مملوءة بالسوائل على سطح المبيض. يمكن تحديد Corpora lutea على أنها هياكل صلبة حمراء أو برتقالية أو صفراء بارزة من سطح المبيض. - استخدم المقص لإزالة أي نسيج ضام زائد ودهون من المبايض.
- اغسل المبيضين لمدة 30 ثانية في 70٪ إيثانول في دورق.
- اغسل المبيضين 3 مرات لمدة 2 دقيقة لكل منهما في أكواب دافئة (38.5 درجة مئوية) PBS + PenStrep ، باستخدام PBS + PenStrep الطازج لكل غسلة.
- حافظ على المبايض دافئة (38.5 درجة مئوية) PBS + PenStrep حتى تصبح جاهزة للمعالجة.
ملاحظة: يمكن أن تكون المسافة بين المختبر ومصدر المبيض متغيرة. لذلك ، من المهم إكمال البروتوكول في الوقت المناسب لضمان الحفاظ على صلاحية المسام.
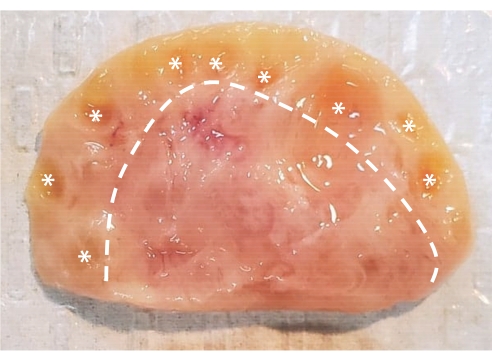
الشكل 1: تشريح المبيض البقري. يتكون المبيض البقري من منطقتين رئيسيتين محاطة بطبقة ظهارية. تحتوي القشرة ، التي تتكون من الأنسجة الموجودة على يسار الخط المتقطع ، على جريبات مبيض من المرحلة البدائية إلى المرحلة الغارية. بصيلات Preantral صغيرة جدا بحيث لا يمكن رؤيتها بالعين المجردة. يتم تمييز بصيلات الغار مع العلامات النجمية. يحتوي النخاع، الذي يتكون من النسيج الموجود على يمين الخط المتقطع، على أوعية دموية وأوعية لمفاوية وأعصاب. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
4. إجراء ختم
ملاحظة: قم بمعالجة مبيض واحد فقط في كل مرة. قم بمعالجة المبايض بسرعة لتجنب انخفاض درجة الحرارة ، مما قد يؤثر على صلاحية الجريب.
- انقل مبيضا واحدا إلى لوح التقطيع على ورق الطاولة (الشكل 2 أ) وقم بإعداد مفرمة الأنسجة (الشكل 2 ب).
- باستخدام ملقط ومشرط ، اقطع المبيض إلى نصفين وأزل النخاع من كل نصف ، ولم يتبق سوى القشرة بسمك 1 مم تقريبا كما هو موضح في الشكل 2C.
- قطع المبيض إلى نصفين طوليا من موقع ربط الرباط إلى موقع التعلق المقابل.
- احتفظ بنصف المبيض على لوح التقطيع المراد معالجته وضع النصف الآخر من المبيض مرة أخرى في درجة حرارة (38.5 درجة مئوية) PBS + PenStrep.
- مع توجيه النخاع المكشوف لأعلى ، قم بتقطيعه على طول انحناء المبيض على بعد حوالي 2 مم من سطح المبيض دون قطع القشرة.
- استخدم الشريحة على طول انحناء المبيض كدليل لتعميق الشريحة ، مع الاستمرار في تتبع انحناء المبيض لفصل القشرة عن النخاع.
- تشريح وتجاهل أي corpora lutea من المبيض عن طريق قطع على طول حدود الجسم الأصفر.
- اقلب نصف المبيض بحيث تواجه الظهارة لأعلى واستخدم المشرط لإنهاء قطع النخاع بعيدا عن القشرة. قم بقص أي نسيج ضام أبيض متبقي حول حافة قطعة المبيض التي كانت متصلة بالأربطة.
- بمجرد إزالة غالبية النخاع ، استخدم المشرط لقطع القشرة إلى سمك 1 مم تقريبا. تلاعب بالمشرط بحركات صغيرة ذهابا وإيابا لحلق ما تبقى من النخاع.
ملاحظة: النخاع هو الجزء الداخلي من المبيض الذي يحتوي على أوعية دموية كبيرة. القشرة هي الجزء الخارجي من المبيض ، وتقع مباشرة تحت ظهارة السطح الخارجي. يبلغ سمك القشرة حوالي 1 مم في المبيض البقري ، وبالتالي فإن قطع المبيض بسمك 1 مم سيزيل النخاع.
- قطع القشرة إلى قطع لا يزيد حجمها عن 2.5 سم × 2.5 سم. احتفظ بقطع القشرة في PBS + PenStrep دافئة (38.5 درجة مئوية) حتى تصبح جاهزة للتقطيع.
- املأ دورقا بما لا يقل عن 50 مل من PBS + PenStrep الدافئ (38.5 درجة مئوية) واحصل على ماصة نقل بلاستيكية.
- انقل قطعة واحدة من القشرة إلى طبق بتري على مفرمة الأنسجة وبلل المنديل بثلاث أو أربع قطرات من PBS + PenStrep الدافئ (38.5 درجة مئوية).
- أمسك قطعة الأنسجة بثبات بزوج من الملقط واضغط على زر إعادة الضبط مرة واحدة لبدء تشغيل مفرمة الأنسجة. ثبت طبق بتري بيد واحدة مع الاستمرار في تثبيت الأنسجة بالملقط. حرك الملقط الأيسر على طول المنديل حسب الحاجة لتجنب اصطدام الشفرة بالملقط. يبلغ طول الشرائط الناتجة حوالي 500 ميكرومتر.
- بمجرد قطع قطعة القشرة بالكامل إلى شرائح ، استخدم مقبض حامل الشفرة لرفع الشفرة عن طبق بتري والملقط لإزالة أي نسيج من الشفرة.
- قم بتدوير حامل اللوحة 90 درجة.
- اضغط على زر إعادة الضبط مرة واحدة. ثبت طبق بتري بيد واحدة أثناء استخدام الملقط لدفع شرائط الأنسجة في مسار الشفرة.
- مرر الشفرة بالكامل عبر شرائط الأنسجة. استخدم مقبض حامل الشفرة لرفع الشفرة عن طبق بتري والملقط لإزالة أي نسيج من الشفرة.
- استخدم ماصة النقل ودافئة (38.5 درجة مئوية) PBS + PenStrep لغسل الأنسجة المفرومة (الحجم النهائي للأنسجة: 500 ميكرومتر × 500 ميكرومتر × 1 مم مكعبات) في أنبوب مخروطي دافئ مسبقا (38.5 درجة مئوية) 50 مل. أعد الأنبوب المخروطي إلى الماء أو حمام الخرز للحفاظ على دفء الأنسجة المفرومة (38.5 درجة مئوية).
- استخدم مفك البندق لإزالة الجوز من ذراع التقطيع ، وقم بإزالة الغسالة وقفل الشفرة. باستخدام الملقط ، قم بإزالة الشفرة من ذراع التقطيع ، واقلبها بحيث تواجه الحافة غير المستخدمة طبق بتري ، وضعها مرة أخرى على ذراع التقطيع. استبدل مشبك الشفرة والغسالة والصامولة، وأعد ضبط مقبض تحرير الطاولة كما هو موضح في الخطوات 2.5-2.7.
- كرر الخطوات 4.5-4.12 لجميع القطع المتبقية من القشرة من المبيض ، مع استبدال الشفرات بأخرى جديدة بعد استخدام كل حافة قطع.
- تخلص من جميع الشفرات المستخدمة في حاوية أدوات حادة بلاستيكية صلبة الجدران.
5. إجراء التجانس
- تأكد من توصيل وحدة الخالط (انظر جدول المواد) وضبط السرعة على الشريط الثاني (9000-11000 دورة في الدقيقة). أدخل مسبار المولد 10 مم في الوحدة وفقا لمواصفات الشركة المصنعة.
- اضبط مؤقتا لمدة 1 دقيقة وأدخل المسبار في الأنبوب المخروطي سعة 50 مل الذي يحتوي على أنسجة القشرة المفرومة من مبيض واحد (الخطوة 4.11) وما يكفي من PBS + PenStrep لملء الأنبوب إلى خط 25 مل. يجب أن يكون العمق الذي يتم إدخال المسبار فيه 1/3 من ارتفاع السائل المقاس من أسفل الغرفة. ضع المسبار بعيدا قليلا عن المركز لتقليل الدوامة.
- ابدأ تشغيل المؤقت وقم بتشغيل الخالط. تأكد من أن الجزء السفلي من المسبار لا يلمس الأنبوب وأمسك الأنبوب أثناء تشغيل الخالط.
- بعد 1 دقيقة من التجانس ، قم بإزالة المسبار من الأنبوب. باستخدام الملقط ، قم بإزالة أي نسيج ضام يسد فتحات التهوية والمسافة بين سكين الدوار وأنبوب الدوار. إذا علقت أي قطعة من القشرة في المسبار ، فقم بإزالتها بالملقط ووضعها مرة أخرى في الأنبوب.
- كرر الخطوات 5.2-5.4 5x إضافية ليصبح المجموع 6 دقائق من التجانس.
- ضع الأنبوب مع الأنسجة المتجانسة في الماء أو حمام الخرز للحفاظ على الأنسجة دافئة (38.5 درجة مئوية). بعد معالجة المبيض الأخير ، قم بتفكيك مسبار المولد وتنظيفه وتجفيفه على الفور وفقا لمواصفات الشركة المصنعة.
6. إجراء الترشيح
- صب الأنسجة المشتتة في القمع المغطى بالقماش القطني الذي يتم إدخاله في قارورة Erlenmeyer. شطف محتويات الأنبوب في القمع باستخدام PBS + PenStrep دافئ (38.5 درجة مئوية) حتى لا تبقى شظايا الأنسجة في الأنبوب.
- أجبر شظايا الأنسجة على المرور عبر ثقوب القماش عن طريق لف القماش القطني حول شظايا الأنسجة والضغط حتى تتم إزالة جميع السوائل والأنسجة الزائدة من القماش القطني.
- أعد فتح القماش القطني فوق القمع ، وشطف القماش القطني باستخدام PBS + PenStrep باستخدام ماصة نقل ، واضغط مرة أخرى على أي شظايا الأنسجة المتبقية من خلال القماش.
- استخدم مرقئ لحمل مصفاة الخلايا 300 ميكرومتر فوق دورق سعة 200 مل. صب الراشح في قارورة Erlenmeyer من خلال مصفاة الخلية. شطف محتويات القارورة في مصفاة الخلية باستخدام دافئ (38.5 درجة مئوية) PBS + PenStrep حتى لا تبقى شظايا الأنسجة.
- إذا أصبحت مصفاة الخلية مسدودة بالأنسجة ، فاضغط برفق على مصفاة الخلية على الدورق للتأكد من ترشيح كل السائل في الدورق ، ثم اقلب مصفاة الخلية رأسا على عقب واضغط على بقايا الأنسجة الكبيرة على ورق الطاولة. أعد مصفاة الخلية فوق الكأس الزجاجية واستمر في سكب الراشح من خلالها. كرر حسب الضرورة حتى يتم تصفية كل الترشيح من دورق Erlenmeyer.
- استخدم مرقئ لحمل مصفاة الخلايا 40 ميكرومتر على دورق ثان سعة 200 مل. صب الراشح في أول كأس زجاجية سعة 200 مل عبر مصفاة الخلية. شطف محتويات الدورق في مصفاة الخلية باستخدام PBS + PenStrep دافئ (38.5 درجة مئوية) حتى لا تبقى شظايا الأنسجة. لا تتخلص من محتويات مصفاة الخلايا 40 ميكرومتر.
- قم بتركيب إبرة 18 جم على حقنة سعة 20 مل. املأ المحقنة ب FWM. اقلب مصفاة الخلايا 40 ميكرومتر رأسا على عقب فوق طبق بتري مربع واستخدم المحقنة لغسل محتويات مصفاة الخلية في الطبق. أعد ملء المحقنة واشطف مصفاة الخلية حسب الحاجة حتى لا تبقى شظايا الأنسجة.
ملاحظة: عادة ما يكون 25 مل من FWM كافيا لشطف محتويات مصفاة الخلايا 40 ميكرومتر بالكامل.

الشكل 2: إعداد مساحة العمل لمعالجة المبيض وسير عمل البروتوكول . (أ) إعداد مقاعد البدلاء لقطع المبيضين قبل التقطيع ولتصفية تجانس المبيض. (ب) إعداد مفرمة الأنسجة والخالط ، مع دعم الستايروفوم لتقليل اهتزازات مرحلة الخالط. (ج) رسم تخطيطي يوضح سير العمل لمعالجة مبيض واحد كامل. يتم قطع المبايض من النسيج الضام الزائد ثم تقطيعها إلى نصفين ، ويتم إزالة النخاع حتى تبقى شريحة من القشرة بسمك ~ 1 مم. يتم تقطيع القشرة إلى قطع 2.5 سم × 2.5 سم وتقطيعها في مفرمة الأنسجة على فاصل قطع يبلغ 500 ميكرومتر. ثم يتم تجانس القطع ، ويتم ترشيح التجانس من خلال القماش القطني متبوعا بالترشيح من خلال مصافي خلايا 300 ميكرومتر و 40 ميكرومتر. يتم شطف محتويات مصفاة الخلايا 40 ميكرومتر في طبق بتري مربع ، والذي يتم البحث عن بصيلات باستخدام مجسم. تم إنشاؤها باستخدام BioRender.com. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
7. البحث وجمع البصيلات
- انقل طبق بتري المربع (الخطوة 6.6) إلى مجسم مع مرحلة دافئة مضبوطة على 38.5 درجة مئوية. يجب ضبط تكبير المجسم بين 1.25x و 3.2x حسب تفضيل الباحث.
- ماصة 10 ميكرولتر قطرات من FWM في طبق بتري 60 مم وتغطية قطرات بالزيت المعدني لمنع الجفاف. ضع طبق بتري مع قطرات الوسائط على طبق تسخين مضبوط على 38.5 درجة مئوية.
ملاحظة: يمكن استخدام لوحة من 4 آبار لجمع البصيلات. أضف 500 ميكرولتر من وسائط الغسيل إلى بئر واحد أو بئرين. ضعه على طبق التسخين على 38.5 درجة مئوية. - الحصول على المكبس micropipette وتلميح.
ملاحظة: يوصى باستخدام ماصة زجاجية سعة 1-5 ميكرولتر (انظر جدول المواد) لأن البصيلات أقل عرضة للالتصاق بالماصة الزجاجية وتضيع عند نقلها بين المحاليل. كما أنها أداة صغيرة بما يكفي للسماح بمعالجة دقيقة أسهل وأكثر دقة للبصيلات. - تحديد بصيلات من طبق بتري مربع ونقلها إلى قطرات الوسائط (FWM) باستخدام micropipette. من المحتمل أن تكون العديد من البصيلات مغروسة في حطام الأنسجة ويمكن استرجاعها باستخدام إحدى الطريقتين كما هو موضح أدناه.
ملاحظة: الجريبات مستطيلة ، وليست كرات مثالية ، وعادة ما تحتوي على بويضة ، تظهر كدائرة بيضاء صلبة في تباينات داكنة ، باتجاه مركز الجريب (الشكل 3A-C). احرص على تجنب الخلط بين البصيلات والبويضات العارية. تميل البويضات إلى أن تكون كرات مثالية ومحاطة بغشاء سميك وواضح (المنطقة الشفافة). يمكن استخدام مجهر مقلوب بتكبير 10x (أو أكثر) لفحص البصيلات عن كثب (الشكل 3D).- افصل البصيلات بعناية عن الحطام باستخدام طرف الماصة الدقيقة أو الإبر الدقيقة (27 جم).
- بدلا من ذلك ، استخدم ماصة باستور زجاجية مع لمبة مطاطية لامتصاص وبخ الحطام في الطبق عدة مرات لإزاحة البصيلات من الحطام.
- اعمل بسرعة ، لا تستغرق أكثر من 30 دقيقة ، للبحث في طبق بتري للمساعدة في الحفاظ على صلاحية الجريب.
- ضع خمس بصيلات فقط كحد أقصى لكل قطرة 10 ميكرولتر ، لأن الكثافة العالية يمكن أن تزيد من احتمالية التصاق البصيلات ببعضها البعض.
8. اختبار جدوى استبعاد التريبان الأزرق
ملاحظة: استخدم غطاء طبق بتري أو طبق من 4 آبار لجميع الخطوات التالية ، حيث تلتصق البصيلات ببلاستيك الغطاء أقل مما تلتصق ببلاستيك الطبق الفعلي.
- تحضير PBS + 0.2٪ بولي فينيل بيروليدون (PVP) عن طريق إذابة 100 ملغ PVP في 50 مل من PBS.
ملاحظة: يستخدم PVP هنا لتقليل احتمالية التصاق البصيلات بالطبق. - استخدم الماصة الدقيقة لنقل جميع البصيلات (متوسط 40) من قطرات الوسائط إلى قطرة 50 ميكرولتر من PBS + 0.2٪ PVP.
- اغسل البصيلات 2x عن طريق نقلها بالتتابع إلى قطرات جديدة 50 ميكرولتر من PBS + 0.2٪ PVP.
- نقل بصيلات إلى قطرة 285 ميكرولتر من PBS + 0.2 ٪ PVP.
- أضف 15 ميكرولتر من التريبان الأزرق إلى قطرة 285 ميكرولتر من PBS + 0.2٪ PVP (التركيز النهائي 0.05٪ من التربان الأزرق) واخلط القطرة بعناية باستخدام طرف ماصة 200 ميكرولتر مضبوط على 100 ميكرولتر.
ملاحظة: في حالة استخدام لوحة 4 آبار لاختبار صلاحية التريبان ، أضف 475 ميكرولتر من PBS + 0.2٪ PVP و 25 ميكرولتر من التربان الأزرق إلى بئر واحد. - احتضان المسام لمدة 1 دقيقة في قطرة التريبان الزرقاء ، ثم انقل البصيلات إلى قطرة 50 ميكرولتر (أو 500 ميكرولتر جيدا) من PBS + 0.2٪ PVP.
- اغسل البصيلات 3 مرات وفقا للخطوة 8.3 بقطرات جديدة 50 ميكرولتر (أو 500 ميكرولتر لكل بئر) من PBS + 0.2٪ PVP.
- تخلص من أي بصيلات لا تزال تظهر باللون الأزرق بعد ثلاث غسلات في PBS + 0.2٪ PVP ، لأنها غير قابلة للحياة. أي بصيلات لا تحتفظ باللون الأزرق بعد ثلاث غسلات قابلة للحياة ويمكن استخدامها في التألق المناعي أو الثقافة أو غيرها من الإجراءات (الشكل 3E). قم بتجميد البصيلات في النيتروجين السائل وتخزينها في درجة حرارة -80 درجة مئوية حتى يتم استخدامها مرة أخرى إذا لزم الأمر.
- قم بإجراء تحليل RT-qPCR وتلطيخ التألق المناعي للبصيلات كما هو موضح في الخطوتين 9 و 10.

الشكل 3: البصيلات المعزولة واختبار استبعاد التريبان الأزرق. (أ-ج) تم تصوير البصيلات المعزولة من خلال مجهر مجسم بعدة تكبيرات. أ – البصيلات المعزولة بين الحطام داخل طبق البحث الأولي. البصيلات الفردية محاطة بدائرة باللون الأحمر. شريط المقياس = 2000 ميكرومتر. (ب) بصيلات وحطام معزول داخل قطرة من وسط غسل البصيلات مغطى بالزيت المعدني. شريط المقياس = 1000 ميكرومتر. (C) بصيلات معزولة بدون حطام بتكبير أعلى. شريط المقياس = 1000 ميكرومتر. (د) بصيلات معزولة تم تصويرها باستخدام مجهر برايت فيلد مقلوب. شريط المقياس = 100 ميكرومتر. (ه) صور تمثيلية لبصيلات قابلة للحياة (غير ملوثة) وغير قابلة للحياة (بقعة زرقاء) تم تصويرها باستخدام مجهر برايت فيلد مقلوب وهدف 20x. شريط المقياس = 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
9. تحليل RT-qPCR
- عزل الحمض النووي الريبي عن البصيلات القابلة للحياة (من الخطوة 8.8) باستخدام كاشف عزل الحمض النووي الريبي (انظر جدول المواد). قم بتنقية الحمض النووي الريبي ومعالجته باستخدام DNase باستخدام مجموعة أدوات التنظيف المتاحة تجاريا (انظر جدول المواد) وفقا لتعليمات الشركة المصنعة.
- قم بإخراج الحمض النووي الريبي ب 14 ميكرولتر من الماء الخالي من RNase وقم بتحديده باستخدام مقياس الطيف الضوئي. يمكن تخزين الحمض النووي الريبي في -80 درجة مئوية حتى تخليق cDNA.
- قم بإجراء تخليق cDNA من كميات متساوية من الحمض النووي الريبي المستخرج من البصيلات الأولية والثانوية المبكرة ، باستخدام مجموعة توليف cDNA المتاحة تجاريا (انظر جدول المواد) وفقا لتعليمات الشركة المصنعة. احتضان خليط التفاعل لمدة 5 دقائق عند 25 درجة مئوية تليها 60 دقيقة عند 42 درجة مئوية ، ثم قم بإنهاء التفاعل عن طريق التسخين عند 70 درجة مئوية لمدة 5 دقائق.
- قم بإجراء RT-qPCR باستخدام cDNA المركب (5 نانوغرام لكل تفاعل) والبادئات (الجدول 1) باستخدام مزيج تفاعل متاح تجاريا (انظر جدول المواد). استخدم ظروف الدورة الحرارية: 30 ثانية عند 95 درجة مئوية لتنشيط البلمرة ، تليها 40 دورة تضخيم ، حيث تضمنت كل دورة 15 ثانية عند 95 درجة مئوية للتمسخ و 30 ثانية عند 60 درجة مئوية للتلدين / التمديد. تحليل RT-qPCR عن طريق تحديد قيم عتبة الدورة (Ct) و / أو عرض منتجات تفاعل البوليميراز المتسلسل باستخدام الرحلان الكهربائي لهلام الأغاروز.
ملاحظة: تم تقييم التعبير النصي لعلامة الخلية الحبيبية FSHR وعلامة الخلايا الجرثومية DAZL في هذه الدراسة. كانت الجينات المرجعية هي H2A و ACTB. - قم بإجراء تحليل منحنى الذوبان عن طريق زيادة درجة الحرارة من 65 درجة مئوية بزيادات 0.5 درجة مئوية كل 5 ثوان حتى تصل إلى 95 درجة مئوية.
10. تحليل التألق المناعي
- إصلاح بصيلات قابلة للحياة (من الخطوة 8.8) لمدة 15 دقيقة في قطرة 100 ميكرولتر من 4٪ (v / v) بارافورمالدهيد (PFA) في درجة حرارة الغرفة (RT) ، تليها غسل 3x في 100 ميكرولتر قطرات من PBS + 0.1٪ BSA + 0.1٪ توين 20.
- سد البصيلات لمدة 1 ساعة في RT في مخزن مؤقت مانع يتكون من 1x PBS + 5٪ (v / v) مصل حمار عادي (NDS). بعد الحجب ، احتضان البصيلات طوال الليل عند 4 درجات مئوية في قطرة 100 ميكرولتر من 4 ميكروغرام / مل أرنب مضاد CX37 للإنسان أو 4 ميكروغرام / مل من النوع المتماثل للأرانب IgG (التحكم السلبي) المخفف في المخزن المؤقت للحظر.
- اغسل البصيلات 3x في 100 ميكرولتر قطرات من PBS + 0.1٪ BSA + 0.1٪ توين 20 ، ثم احتضنها لمدة ساعة واحدة في RT في الظلام في قطرة 100 ميكرولتر من 2 ميكروغرام / مل حمار مضاد للأرانب AlexaFluor 488 جسم مضاد ثانوي مخفف في مانع المخزن المؤقت.
- احتضان البصيلات لمدة 5 دقائق في RT في الظلام في قطرة 100 ميكرولتر من 1 ميكروغرام / مل Hoechst 33342 مخففة في المخزن المؤقت المانع لتسمية الحمض النووي.
- انقل البصيلات إلى قطرة 5 ميكرولتر من وسائط التثبيت (انظر جدول المواد) على شريحة مجهر زجاجية وقم بتغطيتها بزلة غطاء. اتركي الشرائح لعلاجها في RT طوال الليل ، متبوعة بالختم بطلاء الأظافر. قم بتخزينها في درجة حرارة 4 درجات مئوية حتى التصوير.
- صور جميع الشرائح في غضون 48 ساعة من انزلاق الغطاء. قم بإجراء التصوير باستخدام مجهر فوق التألق المقلوب (انظر جدول المواد) تحت مرشحات DAPI (الإثارة 380 نانومتر والانبعاث 450 نانومتر) و FITC (الإثارة 470 نانومتر والانبعاث 525 نانومتر).
- إصلاح وقت التعرض لكلتا القناتين. اضبط وقت التعرض FITC (CX37) بناء على التحكم السلبي في النمط المتماثل للأرانب. استخدم هدفا 20x وقناة DAPI مضبوطة على وقت التعرض 50 مللي ثانية لتحديد البصيلات التي تحمل علامة النمط المتماثل للأرانب.
- قم بتصوير هذه البصيلات تحت قناة FITC ، وقم بتقليل وقت التعرض حتى يتم إلغاء كل إشارة الخلفية الخضراء. لاحظ وقت التعرض هذا.
- قم بتصوير جميع البصيلات التي تحمل علامة الأجسام المضادة CX37 باستخدام وقت التعرض المحدد لقناة FITC isotype ووقت التعرض 50 مللي ثانية لقناة DAPI.
- معالجة شدة الإشارة ، كما تم قياسها بواسطة متوسط المنطقة الرمادية بعد العتبة ، باستخدام برنامج معالجة صور الكمبيوتر29 (انظر جدول المواد).
- اضبط ملف tiff لصورة DAPI لكل بصيلة بحيث يتم تحديد المسام بأكمله. استخدم وظيفة تحليل الجسيمات في البرنامج لتحديد المسام بأكمله كمنطقة اهتمام (ROI).
- افتح ملف tiff لصورة FITC للجريب المقابل وقم بتراكب عائد الاستثمار الناتج عن صورة DAPI أعلى صورة FITC. استخدم وظيفة القياس الخاصة بالبرنامج لتحديد متوسط المنطقة الرمادية لصورة FITC ، والتي تمثل شدة الإشارة.
النتائج
نظرة عامة وخطوات حاسمة
باستخدام هذا البروتوكول ، يمكن عزل بصيلات الأبقار الصغيرة بشكل موثوق من المبايض المفردة بأعداد ذات صلة تجريبيا. من إجمالي 30 مكررا ، تم الحصول على 41 جريبة في المتوسط لكل مكرر ، مع نطاق من 11 إلى 135 بصيلة (الشكل 4 أ). في 14 نسخة مكررة ، تم تمييز الب...
Discussion
يفصل البروتوكول الحالي طريقة قابلة للتكرار لاسترداد الجريبات قبل الحمراء في المرحلة المبكرة ، وتحديدا في المراحل الأولية والثانوية المبكرة ، من المبيض البقري. يعتمد هذا البروتوكول على التقارير السابقة20،25،30،34،35،
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم تمويل هذا المشروع جزئيا من قبل مشروع وزارة الزراعة الأمريكية متعدد الولايات W4112 وجائزة UC Davis Jastro Shields إلى SM.
يود المؤلفون أن يعربوا عن تقديرهم لشركة Central Valley Meat، Inc. لتوفير المبايض البقري المستخدمة في جميع التجارب. يشكر المؤلفون أيضا أوليفيا سيلفيرا للمساعدة في معالجة المبيض وعزل الجريب.
Materials
| Name | Company | Catalog Number | Comments |
| 5-3/4" Soda Lime Disposable Glass Pasteur Pipette | Duran Wheaton Kimble | 63A54 | Pasteur pipette that can be used to dislodge follicles from debris while searching within the petri dish |
| 16% Paraformaldehyde | Electron Microscopy Sciences | 15710 | Diluted to 4%; fixation of follicles for immunostaining |
| 20 mL Luer-lock Syringe | Fisher Scientific | Z116882-100EA | Syringe used with the 18 G needle to dislodge follicles from the 40 μm cell strainer |
| #21 Sterile Scalpel Blade | Fisher Scientific | 50-365-023 | Used to cut the ovaries and remove the medula |
| 40 μm Cell Strainer | Fisher Scientific | 22-363-547 | Used to filter the filtrate from the 300 μm cell strainer |
| 104 mm Plastic Funnel | Fisher Scientific | 10-348C | Size can vary, but ensure the cheese cloth is cut appropriately and that the ovarian homogenate will not spill over |
| 300 μm Cell Strainer | pluriSelect | 43-50300-03 | Used to filter the filtrate from the cheese cloth |
| 500 mL Erlenmeyer Flask | Fisher Scientific | FB500500 | Funnel and flask used to catch filtrate from the cheese cloth |
| Air-Tite Sterile Needles 18 G | Thermo Fisher Scientific | 14-817-151 | 18 G offers enough pressure to dislodge follicles from the 40 μm cell strainer |
| Air-Tite Sterile Needles 27 G 13 mm | Fisher Scientific | 14-817-171 | Needles that can be used to manipulate any debris in which follicles are stuck |
| BD Hoechst 33342 Solution | Fisher Scientific | BDB561908 | Fluorescent DNA stain |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A7030-100G | Component of follicle wash media |
| Cheese Cloth | Electron Microscopy Sciences | 71748-00 | First filtering step of the ovarian homogenate meant to remove large tissue debris |
| Classic Double Edge Safety Razor Blades | Wilkinson Sword | N/A | Razor blades that fit the best in the McIlwain Tissue Chopper and do not dull quickly |
| Donkey-Anti-Rabbit Secondary Antibody, Alexa Fluor 488 | Fisher Scientific | A-21206 | Secondary antibody for immunostaining |
| Eisco Latex Pipette Bulbs | Fisher Scientific | S29388 | Rubber bulb to use with Pasteur pipettes |
| HEPES Buffer | Sigma-Aldrich | H3375 | Component of follicle wash media |
| Homogenizer | VWR | 10032-336 | Homogenize the ovarian tissue to release follicles |
| ImageJ/Fiji | NIH | v2.3.1 | Software used for analysis of fluorescence-immunolocalization |
| McIlwain Tissue Chopper | Ted Pella | 10184 | Used to cut ovarian tissue small enough for homogenization |
| Microscope - Stereoscope | Olympus | SZX2-ILLT | Dissection microscope used for searching and harvesting follicles from the filtrate |
| Microscope - Inverted | Nikon | Diaphot 300 | Inverted microscope used for high magnification brightfield visualization of isolated follicles |
| Microscope - Inverted | ECHO | Revolve R4 | Inverted microscope used for high magnification brightfield and epifluorescence visualization of isolated follicles |
| Mineral Oil | Sigma-Aldrich | M8410-1L | Oil to cover the drops of follicle wash medium to prevent evaporation during searching |
| Non-essential Amino Acids (NEAA) | Gibco | 11140-050 | Component of follicle wash medium |
| Normal Donkey Serum | Jackson ImmunoResearch | 017-000-001 | Reagent for immunostaining blocking buffer |
| Nunc 4-well Dishes for IVF | Thermo Fisher Scientific | 144444 | 4-well dishes for follicle isolation and washing |
| Penicillin-Streptomycin Solution 100x | Gibco | 15-140-122 | Component of follicle wash medium |
| Petri Dish 60 mm OD x 13.7 mm | Ted Pella | 10184-04 | Petri dish that fits the best in the McIlwain Tissue Chopper |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | BP665-1 | Washing buffer for ovaries and follicles |
| Plastic Cutting Board | Fisher Scientific | 09-002-24A | Cutting board of sufficient size to safely cut ovaries |
| Polyvinylpyrrolidone (PVP) | Fisher Scientific | BP431-100 | Addition of PVP (0.1% w/v) to PBS prevents follicles from sticking to the plate or each other |
| ProLong Gold Antifade Mountant | Thermo Fisher Scientific | P36930 | Mounting medium for fluorescently labeled cells or tissue |
| Qiagen RNeasy Micro Kit | Qiagen | 74004 | RNA column clean-up kit |
| R | The R Foundation | v4.1.2 | Statistical analysis software |
| Rabbit-Anti-Human Cx37/GJA4 Polyclonal Antibody | Abcam | ab181701 | Cx37 primary antibody for immunostaining |
| RevertAid RT Reverse Transcription Kit | Thermo Fisher Scientific | K1691 | cDNA synthesis kit |
| Rstudio | RStudio, PBC | v2021.09.2 | Statistical analysis software |
| Sodium Hydroxide Solution (1N/Certified) | Fisher Scientific | SS266-1 | Used to increase media pH to 7.6-7.8 |
| Sodium Pyruvate (NaPyr) | Gibco | 11360-070 | Component of follicle wash medium |
| Square Petri Dish 100 mm x 15 mm | Thermo Fisher Scientific | 60872-310 | Gridded petri dishes allow for more efficient identification of follicles |
| SsoAdvanced Universal SYBR Green Supermix | BioRad | 1725271 | Mastermix for PCR reaction |
| Steritop Threaded Bottle Top Filter | Sigma-Aldrich | S2GPT02RE | Used to sterilize follicle wash medium |
| SYBR-safe DNA gel stain | Thermo Fisher Scientific | S33102 | Staining to visual PCR products on agarose gel |
| TCM199 with Hank’s Salts | Gibco | 12-350-039 | Component of follicle wash medium |
| Triton X-100 | Fisher Scientific | BP151-100 | Detergent for immunostaining permeabilization buffer |
| Trizol reagent | Thermo Fisher Scientific | 15596026 | RNA isolation reagent |
| Trypan Blue Solution, 0.4% | Gibco | 15-250-061 | Used for testing viability of isolated follicles |
| Tween 20 | Detergent for immunostaining wash buffer | ||
| Warmer Plate Universal | WTA | 20931 | Warm plate to keep follicles at 38.5 °C while searching under the microscope |
| Wiretrol II Calibrated Micropipets | Drummond | 50002-005 | Glass micropipettes to manipulate follicles |
References
- Fortune, J. E., Yang, M. Y., Allen, J. J., Herrick, S. L. Triennial reproduction symposium: The ovarian follicular reserve in cattle: What regulates its formation and size. Journal of Animal Science. 91 (7), 3041-3050 (2013).
- Fair, T., Hulshof, S. C., Hyttel, P., Greve, T., Boland, M. Oocyte ultrastructure in bovine primordial to early tertiary follicles. Anatomy and Embryology. 195 (4), 327-336 (1997).
- Jaffe, L. A., Egbert, J. R. Regulation of mammalian oocyte meiosis by intercellular communication within the ovarian follicle. Annual Review of Physiology. 79, 237-260 (2017).
- Driancourt, M. A., Reynaud, K., Cortvrindt, R., Smitz, J. Roles of KIT and KIT LIGAND in ovarian function. Reviews of Reproduction. 5 (3), 143-152 (2000).
- Lussier, J. G., Matton, P., Dufour, J. J. Growth rates of follicles in the ovary of the cow. Journal of Reproductive Fertility. 81 (2), 301-307 (1987).
- Aerts, J. M. J., Bols, P. E. J. Ovarian follicular dynamics: a review with emphasis on the bovine species. Part I: Folliculogenesis and preantral follicle development. Reproduction in Domestic Animals. 45 (1), 171-179 (2010).
- Sugiura, K., Pendola, F. L., Eppig, J. J. Oocyte control of metabolic cooperativity between oocytes and companion granulosa cells: energy metabolism. Developmental Biology. 279 (1), 20-30 (2005).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biology of Reproduction. 73 (2), 351-357 (2005).
- Sugimura, S., et al. Amphiregulin co-operates with bone morphogenetic protein 15 to increase bovine oocyte developmental competence: effects on gap junction-mediated metabolite supply. Molecular Human Reproduction. 20 (6), 499-513 (2014).
- Edson, M. A., Nagaraja, A. K., Matzuk, M. M. The mammalian ovary from genesis to revelation. Endocrine Reviews. 30 (6), 624-712 (2009).
- Matzuk, M. M., Burns, K. H. Genetics of mammalian reproduction: modeling the end of the germline. Annual Review of Physiology. 74, 503-528 (2012).
- McGee, E. A., Raj, R. S. Regulators of ovarian preantral follicle development. Seminars in Reproductive Medicine. 33 (3), 179-184 (2015).
- Chen, Y., et al. The factors and pathways regulating the activation of mammalian primordial follicles in vivo. Frontiers in Cell and Developmental Biology. 8, 575706 (2020).
- Figueiredo, J. R., et al. Development of a combined new mechanical and enzymatic method for the isolation of intact preantral follicles from fetal, calf and adult bovine ovaries. Theriogenology. 40 (4), 789-799 (1993).
- Sirard, M. A. The ovarian follicle of cows as a model for human. Animal Models and Human Reproduction. , 127-144 (2017).
- Parkes, W. S., et al. Hyaluronan and collagen are prominent extracellular matrix components in bovine and porcine ovaries. Genes. 12 (8), 1186 (2021).
- Araújo, V. R., Gastal, M. O., Figueiredo, J. R., Gastal, E. L. In vitro culture of bovine preantral follicles: a review. Reproductive Biology and Endocrinology. 12 (1), 1-14 (2014).
- Eppig, J. J., Schroeder, A. C. Capacity of mouse oocytes from preantral follicles to undergo embryogenesis and development to live young after growth, maturation, and fertilization in vitro. Biology of Reproduction. 41 (2), 268-276 (1989).
- McLaughlin, M., Telfer, E. E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Nuttinck, F., Mermillod, P., Massip, A., Dessy, F. Characterization of in vitro growth of bovine preantral ovarian follicles: A preliminary study. Theriogenology. 39 (4), 811-821 (1993).
- Demeestere, I., et al. Effect of preantral follicle isolation technique on in-vitro follicular growth, oocyte maturation and embryo development in mice. Human Reproduction. 17 (8), 2152-2159 (2002).
- Fattahi, A., et al. Optimization of porcine ovarian follicle isolation methods for better developmental potential. Tissue Engineering Part A. 26 (13-14), 712-719 (2020).
- Nagashima, J. B., Hill, A. M., Songsasen, N. In vitro development of mechanically and enzymatically isolated cat ovarian follicles. Reproduction and Fertility. 2 (1), 35-46 (2021).
- Lucci, C. M., Rumpf, R., Figueiredo, J. R., Báo, S. N. Zebu (Bos indicus) ovarian preantral follicles: Morphological characterization and development of an efficient isolation method. Theriogenology. 57 (5), 1467-1483 (2002).
- Langbeen, A., et al. Characterization of freshly retrieved preantral follicles using a low-invasive, mechanical isolation method extended to different ruminant species. Zygote. 23 (5), 683-694 (2014).
- Candelaria, J. I., Denicol, A. C. Characterization of isolated bovine preantral follicles based on morphology, diameter and cell number. Zygote. 28 (2), 154-159 (2020).
- vanden Hurk, R., et al. Ultrastructure and viability of isolated bovine preantral follicles. Human Reproduction Update. 4 (6), 833-841 (1998).
- Paes, V. M., et al. Effect of heat stress on the survival and development of in vitro cultured bovine preantral follicles and on in vitro maturation of cumulus-oocyte complex. Theriogenology. 86 (4), 994-1003 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological image analysis. Nature Methods. 9 (7), 676-682 (2012).
- de Aguiar, L. H., Hyde, K. A., Pedroza, G. H., Denicol, A. C. Heat stress impairs in vitro development of preantral follicles of cattle. Animal Reproduction Science. 213, 106277 (2020).
- Kristensen, S. G., Ebbesen, P., Andersen, C. Y. Transcriptional profiling of five isolated size-matched stages of human preantral follicles. Molecular and Cellular Endocrinology. 401, 189-201 (2015).
- Candelaria, J. I., Rabaglino, M. B., Denicol, A. C. Ovarian preantral follicles are responsive to FSH as early as the primary stage of development. Journal of Endocrinology. 247 (2), 153-168 (2020).
- Nuttinck, F., et al. Comparative immunohistochemical distribution of Connexin 37 and Connexin 43 throughout folliculogenesis in the bovine ovary. Molecular Reproduction and Development. 57 (1), 60-66 (2000).
- Itoh, T., Hoshi, H. Efficient isolation and long-term viability of bovine small preantral follicles in vitro. In Vitro Cellular and Developmental Biology-Animal. 36 (4), 235-240 (2000).
- Saha, S., Shimizu, M., Geshi, M., Izaike, Y. In vitro culture of bovine preantral follicles. Animal Reproduction Science. 63 (1-2), 27-39 (2000).
- Bus, A., et al. Preservation of connexin 43 and transzonal projections in isolated bovine pre-antral follicles before and following vitrification. Journal of Assisted Reproduction and Genetics. 38 (2), 479-492 (2021).
- Gougeon, A., Ecochard, R., Thalabard, J. C. Age-related changes of the population of human ovarian follicles: increase in the disappearance rate of non-growing and early-growing follicles in aging women. Biology of Reproduction. 50 (3), 653-663 (1994).
- Xu, D., et al. Raf-ERK1/2 signaling pathways mediate steroid hormone synthesis in bovine ovarian granulosa cells. Reproduction in Domestic Animals. 54 (5), 741-749 (2019).
- Santos, R. R., et al. Cryopreservation of ovarian tissue: an emerging technology for female germline preservation of endangered species and breeds. Animal Reproduction Science. 122 (3-4), 151-163 (2010).
- Leonel, E. C. R., Lucci, C. M., Amorim, C. A. Cryopreservation of human ovarian tissue: a review. Transfusion Medicine and Hemotherapy. 46 (3), 173-181 (2019).
- Bus, A., Langbeen, A., Martin, B., Leroy, J. I. M. R., Bols, P. E. J. Is the pre-antral ovarian follicle the 'holy grail' for female fertility preservation. Animal Reproduction Science. 207, 119-130 (2019).
- Chen, J., et al. Optimization of follicle isolation for bioengineering of human artificial ovary. Biopreservation and Biobanking. , (2021).
- Chiti, M. C., et al. A modified and tailored human follicle isolation procedure improves follicle recovery and survival. Journal of Ovarian Research. 10 (1), 1-9 (2017).
- Kristensen, S. G., Rasmussen, A., Byskov, A. G., Andersen, C. Y. Isolation of pre-antral follicles from human ovarian medulla tissue. Human Reproduction. 26 (1), 157-166 (2011).
- Oktay, K., et al. Isolation and characterization of primordial follicles from fresh and cryopreserved human ovarian tissue. Fertility and Sterility. 67 (3), 481-486 (1997).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved