需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用碎裂、均质化和连续过滤的组合从牛卵巢中分离小的前窦卵泡
摘要
推进前窦卵泡生成的研究需要从单个卵巢中分离卵泡的有效方法。这里介绍的是一种简化的机械方案,用于使用组织切碎器和均质器从牛卵巢中分离卵泡。该方法允许从单个卵巢中收集大量活的前窦卵泡。
摘要
了解哺乳动物卵泡发生的完整过程对于改善牲畜、人类和濒危物种的辅助生殖技术至关重要。由于难以分离较小的前窦卵泡,特别是在牛等大型哺乳动物中,研究主要局限于窦前卵泡和大前窦卵泡。这项工作提供了一种从单个牛卵巢中取出大量小前窦卵泡的有效方法。使用组织切碎器将单个牛卵巢的皮层切成500μm立方体,并使用10mm探针以9,000-11,000rpm匀浆6分钟。使用奶酪布从匀浆中分离大碎片,然后通过300μm和40μm细胞过滤器进行连续过滤。将保留在40μm过滤器中的内容物冲洗到搜索皿中,在那里鉴定卵泡并将其收集到一滴培养基中。通过台盼蓝染色 测试 收集的卵泡的活力。该方法能够在大约90分钟内从单个牛卵巢中分离出大量活的小前窦卵泡。重要的是,这种方法完全是机械的,避免使用酶解离组织,这可能会损害卵泡。使用该协议获得的卵泡可用于下游应用,例如用于RT-qPCR的RNA分离,特定蛋白质的免疫定位和 体外 培养。
引言
卵巢卵泡是卵巢的功能单位,负责配子(卵母细胞)的产生以及对生殖功能和整体健康至关重要的激素。原始卵泡在胎儿发育期间或新生儿期在卵巢中形成,具体取决于物种1,它们构成了女性的卵巢储备。卵泡生长始于原始卵泡的激活,这些卵泡离开休息池并进入生长阶段。前窦卵泡发生,包括窦发育前的所有卵泡阶段,是一个高度动态的过程,需要卵母细胞和周围颗粒细胞的同步形态和代谢变化,由这两种细胞类型之间的紧密通信驱动2,3。前窦卵泡构成了在任何给定时间在卵巢中发现的大部分滤泡单位4.据估计,通过卵泡生成的前窦阶段的发育比窦发育长数周5,6,并且这段时间是卵母细胞和体细胞获得足够成熟以进入发育的最后阶段(即窦期)所必需的,并为排卵,受精和胚胎发育做准备7,8,9。
目前关于卵巢前窦卵泡发生的大部分知识来自小鼠模型10,11,12,13,部分原因是从较小且纤维较少的卵巢中恢复大量这些卵泡的容易程度。尽管从牛卵巢中分离出大量前窦卵泡的报道可以追溯到大约30年前14,但对这些早期卵泡发育的调节过程的更完整的理解仍未实现,主要是由于缺乏优化,有效和可重复的方法来检索足够数量的活前窦卵泡,特别是在发育的早期阶段。随着人们对保存卵巢储备以备将来用于人类辅助生殖的兴趣日益浓厚,奶牛因其更相似的卵巢结构而成为有吸引力的模型15。然而,与小鼠卵巢16相比,牛卵巢的胶原蛋白明显更丰富,使得使用为小鼠描述的方法进行机械隔离的效率非常低。扩大生育力保存技术的努力包括将前窦卵泡完全体外生长到窦期,然后是封闭卵母细胞的体外成熟(IVM),体外受精(IVF)以及胚胎的产生和移植17。到目前为止,整个过程仅在小鼠18中实现。在牛中,体外卵泡生长的进展仅限于培养开始时具有可变卵泡阶段的少数报告,以及方案17,19之间的可变培养长度。
文献中描述的从牛卵巢中收获前窦卵泡的方法大多使用机械和酶促技术,无论是分离的还是组合的2,14,17,20。牛前窦卵泡分离方案的第一份报告使用组织匀浆器和连续过滤来处理整个卵巢20。这项研究之后,报告了利用胶原酶14的机械和酶程序。当利用胶原酶消化卵巢组织时,一个反复出现的主题是滤泡基底膜受损的潜在风险,这可能会损害卵泡活力14,21,22,23。因此,已经采用了不同的机械方法组合,例如使用组织切碎器和重复移液或组织切碎器与均质化相结合20,24,25,26。已经描述的另一种机械技术利用针直接从卵巢组织中解剖前窦卵泡,这对于分离较大的(>200μm)次级卵泡特别有用。然而,这个过程是耗时的,对于分离较小的前窦卵泡效率低下,并且在牛卵巢中尝试时依赖于技能组19,27,28。
利用文献中描述的不同技术,该协议旨在以简单,一致和有效的方式优化单个牛卵巢中前窦卵泡的分离,避免在酶溶液中孵育。改进分离前窦卵泡的方法将为增强对这一卵泡生成阶段的理解提供机会,并使开发有效的培养系统以将前窦卵泡发育到窦期。本文描述的从大型哺乳动物(如牛种)中分离前窦卵泡的详细程序对于旨在研究可转化为人类的非小鼠物种的早期卵泡发生的研究人员至关重要。
研究方案
牛(Bos taurus)卵巢来自当地的屠宰场,并在收集后6小时内运送到实验室。由于该设施处理的动物数量众多,动物的年龄、品种和发情周期的阶段是未知的。由于这些实验中没有使用活体动物,因此不需要批准的动物护理和使用方案。
1. 设备和试剂的准备
- 用台纸覆盖实验室工作台的 2 英尺宽部分。
- 获得手术刀手柄,无菌手术刀刀片,止血器,一对解剖钳,20 mL鲁尔锁注射器,18 G针头,两个200 mL烧杯,500 mL锥形瓶,直径104 mm的塑料漏斗,塑料砧板,每个正在处理的卵巢一个22 cm2 层粗棉布(粗棉布可以在使用前通过高压灭菌进行灭菌), 一个300μm细胞过滤器和一个40μm细胞过滤器(见 材料表)。
- 将所有设备转移到工作台上。
- 使用止血器将手术刀刀片插入手术刀手柄上。将刀片的倾斜底座与手柄上的角度指示器对齐,然后将刀片滑入手柄的凹槽中。
- 将漏斗放入锥形瓶中,并用粗棉布盖住漏斗开口。
- 每个卵巢放置一个50mL锥形管,在设置为38.5°C的水浴或珠浴中进行处理。
- 将一个100mm x 15mm方形培养皿放在设置为38.5°C的载玻片加热器上处理的每个卵巢。
- 将 10 mL 青霉素-链霉素(PenStrep;10,000 U/mL 青霉素和 10,000 μg/mL 链霉素)加入 1 L 1x 磷酸盐缓冲盐水 (PBS) 中。在卵巢处理前至少2小时在设置为38.5°C的水浴或珠浴中加热PBS + PenStrep。
注意:当分离的卵泡被培养时,PBS + PenStrep溶液对于清洗卵巢是必不可少的,并且仍然建议用于任何下游实验以减轻微生物污染。 - 为了收集处理过的卵巢滤液,请使用由TCM199和Hank's Salts(参见 材料表)组成的卵泡清洗培养基(FWM),其中含有3mg / mL牛血清白蛋白(BSA),25 mM HEPES缓冲液,100 UI青霉素/ 100μg/ mL链霉素,1 mM丙酮酸钠(NaPyr)和100 nM非必需氨基酸(NEAA)。
- 将无菌TCM199、250 mL瓶和100 mL量筒转移到生物安全柜(BSC)中。将 194 mL TCM199 转移到瓶中。
- 从平衡计分卡中取出TCM199烧杯并放入搅拌板中。向瓶中加入 600 毫克 BSA、1.19 克 HEPES 缓冲液和高压灭菌的搅拌棒并搅拌直至溶解。
- 一旦BSA和HEPES缓冲液完全溶解,向培养基中加入1N氢氧化钠(NaOH),直到其达到pH值为7.6-7.8的pH值,如pH计测量的那样。
- 在转移到平衡计分卡之前,用 70% 乙醇擦拭培养基瓶、真空过滤装置、四个 50 mL 锥形管以及 PenStrep、NaPyr 和 NEAA 瓶。
- 在TCM199 + 3 mg/mL BSA + 25 mM HEPES瓶中加入PenStrep(10,000 U / mL青霉素和10,000 μg/ mL链霉素),100 mM NaPyr和100x NEAA。无菌过滤最终培养基并等分到50 mL锥形管中。将培养基在4°C下储存长达2周。
- 在卵巢处理前至少1小时,在设置为38.5°C的珠浴中加热每两个卵巢一个50mL锥形培养基管。
2. 组织切碎器设置
- 确保组织切碎器(请参阅 材料表)已插入并打开。
- 根据制造商的规格,将切片厚度设置为 500 μm,刀片力控制旋钮设置为 20°,速度控制旋钮设置为 90°。
- 将60毫米塑料培养皿插入板架,并将板架插入其载物台上。
- 顺时针转动手动操作旋钮,将切碎臂抬高到尽可能高。
- 使用镊子,将双刃剃须刀片(见 材料表)放在插入切碎臂的螺钉上。将刀片扣放在刀片上,并用垫圈和螺母固定。让螺母松动四分之一。
- 旋转手动操作旋钮,直到切碎臂将刀片平放在培养皿上。用螺母起子拧紧其余部分的螺母。
- 使用手动操作旋钮将切碎臂抬高。将桌面释放旋钮一直向左移动,直到其凹槽到位。
3. 卵巢准备
- 在实验室中将卵巢转移到温暖(38.5°C)无菌PBS + PenStrep。
注意:建议在从动物身上取出后尽快处理卵巢以进行卵泡分离。在该协议中,卵巢在收获后6小时内处理。将卵巢从屠宰场运送到实验室,在含有无菌0.9%盐水溶液的保温瓶中,温度约为38.5°C。 - 如果可能,选择小(≤4厘米x 3厘米x 3厘米)卵巢,其中包含小(3-5毫米)窦卵泡,没有大的(≥8毫米)窦卵泡,也没有突出的黄体(图1)。建议使用这些标准,以确保在含有分离卵泡的最终方形培养皿中包括最少量的非卵泡碎片,例如基质细胞和细胞外基质。
注意:窦卵泡可以识别为卵巢表面的球形,充满液体的囊泡结构。黄体可以识别为从卵巢表面突出的红色、橙色或黄色僵硬结构。 - 使用剪刀去除卵巢中多余的结缔组织和脂肪。
- 在烧杯中用70%乙醇清洗卵巢30秒。
- 在温暖(38.5°C)PBS + PenStrep的烧杯中洗涤卵巢3次,每次洗涤使用新鲜的PBS + PenStrep洗涤2分钟。
- 将卵巢保持在温暖(38.5°C)PBS + PenStrep中,直到准备好处理。
注意:实验室和卵巢源之间的距离可以是可变的。因此,及时完成方案以确保维持卵泡活力非常重要。
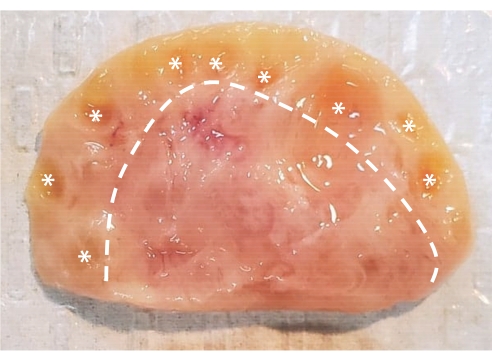
图1:牛卵巢的解剖结构。 牛卵巢由封闭在上皮层中的两个主要区域组成。皮层由虚线左侧的组织组成,包含从原始阶段到窦阶段的卵巢卵泡。前窦卵泡太小,肉眼无法看到;窦卵泡标有星号。髓质由虚线右侧的组织组成,包含血管、淋巴管和神经。 请点击此处查看此图的大图。
4. 切碎程序
注意:一次只能处理一个卵巢。快速处理卵巢以避免温度下降,这可能会影响卵泡活力。
- 将一个卵巢转移到工作台纸上的砧板上(图2A)并准备组织切碎器(图2B)。
- 使用镊子和手术刀将卵巢切成两半,并从每一半去除髓质,仅留下厚度约为1毫米的皮质,如图 2C所示。
- 将卵巢从一个韧带附着部位纵向切成两半到相反的附着部位。
- 将一半的卵巢保留在要处理的砧板上,然后将另一半卵巢放回温暖(38.5°C)PBS + PenStrep中。
- 暴露的髓质朝上,沿着卵巢的曲率切开,距离卵巢表面约2毫米,不要穿过皮层。
- 使用沿卵巢曲率的切片作为加深切片的指导,仍然遵循卵巢的曲率将皮层与髓质分开。
- 通过沿着黄体的边界切割,从卵巢中解剖并丢弃任何黄体。
- 将卵巢翻转一半,使上皮朝上,然后用手术刀完成将髓质从皮质上切开。修剪掉连接到韧带的卵巢片边缘周围任何残留的白色结缔组织。
- 去除大部分髓质后,用手术刀将皮质切成大约 1 毫米厚。用小的来回动作操纵手术刀,剃掉延髓的其余部分。
注意:髓质是含有大血管的卵巢内部。皮层是卵巢的外部,直接位于最外层表面上皮的下方。牛卵巢中的皮层厚度约为 1 毫米,因此将卵巢切成 1 毫米的厚度将去除髓质。
- 将皮层切成不超过 2.5 厘米 x 2.5 厘米的碎片。将皮层片保持在温暖(38.5°C)PBS + PenStrep中,直到准备切碎。
- 用至少 50 mL 温热 (38.5 °C) PBS + PenStrep 填充烧杯,并获得塑料转移移液器。
- 将一块皮层转移到组织切碎机上的培养皿中,并用三或四滴温(38.5°C)PBS + PenStrep润湿组织。
- 用一对镊子将组织固定住,然后按一次重置按钮以启动组织切碎器。用一只手稳定培养皿,同时继续用镊子稳定组织。根据需要沿组织向左移动镊子,以避免刀片撞击镊子。所得条带的长度约为 500 μm。
- 将整块皮质切成条状后,使用刀片架旋钮将刀片从培养皿和镊子上提起,以去除刀片上的任何组织。
- 将板架旋转 90°。
- 按一次重置按钮。用一只手稳定培养皿,同时使用镊子将组织条推入刀片的路径。
- 将刀片完全穿过组织条。使用刀片架旋钮将刀片从培养皿上提起,使用镊子从刀片上取下任何组织。
- 使用移液管和温热(38.5°C)PBS + PenStrep将切碎的组织(组织的最终尺寸:500μm x 500μm x 1mm立方体)洗涤到预热(38.5°C)50 mL锥形管中。将锥形管放回水或珠浴中,以保持切碎的组织温暖(38.5°C)。
- 使用螺母刀从切碎臂上取下螺母,然后取下垫圈和刀片扣。使用镊子,从切菜臂上取下刀片,将其翻转过来,使未使用的边缘面向培养皿,然后将其放回切臂上。更换刀片式服务器扣、垫圈和螺母,并按照步骤 2.5-2.7 中所述重置工作台释放旋钮。
- 对卵巢中所有剩余的皮层重复步骤4.5-4.12,在每个切削刃使用后用新刀片替换刀片。
- 将所有用过的刀片丢弃在硬壁塑料锐器容器中。
5. 均质程序
- 确保均质机单元(见 材料表)已插入,并将速度设置为第二巴(9,000-11,000 rpm)。根据制造商的规格将 10 mm 发生器探头插入设备。
- 设置一个计时器1分钟,并将探针插入50 mL锥形管中,其中包含来自一个卵巢的切碎皮质组织(步骤4.11)和足够的PBS + PenStrep以将管填充到25 mL线。探头插入的深度必须是从腔室底部测量的液体高度的 1/3。将探头稍微偏离中心以尽量减少涡旋。
- 启动计时器并打开均质机。确保探头底部不接触试管,并在均质器打开时保持试管静止。
- 均质化1分钟后,从管中取出探针。使用镊子去除堵塞通气孔以及转子刀和转子管之间空间的任何结缔组织。如果有任何皮层卡在探头中,请用镊子将其取出并放回管中。
- 重复步骤5.2-5.4,再增加5倍,总共6分钟的均质化。
- 将装有均质组织的管放入水或珠浴中以保持组织温暖(38.5°C)。处理完最后一个卵巢后,立即根据制造商的规格拆卸、清洁和干燥发生器探头。
6. 过滤程序
- 将分散的组织倒入插入锥形瓶中的粗棉布覆盖的漏斗中。使用温热(38.5°C)PBS + PenStrep将管的内容物冲洗到漏斗中,直到管中没有组织碎片残留。
- 通过将粗棉布缠绕在组织碎片周围并挤压直到从粗棉布上去除所有多余的液体和组织,迫使组织碎片穿过布的孔。
- 重新打开漏斗上的粗棉布,使用移液管用PBS + PenStrep冲洗粗棉布,然后再次通过布挤压任何残留的组织碎片。
- 使用止血器将 300 μm 细胞过滤器固定在 200 mL 烧杯上。将锥形瓶中的滤液倒入锥形瓶中,通过细胞过滤器。使用温热(38.5°C)PBS + PenStrep将烧瓶的内容物冲洗到细胞过滤器中,直到没有组织碎片残留。
- 如果细胞过滤器被组织堵塞,请轻轻敲击烧杯上的细胞过滤器,以确保所有液体都已过滤到烧杯中,然后将细胞过滤器倒置并将大组织碎片敲出到工作台纸上。将细胞过滤器放回烧杯上,然后继续将滤液倒入其中。根据需要重复,直到锥形瓶中的所有滤液都被过滤过。
- 使用止血器将 40 μm 细胞过滤器固定在第二个 200 mL 烧杯上。将前 200 mL 烧杯中的滤液倒入细胞过滤器中。使用温热(38.5°C)PBS + PenStrep将烧杯的内容物冲洗到细胞过滤器中,直到没有组织碎片残留。不要丢弃40μm细胞过滤器的内容物。
- 将 18 G 针头安装到 20 mL 注射器上。用FWM填充注射器。将40μm细胞过滤器倒置在方形培养皿上,并使用注射器将细胞过滤器的内容物洗出到培养皿中。重新填充注射器并根据需要冲洗细胞过滤器,直到没有组织碎片残留。
注意:通常,25 mL FWM 足以完全冲洗掉 40 μm 细胞过滤器的内容物。

图 2:卵巢处理和方案工作流程的工作区 设置。 (A)工作台设置,用于在切碎前切割卵巢和过滤卵巢匀浆。(B)组织切碎机和均质机设置,用聚苯乙烯泡沫塑料支撑,以减少均质机阶段的振动。(C)说明处理一个整个卵巢的工作流程的示意图。将卵巢从多余的结缔组织中修剪,然后切成两半,并去除髓质,直到留下~1毫米厚的皮层。将皮层切成2.5厘米x 2.5厘米的碎片,并在组织切碎器中切碎,切割间隔为500μm。然后将碎片均质化,均质通过粗棉布过滤,然后通过300μm和40μm细胞过滤器过滤。将40μm细胞过滤器的内容物冲洗到方形培养皿中,使用体视显微镜搜索卵泡。用 BioRender.com 创建。 请点击此处查看此图的大图。
7. 搜索和收集卵泡
- 将方形培养皿(步骤6.6)转移到立体镜中,加热阶段设置为38.5°C。 立体镜放大倍率应设置在 1.25 倍和 3.2 倍之间,具体取决于搜索者的偏好。
- 将 10 μL FWM 滴移液到 60 mm 培养皿中,并用矿物油覆盖液滴以防止变干。将带有培养基滴的培养皿放在设置为38.5°C的加热板上。
注意:4孔板可用于收集卵泡。将 500 μL 清洗介质加入一个或两个孔中。放在设置为38.5°C的加热板上。 - 获取微量移液器柱塞和吸头。
注意:建议使用玻璃1-5μL微量移液器(参见 材料表),因为滤泡不太可能粘附在玻璃移液器上,并且在溶液之间转移时会丢失。它也是一种足够小的仪器,可以更容易和更精确地对卵泡进行显微操作。 - 从方形培养皿中识别卵泡,并使用微量移液器转移到培养基(FWM)滴剂中。许多卵泡可能嵌入组织碎片中,可以使用下面描述的两种方法之一进行检索。
注意:卵泡是长方形的,而不是完美的球体,通常有一个卵母细胞,在较深的对比中呈现为一个实心白色圆圈,朝向卵泡的中心(图3A-C)。注意避免将卵泡与裸露的卵母细胞混淆。卵母细胞往往是完美的球体,并被厚厚的透明膜(透明带)包围。放大倍率为10倍(或更大)的倒置显微镜可用于仔细检查卵泡(图3D)。- 使用微量移液管的尖端或细针(27 G)小心地将卵泡与碎片分开。
- 或者,使用带有橡胶灯泡的玻璃巴斯德移液管多次吸收并喷出培养皿中的碎屑,以将卵泡从碎屑中取出。
- 快速工作,不超过30分钟,搜索培养皿以帮助保持卵泡活力。
- 每 10 μL 滴最多只能放置 5 个卵泡,因为更高的密度会增加卵泡粘附在一起的可能性。
8. 台盼蓝排除活性试验
注意:使用培养皿或4孔板的盖子进行以下所有步骤,因为毛囊粘在盖子的塑料上比粘在实际培养皿的塑料上少。
- 通过将 100 mg PVP 溶解在 50 mL PBS 中来制备 PBS + 0.2% 聚乙烯吡咯烷酮 (PVP)。
注意:这里使用PVP来减少卵泡附着在培养皿上的可能性。 - 使用微量移液器将所有卵泡(平均 40 个)从培养基滴液转移到 50 μL PBS + 0.2% PVP 液滴中。
- 将卵泡依次转移到新鲜的 50 μL PBS + 0.2% PVP 滴剂中,清洗卵泡 2 倍。
- 将卵泡转移到 285 μL PBS + 0.2% PVP 滴剂中。
- 将 15 μL 台盼蓝加入 285 μL PBS + 0.2% PVP(终浓度为 0.05% 台盼蓝)液滴中,并使用设置为 100 μL 的 200 μL 移液器吸头小心混合滴注。
注意:如果使用 4 孔板进行台盼活性测试,请在一个孔中加入 475 μL PBS + 0.2% PVP 和 25 μL 台盼蓝。 - 将卵泡在台盼蓝滴中孵育 1 分钟,然后将卵泡转移到 50 μL 滴(或 500 μL 孔)的 PBS + 0.2% PVP 中。
- 按照步骤8.3用新鲜的50μL滴剂(或每孔500μL)PBS + 0.2%PVP洗涤卵泡3次。
- 丢弃在PBS + 0.2%PVP中洗涤三次后仍呈蓝色的任何卵泡,因为这些卵泡是不可存活的。任何在三次洗涤后不保留蓝色的卵泡都是可行的,可用于免疫荧光、培养或其他程序(图 3E)。将卵泡在液氮中快速冷冻,并储存在-80°C直至需要进一步使用。
- 按照步骤9和10中所述对卵泡进行RT-qPCR分析和免疫荧光染色。

图3:分离卵泡和台盼蓝排除试验。 (A-C)分离的卵泡通过体视显微镜以几个放大倍数成像。(A)初始搜索盘内碎片中的分离卵泡。单个卵泡用红色圈出。比例尺 = 2,000 μm。 (B)在覆盖有矿物油的卵泡洗涤介质液滴内分离的卵泡和碎片。比例尺 = 1,000 μm。 (C)在较高放大倍率下没有碎片的分离卵泡。比例尺 = 1,000 μm。 (D)使用倒置明场显微镜成像的分离卵泡。比例尺= 100μm。 (E)使用倒置明场显微镜和20倍物镜成像的活(未染色)和非活(蓝色染色)卵泡的代表性图像。比例尺 = 100 μm。 请点击此处查看此图的大图。
9. 逆转录-qPCR分析
- 使用RNA分离试剂从活卵泡中分离RNA(从步骤8.8开始)(参见 材料表)。纯化RNA并根据制造商的说明使用市售的净化试剂盒(参见 材料表)用DNase处理。
- 用 14 μL 不含 RNase 的水洗脱 RNA,并使用分光光度计定量。RNA可以储存在-80°C直到cDNA合成。
- 根据制造商的说明,使用市售的cDNA合成试剂盒(参见 材料表)从初级和早期次级卵泡中提取的等量的RNA中进行cDNA合成。将反应混合物在25°C下孵育5分钟,然后在42°C下孵育60分钟,然后通过在70°C下加热5分钟来终止反应。
- 使用市售反应混合物(参见材料表)对合成的cDNA(每次反应5ng)和引物(表1)进行RT-qPCR。使用热循环条件:在95°C下30秒进行聚合酶活化,然后进行40个扩增循环,其中每个循环包括在95°C下变性15秒,在60°C下30秒进行退火/延伸。通过量化循环阈值 (Ct) 值来分析 RT-qPCR 和/或使用琼脂糖凝胶电泳查看 PCR 产物。
注意:本研究评估了颗粒细胞标志物 FSHR 和生殖细胞标志物 DAZL 的转录表达。参考基因是 H2A 和 ACTB。 - 通过每5秒以0.5°C的增量将温度从65°C增加到达到95°C来运行熔融曲线分析。
10. 免疫荧光分析
- 在室温 (RT) 下在 100 μL 滴 4% (v/v) 多聚甲醛 (PFA) 中固定活卵泡(来自步骤 8.8)15 分钟,然后在 100 μL 滴 PBS + 0.1% BSA + 0.1% 吐温 20 中洗涤 3 次。
- 在室温下在由1x PBS + 5%(v / v)正常驴血清(NDS)组成的封闭缓冲液中将卵泡封闭1小时。封闭后,将卵泡在4°C下在100μL滴4μg/ mL兔抗人CX37抗体或4μg/ mL兔同种型IgG(阴性对照)中孵育过夜在封闭缓冲液中稀释。
- 在 100 μL PBS + 0.1% BSA + 0.1% 吐温 20 滴中洗涤卵泡 3 次,然后在黑暗中在室温下在 100 μL 滴落的 2 μg/mL 驴抗兔 AlexaFluor 488 二抗中孵育 1 小时在封闭缓冲液中。
- 将卵泡在室温下在黑暗中孵育 5 分钟,在 100 μL 滴 1 μg/mL Hoechst 33342 中稀释在封闭缓冲液中以标记 DNA。
- 将卵泡转移到玻璃显微镜载玻片上的5μL封片剂(参见 材料表)中,并盖上盖玻片。将载玻片在室温下固化过夜,然后用指甲油密封。将它们储存在4°C直至成像。
- 在盖子滑动后48小时内对所有载玻片进行成像。在DAPI(激发380nm和发射450nm)和FITC(激发470nm和发射525nm)滤光片下使用倒落射荧光显微镜(参见 材料表)进行成像。
- 固定两个通道的曝光时间。根据兔同种型阴性对照调整FITC(CX37)曝光时间。使用20倍物镜,将DAPI通道设置为50毫秒曝光时间,以鉴定兔子同种型标记的卵泡。
- 在FITC通道下对这些卵泡进行成像,并减少曝光时间,直到所有背景绿色信号被消除。请注意此曝光时间。
- 使用同种型 FITC 通道设置的曝光时间和 DAPI 通道的 50 ms 曝光时间对所有 CX37 抗体标记的卵泡进行成像。
- 使用计算机图像处理程序29处理信号强度,通过阈值化后的平均灰度区域来测量(参见 材料表)。
- 调整每个卵泡的DAPI图像的tiff文件,以便勾勒出整个卵泡。使用程序的分析 粒子 功能选择整个卵泡作为感兴趣区域(ROI)。
- 打开相应卵泡的 FITC 图像的 tiff 文件,并将从 DAPI 图像生成的 ROI 覆盖在 FITC 图像的顶部。使用程序的 测量 功能量化FITC图像的平均灰度区域,表示信号强度。
结果
概述和关键步骤
使用该协议,可以可靠地从单个卵巢中分离出实验相关数量的小牛前窦卵泡。从总共30个重复中,每个重复平均获得41个卵泡,范围为11至135个卵泡(图4A)。在14个重复中,通过在体视显微镜下使用1μm显微镜校准载玻片测量卵泡直径,如前所述26 所示,对卵泡发育阶段进行表征。使用这种方法,共有476个卵泡被分类为原发性?...
讨论
本协议详细介绍了一种可重复的方法,用于从牛卵巢中取出早期前窦卵泡,特别是在初级和早期二级。该协议建立在先前的报告20,25,30,34,35,36的基础上,并提供优化,导致从单个卵巢中分离出有意义数量的卵泡。使用这种方法分离的前窦卵泡...
披露声明
作者没有什么可透露的。
致谢
该项目部分由美国农业部多州项目W4112和加州大学戴维斯分校Jastro Shields授予SM资助。
作者要感谢Central Valley Meat,Inc.提供所有实验中使用的牛卵巢。作者还感谢Olivia Silvera在卵巢处理和卵泡分离方面的帮助。
材料
| Name | Company | Catalog Number | Comments |
| 5-3/4" Soda Lime Disposable Glass Pasteur Pipette | Duran Wheaton Kimble | 63A54 | Pasteur pipette that can be used to dislodge follicles from debris while searching within the petri dish |
| 16% Paraformaldehyde | Electron Microscopy Sciences | 15710 | Diluted to 4%; fixation of follicles for immunostaining |
| 20 mL Luer-lock Syringe | Fisher Scientific | Z116882-100EA | Syringe used with the 18 G needle to dislodge follicles from the 40 μm cell strainer |
| #21 Sterile Scalpel Blade | Fisher Scientific | 50-365-023 | Used to cut the ovaries and remove the medula |
| 40 μm Cell Strainer | Fisher Scientific | 22-363-547 | Used to filter the filtrate from the 300 μm cell strainer |
| 104 mm Plastic Funnel | Fisher Scientific | 10-348C | Size can vary, but ensure the cheese cloth is cut appropriately and that the ovarian homogenate will not spill over |
| 300 μm Cell Strainer | pluriSelect | 43-50300-03 | Used to filter the filtrate from the cheese cloth |
| 500 mL Erlenmeyer Flask | Fisher Scientific | FB500500 | Funnel and flask used to catch filtrate from the cheese cloth |
| Air-Tite Sterile Needles 18 G | Thermo Fisher Scientific | 14-817-151 | 18 G offers enough pressure to dislodge follicles from the 40 μm cell strainer |
| Air-Tite Sterile Needles 27 G 13 mm | Fisher Scientific | 14-817-171 | Needles that can be used to manipulate any debris in which follicles are stuck |
| BD Hoechst 33342 Solution | Fisher Scientific | BDB561908 | Fluorescent DNA stain |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A7030-100G | Component of follicle wash media |
| Cheese Cloth | Electron Microscopy Sciences | 71748-00 | First filtering step of the ovarian homogenate meant to remove large tissue debris |
| Classic Double Edge Safety Razor Blades | Wilkinson Sword | N/A | Razor blades that fit the best in the McIlwain Tissue Chopper and do not dull quickly |
| Donkey-Anti-Rabbit Secondary Antibody, Alexa Fluor 488 | Fisher Scientific | A-21206 | Secondary antibody for immunostaining |
| Eisco Latex Pipette Bulbs | Fisher Scientific | S29388 | Rubber bulb to use with Pasteur pipettes |
| HEPES Buffer | Sigma-Aldrich | H3375 | Component of follicle wash media |
| Homogenizer | VWR | 10032-336 | Homogenize the ovarian tissue to release follicles |
| ImageJ/Fiji | NIH | v2.3.1 | Software used for analysis of fluorescence-immunolocalization |
| McIlwain Tissue Chopper | Ted Pella | 10184 | Used to cut ovarian tissue small enough for homogenization |
| Microscope - Stereoscope | Olympus | SZX2-ILLT | Dissection microscope used for searching and harvesting follicles from the filtrate |
| Microscope - Inverted | Nikon | Diaphot 300 | Inverted microscope used for high magnification brightfield visualization of isolated follicles |
| Microscope - Inverted | ECHO | Revolve R4 | Inverted microscope used for high magnification brightfield and epifluorescence visualization of isolated follicles |
| Mineral Oil | Sigma-Aldrich | M8410-1L | Oil to cover the drops of follicle wash medium to prevent evaporation during searching |
| Non-essential Amino Acids (NEAA) | Gibco | 11140-050 | Component of follicle wash medium |
| Normal Donkey Serum | Jackson ImmunoResearch | 017-000-001 | Reagent for immunostaining blocking buffer |
| Nunc 4-well Dishes for IVF | Thermo Fisher Scientific | 144444 | 4-well dishes for follicle isolation and washing |
| Penicillin-Streptomycin Solution 100x | Gibco | 15-140-122 | Component of follicle wash medium |
| Petri Dish 60 mm OD x 13.7 mm | Ted Pella | 10184-04 | Petri dish that fits the best in the McIlwain Tissue Chopper |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | BP665-1 | Washing buffer for ovaries and follicles |
| Plastic Cutting Board | Fisher Scientific | 09-002-24A | Cutting board of sufficient size to safely cut ovaries |
| Polyvinylpyrrolidone (PVP) | Fisher Scientific | BP431-100 | Addition of PVP (0.1% w/v) to PBS prevents follicles from sticking to the plate or each other |
| ProLong Gold Antifade Mountant | Thermo Fisher Scientific | P36930 | Mounting medium for fluorescently labeled cells or tissue |
| Qiagen RNeasy Micro Kit | Qiagen | 74004 | RNA column clean-up kit |
| R | The R Foundation | v4.1.2 | Statistical analysis software |
| Rabbit-Anti-Human Cx37/GJA4 Polyclonal Antibody | Abcam | ab181701 | Cx37 primary antibody for immunostaining |
| RevertAid RT Reverse Transcription Kit | Thermo Fisher Scientific | K1691 | cDNA synthesis kit |
| Rstudio | RStudio, PBC | v2021.09.2 | Statistical analysis software |
| Sodium Hydroxide Solution (1N/Certified) | Fisher Scientific | SS266-1 | Used to increase media pH to 7.6-7.8 |
| Sodium Pyruvate (NaPyr) | Gibco | 11360-070 | Component of follicle wash medium |
| Square Petri Dish 100 mm x 15 mm | Thermo Fisher Scientific | 60872-310 | Gridded petri dishes allow for more efficient identification of follicles |
| SsoAdvanced Universal SYBR Green Supermix | BioRad | 1725271 | Mastermix for PCR reaction |
| Steritop Threaded Bottle Top Filter | Sigma-Aldrich | S2GPT02RE | Used to sterilize follicle wash medium |
| SYBR-safe DNA gel stain | Thermo Fisher Scientific | S33102 | Staining to visual PCR products on agarose gel |
| TCM199 with Hank’s Salts | Gibco | 12-350-039 | Component of follicle wash medium |
| Triton X-100 | Fisher Scientific | BP151-100 | Detergent for immunostaining permeabilization buffer |
| Trizol reagent | Thermo Fisher Scientific | 15596026 | RNA isolation reagent |
| Trypan Blue Solution, 0.4% | Gibco | 15-250-061 | Used for testing viability of isolated follicles |
| Tween 20 | Detergent for immunostaining wash buffer | ||
| Warmer Plate Universal | WTA | 20931 | Warm plate to keep follicles at 38.5 °C while searching under the microscope |
| Wiretrol II Calibrated Micropipets | Drummond | 50002-005 | Glass micropipettes to manipulate follicles |
参考文献
- Fortune, J. E., Yang, M. Y., Allen, J. J., Herrick, S. L. Triennial reproduction symposium: The ovarian follicular reserve in cattle: What regulates its formation and size. Journal of Animal Science. 91 (7), 3041-3050 (2013).
- Fair, T., Hulshof, S. C., Hyttel, P., Greve, T., Boland, M. Oocyte ultrastructure in bovine primordial to early tertiary follicles. Anatomy and Embryology. 195 (4), 327-336 (1997).
- Jaffe, L. A., Egbert, J. R. Regulation of mammalian oocyte meiosis by intercellular communication within the ovarian follicle. Annual Review of Physiology. 79, 237-260 (2017).
- Driancourt, M. A., Reynaud, K., Cortvrindt, R., Smitz, J. Roles of KIT and KIT LIGAND in ovarian function. Reviews of Reproduction. 5 (3), 143-152 (2000).
- Lussier, J. G., Matton, P., Dufour, J. J. Growth rates of follicles in the ovary of the cow. Journal of Reproductive Fertility. 81 (2), 301-307 (1987).
- Aerts, J. M. J., Bols, P. E. J. Ovarian follicular dynamics: a review with emphasis on the bovine species. Part I: Folliculogenesis and preantral follicle development. Reproduction in Domestic Animals. 45 (1), 171-179 (2010).
- Sugiura, K., Pendola, F. L., Eppig, J. J. Oocyte control of metabolic cooperativity between oocytes and companion granulosa cells: energy metabolism. Developmental Biology. 279 (1), 20-30 (2005).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biology of Reproduction. 73 (2), 351-357 (2005).
- Sugimura, S., et al. Amphiregulin co-operates with bone morphogenetic protein 15 to increase bovine oocyte developmental competence: effects on gap junction-mediated metabolite supply. Molecular Human Reproduction. 20 (6), 499-513 (2014).
- Edson, M. A., Nagaraja, A. K., Matzuk, M. M. The mammalian ovary from genesis to revelation. Endocrine Reviews. 30 (6), 624-712 (2009).
- Matzuk, M. M., Burns, K. H. Genetics of mammalian reproduction: modeling the end of the germline. Annual Review of Physiology. 74, 503-528 (2012).
- McGee, E. A., Raj, R. S. Regulators of ovarian preantral follicle development. Seminars in Reproductive Medicine. 33 (3), 179-184 (2015).
- Chen, Y., et al. The factors and pathways regulating the activation of mammalian primordial follicles in vivo. Frontiers in Cell and Developmental Biology. 8, 575706 (2020).
- Figueiredo, J. R., et al. Development of a combined new mechanical and enzymatic method for the isolation of intact preantral follicles from fetal, calf and adult bovine ovaries. Theriogenology. 40 (4), 789-799 (1993).
- Sirard, M. A. The ovarian follicle of cows as a model for human. Animal Models and Human Reproduction. , 127-144 (2017).
- Parkes, W. S., et al. Hyaluronan and collagen are prominent extracellular matrix components in bovine and porcine ovaries. Genes. 12 (8), 1186 (2021).
- Araújo, V. R., Gastal, M. O., Figueiredo, J. R., Gastal, E. L. In vitro culture of bovine preantral follicles: a review. Reproductive Biology and Endocrinology. 12 (1), 1-14 (2014).
- Eppig, J. J., Schroeder, A. C. Capacity of mouse oocytes from preantral follicles to undergo embryogenesis and development to live young after growth, maturation, and fertilization in vitro. Biology of Reproduction. 41 (2), 268-276 (1989).
- McLaughlin, M., Telfer, E. E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Nuttinck, F., Mermillod, P., Massip, A., Dessy, F. Characterization of in vitro growth of bovine preantral ovarian follicles: A preliminary study. Theriogenology. 39 (4), 811-821 (1993).
- Demeestere, I., et al. Effect of preantral follicle isolation technique on in-vitro follicular growth, oocyte maturation and embryo development in mice. Human Reproduction. 17 (8), 2152-2159 (2002).
- Fattahi, A., et al. Optimization of porcine ovarian follicle isolation methods for better developmental potential. Tissue Engineering Part A. 26 (13-14), 712-719 (2020).
- Nagashima, J. B., Hill, A. M., Songsasen, N. In vitro development of mechanically and enzymatically isolated cat ovarian follicles. Reproduction and Fertility. 2 (1), 35-46 (2021).
- Lucci, C. M., Rumpf, R., Figueiredo, J. R., Báo, S. N. Zebu (Bos indicus) ovarian preantral follicles: Morphological characterization and development of an efficient isolation method. Theriogenology. 57 (5), 1467-1483 (2002).
- Langbeen, A., et al. Characterization of freshly retrieved preantral follicles using a low-invasive, mechanical isolation method extended to different ruminant species. Zygote. 23 (5), 683-694 (2014).
- Candelaria, J. I., Denicol, A. C. Characterization of isolated bovine preantral follicles based on morphology, diameter and cell number. Zygote. 28 (2), 154-159 (2020).
- vanden Hurk, R., et al. Ultrastructure and viability of isolated bovine preantral follicles. Human Reproduction Update. 4 (6), 833-841 (1998).
- Paes, V. M., et al. Effect of heat stress on the survival and development of in vitro cultured bovine preantral follicles and on in vitro maturation of cumulus-oocyte complex. Theriogenology. 86 (4), 994-1003 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological image analysis. Nature Methods. 9 (7), 676-682 (2012).
- de Aguiar, L. H., Hyde, K. A., Pedroza, G. H., Denicol, A. C. Heat stress impairs in vitro development of preantral follicles of cattle. Animal Reproduction Science. 213, 106277 (2020).
- Kristensen, S. G., Ebbesen, P., Andersen, C. Y. Transcriptional profiling of five isolated size-matched stages of human preantral follicles. Molecular and Cellular Endocrinology. 401, 189-201 (2015).
- Candelaria, J. I., Rabaglino, M. B., Denicol, A. C. Ovarian preantral follicles are responsive to FSH as early as the primary stage of development. Journal of Endocrinology. 247 (2), 153-168 (2020).
- Nuttinck, F., et al. Comparative immunohistochemical distribution of Connexin 37 and Connexin 43 throughout folliculogenesis in the bovine ovary. Molecular Reproduction and Development. 57 (1), 60-66 (2000).
- Itoh, T., Hoshi, H. Efficient isolation and long-term viability of bovine small preantral follicles in vitro. In Vitro Cellular and Developmental Biology-Animal. 36 (4), 235-240 (2000).
- Saha, S., Shimizu, M., Geshi, M., Izaike, Y. In vitro culture of bovine preantral follicles. Animal Reproduction Science. 63 (1-2), 27-39 (2000).
- Bus, A., et al. Preservation of connexin 43 and transzonal projections in isolated bovine pre-antral follicles before and following vitrification. Journal of Assisted Reproduction and Genetics. 38 (2), 479-492 (2021).
- Gougeon, A., Ecochard, R., Thalabard, J. C. Age-related changes of the population of human ovarian follicles: increase in the disappearance rate of non-growing and early-growing follicles in aging women. Biology of Reproduction. 50 (3), 653-663 (1994).
- Xu, D., et al. Raf-ERK1/2 signaling pathways mediate steroid hormone synthesis in bovine ovarian granulosa cells. Reproduction in Domestic Animals. 54 (5), 741-749 (2019).
- Santos, R. R., et al. Cryopreservation of ovarian tissue: an emerging technology for female germline preservation of endangered species and breeds. Animal Reproduction Science. 122 (3-4), 151-163 (2010).
- Leonel, E. C. R., Lucci, C. M., Amorim, C. A. Cryopreservation of human ovarian tissue: a review. Transfusion Medicine and Hemotherapy. 46 (3), 173-181 (2019).
- Bus, A., Langbeen, A., Martin, B., Leroy, J. I. M. R., Bols, P. E. J. Is the pre-antral ovarian follicle the 'holy grail' for female fertility preservation. Animal Reproduction Science. 207, 119-130 (2019).
- Chen, J., et al. Optimization of follicle isolation for bioengineering of human artificial ovary. Biopreservation and Biobanking. , (2021).
- Chiti, M. C., et al. A modified and tailored human follicle isolation procedure improves follicle recovery and survival. Journal of Ovarian Research. 10 (1), 1-9 (2017).
- Kristensen, S. G., Rasmussen, A., Byskov, A. G., Andersen, C. Y. Isolation of pre-antral follicles from human ovarian medulla tissue. Human Reproduction. 26 (1), 157-166 (2011).
- Oktay, K., et al. Isolation and characterization of primordial follicles from fresh and cryopreserved human ovarian tissue. Fertility and Sterility. 67 (3), 481-486 (1997).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。