Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение малых преантральных фолликулов из бычьего яичника с использованием комбинации фрагментации, гомогенизации и последовательной фильтрации
В этой статье
Резюме
Продвижение исследования преантрального фолликулогенеза требует эффективных методов выделения фолликулов из одиночных яичников. Здесь представлен упрощенный механический протокол выделения фолликулов из яичников крупного рогатого скота с использованием измельчителя тканей и гомогенизатора. Этот метод позволяет собрать большое количество жизнеспособных преантральных фолликулов из одного яичника.
Аннотация
Понимание полного процесса фолликулогенеза млекопитающих имеет решающее значение для улучшения вспомогательных репродуктивных технологий у домашнего скота, людей и исчезающих видов. Исследования были в основном ограничены антральными и крупными преантральными фолликулами из-за трудностей с выделением более мелких преантральных фолликулов, особенно у крупных млекопитающих, таких как виды крупного рогатого скота. Эта работа представляет собой эффективный подход к извлечению большого количества небольших преантральных фолликулов из одного бычьего яичника. Кору отдельных бычьих яичников разрезали на 500 мкм кубиков с помощью измельчителя тканей и гомогенизировали в течение 6 мин при 9000-11000 об/мин с помощью 10-мм зонда. Крупный мусор отделяли от гомогената с помощью сырной ткани с последующей последовательной фильтрацией через клеточные сетчатые фильтры 300 мкм и 40 мкм. Содержимое, оставшееся в 40-мкм ситечке, промывали в поисковую посуду, где фолликулы были идентифицированы и собраны в каплю среды. Жизнеспособность собранных фолликулов была проверена с помощью окрашивания в синий цвет трипана. Этот метод позволяет выделить большое количество жизнеспособных мелких преантральных фолликулов из одного бычьего яичника примерно за 90 мин. Важно отметить, что этот метод является полностью механическим и позволяет избежать использования ферментов для диссоциации ткани, что может повредить фолликулы. Фолликулы, полученные с использованием этого протокола, могут быть использованы для последующих применений, таких как выделение РНК для RT-qPCR, иммунолокализация специфических белков и культура in vitro .
Введение
Фолликулы яичников являются функциональными единицами яичника, ответственными за выработку гаметы (ооцита), а также гормонов, критически важных для репродуктивной функции и общего состояния здоровья. Примордиальные фолликулы образуются в яичнике во время внутриутробного развития или в неонатальном периоде в зависимости от вида1, и они составляют женский овариальный резерв. Рост фолликулов начинается с активации первичных фолликулов, которые покидают бассейн покоя и входят в фазу роста. Преантральный фолликулогенез, охватывающий все стадии фолликула до развития антрального нерва, представляет собой высокодинамичный процесс, требующий синхронных морфологических и метаболических изменений в ооците и окружающих клетках гранулезы, обусловленных тесной связью между этими двумя типами клеток 2,3. Преантральные фолликулы составляют большинство фолликулярных единиц, обнаруженных в яичнике в любой момент времени4. Развитие через преантральные стадии фолликулогенеза оценивается на несколько недель дольше, чем антральное развитие 5,6, и это время необходимо для того, чтобы яйцеклетки и соматические клетки приобрели достаточную зрелость, чтобы войти в заключительную стадию развития (т. е. антральную стадию), и подготовиться к овуляции, оплодотворению и эмбриональному развитию 7,8,9.
Большая часть текущих знаний о преантральном фолликулогенезе яичников поступает из мышиных моделей 10,11,12,13, отчасти из-за легкости восстановления большого количества этих фолликулов из меньшего и менее волокнистого яичника. Хотя сообщения об выделении большого количества преантральных фолликулов из бычьих яичников датируются примерно 30 годами14, более полное понимание процессов, регулирующих развитие этих фолликулов на ранней стадии, остается нереализованным, в основном из-за отсутствия оптимизированных, эффективных и повторяемых методов для извлечения достаточного количества жизнеспособных преантральных фолликулов, особенно на ранних стадиях развития. С ростом интереса к сохранению овариального резерва для будущего использования в вспомогательной репродукции у людей, коровы становятся привлекательной моделью из-за их более похожей структуры яичников15. Однако бычий яичник заметно богаче коллагеном по сравнению с мышиным яичником16, что делает механическую изоляцию с использованием методов, описанных для мыши, очень неэффективной. Усилия по расширению методов сохранения фертильности включают полный рост преантральных фолликулов in vitro до антральной стадии, за которым следует созревание in vitro (IVM) заключенных ооцитов, экстракорпоральное оплодотворение (ЭКО), а также производство и перенос эмбрионов17. До сих пор весь этот процесс был достигнут только у мышей18. У крупного рогатого скота прогресс в направлении роста фолликулов in vitro ограничен несколькими сообщениями с переменными стадиями фолликула в начале культуры, а также переменной длиной культивирования между протоколами17,19.
Методы, описанные в литературе для сбора преантральных фолликулов из бычьего яичника, в основном использовали механические и ферментативные методы, либо изолированные, либо в комбинации 2,14,17,20. В первом отчете о протоколе выделения преантрального фолликула крупного рогатого скота использовался гомогенизатор ткани и последовательная фильтрация для обработки целых яичников20. За этим исследованием последовали отчеты, сочетающие механические и ферментативные процедуры, в которых использовалась коллагеназа14. Повторяющейся темой при использовании коллагеназы для переваривания ткани яичников является потенциальный риск повреждения фолликулярной базальной мембраны, что может поставить под угрозу жизнеспособность фолликула 14,21,22,23. Поэтому были использованы различные комбинации механических методов, такие как использование измельчителя ткани и повторного пипетки или измельчителятканей в сочетании с гомогенизацией 20,24,25,26. Другой механический метод, который был описан, использует иглы для рассечения преантральных фолликулов непосредственно из ткани яичников, что особенно полезно для выделения более крупных (>200 мкм) вторичных фолликулов. Однако этот процесс занимает много времени, неэффективен для выделения меньших преантральных фолликулов и зависит от набора навыков при попытке в бычьих яичниках 19,27,28.
Используя преимущества различных методов, описанных в литературе, этот протокол был направлен на оптимизацию выделения преантральных фолликулов из одиночных бычьих яичников простым, последовательным и эффективным способом, который позволяет избежать инкубации в ферментативных растворах. Совершенствование методов выделения преантральных фолликулов даст возможность углубить понимание этой стадии фолликулогенеза и позволит разработать эффективные культуральные системы для развития преантральных фолликулов до антральной стадии. Подробные процедуры, описанные в настоящем описании для выделения преантральных фолликулов от крупного млекопитающего, такого как бычий вид, будут иметь жизненно важное значение для исследователей, стремящихся изучить ранний фолликулогенез у немышечных видов, которые могут быть переведены на людей.
протокол
Яичники крупного рогатого скота (Bos taurus) были получены с местной скотобойни и транспортированы в лабораторию в течение 6 часов после сбора. Из-за большого количества животных, обрабатываемых в учреждении, возраст, порода и стадия цикла течки животных неизвестны. Поскольку в этих экспериментах не использовались живые животные, утвержденный протокол ухода за животными и их использования не требовался.
1. Подготовка оборудования и реагентов
- Накройте секцию лабораторного стенда шириной 2 фута настольной бумагой.
- Получить рукоятку скальпеля, стерильное лезвие скальпеля, гемостат, пару рассеченных щипцов, шприц luer-lock 20 мл, иглу 18 г, два стакана 200 мл, колбу Эрленмейера 500 мл, пластиковую воронку диаметром 104 мм, пластиковую разделочную доску, один слой марли22 см2 (марля может быть стерилизована автоклавированием перед использованием) на обрабатываемую яичник, клеточный сетчатый фильтр 300 мкм и клеточный сетчатый фильтр 40 мкм (см. Таблицу материалов).
- Переложите все оборудование на скамейку бумаги.
- Используйте гемостат, чтобы наклеить лезвие скальпеля на рукоятку скальпеля. Выровняйте наклонное основание лезвия по угловому индикатору на рукоятке, затем сдвиньте лезвие в канавку рукоятки.
- Поместите воронку в колбу Эрленмейера и накройте отверстие воронки марлей.
- Поместите по одной конической трубке объемом 50 мл на яичник для обработки в ванну с водой или бисером при температуре 38,5 °C.
- Поместите одну квадратную чашку Петри размером 100 мм x 15 мм на обрабатываемый завязь на скользящем нагревателе, установленном на 38,5 °C.
- Добавьте 10 мл пенициллина-стрептомицина (PenStrep; 10 000 Ед/мл пенициллина и 10 000 мкг/мл стрептомицина) к 1 л 1x фосфатного буферного физиологического раствора (PBS). Нагрейте PBS + PenStrep в ванне с водой или бисером, установленной до 38,5 °C, по крайней мере, за 2 ч до обработки яичников.
ПРИМЕЧАНИЕ: Раствор PBS + PenStrep необходим для промывания яичников, когда изолированные фолликулы будут культивированы, и он по-прежнему рекомендуется для любых последующих экспериментов для смягчения микробного загрязнения. - Для сбора обработанного фильтрата яичников используйте фолликулярную промывочную среду (FWM), состоящую из TCM199 с солями Хэнка (см. Таблицу материалов), содержащими 3 мг / мл бычьего сывороточного альбумина (BSA), буфер HEPES 25 мМ, пенициллин UI / 100 мкг / мл стрептомицина, 1 мМ пирувата натрия (NaPyr) и 100 нМ заменимых аминокислот (NEAA).
- Перенесите стерильный TCM199, бутылку 250 мл и градуированный цилиндр 100 мл в шкаф биобезопасности (BSC). Переложите в бутылку 194 мл TCM199.
- Снимите стакан TCM199 с BSC и доведите до перемешиваемой пластины. Добавьте 600 мг BSA, 1,19 г буфера HEPES и автоклавный перемешивание во флакон и перемешайте до растворения.
- Как только буфер BSA и HEPES полностью растворится, добавьте 1 N гидроксида натрия (NaOH) в среду, пока она не достигнет рН 7,6-7,8, измеренного рН-метром.
- Протрите бутылку со средой, вакуумное фильтрующее устройство, четыре конические трубки по 50 мл и бутылки PenStrep, NaPyr и NEAA с 70% этанолом перед передачей в BSC.
- Добавьте по 2 мл PenStrep (10 000 Ед/мл пенициллина и 10 000 мкг/мл стрептомицина), 100 мМ NaPyr и 100x NEAA во флакон TCM199 + 3 мг/мл BSA + 25 мМ HEPES. Стерильно фильтруют конечную среду и аликвоту в конические трубки объемом 50 мл. Хранить среду при температуре 4 °C до 2 недель.
- Нагревайте одну коническую трубку средой 50 мл на два яичника в бисерной ванне, установленной на 38,5 °C, по крайней мере, за 1 ч до обработки завязи.
2. Настройка измельчителя тканей
- Убедитесь, что измельчитель тканей (см. Таблицу материалов) подключен и включен.
- Установите толщину среза на 500 мкм, ручку управления силой лезвия на 20° и ручку управления скоростью на 90° в соответствии со спецификациями производителя.
- Вставьте 60-миллиметровую пластиковую чашку Петри в держатель пластины и вставьте держатель пластины на сцену.
- Поднимите руку рубки так высоко, как она будет идти, повернув ручку ручного управления по часовой стрелке.
- С помощью щипцов поместите обоюдоострое лезвие бритвы (см. Таблицу материалов) на винт, вставленный в рубящий рычаг. Поместите застежку лезвия поверх лезвия и закрепите шайбой и гайкой. Оставьте гайку на четверть оборота свободной.
- Поверните ручку ручного управления до тех пор, пока рубящий рычаг не защелкнет лезвие плоско на чашке Петри. Затяните гайку оставшуюся часть пути с помощью гайки.
- Поднимите руку рубки так высоко, как она будет идти, используя ручку ручного управления. Переместите ручку выпуска стола влево, пока она не встанет на место.
3. Подготовка яичников
- Переведите яичники в лаборатории на теплый (38,5 °C) стерильный PBS + PenStrep.
ПРИМЕЧАНИЕ: Рекомендуется обрабатывать яичники для выделения фолликулов, как только это возможно после удаления у животного. В этом протоколе яичники обрабатывались в течение 6 часов после сбора урожая. Яичники транспортировали со скотобойни в лабораторию в термосах, содержащих стерильный 0,9% физиологический раствор при температуре приблизительно 38,5 °C. - Если возможно, выберите маленькие (≤ 4 см х 3 см х 3 см) яичники, содержащие маленькие (3-5 мм) антральные фолликулы, без больших (≥8 мм) антральных фолликулов и без выступающих желтых тел (рисунок 1). Эти критерии рекомендуются для обеспечения того, чтобы минимальное количество нефулликулярного мусора, такого как стромальные клетки и внеклеточный матрикс, включалось в полученную квадратную чашку, содержащую изолированные фолликулы.
ПРИМЕЧАНИЕ: Антральные фолликулы могут быть идентифицированы как сферические, заполненные жидкостью везикулярные структуры на поверхности яичника. Corpora lutea может быть идентифицирована как красные, оранжевые или желтые жесткие структуры, выступающие из поверхности яичника. - Используйте ножницы, чтобы удалить излишки соединительной ткани и жира из яичников.
- Промыть яичники в течение 30 с в 70% этаноле в стакане.
- Мойте яичники 3 раза по 2 мин каждый в стаканах теплого (38,5 °C) PBS + PenStrep, используя свежий PBS + PenStrep для каждой стирки.
- Держите яичники в тепле (38,5 °C) PBS + PenStrep до готовности к обработке.
ПРИМЕЧАНИЕ: Расстояние между лабораторией и источником яичников может быть переменным. Поэтому важно своевременно завершить протокол, чтобы обеспечить поддержание жизнеспособности фолликулов.
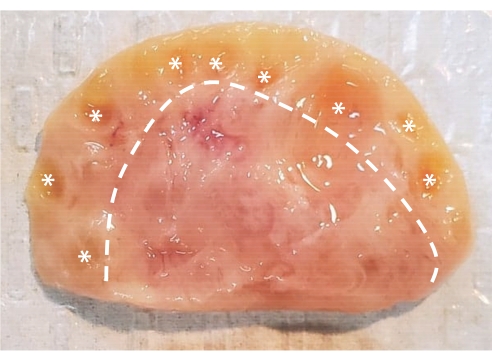
Рисунок 1: Анатомия бычьего яичника. Бычий яичник состоит из двух основных областей, заключенных в эпителиальный слой. Кора, состоящая из ткани слева от пунктирной линии, содержит фолликулы яичников от первичной стадии до антральной стадии. Преантральные фолликулы слишком малы, чтобы их можно было увидеть невооруженным глазом; антральные фолликулы отмечены звездочками. Продолговатый мозг, состоящий из ткани справа от пунктирной линии, содержит кровеносные сосуды, лимфатические сосуды и нервы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Процедура измельчения
ПРИМЕЧАНИЕ: Обрабатывайте только один яичник за раз. Быстро обрабатывать яичники, чтобы избежать снижения температуры, что может повлиять на жизнеспособность фолликула.
- Переложите один яичник на разделочную доску на стендовой бумаге (рисунок 2А) и подготовьте измельчитель тканей (рисунок 2В).
- Используя щипцы и скальпель, разрежьте завязь пополам и удалите продолговатый мозг с каждой половины, оставив только кору при толщине примерно 1 мм, как показано на рисунке 2C.
- Разрезайте яичник пополам продольно от одного места прикрепления связки к противоположному месту прикрепления.
- Держите одну половину завязи на разделочной доске для обработки, а другую половину яичника поместите обратно в теплую (38,5 ° C) PBS + PenStrep.
- Обнаженным продолговатым мозгом, обращенным вверх, разрезают вдоль кривизны яичника примерно на расстоянии 2 мм от поверхности яичника, не разрезая кору.
- Используйте срез вдоль кривизны яичника в качестве ориентира для углубления среза, все еще следуя за искривлением яичника, чтобы отделить кору от продолговатого мозга.
- Рассекните и выбросьте любые желтые тела из завязи, разрезав вдоль границы желтого тела.
- Переверните завязь наполовину так, чтобы эпителий был обращен вверх, и используйте скальпель, чтобы закончить отрезать продолговатый мозг от коры. Обрежьте любую оставшуюся белую соединительную ткань вокруг края яичника, который был соединен со связками.
- После того, как большая часть продолговатого мозга удалена, используйте скальпель, чтобы разрезать кору примерно до 1 мм толщины. Манипулируйте скальпелем небольшими движениями вперед-назад, чтобы сбрить оставшуюся часть продолговатого мозга.
ПРИМЕЧАНИЕ: Продолговатый мозг - это внутренняя часть яичника, содержащая крупные кровеносные сосуды. Кора — это внешняя часть яичника, лежащая непосредственно под самым внешним поверхностным эпителием. Кора имеет толщину примерно 1 мм в бычьем яичнике, и, таким образом, разрезание яичника до толщины 1 мм удалит продолговатый мозг.
- Разрежьте кору на кусочки размером не более 2,5 см х 2,5 см. Держите кусочки коры в тепле (38,5 °C) PBS + PenStrep до готовности к измельчению.
- Наполните стакан не менее чем 50 мл теплого (38,5 °C) PBS + PenStrep и получите пластиковую переносную пипетку.
- Переложите один кусочек коры в чашку Петри на измельчителе тканей и смочите ткань тремя или четырьмя каплями теплой (38,5 °C) PBS + PenStrep.
- Держите кусок ткани устойчивым с помощью пары щипцов и нажмите кнопку сброса один раз, чтобы запустить измельчитель ткани. Стабилизируйте чашку Петри одной рукой, продолжая стабилизировать ткань щипцами. Перемещайте щипцы влево вдоль ткани по мере необходимости, чтобы лезвие не ударилось о щипцы. Полученные полоски будут иметь длину около 500 мкм.
- После того, как весь кусок коры был разрезан на полоски, используйте ручку держателя лезвия, чтобы поднять лезвие с чашки Петри, и щипцы, чтобы удалить любую ткань из лезвия.
- Поверните держатель пластины на 90°.
- Нажмите кнопку сброса один раз. Стабилизируйте чашку Петри одной рукой, используя щипцы, чтобы протолкнуть полоски тканей на путь лезвия.
- Пропустите лезвие полностью через полоски тканей. Используйте ручку держателя лезвия, чтобы поднять лезвие с чашки Петри, и щипцы, чтобы удалить любую ткань из лезвия.
- Используйте переносную пипетку и теплый (38,5 °C) PBS + PenStrep для промывки измельченной ткани (конечный размер ткани: 500 мкм х 500 мкм х 1 мм кубиков) в предварительно нагретую (38,5 °C) коническую трубку объемом 50 мл. Верните коническую трубку в ванну с водой или бисером, чтобы сохранить измельченную ткань в тепле (38,5 °C).
- С помощью гайки извлеките гайку из измельчающего рычага и снимите шайбу и застежку лезвия. С помощью щипцов извлеките лезвие из рубящей руки, переверните его так, чтобы неиспользуемый край был обращен к чашке Петри, и поместите его обратно на рубящую руку. Замените застежку лезвия, шайбу и гайку и сбросьте ручку выпуска стола, как описано в шагах 2.5-2.7.
- Повторите шаги 4.5-4.12 для всех оставшихся кусочков коры от яичника, заменив лезвия новыми после того, как каждая режущая кромка была использована.
- Утилизируйте все использованные лезвия в пластиковый контейнер для острых изделий с твердыми стенками.
5. Процедура гомогенизации
- Убедитесь, что блок гомогенизатора (см. Таблицу материалов) подключен к сети, а скорость установлена на вторую планку (9 000-11 000 об/мин). Вставьте 10-миллиметровый датчик генератора в устройство в соответствии со спецификациями производителя.
- Установите таймер на 1 мин и вставьте зонд в коническую трубку объемом 50 мл, содержащую измельченную ткань коры головного мозга из одного яичника (шаг 4.11) и достаточное количество PBS + PenStrep, чтобы заполнить трубку до линии 25 мл. Глубина, на которую вставляется зонд, должна составлять 1/3 высоты жидкости, измеренной от нижней части камеры. Расположите зонд немного не по центру, чтобы свести к минимуму вихри.
- Запустите таймер и включите гомогенизатор. Убедитесь, что нижняя часть зонда не касается трубки, и держите трубку неподвижно, пока гомогенизатор включен.
- После 1 мин гомогенизации извлеките зонд из трубки. С помощью щипцов удалите любую соединительную ткань, засоряющую вентиляционные отверстия и пространство между ножом ротора и трубкой ротора. Если какие-либо кусочки коры застряли в зонде, удалите их щипцами и поместите обратно в трубку.
- Повторите шаги 5.2-5.4 еще 5x в общей сложности 6 мин гомогенизации.
- Поместите трубку с гомогенизированной тканью в ванну с водой или бисером, чтобы сохранить ткань теплой (38,5 °C). После обработки последнего яичника немедленно разберите, очистите и высушите датчик генератора в соответствии со спецификациями производителя.
6. Процедура фильтрации
- Налейте дисперсную ткань в покрытую марлей воронку, вставленную в колбу Эрленмейера. Смойте содержимое трубки в воронку с помощью теплого (38,5 °C) PBS + PenStrep до тех пор, пока в трубке не останутся фрагменты ткани.
- Заставьте фрагменты ткани пройти через отверстия ткани, скручив марлю вокруг фрагментов ткани и сжимая до тех пор, пока из марли не будет удалена вся лишняя жидкость и ткань.
- Снова откройте марлю над воронкой, промойте марлю PBS + PenStrep с помощью переносной пипетки и снова сожмите любые остаточные фрагменты ткани через ткань.
- Используйте гемостат для удержания клеточного ситечка 300 мкм над стаканом 200 мл. Вылейте фильтрат в колбу Эрленмайера через клеточное ситечко. Смойте содержимое колбы в клеточном ситечке, используя теплый (38,5 °C) PBS + PenStrep до тех пор, пока не останутся фрагменты ткани.
- Если клеточное ситечко засоряется тканью, осторожно прижмите клеточное ситечко к стакану, чтобы убедиться, что вся жидкость просочилась в стакан, а затем переверните клеточный ситечко вверх дном и вытащите крупные обломки тканей на бумагу скамейки. Верните клеточный ситечко над стаканом и продолжайте заливать фильтрат через него. Повторяйте по мере необходимости до тех пор, пока весь фильтрат из колбы Эрленмайера не будет отфильтрован насквозь.
- Используйте гемостат для удержания клеточного ситечка 40 мкм в течение второго стакана объемом 200 мл. Вылейте фильтрат в первый стакан объемом 200 мл через клеточный ситечко. Смойте содержимое стакана в клеточный ситечко, используя теплый (38,5 °C) PBS + PenStrep до тех пор, пока не останутся фрагменты ткани. Не выбрасывайте содержимое 40-мкм клеточного ситечка.
- Поднесите иглу весом 18 г к шприцу объемом 20 мл. Наполните шприц FWM. Переверните 40-мкм клеточное ситечко вверх ногами над квадратной чашкой Петри и используйте шприц, чтобы вымыть содержимое клеточного ситечка в чашку. Наполните шприц и промойте клеточный ситечко по мере необходимости, пока не останутся фрагменты ткани.
ПРИМЕЧАНИЕ: Как правило, 25 мл FWM достаточно для полного смывания содержимого 40-мкм клеточного сетчатого фильтра.

Рисунок 2: Настройка рабочего пространства для обработки яичников и протокольного рабочего процесса. (A) Настольная установка для резки яичников перед измельчением и для фильтрации гомогената яичника. (B) Установка измельчителя и гомогенизатора тканей с поддержкой из пенополистирола для снижения вибраций стадии гомогенизатора. (C) Схема, иллюстрирующая рабочий процесс обработки одного целого яичника. Яичники обрезают излишки соединительной ткани, а затем разрезают пополам, а продолговатый мозг удаляют до тех пор, пока не останется срез коры толщиной ~ 1 мм. Кору разрезают на кусочки размером 2,5 см х 2,5 см и рубят в измельчителе ткани, установленном с интервалом реза 500 мкм. Затем кусочки гомогенизируют, и гомогенат фильтруют через марлю с последующей фильтрацией через клеточные сетчатые фильтры 300 мкм и 40 мкм. Содержимое 40-мкм клеточного ситечка промывают в квадратную чашку Петри, которую ищут фолликулы с помощью стереомикроскопа. Создано с помощью BioRender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
7. Поиск и сбор фолликулов
- Перенесите квадратную чашку Петри (шаг 6.6) в стереоскоп с разогретой сценой, установленной до 38,5 °C. Увеличение стереоскопа должно быть установлено между 1,25x и 3,2x в зависимости от предпочтений поисковика.
- Пипетка 10 мкл капли FWM в 60 мм чашку Петри и накройте капли минеральным маслом, чтобы предотвратить высыхание. Поместите чашку Петри с каплями среды на нагревательную пластину, установленную на 38,5 °C.
ПРИМЕЧАНИЕ: 4-луночная пластина может быть использована для сбора фолликулов. Добавьте 500 мкл промывочной среды в одну или две скважины. Поместите на нагревательную пластину, установленную на 38,5 °C. - Приобретите микропипетку плунжера и наконечник.
ПРИМЕЧАНИЕ: Рекомендуется использовать стеклянную микропипетку объемом 1-5 мкл (см. Таблицу материалов), поскольку фолликулы с меньшей вероятностью прилипают к стеклянной пипетке и теряются при переносе между растворами. Это также достаточно маленький инструмент, чтобы обеспечить более легкое и точное микроманипуляцию фолликулов. - Определите фолликулы из квадратной чашки Петри и переведите на носитель (FWM) капли с помощью микропипетки. Многие фолликулы, вероятно, будут встроены в тканевые обломки и могут быть извлечены с использованием одного из двух методов, описанных ниже.
ПРИМЕЧАНИЕ: Фолликулы продолговатые, а не совершенные сферы, и обычно имеют ооцит, представляющий собой сплошной белый круг в более темных контрастах, к центру фолликула (рисунок 3A-C). Позаботьтесь о том, чтобы не путать фолликулы с оголенными ооцитами. Ооциты, как правило, являются идеальными сферами и окружены толстой, прозрачной мембраной (zona pellucida). Инвертированный микроскоп с увеличением в 10 раз (или выше) может быть использован для более тщательного изучения фолликулов (рисунок 3D).- Тщательно отделите фолликулы от мусора с помощью кончика микропипетки или тонких (27 г) игл.
- В качестве альтернативы, используйте стеклянную пипетку Пастера с резиновой колбой, чтобы взять и выплюнуть мусор в тарелке несколько раз, чтобы выбить фолликулы из мусора.
- Работайте быстро, не дольше 30 минут, чтобы обыскать чашку Петри, чтобы помочь сохранить жизнеспособность фолликула.
- Поместите максимум только пять фолликулов на каплю 10 мкл, так как более высокая плотность может увеличить вероятность того, что фолликулы будут слипаться вместе.
8. Тест на жизнеспособность исключения синего цвета Трипана
ПРИМЕЧАНИЕ: Используйте крышку чашки Петри или 4-луночную пластину для всех следующих шагов, так как фолликулы прилипают меньше к пластику крышки, чем к пластику самой чашки.
- Приготовьте PBS + 0,2% поливинилпирролидона (PVP), растворив 100 мг PVP в 50 мл PBS.
ПРИМЕЧАНИЕ: PVP используется здесь для снижения вероятности прикрепления фолликулов к блюду. - Используйте микропипетку для переноса всех фолликулов (в среднем 40) из капель среды в каплю PBS + 0,2% PVP объемом 50 мкл.
- Промыть фолликулы в 2 раза, переведя их последовательно на свежие 50 мкл капли PBS + 0,2% PVP.
- Переведите фолликулы на 285 мкл капли PBS + 0,2% PVP.
- Добавьте 15 мкл трипана синего к 285 мкл капли PBS + 0,2% PVP (конечная концентрация 0,05% трипан синего) и тщательно перемешайте каплю, используя наконечник пипетки 200 мкл, установленный на 100 мкл.
ПРИМЕЧАНИЕ: При использовании 4-луночной пластины для испытания на жизнеспособность трипана добавьте 475 мкл PBS + 0,2% PVP и 25 мкл трипан-синего в одну лунку. - Инкубируют фолликулы в течение 1 мин в трипан синей капле, а затем переносят фолликулы в каплю 50 мкл (или 500 мкл хорошо) PBS + 0,2% PVP.
- Промыть фолликулы в 3 раза в соответствии со стадией 8.3 свежими каплями 50 мкл (или 500 мкл на лунку) PBS + 0,2% PVP.
- Отбросьте все фолликулы, которые все еще кажутся синими после трех промывок в PBS + 0,2% PVP, так как они нежизнеспособны. Любые фолликулы, которые не сохраняют синюю окраску после трех промываний, жизнеспособны и могут быть использованы для иммунофлуоресценции, культивирования или других процедур (рисунок 3E). Заморозьте фолликулы в жидком азоте и храните при -80 °C до дальнейшего использования, если это необходимо.
- Выполняют анализ RT-qPCR и иммунофлуоресцентное окрашивание фолликулов, как описано в шагах 9 и 10.

Рисунок 3: Изолированные фолликулы и тест на исключение синего трипана. (A-C) Изолированные фолликулы были визуализированы через стереомикроскоп при нескольких увеличениях. (A) Изолированные фолликулы среди мусора в пределах первоначальной поисковой чашки. Отдельные фолликулы обведены красным цветом. Шкала бара = 2000 мкм. (B) Изолированные фолликулы и мусор внутри капли среды для промывания фолликула, покрытой минеральным маслом. Шкала бара = 1000 мкм. (C) Изолированные фолликулы без мусора при более высоком увеличении. Шкала = 1000 мкм. (D) Изолированные фолликулы, визуализированные с помощью инвертированного микроскопа яркого поля. Шкала = 100 мкм. (E) Репрезентативные изображения жизнеспособных (неокрашенных) и нежизнеспособных (синее пятно) фолликулов, визуализированных с помощью инвертированного яркого микроскопа и 20-кратного объектива. Шкала = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
9. Анализ RT-qPCR
- Изолируйте РНК из жизнеспособных фолликулов (с этапа 8.8) с помощью реагента для выделения РНК (см. Таблицу материалов). Очистите РНК и обработайте ДНКазой с помощью коммерчески доступного комплекта для очистки (см. Таблицу материалов) в соответствии с инструкциями производителя.
- Элюируют РНК 14 мкл рваной воды и количественно оценивают с помощью спектрофотометра. РНК может храниться при -80 °C до синтеза кДНК.
- Осуществляют синтез кДНК из равных количеств РНК, извлеченных из первичных и ранних вторичных фолликулов, используя коммерчески доступный набор для синтеза кДНК (см. Таблицу материалов) в соответствии с инструкциями производителя. Инкубируют реакционную смесь в течение 5 мин при 25°С, затем 60 мин при 42°С, затем прекращают реакцию нагреванием при 70°С в течение 5 мин.
- Выполняют ОТ-qPCR с синтезированной кДНК (5 нг на реакцию) и грунтовками (таблица 1) с использованием коммерчески доступной реакционной смеси (см. Таблицу материалов). Используйте условия теплового цикла: 30 с при 95 °C для активации полимеразы, затем 40 циклов амплификации, где каждый цикл включал 15 с при 95 °C для денатурации и 30 с при 60 °C для отжига/расширения. АнализИРУЙТЕ ОТ-qPCR путем количественной оценки значений порога цикла (Ct) и/или просмотрите продукты ПЦР с использованием электрофореза агарозного геля.
ПРИМЕЧАНИЕ: В этом исследовании оценивали экспрессию транскрипта гранулезно-клеточного маркера FSHR и маркера зародышевых клеток DAZL . Референсными генами были H2A и ACTB. - Запустите анализ кривой расплава, увеличивая температуру с 65 °C с шагом 0,5 °C каждые 5 с, пока она не достигнет 95 °C.
10. Иммунофлуоресцентный анализ
- Фиксируют жизнеспособные фолликулы (со стадии 8.8) в течение 15 мин в капле 100 мкл параформальдегида (PFA) (PFA) при комнатной температуре (RT) с последующей промывкой 3x в 100 мкл капель PBS + 0,1% BSA + 0,1% Tween 20.
- Блокируйте фолликулы в течение 1 ч при РТ в блокирующем буфере, состоящем из 1x PBS + 5% (v/v) нормальной ослиной сыворотки (NDS). После блокировки инкубируют фолликулы в течение ночи при 4 °C в капле 100 мкл 4 мкг/мл античеловеческого антитела CX37 кролика или 4 мкг/мл кролика изотипа IgG (отрицательный контроль), разбавленного в блокирующем буфере.
- Промыть фолликулы 3x в 100 мкл каплях PBS + 0,1% BSA + 0,1% Tween 20, а затем инкубировать их в течение 1 ч при RT в темноте в капле 100 мкл 2 мкг/мл ослик-анти-кролик AlexaFluor 488 вторичное антитело разбавлено в блокирующем буфере.
- Инкубируют фолликулы в течение 5 мин при РТ в темноте в капле 100 мкл 1 мкг/мл Hoechst 33342, разведенной в блокирующем буфере для маркировки ДНК.
- Переложите фолликулы на каплю монтажной среды объемом 5 мкл (см. Таблицу материалов) на предметном стекле стеклянного микроскопа и накройте крышкой. Оставьте горки для отверждения в RT на ночь, с последующим запечатыванием лаком для ногтей. Храните их при температуре 4 °C до получения изображения.
- Изображение всех слайдов в течение 48 часов после скольжения крышки. Выполняйте визуализацию с помощью инвертированного эпифлуоресцентного микроскопа (см. Таблицу материалов) под фильтрами DAPI (возбуждение 380 нм и излучение 450 нм) и FITC (возбуждение 470 нм и эмиссия 525 нм).
- Зафиксируйте время экспозиции для обоих каналов. Отрегулируйте время воздействия FITC (CX37) на основе отрицательного контроля изотипа кролика. Используйте 20-кратную цель и канал DAPI, установленный на время экспозиции 50 мс, чтобы идентифицировать фолликулы, меченые изотипом кролика.
- Визуализируйте эти фолликулы под каналом FITC и уменьшите время экспозиции до тех пор, пока весь фоновый зеленый сигнал не будет отменен. Обратите внимание на это время экспозиции.
- Визуализируйте все фолликулы, меченые антителами CX37, используя время экспозиции, установленное для канала FITC изотипа, и время экспозиции 50 мс для канала DAPI.
- Обработайте интенсивность сигнала, измеряемую средней серой областью после порогового значения, с помощью компьютерной программыобработки изображений 29 (см. Таблицу материалов).
- Отрегулируйте tiff-файл изображения DAPI для каждого фолликула таким образом, чтобы весь фолликул был очерчен. Используйте функцию «Анализировать частицы» программы, чтобы выбрать весь фолликул в качестве интересующей области (ROI).
- Откройте tiff-файл изображения FITC для соответствующего фолликула и наложите окупаемость инвестиций, созданную из изображения DAPI, поверх изображения FITC. Используйте функцию Measure программы для количественной оценки средней серой области изображения FITC, которая представляет интенсивность сигнала.
Результаты
Обзор и критические шаги
Используя этот протокол, небольшие преантральные фолликулы крупного рогатого скота могут быть надежно выделены из отдельных яичников в экспериментально релевантных количествах. Из общего числа 30 реплик было получено в среднем 41 фолликул на реплика...
Обсуждение
В настоящем протоколе подробно описывается воспроизводимый метод извлечения преантральных фолликулов на ранней стадии, особенно на первичных и ранних вторичных стадиях, из бычьего яичника. Этот протокол основан на предыдущих отчетах 20,25,30,34,35,36 и обеспечивает оптимизацию, которая при?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Этот проект был частично профинансирован многогосударственным проектом USDA W4112 и наградой UC Davis Jastro Shields для SM.
Авторы хотели бы выразить свою признательность Central Valley Meat, Inc. за предоставление бычьих яичников, используемых во всех экспериментах. Авторы также благодарят Оливию Сильвера за помощь в обработке яичников и выделении фолликулов.
Материалы
| Name | Company | Catalog Number | Comments |
| 5-3/4" Soda Lime Disposable Glass Pasteur Pipette | Duran Wheaton Kimble | 63A54 | Pasteur pipette that can be used to dislodge follicles from debris while searching within the petri dish |
| 16% Paraformaldehyde | Electron Microscopy Sciences | 15710 | Diluted to 4%; fixation of follicles for immunostaining |
| 20 mL Luer-lock Syringe | Fisher Scientific | Z116882-100EA | Syringe used with the 18 G needle to dislodge follicles from the 40 μm cell strainer |
| #21 Sterile Scalpel Blade | Fisher Scientific | 50-365-023 | Used to cut the ovaries and remove the medula |
| 40 μm Cell Strainer | Fisher Scientific | 22-363-547 | Used to filter the filtrate from the 300 μm cell strainer |
| 104 mm Plastic Funnel | Fisher Scientific | 10-348C | Size can vary, but ensure the cheese cloth is cut appropriately and that the ovarian homogenate will not spill over |
| 300 μm Cell Strainer | pluriSelect | 43-50300-03 | Used to filter the filtrate from the cheese cloth |
| 500 mL Erlenmeyer Flask | Fisher Scientific | FB500500 | Funnel and flask used to catch filtrate from the cheese cloth |
| Air-Tite Sterile Needles 18 G | Thermo Fisher Scientific | 14-817-151 | 18 G offers enough pressure to dislodge follicles from the 40 μm cell strainer |
| Air-Tite Sterile Needles 27 G 13 mm | Fisher Scientific | 14-817-171 | Needles that can be used to manipulate any debris in which follicles are stuck |
| BD Hoechst 33342 Solution | Fisher Scientific | BDB561908 | Fluorescent DNA stain |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A7030-100G | Component of follicle wash media |
| Cheese Cloth | Electron Microscopy Sciences | 71748-00 | First filtering step of the ovarian homogenate meant to remove large tissue debris |
| Classic Double Edge Safety Razor Blades | Wilkinson Sword | N/A | Razor blades that fit the best in the McIlwain Tissue Chopper and do not dull quickly |
| Donkey-Anti-Rabbit Secondary Antibody, Alexa Fluor 488 | Fisher Scientific | A-21206 | Secondary antibody for immunostaining |
| Eisco Latex Pipette Bulbs | Fisher Scientific | S29388 | Rubber bulb to use with Pasteur pipettes |
| HEPES Buffer | Sigma-Aldrich | H3375 | Component of follicle wash media |
| Homogenizer | VWR | 10032-336 | Homogenize the ovarian tissue to release follicles |
| ImageJ/Fiji | NIH | v2.3.1 | Software used for analysis of fluorescence-immunolocalization |
| McIlwain Tissue Chopper | Ted Pella | 10184 | Used to cut ovarian tissue small enough for homogenization |
| Microscope - Stereoscope | Olympus | SZX2-ILLT | Dissection microscope used for searching and harvesting follicles from the filtrate |
| Microscope - Inverted | Nikon | Diaphot 300 | Inverted microscope used for high magnification brightfield visualization of isolated follicles |
| Microscope - Inverted | ECHO | Revolve R4 | Inverted microscope used for high magnification brightfield and epifluorescence visualization of isolated follicles |
| Mineral Oil | Sigma-Aldrich | M8410-1L | Oil to cover the drops of follicle wash medium to prevent evaporation during searching |
| Non-essential Amino Acids (NEAA) | Gibco | 11140-050 | Component of follicle wash medium |
| Normal Donkey Serum | Jackson ImmunoResearch | 017-000-001 | Reagent for immunostaining blocking buffer |
| Nunc 4-well Dishes for IVF | Thermo Fisher Scientific | 144444 | 4-well dishes for follicle isolation and washing |
| Penicillin-Streptomycin Solution 100x | Gibco | 15-140-122 | Component of follicle wash medium |
| Petri Dish 60 mm OD x 13.7 mm | Ted Pella | 10184-04 | Petri dish that fits the best in the McIlwain Tissue Chopper |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | BP665-1 | Washing buffer for ovaries and follicles |
| Plastic Cutting Board | Fisher Scientific | 09-002-24A | Cutting board of sufficient size to safely cut ovaries |
| Polyvinylpyrrolidone (PVP) | Fisher Scientific | BP431-100 | Addition of PVP (0.1% w/v) to PBS prevents follicles from sticking to the plate or each other |
| ProLong Gold Antifade Mountant | Thermo Fisher Scientific | P36930 | Mounting medium for fluorescently labeled cells or tissue |
| Qiagen RNeasy Micro Kit | Qiagen | 74004 | RNA column clean-up kit |
| R | The R Foundation | v4.1.2 | Statistical analysis software |
| Rabbit-Anti-Human Cx37/GJA4 Polyclonal Antibody | Abcam | ab181701 | Cx37 primary antibody for immunostaining |
| RevertAid RT Reverse Transcription Kit | Thermo Fisher Scientific | K1691 | cDNA synthesis kit |
| Rstudio | RStudio, PBC | v2021.09.2 | Statistical analysis software |
| Sodium Hydroxide Solution (1N/Certified) | Fisher Scientific | SS266-1 | Used to increase media pH to 7.6-7.8 |
| Sodium Pyruvate (NaPyr) | Gibco | 11360-070 | Component of follicle wash medium |
| Square Petri Dish 100 mm x 15 mm | Thermo Fisher Scientific | 60872-310 | Gridded petri dishes allow for more efficient identification of follicles |
| SsoAdvanced Universal SYBR Green Supermix | BioRad | 1725271 | Mastermix for PCR reaction |
| Steritop Threaded Bottle Top Filter | Sigma-Aldrich | S2GPT02RE | Used to sterilize follicle wash medium |
| SYBR-safe DNA gel stain | Thermo Fisher Scientific | S33102 | Staining to visual PCR products on agarose gel |
| TCM199 with Hank’s Salts | Gibco | 12-350-039 | Component of follicle wash medium |
| Triton X-100 | Fisher Scientific | BP151-100 | Detergent for immunostaining permeabilization buffer |
| Trizol reagent | Thermo Fisher Scientific | 15596026 | RNA isolation reagent |
| Trypan Blue Solution, 0.4% | Gibco | 15-250-061 | Used for testing viability of isolated follicles |
| Tween 20 | Detergent for immunostaining wash buffer | ||
| Warmer Plate Universal | WTA | 20931 | Warm plate to keep follicles at 38.5 °C while searching under the microscope |
| Wiretrol II Calibrated Micropipets | Drummond | 50002-005 | Glass micropipettes to manipulate follicles |
Ссылки
- Fortune, J. E., Yang, M. Y., Allen, J. J., Herrick, S. L. Triennial reproduction symposium: The ovarian follicular reserve in cattle: What regulates its formation and size. Journal of Animal Science. 91 (7), 3041-3050 (2013).
- Fair, T., Hulshof, S. C., Hyttel, P., Greve, T., Boland, M. Oocyte ultrastructure in bovine primordial to early tertiary follicles. Anatomy and Embryology. 195 (4), 327-336 (1997).
- Jaffe, L. A., Egbert, J. R. Regulation of mammalian oocyte meiosis by intercellular communication within the ovarian follicle. Annual Review of Physiology. 79, 237-260 (2017).
- Driancourt, M. A., Reynaud, K., Cortvrindt, R., Smitz, J. Roles of KIT and KIT LIGAND in ovarian function. Reviews of Reproduction. 5 (3), 143-152 (2000).
- Lussier, J. G., Matton, P., Dufour, J. J. Growth rates of follicles in the ovary of the cow. Journal of Reproductive Fertility. 81 (2), 301-307 (1987).
- Aerts, J. M. J., Bols, P. E. J. Ovarian follicular dynamics: a review with emphasis on the bovine species. Part I: Folliculogenesis and preantral follicle development. Reproduction in Domestic Animals. 45 (1), 171-179 (2010).
- Sugiura, K., Pendola, F. L., Eppig, J. J. Oocyte control of metabolic cooperativity between oocytes and companion granulosa cells: energy metabolism. Developmental Biology. 279 (1), 20-30 (2005).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biology of Reproduction. 73 (2), 351-357 (2005).
- Sugimura, S., et al. Amphiregulin co-operates with bone morphogenetic protein 15 to increase bovine oocyte developmental competence: effects on gap junction-mediated metabolite supply. Molecular Human Reproduction. 20 (6), 499-513 (2014).
- Edson, M. A., Nagaraja, A. K., Matzuk, M. M. The mammalian ovary from genesis to revelation. Endocrine Reviews. 30 (6), 624-712 (2009).
- Matzuk, M. M., Burns, K. H. Genetics of mammalian reproduction: modeling the end of the germline. Annual Review of Physiology. 74, 503-528 (2012).
- McGee, E. A., Raj, R. S. Regulators of ovarian preantral follicle development. Seminars in Reproductive Medicine. 33 (3), 179-184 (2015).
- Chen, Y., et al. The factors and pathways regulating the activation of mammalian primordial follicles in vivo. Frontiers in Cell and Developmental Biology. 8, 575706 (2020).
- Figueiredo, J. R., et al. Development of a combined new mechanical and enzymatic method for the isolation of intact preantral follicles from fetal, calf and adult bovine ovaries. Theriogenology. 40 (4), 789-799 (1993).
- Sirard, M. A. The ovarian follicle of cows as a model for human. Animal Models and Human Reproduction. , 127-144 (2017).
- Parkes, W. S., et al. Hyaluronan and collagen are prominent extracellular matrix components in bovine and porcine ovaries. Genes. 12 (8), 1186 (2021).
- Araújo, V. R., Gastal, M. O., Figueiredo, J. R., Gastal, E. L. In vitro culture of bovine preantral follicles: a review. Reproductive Biology and Endocrinology. 12 (1), 1-14 (2014).
- Eppig, J. J., Schroeder, A. C. Capacity of mouse oocytes from preantral follicles to undergo embryogenesis and development to live young after growth, maturation, and fertilization in vitro. Biology of Reproduction. 41 (2), 268-276 (1989).
- McLaughlin, M., Telfer, E. E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Nuttinck, F., Mermillod, P., Massip, A., Dessy, F. Characterization of in vitro growth of bovine preantral ovarian follicles: A preliminary study. Theriogenology. 39 (4), 811-821 (1993).
- Demeestere, I., et al. Effect of preantral follicle isolation technique on in-vitro follicular growth, oocyte maturation and embryo development in mice. Human Reproduction. 17 (8), 2152-2159 (2002).
- Fattahi, A., et al. Optimization of porcine ovarian follicle isolation methods for better developmental potential. Tissue Engineering Part A. 26 (13-14), 712-719 (2020).
- Nagashima, J. B., Hill, A. M., Songsasen, N. In vitro development of mechanically and enzymatically isolated cat ovarian follicles. Reproduction and Fertility. 2 (1), 35-46 (2021).
- Lucci, C. M., Rumpf, R., Figueiredo, J. R., Báo, S. N. Zebu (Bos indicus) ovarian preantral follicles: Morphological characterization and development of an efficient isolation method. Theriogenology. 57 (5), 1467-1483 (2002).
- Langbeen, A., et al. Characterization of freshly retrieved preantral follicles using a low-invasive, mechanical isolation method extended to different ruminant species. Zygote. 23 (5), 683-694 (2014).
- Candelaria, J. I., Denicol, A. C. Characterization of isolated bovine preantral follicles based on morphology, diameter and cell number. Zygote. 28 (2), 154-159 (2020).
- vanden Hurk, R., et al. Ultrastructure and viability of isolated bovine preantral follicles. Human Reproduction Update. 4 (6), 833-841 (1998).
- Paes, V. M., et al. Effect of heat stress on the survival and development of in vitro cultured bovine preantral follicles and on in vitro maturation of cumulus-oocyte complex. Theriogenology. 86 (4), 994-1003 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological image analysis. Nature Methods. 9 (7), 676-682 (2012).
- de Aguiar, L. H., Hyde, K. A., Pedroza, G. H., Denicol, A. C. Heat stress impairs in vitro development of preantral follicles of cattle. Animal Reproduction Science. 213, 106277 (2020).
- Kristensen, S. G., Ebbesen, P., Andersen, C. Y. Transcriptional profiling of five isolated size-matched stages of human preantral follicles. Molecular and Cellular Endocrinology. 401, 189-201 (2015).
- Candelaria, J. I., Rabaglino, M. B., Denicol, A. C. Ovarian preantral follicles are responsive to FSH as early as the primary stage of development. Journal of Endocrinology. 247 (2), 153-168 (2020).
- Nuttinck, F., et al. Comparative immunohistochemical distribution of Connexin 37 and Connexin 43 throughout folliculogenesis in the bovine ovary. Molecular Reproduction and Development. 57 (1), 60-66 (2000).
- Itoh, T., Hoshi, H. Efficient isolation and long-term viability of bovine small preantral follicles in vitro. In Vitro Cellular and Developmental Biology-Animal. 36 (4), 235-240 (2000).
- Saha, S., Shimizu, M., Geshi, M., Izaike, Y. In vitro culture of bovine preantral follicles. Animal Reproduction Science. 63 (1-2), 27-39 (2000).
- Bus, A., et al. Preservation of connexin 43 and transzonal projections in isolated bovine pre-antral follicles before and following vitrification. Journal of Assisted Reproduction and Genetics. 38 (2), 479-492 (2021).
- Gougeon, A., Ecochard, R., Thalabard, J. C. Age-related changes of the population of human ovarian follicles: increase in the disappearance rate of non-growing and early-growing follicles in aging women. Biology of Reproduction. 50 (3), 653-663 (1994).
- Xu, D., et al. Raf-ERK1/2 signaling pathways mediate steroid hormone synthesis in bovine ovarian granulosa cells. Reproduction in Domestic Animals. 54 (5), 741-749 (2019).
- Santos, R. R., et al. Cryopreservation of ovarian tissue: an emerging technology for female germline preservation of endangered species and breeds. Animal Reproduction Science. 122 (3-4), 151-163 (2010).
- Leonel, E. C. R., Lucci, C. M., Amorim, C. A. Cryopreservation of human ovarian tissue: a review. Transfusion Medicine and Hemotherapy. 46 (3), 173-181 (2019).
- Bus, A., Langbeen, A., Martin, B., Leroy, J. I. M. R., Bols, P. E. J. Is the pre-antral ovarian follicle the 'holy grail' for female fertility preservation. Animal Reproduction Science. 207, 119-130 (2019).
- Chen, J., et al. Optimization of follicle isolation for bioengineering of human artificial ovary. Biopreservation and Biobanking. , (2021).
- Chiti, M. C., et al. A modified and tailored human follicle isolation procedure improves follicle recovery and survival. Journal of Ovarian Research. 10 (1), 1-9 (2017).
- Kristensen, S. G., Rasmussen, A., Byskov, A. G., Andersen, C. Y. Isolation of pre-antral follicles from human ovarian medulla tissue. Human Reproduction. 26 (1), 157-166 (2011).
- Oktay, K., et al. Isolation and characterization of primordial follicles from fresh and cryopreserved human ovarian tissue. Fertility and Sterility. 67 (3), 481-486 (1997).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены