このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
フラグメンテーション、ホモジナイズ、および連続ろ過の組み合わせを使用したウシ卵巣からの小さな前胞卵胞の分離
要約
前胞形成の研究を進めるには、単一の卵巣から卵胞を分離する効率的な方法が必要です。ここに提示されているのは、組織チョッパーとホモジナイザーを使用してウシの卵巣から卵胞を分離するための合理化された機械的プロトコルです。この方法は、単一の卵巣から多数の生存可能な前胞卵胞の収集を可能にする。
要約
哺乳類の卵胞形成の全過程を理解することは、家畜、ヒト、絶滅危惧種の生殖補助医療を向上させるために重要です。研究は、特にウシ種などの大型哺乳類では、より小さな前胞状卵胞の分離が困難であるため、主に前胞状および大型前胞状卵胞に限定されてきました。この研究は、単一のウシ卵巣から多数の小さな前胞胞を回収するための効率的なアプローチを提示します。個々のウシ卵巣の皮質を組織チョッパーを使用して500μmの立方体にスライスし、10mmプローブを使用して9,000〜11,000rpmで6分間ホモジナイズしました。大きな破片をチーズクロスを使用してホモジネートから分離し、続いて300μmおよび40μmのセルストレーナーで連続ろ過しました。40μmストレーナーに保持された内容物を検索皿にすすぎ、そこで卵胞を特定し、一滴の培地に集めた。採取した卵胞の生存率をトリパンブルー染色 により 試験した。この方法では、約90分で単一のウシ卵巣から多数の生存可能な小さな前胞胞を単離することができます。重要なことに、この方法は完全に機械的であり、卵胞を損傷する可能性のある組織を解離するための酵素の使用を回避します。このプロトコルを使用して得られた卵胞は、RT-qPCR用のRNAの単離、特定のタンパク質の免疫局在化、 in vitro 培養などのダウンストリームアプリケーションに使用できます。
概要
卵巣卵胞は卵巣の機能単位であり、配偶子(卵母細胞)の産生、ならびに生殖機能と全体的な健康に重要なホルモンの産生に関与しています。原始卵胞は、種に応じて胎児の発育中または新生児期に卵巣に形成され1、女性の卵巣予備能を構成します。卵胞の成長は、休息プールを離れて成長期に入る原始卵胞の活性化から始まります。前胞形成は、前庭発育前のすべての卵胞段階を網羅し、これら2つの細胞型間の緊密なコミュニケーションによって駆動される、卵母細胞および周囲の顆粒膜細胞の同期形態学的および代謝的変化を必要とする非常に動的なプロセスです2,3。前胞卵胞は、いつでも卵巣に見られる卵胞単位の大部分を構成します4。卵胞形成の前期までの発達は、胞状発達よりも数週間長いと推定されており5,6、この時間は、卵母細胞と体細胞が発達の最終段階(すなわち、胞状段階)に入るのに十分な成熟を獲得し、排卵、受精、および胚発生の準備をするために必要な7,8,9。
卵巣前胞卵胞形成に関する現在の知識の多くは、マウスモデル10、11、12、13から来ており、これは、より小さく、線維性の低い卵巣からこれらの卵胞を多数回収することが容易であることに一部起因しています。ウシの卵巣から多数の前胞胞が分離されたという報告は約30年前にさかのぼりますが14、これらの初期段階の卵胞の発達を調節するプロセスに関するより完全な理解は、主に、特に発生の初期段階で、十分な数の生存可能な前胞卵胞を回収するための最適化され、効率的で、再現性のある方法がないため、実現されていません。ヒトの生殖補助医療における将来の使用のために卵巣予備能を保存することへの関心が高まるにつれ、牛は卵巣構造がより類似しているため、魅力的なモデルになります15。しかし、ウシ卵巣はマウス卵巣16と比較してコラーゲンが著しく豊富であり、マウスについて記載された方法を用いた機械的単離は非常に非効率的である。生殖能力保存技術を拡大するための努力には、前胞卵胞の胞状段階への完全なin vitro成長、それに続く囲まれた卵母細胞の体外成熟(IVM)、体外受精(IVF)、および胚の生産と移植が含まれます17。これまでのところ、このプロセス全体はマウス18でのみ達成されています。ウシでは、in vitroでの卵胞成長への進行は、培養開始時の卵胞段階が変動し、プロトコル間の培養の長さが変動するいくつかの報告に限定されています17,19。
ウシ卵巣からの前胞卵胞の収穫のための文献に記載されている方法は、単離または組み合わせて、機械的および酵素的技術を主に使用してきた2,14,17,20。ウシ前胞卵胞単離のためのプロトコルの最初の報告では、組織ホモジナイザーと連続ろ過を使用して卵巣全体を処理しました20。この研究に続いて、コラゲナーゼ14を利用した機械的手順と酵素的手順を組み合わせた報告が続きました。卵巣組織を消化するためにコラゲナーゼを利用する際の繰り返しのテーマは、卵胞の生存率を損なう可能性のある卵胞基底膜の損傷の潜在的なリスクです14,21,22,23。したがって、組織チョッパーと繰り返しピペッティングの使用、または均質化と組み合わせた組織チョッパーの使用など、機械的方法のさまざまな組み合わせが採用されてきました20、24、25、26。記載されている別の機械的技術は、針を利用して卵巣組織から直接前胞卵胞を解剖し、これはより大きな(>200μm)二次卵胞を単離するのに特に有用である。ただし、このプロセスは時間がかかり、より小さな前胞卵胞を分離するには非効率的であり、ウシの卵巣で試みた場合のスキルセットに依存します19,27,28。
文献に記載されているさまざまな技術を利用して、このプロトコルは、酵素溶液でのインキュベーションを回避する、単純で一貫性のある効率的な方法で、単一のウシ卵巣からの前胞卵胞の分離を最適化することを目的としていました。前胞卵胞の単離方法を改善することは、卵胞形成のこの段階の理解を深め、前胞卵胞を前胞期に発達させるための効果的な培養システムの開発を可能にする機会を提供します。ウシ種などの大型哺乳類から前胞卵胞を単離するための本明細書に記載される詳細な手順は、ヒトに翻訳可能な非マウス種における初期の卵胞形成の研究を目指す研究者にとって不可欠であろう。
プロトコル
ウシ(Bos taurus)卵巣は地元の食肉処理場から供給され、収集から6時間以内に実験室に輸送されました。施設内で処理される動物の数が多いため、動物の年齢、品種、発情周期の段階は不明です。これらの実験では生きた動物が使用されなかったため、承認された動物の世話と使用のプロトコルは必要ありませんでした。
1.機器と試薬の準備
- 実験台の幅2フィートのセクションをベンチペーパーで覆います。
- メスハンドル、滅菌メスブレード、止血剤、解剖鉗子のペア、20 mLルアーロックシリンジ、18 G針、200 mLビーカー2つ、500 mL三角フラスコ、直径104 mmのプラスチック漏斗、プラスチック製まな板、処理される卵巣ごとに1つの22 cm2層の チーズクロス(チーズクロスは使用前にオートクレーブ滅菌によって滅菌できます)、 300 μmのセルストレーナーと40 μmのセルストレーナー( 材料表を参照)。
- すべての機器をベンチペーパーに移します。
- 止血剤を使用して、メスの刃をメスのハンドルにスロットします。ブレードの角度の付いたベースをハンドルの角度の付いたインジケーターに合わせ、ブレードをハンドルの溝にスライドさせます。
- 漏斗を三角フラスコに入れ、漏斗の開口部をチーズクロスで覆います。
- 処理する卵巣ごとに1本の50 mLコニカルチューブを38.5°Cに設定された水またはビーズバスに入れます。
- 処理する卵巣ごとに100 mm x 15 mmの正方形のペトリ皿を1枚、38.5°Cに設定されたスライドウォーマーに置きます。
- 10 mLのペニシリン-ストレプトマイシン(PenStrep;10,000 U/mLペニシリンおよび10,000 μg/mLストレプトマイシン)を1 Lの1xリン酸緩衝生理食塩水(PBS)に加えます。卵巣処理の少なくとも2時間前に、PBS + PenStrepを38.5°Cに設定された水またはビーズバスで温めます。
注:PBS + PenStrepソリューションは、単離された卵胞を培養するときに卵巣を洗浄するために不可欠であり、微生物汚染を軽減するために下流の実験に推奨されます。 - 処理された卵巣濾液を採取するには、3 mg/mLのウシ血清アルブミン(BSA )、25 mM HEPESバッファー、100 UIペニシリン/100 μg/mLストレプトマイシン、1 mMピルビン酸ナトリウム(NaPyr)、および100 nMの非必須アミノ酸(NEAA)を含むTCM199とハンクス塩からなる卵胞洗浄培地(FWM)を使用します。
- 滅菌済みのTCM199、250 mLボトル、および100 mLメスシリンダーをバイオセーフティキャビネット(BSC)に移します。194 mLのTCM199をボトルに移します。
- TCM199のビーカーをBSCから取り出し、攪拌プレートに持ってきます。600 mgのBSA、1.19 gのHEPESバッファー、およびオートクレーブ滅菌した攪拌子をボトルに加え、溶解するまで攪拌します。
- BSAおよびHEPESバッファーが完全に溶解したら、pHメーターで測定したpHが7.6〜7.8になるまで、1 N水酸化ナトリウム(NaOH)を培地に加えます。
- BSCに移す前に、培地のボトル、真空ろ過装置、4つの50 mLコニカルチューブ、およびPenStrep、NaPyr、およびNEAAのボトルを70%エタノールで拭きます。
- ペンストレップ(ペニシリン10,000 U/mL、ストレプトマイシン10,000 μg/mL)、100 mM NaPyr、および100x NEAAをTCM199 + 3 mg/mL BSA + 25 mM HEPESのボトルにそれぞれ2 mL加えます。最終培地を滅菌ろ過し、50 mLコニカルチューブに分注します。培地を4°Cで最大2週間保存します。
- 卵巣処理の少なくとも1時間前に、卵巣2個あたり1本の50 mLコニカルチューブを38.5°Cに設定されたビーズバスで温めます。
2.ティッシュチョッパーのセットアップ
- ティッシュチョッパー( 材料の表を参照)が接続され、オンになっていることを確認します。
- メーカーの仕様に従って、スライスの厚さを500μm、ブレードフォースコントロールノブを20°、速度コントロールノブを90°に設定します。
- 60mmのプラスチック製ペトリ皿をプレートホルダーに挿入し、プレートホルダーをステージに挿入します。
- 手動操作ノブを時計回りに回して、チョッピングアームをできるだけ高く上げます。
- 鉗子を使用して、両刃のかみそりの刃( 材料の表を参照)をチョッピングアームに挿入されたネジに置きます。ブレードクラスプをブレードの上に置き、ワッシャーとナットで固定します。ナットを4分の1回転緩めたままにします。
- チョッピングアームがブレードをペトリ皿に平らにカチッとはめるまで、手動操作ノブを回します。ナットドライバーで残りの部分でナットを締めます。
- 手動操作ノブを使用して、チョッピングアームをできるだけ高く上げます。テーブルリリースノブを、所定の位置に収まるまで左端まで動かします。
3.卵巣の準備
- 実験室で卵巣を温めた(38.5°C)滅菌PBS + PenStrepに移します。
注: 動物から取り出した後、実行可能になったらすぐに卵胞の隔離のために卵巣を処理することをお勧めします。このプロトコルでは、卵巣は収穫から6時間以内に処理されました。卵巣は、約38.5°Cの滅菌0.9%生理食塩水を含む魔法瓶で食肉処理場から実験室に輸送されました。 - 可能であれば、小さな(3〜5 mm)胞状卵胞を含み、大きな(≥8 mm)胞状卵胞がなく、目立つ黄体がない小さな(≤ 4 cm x 3 cm x 3 cm)卵巣を選択します(図1)。これらの基準は、間質細胞および細胞外マトリックスなどの最小限の量の非卵胞破片が、単離された卵胞を含む結果として生じる正方形皿に含まれることを確実にするために推奨される。
注:胞状卵胞は、卵巣の表面にある球形の液体で満たされた小胞構造として識別できます。コーパスルテアは、卵巣の表面から突き出た赤、オレンジ、または黄色の硬い構造として識別できます。 - はさみを使用して、卵巣から余分な結合組織と脂肪を取り除きます。
- ビーカーの70%エタノールで卵巣を30秒間洗浄します。
- 温かい(38.5°C)PBS +ペンストレップのビーカーで卵巣を3回、各洗浄に新鮮なPBS +ペンストレップを使用して2分間洗浄します。
- 処理の準備ができるまで、卵巣を暖かい(38.5°C)PBS + PenStrepに保ちます。
注:実験室と卵巣源の間の距離は可変である可能性があります。したがって、卵胞の生存率の維持を確実にするために、適時にプロトコルを完了することが重要です。
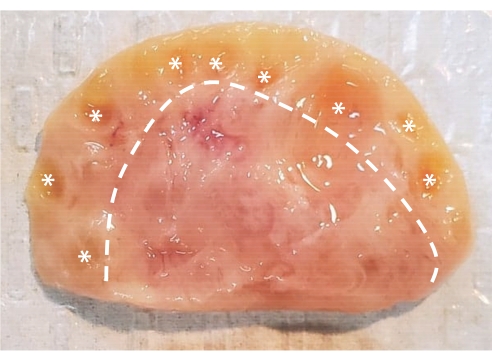
図1:ウシ卵巣の解剖学。 ウシ卵巣は、上皮層に囲まれた2つの主要な領域で構成されています。破線の左側の組織で構成される皮質には、原始期から胞状期までの卵巣卵胞が含まれています。前胞卵胞は肉眼で見るには小さすぎます。胞状卵胞はアスタリスクでマークされています。延髄は破線の右側の組織で構成され、血管、リンパ管、神経が含まれています。 この図の拡大版を表示するには、ここをクリックしてください。
4.チョップ手順
注:一度に1つの卵巣のみを処理します。卵胞の生存率に影響を与える可能性のある温度低下を避けるために、卵巣を迅速に処理します。
- 1つの卵巣をベンチペーパーのまな板に移し(図2A)、ティッシュチョッパーを準備します(図2B)。
- 鉗子とメスを使用して、卵巣を半分に切り、各半分から髄質を取り除き、 図2Cに示すように、約1 mmの厚さの皮質のみを残します。
- 卵巣を1つの靭帯付着部位から反対側の付着部位まで縦方向に半分に切断します。
- 卵巣の半分を処理対象のまな板の上に置き、卵巣の残りの半分を温かい(38.5°C)PBS + PenStrepに戻します。
- 露出した髄質を上に向けて、皮質を切断せずに、卵巣の表面から約2 mm離れた卵巣の湾曲に沿ってスライスします。
- 卵巣の湾曲に沿ったスライスをガイドとして使用してスライスを深め、卵巣の湾曲に従って皮質を髄質から分離します。
- 黄体の境界に沿って切断することにより、卵巣から黄体を解剖して廃棄します。
- 上皮が上を向くように卵巣を半分裏返し、メスを使用して髄質を皮質から切断し続けます。靭帯に接続された卵巣片の端の周りに残っている白い結合組織を切り取ります。
- 髄質の大部分が除去されたら、メスを使用して皮質を約1mmの厚さに切断します。メスを小さな前後の動きで操作して、髄質の残りの部分を削り取ります。
注:髄質は、大きな血管を含む卵巣の内側部分です。皮質は卵巣の外側部分であり、最外表面上皮の真下にあります。牛の卵巣の皮質の厚さは約1 mmであるため、卵巣を1 mmの厚さに切断すると髄質が除去されます。
- 皮質を2.5 cm x 2.5 cm以下の小片に切ります。切り刻む準備ができるまで、皮質片を温かい(38.5°C)PBS + PenStrepに保ちます。
- ビーカーに少なくとも50 mLの温かい(38.5°C)PBS + PenStrepを満たし、プラスチック製のトランスファーピペットを入手します。
- 1枚の皮質をティッシュチョッパーのペトリ皿に移し、3〜4滴の温かい(38.5°C)PBS + PenStrepで組織を濡らします。
- 鉗子で組織片をしっかりと保持し、リセットボタンを1回押してティッシュチョッパーを開始します。鉗子で組織を安定させ続けながら、片手でペトリ皿を安定させます。ブレードが鉗子に当たらないように、必要に応じて鉗子を組織に沿って左に動かします。結果として得られるストリップの長さは約500μmになります。
- 皮質全体がストリップに切断されたら、ブレードホルダーノブを使用してブレードをペトリ皿から持ち上げ、鉗子を使用してブレードから組織を取り除きます。
- プレートホルダーを90°回転させます。
- リセットボタンを一度押します。片手でペトリ皿を安定させ、鉗子を使用してティッシュストリップをブレードの経路に押し込みます。
- ブレードをティッシュストリップに完全に通します。ブレードホルダーノブを使用してブレードをペトリ皿から持ち上げ、鉗子を使用してブレードから組織を取り除きます。
- トランスファーピペットと温めた(38.5°C)PBS + PenStrepを使用して、刻んだ組織(組織の最終サイズ:500 μm x 500 μm x 1 mmキューブ)を、事前に温めた(38.5 °C)50 mLコニカルチューブに洗浄します。円錐形のチューブを水またはビーズバスに戻し、刻んだティッシュを暖かく保ちます(38.5°C)。
- ナットドライバーを使用してチョッピングアームからナットを取り外し、ワッシャーとブレードクラスプを取り外します。鉗子を使用して、チョッピングアームからブレードを取り外し、未使用のエッジがペトリ皿に面するように裏返し、チョッピングアームに戻します。ブレードクラスプ、ワッシャー、ナットを交換し、手順2.5〜2.7の説明に従ってテーブルリリースノブをリセットします。
- 卵巣の残りのすべての皮質片について手順4.5〜4.12を繰り返し、各刃先を使用した後にブレードを新しいものと交換します。
- 使用済みのブレードはすべて、厚肉のプラスチック製鋭利な容器に入れて廃棄してください。
5. 均質化手順
- ホモジナイザーユニット( 材料の表を参照)が接続され、速度が9,000番目のバー(11,000〜11,000 rpm)に設定されていることを確認します。メーカーの仕様に従って、10mmの発電機プローブをユニットに挿入します。
- タイマーを1分に設定し、1つの卵巣から刻んだ皮質組織を含む50 mLの円錐形チューブにプローブを挿入し(ステップ4.11)、チューブを25 mLラインまで満たすのに十分なPBS + PenStrepを挿入します。プローブを挿入する深さは、チャンバーの底から測定した液体の高さの1/3である必要があります。渦を最小限に抑えるために、プローブを中心から少しずらして配置します。
- タイマーを開始し、ホモジナイザーをオンにします。プローブの底がチューブに触れていないことを確認し、ホモジナイザーがオンになっている間はチューブを静止させます。
- 1分間ホモジナイズした後、プローブをチューブから取り外します。鉗子を使用して、通気孔とローターナイフとローターチューブの間のスペースを詰まらせている結合組織を取り除きます。皮質の一部がプローブに詰まっている場合は、鉗子でそれらを取り除き、チューブに戻します。
- 手順5.2〜5.4をさらに5倍繰り返して、合計6分間の均質化を行います。
- 均質化した組織を入れたチューブを水またはビーズバスに入れて、組織を暖かく保ちます(38.5°C)。最後の卵巣を処理した後、メーカーの仕様に従って、すぐに発電機プローブを分解、清掃、乾燥させます。
6.ろ過手順
- 分散した組織を、三角フラスコに挿入されたチーズクロスで覆われた漏斗に注ぎます。チューブ内に組織片が残らなくなるまで、温かい(38.5°C)PBS + PenStrepを使用して、チューブの内容物を漏斗にすすぎます。
- ティッシュフラグメントの周りにチーズクロスをひねり、余分な液体と組織がチーズクロスから取り除かれるまで絞ることにより、ティッシュフラグメントをクロスの穴に通します。
- 漏斗の上でチーズクロスを再度開き、トランスファーピペットを使用してPBS + PenStrepでチーズクロスをすすぎ、布を通して残りの組織片を再度絞ります。
- 止血剤を使用して、300 μmのセルストレーナーを200 mLビーカーの上に保持します。三角フラスコ内の濾液をセルストレーナーを通して注ぎます。組織断片がなくなるまで、温かい(38.5°C)PBS + PenStrepを使用して、フラスコの内容物をセルストレーナーにすすぎます。
- セルストレーナーが組織で詰まった場合は、セルストレーナーをビーカーに軽くたたいて、すべての液体がビーカーにろ過されたことを確認してから、セルストレーナーを逆さまにして、大きな組織の破片をベンチペーパーにタップアウトします。セルストレーナーをビーカーの上に戻し、濾液をビーカーに注ぎ続けます。三角フラスコからのすべての濾液がろ過されるまで、必要に応じて繰り返します。
- 止血剤を使用して、40 μmのセルストレーナーを2番目の200 mLビーカーの上に保持します。最初の200 mLビーカーのろ液をセルストレーナーに注ぎます。組織片がなくなるまで、温かい(38.5°C)PBS + PenStrepを使用して、ビーカーの内容物をセルストレーナーにすすぎます。40 μmのセルストレーナーの内容物を廃棄しないでください。
- 18 Gの針を20 mLシリンジに合わせます。シリンジにFWMを充填します。40 μmのセルストレーナーを正方形のペトリ皿に逆さまにし、シリンジを使用してセルストレーナーの内容物を皿に洗い流します。シリンジを補充し、組織片がなくなるまで必要に応じてセルストレーナーをすすぎます。
注:通常、40 μmのセルストレーナーの内容物を完全に洗い流すには、25 mLのFWMで十分です。

図2:卵巣処理とプロトコルワークフローのためのワークスペースのセットアップ 。 (A)刻む前に卵巣を切断し、卵巣ホモジネートをろ過するためのベンチセットアップ。(B)組織チョッパーとホモジナイザーをセットアップし、ホモジナイザーステージの振動を低減するための発泡スチロールサポートを備えています。(C)1つの卵巣全体の処理のためのワークフローを示す概略図。卵巣から余分な結合組織をトリミングしてから半分に切断し、厚さ1~1mmの皮質のスライスが残るまで髄質を取り除きます。皮質を2.5 cm x 2.5 cmの小片に切断し、500 μmの切断間隔に設定した組織チョッパーで切り刻みます。次に、ピースをホモジナイズし、ホモジネートをチーズクロスでろ過した後、300 μmおよび40 μmのセルストレーナーでろ過します。40 μmの細胞ストレーナーの内容物を正方形のペトリ皿にすすぎ、実体顕微鏡を使用して卵胞を検索します。BioRender.com で作成。 この図の拡大版を表示するには、ここをクリックしてください。
7.卵胞の検索と収集
- 正方形のペトリ皿(ステップ6.6)を、38.5°Cに設定された加温されたステージを備えたステレオスコープに移します。 ステレオスコープの倍率は、検索者の好みに応じて1.25倍から3.2倍の間で設定する必要があります。
- FWM10 μL滴を60 mmのペトリ皿にピペットで入れ、乾燥を防ぐためにミネラルオイルで滴を覆います。培地滴を入れたペトリ皿を38.5°Cに設定された加温プレートに置きます。
注:4ウェルプレートを使用して卵胞を収集できます。500 μLの洗浄媒体を1つまたは2つのウェルに追加します。38.5°Cに設定された加温プレートに置きます。 - マイクロピペットプランジャーとチップを入手します。
注:卵胞がガラスピペットに付着し、溶液間を移動するときに失われる可能性が低いため、ガラス製の1〜5 μLマイクロピペット( 材料の表を参照)をお勧めします。また、卵胞のより簡単で正確なマイクロマニピュレーションを可能にするのに十分なほど小さい器具です。 - 正方形のペトリ皿から卵胞を識別し、マイクロピペットを使用して培地(FWM)ドロップに移します。多くの卵胞は組織の破片に埋め込まれている可能性が高く、以下に説明するように2つの方法のいずれかを使用して取得できます。
注:卵胞は完全な球ではなく長方形であり、通常、卵母細胞を持ち、卵胞の中心に向かって暗いコントラストで実線の白い円として表示されます(図3A-C)。卵胞と露出した卵母細胞を混同しないように注意してください。卵母細胞は完全な球である傾向があり、厚くて透明な膜(透明帯)に囲まれています。倍率10倍(またはそれ以上)の倒立顕微鏡を使用して、卵胞をより詳細に検査できます(図3D)。- マイクロピペットの先端または細い(27 G)針を使用して、卵胞を破片から慎重に分離します。
- または、ゴム球付きのガラス製パスツールピペットを使用して、皿の中の破片を複数回取り上げて噴出し、破片から卵胞を取り除きます。
- 卵胞の生存率を維持するためにペトリ皿を検索するために、30分以内に迅速に作業します。
- 密度が高いほど卵胞が付着する可能性が高くなる可能性があるため、10 μLドロップあたり最大5つの卵胞のみを配置します。
8.トリパンブルー排除生存率試験
注意: 卵胞は実際の皿のプラスチックよりも蓋のプラスチックに付着しないため、次のすべての手順でペトリ皿または4ウェルプレートの蓋を使用してください。
- 100 mg PVPを50 mLのPBSに溶解することにより、PBS + 0.2%ポリビニルピロリドン(PVP)を調製します。
注:ここでは、卵胞が皿に付着する可能性を減らすためにPVPが使用されます。 - マイクロピペットを使用して、培地滴からすべての卵胞(平均40個)をPBS + 0.2% PVPの50 μL滴に移します。
- 卵胞をPBS + 0.2%PVPの新鮮な50μL滴に順次移して2回洗浄します。
- 卵胞を285μL滴のPBS + 0.2%PVPに移します。
- 285 μLのPBS + 0.2% PVP(最終濃度0.05%トリパンブルー)のドロップに15 μLのトリパンブルーを加え、100 μLに設定した200 μLのピペットチップを使用してドロップを注意深く混合します。
注:トリパン生存率試験に4ウェルプレートを使用する場合は、475 μLのPBS + 0.2%PVPと25 μLのトリパンブルーを1つのウェルに追加します。 - 卵胞をトリパンブルードロップで1分間インキュベートし、次に卵胞をPBS + 0.2%PVPの50μLドロップ(または500μLウェル)に移します。
- ステップ8.3に従って卵胞を、PBS + 0.2%PVPの新鮮な50 μL滴(またはウェルあたり500 μL)で3回洗浄します。
- PBS + 0.2%PVPで3回洗浄した後もまだ青く見える卵胞は、実行不可能であるため、廃棄してください。3回の洗浄後に青色が保持されない卵胞は生存可能であり、免疫蛍光、培養、またはその他の手順に使用できます(図3E)。卵胞を液体窒素で急速凍結し、必要に応じてさらに使用するまで-80°Cで保管します。
- RT-qPCR分析およびステップ9および10に記載されているように卵胞の免疫蛍光染色を実行します。

図3:単離された卵胞およびトリパンブルー排除試験 。 (A〜C)単離された卵胞を、実体顕微鏡を通していくつかの倍率で画像化した。(A)最初の検索皿内の破片の中から孤立した卵胞。個々の卵胞は赤で囲まれています。スケールバー= 2,000μm。 (B)鉱油で覆われた卵胞洗浄培地の液滴内の単離された卵胞および破片。スケールバー= 1,000μm。 (C)より高い倍率で破片のない単離された卵胞。スケールバー = 1,000 μm。 (D)倒立明視野顕微鏡を使用して画像化された単離された卵胞。スケールバー= 100μm。 (E)倒立明視野顕微鏡と20倍対物レンズを使用して画像化された生存可能(染色されていない)および生存不可能な(青い染色)卵胞の代表的な画像。スケールバー = 100 μm。 この図の拡大版を表示するには、ここをクリックしてください。
9. RT-qPCR分析
- RNA単離試薬を使用して、生存可能な卵胞からRNAを単離します( ステップ8.8から)。RNAを精製し、製造元の指示に従って市販のクリーンアップキット( 材料の表を参照)を使用してDNaseで処理します。
- RNAを14 μLのRNaseフリー水で溶出し、分光光度計を使用して定量します。RNAは、cDNA合成まで-80°Cで保存できます。
- 製造元の指示に従って、市販のcDNA合成キット( 材料の表を参照)を使用して、一次卵胞と初期二次卵胞から抽出した等量のRNAからcDNA合成を実行します。反応混合物を25°Cで5分間インキュベートした後、42°Cで60分間インキュベートした後、70°Cで5分間加熱して反応を終了します。
- 市販の反応ミックス(材料の表を参照)を使用して、合成したcDNA(反応あたり5 ng)およびプライマー(表1)を使用してRT-qPCRを実行します。熱サイクル条件を使用します:ポリメラーゼの活性化には95°Cで30秒、その後40サイクルの増幅を行い、各サイクルには変性のために95°Cで15秒、アニーリング/伸長のために60°Cで30秒が含まれていました。サイクル閾値(Ct)を定量化してRT-qPCRを分析するか、アガロースゲル電気泳動を使用してPCR産物を表示します。
注:顆粒膜細胞 マーカーFSHR および生殖細胞 マーカーDAZL の転写産物発現は、この研究で評価されました。参照遺伝子は H2A および ACTBであった。 - メルトカーブ解析を実行するには、温度を 65 °C から 5 °C 刻みで 95 °C に達するまで上げます。
10. 免疫蛍光分析
- 室温(RT)で4%(v/v)パラホルムアルデヒド(PFA)を100 μL滴下して15分間生存卵胞を固定し(ステップ8.8から)、続いてPBS + 0.1% BSA + 0.1%トゥイーン20の100 μL滴で3倍洗浄します。
- 卵胞を、1x PBS + 5%(v / v)の正常なロバ血清(NDS)からなるブロッキングバッファーでRTで1時間ブロックします。ブロッキング後、ブロッキングバッファーで希釈した4 μg/mLウサギ抗ヒトCX37抗体または4 μg/mLウサギアイソタイプIgG(陰性対照)を100 μL滴下し、卵胞を4°Cで一晩インキュベートします。
- 卵胞をPBS + 0.1% BSA + 0.1% Tween 20の100 μL滴で3回洗浄し、ブロッキングバッファーで希釈した2 μg/mLのロバ抗ウサギAlexaFluor 488二次抗体を100 μL滴下し、暗所でRTで1時間インキュベートします。
- ブロッキングバッファーで希釈した1 μg/mL Hoechst 33342を100 μL滴下し、暗所のRTで5分間卵胞をインキュベートし、DNAを標識します。
- 卵胞をガラス顕微鏡スライド上の5 μL滴の封入剤( 材料の表を参照)に移し、カバースリップで覆います。スライドをRTで一晩硬化させ、続いてマニキュアで密封します。イメージングするまで4°Cで保存してください。
- カバーが滑ってから48時間以内のすべてのスライドを画像化します。DAPI(励起380 nmおよび発光450 nm)およびFITC(励起470 nmおよび発光525 nm)フィルターの下で倒立落射蛍光顕微鏡( 材料表を参照)を使用してイメージングを実行します。
- 両方のチャンネルの露出時間を修正します。ウサギのアイソタイプ陰性対照に基づいてFITC(CX37)曝露時間を調整します。20倍の対物レンズを使用し、DAPIチャンネルを50ミリ秒の曝露時間に設定して、ウサギのアイソタイプ標識卵胞を特定します。
- FITCチャネルの下でこれらの卵胞を画像化し、すべてのバックグラウンドグリーン信号が廃止されるまで露光時間を短縮します。この露出時間に注意してください。
- アイソタイプFITCチャネルに設定された露光時間およびDAPIチャネルに50ミリ秒の露光時間を使用して、すべてのCX37抗体標識卵胞を画像化します。
- 閾値化後の平均グレー領域によって測定される信号強度を処理する、コンピュータ画像処理プログラム29( 材料の表を参照されたい)。
- 各卵胞の DAPI イメージの tiff ファイルを調整して、卵胞全体の輪郭が見えるようにします。プログラムの パーティクル分析 機能を使用して、卵胞全体を関心領域(ROI)として選択します。
- 対応する卵胞のFITCイメージのtiffファイルを開き、DAPIイメージから生成されたROIをFITCイメージの上にオーバーレイします。プログラムの 測定 機能を使用して、信号強度を表すFITC画像の平均グレー領域を定量化します。
結果
概要と重要な手順
このプロトコルを使用すると、小さなウシ前胞胞を実験的に関連する数で単一の卵巣から確実に分離できます。合計30回の反復から、反復あたり平均41個の卵胞が得られ、11〜135個の卵胞の範囲でした(図4A)。14回の反復において、卵胞は、実体顕微鏡下で1μmの顕微鏡キャリブレーションスライドを使用して卵胞直径を測定することによっ...
ディスカッション
本プロトコルは、ウシ卵巣から、特に一次および初期の二次段階で、初期段階の前胞状卵胞を回収するための再現可能な方法を詳述している。このプロトコルは、以前のレポート20、25、30、34、35、36に基づいており、個々の卵巣から意味のある数の卵?...
開示事項
著者は開示するものは何もありません。
謝辞
このプロジェクトは、USDAマルチステートプロジェクトW4112とカリフォルニア大学デービス校ジャストロシールズ賞によってSMに部分的に資金提供されました。
著者らは、すべての実験で使用されたウシの卵巣を提供してくれたセントラルバレーミート社に感謝の意を表したいと思います。著者らはまた、卵巣処理と卵胞の分離を支援してくれたオリビア・シルベラに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 5-3/4" Soda Lime Disposable Glass Pasteur Pipette | Duran Wheaton Kimble | 63A54 | Pasteur pipette that can be used to dislodge follicles from debris while searching within the petri dish |
| 16% Paraformaldehyde | Electron Microscopy Sciences | 15710 | Diluted to 4%; fixation of follicles for immunostaining |
| 20 mL Luer-lock Syringe | Fisher Scientific | Z116882-100EA | Syringe used with the 18 G needle to dislodge follicles from the 40 μm cell strainer |
| #21 Sterile Scalpel Blade | Fisher Scientific | 50-365-023 | Used to cut the ovaries and remove the medula |
| 40 μm Cell Strainer | Fisher Scientific | 22-363-547 | Used to filter the filtrate from the 300 μm cell strainer |
| 104 mm Plastic Funnel | Fisher Scientific | 10-348C | Size can vary, but ensure the cheese cloth is cut appropriately and that the ovarian homogenate will not spill over |
| 300 μm Cell Strainer | pluriSelect | 43-50300-03 | Used to filter the filtrate from the cheese cloth |
| 500 mL Erlenmeyer Flask | Fisher Scientific | FB500500 | Funnel and flask used to catch filtrate from the cheese cloth |
| Air-Tite Sterile Needles 18 G | Thermo Fisher Scientific | 14-817-151 | 18 G offers enough pressure to dislodge follicles from the 40 μm cell strainer |
| Air-Tite Sterile Needles 27 G 13 mm | Fisher Scientific | 14-817-171 | Needles that can be used to manipulate any debris in which follicles are stuck |
| BD Hoechst 33342 Solution | Fisher Scientific | BDB561908 | Fluorescent DNA stain |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A7030-100G | Component of follicle wash media |
| Cheese Cloth | Electron Microscopy Sciences | 71748-00 | First filtering step of the ovarian homogenate meant to remove large tissue debris |
| Classic Double Edge Safety Razor Blades | Wilkinson Sword | N/A | Razor blades that fit the best in the McIlwain Tissue Chopper and do not dull quickly |
| Donkey-Anti-Rabbit Secondary Antibody, Alexa Fluor 488 | Fisher Scientific | A-21206 | Secondary antibody for immunostaining |
| Eisco Latex Pipette Bulbs | Fisher Scientific | S29388 | Rubber bulb to use with Pasteur pipettes |
| HEPES Buffer | Sigma-Aldrich | H3375 | Component of follicle wash media |
| Homogenizer | VWR | 10032-336 | Homogenize the ovarian tissue to release follicles |
| ImageJ/Fiji | NIH | v2.3.1 | Software used for analysis of fluorescence-immunolocalization |
| McIlwain Tissue Chopper | Ted Pella | 10184 | Used to cut ovarian tissue small enough for homogenization |
| Microscope - Stereoscope | Olympus | SZX2-ILLT | Dissection microscope used for searching and harvesting follicles from the filtrate |
| Microscope - Inverted | Nikon | Diaphot 300 | Inverted microscope used for high magnification brightfield visualization of isolated follicles |
| Microscope - Inverted | ECHO | Revolve R4 | Inverted microscope used for high magnification brightfield and epifluorescence visualization of isolated follicles |
| Mineral Oil | Sigma-Aldrich | M8410-1L | Oil to cover the drops of follicle wash medium to prevent evaporation during searching |
| Non-essential Amino Acids (NEAA) | Gibco | 11140-050 | Component of follicle wash medium |
| Normal Donkey Serum | Jackson ImmunoResearch | 017-000-001 | Reagent for immunostaining blocking buffer |
| Nunc 4-well Dishes for IVF | Thermo Fisher Scientific | 144444 | 4-well dishes for follicle isolation and washing |
| Penicillin-Streptomycin Solution 100x | Gibco | 15-140-122 | Component of follicle wash medium |
| Petri Dish 60 mm OD x 13.7 mm | Ted Pella | 10184-04 | Petri dish that fits the best in the McIlwain Tissue Chopper |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | BP665-1 | Washing buffer for ovaries and follicles |
| Plastic Cutting Board | Fisher Scientific | 09-002-24A | Cutting board of sufficient size to safely cut ovaries |
| Polyvinylpyrrolidone (PVP) | Fisher Scientific | BP431-100 | Addition of PVP (0.1% w/v) to PBS prevents follicles from sticking to the plate or each other |
| ProLong Gold Antifade Mountant | Thermo Fisher Scientific | P36930 | Mounting medium for fluorescently labeled cells or tissue |
| Qiagen RNeasy Micro Kit | Qiagen | 74004 | RNA column clean-up kit |
| R | The R Foundation | v4.1.2 | Statistical analysis software |
| Rabbit-Anti-Human Cx37/GJA4 Polyclonal Antibody | Abcam | ab181701 | Cx37 primary antibody for immunostaining |
| RevertAid RT Reverse Transcription Kit | Thermo Fisher Scientific | K1691 | cDNA synthesis kit |
| Rstudio | RStudio, PBC | v2021.09.2 | Statistical analysis software |
| Sodium Hydroxide Solution (1N/Certified) | Fisher Scientific | SS266-1 | Used to increase media pH to 7.6-7.8 |
| Sodium Pyruvate (NaPyr) | Gibco | 11360-070 | Component of follicle wash medium |
| Square Petri Dish 100 mm x 15 mm | Thermo Fisher Scientific | 60872-310 | Gridded petri dishes allow for more efficient identification of follicles |
| SsoAdvanced Universal SYBR Green Supermix | BioRad | 1725271 | Mastermix for PCR reaction |
| Steritop Threaded Bottle Top Filter | Sigma-Aldrich | S2GPT02RE | Used to sterilize follicle wash medium |
| SYBR-safe DNA gel stain | Thermo Fisher Scientific | S33102 | Staining to visual PCR products on agarose gel |
| TCM199 with Hank’s Salts | Gibco | 12-350-039 | Component of follicle wash medium |
| Triton X-100 | Fisher Scientific | BP151-100 | Detergent for immunostaining permeabilization buffer |
| Trizol reagent | Thermo Fisher Scientific | 15596026 | RNA isolation reagent |
| Trypan Blue Solution, 0.4% | Gibco | 15-250-061 | Used for testing viability of isolated follicles |
| Tween 20 | Detergent for immunostaining wash buffer | ||
| Warmer Plate Universal | WTA | 20931 | Warm plate to keep follicles at 38.5 °C while searching under the microscope |
| Wiretrol II Calibrated Micropipets | Drummond | 50002-005 | Glass micropipettes to manipulate follicles |
参考文献
- Fortune, J. E., Yang, M. Y., Allen, J. J., Herrick, S. L. Triennial reproduction symposium: The ovarian follicular reserve in cattle: What regulates its formation and size. Journal of Animal Science. 91 (7), 3041-3050 (2013).
- Fair, T., Hulshof, S. C., Hyttel, P., Greve, T., Boland, M. Oocyte ultrastructure in bovine primordial to early tertiary follicles. Anatomy and Embryology. 195 (4), 327-336 (1997).
- Jaffe, L. A., Egbert, J. R. Regulation of mammalian oocyte meiosis by intercellular communication within the ovarian follicle. Annual Review of Physiology. 79, 237-260 (2017).
- Driancourt, M. A., Reynaud, K., Cortvrindt, R., Smitz, J. Roles of KIT and KIT LIGAND in ovarian function. Reviews of Reproduction. 5 (3), 143-152 (2000).
- Lussier, J. G., Matton, P., Dufour, J. J. Growth rates of follicles in the ovary of the cow. Journal of Reproductive Fertility. 81 (2), 301-307 (1987).
- Aerts, J. M. J., Bols, P. E. J. Ovarian follicular dynamics: a review with emphasis on the bovine species. Part I: Folliculogenesis and preantral follicle development. Reproduction in Domestic Animals. 45 (1), 171-179 (2010).
- Sugiura, K., Pendola, F. L., Eppig, J. J. Oocyte control of metabolic cooperativity between oocytes and companion granulosa cells: energy metabolism. Developmental Biology. 279 (1), 20-30 (2005).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biology of Reproduction. 73 (2), 351-357 (2005).
- Sugimura, S., et al. Amphiregulin co-operates with bone morphogenetic protein 15 to increase bovine oocyte developmental competence: effects on gap junction-mediated metabolite supply. Molecular Human Reproduction. 20 (6), 499-513 (2014).
- Edson, M. A., Nagaraja, A. K., Matzuk, M. M. The mammalian ovary from genesis to revelation. Endocrine Reviews. 30 (6), 624-712 (2009).
- Matzuk, M. M., Burns, K. H. Genetics of mammalian reproduction: modeling the end of the germline. Annual Review of Physiology. 74, 503-528 (2012).
- McGee, E. A., Raj, R. S. Regulators of ovarian preantral follicle development. Seminars in Reproductive Medicine. 33 (3), 179-184 (2015).
- Chen, Y., et al. The factors and pathways regulating the activation of mammalian primordial follicles in vivo. Frontiers in Cell and Developmental Biology. 8, 575706 (2020).
- Figueiredo, J. R., et al. Development of a combined new mechanical and enzymatic method for the isolation of intact preantral follicles from fetal, calf and adult bovine ovaries. Theriogenology. 40 (4), 789-799 (1993).
- Sirard, M. A. The ovarian follicle of cows as a model for human. Animal Models and Human Reproduction. , 127-144 (2017).
- Parkes, W. S., et al. Hyaluronan and collagen are prominent extracellular matrix components in bovine and porcine ovaries. Genes. 12 (8), 1186 (2021).
- Araújo, V. R., Gastal, M. O., Figueiredo, J. R., Gastal, E. L. In vitro culture of bovine preantral follicles: a review. Reproductive Biology and Endocrinology. 12 (1), 1-14 (2014).
- Eppig, J. J., Schroeder, A. C. Capacity of mouse oocytes from preantral follicles to undergo embryogenesis and development to live young after growth, maturation, and fertilization in vitro. Biology of Reproduction. 41 (2), 268-276 (1989).
- McLaughlin, M., Telfer, E. E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Nuttinck, F., Mermillod, P., Massip, A., Dessy, F. Characterization of in vitro growth of bovine preantral ovarian follicles: A preliminary study. Theriogenology. 39 (4), 811-821 (1993).
- Demeestere, I., et al. Effect of preantral follicle isolation technique on in-vitro follicular growth, oocyte maturation and embryo development in mice. Human Reproduction. 17 (8), 2152-2159 (2002).
- Fattahi, A., et al. Optimization of porcine ovarian follicle isolation methods for better developmental potential. Tissue Engineering Part A. 26 (13-14), 712-719 (2020).
- Nagashima, J. B., Hill, A. M., Songsasen, N. In vitro development of mechanically and enzymatically isolated cat ovarian follicles. Reproduction and Fertility. 2 (1), 35-46 (2021).
- Lucci, C. M., Rumpf, R., Figueiredo, J. R., Báo, S. N. Zebu (Bos indicus) ovarian preantral follicles: Morphological characterization and development of an efficient isolation method. Theriogenology. 57 (5), 1467-1483 (2002).
- Langbeen, A., et al. Characterization of freshly retrieved preantral follicles using a low-invasive, mechanical isolation method extended to different ruminant species. Zygote. 23 (5), 683-694 (2014).
- Candelaria, J. I., Denicol, A. C. Characterization of isolated bovine preantral follicles based on morphology, diameter and cell number. Zygote. 28 (2), 154-159 (2020).
- vanden Hurk, R., et al. Ultrastructure and viability of isolated bovine preantral follicles. Human Reproduction Update. 4 (6), 833-841 (1998).
- Paes, V. M., et al. Effect of heat stress on the survival and development of in vitro cultured bovine preantral follicles and on in vitro maturation of cumulus-oocyte complex. Theriogenology. 86 (4), 994-1003 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological image analysis. Nature Methods. 9 (7), 676-682 (2012).
- de Aguiar, L. H., Hyde, K. A., Pedroza, G. H., Denicol, A. C. Heat stress impairs in vitro development of preantral follicles of cattle. Animal Reproduction Science. 213, 106277 (2020).
- Kristensen, S. G., Ebbesen, P., Andersen, C. Y. Transcriptional profiling of five isolated size-matched stages of human preantral follicles. Molecular and Cellular Endocrinology. 401, 189-201 (2015).
- Candelaria, J. I., Rabaglino, M. B., Denicol, A. C. Ovarian preantral follicles are responsive to FSH as early as the primary stage of development. Journal of Endocrinology. 247 (2), 153-168 (2020).
- Nuttinck, F., et al. Comparative immunohistochemical distribution of Connexin 37 and Connexin 43 throughout folliculogenesis in the bovine ovary. Molecular Reproduction and Development. 57 (1), 60-66 (2000).
- Itoh, T., Hoshi, H. Efficient isolation and long-term viability of bovine small preantral follicles in vitro. In Vitro Cellular and Developmental Biology-Animal. 36 (4), 235-240 (2000).
- Saha, S., Shimizu, M., Geshi, M., Izaike, Y. In vitro culture of bovine preantral follicles. Animal Reproduction Science. 63 (1-2), 27-39 (2000).
- Bus, A., et al. Preservation of connexin 43 and transzonal projections in isolated bovine pre-antral follicles before and following vitrification. Journal of Assisted Reproduction and Genetics. 38 (2), 479-492 (2021).
- Gougeon, A., Ecochard, R., Thalabard, J. C. Age-related changes of the population of human ovarian follicles: increase in the disappearance rate of non-growing and early-growing follicles in aging women. Biology of Reproduction. 50 (3), 653-663 (1994).
- Xu, D., et al. Raf-ERK1/2 signaling pathways mediate steroid hormone synthesis in bovine ovarian granulosa cells. Reproduction in Domestic Animals. 54 (5), 741-749 (2019).
- Santos, R. R., et al. Cryopreservation of ovarian tissue: an emerging technology for female germline preservation of endangered species and breeds. Animal Reproduction Science. 122 (3-4), 151-163 (2010).
- Leonel, E. C. R., Lucci, C. M., Amorim, C. A. Cryopreservation of human ovarian tissue: a review. Transfusion Medicine and Hemotherapy. 46 (3), 173-181 (2019).
- Bus, A., Langbeen, A., Martin, B., Leroy, J. I. M. R., Bols, P. E. J. Is the pre-antral ovarian follicle the 'holy grail' for female fertility preservation. Animal Reproduction Science. 207, 119-130 (2019).
- Chen, J., et al. Optimization of follicle isolation for bioengineering of human artificial ovary. Biopreservation and Biobanking. , (2021).
- Chiti, M. C., et al. A modified and tailored human follicle isolation procedure improves follicle recovery and survival. Journal of Ovarian Research. 10 (1), 1-9 (2017).
- Kristensen, S. G., Rasmussen, A., Byskov, A. G., Andersen, C. Y. Isolation of pre-antral follicles from human ovarian medulla tissue. Human Reproduction. 26 (1), 157-166 (2011).
- Oktay, K., et al. Isolation and characterization of primordial follicles from fresh and cryopreserved human ovarian tissue. Fertility and Sterility. 67 (3), 481-486 (1997).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved