Method Article
إنتاج الخلايا العصبية البشرية Neurogenin 2-inducible في مفاعل حيوي معلق ثلاثي الأبعاد
In This Article
Summary
توضح هذه المقالة بروتوكولا لتوليد الخلايا العصبية المشتقة من الخلايا الجذعية متعددة القدرات التي يسببها الإنسان في مفاعل حيوي معلق 3D على الطاولة.
Abstract
كان اشتقاق خلايا السلالة العصبية من الخلايا الجذعية متعددة القدرات التي يسببها الإنسان (hiPSCs) علامة فارقة في أبحاث الدماغ. منذ ظهورها لأول مرة ، تم تحسين البروتوكولات باستمرار وتستخدم الآن على نطاق واسع في البحث وتطوير الأدوية. ومع ذلك ، فإن المدة الطويلة جدا لبروتوكولات التمايز والنضج التقليدية هذه والطلب المتزايد على hiPSCs عالية الجودة ومشتقاتها العصبية تزيد من الحاجة إلى اعتماد هذه البروتوكولات وتحسينها وتوحيدها للإنتاج على نطاق واسع. يقدم هذا العمل بروتوكولا سريعا وفعالا للتمييز بين الخلايا العصبية المعدلة وراثيا والقابلة للحث بالدوكسيسيكلين 2 (iNGN2) التي تعبر عن hiPSCs إلى خلايا عصبية باستخدام مفاعل حيوي ثلاثي الأبعاد (3D) معلق على الطاولة.
باختصار ، سمح لمعلقات الخلية المفردة ل iNGN2-hiPSCs بتكوين مجاميع في غضون 24 ساعة ، وتم تحفيز الالتزام بالنسب العصبي عن طريق إضافة الدوكسيسيكلين. تم فصل المجاميع بعد 2 أيام من الحث وكانت الخلايا إما محفوظة بالتبريد أو معاد طلاؤها للنضج النهائي. عبرت الخلايا العصبية iNGN2 المتولدة عن علامات عصبية كلاسيكية في وقت مبكر وشكلت شبكات عصبية معقدة في غضون أسبوع واحد بعد إعادة الطلاء ، مما يشير إلى زيادة نضج الثقافات العصبية. باختصار ، يتم توفير بروتوكول مفصل خطوة بخطوة للتوليد السريع للخلايا العصبية المشتقة من hiPSC في بيئة 3D التي تحمل إمكانات كبيرة كنقطة انطلاق لنمذجة المرض ، وفحوصات الأدوية عالية الإنتاجية للنمط الظاهري ، واختبار السمية على نطاق واسع.
Introduction
الاضطرابات العصبية هي السبب الرئيسي للإعاقة في جميع أنحاء العالم1. يتأثر واحد من كل ستة أشخاص ، ويستمر معدل الإصابة في الارتفاع. إن العبء المالي المرتبط بالمجتمعات وأنظمة الرعاية الصحية لديها ضخم. وقدر تقييم أجري في 30 دولة أوروبية في عام 2010 التكاليف السنوية بمبلغ 800 مليار يورو تتعلق بالاضطرابات العقلية والعصبية2. يتطلب العبء الاجتماعي والاقتصادي المتزايد استراتيجيات علاج فعالة ، وعلى الرغم من أن فهمنا للفيزيولوجيا المرضية للمرض قد زاد بشكل كبير ، إلا أن الترجمة إلى العيادات غالبا ما تكون غير كافية. بشكل عام ، يدخل 12٪ فقط من المستحضرات الصيدلانية في التجارب السريرية ، والتي يفشل أكثر من 80٪ منها خلال المراحل اللاحقة ، ويرجع ذلك أساسا إلى عدم الفعالية أو السمية غير المتوقعة 3,4. تتنوع الأسباب ، لكن قابلية النقل المحدودة من الاختبارات على الحيوانات في المراحل قبل السريرية إلى التجارب البشرية قد ظهرت بشكل متزايدفي المقدمة 5. قد تسد نماذج الخلايا والأنسجة البشرية في المختبر فجوة الترجمة بين الأنواع ، ويمتلك التقدم في تكنولوجيا الخلايا الجذعية متعددة القدرات التي يسببها الإنسان (hiPSC) إمكانات كبيرة في هذا الصدد. تستخدم hiPSCs على نطاق واسع في الأبحاث الأساسية وتشترك في الخصائص الأساسية مع الخلايا الجذعية الجنينية (hESCs) ، مثل قدرة التجديد الذاتي غير المحدودة تقريبا والقدرة على التمايز إلى جميع طبقات الجراثيم الثلاث6 ، مع التحايل على المخاوف الأخلاقية المرتبطة بتدمير الأجنة.
كان اشتقاق الخلايا العصبية من hESCs ، ولاحقا hiPSCs ، علامة فارقة في أبحاث الدماغ. استندت بروتوكولات التمايز الأولية إلى تطبيق عوامل النمو التي تحاكي الخطوات الحرجة أثناء التطور الجنيني ، ومعظمها ينطوي على تثبيط SMAD المزدوج إما في المزارع المعلقة أو الملتصقة7،8،9. تم إنشاء الخلايا العصبية الناضجة بنجاح ، لكن العديد من عيوب هذه البروتوكولات لا تزال تعيق استخدامها على نطاق واسع في تطوير الأدوية ، مثل العائد المنخفض والتباين العالي من دفعة إلى أخرى للخلايا العصبية المتولدة ، فضلا عن عبء العمل المكثف المتعلق بأوقات الثقافة الطويلة. تم تحقيق تحسينات من خلال التعبير القسري لعوامل النسخ المشاركة بشكل حاسم في تكوين الخلايا العصبية ، وتم تحديد أفراد عائلة neurogenin (NGN) ، ولا سيما NGN2 ، كمحركات فعالة10. أدى التعبير خارج الرحم بوساطة عدسي ل NGN2 في hiPSCs إلى تسريع المراحل المبكرة من التمايز العصبي بشكل كبير ، وتسبب في مصير الخلايا العصبية خلال أسبوع واحد فقط11. أدى النضج النهائي اللاحق في الثقافات المشتركة مع الخلايا النجمية إلى خلايا عصبية وظيفية عالية النقاء وكمية مع خصائص قابلة للتكرار. ثم تم تطبيق التحرير الجيني الموجه للموقع لموقع الملاذ الآمن لموقع تكامل الفيروس المرتبط بالغدي 1 (AAVS1) لإنشاء خطوط hiPSC مع شريط تعبير مستقر ومحفز للدوكسيسيكلين ل NGN212,13 ، وبالتالي تقليل الآثار الجانبية غير المرغوب فيها لتوصيل الفيروس العدسي.
إن التمايز القوي والفعال للخلايا العصبية العصبية 2 (iNGN2) المحرضة بالدوكسيسيكلين يحمل إمكانات كبيرة لفحوصات الأدوية ذات النمط الظاهري عالية الإنتاجية ومقايسات السمية10،14،15 ؛ وقد تم إحراز تقدم كبير في المعالجة الحيوية خلال العقد الماضي في تنفيذ المفاعلات الحيوية لتوسيع الخلايا القابلة للتطوير والتمايز16،17،18،19. ومع ذلك ، يتم تحسين غالبية بروتوكولات التمايز للثقافات الملتصقة ، وغالبا ما تتطلب الترجمة إلى بيئة ثلاثية الأبعاد (3D) تعديلات أساسية. في الآونة الأخيرة ، تم الإبلاغ عن الاستخدام الناجح لمفاعل حيوي ثلاثي الأبعاد على الطاولة مع ميزات إجهاد القص المنخفضة لتوسيع hiPSCs والتمايز القابل للتكرار إلى خلايا الكبد وخلايا عضلة القلب والخلايا العصبية20. هنا ، يتم توفير بروتوكول مفصل لتوليد وتوصيف الخلايا العصبية iNGN2 باستخدام المفاعل الحيوي ثلاثي الأبعاد المتطابق.
Protocol
ملاحظة: يجب إجراء جميع عمليات التلاعب بالخلايا ، وكذلك أطباق الاستزراع والمستحضرات المتوسطة ، في ظل ظروف معقمة. يجب تنظيف غطاء التدفق الصفحي جيدا قبل الاستخدام وبعد المعالجة عن طريق مسح جميع الأسطح بنسبة 70٪ من الإيثانول. تم تحسين البروتوكول الموصوف للتمايز العصبي في حاضنة CERO 3D والمفاعل الحيوي (في ما يلي يشار إليه باسم المفاعل الحيوي على الطاولة). يوفر هذا المفاعل الحيوي الموضوعة على الطاولة أربع فتحات لأنابيب المفاعلات الحيوية المتخصصة ، كل منها بسعة قصوى تبلغ 50 مل. يتم التحكم في درجة الحرارة ومستويات CO2 بشكل مستمر ، ويتم تنظيم معلمات الزراعة (على سبيل المثال ، سرعة الدوران والوقت) لكل أنبوب بشكل مستقل. تم تنفيذ جميع خطوات الشفط باستخدام ماصة شفط ومضخة تفريغ ، ما لم يذكر خلاف ذلك.
1. زراعة وتوسيع hiPSCs
ملاحظة: يتم استخدام خط NGN2 hiPSC المحرض بالدوكسيسيكلين المصمم هندسيا BIONi010-C-13 في هذا البروتوكول. تم تحسين بروتوكول التوسيع المقدم هنا لأطباق بتري 6 سم ، ولكن يمكن استخدام تنسيقات الثقافة البديلة إذا كنت تفضل ذلك.
- قم بتغطية أطباق بتري 6 سم بمصفوفة غشاء قاعدي مخففة في وسط النسر المعدل من Dulbecco (DMEM) / F12 (-/-) بتركيز نهائي قدره 0.083 مجم / مل / 10 سم2. احتضان الأطباق المغلفة على حرارة 37 درجة مئوية لمدة 30 دقيقة على الأقل.
ملاحظة: يمكن العثور على بروتوكول مفصل لإعداد محلول مصفوفة الغشاء القاعدي في تعليمات الشركة المصنعة. يمكن استزراع hiPSCs على مصفوفات بديلة خارج الخلية للتوسع. - إذابة hiPSCs المحفوظة بالتبريد وفقا لبروتوكول مستخدم خط الخلاياEBiSC 21 في وسط صيانة iPSC خال من وحدة التغذية + مثبط ROCK 10 ميكرومتر (Y-27632). يوصى بكثافة بذر من 1 × 106 خلايا قابلة للحياة لكل طبق 60 مم.
- قم بتغيير الوسيط في اليوم التالي إلى وسيط صيانة iPSC خال من وحدة التغذية بدون مثبطات ROCK ، وقم بإجراء تغييرات يومية على الوسائط.
- ابدأ بالمرور عندما تصل ثقافات hiPSC إلى التقاء 60٪ -80٪. تحقق من وجود مناطق متباينة ونظف المستعمرات يدويا إذا تجاوزت المساحة 5٪.
ملاحظة: تظهر hiPSCs غير المتمايزة كخلايا مستديرة ذات نواة بارزة وسيتوبلازم أقل. تتشكل المستعمرات المسطحة والمعبأة بإحكام في وقت مبكر بعد ذوبان الجليد أو المرور. يتم عرض صور برايت فيلد النموذجية لثقافات hiPSC في الشكل 1. يتم توفير مزيد من المعلومات في بروتوكول مستخدم خط الخليةEBiSC 21. للتمرير ، قم بإعداد الأطباق المغلفة بمصفوفة الغشاء القاعدي ووسط صيانة iPSC الخالي من وحدة التغذية. - نضح الوسط من مزارع hiPSC وشطف الخلايا 2x مع 0.5 mM حمض الإيثيلين ديامينيترايتيك (EDTA) في 1x محلول ملحي مخزن بالفوسفات من Dulbecco (DPBS) بدون Ca 2+ و Mg2+ (DPS [-/-] ، انظر جدول المواد).
- قم بإزالة المادة الطافية وأضف 2 مل من 0.5 مللي متر EDTA في 1x DPBS (-/-) إلى أطباق بتري 6 سم. احتضان الخلايا عند 37 درجة مئوية لمدة 3 دقائق في الحاضنة.
- نضح 1.5 مل من محلول EDTA واستمر في الحضانة لمدة 3-5 دقائق.
- اضغط برفق على الأطباق لتسهيل انفصال الخلايا.
ملاحظة: تحقق من الانفصال عن طريق التقييم البصري. يجب أن تبدأ مستعمرات hiPSC في الانفصال بعد 5 دقائق ، ولكن قد تكون هناك حاجة إلى وقت حضانة أطول مع ثقافات hiPSC المتقاربة الأعلى. إذا لم تنفصل المستعمرات ، فقم بزيادة وقت الحضانة حتى 10 دقائق ، لكن لا تتجاوز هذا الإطار الزمني. - أضف 5 مل من وسيط صيانة iPSC الخالي من وحدة التغذية إلى أطباق بتري 6 سم ، وأعد تعليق المستعمرات برفق 2x باستخدام ماصة مصلية سعة 10 مل أو باستخدام أطراف ماصة عريضة التجويف. انقل الخلايا إلى أنبوب سعة 15 مل.
ملاحظة: hiPSCs حساسة للغاية للإجهاد الميكانيكي. وبالتالي ، ينبغي تجنب التعليق المتعدد. يجب أن يتكون تعليق الخلية النهائي من شظايا مستعمرة صغيرة (50-200 ميكرومتر). - قم بشفط المادة الطافية من أطباق الاستزراع المغلفة ، وقم بإعداد 4 مل من وسط صيانة iPSC الخالي من وحدة التغذية لكل طبق 6 سم.
- انقل شظايا المستعمرة الصغيرة إلى أطباق الاستزراع الطازجة بنسب مقسمة من 1:10 إلى 1:40 ، وازرعها عند 37 درجة مئوية و 5٪ CO2 مع تغييرات الوسائط اليومية.
ملاحظة: يجب أن تلتصق المستعمرات الصغيرة في غضون 1 أو 2 ساعة بعد المرور.
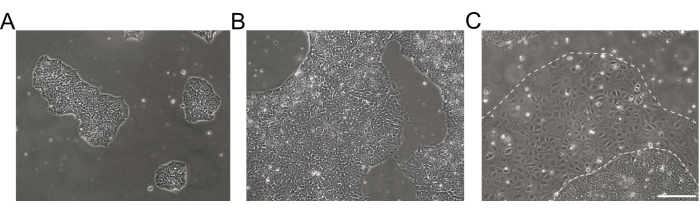
الشكل 1: مورفولوجيا مزارع الخلايا الجذعية متعددة القدرات التي يسببها الإنسان . (أ ، ب) ثقافات hiPSC عالية الجودة ذات التقاء مختلفة تظهر مستعمرات hiPSC مضغوطة مع مورفولوجيا متجانسة وحواف محددة. (C) ثقافة hiPSC مع مجموعات ناشئة من الخلايا المتمايزة حول حواف المستعمرة (خط أبيض متقطع). شريط المقياس = 200 ميكرومتر. اختصار: hiPSC = الخلايا الجذعية متعددة القدرات التي يسببها الإنسان. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. الزراعة المسبقة ل hiPSCs في نظام المفاعل الحيوي الموضوعة على الطاولة (اليوم 2)
ملاحظة: ابدأ الزراعة المسبقة عندما تصل ثقافات hiPSC إلى التقاء بين 60٪ و 80٪. تحقق من مستعمرات hiPSC للمناطق المتباينة. خلال مرحلة ما قبل الزراعة هذه ، يتم الحفاظ على hiPSCs في وسط صيانة iPSC خال من وحدة التغذية لمدة 2 أيام.
- تحضير وسائط الاستزراع ، التي تتكون من وسيط صيانة iPSC خال من التغذية ومثبط 10 ميكرومتر ROCK (Y-27632).
- نضح الوسط تماما من hiPSCs وشطف الخلايا برفق باستخدام 1x DPBS (-/-) مرتين.
- أضف 2.0 مل من محلول التربسين-EDTA المسخن مسبقا إلى أطباق بتري 6 سم واحتضان الخلايا لمدة 3 دقائق عند 37 درجة مئوية في الحاضنة.
- اضغط برفق على الأطباق لتسهيل انفصال الخلايا ، أو احتضانها لمدة 1-2 دقيقة أطول.
- أعد تعليق الخلايا في 5 مل من وسيط صيانة iPSC الخالي من وحدة التغذية + مثبط ROCK لكل طبق. انقل معلق الخلية إلى أنبوب سعة 15 مل أو 50 مل واخلطه برفق عن طريق السحب لضمان تفرد الخلية.
- حدد أرقام الخلايا في 100 ميكرولتر من تعليق الخلية باستخدام عداد خلية آلي كما هو موضح سابقا20. نقل الحجم المقابل ل 15 × 106 خلايا لكل أنبوب مفاعل حيوي إلى أنبوب 50 مل.
- أجهزة الطرد المركزي الخلايا في 300 × غرام لمدة 3 دقائق.
- نضح المادة الطافية وأعد تعليق الخلايا في 2 مل من وسيط صيانة iPSC الخالي من وحدة التغذية + مثبط ROCK.
- املأ كل أنبوب سعة 50 مل ب 18 مل من الوسط (كثافة بذر الخلية 0.75 × 106 خلايا / مل). قم بتوزيع تعليق الخلية في أنابيب المفاعل الحيوي (20 مل لكل أنبوب).
- ضع الأنابيب في نظام المفاعل الحيوي. اضبط معلمات الزراعة التالية: فترة دوران 2 ثانية ، سرعة دوران 60 دورة في الدقيقة ، بدون توقف للتحريك ، 37 درجة مئوية ، و 5٪ CO2 لمدة غير محدودة20.
- ابدأ برنامج الزراعة عبر شاشة المفاعل الحيوي.
- قم بتغيير الوسائط في اليوم التالي. دع الركام يستقر في أنابيب المفاعل الحيوي لمدة ~ 5 دقائق. نضح بعناية طاف .
ملاحظة: لا تدع الركام يستقر لمدة تزيد عن 10 دقائق ، لأنها قد تلتصق ببعضها البعض وتبني تعليقا إجماليا غير متجانس. يوصى بترك ~ 5 مل من وسط الاستزراع في أنبوب المفاعل الحيوي. - أضف 15 مل من وسط صيانة iPSC الطازج الخالي من التغذية بدون مثبط ROCK لكل أنبوب ، واستمر في الزراعة في المفاعل الحيوي الموضوعة على الطاولة لمدة 24 ساعة.
3. تمايز hiPSCs إلى الخلايا العصبية المبكرة (اليوم 0)
- تحضير الوسط العصبي القاعدي (NBM): 50٪ DMEM / F-12 مع ثنائي ببتيد L-alanyl-L-glutamine المستقر ، 50٪ وسط عصبي قاعدي ، مكمل خال من المصل 0.5x (50x) ، مكمل خال من المصل 0.5x يعتمد على تركيبة N-1 من Bottenstein (100x) ، 0.5x مستقر L-alanyl-L-glutamine dipeptide ، محلول أحماض أمينية غير أساسية 0.5x MEM (100x) ، 500 نانومتر بيروفات الصوديوم (100 mM) ، 50 nM 2-mercaptoethanol (50 mM) ، 0.025٪ محلول أنسولين بشري ، و 5 U / mL بنسلين-ستربتومايسين.
ملاحظة: يجب تخزين NBM في 4 °C ويمكن استخدامه لمدة تصل إلى 2 أسابيع. - ابدأ التمايز العصبي عن طريق إضافة الدوكسيسيكلين (DOX) إلى مزارع hiPSC. لهذا ، دع الركام يستقر في أنابيب المفاعل الحيوي. قم بشفط المادة الطافية بعناية من الخلايا ، وترك ~ 5 مل في الأنبوب ، وأضف 35 مل من وسط الحث العصبي (NIM) الذي يتكون من NBM و 2 ميكروغرام / مل DOX.
ملاحظة: نظرا لأن DOX حساس للضوء ، فمن المستحسن إطفاء الضوء أثناء العمل. - ضع الأنابيب مرة أخرى في المفاعل الحيوي الموجود على الطاولة واستمر في الزراعة.
- قم بإجراء تغييرات الوسائط كل يوم لمدة يومين، كما هو موضح في الخطوة 3.2.
ملاحظة: بعد 4 أيام في ثقافة التعليق ، يمكن فصل الركام ، والحفاظ على الخلايا العصبية المبكرة بالتبريد أو إعادة الطلاء مباشرة للنضج النهائي.
4. الحفظ بالتبريد للخلايا العصبية المبكرة (اليوم 2)
ملاحظة: الحفظ بالتبريد غير مطلوب وليس حاسما لعملية التمايز ، ولكن يوصى به بشدة حيث يمكن إنتاج مخزونات كبيرة من الخلايا العصبية المبكرة وتخزينها للنضج والتحليلات اللاحقة.
- دع الركام يستقر في أنبوب المفاعل الحيوي. نضح الطافي كما هو موضح سابقا.
- انقل الركام إلى أنبوب معقم سعة 15 مل أو 50 مل واشطف الركام برفق 2x باستخدام 1x DPBS (-/-). استنشاق بعناية طاف قدر الإمكان دون إزعاج الركام.
- أضف 2-5 مل من إنزيم تفكك الخلايا المسخن مسبقا ، اعتمادا على حجم الحبيبات ، واحتضن الخلايا لمدة 10 دقائق تقريبا عند 37 درجة مئوية في حمام مائي. أعد تعليق الركام المترسب برفق كل 2 دقيقة حتى تنفصل الركام.
ملاحظة: يجب الحصول على تعليق خلية متجانسة تقريبا بعد 7-10 دقائق من الحضانة. - أضف الحجم الثلاثي لوسط NBM المسخن مسبقا وأعد تعليق الخلايا بعناية لضمان تفرد الخلية.
- حدد أعداد الخلايا وانقل الحجم المقابل للحفظ بالتبريد إلى أنبوب سعة 15 مل أو 50 مل.
ملاحظة: يوصى بكثافة خلية من 5-10 × 106 خلايا / مل من وسط التجميد. - أجهزة الطرد المركزي الخلايا في 300 × غرام لمدة 3 دقائق.
- نضح المادة الطافية وأعد تعليق حبيبات الخلية برفق في الحجم المقابل لوسط التجميد الذي يحتوي على 10٪ ثنائي ميثيل سلفوكسيد (DMSO).
- قلص تعليق الخلية في قوارير مناسبة للحفظ بالتبريد (1 مل / قارورة).
- انقل القوارير على الفور إلى حاوية تجميد مبردة مسبقا وبطيئة المعدل مملوءة ب 2-بروبانول وضع الحاوية عند -80 درجة مئوية طوال الليل. ضع القوارير على حرارة -150 درجة مئوية في اليوم التالي للتخزين طويل الأجل.
ملاحظة: السائل 2-بروبانول شديد الاشتعال وقد يتسبب في تلف العين عند ملامسته. الابتعاد عن الحرارة وارتداء القفازات الواقية وكذلك النظارات.
5. نضوج الخلايا العصبية المشتقة من hiPSC في الثقافات أحادية الطبقة
- قم بإعداد أطباق الاستزراع المغلفة بولي-L-ornithine / laminin للزراعة طويلة المدى للخلايا العصبية المشتقة من hiPSC.
- قم بتخفيف محلول مخزون poly-L-ornithine إلى 0.001٪ في 1x DPBS (-/-) وقم بتغطية الأطباق طوال الليل عند 4 درجات مئوية ، أو لمدة 4 ساعات عند 37 درجة مئوية. نضح محلول poly-L-ornithine واغسل الألواح مرة واحدة باستخدام 1x DPBS (-/-).
- قم بتخفيف محلول اللامينين في 1x DPBS (-/-) إلى تركيز نهائي قدره 10 ميكروغرام / مل واحتضان الأطباق طوال الليل عند 4 درجات مئوية ، أو لمدة 4 ساعات عند 37 درجة مئوية.
ملاحظة: يوصى بحجم 0.1-0.15 مل لكل سم 2 لإجراءات الطلاء ، و 0.2 مل لكل سم2 لجميع خطوات الغسيل المعنية. يمكن استخدام ركائز طلاء بديلة ، ولكن يجب تقييم التأثيرات المحتملة على ارتباط الخلية ونضجها.
- قم بإذابة الخلايا المحفوظة بالتبريد. لهذا ، ضع cryovial في حمام مائي (اضبط على 37 درجة مئوية) وقم بتدويره لمدة 1 دقيقة تقريبا ، حتى يتم ترك كتلة صغيرة من تعليق الخلية المجمدة.
- انقل تعليق الخلية بعناية بالتنقيط إلى أنبوب سعة 15 مل محضر ب 10 مل من NBM المسخن مسبقا. شطف cryovial مع 1 مل من NBM ونقل تعليق الخلية إلى أنبوب 15 مل متطابقة.
- أجهزة الطرد المركزي الخلايا في 300 × غرام لمدة 3 دقائق.
- نضح المادة الطافية وإضافة 1-2 مل من NIM المكمل بمثبط 10 ميكرومتر ROCK.
- أعد تعليق حبيبات الخلية بعناية وحدد أرقام الخلايا.
- نضح محلول اللامينين المتبقي من أطباق زراعة الخلايا المغلفة وبذر الخلايا بكثافة بذر 1 × 105 خلايا / سم2 في NIM مع استكمال مثبط 10 ميكرومتر ROCK.
- قم بتبديل الوسط بعد 24 ساعة إلى NIM بدون مثبط ROCK.
- إجراء تغييرات متوسطة يومية لمدة 4 أيام.
- بعد هذه المرحلة الأولية من تحريض NGN2 ، حذف DOX وزراعة الخلايا في NBM ، مع تغيير نصف الوسائط 2x في الأسبوع حتى الوصول إلى المرحلة المطلوبة من النضج.
ملاحظة: يوصى بالزراعة المشتركة للخلايا العصبية iNGN2 مع الخلايا النجمية لزيادة بقاء الخلية والتعلق والنضج والنشاط الكهربائي13,22.
6. توصيف الخلايا العصبية المشتقة من hiPSC
ملاحظة: يمكن تقييم التمايز إلى مشتقات الخلايا العصبية من خلال التقنيات التالية.
- الكيمياء المناعية والتصوير
- نضح الوسط من الخلايا العصبية المشتقة من hiPSC واغسل الخلايا مرة واحدة باستخدام 1x DPBS مع Ca 2+ و Mg2+ (+/+).
ملاحظة: ماصة بعناية ، ويفضل على حواف البئر حيث قد تنفصل الخلايا بسهولة شديدة عن السطح. يوصى بحجم 0.2 مل لكل سم2 لجميع خطوات الغسيل لضمان تغطية كاملة للخلايا باستخدام 1x DPBS (+/+). - ثبت الخلايا العصبية باستخدام محلول تثبيت يحتوي على 4٪ بارافورمالدهايد في DPBS (+/+) لمدة 15 دقيقة في درجة حرارة الغرفة (RT). يوصى بحجم 0.1 مل لكل سم2 .
ملاحظة: بارافورمالدهيد (4٪) في DPBS هو محلول خطير ومهيج للجلد مع سمية حادة ومسرطنة محتملة. الابتعاد عن الحرارة ، وارتداء القفازات والنظارات الواقية ، وتجنب الاستنشاق ، واستخدام الحل فقط في بيئة جيدة التهوية. - شطف الخلايا برفق 2x في 1x DPBS (+/+) والمضي قدما في تلطيخ.
ملاحظة: يمكن تخزين الخلايا الثابتة في DPBS (+/+) عند 4 درجة مئوية لمدة تصل إلى 1 شهر حتى مزيد من المعالجة. - نضح DPBS (+/+) من العينات. قم بتخلل الخلايا وحظر مواقع الربط غير المحددة باستخدام 1x DPBS (+/+) يحتوي على 1٪ BSA و 0.2٪ Triton-X-100 لمدة 60 دقيقة في RT.
ملاحظة: يوصى بحجم 0.2 مل لكل سم2 . - إزالة المادة الطافية واحتضان الخلايا طوال الليل عند 4 درجات مئوية ، مع تخفيف الأجسام المضادة الأولية المعنية في محلول التلوين (1x DPBS [+/+] يحتوي على 1٪ BSA) (انظر جدول المواد). تأكد من أن الخلايا مغطاة بالكامل بالمحلول.
ملاحظة: يوصى بحجم 0.1-0.15 مل لكل سم2 . - نضح المخزن المؤقت تلطيخ وشطف الخلايا 3x في 1x DPBS (+/+).
- تمييع الأجسام المضادة الثانوية المقابلة (انظر جدول المواد) في مخزن التلوين بتركيز نهائي قدره 1: 1000.
- احتضان الخلايا في محلول الأجسام المضادة المخفف لمدة 1 ساعة في RT في الظلام. تأكد من أن الخلايا مغطاة بالكامل بالمحلول.
ملاحظة: يوصى بحجم 0.1-0.15 مل لكل سم2 . - نضح محلول الأجسام المضادة الثانوي وشطف الخلايا 2x في 1x DPBS (+/+).
- قم بتلطيخ النوى ب 4 '، 6-دياميدينو-2-فينيليندول (DAPI) ، مخفف في DPBS (+/+) لمدة 5 دقائق في RT.
ملاحظة: يوصى بحجم عمل يتراوح بين 0.1 و0.15 مل لكل سم2 . - شطف الخلايا 2x في 1x DPBS (+/+).
- قم بتخزين الخلايا في DPBS (+/+) عند 4 درجات مئوية حتى التصوير.
ملاحظة: تصوير برايتفيلد مناسب لتتبع التغيرات المورفولوجية ونمو الخلايا العصبية. بالإضافة إلى ذلك ، يمكن تقييم تعبير العلامة النمطية بواسطة الفحص المجهري الفلوري. في حين أن hiPSCs غير المتمايزة تعبر عن OCT 3/4 و NANOG ، فإن بيتا III توبولين (TUBB3) والبروتين المرتبط بالأنابيب الدقيقة 2 (MAP2) قد تكون بمثابة علامات عصبية لتصور الخلايا العصبية والمحاور. يمكن تقييم الشبكة العصبية بشكل أكبر عن طريق تحديد طول الخلايا العصبية في صور برايت فيلد أو الفلورسنت.
- نضح الوسط من الخلايا العصبية المشتقة من hiPSC واغسل الخلايا مرة واحدة باستخدام 1x DPBS مع Ca 2+ و Mg2+ (+/+).
- تحليلات التعبير الجيني عن طريق تفاعل البوليميراز المتسلسل الكمي في الوقت الفعلي (qPCR)
- نضح الوسط وشطف الخلايا مرة واحدة في 1x DPBS (-/-).
ملاحظة: يوصى بحجم 0.2 مل لكل سم2 . - أضف محلول تحلل الحمض النووي الريبي البارد واحصد الخلايا عن طريق الخدش.
- عزل الحمض النووي الريبي باستخدام مجموعة مناسبة قائمة على العمود ، وتحديد تركيزات الحمض النووي الريبي عن طريق قياس الطيف الضوئي للأشعة فوق البنفسجية.
- قم بتوليد cDNA باستخدام 250 نانوغرام من إجمالي الحمض النووي الريبي ومجموعة مناسبة للنسخ العكسي.
- تحضير تفاعلات qPCR للمنارة الجزيئية التي تحتوي على 2.5 نانوغرام من cDNA في نسختين. استخدم مزيجا رئيسيا مناسبا ومقايسات التمهيدي المقابلة20 (انظر جدول المواد).
- قم بتشغيل qPCR عن طريق تطبيق 45 دورة مع التلدين التمهيدي عند 60 درجة مئوية لمدة 20 ثانية.
- تطبيع مستويات التعبير الجيني النسبية إلى متوسط جينات التدبير المنزلي GAPDH و HPRT1 و GUSB. قم بتطبيق طريقة ΔΔCt23 ، باستخدام hiPSCs غير المتمايزة كمعاير.
- نضح الوسط وشطف الخلايا مرة واحدة في 1x DPBS (-/-).
النتائج
خلال الخطوات الأولية ، يتم فصل الثقافات الملتصقة من hiPSCs ، ومفردها ، ونقلها إلى التعليق (الشكل 2). تتشكل الركام في غضون 24 ساعة وتنمو باستمرار في الحجم. بعد 2 أيام من تحريض الجينات المحورة ، يمكن الحفاظ على الخلايا العصبية المبكرة بالتبريد للتجارب اللاحقة.
يؤدي الانتشار المستمر خلال الأيام الأولى في التعليق إلى زيادة في عدد الخلايا ، حيث يصل إلى ذروته بعد يومين من الحث (الشكل 3 أ ، ب). جنبا إلى جنب مع الانتشار ، تبدأ المجاميع في النمو. مقارنة باليوم 0 ، يظهر القطر زيادة بنسبة 50٪ في اليوم 2 ، ويتضاعف تقريبا في اليوم 5 (الشكل 3D). على الرغم من أن القطر المتزايد يحد من إمدادات المغذيات داخل الركام ، إلا أن صلاحية الخلايا لا تتأثر في اليوم 2 أو في اليوم 5 من التمايز (الشكل 3C). ومع ذلك ، فإن الزراعة المطولة لأكثر من 4 أيام في التعليق لا تزيد من تحسين إنتاج الخلايا ، حيث تصبح الركام مقاومة بشكل متزايد للتفرد الأنزيمي (الشكل 3 ب).
عند الحفظ بالتبريد ، يتم إذابة خلايا اليوم 2 وطلائها على أطباق بولي-L-ornithine (PLO) - لامينين للنضج النهائي. بشكل عام ، تلتصق الخلايا جيدا بعد الذوبان ، وتبدأ في تمديد الخلايا العصبية في وقت مبكر. يؤكد ملف تعريف التعبير الجيني الزمني ، وكذلك التلوين الكيميائي المناعي للعلامات العصبية TUBB3 و MAP2 ، هوية الخلايا العصبية (الشكل 4A ، B). بالإضافة إلى ارتفاع مستويات TUBB3 و MAP2 ، يتم إثراء الثقافات العصبية في نسخ تاو البروتين المرتبطة بالأنابيب الدقيقة (MAPT) ، وترميز بروتين عصبي يشارك في تثبيت المحور العصبي ، وتظهر انخفاضا مصاحبا في التعبير عن عامل النسخ المنظم متعدد القدرات POU5F1. علاوة على ذلك ، يتم تشكيل شبكة عصبية كثيفة خلال الأسبوع الأول بعد ذوبان الجليد (الشكل 4C). تشير هذه التغييرات المورفولوجية ، جنبا إلى جنب مع ملف النسخ ، إلى زيادة نضوج الثقافات العصبية.
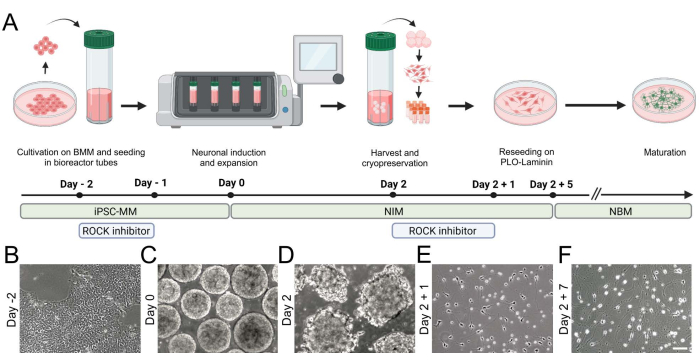
الشكل 2: توليد الخلايا العصبية iNGN2 المشتقة من hiPSC باستخدام مفاعل حيوي منضدي. (أ) نظرة عامة تخطيطية على نموذج التمايز، تسلط الضوء على الخطوات الرئيسية لزراعة الخلايا. (ب-و) تصور صور برايتفيلد (B) hiPSCs و (C ، D) تكوين الركام في المفاعل الحيوي الموضوعة على الطاولة. (E,F) تعمل الخلايا العصبية iNGN2 على تمديد الخلايا العصبية والخضوع للتغيرات المورفولوجية أثناء التمايز. شريط المقياس = 100 ميكرومتر. الاختصارات: BMM = مصفوفة الغشاء القاعدي. iPSC-MM = وسيط صيانة iPSC ؛ PLO = بولي-L- أورنيثين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
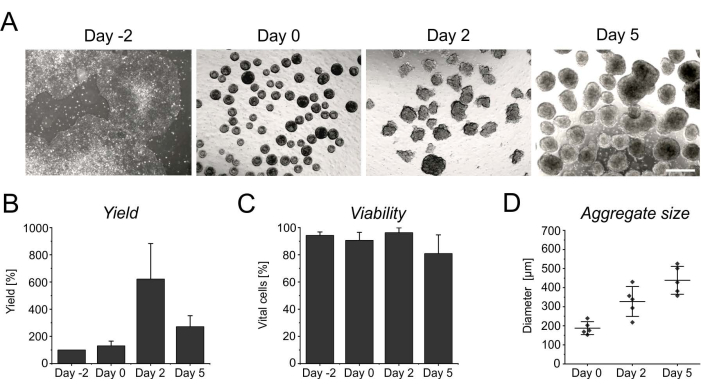
الشكل 3: إنتاجية الخلية وصلاحيتها أثناء تكوين الركام ونموه. (أ) تصور صور برايتفيلد تكوين الركام في غضون 2 أيام من الثقافة في المفاعل الحيوي على الطاولة ، بالإضافة إلى الزيادة في حجم الركام بمرور الوقت. شريط المقياس = 500 ميكرومتر. (ب) القياس الكمي لمحصول الخلية و (ج) الصلاحية خلال مسار التمايز. تمثل الرسوم البيانية الشريطية المتوسط + SD من أربع تجارب مستقلة. (د) تم تحديد القطر ، الذي يدل على حجم الركام ، بشكل شبه تلقائي باستخدام برنامج ImageJ مفتوح المصدر (الإصدار 1.53). أولا ، تم تحويل صور برايت فيلد إلى صور ثنائية ، ثم تم تقييمها بشكل أكبر باستخدام أداة تحليل الجسيمات ، مع تطبيق المعلمات التالية: الحجم > 2500 ميكرومتر2 ، الدائرية 0.45-1 ، استبعاد الحواف ، وتشمل الثقوب. تشير الخطوط الأفقية إلى متوسط ± SD لخمسة تمايزات مستقلة. تمثل النقاط المفردة متوسط تجارب التمايز الفردية مع ما لا يقل عن 20 إجمالا لكل نقطة زمنية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
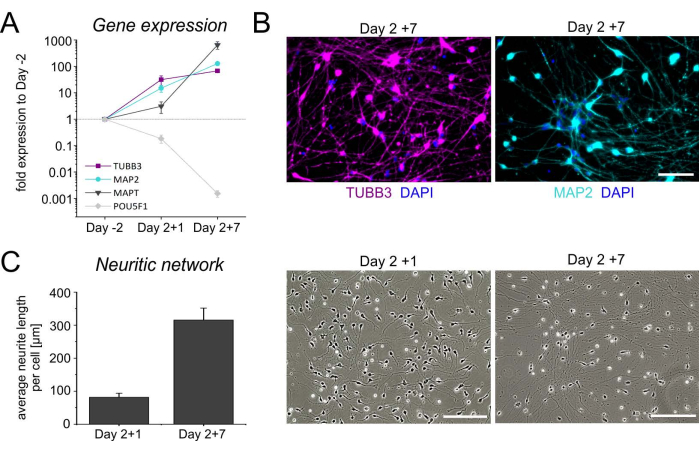
الشكل 4: توصيف الخلايا العصبية iNGN2 المشتقة من hiPSC. ملف تعريف التعبير الجيني الصدغي للجينات العصبية TUBB3 و MAP2 و MAPT ، بالإضافة إلى الجين المرتبط بالخلايا الجذعية متعددة القدرات POU5F1. تم تطبيع مستويات التعبير النسبي للجينات المرجعية GAPDH و HPRT1 و GUSB. تم اختيار hiPSCs غير المتمايزة (اليوم 2) كمعاير. تشير الرموز الهندسية إلى متوسط ± SD لأربعة تمايزات مستقلة. (B) صور تمثيلية للخلايا العصبية iNGN2 في اليوم السابع بعد الذوبان (اليوم 2 + 7) ، ملطخة ببيتا III توبولين (TUBB3 ، أرجواني) والبروتين المرتبط بالأنابيب الدقيقة 2 (MAP2 ، سماوي). تم تلطيخ نوى الخلية ب DAPI. قضبان المقياس = 100 ميكرومتر. (ج) تقييم الشبكة العصبية في صور برايت فيلد للمزارع العصبية بعد الذوبان. تم تحديد الطول الإجمالي للأعصاب في منطقة 930.82 × 698.11 ميكرومتر2 باستخدام ImageJ (الإصدار 1.53). بعد ضبط السطوع والتباين ، تم تحويل الصور إلى صور 8 بت وتم عكس الألوان. تم بعد ذلك هيكلة الخلايا العصبية ثم تحليلها باستخدام مكونات ImageJ الإضافية "Skeletonize" و "Analyze Skeleton" ، على التوالي. تم تقسيم الطول الإجمالي للخلايا العصبية على عدد السوما في المنطقة محل الاهتمام للحصول على متوسط طول / خلية العصب. تمثل الرسوم البيانية الشريطية المتوسط + SD من ثلاث تجارب مستقلة. الاختصارات: DAPI = 4',6-دياميدينو-2-فينيليندول. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
لقد ثبت سابقا أن التعبير خارج الرحم لعامل النسخ العصبي NGN2 يسرع المراحل المبكرة من التمايز العصبي ويحفز التزام النسب العصبي في hiPSCs في غضون أسبوع واحد من الزراعة12،13،20. يصف هذا العمل بروتوكولا مفصلا لتمايز BIONi010-C-13 hiPSCs المحررة جينيا إلى خلايا عصبية iNGN2 باستخدام مفاعل حيوي على الطاولة.
المفاعل الحيوي CERO 3D هو مفاعل حيوي منخفض الحجم مع أربع فتحات للأنابيب المتخصصة ، كل منها بسعة قصوى تبلغ 50 مل. يتم التحكم باستمرار في درجة الحرارة ومستويات CO2 ويتم تنظيم معلمات الزراعة (على سبيل المثال ، سرعة الدوران والوقت) لكل أنبوب ، مما يمكن المستخدمين بشكل مستقل من تشغيل العديد من أساليب التمايز بالتوازي. تسمح كسارات الموجات المدمجة على جدار الأنبوب الداخلي باضطراب الوسط مع إجهاد القص المنخفض والحفاظ على مجاميع 3D في التعليق أثناء الدوران المتحكم فيه. قد يؤثر الوصول المحدود إلى العناصر الغذائية ، بالإضافة إلى تفاعلات الخلايا الخلوية ثلاثية الأبعاد والمصفوفة الخلوية خارج الخلية (ECM) ، بشكل كبير على التمايز الخلوي والسلوك24،25،26،27.
إن زراعة الخلايا كمجاميع 3D في التعليق يزيد من تفاعلات الخلايا هذه ، وبالتالي محاكاة البيئة في الجسم الحي للأنسجة أو الأعضاء عن كثب28. ينظم الاضطراب المصاحب للوسط حجم الركام بسبب الاحتكاك الميكانيكي ، ويحسن تبادل الغازات ، ويقلل من تدرج العناصر الغذائية والنفايات في الأنبوب ، مع الحفاظ على التدرجات الفسيولوجية ذات الصلة داخل الركام29،30،31،32،33،34. على الرغم من إجراء تغييرات متوسطة يدويا ، إلا أن المفاعل الحيوي الموجود على الطاولة يقلل من تكاليف العمالة والتشغيل مقارنة بقوارير الاستزراع الثابتة. يوفر المفاعل الحيوي أيضا العديد من المزايا مقارنة بالمفاعلات الحيوية ذات الخزان المتحرك المؤتمتة بالكامل ، حيث يقلل التصميم الخالي من المكره من إجهاد القص الهيدروديناميكي على السطح الكلي ، وبالتالي لا يحسن بقاء الخلية فحسب ، بل يحد أيضا من تأثيرات إجهاد القص على iPSCs الحساسة ، وتمايز الخلايا ، والوظيفة35،36،37،38.
تمثل المفاعلات الحيوية ذات العجلات العمودية ، حيث يتم تحريك الخلايا بواسطة المكره الرأسي الكبير ، وكذلك المفاعلات الحيوية ذات الحركة الهزازة باستخدام أكياس الثقافة المنتفخة المرفقة بمنصة آلية ، منصات تعليق 3D بديلة. على الرغم من اختبارها بشكل مفرط لزراعة hiPSCs17،18،19،39،40 ، إلا أنه لا يعرف سوى القليل عن قابليتها للتطبيق في مناهج التمايز العصبي ، وتقتصر التقارير على التوسع الناجح لخلايا السلائف العصبية للثدييات والإنسان في المفاعلات الحيوية ذات الخزان المتحرك41،42،43،44 ، مع عدد نادر من الدراسات التي تركز على النضج44,45. بشكل عام ، توفر منصات التعليق الآلي 3D ميزة التغييرات المتوسطة المؤتمتة بالكامل والتي يتم التحكم فيها بواسطة الكمبيوتر ، وبالتالي تقليل الاختلافات في التعامل وتقليل مخاطر التلوث. علاوة على ذلك ، يمكن مراقبة المعلمات الغذائية مثل تركيز اللاكتات والجلوكوز بشكل مستمر. ومع ذلك ، فإن إنشاء هذه الأنظمة غالبا ما يتطلب استثمارا أوليا كبيرا ، ومساحة مختبرية ، وتدريب موظفين مؤهلين. يمثل المفاعل الحيوي الموجود على الطاولة بديلا مضغوطا وسهل الاستخدام لزراعة الخلايا المعلقة ، ولكنه لا يوفر مراقبة متزامنة للمغذيات.
كما هو الحال في غالبية البروتوكولات المستخدمة لزراعة الخلايا في منصات تعليق 3D ، يمثل التكوين الأولي للركام خطوة حاسمة. يتم استزراع hiPSCs كطبقة أحادية ملتصقة ويتم نقلها لاحقا كمعلقات أحادية الخلية إلى بيئة 3D. لتقليل فقدان الخلايا في تلك المرحلة ، يجب مراعاة العديد من الجوانب. يعني تصميم الأنابيب مع كاسحات الموجات المدمجة أن الحد الأدنى من حجم الثقافة يبلغ 10 مل لكل أنبوب مطلوب لضمان الاضطراب المتوسط الأمثل. لذلك لا ينبغي تقويض الحجم الحرج على المدى الطويل. علاوة على ذلك ، يوصى بشدة بكثافة أولية تبلغ 7.5 مليون خلية لكل 10 مل من حجم الاستزراع ، وسرعة دوران تبلغ 60 دورة في الدقيقة ، لتشكيل مجاميع مستقرة على المدى القصير ، على الرغم من أن التعديلات قد تكون ضرورية اعتمادا على خط الخلية.
بعد نقل hiPSCs إلى التعليق ، يجب تشكيل الركام في غضون 24 ساعة. التغيير الوسيط الأول أمر بالغ الأهمية ، حيث أن الركام صغير وقد لا يستقر بشكل صحيح. يمكن تمديد وقت ترسيب الركام ولكن يجب ألا يتجاوز أكثر من 10 دقائق ، حيث قد تبدأ الركام في التكتل والنمو بطريقة غير متجانسة. أثناء الشفط ، يجب ترك الحد الأدنى من حجم الثقافة البالغ 5 مل في الأنبوب ، ويجب تجنب أي اضطرابات في الوسط. ومع ذلك ، من المتوقع فقدان الخلايا والركام خلال المراحل الأولية. يشير عدد الخلايا إلى وجود عائد ثابت للخلايا خلال أول 2 أيام في الثقافة ، مما يشير إلى أن القدرة التكاثرية العالية ل hiPSCs تعوض عن فقدان الخلية الأولي. بمجرد التعليق ، تؤدي الزراعة اللطيفة والاضطراب إلى مجاميع متجانسة الحجم تبدأ في النمو بمرور الوقت.
تم إجراء التمايز العصبي وفقا لبروتوكول تم نشره مسبقا بناء على التعبير المفرط ل NGN2 الناجم عن الدوكسيسيكلين 13 ، وتم تحسين الخطوات الفردية لزراعة ثلاثيةالأبعاد. عامل النسخ العصبي NGN2 هو محرك موصوف جيدا في التمايز العصبي ويسرع الحث العصبي بشكل كبير11،13،46. في حين أن الأنماط التقليدية مع عوامل النمو المحددة تستغرق عدة أسابيع إلى أشهر7،8،9 ، فإن تعبير NGN2 يحفز مصير الخلايا العصبية في غضون أيام. بالإضافة إلى تقصير وقت الزراعة ، لا يعتمد البروتوكول على عوامل النمو باهظة الثمن ولا مصفوفات الطلاء لثقافة التعليق الأولية ، وبالتالي تقليل تكاليف الزراعة بشكل إضافي.
علاوة على ذلك ، كشفت مقارنة مباشرة للجيل المدفوع ب NGN2 من الخلايا العصبية غير الناضجة في الثقافات الملتصقة والمعلقة عن زيادة بمقدار 1.36 ضعف في الخلايا بعد 4 أيام في المزرعة باستخدام المفاعل الحيوي20 على الطاولة ، في حين من المتوقع أن ينخفض حجم الوسط المطلوب لتوليد مليون خلية إلى النصف. لذلك قد يكون استخدام المفاعل الحيوي الموضوعة على الطاولة لتوليد الخلايا العصبية iNGN2 مفيدا ، حيث يمكن إنتاج عدد أكبر من الخلايا بوقت وتكلفة معالجة أقل. تماشيا مع التقارير السابقة ، لوحظ التزام النسب العصبي في وقت مبكر. بعد يومين من تحريض NGN2 ، كان التعبير العميق عن العلامات العصبية الكلاسيكية مثل TUBB3 و MAP2 و MAPT واضحا ، مما يدعم قابلية تطبيق المفاعل الحيوي على الطاولة لتحريض الخلايا العصبية. باتباع هذا البروتوكول ، يمكن الحصول على ما يقرب من 6.2 مليون خلية عصبية iNGN2 غير ناضجة من 1 مليون hiPSCs في غضون 4 أيام من الثقافة. ومع ذلك ، قد تختلف سعة الإنتاج عبر الدفعات وتعتمد على حجم ثقافة التعليق عند البذر.
لزيادة الغلة بشكل أكبر ، تم تمديد وقت الزراعة لمدة 3 أيام إضافية ؛ ومع ذلك ، على الرغم من أن الركام أصبح أكبر ، إلا أنه أصبح مضغوطا للغاية ولا يمكن فصله بشكل صحيح للحفظ بالتبريد أو إعادة الطلاء. على الرغم من التقدم في نهج ثقافة 3D ، لا تزال الثقافات العصبية 2D الملتصقة هي المعيار الذهبي للتحليلات الوظيفية مثل صفائف الأقطاب الكهربائية الدقيقة أو تصوير الكالسيوم. وبالتالي فإن تفرد الخلايا هو شرط أساسي مهم لشبكة أحادية الطبقة العصبية وعصبية موزعة بشكل متجانس. يمكن استخدام انفصال ميكانيكي أقوى للخلايا أو كواشف تفكك قاسية لضمان التفرد ، ولكن مع تأثيرات محتملة على صلاحية الخلية ، وعلم وظائف الأعضاء ، وقدرة إعادة التعلق47،48. فيما يتعلق بالحاجة إلى خلايا مفردة لمزيد من التحليلات والنضج ، تم فصل المجاميع بعد 4 أيام من التعليق ، وتم حفظ الخلايا العصبية iNGN2 (اليوم 2) بالتبريد. أكد تمايز وتوصيف الخلايا العصبية iNGN2 بعد ذوبان الجليد نضجا متزايدا للمزارع العصبية وتشكيل شبكة عصبية كثيفة.
ينتج عن البروتوكول المقدم عددا كبيرا من الخلايا العصبية iNGN2. ومع ذلك ، يجب النظر في العديد من القيود. أما بالنسبة لمعظم منصات ثقافة التعليق ، فإن نقل hiPSCs من ثقافة ملتصقة 2D إلى بيئة 3D أمر بالغ الأهمية وغالبا ما يرتبط بفقدان عميق للخلايا. ومن المتوقع حدوث المزيد من الخسائر الكبيرة في الخلايا والخسائر الإجمالية أثناء التغييرات في الوسائط. بالمقارنة مع المنصات الآلية ، يتم زيادة وقت المناولة ومخاطر التلوث باستخدام المفاعل الحيوي الموضوعة على الطاولة ، حيث يجب إجراء تغييرات متوسطة يدويا. بصرف النظر عن الافتقار إلى الأتمتة ، لا يوفر المفاعل الحيوي الموضوعة على الطاولة إمكانية مراقبة العناصر الغذائية ، كما أن السعة القصوى البالغة 50 مل لكل أنبوب تحد من إمكانات ترقية البروتوكول. أخيرا ، من المهم ملاحظة أنه على الرغم من أن NGN2 يسرع الالتزام بالنسب العصبي ، إلا أن مدة النضج النهائي لا يتم تقصيرها ولا تزال تتطلب زراعة طويلة الأجل على مدار عدة أسابيع. نظرا لأهمية الدعم النجمي للوظيفة العصبية والتعلق والبقاء على قيد الحياة49،50،51 ، يجب النظر في مناهج الثقافة المشتركة ، وقد تكون ضرورية للزراعة على المدى الطويل.
باختصار ، تمت ترجمة بروتوكول التمايز ثنائي الأبعاد بنجاح إلى بيئة ثلاثية الأبعاد لتوليد سريع وقابل للتكرار من الخلايا العصبية iNGN2 من خلال تنفيذ مفاعل حيوي على الطاولة. ينتج البروتوكول الموصوف كميات كبيرة من الخلايا العصبية المشتقة من iPSC عالية الجودة ، والتي قد تكون بمثابة نقطة انطلاق لاختبار النموذج المعقد ، وفحوصات الأدوية عالية الإنتاجية ، وفحوصات السمية واسعة النطاق.
Disclosures
يعلن المؤلفون عدم وجود مصالح متنافسة.
Acknowledgements
تلقى مشروع EBiSC2 تمويلا من التعهد المشترك لمبادرة الأدوية المبتكرة 2 (JU) بموجب اتفاقية المنحة رقم 821362. تتلقى JU الدعم من برنامج البحث والابتكار Horizon 2020 التابع للاتحاد الأوروبي و EFPIA. نشكر نادين ج. سمندزيتش، وهيلين د. م. همر، وجون مجد بالسترز، وفانيسا م. ناليواجا على مساعدتهم في تحليل المناعة الكيميائية والتعبير الجيني، وكذلك هايكه أرثين على دعمها الفني الممتاز. علاوة على ذلك ، نشكر ستيفاني بور على إنشاء برنامج المفاعل الحيوي. تم إنشاء الشكل 2A باستخدام BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol 50 mM | Gibco | 11528926 | |
| 60 mm Nunclon Delta Surface | Nunc | 734-2040 | |
| Anti-beta III Tubulin antibody [TU-20] (dilution 1:1,000) | Abcam | ab7751 | |
| Applied Biosystems High-Capacity cDNA Reverse Transcription Kit | Thermo Fisher Scientific | 10400745 | |
| B-27 Supplement (50x) | Gibco | 11530536 | serum-free Supplement (50x) |
| BIONi010-C-13 hiPSC line | European Bank for induced pluripotent Stem Cell (EBiSC), BIONEER as Depositor | SAMEA103988285 | Bioneer is depositor in EBiSC and owner of the hiPSC line. |
| Biorender | Biorender.com | ||
| BSA Cell Culture grade | Thermo Fisher Scientific | 12330023 | |
| CERO 3D Incubator & Bioreactor | OLS OMNI Life Science | 2800000 | |
| CEROtubes Cell culture Tubes 50 mL | OLS OMNI Life Science | 2800005 | |
| Citavi 6 | Swiss Academic Software | ||
| CryoStor CS10 | Stemcell | 7930 | freezing medium containing 10% DMSO |
| Cytofix Fixation Solution | BD Biosciences | 554655 | fixation solution containing 4% paraformaldehyde |
| DAPI (NUCBLUE FIXED CELL STAIN) | Thermo Fisher Scientific | 12333553 | |
| Doxycycline hydrochloride (DOX) | Sigma-Aldrich | D3447 | |
| DPBS without Calcium and Magnesium (DPBS -/-) | Gibco | 14190250 | |
| DPBS with Calcium and Magnesium (DPBS +/+) | Gibco | 11580456 | |
| DMEM/F12 (-/-) | Gibco | 21331-020 | |
| DMEM/F-12, GlutaMAX Supplement | Gibco | 31331-028 | |
| EVOS XL Core Cell Imaging System | Thermo Fisher Scientific | ||
| Goat anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Thermo Fisher Scientific | A21424 | |
| GlutaMAX supplement | Gibco | 35050-038 | stabilized L-alanyl-L-glutamine dipeptid |
| ImageJ 1.51v | National Institute of Health | ||
| Insulin solution human | Sigma-Aldrich | I9278l | |
| Laminin | Merck | L2020 | |
| MACSQuant Analyzer | Miltenyi | ||
| MAP2 Monoclonal Antibody (dilution 1: 300) | Thermo Fisher Scientific | 13-1500 | |
| Matrigel Growth factor reduced, phenol-red free | Corning Life Science | 356231 | basement membrane matrix |
| MEM Non-Essential Amino Acids Solution (100x) | Gibco | 11140035 | |
| MicroAmp Optical Adhesive Film Kit | Thermo Fisher Scientific | 10095714 | |
| mTeSR1 | Stemcell | 85850 | feeder-free iPSC maintenance medium |
| N-2 Supplement (100x) | Gibco | 17502-048 | serum-free Supplement based on Bottenstein’s N-1 formulation |
| Neurobasal Medium | Gibco | 11570556 | |
| Nikon Eclipse TS2 | Nikon Instruments Europe B.V. | ||
| NucleoCounter-NC200 | ChemoMetec A/S | ||
| Origin 2021 | OriginLab | ||
| Penicillin-Streptomycin | Gibco | 11548876 | |
| Perm/Wash Buffer | BD Biosciences | 554723 | |
| Primer assay TUBB3(Hs00801390_s1) | Thermo Fisher Scientific | 11620099 | |
| Primer assay GAPDH (Hs99999905_m1) | Thermo Fisher Scientific | 11620099 | |
| Primer assay GUSB (Hs99999908_m1) | Thermo Fisher Scientific | 11620099 | |
| Primer assay HPRT1 (Hs99999909_m1) | Thermo Fisher Scientific | 11620099 | |
| Primer assay MAP2 (Hs00258900_m1) | Thermo Fisher Scientific | 11620099 | |
| Primer assay MAPT (Hs00902194_m1) | Thermo Fisher Scientific | 11620099 | |
| Primer assay POU5F1 (Hs04260367_gH) | Thermo Fisher Scientific | 11620099 | |
| Poly-L-ornithine 0.01% | Merck | P4957 | |
| RNeasy Plus Micro Kit (50)-Kit | Qiagen | 74034 | column-based RNA isolation kit |
| RLT Buffer | Qiagen | 79216 | cell lysis buffer |
| Sodium Pyruvat (100 mM) | Gibco | 12539059 | |
| StemPro Accutase | Gibco | 11599686 | cell dissociation enzyme |
| TAQMAN FAST ADVANCED MASTER MIX | Thermo Fisher Scientific | 11380912 | qPCR master mix |
| Triton-X-100 | Sigma-Aldrich | T8787 | |
| TrypLE Select Enzym | Gibco | 12563-011 | Trypsin-EDTA solution |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific | AM9260G | |
| Via1-Cassette | ChemoMetec A/S | 941-0012 | |
| Wide Bore Filtered Pipette Tips | Thermo Fisher Scientific | 10088880 | |
| X20 OPTICAL 96WELL FAST CLEAR REACTION PLATES | Thermo Fisher Scientific | 15206343 | |
| Y-27632 dihydrochloride, Rho kinase inhibitor (ROCK inhibitor) | Abcam | ab120129 |
References
- Feigin, V. L., et al. The global burden of neurological disorders: translating evidence into policy. The Lancet. Neurology. 19 (3), 255-265 (2020).
- Olesen, J., Gustavsson, A., Svensson, M., Wittchen, H. -. U., Jönsson, B. The economic cost of brain disorders in Europe. European Journal of Neurology. 19 (1), 155-162 (2012).
- Preclinical Development: The Safety Hurdle Prior to Human Trials. American Pharmaceutical Review Available from: https://www.americanpharmaceuticalreview.com/Featured-Articles/187349-Preclinical-Development-The-Safety-Hurdle-Prior-to-Human-Trials (2016)
- van Norman, G. A. Phase II trials in drug development and adaptive trial design. JACC. Basic to Translational Science. 4 (3), 428-437 (2019).
- van Norman, G. A. Limitations of animal studies for predicting toxicity in clinical trials: part 2: potential alternatives to the use of animals in preclinical trials. JACC. Basic to Translational Science. 5 (4), 387-397 (2020).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Shi, Y., Kirwan, P., Livesey, F. J. Directed differentiation of human pluripotent stem cells to cerebral cortex neurons and neural networks. Nature Protocols. 7 (10), 1836-1846 (2012).
- Reinhardt, P., et al. Derivation and expansion using only small molecules of human neural progenitors for neurodegenerative disease modeling. PloS One. 8 (3), 59252 (2013).
- Hulme, A. J., Maksour, S., St-Clair Glover, M., Miellet, S., Dottori, M. Making neurons, made easy: the use of Neurogenin-2 in neuronal differentiation. Stem Cell Reports. 17 (1), 14-34 (2022).
- Zhang, Y., et al. Rapid single-step induction of functional neurons from human pluripotent stem cells. Neuron. 78 (5), 785-798 (2013).
- Schmid, B., et al. Generation of two gene edited iPSC-lines carrying a DOX-inducible NGN2 expression cassette with and without GFP in the AAVS1 locus. Stem Cell Research. 52, 102240 (2021).
- Shih, P. -. Y., et al. Development of a fully human assay combining NGN2-inducible neurons co-cultured with iPSC-derived astrocytes amenable for electrophysiological studies. Stem Cell Research. 54, 102386 (2021).
- Chang, C. -. Y., et al. Induced pluripotent stem cell (iPSC)-based neurodegenerative disease models for phenotype recapitulation and drug screening. Molecules. 25 (8), 2000 (2000).
- Silva, M. C., Haggarty, S. J. Human pluripotent stem cell-derived models and drug screening in CNS precision medicine. Annals of the New York Academy of Sciences. 1471 (1), 18-56 (2020).
- Elanzew, A., Sommer, A., Pusch-Klein, A., Brüstle, O., Haupt, S. A reproducible and versatile system for the dynamic expansion of human pluripotent stem cells in suspension. Biotechnology Journal. 10 (10), 1589-1599 (2015).
- Davis, B. M., Loghin, E. R., Conway, K. R., Zhang, X. Automated closed-system expansion of pluripotent stem cell aggregates in a rocking-motion bioreactor. SLAS Technology. 23 (4), 364-373 (2018).
- Kropp, C., et al. Impact of feeding strategies on the scalable expansion of human pluripotent stem cells in single-use stirred tank bioreactors. Stem Cells Translational Medicine. 5 (10), 1289-1301 (2016).
- Borys, B. S., et al. Overcoming bioprocess bottlenecks in the large-scale expansion of high-quality hiPSC aggregates in vertical-wheel stirred suspension bioreactors. Stem Cell Research & Therapy. 12 (1), 55 (2021).
- Kwok, C. K., et al. Scalable expansion of iPSC and their derivatives across multiple lineages. Reproductive Toxicology. 112, 23-35 (2022).
- User Protocol for Human induced Pluripotent Stem Cells. EBiSC Available from: https://ebisc.org/docs/ebisc/EBiSC_User_Protocol_for_Human_induced_Pluripotent_Stem_Cells.pdf (2023)
- Neyrinck, K., et al. SOX9-induced generation of functional astrocytes supporting neuronal maturation in an all-human system. Stem Cell Reviews and Reports. 17 (5), 1855-1873 (2021).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Griffith, L. G., Swartz, M. A. Capturing complex 3D tissue physiology in vitro. Nature Reviews. Molecular Cell Biology. 7 (3), 211-224 (2006).
- Burdick, J. A., Vunjak-Novakovic, G. Engineered microenvironments for controlled stem cell differentiation. Tissue Engineering. Part A. 15 (2), 205-219 (2009).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension: how 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125, 3015-3024 (2012).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266-277 (2017).
- Haycock, J. W. 3D cell culture: a review of current approaches and techniques. Methods in Molecular Biology. 695, 1-15 (2011).
- Sen, A., Kallos, M. S., Behie, L. A. Effects of hydrodynamics on cultures of mammalian neural stem cell aggregates in suspension bioreactors. Industrial and Engineering Chemical Research. 40 (23), 5350-5357 (2001).
- Gerecht-Nir, S., Cohen, S., Itskovitz-Eldor, J. Bioreactor cultivation enhances the efficiency of human embryoid body (hEB) formation and differentiation. Biotechnology and Bioengineering. 86 (5), 493-502 (2004).
- Zhao, F., et al. Effects of oxygen transport on 3-d human mesenchymal stem cell metabolic activity in perfusion and static cultures: experiments and mathematical model. Biotechnology Progress. 21 (4), 1269-1280 (2005).
- Cimetta, E., Figallo, E., Cannizzaro, C., Elvassore, N., Vunjak-Novakovic, G. Micro-bioreactor arrays for controlling cellular environments: design principles for human embryonic stem cell applications. Methods. 47 (2), 81-89 (2009).
- Kehoe, D. E., Jing, D., Lock, L. T., Tzanakakis, E. S. Scalable stirred-suspension bioreactor culture of human pluripotent stem cells. Tissue Engineering. Part A. 16 (2), 405-421 (2010).
- Sargent, C. Y., et al. Hydrodynamic modulation of embryonic stem cell differentiation by rotary orbital suspension culture. Biotechnology and Bioengineering. 105 (3), 611-626 (2010).
- Liu, N., Zang, R., Yang, S. -. T., Li, Y. Stem cell engineering in bioreactors for large-scale bioprocessing. Engineering in Life Sciences. 14 (1), 4-15 (2014).
- Wolfe, R. P., Leleux, J., Nerem, R. M., Ahsan, T. Effects of shear stress on germ lineage specification of embryonic stem cells. Integrative Biology: Quantitative Biosciences from Nano to Macro. 4 (10), 1263-1273 (2012).
- Wolfe, R. P., Ahsan, T. Shear stress during early embryonic stem cell differentiation promotes hematopoietic and endothelial phenotypes. Biotechnology and Bioengineering. 110 (4), 1231-1242 (2013).
- Shafa, M., et al. Impact of stirred suspension bioreactor culture on the differentiation of murine embryonic stem cells into cardiomyocytes. BMC Cell Biology. 12 (1), 53 (2011).
- Kwok, C. K., et al. Scalable stirred suspension culture for the generation of billions of human induced pluripotent stem cells using single-use bioreactors. Journal of Tissue Engineering and Regenerative Medicine. 12 (2), 1076-1087 (2018).
- Rodrigues, C. A. V., et al. Scalable culture of human induced pluripotent cells on microcarriers under xeno-free conditions using single-use vertical-wheel™ bioreactors. Journal of Chemical Technology & Biotechnology. 93 (12), 3597-3606 (2018).
- Gilbertson, J. A., Sen, A., Behie, L. A., Kallos, M. S. Scaled-up production of mammalian neural precursor cell aggregates in computer-controlled suspension bioreactors. Biotechnology and Bioengineering. 94 (4), 783-792 (2006).
- Baghbaderani, B. A., et al. Expansion of human neural precursor cells in large-scale bioreactors for the treatment of neurodegenerative disorders. Biotechnology Progress. 24 (4), 859-870 (2008).
- Baghbaderani, B. A., et al. Bioreactor expansion of human neural precursor cells in serum-free media retains neurogenic potential. Biotechnology and Bioengineering. 105 (4), 823-833 (2010).
- Serra, M., Brito, C., Costa, E. M., Sousa, M. F. Q., Alves, P. M. Integrating human stem cell expansion and neuronal differentiation in bioreactors. BMC Biotechnology. , 82 (2009).
- Zhao, S., et al. Generation of cortical neurons through large-scale expanding neuroepithelial stem cell from human pluripotent stem cells. Stem Cell Research & Therapy. 11 (1), 431 (2020).
- Pawlowski, M., et al. Inducible and deterministic forward programming of human pluripotent stem cells into neurons, skeletal myocytes, and oligodendrocytes. Stem Cell Reports. 8 (4), 803-812 (2017).
- Bajpai, R., Lesperance, J., Kim, M., Terskikh, A. V. Efficient propagation of single cells Accutase-dissociated human embryonic stem cells. Molecular Reproduction and Development. 75 (5), 818-827 (2008).
- Jager, L. D., et al. Effect of enzymatic and mechanical methods of dissociation on neural progenitor cells derived from induced pluripotent stem cells. Advances in Medical Sciences. 61 (1), 78-84 (2016).
- Allen, N. J. Astrocyte regulation of synaptic behavior. Annual Review of Cell and Developmental Biology. 30, 439-463 (2014).
- Verkhratsky, A., Nedergaard, M., Hertz, L. Why are astrocytes important. Neurochemical Research. 40 (2), 389-401 (2015).
- Jäkel, S., Dimou, L. Glial cells and their function in the adult brain: a journey through the history of their ablation. Frontiers in Cellular Neuroscience. 11, 24 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved