Method Article
在三维悬浮生物反应器中产生人神经原蛋白2诱导神经元
摘要
本文描述了在台式 3D 悬浮生物反应器中生成人类诱导多能干细胞衍生神经元的协议。
摘要
从人类诱导的多能干细胞(hiPSCs)衍生神经元谱系细胞标志着大脑研究的一个里程碑。自首次出现以来,实验方案一直在不断优化,现在广泛用于研究和药物开发。然而,这些传统分化和成熟方案的持续时间很长,对高质量hiPSC及其神经衍生物的需求不断增加,因此需要将这些方案采用、优化和标准化到大规模生产。这项工作提供了一种快速有效的方案,用于使用台式三维(3D)悬浮生物反应器将表达强力霉素的神经原蛋白2(iNGN2)表达hiPSCs分化为神经元。
简而言之,允许iNGN2-hiPSCs的单细胞悬液在24小时内形成聚集体,并通过添加多西环素诱导神经元谱系承诺。诱导2天后解离聚集体,细胞冷冻保存或重新铺板以终末成熟。生成的iNGN2神经元在早期表达经典神经元标志物,并在重铺后1周内形成复杂的神经炎网络,表明神经元培养物的成熟度不断提高。总之,提供了在3D环境中快速生成hiPSC衍生神经元的详细分步方案,该方案作为疾病建模,表型高通量药物筛选和大规模毒性测试的起点具有巨大潜力。
引言
神经系统疾病是全世界残疾的主要原因1.六分之一的人受到影响,发病率继续上升。社会及其保健系统的相关财政负担是巨大的。2010年对30个欧洲国家的评估估计,每年与精神和神经疾病有关的费用为8000亿欧元2.不断增加的社会经济负担需要有效的治疗策略,尽管我们对疾病病理生理学的理解大幅增加,但转化为临床往往不足。一般来说,只有12%的药物进入临床试验,其中超过80%的药物在后期失败,主要是由于无效或意外毒性3,4。原因多种多样,但从临床前阶段的动物试验到人体试验的有限可转移性越来越突出5。人类体外细胞和组织模型可以弥合种间翻译的空白,人类诱导多能干细胞(hiPSC)技术的进步在这方面具有巨大的潜力。hiPSCs广泛用于基础研究,并与胚胎干细胞(hESCs)共享基本特征,例如几乎无限的自我更新能力和分化为所有三个胚层的能力6,同时规避与胚胎破坏相关的伦理问题。
从hESCs和后来的hiPSCs衍生神经元细胞标志着大脑研究的一个里程碑。最初的分化方案基于应用模拟胚胎发生过程中关键步骤的生长因子,其中大多数涉及悬浮或贴壁培养物中的双重SMAD抑制7,8,9。成熟的神经元已经成功生成,但这些方案的几个缺点仍然阻碍了它们在药物开发中的广泛使用,例如生成的神经元的低产量和高批次间变异性,以及与长培养时间相关的大量工作量。通过强制表达与神经发生密切相关的转录因子已经取得了改善,神经生殖蛋白(NGN)家族的成员,特别是NGN2,已被确定为有效的驱动因素10。在hiPSCs中,NGN2的慢端介导异位表达显着加速了神经元分化的早期阶段,并在短短1周内诱导神经元细胞命运11。随后在与星形胶质细胞共培养中的终末成熟产生了具有可重复特性的高纯度和高数量的功能性神经元。然后应用腺相关病毒整合位点 1 (AAVS1) 安全港位点的定点基因编辑,以创建具有稳定且多西环素诱导的表达盒的 hiPSC 系,用于 NGN212,13,从而最大限度地减少慢病毒递送的不良副作用。
强力霉素诱导的神经原蛋白2(iNGN2)神经元的稳健高效分化在高通量表型药物筛选和毒性测定方面具有巨大潜力10,14,15;在过去十年中,生物工艺取得了实质性进展,实施了生物反应器以实现可扩展的细胞扩增和分化16,17,18,19。然而,大多数分化方案都针对贴壁培养进行了优化,并且转化为三维(3D)环境通常需要必要的修改。最近,据报道,成功使用具有降低剪切应力特征的台式3D生物反应器来扩增hiPSCs并可重复分化为肝细胞,心肌细胞和神经元20。在这里,使用相同的台式3D生物反应器提供了用于生成和表征iNGN2神经元的详细协议。
研究方案
注意:所有细胞操作以及培养皿和培养基制剂应在无菌条件下进行。层流罩应在使用前和加工后用70%乙醇擦拭所有表面彻底清洁。所描述的协议针对CERO 3D培养箱和生物反应器(在下文中称为台式生物反应器)中的神经元分化进行了优化。该台式生物反应器提供四个用于专用生物反应器管的插槽,每个插槽的最大容量为 50 mL。连续控制温度和CO2 水平,并独立调节每个试管的培养参数(例如,转速和时间)。除非另有说明,则所有抽吸步骤均使用吸液管和真空泵进行。
1. hiPSC的培养和扩增
注意:本协议中使用工程多西环素诱导的NGN2 hiPSC系BIONi010-C-13。此处提供的扩增方案针对 6 cm 培养皿进行了优化,但如果愿意,可以使用替代培养形式。
- 用基底膜基质涂覆6厘米培养皿,在冷Dulbecco的改良鹰培养基(DMEM)/ F12(-/-)中稀释,最终浓度为0.083mg / mL / 10cm2。将包衣培养皿在37°C孵育至少30分钟。
注意:制备基底膜基质溶液的详细方案可以在制造商的说明中找到。hiPSCs可以在替代的细胞外基质上培养以进行扩增。 - 根据EBiSC细胞系用户协议21 在无饲养层iPSC维持培养基+ 10μM ROCK抑制剂(Y-27632)中解冻冷冻保存的hiPSC。建议接种密度为每60 mm培养皿1×106 个活细胞。
- 第二天将培养基更换为不含ROCK抑制剂的无饲养层iPSC维持培养基,并每天更换培养基。
- 当hiPSC培养物达到60%-80%的汇合度时开始传代。检查不同的区域,如果面积超过5%,请手动清洁菌落。
注意:未分化的hiPSC表现为圆形细胞,具有突出的核仁和较少的细胞质。扁平且紧密堆积的菌落在解冻或传代后早期形成。hiPSC培养物的示例明场图像如图 1所示。更多信息在EBiSC细胞系用户协议21中提供。对于传代,准备基底膜基质包被的培养皿和无饲养层的iPSC维持培养基。 - 从hiPSC培养物中吸出培养基,并在不含Ca 2+和Mg2+的1x Dulbecco磷酸盐缓冲盐水(DPBS)中用0.5mM乙二胺四乙酸(EDTA)冲洗细胞2x(DPS [-/-],参见材料表)。
- 取出上清液,在 1x DPBS (-/-) 中加入 2 mL 0.5 mM EDTA 到 6 cm 培养皿中。将细胞在37°C下在培养箱中孵育3分钟。
- 吸出 1.5 mL EDTA 溶液并继续孵育 3-5 分钟。
- 轻轻敲击培养皿以促进细胞分离。
注:通过目视评估检查脱离。hiPSC 菌落应在 5 分钟后开始分离,但对于融合度较高的 hiPSC 培养物,可能需要更长的孵育时间。如果菌落不分离,则将孵育时间增加到10分钟,但不要超过此时间范围。 - 将 5 mL 无饲养层 iPSC 维持培养基加入 6 cm 培养皿中,并用 10 mL 血清移液管或使用宽口径移液器吸头轻轻重悬菌落 2 倍。将细胞转移到 15 mL 管中。
注意:hiPSC对机械应力高度敏感;因此,应避免多次重悬。最终细胞悬液应由小的菌落片段(50-200μm)组成。 - 从包被的培养皿中吸出上清液,每 6 cm 培养皿制备 4 mL 无饲养层 iPSC 维持培养基。
- 将小菌落片段以1:10至1:40的分流比转移到新鲜制备的培养皿中,并在37°C和5%CO2 下培养,每天更换培养基。
注意:小菌落应在传代后 1 或 2 小时内附着。
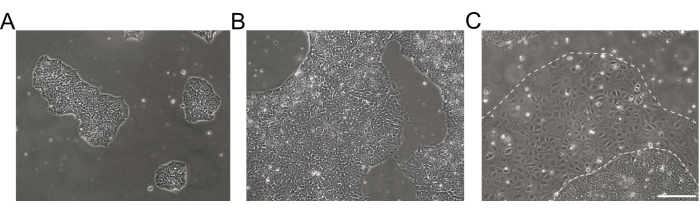
图1:人诱导多能干细胞培养物的形态 。 (A,B)不同汇合度的高质量hiPSC培养物显示出具有均匀形态和明确边缘的致密hiPSC集落。(C)hiPSC培养,菌落边缘周围出现分化细胞簇(白虚线)。比例尺 = 200 μm。缩写:hiPSC = 人诱导多能干细胞。 请点击此处查看此图的大图。
2. 在台式生物反应器系统中预培养 hiPSC(第 2 天)
注意:当hiPSC培养物达到60%至80%之间的汇合度时,开始预培养。检查hiPSC菌落是否有不同的区域。在此预培养阶段,将hiPSC在无饲养层iPSC维持培养基中维持2天。
- 制备培养基,由无饲养层iPSC维持培养基和10μM ROCK抑制剂(Y-27632)组成。
- 从 hiPSC 中完全吸出培养基,并用 1x DPBS (-/-) 轻轻冲洗细胞两次。
- 向6cm培养皿中加入2.0mL预热的胰蛋白酶-EDTA溶液,并在培养箱中于37°C孵育细胞3分钟。
- 轻轻敲击培养皿以促进细胞分离,或孵育 1-2 分钟。
- 将细胞重悬于每培养皿 5 mL 无饲养层的 iPSC 维持培养基 + ROCK 抑制剂中。将细胞悬液转移到 15 mL 或 50 mL 管中,并通过移液轻轻混合以确保细胞单一化。
- 如前所述,使用自动细胞计数器确定 100 μL 细胞悬液中的细胞数20。将每个生物反应器管中 15 × 106 个细胞的相应体积转移到 50 mL 管中。
- 将细胞以300× g 离心3分钟。
- 吸出上清液并将细胞重悬于 2 mL 无饲养层的 iPSC 维持培养基 + ROCK 抑制剂中。
- 用 18 mL 培养基填充每个 50 mL 管(细胞接种密度为 0.75 × 106 个细胞/mL)。将细胞悬液分配到生物反应器管中(每管 20 mL)。
- 将管子放入生物反应器系统。设置以下培养参数:2 秒旋转周期,60 rpm 旋转速度,无搅拌暂停,37 °C 和 5% CO2 无限期20.
- 通过生物反应器显示屏 启动 培养程序。
- 第二天更换介质。让聚集体在生物反应器管中沉淀~5分钟。小心吸出上清液。
注意:不要让聚集体稳定超过 10 分钟,因为它们可能会相互粘附并形成异质聚集悬浮液。建议在生物反应器管中留下~5mL培养基。 - 每管加入 15 mL 不含 ROCK 抑制剂的新鲜无饲养层 iPSC 维持培养基,并在台式生物反应器中继续培养 24 小时。
3. hiPSC 分化为早期神经元(第 0 天)
- 制备神经基础培养基 (NBM):50% DMEM/F-12 与稳定的 L-丙氨酰-L-谷氨酰胺二肽、50% 神经基础培养基、0.5x 无血清补充剂 (50x)、基于 Bottenstein N-1 配方的 0.5x 无血清补充剂 (100x)、0.5x 稳定的 L-丙氨酰-L-谷氨酰胺二肽、0.5x MEM 非必需氨基酸溶液 (100x)、500 nM 丙酮酸钠 (100 mM)、50 nM 2-巯基乙醇 (50 mM)、0.025% 人胰岛素溶液和 5 U/mL 青霉素-链霉素。
注意:NBM必须储存在4°C,最多可以使用2周。 - 通过在 hiPSC 培养物中添加多西环素 (DOX) 来开始神经元分化。为此,让聚集体在生物反应器管中沉淀下来。小心地从细胞中吸出上清液,在管中留下~5mL,并加入由NBM和2μg/ mL DOX组成的35mL神经诱导培养基(NIM)。
注意:由于DOX对光敏感,建议在工作时关闭灯。 - 将试管放回台式生物反应器中并继续培养。
- 每天执行介质更换,持续 2 天,如步骤 3.2 中所述。
注意:悬浮培养4天后,可以解离聚集体,并将早期神经元冷冻保存或直接重新铺板以进行终末成熟。
4. 早期神经元的冷冻保存(第 2 天)
注意:冷冻保存不是必需的,对分化过程并不重要,但强烈建议使用,因为可以产生和储存大量早期神经元,以供随后的成熟和分析。
- 让聚集体在生物反应器管中沉淀下来。如前所述吸出上清液。
- 将聚集体转移到无菌的 15 mL 或 50 mL 管中,并用 1x DPBS (-/-) 轻轻冲洗聚集体 2 倍。尽可能小心地吸出上清液,不要干扰聚集体。
- 根据沉淀大小,加入2-5mL预热的细胞解离酶,并将细胞在37°C的水浴中孵育约10分钟。每2分钟轻轻重悬沉淀的聚集体,直到聚集体解离。
注意:孵育7-10分钟后应获得几乎均匀的细胞悬液。 - 加入三倍体积的预热NBM培养基,并小心地重悬细胞以确保细胞单一化。
- 确定细胞数量并将相应的体积转移到 15 mL 或 50 mL 管中以进行冷冻保存。
注意:建议细胞密度为5-10×106 个细胞/ mL冷冻培养基。 - 将细胞以300 ×g 离心3分钟。
- 吸出上清液并将细胞沉淀轻轻重悬于含有10%二甲基亚砜(DMSO)的相应体积的冷冻培养基中。
- 将细胞悬液分装在合适的小瓶中进行冷冻保存(1 mL/小瓶)。
- 立即将小瓶转移到装有2-丙醇的预冷慢速冷冻容器中,并将容器置于-80°C过夜。第二天将小瓶置于-150°C进行长期储存。
注意:液体2-丙醇是高度易燃的,接触时可能会造成眼睛损伤。远离热源,戴防护手套和眼镜。
5. hiPSC衍生神经元在单层培养物中的成熟
- 制备聚-L-鸟氨酸/层粘连蛋白包被的培养皿,用于长期培养hiPSC衍生的神经元。
- 将聚-L-鸟氨酸储备溶液在1x DPBS(-/-)中稀释至0.001%,并在4°C下包被培养皿过夜,或在37°C下涂覆4小时。 吸出聚-L-鸟氨酸溶液并用1x DPBS(-/-)洗涤板一次。
- 将层粘连蛋白溶液在1x DPBS(-/-)中稀释至终浓度为10μg/ mL,并将培养皿在4°C孵育过夜,或在37°C孵育4小时。
注意:对于包衣程序,建议体积为每cm 2 0.1-0.15 mL,对于所有相关洗涤步骤,建议体积为每cm2 0.2 mL。可以使用替代涂层基材,但应评估对细胞附着和成熟的潜在影响。
- 解冻冷冻保存的细胞。为此,将冷冻管置于水浴(设置为37°C)中并旋转约1分钟,直到留下一小团冷冻细胞悬液。
- 小心地将细胞悬液滴入用 10 mL 预热的 NBM 制备的 15 mL 管中。用 1 mL NBM 冲洗冷冻管,并将细胞悬液转移到相同的 15 mL 管中。
- 将细胞以300× g 离心3分钟。
- 吸出上清液并加入 1-2 mL 补充有 10 μM ROCK 抑制剂的 NIM。
- 小心重悬细胞沉淀并确定细胞数量。
- 从包被的细胞培养皿中吸出剩余的层粘连蛋白溶液,并在补充有10μM ROCK抑制剂的NIM中以1×105 个细胞/ cm2的接种密度接种细胞。
- 24小时后将培养基切换到没有ROCK抑制剂的NIM。
- 每天更换培养基 4 天。
- 在NGN2诱导的初始阶段之后,省略DOX并在NBM中培养细胞,半培养基每周更换2次,直到达到所需的成熟阶段。
注意:建议将iNGN2神经元与星形胶质细胞共培养,以提高细胞存活率,附着,成熟度和电活性13,22。
6. hiPSC衍生神经元的表征
注意:可以通过以下技术评估神经元衍生物的分化。
- 免疫细胞化学和成像
- 从hiPSC衍生的神经元中吸出培养基,并用含有Ca 2+和Mg2+(+/+)的1x DPBS洗涤细胞一次。
注意:小心移液,优先在孔边缘,因为细胞可能很容易从表面上分离。建议所有洗涤步骤的体积为 0.2 mL/cm 2 ,以确保 1x DPBS (+/+) 完全覆盖细胞。 - 在室温(RT)下,使用含有DPBS (+/ +)中4%多聚甲醛的固定溶液固定神经元细胞15分钟。建议体积为 0.1 mL/cm2 。
注意:DPBS中的多聚甲醛(4%)是一种危险的皮肤刺激性溶液,具有急性毒性和潜在的致癌性。远离热源,戴防护手套和眼镜,避免吸入,仅在通风环境中使用溶液。 - 在 1x DPBS (+/+) 中轻轻冲洗细胞 2 次,然后继续染色。
注意:固定细胞可以在4°C的DPBS(+/+)中储存长达1个月,直到进一步处理。 - 从样品中吸出DPBS (+/+)。透化细胞并用含有1%BSA和0.2%Triton-X-100的1x DPBS (+/ +)阻断非特异性结合位点,在室温下60分钟。
注意:建议体积为每厘米 20.2 mL。 - 除去上清液并将细胞在4°C孵育过夜,将相应的一抗稀释在染色缓冲液(含有1%BSA的1x DPBS [+ / +])中(参见 材料表)。确保细胞完全被溶液覆盖。
注意:建议体积为每cm2 0.1-0.15 mL。 - 吸出染色缓冲液并在 1x DPBS (+/+) 中冲洗细胞 3 次。
- 在染色缓冲液中以1:1,000的终浓度稀释相应的二抗(参见 材料表)。
- 将细胞在稀释的抗体溶液中在室温下在黑暗中孵育1小时。确保细胞完全被溶液覆盖。
注意:建议体积为每cm2 0.1-0.15 mL。 - 吸出二抗溶液,并在 1x DPBS (+/+) 中冲洗细胞 2 次。
- 用4',6-二脒基-2-苯基吲哚(DAPI)复染细胞核,在室温下用DPBS(+/+)稀释5分钟。
注意:建议工作体积为每cm2 0.1-0.15 mL。 - 在 1x DPBS (+/+) 中冲洗细胞 2 次。
- 将细胞储存在4°C的DPBS(+/ +)中直至成像。
注意:明场成像适用于跟踪形态变化和神经突生长。此外,刻板型标志物的表达可以通过荧光显微镜进行评估。虽然未分化的hiPSC表达OCT 3/4和NANOG,但β-III-微管蛋白(TUBB3)和微管相关蛋白2(MAP2)可作为可视化神经突和轴突的神经元标志物。可以通过确定明场或荧光图像中的神经突长度来进一步评估神经炎网络。
- 从hiPSC衍生的神经元中吸出培养基,并用含有Ca 2+和Mg2+(+/+)的1x DPBS洗涤细胞一次。
- 通过定量实时聚合酶链反应 (qPCR) 进行基因表达分析
- 吸出培养基并在1x DPBS(-/-)中冲洗细胞一次。
注意:建议体积为每厘米 20.2 mL。 - 加入冷RNA裂解缓冲液并通过刮擦收获细胞。
- 使用合适的基于色谱柱的试剂盒分离RNA,并通过紫外光光谱法测定RNA浓度。
- 使用 250 ng 的总 RNA 和合适的逆转录试剂盒生成 cDNA。
- 制备含有 2.5 ng cDNA 的一式两份的分子信标 qPCR 反应。使用适当的预混液和相应的引物测定20 (见 材料表)。
- 通过应用45个循环,引物在60°C下退火20秒来运行qPCR。
- 将相对基因表达水平标准化为管家基因GAPDH,HPRT1和GUSB的平均值。应用ΔΔCt方法23,使用未分化的hiPSC作为校准品。
- 吸出培养基并在1x DPBS(-/-)中冲洗细胞一次。
结果
在初始步骤中,hiPSC的贴壁培养物被分离,单相并转移到悬浮液中(图2)。聚集体在24小时内形成并不断增大。经过2天的转基因诱导,早期神经元可以冷冻保存用于后续实验。
悬浮最初几天的持续增殖导致细胞数量增加,在诱导2天后达到峰值(图3A,B)。随着扩散,聚集体开始增长。与第 0 天相比,直径在第 2 天增加了 50%,在第 5 天几乎翻了一番(图 3D)。尽管直径的增加限制了聚集体内的营养供应,但在分化的第2天或第5天,细胞的活力不会受到影响(图3C)。然而,长时间悬浮培养超过4天并不能进一步提高细胞产量,因为聚集体对酶奇异化的抵抗力越来越强(图3B)。
冷冻保存后,将第2天细胞解冻并接种到聚-L-鸟氨酸(PLO)-层粘连蛋白包被的培养皿上以进行终末成熟。一般来说,细胞在解冻后附着得很好,并在早期开始延长神经突。时间基因表达谱以及神经元标志物 TUBB3 和 MAP2 的免疫细胞化学染色证实了神经元细胞的身份(图 4A,B)。除了 TUBB3 和 MAP2 水平升高外,神经元培养物还富含微管相关蛋白 tau 转录物 (MAPT),编码参与轴突稳定的神经元蛋白,并显示伴随多能性调节转录因子 POU5F1 的表达下降。此外,在解冻后的第一周内形成致密的神经炎网络(图4C)。这些形态变化与转录谱相结合,表明神经元培养物的成熟度越来越高。
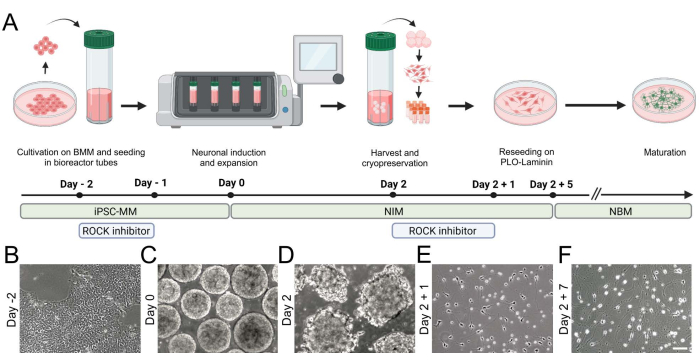
图 2:使用台式生物反应器生成 hiPSC 衍生的 iNGN2 神经元。 (A)分化范式的示意图概述,突出了细胞培养的关键步骤。(B-F)明场图像可视化了(B)hiPSC和(C,D)台式生物反应器中聚集体的形成。(E,F)iNGN2神经元在分化过程中延伸神经突并发生形态变化。比例尺 = 100 μm。缩写:BMM = 基底膜基质;iPSC-MM = iPSC 维持培养基;PLO = 聚-L-鸟氨酸。请点击此处查看此图的大图。
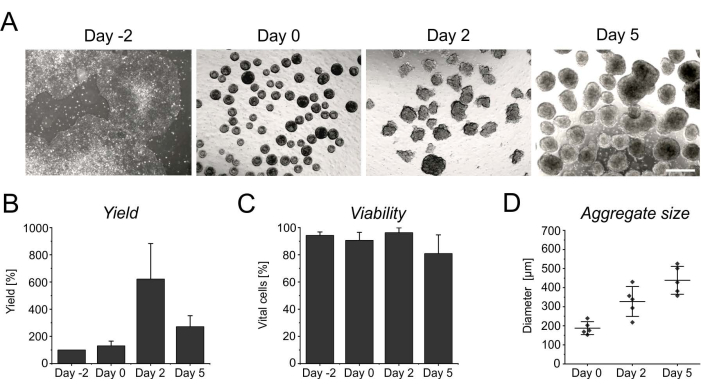
图3:聚集体形成和生长过程中的细胞产量和活力。 (A)明场图像描绘了在台式生物反应器中培养2天内聚集体的形成,以及聚集体尺寸随时间的增加。比例尺 = 500 μm。 (B)细胞产量和(C)分化过程中活力的定量。条形图表示来自四个独立实验的平均值 + SD。(D)指示骨料大小的直径是使用开源软件ImageJ(版本1.53)半自动确定的。首先,将明场图像转换为二值图像,然后使用分析粒子工具进一步评估,应用以下参数:尺寸> 2,500 μm2,圆度0.45-1,排除边缘并包括孔。水平线表示五个独立分化的平均±SD。单点表示每个时间点至少 20 个聚合的单个微分实验的平均值。请点击此处查看此图的大图。
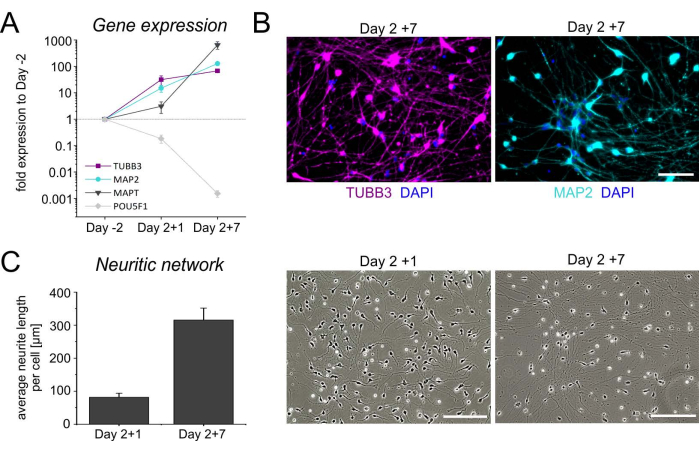
图 4:hiPSC 衍生的 iNGN2 神经元的表征。 神经元基因 TUBB3,MAP2 和 MAPT以及多能干细胞相关基因 POU5F1的时间基因表达谱。相对表达水平归一化为参考基因 GAPDH,HPRT1 和 GUSB。选择未分化的hiPSC(第2天)作为校准品。几何符号表示四个独立微分的平均±SD。(B)解冻后第7天(第2天+ 7)iNGN2神经元的代表性图像,染色β-III-微管蛋白(TUBB3,洋红色)和微管相关蛋白2(MAP2,青色)。细胞核用DAPI复染。比例尺 = 100 μm。 (C)解冻后神经元培养物明场图像中神经炎网络的评估。使用 ImageJ(版本 1.53)在 930.82 × 698.11 μm2 的区域内测定神经突的总长度。调整亮度和对比度后,将图像转换为8位图像,并将颜色反转。随后对神经突进行骨架化,然后分别使用 ImageJ 插件"骨架化"和"分析骨架"进行分析。将神经突的总长度除以感兴趣区域中的体细胞数量,以产生平均神经突长度/细胞。条形图表示三个独立实验的平均值 + SD。缩写:DAPI = 4',6-二脒基-2-苯基吲哚。 请点击此处查看此图的大图。
讨论
神经元转录因子 NGN2 的异位表达先前已被证明可以加速神经元分化的早期阶段,并在培养后 1 周内诱导 hiPSC 中的神经元谱系承诺12,13,20。这项工作描述了使用台式生物反应器将基因编辑的BIONi010-C-13 hiPSCs分化为iNGN2神经元的详细协议。
CERO 3D 生物反应器是一种小容量生物反应器,具有四个专用管槽,每个槽的最大容量为 50 mL。连续控制温度和 CO2 水平,并调节每个试管的培养参数(例如转速和时间),使用户能够独立地并行运行多种差异化方法。内管壁上的集成破波器允许以低剪切应力对介质进行扰动,并在受控旋转期间保持 3D 骨料悬浮状态。获得营养物质的有限以及强制执行的3D细胞-细胞和细胞-细胞外基质(ECM)相互作用可能会显着影响细胞分化和行为24,25,26,27。
将细胞培养为悬浮液中的3D聚集体会增加这些细胞相互作用,从而更紧密地模拟组织或器官的体内环境28。介质的伴随扰动调节了由于机械摩擦引起的聚集体尺寸,改善了气体交换,并降低了管中营养物质和废物的梯度,同时保留了聚集体内部的生理相关梯度29,30,31,32,33,34.虽然培养基更换是手动进行的,但与静态培养瓶相比,台式生物反应器降低了劳动力和运营成本。与全自动搅拌罐生物反应器相比,生物反应器还具有几个优点,因为无叶轮设计减少了聚集体表面的流体动力剪切应力,从而不仅提高了细胞存活率,而且还限制了剪切应力对敏感iPSC、细胞分化和功能的影响35,36,37,38。
垂直轮式生物反应器,其中细胞由大型垂直叶轮搅拌,以及使用连接到电动平台的充气培养袋的摇摆运动生物反应器,代表了替代的3D悬浮平台。尽管对hiPSCs17,18,19,39,40的培养进行了过度测试,但对其在神经元分化方法中的适用性知之甚少,并且报告仅限于哺乳动物和人类神经前体细胞在搅拌罐生物反应器41,42,43,44中的成功扩增,很少有研究集中在成熟度44,45。通常,自动3D悬挂平台具有全自动和计算机控制的介质更换优势,从而减少了处理中的变化并最大限度地降低了污染风险。此外,可以连续监测乳酸和葡萄糖浓度等营养参数。然而,这些系统的建立通常需要大量的初始投资、实验室空间和合格人员的培训。台式生物反应器是悬浮培养细胞的紧凑且易于使用的替代方案,但不能同时监测营养物质。
与用于在3D悬浮平台中培养细胞的大多数方案一样,聚集体的初始形成是一个关键步骤。hiPSCs以贴壁单层形式培养,随后作为单细胞悬浮液转移到3D环境中。为了在该阶段最大限度地减少细胞损失,需要考虑几个方面。带有集成破波器的试管设计意味着每个试管需要 10 mL 的最小培养体积,以确保最佳的培养基扰动。因此,从长远来看,不应削弱临界量。此外,强烈建议起始接种密度为每 10 mL 培养体积 750 万个细胞,转速为 60 rpm,以便在短期内形成稳定的聚集体,但可能需要根据细胞系进行调整。
将hiPSCs转移到悬浮液中后,应在24小时内形成聚集体。第一个中等变化至关重要,因为骨料很小,可能无法正确稳定下来。聚集体沉降的时间可以延长,但不应超过10分钟,因为聚集体可能开始结块并以非均质方式生长。在抽吸过程中,应在管中留下 5 mL 的最小培养体积,并应避免培养基的任何扰动。然而,在初始阶段,预计细胞和聚集体会丢失。细胞计数表明培养前 2 天的细胞产量恒定,表明 hiPSC 的高增殖能力补偿了初始细胞损失。一旦悬浮,温和的培养和扰动会导致均匀大小的聚集体随着时间的推移开始生长。
根据先前发表的基于多西环素诱导的NGN2过表达的方案进行神经元分化13,并且针对3D培养优化了各个步骤。神经元转录因子NGN2是神经元分化中描述良好的驱动因素,并显着加速神经元诱导11,13,46。虽然具有明确生长因子的传统模式需要数周至数月7,8,9,但NGN2表达可在几天内诱导神经元细胞命运。除了缩短培养时间外,该方案既不依赖于昂贵的生长因子,也不依赖于用于初始悬浮培养的包衣基质,从而进一步降低了培养成本。
此外,对贴壁和悬浮培养物中NGN2驱动的未成熟神经元的生成进行直接比较显示,使用台式生物反应器20培养4天后细胞增加了1.36倍,而产生100万个细胞所需的培养基体积预计将减半。因此,使用台式生物反应器生成iNGN2神经元可能是有益的,因为可以以较低的处理时间和成本生产更多数量的细胞。与之前的报告一致,神经元谱系承诺在早期就被观察到了。NGN2诱导2天后,TUBB3、MAP2和MAPT等经典神经元标志物的深刻表达明显,支持了台式生物反应器对神经元诱导的适用性。按照该协议,在培养后 4 天内可以从 100 万个 hiPSC 中获得大约 620 万个未成熟的 iNGN2 神经元。然而,产量可能因批次而异,并取决于播种时的悬浮培养量。
为了进一步提高产量,栽培时间延长了3天;然而,尽管聚集体变得更大,但它们也变得非常致密,并且不能正确解离以进行冷冻保存或重新电镀。尽管3D培养方法取得了进步,但贴壁2D神经元培养仍然是微电极阵列或钙成像等功能分析的黄金标准。因此,细胞奇异化是均匀分布的神经元单层和神经炎网络的重要先决条件。可以使用更强的细胞机械分离或苛刻的解离试剂来确保奇异化,但对细胞活力、生理和再附着能力有潜在影响47,48。关于需要单细胞进行进一步分析和成熟,聚集体在悬浮4天后解离,并且(第2天)iNGN2神经元冷冻保存。iNGN2神经元的解冻后分化和表征证实了神经元培养物的日益成熟和致密神经炎网络的形成。
所提供的协议产生大量的iNGN2神经元。但是,需要考虑一些限制。对于大多数悬浮培养平台,hiPSCs从2D贴壁培养物转移到3D环境至关重要,并且通常与严重的细胞丢失有关。在更换培养基期间,预计细胞和聚集体会进一步显著损失。与自动化平台相比,使用台式生物反应器的处理时间和污染风险增加,因为必须手动进行介质更换。除了缺乏自动化之外,台式生物反应器无法监测营养物质,并且每管 50 mL 的最大容量限制了方案的升级潜力。最后,重要的是要注意,尽管NGN2加速了神经元谱系的承诺,但终末成熟的持续时间并没有缩短,仍然需要数周的长期培养。鉴于星形胶质细胞支持对神经元功能、附着和存活的重要性49,50,51,应考虑共培养方法,甚至可能是长期培养所必需的。
总之,通过实施台式生物反应器,将2D分化方案成功转化为3D环境,以快速和可重复地生成iNGN2神经元。所描述的方案产生大量高质量的iPSC衍生神经元,可作为复杂模型测试,高通量药物筛选和大规模毒性测定的起点。
披露声明
作者声明没有竞争利益。
致谢
EBiSC2项目已根据第821362号赠款协议获得了创新药物倡议2联合企业(JU)的资助。JU得到了欧盟地平线2020研究和创新计划以及EFPIA的支持。我们感谢Nadine J. Smandzich,Helene D. M. Hemmer,Johnn-Majd Balsters和Vanessa M. Nalewaja在免疫细胞化学和基因表达分析方面的帮助,以及Heike Arthen出色的技术支持。此外,我们感谢Stephanie Bur建立生物反应器计划。 图 2A 是用 BioRender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol 50 mM | Gibco | 11528926 | |
| 60 mm Nunclon Delta Surface | Nunc | 734-2040 | |
| Anti-beta III Tubulin antibody [TU-20] (dilution 1:1,000) | Abcam | ab7751 | |
| Applied Biosystems High-Capacity cDNA Reverse Transcription Kit | Thermo Fisher Scientific | 10400745 | |
| B-27 Supplement (50x) | Gibco | 11530536 | serum-free Supplement (50x) |
| BIONi010-C-13 hiPSC line | European Bank for induced pluripotent Stem Cell (EBiSC), BIONEER as Depositor | SAMEA103988285 | Bioneer is depositor in EBiSC and owner of the hiPSC line. |
| Biorender | Biorender.com | ||
| BSA Cell Culture grade | Thermo Fisher Scientific | 12330023 | |
| CERO 3D Incubator & Bioreactor | OLS OMNI Life Science | 2800000 | |
| CEROtubes Cell culture Tubes 50 mL | OLS OMNI Life Science | 2800005 | |
| Citavi 6 | Swiss Academic Software | ||
| CryoStor CS10 | Stemcell | 7930 | freezing medium containing 10% DMSO |
| Cytofix Fixation Solution | BD Biosciences | 554655 | fixation solution containing 4% paraformaldehyde |
| DAPI (NUCBLUE FIXED CELL STAIN) | Thermo Fisher Scientific | 12333553 | |
| Doxycycline hydrochloride (DOX) | Sigma-Aldrich | D3447 | |
| DPBS without Calcium and Magnesium (DPBS -/-) | Gibco | 14190250 | |
| DPBS with Calcium and Magnesium (DPBS +/+) | Gibco | 11580456 | |
| DMEM/F12 (-/-) | Gibco | 21331-020 | |
| DMEM/F-12, GlutaMAX Supplement | Gibco | 31331-028 | |
| EVOS XL Core Cell Imaging System | Thermo Fisher Scientific | ||
| Goat anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Thermo Fisher Scientific | A21424 | |
| GlutaMAX supplement | Gibco | 35050-038 | stabilized L-alanyl-L-glutamine dipeptid |
| ImageJ 1.51v | National Institute of Health | ||
| Insulin solution human | Sigma-Aldrich | I9278l | |
| Laminin | Merck | L2020 | |
| MACSQuant Analyzer | Miltenyi | ||
| MAP2 Monoclonal Antibody (dilution 1: 300) | Thermo Fisher Scientific | 13-1500 | |
| Matrigel Growth factor reduced, phenol-red free | Corning Life Science | 356231 | basement membrane matrix |
| MEM Non-Essential Amino Acids Solution (100x) | Gibco | 11140035 | |
| MicroAmp Optical Adhesive Film Kit | Thermo Fisher Scientific | 10095714 | |
| mTeSR1 | Stemcell | 85850 | feeder-free iPSC maintenance medium |
| N-2 Supplement (100x) | Gibco | 17502-048 | serum-free Supplement based on Bottenstein’s N-1 formulation |
| Neurobasal Medium | Gibco | 11570556 | |
| Nikon Eclipse TS2 | Nikon Instruments Europe B.V. | ||
| NucleoCounter-NC200 | ChemoMetec A/S | ||
| Origin 2021 | OriginLab | ||
| Penicillin-Streptomycin | Gibco | 11548876 | |
| Perm/Wash Buffer | BD Biosciences | 554723 | |
| Primer assay TUBB3(Hs00801390_s1) | Thermo Fisher Scientific | 11620099 | |
| Primer assay GAPDH (Hs99999905_m1) | Thermo Fisher Scientific | 11620099 | |
| Primer assay GUSB (Hs99999908_m1) | Thermo Fisher Scientific | 11620099 | |
| Primer assay HPRT1 (Hs99999909_m1) | Thermo Fisher Scientific | 11620099 | |
| Primer assay MAP2 (Hs00258900_m1) | Thermo Fisher Scientific | 11620099 | |
| Primer assay MAPT (Hs00902194_m1) | Thermo Fisher Scientific | 11620099 | |
| Primer assay POU5F1 (Hs04260367_gH) | Thermo Fisher Scientific | 11620099 | |
| Poly-L-ornithine 0.01% | Merck | P4957 | |
| RNeasy Plus Micro Kit (50)-Kit | Qiagen | 74034 | column-based RNA isolation kit |
| RLT Buffer | Qiagen | 79216 | cell lysis buffer |
| Sodium Pyruvat (100 mM) | Gibco | 12539059 | |
| StemPro Accutase | Gibco | 11599686 | cell dissociation enzyme |
| TAQMAN FAST ADVANCED MASTER MIX | Thermo Fisher Scientific | 11380912 | qPCR master mix |
| Triton-X-100 | Sigma-Aldrich | T8787 | |
| TrypLE Select Enzym | Gibco | 12563-011 | Trypsin-EDTA solution |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific | AM9260G | |
| Via1-Cassette | ChemoMetec A/S | 941-0012 | |
| Wide Bore Filtered Pipette Tips | Thermo Fisher Scientific | 10088880 | |
| X20 OPTICAL 96WELL FAST CLEAR REACTION PLATES | Thermo Fisher Scientific | 15206343 | |
| Y-27632 dihydrochloride, Rho kinase inhibitor (ROCK inhibitor) | Abcam | ab120129 |
参考文献
- Feigin, V. L., et al. The global burden of neurological disorders: translating evidence into policy. The Lancet. Neurology. 19 (3), 255-265 (2020).
- Olesen, J., Gustavsson, A., Svensson, M., Wittchen, H. -. U., Jönsson, B. The economic cost of brain disorders in Europe. European Journal of Neurology. 19 (1), 155-162 (2012).
- Preclinical Development: The Safety Hurdle Prior to Human Trials. American Pharmaceutical Review Available from: https://www.americanpharmaceuticalreview.com/Featured-Articles/187349-Preclinical-Development-The-Safety-Hurdle-Prior-to-Human-Trials (2016)
- van Norman, G. A. Phase II trials in drug development and adaptive trial design. JACC. Basic to Translational Science. 4 (3), 428-437 (2019).
- van Norman, G. A. Limitations of animal studies for predicting toxicity in clinical trials: part 2: potential alternatives to the use of animals in preclinical trials. JACC. Basic to Translational Science. 5 (4), 387-397 (2020).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nature Biotechnology. 27 (3), 275-280 (2009).
- Shi, Y., Kirwan, P., Livesey, F. J. Directed differentiation of human pluripotent stem cells to cerebral cortex neurons and neural networks. Nature Protocols. 7 (10), 1836-1846 (2012).
- Reinhardt, P., et al. Derivation and expansion using only small molecules of human neural progenitors for neurodegenerative disease modeling. PloS One. 8 (3), 59252 (2013).
- Hulme, A. J., Maksour, S., St-Clair Glover, M., Miellet, S., Dottori, M. Making neurons, made easy: the use of Neurogenin-2 in neuronal differentiation. Stem Cell Reports. 17 (1), 14-34 (2022).
- Zhang, Y., et al. Rapid single-step induction of functional neurons from human pluripotent stem cells. Neuron. 78 (5), 785-798 (2013).
- Schmid, B., et al. Generation of two gene edited iPSC-lines carrying a DOX-inducible NGN2 expression cassette with and without GFP in the AAVS1 locus. Stem Cell Research. 52, 102240 (2021).
- Shih, P. -. Y., et al. Development of a fully human assay combining NGN2-inducible neurons co-cultured with iPSC-derived astrocytes amenable for electrophysiological studies. Stem Cell Research. 54, 102386 (2021).
- Chang, C. -. Y., et al. Induced pluripotent stem cell (iPSC)-based neurodegenerative disease models for phenotype recapitulation and drug screening. Molecules. 25 (8), 2000 (2000).
- Silva, M. C., Haggarty, S. J. Human pluripotent stem cell-derived models and drug screening in CNS precision medicine. Annals of the New York Academy of Sciences. 1471 (1), 18-56 (2020).
- Elanzew, A., Sommer, A., Pusch-Klein, A., Brüstle, O., Haupt, S. A reproducible and versatile system for the dynamic expansion of human pluripotent stem cells in suspension. Biotechnology Journal. 10 (10), 1589-1599 (2015).
- Davis, B. M., Loghin, E. R., Conway, K. R., Zhang, X. Automated closed-system expansion of pluripotent stem cell aggregates in a rocking-motion bioreactor. SLAS Technology. 23 (4), 364-373 (2018).
- Kropp, C., et al. Impact of feeding strategies on the scalable expansion of human pluripotent stem cells in single-use stirred tank bioreactors. Stem Cells Translational Medicine. 5 (10), 1289-1301 (2016).
- Borys, B. S., et al. Overcoming bioprocess bottlenecks in the large-scale expansion of high-quality hiPSC aggregates in vertical-wheel stirred suspension bioreactors. Stem Cell Research & Therapy. 12 (1), 55 (2021).
- Kwok, C. K., et al. Scalable expansion of iPSC and their derivatives across multiple lineages. Reproductive Toxicology. 112, 23-35 (2022).
- User Protocol for Human induced Pluripotent Stem Cells. EBiSC Available from: https://ebisc.org/docs/ebisc/EBiSC_User_Protocol_for_Human_induced_Pluripotent_Stem_Cells.pdf (2023)
- Neyrinck, K., et al. SOX9-induced generation of functional astrocytes supporting neuronal maturation in an all-human system. Stem Cell Reviews and Reports. 17 (5), 1855-1873 (2021).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Griffith, L. G., Swartz, M. A. Capturing complex 3D tissue physiology in vitro. Nature Reviews. Molecular Cell Biology. 7 (3), 211-224 (2006).
- Burdick, J. A., Vunjak-Novakovic, G. Engineered microenvironments for controlled stem cell differentiation. Tissue Engineering. Part A. 15 (2), 205-219 (2009).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension: how 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125, 3015-3024 (2012).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266-277 (2017).
- Haycock, J. W. 3D cell culture: a review of current approaches and techniques. Methods in Molecular Biology. 695, 1-15 (2011).
- Sen, A., Kallos, M. S., Behie, L. A. Effects of hydrodynamics on cultures of mammalian neural stem cell aggregates in suspension bioreactors. Industrial and Engineering Chemical Research. 40 (23), 5350-5357 (2001).
- Gerecht-Nir, S., Cohen, S., Itskovitz-Eldor, J. Bioreactor cultivation enhances the efficiency of human embryoid body (hEB) formation and differentiation. Biotechnology and Bioengineering. 86 (5), 493-502 (2004).
- Zhao, F., et al. Effects of oxygen transport on 3-d human mesenchymal stem cell metabolic activity in perfusion and static cultures: experiments and mathematical model. Biotechnology Progress. 21 (4), 1269-1280 (2005).
- Cimetta, E., Figallo, E., Cannizzaro, C., Elvassore, N., Vunjak-Novakovic, G. Micro-bioreactor arrays for controlling cellular environments: design principles for human embryonic stem cell applications. Methods. 47 (2), 81-89 (2009).
- Kehoe, D. E., Jing, D., Lock, L. T., Tzanakakis, E. S. Scalable stirred-suspension bioreactor culture of human pluripotent stem cells. Tissue Engineering. Part A. 16 (2), 405-421 (2010).
- Sargent, C. Y., et al. Hydrodynamic modulation of embryonic stem cell differentiation by rotary orbital suspension culture. Biotechnology and Bioengineering. 105 (3), 611-626 (2010).
- Liu, N., Zang, R., Yang, S. -. T., Li, Y. Stem cell engineering in bioreactors for large-scale bioprocessing. Engineering in Life Sciences. 14 (1), 4-15 (2014).
- Wolfe, R. P., Leleux, J., Nerem, R. M., Ahsan, T. Effects of shear stress on germ lineage specification of embryonic stem cells. Integrative Biology: Quantitative Biosciences from Nano to Macro. 4 (10), 1263-1273 (2012).
- Wolfe, R. P., Ahsan, T. Shear stress during early embryonic stem cell differentiation promotes hematopoietic and endothelial phenotypes. Biotechnology and Bioengineering. 110 (4), 1231-1242 (2013).
- Shafa, M., et al. Impact of stirred suspension bioreactor culture on the differentiation of murine embryonic stem cells into cardiomyocytes. BMC Cell Biology. 12 (1), 53 (2011).
- Kwok, C. K., et al. Scalable stirred suspension culture for the generation of billions of human induced pluripotent stem cells using single-use bioreactors. Journal of Tissue Engineering and Regenerative Medicine. 12 (2), 1076-1087 (2018).
- Rodrigues, C. A. V., et al. Scalable culture of human induced pluripotent cells on microcarriers under xeno-free conditions using single-use vertical-wheel™ bioreactors. Journal of Chemical Technology & Biotechnology. 93 (12), 3597-3606 (2018).
- Gilbertson, J. A., Sen, A., Behie, L. A., Kallos, M. S. Scaled-up production of mammalian neural precursor cell aggregates in computer-controlled suspension bioreactors. Biotechnology and Bioengineering. 94 (4), 783-792 (2006).
- Baghbaderani, B. A., et al. Expansion of human neural precursor cells in large-scale bioreactors for the treatment of neurodegenerative disorders. Biotechnology Progress. 24 (4), 859-870 (2008).
- Baghbaderani, B. A., et al. Bioreactor expansion of human neural precursor cells in serum-free media retains neurogenic potential. Biotechnology and Bioengineering. 105 (4), 823-833 (2010).
- Serra, M., Brito, C., Costa, E. M., Sousa, M. F. Q., Alves, P. M. Integrating human stem cell expansion and neuronal differentiation in bioreactors. BMC Biotechnology. , 82 (2009).
- Zhao, S., et al. Generation of cortical neurons through large-scale expanding neuroepithelial stem cell from human pluripotent stem cells. Stem Cell Research & Therapy. 11 (1), 431 (2020).
- Pawlowski, M., et al. Inducible and deterministic forward programming of human pluripotent stem cells into neurons, skeletal myocytes, and oligodendrocytes. Stem Cell Reports. 8 (4), 803-812 (2017).
- Bajpai, R., Lesperance, J., Kim, M., Terskikh, A. V. Efficient propagation of single cells Accutase-dissociated human embryonic stem cells. Molecular Reproduction and Development. 75 (5), 818-827 (2008).
- Jager, L. D., et al. Effect of enzymatic and mechanical methods of dissociation on neural progenitor cells derived from induced pluripotent stem cells. Advances in Medical Sciences. 61 (1), 78-84 (2016).
- Allen, N. J. Astrocyte regulation of synaptic behavior. Annual Review of Cell and Developmental Biology. 30, 439-463 (2014).
- Verkhratsky, A., Nedergaard, M., Hertz, L. Why are astrocytes important. Neurochemical Research. 40 (2), 389-401 (2015).
- Jäkel, S., Dimou, L. Glial cells and their function in the adult brain: a journey through the history of their ablation. Frontiers in Cellular Neuroscience. 11, 24 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。