A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
وضع أقطاب تحفيز خارج الجمجمة وقياس تدفق الدم الدماغي والمجالات الكهربائية داخل الجمجمة في الفئران المخدرة
In This Article
Summary
وصفنا بروتوكولا لتقييم منحنيات الاستجابة للجرعة للتحفيز خارج الجمجمة من حيث قياسات المجال الكهربائي للدماغ وتدفق الدم الدماغي ذي الصلة. نظرا لأن هذا البروتوكول يتضمن وضع قطب كهربائي غازي في الدماغ ، فهناك حاجة إلى تخدير عام ، مع تفضيل التنفس التلقائي بدلا من التنفس المتحكم فيه.
Abstract
يعد الكشف عن استجابات تدفق الدم الدماغي (CBF) لأشكال مختلفة من التنشيط العصبي أمرا بالغ الأهمية لفهم وظيفة الدماغ الديناميكية والاختلافات في إمداد الدماغ بالركيزة. تصف هذه الورقة بروتوكولا لقياس استجابات CBF لتحفيز التيار المتردد عبر الجمجمة (tACS). يتم تقدير منحنيات الاستجابة للجرعة من كل من تغير CBF الذي يحدث مع tACS (mA) ومن المجال الكهربائي داخل الجمجمة (mV / mm). نحن نقدر المجال الكهربائي داخل الجمجمة بناء على السعات المختلفة التي تقاس بواسطة الأقطاب الزجاجية الدقيقة داخل كل جانب من جوانب الدماغ. في هذه الورقة ، نصف الإعداد التجريبي ، والذي يتضمن استخدام مجسات دوبلر بالليزر الثنائية (LD) أو تصوير البقع بالليزر (LSI) لقياس CBF. نتيجة لذلك ، يتطلب هذا الإعداد تخديرا لوضع القطب واستقراره. نقدم علاقة بين استجابة CBF والتيار كدالة للعمر ، مما يدل على استجابة أكبر بكثير في التيارات الأعلى (1.5 مللي أمبير و 2.0 مللي أمبير) في الضابطة الصغيرة (12-14 أسبوعا) مقارنة بالحيوانات الأكبر سنا (28-32 أسبوعا) (p < 0.005 فرق). نظهر أيضا استجابة كبيرة ل CBF عند شدة المجال الكهربائي <5 مللي فولت / مم ، وهو اعتبار مهم للدراسات البشرية النهائية. تتأثر استجابات CBF هذه أيضا بشدة باستخدام التخدير مقارنة بالحيوانات المستيقظة ، والتحكم في التنفس (أي التنبيب مقابل التنفس التلقائي) ، والعوامل الجهازية (أي CO2) ، والتوصيل الموضعي داخل الأوعية الدموية ، والذي يتم بوساطة الخلايا المحيطة والخلايا البطانية. وبالمثل ، قد تحد تقنيات التصوير / التسجيل الأكثر تفصيلا من حجم المجال من الدماغ بأكمله إلى منطقة صغيرة فقط. نصف استخدام الأقطاب الكهربائية خارج الجمجمة لتطبيق تحفيز tACS ، بما في ذلك تصميمات الأقطاب الكهربائية محلية الصنع والتجارية للقوارض ، والقياس المتزامن ل CBF والمجال الكهربائي داخل الجمجمة باستخدام أقطاب تسجيل DC الزجاجية الثنائية ، وطرق التصوير. نحن نطبق حاليا هذه التقنيات لتنفيذ تنسيق الحلقة المغلقة لزيادة CBF في النماذج الحيوانية لمرض الزهايمر والسكتة الدماغية.
Introduction
التحفيز الكهربائي عبر الجمجمة (tES ؛ مع تحفيز الموجات الجيبية ، tACS) هو نهج شائع وخارجي وغير جراحي للتعديل العصبي للدماغ 1,2. في السابق ، افترضنا أنه في جرعات معينة ، قد يزيد tES (وخاصة tACS) من تدفق الدم الدماغي (CBF) في مناطق الدماغ الأساسية3. علاوة على ذلك ، قد توجد علاقة بين الجرعة والاستجابة بين التيار الخارجي المطبق أو المجال الكهربائي داخل الجمجمة واستجابات CBF الناتجة. ومع ذلك ، فقد ركزت معظم بروتوكولات التحفيز السريري على أقصى مستوى مريح للبشرة من التحفيز (أي ~ 2 مللي أمبير) لفترات زمنية محددة (أي 30-45 دقيقة) كبروتوكول علاج 4,5. في القوارض ، من الممكن استخدام أقطاب دماغية غازية خارج الجمجمة يتم تطبيقها مباشرة على الجمجمة للتحقيق في المجالات الكهربائية في الدماغ التي يسببها tES6. ومن ثم، فإن الهدف من هذا النهج هو تحديد آثار شدة الترددات المضادة للمركبات عند الترددات ذات الصلة على تغيرات معامل الاستخلاص المتردد من حيث العلاقة بين الجرعة والاستجابة. يعتمد منحنى الاستجابة للجرعة هذا على قياسات مباشرة للعلامات الحيوية الفسيولوجية قصيرة المدى ل CBF فيما يتعلق بالمجال الكهربائي المفروض على الدماغ3. لقد أظهرنا سابقا أنه ، في السعات الأكبر ، عادة خارج نطاق المجالات الكهربائية داخل الدماغ التي يسببها tACS سريريا ، هناك علاقة شبه خطية بين المجال الكهربائي المستحث و CBF في القشرة3. ومع ذلك ، قد يكون التحفيز في المجال الأصغر (أي شدة 1-5 مللي فولت / مم) أكثر ملاءمة وجدوى للاستخدام في البشر. ومن ثم ، قمنا بتعديل تقنياتنا للكشف عن تغييرات CBF الأصغر.
تصف هذه الورقة بروتوكولا لتحليل تأثيرات التيارات الجيبية المتناوبة لشدة المجال السفلي tES (tACS) على CBF (أي تيار 0.5-2.0 مللي أمبير ، مجال كهربائي 1-5 مللي فولت / مم) ، والتي يمكن تحملها بواسطة القوارض المستيقظة5. يتضمن هذا البروتوكول استخدام تصوير بقع ليزر جديد أثناء tACS ، بالإضافة إلى أقطاب زجاجية مزدوجة داخل الجمجمة ، لتحديد كل من انتشار tACS النشط داخل الدماغ (كما يراقبه CBF) وشدة المجال الكهربائي داخل الجمجمة ، والتي تظهر كرسم تخطيطي وصورة تجريبية فعلية (الشكل 1). هناك العديد من الآثار الفسيولوجية المحتملة ل tES داخل الدماغ ، بما في ذلك التعديل العصبي المباشر ، واللدونة العصبية ، وتنشيط الخلايا النجمية 7,8. على الرغم من قياس CBF باستخدام tDCS 9,10 ، إلا أن هذه القياسات كانت بطيئة وغير مباشرة وغير كافية لتقييم وظيفة الاستجابة للجرعة في الدماغ. لذلك ، باستخدام المؤشرات الحيوية المناسبة قصيرة المدى (أي CBF ، المجالات الكهربائية) وتسلسل التشغيل / الإيقاف السريع ل tACS ، يمكننا الآن تقدير وظيفة الاستجابة للجرعة بشكل أكثر دقة. علاوة على ذلك ، يمكننا تطبيق تقنيات مختلفة لقياس CBF ، بما في ذلك كل من مجسات دوبلر بالليزر البؤرية (LD) وتصوير البقع بالليزر (LSI) مع مناطق اهتمام محددة.
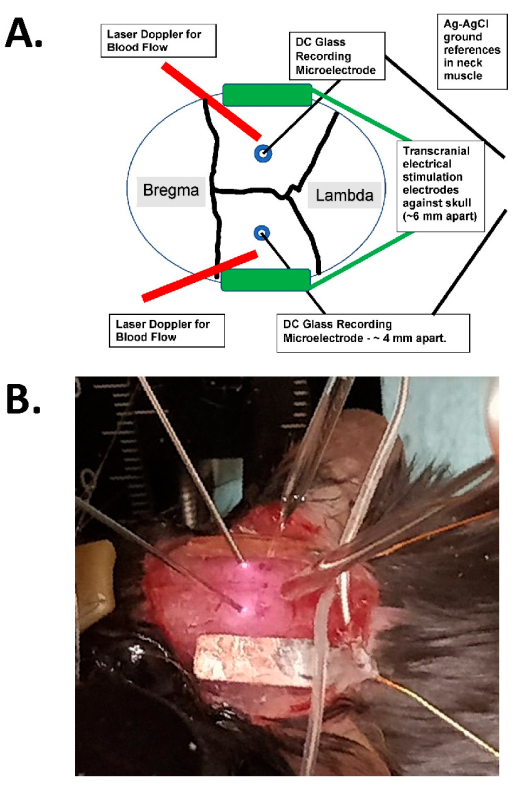
الشكل 1: مخطط التحفيز عبر الجمجمة ومثال فوتوغرافي. أ: رسم تخطيطي لإعداد التحفيز عبر الجمجمة. يوضح الشكل جمجمة فأر بها خيوط إكليلية وسهمية. يتم وضع الأقطاب الكهربائية عبر الجمجمة بشكل جانبي ومتماثل على الجمجمة ويتم تركيبها بالغراء الجراحي ومعجون موصل بين الأقطاب الكهربائية والجمجمة. يتم توصيل هذه الأقطاب بجهاز تحفيز تيار ثابت متوافق مع الإنسان ، والذي يمكنه تحديد تردد التحفيز وسعته ومدته. لتقييم المجالات الكهربائية داخل الجمجمة ، يتم وضع أقطاب زجاجية ثنائية (~ 2 MΩ) في القشرة الدماغية (أي في غضون 1 مم من الجانب الداخلي للجمجمة من خلال ثقوب لدغ صغيرة) ، ويتم إغلاقها بالزيت المعدني ولها أسباب AgCl في عضلة الرقبة (كما هو موضح كأسلاك أكبر في المركز مدفونة في أنسجة الرقبة تحت الجلد). يتم توصيل هذه الأقطاب الزجاجية بمكبر للتيار المستمر ، ويتم تسجيل مخرجاتها من خلال محول رقمي بأربع قنوات على الأقل. كما يتم وضع مجسات دوبلر بالليزر الثنائية على الجمجمة للتسجيلات. يتم تصوير الجمجمة بأكملها أيضا إما بجهاز تصوير بقع الليزر أو كاميرا مبردة عالية الدقة (على الأقل 1024 × 1024 بكسل ، عمق 12-14 بت بكسل) للكشف عن الإشارة الضوئية الجوهرية. عادة ما يتم اختيار تردد الهيموغلوبين متساوي البستيست (أي 562 نانومتر) للإضاءة لتصوير تدفق الدم. (ب) صورة مقربة لتجربة فعلية ، تظهر مجسات دوبلر الليزرية الثنائية (إلى اليسار) ، والأقطاب الدقيقة (الثنائية) داخل الجمجمة التي تسجل الأقطاب الدقيقة الموضوعة من خلال ثقوب الأزيز ، ومع تحفيز الأقطاب الكهربائية tACS بشكل جانبي. اختصار: tACS = تحفيز التيار المتناوب عبر الجمجمة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
كطريقة لتقييم الآليات ، يمكننا أيضا استجواب التفاعلات مع العمليات الفسيولوجية الأخرى التي تغير أيضا CBF ، مثل إزالة الاستقطاب الناجم عن الانتشار K + 11. علاوة على ذلك ، بدلا من الجلسات المجدولة في أوقات منتظمة ، من الممكن أيضا تطوير نظام حلقة مغلقة يعتمد على مؤشرات حيوية إضافية لمجموعة متنوعة من الأمراض ، كما تم اقتراحه لعلاج الصرع12 (أي أجهزة Neuropace السريرية). على سبيل المثال ، يعتمد تحفيز الدماغ ذو الحلقة المغلقة لمرض باركنسون عادة على إمكانات المجال المحلي الجوهرية غير الطبيعية (LFPs) الجوهرية لهذا المرض في حالة عدم وجود الدوبامين الكافي (عادة LFPs β النطاق) 13.
Protocol
تمت الموافقة على جميع الإجراءات المتعلقة بالحيوان من قبل اللجنة المؤسسية لرعاية واستخدام في جامعة ديوك أو السلطة المحلية المكافئة التي تنظم البحوث التي تشمل. راجع جدول المواد للحصول على تفاصيل حول جميع المواد والأدوات والمعدات المستخدمة في هذا البروتوكول.
1. إعداد الصك
- تأكد من أن جميع العناصر والأدوات الجراحية المطلوبة في مكانها (الشكل 2): محلول تنظيف فروة الرأس (ضمادات الكحول) ، وشريط ، وملقط ، ومقص ، ومثقاب لوضع ثقوب النتوءات الصغيرة (0.5 مم).
- قم بإعداد أقطاب السطح خارج الجمجمة لتطبيق الجمجمة ، وتأكد من تنظيف أي غراء جراحي منها إذا تم استخدامها مسبقا.
- تحقق من مقاومة أقطاب tACS هذه مباشرة قبل وضعها على الجمجمة. لهذا ، استخدم وظيفة القياس المدمجة لمحفز tACS مع وضع كلا القطبين في حمام ملحي.
ملاحظة: المقاومة المفضلة هي <5 KΩ لكل زوج من الأقطاب الكهربائية للسماح بمرور تيار كاف عبر الجمجمة. يتحقق جهاز التحفيز من المعاوقة قبل توصيل نبضات التيار المستمر ويعطي القيمة مباشرة.
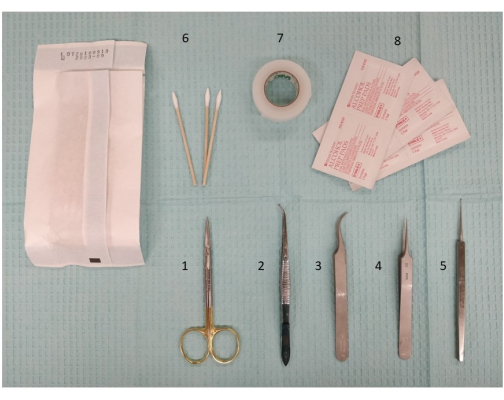
الشكل 2: صورة للأجهزة المطلوبة ، بما في ذلك أدوات التشريح والمقص ، لإعداد التحفيز خارج الجمجمة. 1. مقص تشريح دقيق ، 11.5 سم ؛ 2. ملقط ، 11.5 سم ، منحنى طفيف ، مسنن. 3. دومون # 7 ملقط ، منحني ؛ 4. دومون # 5 ملقط. 5. كوريت صغير ، 13 سم ؛ 6. س نصائح. 7. الشريط الجراحي. 8. منصات الكحول. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. إعداد للجراحة
ملاحظة: في هذه التجارب ، استخدمنا 14 فأرا ضابطا C57BL / 6 تتراوح أعمارهم بين 12 أسبوعا و 33 أسبوعا ، منها خمسة ذكور وتسعة إناث.
- تخدير في غرفة الحث مع الأيزوفلوران في 30٪ O2 عند ~ 1.5 لتر / دقيقة ، مع ~ 4٪ في البداية للحث و ~ 1.25٪ -1.5٪ للحفاظ على مستوى التخدير مع التنفس التلقائي وكافية للقضاء على استجابة قرصة الذيل.
- انقل إلى الإطار التجسيمي بعد الحث ، ثم قم بتأمين الرأس في مخروط الأنف وقضبان الأذن لتطبيق القطب الكهربائي اللاحق وإجراء ثقب الأزيز (الشكل 1 والشكل 3).
- قم بتوصيل مخروط الأنف للإطار التجسيمي بالمبخر عبر مدخل ومخرج لإزالة أي بقايا إيزوفلوران من خلال نظام زبال (على سبيل المثال ، الفحم أو الفراغ). تأكد من عدم وجود تسرب للهواء من مخروط الأنف ، للحفاظ على مستوى التخدير باستخدام الأيزوفلوران ولمنع التسرب العرضي في هواء الغرفة (الشكل 3).
- تحقق من موضع الماوس في الإطار التجسيمي ، بما في ذلك موضع مخروط الأنف ، للسماح بالتنفس التلقائي دون التنبيب ، وكذلك استعادة التخدير المناسب والكسح لحماية موظفي البحث (الشكل 3).
- ضع المجسات لقياس النبض وتشبع الأكسجين النبضي (نبض OX) وضغط الدم ودرجة الحرارة على ؛ تأكد من أن الحد الأدنى لأكسجة النبض هو 90٪ وأن النبض هو >450 / دقيقة (يظهر الحد الأدنى للإنذار على أنه 380 نبضة / دقيقة). سجل هذه المعلمات أثناء الإجراء على فترات منتظمة أو بشكل مستمر ، اعتمادا على نظام التسجيل (الشكل 3).
- قبل البدء في الإجراء ، تحقق من مستوى تخدير باستخدام (على سبيل المثال) قرصة إصبع القدم للتحقق من ردود الفعل. إذا لم يكن هناك رد فعل ، فإن مستوى التخدير هو الأمثل ، طالما أن يحافظ على التنفس التلقائي والأوكسجين النبضي الكافي. إذا كان هناك رد فعل ، فقم بزيادة توصيل الأيزوفلوران لتعميق مستوى التخدير ، ثم أعد فحص المنعكس. مراقبة ومراقبة التردد التنفسي للحيوان باستمرار ، وضبط توصيل الأيزوفلوران وفقا لذلك.
- حلق شعر فروة الرأس أو أزل الشعر باستخدام كريم مزيل الشعر (نظف الكريم المتبقي بممرات وسادة الكحول).
- ضع مرهم العين ، ثم قم بتنظيف فروة الرأس بشكل معقم بثلاثة ممرات من اليود والكحول قبل الاستئصال باستخدام المقص.

الشكل 3: صورة للحيوان في إطار التوضيع التجسيمي ، مع كشف الجمجمة وأقطاب تحفيز tACS فقط في مكانها (قبل وضع ثقب الأزيز). لاحظ جهاز ضغط الدم حول الذيل ومقياس التأكسج النبضي على المخلب ، مع القراءة على اليسار. هناك أنابيب كسح للأيزوفلوران حول مخروط الأنف. اختصار: tACS = تحفيز التيار المتناوب عبر الجمجمة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. الإجراء الجراحي: تطبيق الأقطاب الكهربائية المحفزة وعمل ثقوب الأزيز
- لإجراء دراسة نهائية ، قم بإزالة فروة الرأس باستخدام مقص جراحي ، وفضح الجمجمة ~ 3 مم من خياطة اللامبويد ذيليا و ~ 3 مم أمامية إلى البريغما لفضح جزء من الخيط الجبهي الخلفي. قم باستئصال فروة الرأس بشكل متساو لكشف الجزء الأولي من العضلة الصدغية على كلا الجانبين (الشكل 3).
- قم بإزالة أي أنسجة ضامة تحت الجلد متبقية بحيث تكون الجمجمة نظيفة وجافة لتطبيق الأقطاب الكهربائية المحفزة.
- ضع الجل أو المعجون الموصل على جانب الأقطاب الكهربائية التي ستكون على اتصال بالجمجمة ، وقم بتأمين الأقطاب الكهربائية بالغراء الجراحي حول الحافة في أماكن متقطعة.
ملاحظة: لا تسمح للهلام الموصل بالتدخل في الغراء الجراحي الفائق للسماح برابطة أفضل مع سطح الجمجمة. يمكن أيضا عزل السطح الخارجي للأقطاب الكهربائية (من فروة الرأس إذا تم إغلاقه أثناء جراحة البقاء على قيد الحياة) باستخدام الغراء الجراحي الفائق. - استخدم إما أقطاب كهربائية مسطحة تجارية ، أو قم بإنشاء أقطاب كهربائية داخلية باستخدام سلك معزول بقطر 100 ميكرومتر (ملحوم باللوحة) وصفيحة نحاسية مرنة ومعزولة (على سطح واحد) مقطوعة وفقا لحجم الجمجمة.
- ضع معجون الليدوكائين على العضلات الصدغية وفروة الرأس على كلا الجانبين دون إزعاج الأقطاب الكهربائية لتقليل تنشيط العضلات والأعصاب الطرفية.
- بمجرد وضع أقطاب التحفيز خارج الجمجمة في مكانها 4 مم بشكل جانبي على كل جانب من الجمجمة (بين البريغما واللامدا) ، قم بحفر فتحتين بطول 0.5 مم للأقطاب الزجاجية 2 مم على كل جانب من خط الوسط ، على بعد 4 مم عن بعضها البعض ، متعامد مع الخيط السهمي (الشكل 1). املأ ثقوب النتوءات هذه بالزيت المعدني المعقم لمنع دخول التيار إلى الجمجمة من الأقطاب الكهربائية خارج الجمجمة.
- إذا رغبت في تجربة معينة للحث على انتشار الاكتئاب (أي الاكتئاب المنتشر الناجم عن البوتاسيوم [K + -SD]) ، أضف ، على الجانب الأيمن من الجمجمة ، ثقب لدغ ثالث 0.5 مم ~ 1.5 مم منبر إلى الخيط الإكليلي و ~ 1 مم جانبي إلى الخيط الجبهي الخلفي. املأ فتحة النتوء هذه بالمحلول الملحي لتطبيق 1 M KCl لاحقا للحث على K + -SD.
- اختبر مقاومة الأقطاب الكهربائية المحفزة خارج الجمجمة قبل وضع ثقب الأزيز (ومقارنة بنفس الأقطاب الكهربائية الموضوعة في حمام ملحي) وبعد وضع ثقب الأزيز للتحقق من أن ثقوب الأزيز لا تتداخل مع تدفق التيار إلى الدماغ (أي تأكد من أن المقاومة لم تتغير).
ملاحظة: يتم توفير قياس المعاوقة مباشرة بواسطة جهاز التحفيز. بشكل عام ، وجدنا أن مقاومة النظام الكلية (أي من الأقطاب الكهربائية خارج الجمجمة عبر مسار الجمجمة / الدماغ ، عادة ~ 3 KΩ) ثابتة نسبيا بغض النظر عن ثقوب الأزيز والأقطاب الزجاجية الدقيقة ، مما يشير إلى أن هناك الحد الأدنى من تسرب التيار مباشرة إلى الدماغ من خلال ثقوب الأزيز. - ضع أقطاب التحفيز المزمن عبر الجمجمة للتحفيز المزمن بطريقة مماثلة. في هذه الحالة ، اعزل السطح الخارجي للأقطاب الكهربائية ، وأغلق فروة الرأس ، وقم إما بنفق الأسلاك المعزولة عبر فروة الرأس أو توجيهها إلى مرحلة رأس ثابتة مثبتة على الجمجمة.
4. الإجراء الفسيولوجي
- ابدأ بالجوانب الفسيولوجية للتجربة ، بمجرد أن يكون مستعدا تماما للتجربة الفسيولوجية غير الباقية. الحفاظ على مستوى التخدير الكافي لكل من التنفس التلقائي ومستويات الثور والجهاز التنفسي والنبض الكافية.
- قم بقياس CBF الناتج عن التحفيز خارج الجمجمة بإحدى الطريقتين التاليتين.
- ضع الماوس تحت جهاز تصوير بقع الليزر مع أو بدون أقطاب تسجيل داخل الجمجمة لقياس المجال الكهربائي داخل الجمجمة أثناء نوبات التحفيز (الشكل 3).
- نقل إلى إعداد فسيولوجي لوضع مجسات دوبلر بالليزر الثنائية والأقطاب الكهربائية داخل الجمجمة لقياس المجال الكهربائي داخل الجمجمة أثناء نوبات التحفيز (الشكل 1).
5. وضع دوبلر الليزر الثنائي والأقطاب الزجاجية
- نقل إلى مرحلة المجهر لتطبيق تحقيقات دوبلر الليزر الثنائية. ضع المجسات أعلى سطح الجمجمة بين ثقوب النتوءات الثنائية والخيط الإكليلي (الشكل 1).
- املأ الأقطاب الكهربائية الزجاجية الدقيقة المسحوبة (~ 0.1 ميكرومتر ، مقاومة 2-6 MΩ) ب 0.2 M NaCl ، وضعها باستخدام مناور دقيق في فتحتي الأزيز الموضوعتين بشكل جانبي على الخيط السهمي 3,14 (الشكل 1).
ملاحظة: تقع هذه الثقوب بين قطبي التحفيز خارج الجمجمة المتماثلين (الشكل 1). - بمجرد إدخالها في الدماغ ، تأكد من أن هذه الأقطاب الزجاجية الدقيقة ~ 1 مم داخل القشرة الدماغية. أداء ملامح العمق في أعماق متناظرة مختلفة. أعد ملء ثقوب النتوءات بالزيت المعدني المعقم لعزل هذا المسار لتدفق التيار.
6. إجراء التحفيز وقياس شدة تحفيز التيار المتردد عبر الجمجمة (tACS) أو تحفيز التيار المباشر عبر الجمجمة (tDCS)
- سجل البيانات المستمرة من مجسات دوبلر بالليزر المزدوجة على الجمجمة ومخرجي الأقطاب الكهربائية الدقيقة داخل الجمجمة (المسجلة باستخدام مضخم تيار مستمر مع حواجز الرأس) باستخدام نظام رقمنة وبرنامج بأربع قنوات على الأقل (بمعدل أخذ عينات 1 كيلو هرتز). بمجرد تسجيل جميع القيم على مدى مدة خط أساس مستقرة بما فيه الكفاية (أي >10 دقائق) ، اختبر التحفيز خارج الجمجمة.
ملاحظة: يوضح الشكل 4 مثالا على القنوات الأربع التي تحتوي على قطبي تسجيل داخل الجمجمة في القنوات العلوية واستجابة CBF في القنوات السفلية. - تطبيق فترات قصيرة من التحفيز على / إيقاف التشغيل بسعات مختلفة (أي 20-30 ثانية ، 0.5-2.0 مللي أمبير ، في النطاق المسموح به) للحصول على خط أساس واضح قبل وبعد التحفيز (الشكل 4). قم بتطبيق التحفيز بين قطبي tACS للجمجمة على كلا الجانبين (الشكل 1) باستخدام جهاز تحفيز تجاري متوافق مع الإنسان يوفر تيارا ثابتا.
- راقب الماوس عن كثب بحثا عن تشنجات عضلية أو استجابات أخرى ل tACS ، مثل تغيير في النبض أو التنفس ، لإنشاء حد أعلى للتحمل (بشكل عام ~ 2 مللي أمبير).
- استمر في مراقبة المعاوقة عبر الأقطاب الكهربائية باستخدام فترات التحفيز للتأكد من ثباتها.
- أضف كمية صغيرة (2-3 ميكرولتر) من 1 M KCl إلى فتحة النتوءالأمامية 14 للحث على أحداث K + -SD التلقائية. وتولد هذه استجابة كبيرة لإطار بناء القدرات وتفاعلات بين استجابة إطار بناء القدرات الناجم عن K+-SD واستجابة إطار بناء القدرات (CBF). تقدير استجابة tACS CBF ، وتطبيق تحفيز tACS قبل وبعد حدوث SD.
- في نهاية التجربة ، قم بإجراء القتل الرحيم من خلال جرعة زائدة من الأيزوفلوران (5٪) ثم قطع الرأس بمجرد توقف التنفس ونبضات القلب.
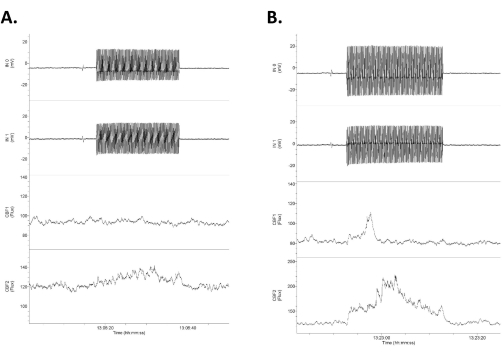
الشكل 4: بيانات توضح أربع قنوات من البيانات الأولية استجابة ل tACS منخفضة الكثافة. يتم ترتيب البيانات مع الصفين العلويين كتسجيلات كهربائية DC مباشرة داخل الجمجمة (تسمى المدخلات 1 [IN0] والمدخلات 2 [IN1]) والصفين السفليين كتسجيلات دوبلر ليزر ثنائية لتدفق الدم الدماغي. لاحظ أن الاستجابات غير متماثلة بين آثار تدفق الدم الكهربائية والدماغية اليمنى (العلوية) واليسرى (السفلية). أ: استجابة صغيرة (زيادة بنسبة 16٪ في تدفق الدم) استجابة لمثير مقداره 1.2 مللي فولت/مم 20 ثانية (0.75 مللي أمبير). ب: استجابة أكبر (زيادة بنسبة 21٪ في تدفق الدم) استجابة لمثير مقداره 1.4 mV/mm (1.0 mA). اختصار: tACS = تحفيز التيار المتناوب عبر الجمجمة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
7. حساب المجال الكهربائي
- قم بقياس الفرق في الناتج من القطبين داخل الجمجمة باستخدام الفرق في نصف الموجة (دورة واحدة) للموجتين الجيبيتين المسجلتين (الأثران العلويان في الشكل 4). اقسم هذا الاختلاف (mV) على المسافة بين القطبين (مم ، هنا ~ 4 مم ولكن تم قياسه مباشرة في كل حالة) للوصول إلى شدة المجال (mV / mm) 3,6.
النتائج
النتائج التمثيلية موضحة في الشكل 4 والشكل 5 والشكل 6. يوضح الشكل 4 مثالا على القنوات الأربع التي تحتوي على قطبي تسجيل داخل الجمجمة على القنوات العلوية واستجابات CBF على القنوات السفلية. يكون tACS متماثلا عبر الجمجمة ، ولكن بشكل ع?...
Discussion
يركز هذا البروتوكول على القياس المخدر في الجسم الحي لاستجابة CBF كعلامة حيوية لتقدير استجابة الدماغ ل tES14. تشمل المؤشرات الحيوية طويلة المدى لاستجابة tES تأثيرات العلاج النسيجي ، مثل الوقاية أو التغيرات في تكوين لوحة الأميلويد (أي مع تحفيز جاما عند 40 هرتز في العديد من نماذج ...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
تم دعم هذه الدراسة من خلال المنح التالية (إلى D.A.T.): NIA RO1 AG074999 و NIA R21AG051103 و VA I21RX002223 و VA I21 BX003023.
Materials
| Name | Company | Catalog Number | Comments |
| Alcohol pads | HenryShein | 112-6131 | |
| Baby mineral oil | Johnson & Johnson | ||
| BD 1 mL syringe | Becton Dikinson | REF 305699 | |
| C3 Flat Surface Electrodes | Neuronexus | ||
| C57BI mice | from NIH colonies | ||
| Copper skull electrods | In house preparation | ||
| Digidata 1440, Clampex | Axon Instruments | ||
| Dumont #5 forceps | FST | #5 | |
| Dumont #7 forceps curved | Dumont | RS-5047 | |
| Eye ointment | Major | LubiFresh P.M. NDC-0904-6488-38 | |
| Flaming/Brown micropipette puller | Sutter instrument Co. | Model P-87 | |
| Forceps 11.5 cm slight curve serrated | Roboz | RS-8254 | |
| Intramedic needle 23 G | Becton Dikinson | REF 427565 | |
| KCl 1 M | In house preparation | ||
| Laser Doppler Probes | Moor Instruments | 0.46 mm laser doppler probes | |
| Laser Speckle Imaging Device | RWD | RFLSI-ZW | |
| Micro curette 13 cm | FST | 10080-05 | |
| Micro Dissecting Scissors, 11.5 cm | Roboz | RS-5914 | |
| Mouse anesthesia fixation | Stoelting | ||
| Neuroconn-DS | Neurocare | DC-Stimulator Plus | |
| PhysioSuite Monitoring | Kent Scientific | ||
| Q-tips | Fisherbrand | 22363167 | |
| Saline 0.9% NaCl solution | Baxter | 281322 | |
| Sensicam QE | PCO Instruments | ||
| Software | Axon Instruments Clampex | ||
| Surgical glue | Covetrus | 31477 | |
| Surgical tape | 3M Transpore | T9784 |
References
- Bestmann, S., Walsh, V. Transcranial electrical stimulation. Current Biology. 27 (23), R1258-R1262 (2017).
- Bikson, M., et al. Rigor and reproducibility in research with transcranial electrical stimulation: An NIMH-sponsored workshop. Brain Stimulation. 11 (3), 465-480 (2018).
- Turner, D. A., Degan, S., Galeffi, F., Schmidt, S., Peterchev, A. V. Rapid, dose-dependent enhancement of cerebral blood flow by transcranial AC stimulation in mouse. Brain Stimulation. 14 (1), 80-87 (2020).
- Shah, S., Chhatbar, P. Y., Feld, J. A., Feng, W. Integrating tDCS into routine inpatient rehabilitation practice to boost post-stroke recovery. Brain Stimulation. 13 (4), 953-954 (2020).
- Voroslakos, M., et al. Direct effects of transcranial electric stimulation on brain circuits in rats and humans. Nature Communications. 9 (1), 483 (2018).
- Alekseichuk, I., Mantell, K., Shirinpour, S., Opitz, A. Comparative modeling of transcranial magnetic and electric stimulation in mouse, monkey, and human. Neuroimage. 194, 136-148 (2019).
- Tavakoli, A. V., Yun, K. Transcranial alternating current stimulation (tACS) mechanisms and protocols. Frontiers in Cellular Neuroscience. 11, 214 (2017).
- Yavari, F., Jamil, A., Mosayebi Samani, M., Vidor, L. P., Nitsche, M. A. Basic and functional effects of transcranial electrical stimulation (tES)-An introduction. Neuroscience and Biobehavioral Reviews. 85, 81-92 (2018).
- Wachter, D., et al. Transcranial direct current stimulation induces polarity-specific changes of cortical blood perfusion in the rat. Experimental Neurology. 227 (2), 322-327 (2011).
- Han, C. H., et al. Hemodynamic responses in rat brain during transcranial direct current stimulation: A functional near-infrared spectroscopy study. Biomedical Optics Express. 5 (6), 1812-1821 (2014).
- Ayata, C., Lauritzen, M. Spreading depression, spreading depolarizations, and the cerebral vasculature. Physiological Reviews. 95 (3), 953-993 (2015).
- Berenyi, A., Belluscio, M., Mao, D., Buzsaki, G. Closed-loop control of epilepsy by transcranial electrical stimulation. Science. 337 (6095), 735-737 (2012).
- Hoang, K. B., Cassar, I. R., Grill, W. M., Turner, D. A. Biomarkers and stimulation algorithms for adaptive brain stimulation. Frontiers in Neuroscience. 11, 564 (2017).
- Turner, D., A, D. S., Hoffmann, U., Galleffi, F., Colton, C. A. CVN-AD Alzheimer's mice show premature reduction in neurovascular coupling in response to spreading depression and anoxia compared to aged controls. Alzheimer's and Dementia. 17 (7), 1109-1120 (2021).
- Colton, C. A., et al. mNos2 deletion and human NOS2 replacement in Alzheimer disease models. Journal of Neuropathology and Experimental Neurology. 73 (8), 752-769 (2014).
- Castano-Prat, P., et al. Altered slow (<1 Hz) and fast (beta and gamma) neocortical oscillations in the 3xTg-AD mouse model of Alzheimer's disease under anesthesia. Neurobiology of Aging. 79, 142-151 (2019).
- Etter, G., et al. Optogenetic gamma stimulation rescues memory impairments in an Alzheimer's disease mouse model. Nature Communications. 10 (1), 5322 (2019).
- Iaccarino, H. F., et al. Gamma frequency entrainment attenuates amyloid load and modifies microglia. Nature. 540 (7632), 230-235 (2016).
- Martorell, A. J., et al. Multi-sensory gamma stimulation ameliorates Alzheimer's-associated pathology and improves cognition. Cell. 177 (2), 256-271 (2019).
- Dawson, J., et al. Vagus nerve stimulation paired with rehabilitation for upper limb motor function after ischaemic stroke (VNS-REHAB): A randomised, blinded, pivotal, device trial. Lancet. 397 (10284), 1545-1553 (2021).
- Hacker, M. L., et al. Deep brain stimulation in early-stage Parkinson disease: Five-year outcomes. Neurology. 95 (4), e393-e401 (2020).
- Duun-Henriksen, J., et al. A new era in electroencephalographic monitoring? Subscalp devices for ultra-long-term recordings. Epilepsia. 61 (9), 1805-1817 (2020).
- Haneef, Z., et al. Sub-scalp electroencephalography: A next-generation technique to study human neurophysiology. Clinical Neurophysiology. 141, 77-87 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved