需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
麻醉小鼠颅外刺激电极的放置和脑血流量和颅内电场的测量
摘要
我们描述了一种评估颅外刺激剂量反应曲线的方案,包括脑电场测量和相关的生物标志物-脑血流。由于该方案涉及将侵入性电极植入大脑,因此需要全身麻醉,首选自主呼吸而不是控制呼吸。
摘要
检测脑血流 (CBF) 对各种形式的神经元激活的反应对于了解动态脑功能和大脑底物供应的变化至关重要。本文描述了一种测量 CBF 对经颅交流电刺激 (tACS) 反应的方案。剂量反应曲线是根据 tACS (mA) 和颅内电场 (mV/mm) 发生的 CBF 变化估计的。我们根据大脑两侧玻璃微电极测量的不同振幅来估计颅内电场。在本文中,我们描述了实验装置,其中包括使用双侧激光多普勒 (LD) 探头或激光散斑成像 (LSI) 来测量 CBF;因此,这种设置需要麻醉才能放置电极并保持稳定性。我们提出了CBF响应与电流之间的相关性作为年龄的函数,与老年动物(28-32周)相比,年轻对照动物(12-14周)在较高电流(1.5mA和2.0mA)下的反应明显更大(p < 0.005差异)。我们还证明了在电场强度 <5 mV/mm 下显着的 CBF 响应,这是最终人体研究的重要考虑因素。与清醒动物相比,麻醉的使用、呼吸控制(即插管与自主呼吸)、全身因素(即 CO2)以及血管内的局部传导(由周细胞和内皮细胞介导)也强烈影响这些 CBF 反应。同样,更详细的成像/记录技术可能会将整个大脑的视野大小限制在一个小区域。我们描述了使用颅外电极进行 tACS 刺激,包括啮齿动物的自制和商业电极设计、使用双侧玻璃直流记录电极同时测量 CBF 和颅内电场以及成像方法。我们目前正在应用这些技术来实现一种闭环形式,用于在阿尔茨海默病和中风的动物模型中增强CBF。
引言
经颅电刺激(tES;正弦波刺激,tACS)是一种常见的、外部的、非侵入性的脑神经调控方法1,2。之前,我们假设在某些剂量下,tES(尤其是 tACS)可能会增加潜在大脑区域的脑血流量 (CBF)3。此外,施加的外部电流或颅内电场与产生的CBF反应之间可能存在剂量反应关系。然而,大多数临床刺激方案都集中在预定时间段(即 30-45 分钟)的最大舒适皮肤刺激水平(即 ~ 2 mA)作为治疗方案 4,5。在啮齿动物中,可以使用直接施加在颅骨上的侵入性颅外脑电极来研究 tES6 诱导的大脑电场。因此,该方法的目标是根据剂量-反应关系确定相关频率下 tACS 强度对 CBF 变化的影响。该剂量反应曲线基于CBF与施加在大脑上的电场相关的短期生理生物标志物直接测量3。我们之前已经证明,在较大的振幅下,通常超出临床上由 tACS 诱导的大脑内电场范围,感应电场与皮层3 中的 CBF 之间存在近线性相关性。然而,较小视野的刺激(即 1-5 mV/mm 强度)可能更适合用于人类;因此,我们修改了我们的技术来检测较小的CBF变化。
本文描述了一种方案,用于分析低场强 tES 交流正弦电流 (tACS) 对 CBF(即 0.5-2.0 mA 电流,1-5 mV/mm 电场)的影响,清醒的啮齿动物可以耐受5。该协议涉及在tACS期间使用新型激光散斑成像以及双颅内玻璃电极,以确定活性tACS在大脑内的扩散(由CBF监测)和颅内电场强度,其显示为图表和实际实验照片(图1)。tES 在大脑内有许多可能的生理效应,包括直接神经元调节、神经可塑性和星形胶质细胞激活 7,8。尽管 CBF 已使用 tDCS 9,10 进行测量,但这些测量缓慢、间接且不足以评估大脑中的剂量反应功能。因此,通过使用适当的短期生物标志物(即 CBF、电场)和 tACS 的快速开/关序列,我们现在可以更准确地估计剂量反应函数。此外,我们可以应用不同的技术来测量 CBF,包括具有定义感兴趣区域的聚焦激光多普勒探头 (LD) 和激光散斑成像 (LSI)。
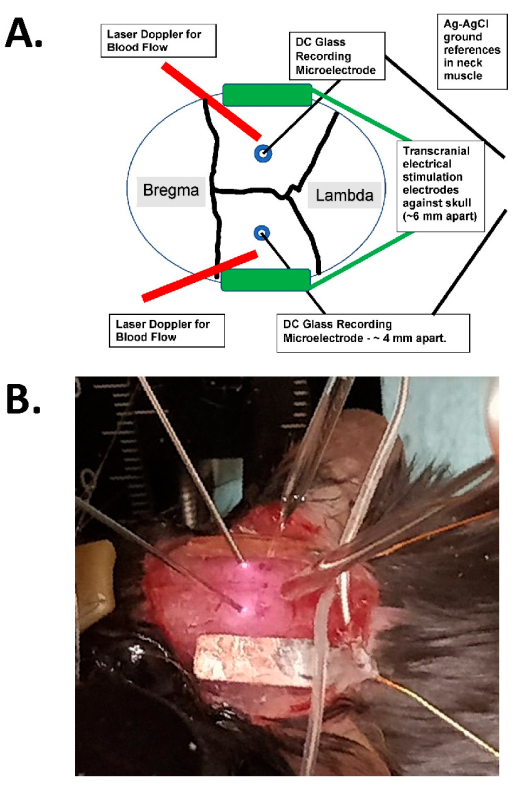
图 1:经颅刺激图和摄影示例。 (A) 经颅刺激装置示意图。该图显示了带有冠状缝合线和矢状缝合线的小鼠头骨。经颅电极横向对称放置在颅骨上,并在电极和颅骨之间安装有手术胶和导电膏。这些电极连接到与人体兼容的恒流刺激装置,该装置可以指定刺激的频率、幅度和持续时间。为了评估颅内电场,将双侧玻璃电极(~2 MΩ)放置在大脑皮层中(即,在颅骨内侧1mm以内,通过小毛刺孔),并用矿物油密封,并在颈部肌肉中具有AgCl基础(显示为中心埋入皮下颈部组织的较大电线)。这些玻璃电极连接到直流放大器,其输出通过至少具有四个通道的数字化仪进行记录。双侧激光多普勒探头也被放置在颅骨上进行记录。整个头骨还使用激光散斑成像设备或高分辨率(至少 1,024 x 1,024 像素,12-14 位像素深度)冷却相机进行成像,以进行固有光信号检测。通常选择血红蛋白等吸收频率(即 562 nm)作为血流成像的照明。(B) 实际实验的特写图像,显示双侧激光多普勒探头(左侧)、通过毛刺孔放置的(双侧)颅内玻璃记录微电极以及横向放置 tACS 刺激电极。缩写:tACS=经颅交流电刺激。请点击这里查看此图的较大版本.
作为评估机制的一种方式,我们还可以询问与其他也改变 CBF 的生理过程的相互作用,例如 K+ 诱导的扩散去极化11。此外,除了定期安排的会议外,还可以开发基于各种疾病的额外生物标志物的闭环系统,正如为癫痫治疗12 (即临床Neuropace设备)所建议的那样。例如,在缺乏足够的多巴胺(通常是β波段 LFP)的情况下,帕金森病的闭环脑刺激通常基于该疾病固有的固有异常局部场电位 (LFP)13。
研究方案
所有动物程序均由杜克大学机构动物护理和使用委员会或同等的地方当局批准,以规范涉及动物的研究。有关本协议中使用的所有材料、仪器和设备的详细信息,请参阅 材料表 。
1. 仪器准备
- 确保所有必需的物品和手术器械都已到位(图 2):头皮清洁液(酒精棉)、胶带、镊子、剪刀和用于放置小 (0.5 毫米) 毛刺孔的钻头。
- 准备颅外表面电极用于颅骨应用,并确保已清除任何手术胶水(如果以前使用过)。
- 在将这些 tACS 电极施加到颅骨之前,直接验证这些 tACS 电极的阻抗。为此,请使用 tACS 刺激器的内置测量功能,将两个电极置于盐水浴中。
注意:优选阻抗为每对电极 <5 KΩ,以允许足够的电流通过颅骨。刺激器设备在提供恒流脉冲之前检查阻抗并直接给出值。
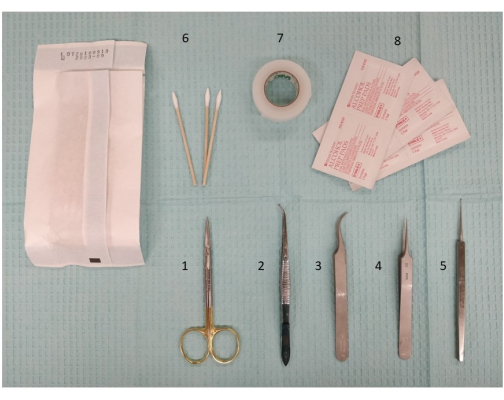
图 2:准备颅外刺激所需的仪器(包括解剖器械和剪刀)的照片。 1.微型解剖剪刀,11.5厘米;2.镊子,11.5厘米,略弯曲,锯齿状;3. Dumont #7 镊子,弯曲;4. Dumont #5 镊子;5. 微量刮匙,13 厘米;6. Q-tips;7.手术胶带;8.酒精棉片。 请点击这里查看此图的较大版本.
2. 动物手术准备
注:对于这些实验,我们使用了 14 只 12 周至 33 周龄的 C57BL/6 对照小鼠,其中 5 只为雄性,9 只为雌性。
- 在诱导室中用异氟醚在30%O2 中以~1.5L / min的速度麻醉动物,最初~4%用于诱导,~1.25%-1.5%用于维持自主呼吸的麻醉水平,足以消除尾部捏合反应。
- 诱导后将动物转移到立体定位框架中,然后将头部固定在鼻锥和耳杆中,以进行随后的电极应用和毛刺孔程序(图1 和 图3)。
- 通过入口将立体定位框架的鼻锥连接到蒸发器,并通过清除系统(例如木炭或真空)去除任何异氟烷残留物。确保鼻锥没有漏气,既可以保持异氟烷的麻醉水平,又可以防止意外泄漏到室内空气中(图 3)。
- 检查鼠标在立体定位框架中的位置,包括鼻锥的位置,以允许在不插管的情况下自主呼吸,以及适当的麻醉恢复和清除以保护研究人员(图3)。
- 将用于测量脉搏、脉搏血氧饱和度(脉搏OX)、血压和体温的探头放在动物身上;确保最小脉冲氧合为 90%,脉冲为 >450/min(报警下限显示为 380 脉冲/分钟)。在手术过程中定期或连续记录这些参数,具体取决于记录系统(图3)。
- 在开始手术之前,使用(例如)脚趾捏来检查动物的镇静水平以检查反射。如果没有反射,那么只要动物保持自主呼吸和足够的脉冲氧合,镇静水平就是最佳的。如果有反射,增加异氟醚的输送以加深麻醉水平,然后重新检查反射。持续观察和监测动物的呼吸频率,并相应地调整异氟醚递送。
- 剃掉头皮毛发或用脱毛膏去除毛发(用酒精垫通道清洁残留的乳霜)。
- 涂抹眼膏,然后在使用剪刀切除之前用三代碘和酒精无菌清洁头皮。

图 3:立体定向框架中的动物图像,头骨暴露在外,只有 tACS 刺激器电极就位(在放置毛刺孔之前)。 注意尾巴周围的血压计和爪子上的脉搏血氧仪,读数在左边。鼻锥周围有异氟醚的清除管。缩写:tACS=经颅交流电刺激。 请点击这里查看此图的较大版本.
3.外科手术:施加刺激电极并制作毛刺孔
- 对于终末研究,使用手术剪刀去除头皮,并将颅骨从羊角缝合线尾部暴露 ~3 毫米,将额叶 ~3 毫米暴露到前囟,以暴露额后缝合线的一部分。切除头皮,露出两侧颞肌的初始部分(图3)。
- 去除任何残留的皮下结缔组织,使颅骨清洁干燥,以便应用刺激电极。
- 在与颅骨接触的电极一侧涂上导电凝胶或糊状物,并用手术强力胶将电极固定在边缘的间歇点。
注意:不要让导电凝胶干扰手术强力胶,以便更好地与颅骨表面粘合。电极的外表面也可以使用手术强力胶绝缘(如果在生存手术期间闭合,则与头皮绝缘)。 - 使用商用扁平电极,或使用直径为 100 μm(焊接到板上)的绝缘线和根据头骨大小切割的 1 mm x 3 mm 柔性绝缘(在一个表面上)铜板创建内部电极。
- 在不干扰电极的情况下,将利多卡因糊剂涂抹在两侧的颞肌和头皮上,以减少肌肉和周围神经的激活。
- 一旦颅外刺激电极在颅骨两侧两侧(前囟和λ之间)横向4 mm就位,在中线每侧2 mm处为玻璃电极钻两个0.5 mm的毛刺孔,彼此相距4 mm,与矢状缝合线正交(图1)。用无菌矿物油填充这些毛刺孔,以防止电流从颅外电极进入颅骨。
- 如果需要特定实验诱发扩散性凹陷(即钾诱导的扩散性抑制 [K+-SD]),请在颅骨右侧添加第三个 0.5 mm 毛刺孔 ~1.5 mm 喙部至冠状缝合线,~1 mm 外侧至额缝线。用生理盐水填充这个毛刺孔,以便以后施用 1 M KCl 以诱导 K+-SD。
- 在放置毛刺孔之前(并与放置在盐水浴中的相同电极进行比较)和放置毛刺孔后测试颅外刺激电极的阻抗,以验证毛刺孔不会干扰流入大脑的电流(即,确保电阻不变)。
注意: 阻抗测量由刺激装置直接提供。通常,我们发现无论毛刺孔和玻璃微电极如何,整个系统阻抗(即从颅外电极穿过颅骨/脑通路,通常为 ~3 KΩ)都相对恒定,这表明通过毛刺孔直接泄漏到大脑的电流最小。 - 以类似的方式放置用于慢性刺激的慢性经颅刺激电极。在这种情况下,将电极的外表面绝缘,闭合头皮,然后将绝缘线穿过头皮或将它们连接到头骨的固定头级中。
4.生理过程
- 从实验的生理方面开始,一旦动物为非存活的生理实验做好了充分的准备。保持足够的麻醉水平,以适应自主呼吸和足够的脉搏血氧、呼吸和脉搏水平。
- 通过以下两种方法之一测量颅外刺激产生的 CBF。
- 将鼠标置于带有或不带有颅内记录电极的激光散斑成像装置下,以测量刺激发作期间的颅内电场(图3)。
- 将动物转移到生理制剂中,用于放置双侧激光多普勒探头和颅内电极,以测量刺激发作期间的颅内电场(图1)。
5. 双侧激光多普勒电极和玻璃电极的放置
- 将动物转移到显微镜台上,用于应用双侧激光多普勒探针。将探头放在双侧毛刺孔和冠状缝合线之间的颅骨表面顶部(图1)。
- 用0.2M NaCl填充拉动的玻璃微电极(~0.1μM,2-6MΩ阻抗),并使用显微操纵器将它们放入横向放置在矢状缝合线3,14的两个毛刺孔中(图1)。
注意:这些毛刺孔位于两个对称的颅外刺激电极之间(图1)。 - 一旦插入大脑,确保这些玻璃微电极在大脑皮层内~1毫米。在各种对称深度下执行深度剖面图。用无菌矿物油重新填充毛刺孔,以绝缘该路径以防电流流动。
6. 经颅交流电刺激(tACS)或经颅直流电刺激(tDCS)的刺激程序和强度测量
- 使用具有至少四个通道(采样率为1 KHz)的数字化系统和软件记录来自颅骨上的双激光多普勒探头和两个颅内微电极输出(使用带头台的直流放大器记录)的连续数据。一旦在足够稳定的基线持续时间(即 >10 分钟)内记录了所有值,就测试颅外刺激。
注: 图 4 显示了四个通道的示例,其中两个颅内记录电极位于上通道,CBF 响应位于下通道。 - 在各种振幅(即,20-30 s,0.5-2.0 mA,在可耐受范围内)施加短暂的开/关刺激,以获得刺激前后的清晰基线(图4)。使用提供恒定电流的商用人体兼容刺激装置在两侧的两个颅骨tACS电极之间施加刺激(图1)。
- 密切观察小鼠的肌肉抽搐或对tACS的其他反应,例如脉搏或呼吸的变化,以创建耐受性上限(通常为~2mA)。
- 继续用刺激周期监测电极上的阻抗,以确保这是恒定的。
- 向前毛刺孔14 中加入少量(2-3μL)1M KCl以诱导自发的K + -SD事件。这些产生较大的 CBF 响应以及 K+-SD 诱导的 CBF 响应与 CBF 响应之间的相互作用。估计 tACS CBF 反应,在 SD 发生之前和之后应用 tACS 刺激。
- 在实验结束时,通过过量的异氟烷(5%)进行安乐死,然后在呼吸和心跳停止后将其斩首。
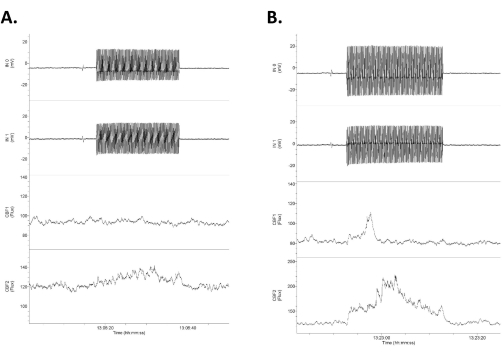
图 4:数据显示响应低强度 tACS 的四个原始数据通道。 数据排列在上面的两行作为颅内直接直流电记录(标记为输入 1 [IN0] 和输入 2 [IN1]),下两行作为脑血流的双侧激光多普勒记录。请注意,右(上)和左(下)电血流和脑血流迹线之间的响应是不对称的。(A) 对 1.2 mV/mm 20 s 刺激 (0.75 mA) 的反应很小(血流量增加 16%)。(B) 对 1.4 mV/mm 刺激 (1.0 mA) 的反应更大(血流量增加 21%)。缩写:tACS=经颅交流电刺激。 请点击这里查看此图的较大版本.
7.电场的计算
- 使用记录的两个正弦波的半波(一个周期)的差异(图4中的上两条迹线)测量两个颅内电极输出的差异。将该差值 (mV) 除以两个电极之间的距离(mm,此处为 ~4 mm,但在每种情况下直接测量)得出场强 (mV/mm)3,6。
结果
代表性结果如图4、图5和图6所示。图 4 显示了四个通道的示例,其中两个颅内记录电极位于上通道,CBF 响应位于下通道。tACS在颅骨上是对称的,但一般来说,对于施加的交流电流,颅内视野响应略有不对称,一侧的响应比另一侧大(图4)。CBF对tACS电刺激3的反应在较高
讨论
该协议侧重于 CBF 反应的体内麻醉测量,作为估计大脑对 tES14 反应的生物标志物。tES 反应的长期生物标志物包括组织学治疗效果,例如预防或改变淀粉样斑块的形成(即,在几种 AD 模型中以 40 Hz 进行伽马刺激)16,17,18,19,但短期生物标志物也有助于估计即时生理效应和计算剂量反应?...
披露声明
作者没有利益冲突需要声明。
致谢
这项研究得到了以下赠款(对 D.A.T.)的支持:NIA RO1 AG074999、NIA R21AG051103、VA I21RX002223 和 VA I21 BX003023。
材料
| Name | Company | Catalog Number | Comments |
| Alcohol pads | HenryShein | 112-6131 | |
| Baby mineral oil | Johnson & Johnson | ||
| BD 1 mL syringe | Becton Dikinson | REF 305699 | |
| C3 Flat Surface Electrodes | Neuronexus | ||
| C57BI mice | from NIH colonies | ||
| Copper skull electrods | In house preparation | ||
| Digidata 1440, Clampex | Axon Instruments | ||
| Dumont #5 forceps | FST | #5 | |
| Dumont #7 forceps curved | Dumont | RS-5047 | |
| Eye ointment | Major | LubiFresh P.M. NDC-0904-6488-38 | |
| Flaming/Brown micropipette puller | Sutter instrument Co. | Model P-87 | |
| Forceps 11.5 cm slight curve serrated | Roboz | RS-8254 | |
| Intramedic needle 23 G | Becton Dikinson | REF 427565 | |
| KCl 1 M | In house preparation | ||
| Laser Doppler Probes | Moor Instruments | 0.46 mm laser doppler probes | |
| Laser Speckle Imaging Device | RWD | RFLSI-ZW | |
| Micro curette 13 cm | FST | 10080-05 | |
| Micro Dissecting Scissors, 11.5 cm | Roboz | RS-5914 | |
| Mouse anesthesia fixation | Stoelting | ||
| Neuroconn-DS | Neurocare | DC-Stimulator Plus | |
| PhysioSuite Monitoring | Kent Scientific | ||
| Q-tips | Fisherbrand | 22363167 | |
| Saline 0.9% NaCl solution | Baxter | 281322 | |
| Sensicam QE | PCO Instruments | ||
| Software | Axon Instruments Clampex | ||
| Surgical glue | Covetrus | 31477 | |
| Surgical tape | 3M Transpore | T9784 |
参考文献
- Bestmann, S., Walsh, V. Transcranial electrical stimulation. Current Biology. 27 (23), R1258-R1262 (2017).
- Bikson, M., et al. Rigor and reproducibility in research with transcranial electrical stimulation: An NIMH-sponsored workshop. Brain Stimulation. 11 (3), 465-480 (2018).
- Turner, D. A., Degan, S., Galeffi, F., Schmidt, S., Peterchev, A. V. Rapid, dose-dependent enhancement of cerebral blood flow by transcranial AC stimulation in mouse. Brain Stimulation. 14 (1), 80-87 (2020).
- Shah, S., Chhatbar, P. Y., Feld, J. A., Feng, W. Integrating tDCS into routine inpatient rehabilitation practice to boost post-stroke recovery. Brain Stimulation. 13 (4), 953-954 (2020).
- Voroslakos, M., et al. Direct effects of transcranial electric stimulation on brain circuits in rats and humans. Nature Communications. 9 (1), 483 (2018).
- Alekseichuk, I., Mantell, K., Shirinpour, S., Opitz, A. Comparative modeling of transcranial magnetic and electric stimulation in mouse, monkey, and human. Neuroimage. 194, 136-148 (2019).
- Tavakoli, A. V., Yun, K. Transcranial alternating current stimulation (tACS) mechanisms and protocols. Frontiers in Cellular Neuroscience. 11, 214 (2017).
- Yavari, F., Jamil, A., Mosayebi Samani, M., Vidor, L. P., Nitsche, M. A. Basic and functional effects of transcranial electrical stimulation (tES)-An introduction. Neuroscience and Biobehavioral Reviews. 85, 81-92 (2018).
- Wachter, D., et al. Transcranial direct current stimulation induces polarity-specific changes of cortical blood perfusion in the rat. Experimental Neurology. 227 (2), 322-327 (2011).
- Han, C. H., et al. Hemodynamic responses in rat brain during transcranial direct current stimulation: A functional near-infrared spectroscopy study. Biomedical Optics Express. 5 (6), 1812-1821 (2014).
- Ayata, C., Lauritzen, M. Spreading depression, spreading depolarizations, and the cerebral vasculature. Physiological Reviews. 95 (3), 953-993 (2015).
- Berenyi, A., Belluscio, M., Mao, D., Buzsaki, G. Closed-loop control of epilepsy by transcranial electrical stimulation. Science. 337 (6095), 735-737 (2012).
- Hoang, K. B., Cassar, I. R., Grill, W. M., Turner, D. A. Biomarkers and stimulation algorithms for adaptive brain stimulation. Frontiers in Neuroscience. 11, 564 (2017).
- Turner, D., A, D. S., Hoffmann, U., Galleffi, F., Colton, C. A. CVN-AD Alzheimer's mice show premature reduction in neurovascular coupling in response to spreading depression and anoxia compared to aged controls. Alzheimer's and Dementia. 17 (7), 1109-1120 (2021).
- Colton, C. A., et al. mNos2 deletion and human NOS2 replacement in Alzheimer disease models. Journal of Neuropathology and Experimental Neurology. 73 (8), 752-769 (2014).
- Castano-Prat, P., et al. Altered slow (<1 Hz) and fast (beta and gamma) neocortical oscillations in the 3xTg-AD mouse model of Alzheimer's disease under anesthesia. Neurobiology of Aging. 79, 142-151 (2019).
- Etter, G., et al. Optogenetic gamma stimulation rescues memory impairments in an Alzheimer's disease mouse model. Nature Communications. 10 (1), 5322 (2019).
- Iaccarino, H. F., et al. Gamma frequency entrainment attenuates amyloid load and modifies microglia. Nature. 540 (7632), 230-235 (2016).
- Martorell, A. J., et al. Multi-sensory gamma stimulation ameliorates Alzheimer's-associated pathology and improves cognition. Cell. 177 (2), 256-271 (2019).
- Dawson, J., et al. Vagus nerve stimulation paired with rehabilitation for upper limb motor function after ischaemic stroke (VNS-REHAB): A randomised, blinded, pivotal, device trial. Lancet. 397 (10284), 1545-1553 (2021).
- Hacker, M. L., et al. Deep brain stimulation in early-stage Parkinson disease: Five-year outcomes. Neurology. 95 (4), e393-e401 (2020).
- Duun-Henriksen, J., et al. A new era in electroencephalographic monitoring? Subscalp devices for ultra-long-term recordings. Epilepsia. 61 (9), 1805-1817 (2020).
- Haneef, Z., et al. Sub-scalp electroencephalography: A next-generation technique to study human neurophysiology. Clinical Neurophysiology. 141, 77-87 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。