Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mise en place d’électrodes de stimulation extracrânienne et mesure du débit sanguin cérébral et des champs électriques intracrâniens chez des souris anesthésiées
Dans cet article
Résumé
Nous décrivons un protocole d’évaluation des courbes dose-réponse pour la stimulation extracrânienne en termes de mesures du champ électrique cérébral et d’un biomarqueur-flux sanguin cérébral pertinent. Étant donné que ce protocole implique la mise en place invasive d’électrodes dans le cerveau, une anesthésie générale est nécessaire, la respiration spontanée étant préférée aux respirations contrôlées.
Résumé
La détection des réponses du flux sanguin cérébral (CBF) à diverses formes d’activation neuronale est essentielle pour comprendre le fonctionnement dynamique du cerveau et les variations de l’approvisionnement en substrat du cerveau. Cet article décrit un protocole de mesure des réponses CBF à la stimulation transcrânienne par courant alternatif (tACS). Les courbes dose-réponse sont estimées à la fois à partir de la variation du CBF survenant avec le tACS (mA) et du champ électrique intracrânien (mV/mm). Nous estimons le champ électrique intracrânien en fonction des différentes amplitudes mesurées par des microélectrodes en verre de chaque côté du cerveau. Dans cet article, nous décrivons le dispositif expérimental, qui implique l’utilisation de sondes Doppler laser bilatérales (LD) ou d’imagerie laser par chatoiement (LSI) pour mesurer le CBF ; Par conséquent, cette configuration nécessite une anesthésie pour le placement et la stabilité de l’électrode. Nous présentons une corrélation entre la réponse CBF et le courant en fonction de l’âge, montrant une réponse significativement plus importante à des courants plus élevés (1,5 mA et 2,0 mA) chez les jeunes animaux témoins (12-14 semaines) par rapport aux animaux plus âgés (28-32 semaines) (p < 0,005 différence). Nous démontrons également une réponse significative du CBF à des intensités de champ électrique <5 mV/mm, ce qui est une considération importante pour d’éventuelles études humaines. Ces réponses CBF sont également fortement influencées par l’utilisation de l’anesthésie par rapport aux animaux éveillés, le contrôle de la respiration (c’est-à-dire la respiration intubée par rapport à la respiration spontanée), les facteurs systémiques (c’est-à-dire le CO2) et la conduction locale dans les vaisseaux sanguins, qui est médiée par les péricytes et les cellules endothéliales. De même, des techniques d’imagerie et d’enregistrement plus détaillées peuvent limiter la taille du champ de l’ensemble du cerveau à une petite région. Nous décrivons l’utilisation d’électrodes extracrâniennes pour l’application de la stimulation tACS, y compris des conceptions d’électrodes artisanales et commerciales pour les rongeurs, la mesure simultanée du CBF et du champ électrique intracrânien à l’aide d’électrodes d’enregistrement CC bilatérales en verre, et les approches d’imagerie. Nous appliquons actuellement ces techniques pour mettre en œuvre un format en boucle fermée afin d’augmenter le CBF dans des modèles animaux de la maladie d’Alzheimer et des accidents vasculaires cérébraux.
Introduction
La stimulation électrique transcrânienne (tES ; avec stimulation par onde sinusoïdale, tACS) est une approche courante, externe et non invasive de la neuromodulation cérébrale 1,2. Précédemment, nous avons émis l’hypothèse qu’à certaines doses, les tES (et en particulier les tACS) peuvent augmenter le flux sanguin cérébral (CBF) dans les régions cérébrales sous-jacentes3. De plus, il peut exister une relation dose-réponse entre le courant externe appliqué ou le champ électrique intracrânien et les réponses CBF qui en résultent. Cependant, la plupart des protocoles de stimulation clinique se sont concentrés sur un niveau maximal de stimulation cutanée confortable (c’est-à-dire ~ 2 mA) pendant des périodes de temps programmées (c’est-à-dire 30-45 min) en tant que protocole de traitement 4,5. Chez les rongeurs, il est possible d’utiliser des électrodes cérébrales extracrâniennes invasives appliquées directement sur le crâne pour étudier les champs électriques dans le cerveau induits par tES6. Par conséquent, l’objectif de cette approche est de déterminer les effets de l’intensité de la tACS à des fréquences pertinentes sur les changements du CBF en termes de relation dose-réponse. Cette courbe dose-réponse est basée sur un biomarqueur physiologique à court terme - mesures directes du CBF - en relation avec le champ électrique imposé au cerveau3. Nous avons précédemment montré qu’à des amplitudes plus importantes, généralement au-delà de la gamme des champs électriques dans le cerveau induits cliniquement par le tACS, il existe une corrélation quasi linéaire entre le champ électrique induit et le CBF dans le cortex3. Cependant, la stimulation à plus petit champ (c.-à-d. une intensité de 1 à 5 mV/mm) peut être plus pertinente et réalisable pour une utilisation chez l’homme ; par conséquent, nous avons modifié nos techniques pour détecter les plus petits changements de CBF.
Cet article décrit un protocole permettant d’analyser les effets des courants sinusoïdaux alternatifs tES (tACS) à faible intensité de champ sur le CBF (c’est-à-dire un courant de 0,5 à 2,0 mA, un champ électrique de 1 à 5 mV/mm), qui peuvent être tolérés par des rongeurs éveillés5. Ce protocole implique l’utilisation d’une nouvelle imagerie laser par chatoiement pendant le tACS, ainsi que de deux électrodes intracrâniennes en verre, pour déterminer à la fois la propagation du tACS actif dans le cerveau (telle que surveillée par le CBF) et l’intensité du champ électrique intracrânien, qui est montrée à la fois sous forme de diagramme et de photographie expérimentale réelle (Figure 1). Il existe de nombreux effets physiologiques possibles de la tES dans le cerveau, notamment la modulation neuronale directe, la plasticité neuronale et l’activation des astrocytes 7,8. Bien que le CBF ait été mesuré avec la tDCS 9,10, ces mesures étaient lentes, indirectes et insuffisantes pour évaluer la fonction dose-réponse dans le cerveau. Par conséquent, en utilisant des biomarqueurs à court terme appropriés (c.-à-d. CBF, champs électriques) et des séquences marche/arrêt rapides de tACS, nous pouvons maintenant estimer la fonction dose-réponse avec plus de précision. De plus, nous pouvons appliquer différentes techniques pour mesurer le CBF, y compris les sondes Doppler laser focales (LD) et l’imagerie laser par chatoiement (LSI) avec des régions d’intérêt définies.
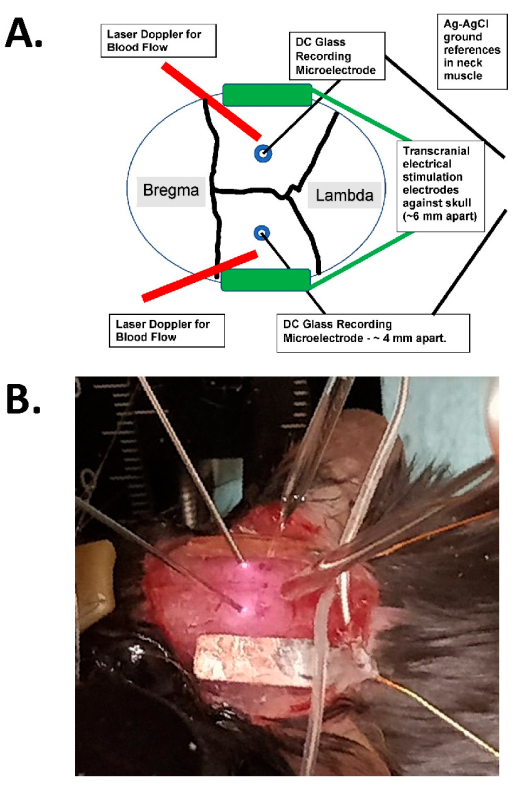
Figure 1 : Schéma de stimulation transcrânienne et exemple photographique. (A) Schéma de l’installation de stimulation transcrânienne. Le schéma montre un crâne de souris avec des sutures coronales et sagittales. Les électrodes transcrâniennes sont placées latéralement et symétriquement sur le crâne et sont montées avec de la colle chirurgicale et de la pâte conductrice entre les électrodes et le crâne. Ces électrodes sont connectées à un dispositif de stimulation à courant constant compatible avec l’homme, qui peut spécifier la fréquence, l’amplitude et la durée de la stimulation. Pour l’évaluation des champs électriques intracrâniens, des électrodes de verre bilatérales (~ 2 MΩ) sont placées dans le cortex cérébral (c’est-à-dire à moins de 1 mm de la face interne du crâne à travers de petits trous de bavures), et celles-ci sont scellées avec de l’huile minérale et ont des motifs AgCl dans le muscle du cou (représentés par des fils plus gros au centre enfouis dans le tissu sous-cutané du cou). Ces électrodes de verre sont connectées à un amplificateur CC et leurs sorties sont enregistrées par un numériseur avec au moins quatre canaux. Des sondes Doppler laser bilatérales sont également placées sur le crâne pour les enregistrements. L’ensemble du crâne est également photographié à l’aide d’un dispositif d’imagerie par chatoiement laser ou d’une caméra refroidie à haute résolution (au moins 1 024 x 1 024 pixels, profondeur de pixel de 12 à 14 bits) pour la détection du signal optique intrinsèque. La fréquence isobestique de l’hémoglobine est généralement choisie (c’est-à-dire 562 nm) pour l’éclairage de l’imagerie du flux sanguin. (B) Une image en gros plan d’une expérience réelle, montrant les sondes Doppler laser bilatérales (à gauche), les microélectrodes d’enregistrement intracrâniennes (bilatérales) en verre placées à travers les trous de bavures, et avec les électrodes de stimulation tACS latéralement. Abréviation : tACS = stimulation transcrânienne à courant alternatif. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Afin d’évaluer les mécanismes, nous pouvons également interroger les interactions avec d’autres processus physiologiques qui modifient également le CBF, tels que la dépolarisation par propagation induite par K+ 11. De plus, plutôt que de programmer des séances à des heures régulières, il est également possible de développer un système en boucle fermée basé sur des biomarqueurs supplémentaires pour une variété de maladies, comme cela a été proposé pour le traitement de l’épilepsie12 (c’est-à-dire les dispositifs cliniques Neuropace). Par exemple, la stimulation cérébrale en boucle fermée pour la maladie de Parkinson est généralement basée sur les potentiels de champ local (LFP) intrinsèques et anormaux intrinsèques à cette maladie en l’absence d’une quantité suffisante de dopamine (généralement des LFP à bande β)13.
Protocole
Toutes les procédures relatives aux animaux ont été approuvées par le Comité institutionnel de protection et d’utilisation des animaux de l’Université Duke ou par l’autorité locale équivalente réglementant la recherche sur les animaux. Consultez le tableau des matériaux pour plus de détails sur tous les matériaux, instruments et équipements utilisés dans ce protocole.
1. Préparation de l’instrument
- Assurez-vous que tous les articles et instruments chirurgicaux nécessaires sont en place (Figure 2) : solution de nettoyage du cuir chevelu (tampons imbibés d’alcool), ruban adhésif, pinces, ciseaux et perceuse pour placer les petits trous de bavure (0,5 mm).
- Préparez les électrodes de surface extracrânienne pour l’application sur le crâne et assurez-vous que toute colle chirurgicale a été nettoyée si elles ont été utilisées précédemment.
- Vérifiez l’impédance de ces électrodes tACS directement avant de les appliquer sur le crâne. Pour cela, utilisez la fonction de mesure intégrée du stimulateur tACS avec les deux électrodes placées dans un bain salin.
REMARQUE : L’impédance préférée est de <5 KΩ par paire d’électrodes pour permettre à un courant suffisant de traverser le crâne. Le stimulateur vérifie l’impédance avant de délivrer des impulsions à courant constant et donne directement la valeur.
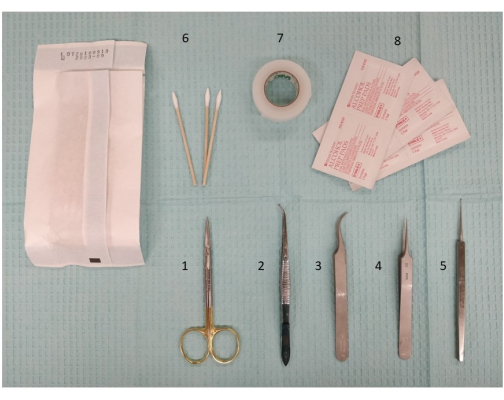
Figure 2 : Photographie de l’instrumentation requise, y compris les instruments de dissection et les ciseaux, pour préparer la stimulation extracrânienne. 1. Ciseaux de micro-dissection, 11,5 cm ; 2. Pince de 11,5 cm, légèrement courbée, dentelée ; 3. Pince Dumont #7, courbée ; 4. Pince Dumont #5 ; 5. Micro curette, 13 cm ; 6. Cotons-tiges ; 7. Ruban chirurgical ; 8. Tampons d’alcool. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Préparation de l’animal à la chirurgie
NOTE : Pour ces expériences, nous avons utilisé 14 souris témoins C57BL/6 âgées de 12 à 33 semaines, dont cinq mâles et neuf femelles.
- Anesthésier l’animal dans une chambre d’induction avec de l’isoflurane à 30 % d’O2 à ~1,5 L/min, avec ~4 % initialement pour induire et ~1,25 %-1,5 % pour maintenir à un niveau d’anesthésie avec respiration spontanée et suffisant pour éliminer la réponse de pincement de la queue.
- Transférer l’animal dans le cadre stéréotaxique après l’induction, puis fixer la tête dans le cône nasal et les barres auriculaires pour l’application ultérieure de l’électrode et la procédure de trou de bavure (Figure 1 et Figure 3).
- Connectez le cône de nez du cadre stéréotaxique au vaporisateur via une entrée et une sortie pour éliminer tout résidu d’isoflurane à travers un système de récupération (par exemple, du charbon de bois ou un aspirateur). Assurez-vous qu’il n’y a pas de fuites d’air du cône nasal, à la fois pour maintenir le niveau d’anesthésie avec l’isofluorane et pour éviter les fuites accidentelles dans l’air ambiant (Figure 3).
- Vérifiez la position de la souris dans le cadre stéréotaxique, y compris la position du cône nasal, pour permettre une respiration spontanée sans intubation, ainsi qu’une récupération appropriée de l’anesthésie et un balayage pour protéger le personnel de recherche (Figure 3).
- Placez les sondes pour mesurer le pouls, la saturation en oxygène du pouls (OX de pouls), la pression artérielle et la température sur l’animal ; Assurez-vous que l’oxygénation minimale des impulsions est de 90 % et que l’impulsion est de >450/min (la limite inférieure de l’alarme est indiquée comme étant de 380 impulsions/min). Enregistrez ces paramètres pendant la procédure à intervalles réguliers ou en continu, selon le système d’enregistrement (Figure 3).
- Avant de commencer la procédure, vérifiez le niveau de sédation de l’animal en utilisant (par exemple) un pincement des orteils pour vérifier les réflexes. S’il n’y a pas de réflexe, le niveau de sédation est optimal, tant que l’animal maintient une respiration spontanée et une oxygénation adéquate du pouls. S’il y a un réflexe, augmentez l’administration d’isoflurane pour approfondir le niveau de l’anesthésie, puis vérifiez à nouveau le réflexe. Observez et surveillez en permanence la fréquence respiratoire de l’animal et ajustez l’administration d’isoflurane en conséquence.
- Rasez les poils du cuir chevelu ou épilez-les avec de la crème dépilatoire (nettoyez les résidus de crème avec des passages de tampons imbibés d’alcool).
- Appliquez une pommade pour les yeux, puis nettoyez le cuir chevelu de manière aseptique avec trois passages d’iode et d’alcool avant l’excision à l’aide de ciseaux.

Figure 3 : Une image de l’animal dans le cadre stéréotaxique, avec le crâne exposé et seules les électrodes du stimulateur tACS en place (avant la mise en place du trou de bavure). Notez l’appareil de mesure de la pression artérielle autour de la queue et l’oxymètre de pouls sur la patte, avec la lecture à gauche. Il y a des tubes de piégeage pour l’isoflurane autour du cône nasal. Abréviation : tACS = stimulation transcrânienne à courant alternatif. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Intervention chirurgicale : Application des électrodes de stimulation et réalisation des trous de bavure
- Pour une étude terminale, retirez le cuir chevelu à l’aide de ciseaux chirurgicaux et exposez le crâne à ~3 mm de la suture lambdoïde caudalement et ~3 mm frontal au bregma pour exposer une partie de la suture frontale postérieure. Exciser le cuir chevelu pariétalement pour exposer la partie initiale du muscle temporal des deux côtés (Figure 3).
- Retirez tous les tissus conjonctifs sous-cutanés résiduels afin que le crâne soit propre et sec pour l’application des électrodes de stimulation.
- Appliquez un gel ou une pâte conductrice sur le côté des électrodes qui seront en contact avec le crâne et fixez les électrodes avec de la superglue chirurgicale autour du bord à des endroits intermittents.
REMARQUE : Ne laissez pas le gel conducteur interférer avec la superglue chirurgicale afin de permettre une meilleure adhérence à la surface du crâne. La surface extérieure des électrodes peut également être isolée (du cuir chevelu si celui-ci est fermé lors d’une chirurgie de survie) à l’aide de superglue chirurgicale. - Utilisez soit des électrodes plates commerciales, soit créez des électrodes maison à l’aide d’un fil isolé d’un diamètre de 100 μm (soudé à la plaque) et d’une plaque de cuivre flexible et isolée (sur une surface) de 1 mm x 3 mm coupée en fonction de la taille du crâne.
- Appliquez la pâte de lidocaïne sur le muscle temporal et le cuir chevelu des deux côtés sans perturber les électrodes pour réduire l’activation des muscles et des nerfs périphériques.
- Une fois que les électrodes de stimulation extracrânienne sont en place à 4 mm latéralement de chaque côté du crâne (entre le bregma et le lambda), percez deux trous de bavure de 0,5 mm pour les électrodes de verre à 2 mm de chaque côté de la ligne médiane, à 4 mm l’une de l’autre, orthogonales à la suture sagittale (Figure 1). Remplissez ces trous de bavure avec de l’huile minérale stérile pour empêcher le courant de pénétrer dans le crâne à partir des électrodes extracrâniennes.
- Si vous souhaitez qu’une expérience particulière induise une dépression d’étalement (c’est-à-dire une dépression d’étalement induite par le potassium [K+-SD]), ajoutez, sur le côté droit du crâne, un troisième trou de bavure de 0,5 mm ~1,5 mm rostral à la suture coronale et ~1 mm latéralement à la suture frontale postérieure. Remplissez ce trou de bavure avec du sérum physiologique pour une application ultérieure de 1 M KCl afin d’induire K+-SD.
- Testez l’impédance des électrodes de stimulation extracrânienne avant la mise en place du trou de bavure (et par rapport aux mêmes électrodes placées dans un bain salin) et après la mise en place du trou de bavure pour vérifier que les trous de bavure n’interfèrent pas avec le flux de courant dans le cerveau (c’est-à-dire assurez-vous que la résistance est inchangée).
REMARQUE : La mesure de l’impédance est fournie directement par le dispositif de stimulation. En général, nous avons constaté que l’impédance globale du système (c’est-à-dire des électrodes extracrâniennes à travers la voie crâne/cerveau, généralement ~3 KΩ) est relativement constante quels que soient les trous de bavure et les microélectrodes en verre, ce qui indique qu’il y a une fuite de courant minimale directement dans le cerveau à travers les trous de bavure. - Placez les électrodes de stimulation transcrânienne chronique pour la stimulation chronique de la même manière. Dans ce cas, isolez la surface externe des électrodes, fermez le cuir chevelu et creusez un tunnel pour les fils isolés à travers le cuir chevelu ou faites-les passer dans un étage de tête fixe monté sur le crâne.
4. Procédure physiologique
- Commencez par les aspects physiologiques de l’expérience, une fois que l’animal est complètement préparé pour l’expérience physiologique de non-survie. Maintenir un niveau d’anesthésie suffisant pour une respiration spontanée et un taux adéquat d’oxymètre de pouls, de voies respiratoires et de pouls.
- Mesurez le CBF résultant de la stimulation extracrânienne par l’une des deux méthodes suivantes.
- Placez la souris sous un appareil d’imagerie par chatoiement laser avec ou sans électrodes d’enregistrement intracrânienne pour mesurer le champ électrique intracrânien pendant les épisodes de stimulation (Figure 3).
- Transférer l’animal dans une préparation physiologique pour la mise en place de sondes Doppler laser bilatérales et d’électrodes intracrâniennes afin de mesurer le champ électrique intracrânien pendant les épisodes de stimulation (Figure 1).
5. Placement d’électrodes laser bilatérales Doppler et de verre
- Transférer l’animal sur une platine de microscope pour l’application de sondes Doppler laser bilatérales. Placez les sondes sur le dessus de la surface du crâne entre les trous de bavure bilatéraux et la suture coronale (Figure 1).
- Remplir des microélectrodes en verre effiloché (~0,1 μM, impédance de 2 à 6 MΩ) avec 0,2 M de NaCl et les placer à l’aide d’un micromanipulateur dans les deux trous de bavure placés latéralement à la suture sagittale 3,14 (Figure 1).
REMARQUE : Ces trous de bavure se trouvent entre les deux électrodes de stimulation extracrânienne symétriques (Figure 1). - Une fois insérées dans le cerveau, assurez-vous que ces microélectrodes en verre sont à ~1 mm dans le cortex cérébral. Effectuez des profils de profondeur à différentes profondeurs symétriques. Remplissez les trous de bavure avec de l’huile minérale stérile pour isoler cette voie pour la circulation du courant.
6. Procédure de stimulation et mesure de l’intensité de la stimulation transcrânienne à courant alternatif (tACS) ou de la stimulation transcrânienne à courant continu (tDCS)
- Enregistrez les données continues des deux sondes Doppler laser sur le crâne et des deux sorties de microélectrodes intracrâniennes (enregistrées à l’aide d’un amplificateur CC avec des têtes de scène) à l’aide d’un système de numérisation et d’un logiciel avec au moins quatre canaux (à une fréquence d’échantillonnage de 1 KHz). Une fois que toutes les valeurs ont été enregistrées sur une durée de référence suffisamment stable (c’est-à-dire >10 min), testez la stimulation extracrânienne.
REMARQUE : La figure 4 montre un exemple des quatre canaux avec les deux électrodes d’enregistrement intracrâniennes dans les canaux supérieurs et la réponse CBF dans les canaux inférieurs. - Appliquez de brèves périodes de stimulation marche/arrêt à différentes amplitudes (c.-à-d. 20 à 30 s, 0,5 à 2,0 mA, dans la plage tolérable) pour obtenir une ligne de base claire avant et après la stimulation (Figure 4). Appliquez la stimulation entre les deux électrodes tACS du crâne de chaque côté (Figure 1) à l’aide d’un dispositif de stimulation commercial compatible avec l’homme qui délivre un courant constant.
- Observez de près la souris pour détecter les contractions musculaires ou d’autres réponses au tACS, telles qu’un changement du pouls ou de la respiration, afin de créer une limite supérieure de tolérance (généralement ~ 2 mA).
- Continuez à surveiller l’impédance aux bornes des électrodes avec des époques de stimulation pour vous assurer qu’elle est constante.
- Ajouter une petite quantité (2-3 μL) de 1 M KCl dans le trou de fraise antérieur14 pour induire des événements spontanés K+-SD. Ceux-ci génèrent une réponse CBF importante et des interactions entre la réponse CBF induite par K+-SD et la réponse CBF. Estimez la réponse tACS CBF, en appliquant la stimulation tACS à la fois avant et après l’apparition de l’écart-type.
- À la fin de l’expérience, procéder à l’euthanasie par surdosage d’isoflurane (5%) puis décapiter une fois que les respirations et les battements cardiaques ont cessé.
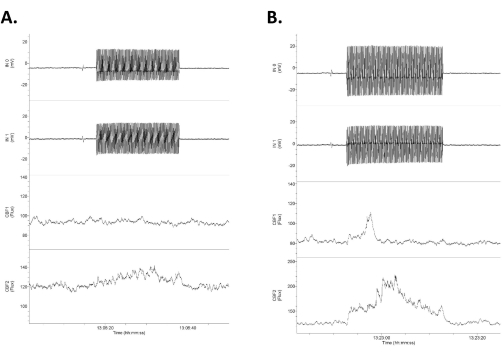
Figure 4 : Données montrant quatre canaux de données brutes en réponse à des tACS de faible intensité. Les données sont disposées avec les deux rangées supérieures en tant qu’enregistrements électriques intracrâniens et directs en courant continu (étiquetées comme entrée 1 [IN0] et entrée 2 [IN1]) et les deux rangées inférieures en tant qu’enregistrements Doppler laser bilatéraux du flux sanguin cérébral. Notez que les réponses sont asymétriques entre les traces de flux sanguin électrique et cérébral droite (supérieure) et gauche (inférieure). (A) Une petite réponse (augmentation de 16 % du flux sanguin) en réponse à un stimulus de 1,2 mV/mm 20 s (0,75 mA). (B) Une réponse plus importante (augmentation de 21 % du flux sanguin) en réponse à un stimulus de 1,4 mV/mm (1,0 mA). Abréviation : tACS = stimulation transcrânienne à courant alternatif. Veuillez cliquer ici pour voir une version agrandie de cette figure.
7. Calcul du champ électrique
- Mesurez la différence de sortie des deux électrodes intracrâniennes à l’aide de la différence de demi-onde (un cycle) des deux ondes sinusoïdales enregistrées (les deux traces supérieures de la figure 4). Divisez cette différence (mV) par la distance entre les deux électrodes (mm, ici ~4 mm mais mesurée directement dans chaque cas) pour obtenir l’intensité du champ (mV/mm)3,6.
Résultats
Des résultats représentatifs sont présentés à la figure 4, à la figure 5 et à la figure 6. La figure 4 montre un exemple des quatre canaux avec les deux électrodes d’enregistrement intracrâniennes sur les canaux supérieurs et les réponses CBF sur les canaux inférieurs. Le tACS est symétrique sur l’ensemble du crâne, mais en général, la réponse du champ intracrânien est légèremen...
Discussion
Ce protocole se concentre sur la mesure in vivo et anesthésiée de la réponse CBF en tant que biomarqueur pour estimer la réponse cérébrale à tES14. Les biomarqueurs à plus long terme de la réponse tES comprennent les effets histologiques du traitement, tels que la prévention ou les changements dans la formation de plaques amyloïdes (c.-à-d. avec une stimulation gamma à 40 Hz dans plusieurs modèles de MA)16,17,18,19
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Cette étude a été financée par les subventions suivantes (à D.A.T.) : NIA RO1 AG074999, NIA R21AG051103, VA I21RX002223 et VA I21 BX003023.
matériels
| Name | Company | Catalog Number | Comments |
| Alcohol pads | HenryShein | 112-6131 | |
| Baby mineral oil | Johnson & Johnson | ||
| BD 1 mL syringe | Becton Dikinson | REF 305699 | |
| C3 Flat Surface Electrodes | Neuronexus | ||
| C57BI mice | from NIH colonies | ||
| Copper skull electrods | In house preparation | ||
| Digidata 1440, Clampex | Axon Instruments | ||
| Dumont #5 forceps | FST | #5 | |
| Dumont #7 forceps curved | Dumont | RS-5047 | |
| Eye ointment | Major | LubiFresh P.M. NDC-0904-6488-38 | |
| Flaming/Brown micropipette puller | Sutter instrument Co. | Model P-87 | |
| Forceps 11.5 cm slight curve serrated | Roboz | RS-8254 | |
| Intramedic needle 23 G | Becton Dikinson | REF 427565 | |
| KCl 1 M | In house preparation | ||
| Laser Doppler Probes | Moor Instruments | 0.46 mm laser doppler probes | |
| Laser Speckle Imaging Device | RWD | RFLSI-ZW | |
| Micro curette 13 cm | FST | 10080-05 | |
| Micro Dissecting Scissors, 11.5 cm | Roboz | RS-5914 | |
| Mouse anesthesia fixation | Stoelting | ||
| Neuroconn-DS | Neurocare | DC-Stimulator Plus | |
| PhysioSuite Monitoring | Kent Scientific | ||
| Q-tips | Fisherbrand | 22363167 | |
| Saline 0.9% NaCl solution | Baxter | 281322 | |
| Sensicam QE | PCO Instruments | ||
| Software | Axon Instruments Clampex | ||
| Surgical glue | Covetrus | 31477 | |
| Surgical tape | 3M Transpore | T9784 |
Références
- Bestmann, S., Walsh, V. Transcranial electrical stimulation. Current Biology. 27 (23), R1258-R1262 (2017).
- Bikson, M., et al. Rigor and reproducibility in research with transcranial electrical stimulation: An NIMH-sponsored workshop. Brain Stimulation. 11 (3), 465-480 (2018).
- Turner, D. A., Degan, S., Galeffi, F., Schmidt, S., Peterchev, A. V. Rapid, dose-dependent enhancement of cerebral blood flow by transcranial AC stimulation in mouse. Brain Stimulation. 14 (1), 80-87 (2020).
- Shah, S., Chhatbar, P. Y., Feld, J. A., Feng, W. Integrating tDCS into routine inpatient rehabilitation practice to boost post-stroke recovery. Brain Stimulation. 13 (4), 953-954 (2020).
- Voroslakos, M., et al. Direct effects of transcranial electric stimulation on brain circuits in rats and humans. Nature Communications. 9 (1), 483 (2018).
- Alekseichuk, I., Mantell, K., Shirinpour, S., Opitz, A. Comparative modeling of transcranial magnetic and electric stimulation in mouse, monkey, and human. Neuroimage. 194, 136-148 (2019).
- Tavakoli, A. V., Yun, K. Transcranial alternating current stimulation (tACS) mechanisms and protocols. Frontiers in Cellular Neuroscience. 11, 214 (2017).
- Yavari, F., Jamil, A., Mosayebi Samani, M., Vidor, L. P., Nitsche, M. A. Basic and functional effects of transcranial electrical stimulation (tES)-An introduction. Neuroscience and Biobehavioral Reviews. 85, 81-92 (2018).
- Wachter, D., et al. Transcranial direct current stimulation induces polarity-specific changes of cortical blood perfusion in the rat. Experimental Neurology. 227 (2), 322-327 (2011).
- Han, C. H., et al. Hemodynamic responses in rat brain during transcranial direct current stimulation: A functional near-infrared spectroscopy study. Biomedical Optics Express. 5 (6), 1812-1821 (2014).
- Ayata, C., Lauritzen, M. Spreading depression, spreading depolarizations, and the cerebral vasculature. Physiological Reviews. 95 (3), 953-993 (2015).
- Berenyi, A., Belluscio, M., Mao, D., Buzsaki, G. Closed-loop control of epilepsy by transcranial electrical stimulation. Science. 337 (6095), 735-737 (2012).
- Hoang, K. B., Cassar, I. R., Grill, W. M., Turner, D. A. Biomarkers and stimulation algorithms for adaptive brain stimulation. Frontiers in Neuroscience. 11, 564 (2017).
- Turner, D., A, D. S., Hoffmann, U., Galleffi, F., Colton, C. A. CVN-AD Alzheimer's mice show premature reduction in neurovascular coupling in response to spreading depression and anoxia compared to aged controls. Alzheimer's and Dementia. 17 (7), 1109-1120 (2021).
- Colton, C. A., et al. mNos2 deletion and human NOS2 replacement in Alzheimer disease models. Journal of Neuropathology and Experimental Neurology. 73 (8), 752-769 (2014).
- Castano-Prat, P., et al. Altered slow (<1 Hz) and fast (beta and gamma) neocortical oscillations in the 3xTg-AD mouse model of Alzheimer's disease under anesthesia. Neurobiology of Aging. 79, 142-151 (2019).
- Etter, G., et al. Optogenetic gamma stimulation rescues memory impairments in an Alzheimer's disease mouse model. Nature Communications. 10 (1), 5322 (2019).
- Iaccarino, H. F., et al. Gamma frequency entrainment attenuates amyloid load and modifies microglia. Nature. 540 (7632), 230-235 (2016).
- Martorell, A. J., et al. Multi-sensory gamma stimulation ameliorates Alzheimer's-associated pathology and improves cognition. Cell. 177 (2), 256-271 (2019).
- Dawson, J., et al. Vagus nerve stimulation paired with rehabilitation for upper limb motor function after ischaemic stroke (VNS-REHAB): A randomised, blinded, pivotal, device trial. Lancet. 397 (10284), 1545-1553 (2021).
- Hacker, M. L., et al. Deep brain stimulation in early-stage Parkinson disease: Five-year outcomes. Neurology. 95 (4), e393-e401 (2020).
- Duun-Henriksen, J., et al. A new era in electroencephalographic monitoring? Subscalp devices for ultra-long-term recordings. Epilepsia. 61 (9), 1805-1817 (2020).
- Haneef, Z., et al. Sub-scalp electroencephalography: A next-generation technique to study human neurophysiology. Clinical Neurophysiology. 141, 77-87 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon