Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Установка экстракраниальных стимулирующих электродов и измерение мозгового кровотока и внутричерепных электрических полей у мышей под наркозом
В этой статье
Резюме
Описан протокол оценки кривых «доза-реакция» при экстракраниальной стимуляции с точки зрения измерений электрического поля мозга и соответствующего биомаркера – мозгового кровотока. Поскольку этот протокол включает в себя инвазивное размещение электродов в головном мозге, необходима общая анестезия, при этом предпочтение отдается спонтанному дыханию, а не контролируемому дыханию.
Аннотация
Обнаружение ответов мозгового кровотока (КБФ) на различные формы активации нейронов имеет решающее значение для понимания динамической функции мозга и вариаций в снабжении мозга субстратом. В данной работе описан протокол измерения ответов КБФ на транскраниальную стимуляцию переменным током (тОКС). Кривые «доза-реакция» оцениваются как по изменению КБФ, происходящему при тОКС (мА), так и по внутричерепному электрическому полю (мВ/мм). Мы оцениваем внутричерепное электрическое поле на основе различных амплитуд, измеряемых стеклянными микроэлектродами в каждой стороне мозга. В этой статье мы описываем экспериментальную установку, которая включает в себя использование либо билатеральных лазерных допплеровских зондов (LD), либо лазерной спекл-визуализации (LSI) для измерения CBF; В результате, эта установка требует анестезии для установки и стабильности электрода. Мы представляем корреляцию между реакцией CBF и током в зависимости от возраста, показывая значительно больший отклик при более высоких токах (1,5 мА и 2,0 мА) у молодых контрольных животных (12-14 недель) по сравнению с более старыми животными (28-32 недели) (p < разница 0,005). Мы также продемонстрировали значительный отклик CBF при напряженности электрического поля <5 мВ/мм, что является важным фактором для возможных исследований на людях. На эти реакции CBF также сильно влияет использование анестезии по сравнению с бодрствующими животными, контроль дыхания (т.е. интубированное или спонтанное дыхание), системные факторы (например, CO2) и местная проводимость в кровеносных сосудах, которая опосредована перицитами и эндотелиальными клетками. Кроме того, более детальные методы визуализации/регистрации могут ограничить размер поля всего мозга только небольшой областью. Описано использование экстракраниальных электродов для применения стимуляции tACS, включая как самодельные, так и коммерческие конструкции электродов для грызунов, одновременное измерение КБВ и внутричерепного электрического поля с помощью двусторонних стеклянных регистрирующих электродов постоянного тока, а также подходы к визуализации. В настоящее время мы применяем эти методы для реализации формата замкнутого цикла для увеличения CBF на животных моделях болезни Альцгеймера и инсульта.
Введение
Транскраниальная электростимуляция (tES; с синусоидальной стимуляцией, tACS) является распространенным внешним, неинвазивным подходом к нейромодуляции головного мозга 1,2. Ранее мы предположили, что в определенных дозах tES (и особенно tACS) может увеличивать мозговой кровоток (CBF) в нижележащих областях мозга3. Кроме того, может существовать зависимость «доза-эффект» между внешним током или внутричерепным электрическим полем и результирующими реакциями КБФ. Тем не менее, большинство протоколов клинической стимуляции сосредоточены на максимально комфортном уровне стимуляции кожи (т.е. ~ 2 мА) в течение запланированных периодов времени (т.е. 30-45 мин) в качестве протокола лечения 4,5. У грызунов можно использовать инвазивные экстракраниальные электроды головного мозга, прикладываемые непосредственно к черепу, для исследования электрических полей в головном мозге, индуцированных tES6. Следовательно, целью данного подхода является определение влияния интенсивности ТСКС на соответствующих частотах на изменения КБВ с точки зрения соотношения доза-реакция. Эта кривая «доза-реакция» основана на краткосрочных физиологических биомаркерах — прямых измерениях CBF — по отношению к электрическому полю, воздействующему на мозг3. Ранее мы показали, что при больших амплитудах, как правило, за пределами диапазона электрических полей в мозге, индуцированных tACS клинически, существует почти линейная корреляция между индуцированным электрическим полем и CBF в коре3. Тем не менее, стимуляция меньшим полем (т.е. интенсивностью 1-5 мВ/мм) может быть более актуальной и осуществимой для использования у людей; Поэтому мы модифицировали наши методы для обнаружения небольших изменений CBF.
В данной работе описан протокол анализа влияния переменных токов tES с более низкой напряженностью поля (tACS) на НБВ (т.е. ток 0,5-2,0 мА, электрическое поле 1-5 мВ/мм), которые могут переноситься бодрствующими грызунами5. Этот протокол включает в себя использование новой лазерной спекл-визуализации во время tACS, а также двойных внутричерепных стеклянных электродов для определения как распространения активного tACS в головном мозге (контролируемого CBF), так и напряженности внутричерепного электрического поля, которое показано как в виде диаграммы, так и в виде фактической экспериментальной фотографии (рис. 1). Существует множество возможных физиологических эффектов tES в головном мозге, включая прямую модуляцию нейронов, нейронную пластичность и активацию астроцитов 7,8. Несмотря на то, что CBF был измерен с помощью tDCS 9,10, эти измерения были медленными, непрямыми и недостаточными для оценки функции «доза-реакция» в мозге. Таким образом, используя соответствующие краткосрочные биомаркеры (т.е. КБФ, электрические поля) и быстрые последовательности включения/выключения tACS, мы теперь можем более точно оценить функцию «доза-реакция». Кроме того, мы можем применять различные методы для измерения CBF, включая как фокальные лазерные допплеровские датчики (LD), так и лазерную спекл-визуализацию (LSI) с определенными областями интереса.
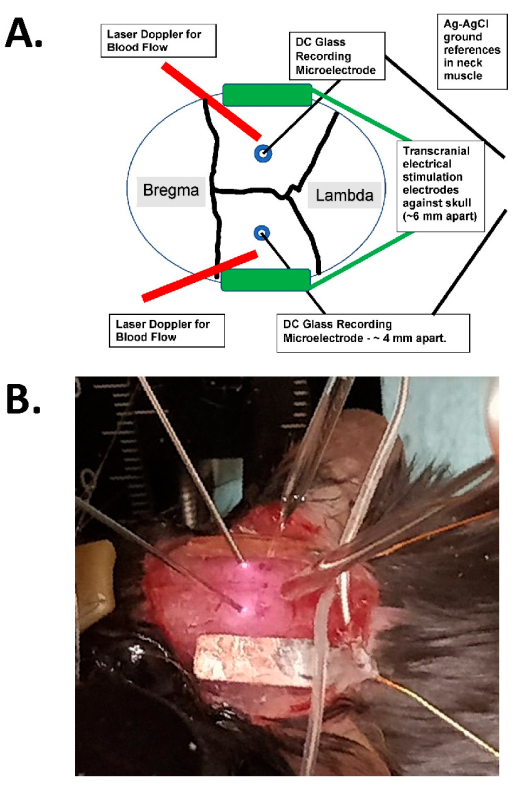
Рисунок 1: Диаграмма транскраниальной стимуляции и фотографический пример. (А) Схема установки транскраниальной стимуляции. На схеме показан череп мыши с венечными и сагиттальными швами. Транскраниальные электроды размещаются латерально и симметрично на черепе и крепятся с помощью хирургического клея и проводящей пасты между электродами и черепом. Эти электроды подключаются к совместимому с человеком устройству стимуляции постоянного тока, которое может задавать частоту, амплитуду и продолжительность стимуляции. Для оценки внутричерепных электрических полей двусторонние стеклянные электроды (~2 МОм) помещаются в кору головного мозга (т.е. в пределах 1 мм от внутренней стороны черепа через небольшие отверстия для заусенцев), которые герметизируются минеральным маслом и имеют основания AgCl в мышце шеи (показаны как более крупные провода в центре, погруженные в подкожную ткань шеи). Эти стеклянные электроды подключаются к усилителю постоянного тока, а их выходы записываются через дигитайзер, имеющий не менее четырех каналов. Двусторонние лазерные допплеровские зонды также помещаются на череп для записи. Весь череп также визуализируется либо с помощью лазерного устройства для визуализации, либо с помощью охлаждаемой камеры с высоким разрешением (не менее 1024 x 1024 пикселей, глубина пикселя 12-14 бит) для обнаружения собственного оптического сигнала. Частота изосбеста гемоглобина обычно выбирается (т.е. 562 нм) для освещения для визуализации кровотока. (B) Изображение реального эксперимента крупным планом, показывающее двусторонние лазерные допплеровские зонды (слева), (двусторонние) внутричерепные стеклянные регистрирующие микроэлектроды, помещенные через отверстия для заусенцев, и электроды, стимулирующие tACS латерально. Аббревиатура: tACS = транскраниальная стимуляция переменным током. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
В качестве способа оценки механизмов мы также можем исследовать взаимодействия с другими физиологическими процессами, которые также изменяют CBF, такими как К+-индуцированная распространяющаяся деполяризация11. Кроме того, вместо регулярных сеансов по расписанию можно разработать систему замкнутого цикла, основанную на дополнительных биомаркерах для различных заболеваний, как это было предложено для лечения эпилепсии12 (т.е. клинические устройства Neuropace). Например, стимуляция мозга с замкнутым контуром при болезни Паркинсона обычно основана на внутренних, аномальных потенциалах локального поля (LFP), присущих этому заболеванию, при отсутствии достаточного количества дофамина (обычно LFP β-диапазона)13.
протокол
Все процедуры с животными были одобрены Комитетом по уходу за животными и их использованию в Университете Дьюка или аналогичным местным органом власти, регулирующим исследования с участием животных. Подробные сведения обо всех материалах, инструментах и оборудовании, используемых в этом протоколе, см. в таблице материалов .
1. Подготовка инструмента
- Убедитесь, что все необходимые предметы и хирургические инструменты на месте (рис. 2): раствор для чистки кожи головы (спиртовые салфетки), скотч, щипцы, ножницы и дрель для установки небольших (0,5 мм) отверстий от заусенцев.
- Подготовьте экстракраниальные поверхностные электроды для наложения на череп и убедитесь, что с них удален хирургический клей, если они использовались ранее.
- Проверьте импеданс этих электродов tACS непосредственно перед их наложением на череп. Для этого используется встроенная функция измерения стимулятора tACS с обоими электродами, помещенными в солевую ванну.
ПРИМЕЧАНИЕ: Предпочтительный импеданс составляет <5 кОм на пару электродов, чтобы обеспечить прохождение достаточного тока через череп. Устройство-стимулятор проверяет импеданс перед подачей импульсов постоянного тока и выдает значение напрямую.
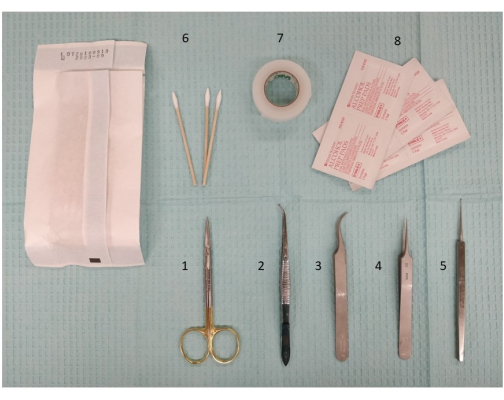
Рисунок 2: Фотография необходимого инструментария, включая препарирующие инструменты и ножницы, для подготовки экстракраниальной стимуляции. 1. Ножницы для микропрепарирования, 11,5 см; 2. Щипцы, 11,5 см, слегка изогнутые, зубчатые; 3. Щипцы Dumont #7, изогнутые; 4. Щипцы Dumont #5; 5. Микрокюретка, 13 см; 6. Ватные палочки; 7. Хирургическая лента; 8. Спиртовые салфетки. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
2. Подготовка животного к операции
Примечание: Для этих экспериментов мы использовали 14 контрольных мышей C57BL/6 в возрасте от 12 до 33 недель, из которых пять были самцами и девять самками.
- Обезболивают животное в индукционной камере изофлураном в 30%О2 при ~1,5 л/мин, при этом ~4% первоначально индуцируют и ~1,25%-1,5% поддерживают на уровне анестезии со спонтанным дыханием и достаточным для устранения реакции защемления хвоста.
- После индукции перенесите животное в стереотаксическую рамку, а затем закрепите голову в носовом конусе и ушных планках для последующего наложения электродов и процедуры заусенцев (рис. 1 и рис. 3).
- Подсоедините носовой конус стереотаксической рамы к испарителю через входное отверстие и выходное отверстие, чтобы удалить остатки изофлурана через систему очистки (например, древесный уголь или пылесос). Убедитесь в отсутствии утечек воздуха из носового конуса, как для поддержания уровня анестезии изофтораном, так и для предотвращения случайного попадания воздуха в помещение (Рисунок 3).
- Проверьте положение мыши в стереотаксической рамке, включая положение носового конуса, чтобы обеспечить спонтанное дыхание без интубации, а также соответствующее восстановление после анестезии и очистку для защиты исследовательского персонала (рис. 3).
- Поместите на животное зонды для измерения пульса, насыщения пульса кислородом (pulse OX), артериального давления и температуры; Убедитесь, что минимальная оксигенация импульса составляет 90%, а пульс составляет >450/мин (нижний предел сигнализации отображается как 380 импульсов/мин). Записывайте эти параметры во время процедуры через равные промежутки времени или непрерывно, в зависимости от системы записи (рисунок 3).
- Перед началом процедуры проверьте уровень седации животного, используя, например, зажим пальца ноги, чтобы проверить рефлексы. Если рефлекса нет, то уровень седации оптимален, пока животное поддерживает спонтанное дыхание и адекватную пульсовую оксигенацию. Если есть рефлекс, увеличьте подачу изофлурана для углубления уровня анестезии, а затем перепроверьте рефлекс. Постоянно наблюдайте и контролируйте частоту дыхания животного и соответствующим образом регулируйте подачу изофлурана.
- Сбрейте волосы на голове или удалите волосы с помощью крема для депиляции (остатки крема очистите спиртовыми проходами).
- Нанесите глазную мазь, а затем асептически очистите кожу головы тремя проходами йода и спирта перед иссечением с помощью ножниц.

Рисунок 3: Изображение животного в стереотаксическом кадре, с обнаженным черепом и только электродами-стимуляторами tACS (до установки отверстия в заусенце). Обратите внимание на прибор для измерения артериального давления вокруг хвоста и пульсоксиметр на лапе, с показаниями слева. Вокруг носового обтекателя имеются продувочные трубки для изофлурана. Аббревиатура: tACS = транскраниальная стимуляция переменным током. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
3. Хирургическая процедура: наложение стимулирующих электродов и проделывание заусенцев
- Для терминального исследования удалите скальп хирургическими ножницами и обнажите череп на ~3 мм от лямбдовидного шва каудально и ~3 мм фронтально к брегме, чтобы обнажить часть заднего лобного шва. Иссеките волосистую часть головы теменно, чтобы обнажить начальную часть височной мышцы с обеих сторон (рисунок 3).
- Удалите остатки подкожных соединительных тканей, чтобы череп был чистым и сухим для установки стимулирующих электродов.
- Нанесите токопроводящий гель или пасту на ту сторону электродов, которая будет соприкасаться с черепом, и закрепите электроды хирургическим суперклеем по краю в прерывистых местах.
ПРИМЕЧАНИЕ: Не позволяйте проводящему гелю мешать хирургическому суперклею, чтобы обеспечить лучшее сцепление с поверхностью черепа. Внешняя поверхность электродов также может быть изолирована (от кожи головы, если она закрыта во время операции по выживанию) с помощью хирургического суперклея. - Используйте либо коммерческие плоские электроды, либо создавайте электроды своими силами, используя изолированный провод диаметром 100 мкм (припаянный к пластине) и гибкую изолированную (на одной поверхности) медную пластину размером 1 мм х 3 мм, вырезанную по размеру черепа.
- Нанесите лидокаиновую пасту на височную мышцу и кожу головы с обеих сторон, не повреждая электроды, чтобы уменьшить активацию мышц и периферических нервов.
- После того, как экстракраниальные стимулирующие электроды будут установлены на расстоянии 4 мм латерально с каждой стороны черепа (между брегмой и лямбдой), просверлите два отверстия для заусенцев 0,5 мм для стеклянных электродов по 2 мм с каждой стороны средней линии, на расстоянии 4 мм друг от друга, перпендикулярно сагиттальному шву (рис. 1). Заполните эти отверстия стерильным минеральным маслом, чтобы предотвратить попадание тока в череп от экстракраниальных электродов.
- Если необходимо, чтобы конкретный эксперимент вызвал растекающуюся депрессию (т.е. калий-индуцированную депрессию распространения [K+-SD]), добавьте на правой стороне черепа третье отверстие для заусенцев диаметром 0,5 мм ~1,5 мм рострально к венечному шву и ~1 мм латерально к заднему лобному шву. Заполните это отверстие физиологическим раствором для последующего внесения 1 М KCl, чтобы вызвать K+-SD.
- Проверьте импеданс экстракраниальных стимулирующих электродов как до установки отверстия (и по сравнению с теми же электродами, помещенными в солевую ванну), так и после установки отверстия с заусенцем, чтобы убедиться, что отверстия с заусенцами не мешают протеканию тока в мозг (т. е. убедитесь, что сопротивление не изменилось).
ПРИМЕЧАНИЕ: Измерение импеданса осуществляется непосредственно стимулирующим устройством. В целом, мы обнаружили, что общий импеданс системы (т.е. от экстракраниальных электродов через путь череп/мозг, обычно ~3 кОм) относительно постоянен независимо от заусенцев и стеклянных микроэлектродов, что указывает на минимальную утечку тока непосредственно в мозг через отверстия в заусенцах. - Аналогичным образом разместите электроды хронической транскраниальной стимуляции для хронической стимуляции. В этом случае изолируйте внешнюю поверхность электродов, закройте кожу головы и либо проложите изолированные провода через кожу головы, либо проложите их в неподвижную головную ступень, прикрепленную к черепу.
4. Физиологическая процедура
- Начните с физиологических аспектов эксперимента, как только животное будет полностью готово к физиологическому эксперименту, не связанному с выживанием. Поддерживайте уровень анестезии, достаточный как для спонтанного дыхания, так и для адекватного пульсоксикатора, дыхательных путей и пульса.
- Измерьте КБФ, полученный в результате экстракраниальной стимуляции, одним из следующих двух методов.
- Поместите мышь под лазерное устройство спекл-визуализации с внутричерепными регистрирующими электродами или без них, чтобы измерить внутричерепное электрическое поле во время эпизодов стимуляции (рис. 3).
- Перевести животное на физиологический препарат для установки билатеральных лазерных допплеровских зондов и внутричерепных электродов для измерения внутричерепного электрического поля во время эпизодов стимуляции (рис. 1).
5. Установка двусторонних лазерных допплеровских и стеклянных электродов
- Переведите животное на столик микроскопа для применения двусторонних лазерных допплеровских зондов. Поместите зонды на верхнюю часть поверхности черепа между двусторонними отверстиями для заусенцев и коронарным швом (рисунок 1).
- Натянутые стеклянные микроэлектроды (~0,1 мкМ, импеданс 2-6 МОм) заполняют 0,2 М NaCl и помещают их с помощью микроманипулятора в два отверстия для заусенцев, расположенные сбоку от сагиттального шва 3,14 (рис. 1).
ПРИМЕЧАНИЕ: Эти отверстия находятся между двумя симметричными электродами экстракраниальной стимуляции (Рисунок 1). - После введения в мозг убедитесь, что эти стеклянные микроэлектроды находятся на расстоянии ~1 мм в коре головного мозга. Выполнение профилей глубины на различной симметричной глубине. Заполните отверстия для заусенцев стерильным минеральным маслом, чтобы изолировать этот путь для протекания тока.
6. Процедура стимуляции и измерение интенсивности транскраниальной стимуляции переменным током (tACS) или транскраниальной стимуляции постоянным током (tDCS)
- Непрерывная запись данных с двойных лазерных доплеровских зондов на черепе и двух внутричерепных микроэлектродных выходов (записанных с помощью усилителя постоянного тока с головными столиками) с помощью системы оцифровки и программного обеспечения не менее чем с четырьмя каналами (с частотой дискретизации 1 кГц). После того, как все значения будут зарегистрированы в течение достаточно стабильной исходной длительности (т.е. >10 минут), протестируйте экстракраниальную стимуляцию.
ПРИМЕЧАНИЕ: На рисунке 4 показан пример четырех каналов с двумя внутричерепными регистрирующими электродами в верхних каналах и откликом CBF в нижних каналах. - Применяйте короткие периоды включения/выключения стимуляции с различными амплитудами (например, 20-30 с, 0,5-2,0 мА, в допустимом диапазоне), чтобы получить четкую базовую линию до и после стимуляции (рисунок 4). Примените стимуляцию между двумя электродами tACS черепа с обеих сторон (рис. 1) с помощью коммерческого, совместимого с человеком стимулирующего устройства, которое обеспечивает постоянный ток.
- Внимательно наблюдайте за мышью на предмет мышечных подергиваний или других реакций на tACS, таких как изменение пульса или дыхания, чтобы создать верхний предел переносимости (обычно ~2 мА).
- Продолжайте контролировать импеданс на электродах с периодами стимуляции, чтобы убедиться, что он постоянен.
- Добавьте небольшое количество (2-3 мкл) 1 M KCl в переднее отверстие14 , чтобы индуцировать спонтанные события K+-SD. Они генерируют большой КБФ-ответ и взаимодействия между К+-СД-индуцированным КБФ-ответом и КБФ-ответом. Оценивают реакцию КБК на ТСКС, применяя стимуляцию ТСКС как до, так и после возникновения СД.
- В конце эксперимента проводят эвтаназию с помощью передозировки изофлурана (5%), а затем обезглавливают, как только дыхание и сердцебиение прекратятся.
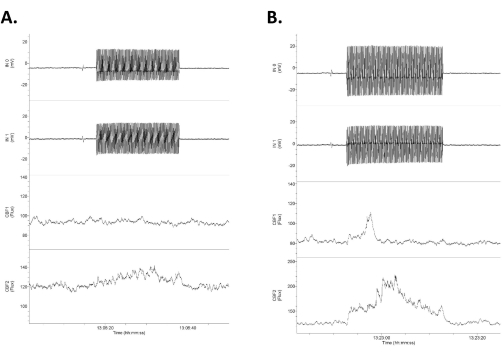
Рисунок 4: Данные, показывающие четыре канала необработанных данных в ответ на низкоинтенсивную tACS. Данные расположены следующим образом: два верхних ряда представляют собой внутричерепные прямые электрические записи постоянного тока (помеченные как Вход 1 [IN0] и Вход 2 [IN1]), а нижние две строки представляют собой двусторонние лазерные допплеровские записи мозгового кровотока. Обратите внимание, что ответы асимметричны между правой (верхней) и левой (нижней) электрической и мозговой дорожками кровотока. (А) Слабая реакция (увеличение кровотока на 16%) в ответ на стимул 1,2 мВ/мм 20 с (0,75 мА). (B) Более выраженная реакция (увеличение кровотока на 21%) в ответ на стимул 1,4 мВ/мм (1,0 мА). Аббревиатура: tACS = транскраниальная стимуляция переменным током. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
7. Расчет электрического поля
- Измерьте разницу в выходе двух внутричерепных электродов, используя разницу в полуволне (один цикл) двух записанных синусоидальных волн (две верхние кривые на рисунке 4). Разделите эту разницу (мВ) на расстояние между двумя электродами (мм, в данном случае ~4 мм, но в каждом случае измеряется напрямую), чтобы получить напряженность поля (мВ/мм)3,6.
Результаты
Репрезентативные результаты показаны на рисунках 4, 5 и 6. На рисунке 4 показан пример четырех каналов с двумя внутричерепными регистрирующими электродами на верхних каналах и ответами КБФ на нижних каналах. tACS симметрична...
Обсуждение
Этот протокол фокусируется на измерении in vivo под наркозом ответа CBF в качестве биомаркера для оценки реакции мозга на tES14. Долгосрочные биомаркеры ответа на тЭС включают гистологические эффекты лечения, такие как предотвращение или изменение образования амилоидных б?...
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявлять.
Благодарности
Это исследование было поддержано следующими грантами (D.A.T.): NIA RO1 AG074999, NIA R21AG051103, VA I21RX002223 и VA I21 BX003023.
Материалы
| Name | Company | Catalog Number | Comments |
| Alcohol pads | HenryShein | 112-6131 | |
| Baby mineral oil | Johnson & Johnson | ||
| BD 1 mL syringe | Becton Dikinson | REF 305699 | |
| C3 Flat Surface Electrodes | Neuronexus | ||
| C57BI mice | from NIH colonies | ||
| Copper skull electrods | In house preparation | ||
| Digidata 1440, Clampex | Axon Instruments | ||
| Dumont #5 forceps | FST | #5 | |
| Dumont #7 forceps curved | Dumont | RS-5047 | |
| Eye ointment | Major | LubiFresh P.M. NDC-0904-6488-38 | |
| Flaming/Brown micropipette puller | Sutter instrument Co. | Model P-87 | |
| Forceps 11.5 cm slight curve serrated | Roboz | RS-8254 | |
| Intramedic needle 23 G | Becton Dikinson | REF 427565 | |
| KCl 1 M | In house preparation | ||
| Laser Doppler Probes | Moor Instruments | 0.46 mm laser doppler probes | |
| Laser Speckle Imaging Device | RWD | RFLSI-ZW | |
| Micro curette 13 cm | FST | 10080-05 | |
| Micro Dissecting Scissors, 11.5 cm | Roboz | RS-5914 | |
| Mouse anesthesia fixation | Stoelting | ||
| Neuroconn-DS | Neurocare | DC-Stimulator Plus | |
| PhysioSuite Monitoring | Kent Scientific | ||
| Q-tips | Fisherbrand | 22363167 | |
| Saline 0.9% NaCl solution | Baxter | 281322 | |
| Sensicam QE | PCO Instruments | ||
| Software | Axon Instruments Clampex | ||
| Surgical glue | Covetrus | 31477 | |
| Surgical tape | 3M Transpore | T9784 |
Ссылки
- Bestmann, S., Walsh, V. Transcranial electrical stimulation. Current Biology. 27 (23), R1258-R1262 (2017).
- Bikson, M., et al. Rigor and reproducibility in research with transcranial electrical stimulation: An NIMH-sponsored workshop. Brain Stimulation. 11 (3), 465-480 (2018).
- Turner, D. A., Degan, S., Galeffi, F., Schmidt, S., Peterchev, A. V. Rapid, dose-dependent enhancement of cerebral blood flow by transcranial AC stimulation in mouse. Brain Stimulation. 14 (1), 80-87 (2020).
- Shah, S., Chhatbar, P. Y., Feld, J. A., Feng, W. Integrating tDCS into routine inpatient rehabilitation practice to boost post-stroke recovery. Brain Stimulation. 13 (4), 953-954 (2020).
- Voroslakos, M., et al. Direct effects of transcranial electric stimulation on brain circuits in rats and humans. Nature Communications. 9 (1), 483 (2018).
- Alekseichuk, I., Mantell, K., Shirinpour, S., Opitz, A. Comparative modeling of transcranial magnetic and electric stimulation in mouse, monkey, and human. Neuroimage. 194, 136-148 (2019).
- Tavakoli, A. V., Yun, K. Transcranial alternating current stimulation (tACS) mechanisms and protocols. Frontiers in Cellular Neuroscience. 11, 214 (2017).
- Yavari, F., Jamil, A., Mosayebi Samani, M., Vidor, L. P., Nitsche, M. A. Basic and functional effects of transcranial electrical stimulation (tES)-An introduction. Neuroscience and Biobehavioral Reviews. 85, 81-92 (2018).
- Wachter, D., et al. Transcranial direct current stimulation induces polarity-specific changes of cortical blood perfusion in the rat. Experimental Neurology. 227 (2), 322-327 (2011).
- Han, C. H., et al. Hemodynamic responses in rat brain during transcranial direct current stimulation: A functional near-infrared spectroscopy study. Biomedical Optics Express. 5 (6), 1812-1821 (2014).
- Ayata, C., Lauritzen, M. Spreading depression, spreading depolarizations, and the cerebral vasculature. Physiological Reviews. 95 (3), 953-993 (2015).
- Berenyi, A., Belluscio, M., Mao, D., Buzsaki, G. Closed-loop control of epilepsy by transcranial electrical stimulation. Science. 337 (6095), 735-737 (2012).
- Hoang, K. B., Cassar, I. R., Grill, W. M., Turner, D. A. Biomarkers and stimulation algorithms for adaptive brain stimulation. Frontiers in Neuroscience. 11, 564 (2017).
- Turner, D., A, D. S., Hoffmann, U., Galleffi, F., Colton, C. A. CVN-AD Alzheimer's mice show premature reduction in neurovascular coupling in response to spreading depression and anoxia compared to aged controls. Alzheimer's and Dementia. 17 (7), 1109-1120 (2021).
- Colton, C. A., et al. mNos2 deletion and human NOS2 replacement in Alzheimer disease models. Journal of Neuropathology and Experimental Neurology. 73 (8), 752-769 (2014).
- Castano-Prat, P., et al. Altered slow (<1 Hz) and fast (beta and gamma) neocortical oscillations in the 3xTg-AD mouse model of Alzheimer's disease under anesthesia. Neurobiology of Aging. 79, 142-151 (2019).
- Etter, G., et al. Optogenetic gamma stimulation rescues memory impairments in an Alzheimer's disease mouse model. Nature Communications. 10 (1), 5322 (2019).
- Iaccarino, H. F., et al. Gamma frequency entrainment attenuates amyloid load and modifies microglia. Nature. 540 (7632), 230-235 (2016).
- Martorell, A. J., et al. Multi-sensory gamma stimulation ameliorates Alzheimer's-associated pathology and improves cognition. Cell. 177 (2), 256-271 (2019).
- Dawson, J., et al. Vagus nerve stimulation paired with rehabilitation for upper limb motor function after ischaemic stroke (VNS-REHAB): A randomised, blinded, pivotal, device trial. Lancet. 397 (10284), 1545-1553 (2021).
- Hacker, M. L., et al. Deep brain stimulation in early-stage Parkinson disease: Five-year outcomes. Neurology. 95 (4), e393-e401 (2020).
- Duun-Henriksen, J., et al. A new era in electroencephalographic monitoring? Subscalp devices for ultra-long-term recordings. Epilepsia. 61 (9), 1805-1817 (2020).
- Haneef, Z., et al. Sub-scalp electroencephalography: A next-generation technique to study human neurophysiology. Clinical Neurophysiology. 141, 77-87 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены