Method Article
عزل الميتوكوندريا بخطوتين بدون علامات لتحسين اكتشاف البروتين وقياسه
In This Article
Summary
نقدم بروتوكولا من خطوتين لعزل الميتوكوندريا عالي الجودة متوافق مع اكتشاف البروتين وقياسه على نطاق البروتين. لا يتطلب بروتوكولنا هندسة وراثية وبالتالي فهو مناسب لدراسة الميتوكوندريا من أي خلايا وأنسجة أولية.
Abstract
معظم العمليات الفسيولوجية والمرضية ، من التمثيل الغذائي المركزي إلى الاستجابة المناعية للتنكس العصبي ، تنطوي على الميتوكوندريا. يتكون بروتين الميتوكوندريا من أكثر من 1000 بروتين ، ويمكن أن تختلف وفرة كل منها ديناميكيا استجابة للمنبهات الخارجية أو أثناء تطور المرض. نصف هنا بروتوكولا لعزل الميتوكوندريا عالية الجودة عن الخلايا والأنسجة الأولية. يشتمل الإجراء المكون من خطوتين على (1) التجانس الميكانيكي والطرد المركزي التفاضلي لعزل الميتوكوندريا الخام ، و (2) التقاط المناعة للميتوكوندريا بدون علامات لعزل العضيات النقية والقضاء على الملوثات. يتم تحليل بروتينات الميتوكوندريا من كل مرحلة تنقية بواسطة مطياف الكتلة الكمي ، ويتم حساب عوائد التخصيب ، مما يسمح باكتشاف بروتينات الميتوكوندريا الجديدة عن طريق البروتينات المطروحة. يوفر بروتوكولنا نهجا حساسا وشاملا لدراسة محتوى الميتوكوندريا في خطوط الخلايا والخلايا الأولية والأنسجة.
Introduction
الميتوكوندريا هي عضيات معقدة وديناميكية قادرة على الشعور والتكيف مع الاحتياجات الأيضية للخلية. تعمل الميتوكوندريا بشكل أساسي لتعقيد التمثيل الغذائي الخلوي ، كمحاور أيضية حيث تتلاقى تفاعلات الكربوهيدرات والبروتين والدهون والحمض النووي والتمثيل الغذائي للعامل المساعد1. كما أنها تعمل كعضيات إشارة لمسارات الاستجابة المناعية الفطرية واستجابة للتغيرات في الأيونات وأنواع الأكسجين التفاعلية 2,3. حتى الآن ، تم تعيين حوالي 1100 بروتين إلى الميتوكوندريا4،5،6 ، ومع ذلك يمكننا أن نفترض أنه لا يزال يتعين اكتشاف المزيد ، خاصة تلك التي يتم التعبير عنها فقط في أنواع معينة من الخلايا أو بشكل عابر في ظل ظروف بيئية محددة. إن تطوير مناهج جديدة لقياس التغيرات في تكوين الميتوكوندريا في الحالات الأيضية ذات الأهمية سيزيد من معرفتنا بهذه العضيات ويسلط الضوء على طرق علاجية جديدة للاضطرابات التي تتميز بخلل الميتوكوندريا7.
حاليا ، تتوفر بروتوكولات عزل الميتوكوندريا المختلفة ، مع اختلاف الغلة ومستويات النقاء8. الأساليب القائمة على الطرد المركزي هي الأكثر شعبية ، بسبب بساطتها وتكلفتها المنخفضة. على الرغم من أن الطرد المركزي التفاضلي مناسب لمعظم التطبيقات ، إلا أن له عيبا في الحصول على نقاء أقل للميتوكوندريا ويتطلب كميات كبيرة من مواد البدء عند استخدام تطبيقات أكثر تعقيدا قائمة على تدرج الكثافة. في السنوات الأخيرة ، ظهرت طرق جديدة لعزل الميتوكوندريا ، مثل التقاط المناعة القائم على العلامة ("MITO-IP")9 وفرز العضيات المنشطبالتألق 10. على الرغم من أن كلا الإجراءين يمكن أن يولدا عينات عالية النقاء ، إلا أن الأول يتطلب هندسة وراثية لوضع علامة على الميتوكوندريا لتنقية التقارب ، مما يجعل البروتوكولات غير متوافقة مع المواد الأولية من الكائنات غير المحورة أو المتبرعين البشريين. وفي الوقت نفسه ، يعتمد الأخير على الوصول إلى أدوات قياس التدفق الخلوي والفرز. يوفر الجمع بين طرق العزل المختلفة وعدا بتوليد بروتوكولات أكثر قوة وزيادة النقاء.
هنا ، نقدم بروتوكولا جديدا لعزل الميتوكوندريا بناء على مزيج من طريقتين موجودتين: (1) الطرد المركزي التفاضلي لعزل جزء الميتوكوندريا الخام ، و (2) الالتقاط المناعي الخالي من العلامات للميتوكوندريا مع حبات فائقة المغناطيسية مرتبطة تساهميا بالأجسام المضادة ضد الغشاء الشفاف للميتوكوندريا الخارجي 22 (Tomm22) 11 ، وهو بروتين غشاء خارجي للميتوكوندريا في كل مكان (الشكل 1). يتوافق الإجراء الذي وصفناه مع مطياف كتلة البروتين الكمي ، ولأنه خال من العلامات ولا يتطلب معالجة وراثية ، يمكن تطبيقه على مجموعة واسعة من نماذج البحث ، من خطوط الخلايا إلى سوائل الجسم إلى الأنسجة الحيوانية الكاملة. علاوة على ذلك ، يتيح استخدام خطوتين في البروتوكول استخدام البروتينات المطروحة 6,12 لاكتشاف بروتينات الميتوكوندريا الجديدة ودراسة تعبيرها.
Protocol
يجب ارتداء القفازات في جميع الأوقات وإجراء خطوات زراعة الخلايا تحت غطاء التدفق الصفحي. يتم الاحتفاظ بالخلايا في حاضنة 37 درجة مئوية مع 5٪ CO2. تمت الموافقة على البحث المقدم في هذا البروتوكول وأجري وفقا لجامعة لوزان والمبادئ التوجيهية السويسرية لاستخدام الحيوانات.
1. ثقافة خط خلية البلاعم RAW264.7
- تنمو خلايا البلاعم RAW264.7 للفئران في وسط النسر المعدل (DMEM) من Dulbecco مع نسبة عالية من الجلوكوز والجلوتامين المكمل بمصل بقري جنيني معطل بالحرارة بنسبة 5٪ (HI-FBS) و 100 وحدة دولية / مل من البنسلين و 100 ميكروغرام / مل من الستربتومايسين (P / S).
ملاحظة: لعزل الميتوكوندريا ، تكفي صفيحة واحدة متقاربة مقاس 15 سم (حوالي 70 × 10 7 خلايا RAW264.7). - الحفاظ على خلايا RAW264.7 في لوحات زراعة الأنسجة. تؤدي كثافة البذر الأولية البالغة 1 × 105 خلايا / مل إلى صفيحة متقاربة في 3 أيام. استخدم 25 مل من تعليق الخلية في الوسائط للوحة 15 سم. تتمتع خلايا RAW264.7 بمعدل انقسام خلوي مرتفع وتحتاج إلى تقسيمها بشكل متكرر أكثر من معظم خطوط الخلايا.
- فصل خلايا RAW264.7
- نضح الوسائط وغسل الخلايا مرة واحدة بمحلول ملحي مخزن بالفوسفات (PBS).
- للحصول على طبق 15 سم ، أضف 8 مل من محلول تفكك RAW الدافئ (270 مللي مول كلوريد البوتاسيوم ، 30 مللي متر ثنائي هيدرات سيترات الصوديوم في H2O ، مصفى معقم) واحتضان الخلايا عند 37 درجة مئوية لمدة 5 دقائق.
- أضف حجما مكافئا من الوسائط إلى الألواح (تخفيف 1: 1 من المخزن المؤقت للتفكك) ، وماصة لفصل الخلايا وتجانسها.
- انقل تعليق الخلية إلى أنبوب مخروطي وطرد مركزي الأنبوب عند 300 × جم لمدة 3 دقائق في درجة حرارة الغرفة.
- نضح المادة الطافية وأعد تعليق الحبيبات في حجم مناسب من الوسائط (الموضحة في الخطوة 1.1) لعد الخلايا.
ملاحظة: يمكن استخدام طرق أخرى لفصل خلايا RAW264.7 ، مثل التربسين أو مكشطة الخلايا. ومع ذلك ، فإن هذه الطرق أكثر قسوة على الخلايا وقد تؤدي إلى استقطابها إلى بلاعم تشبه M1 في الأيام التالية للانفصال.
2. عزل وثقافة البلاعم المشتقة من نخاع العظام (BMDMs)
ملاحظة: البروتوكول الموضح هنا مخصص لماوس واحد ويمكن توسيعه لعدة فئران. تم وصف البروتوكولات التفصيلية لعزل وثقافة BMDM في مكان آخر13،14.
- التضحية بفأر C57BL / 6 يبلغ من العمر 8-12 أسبوعا بجرعة عالية من CO2.
ملاحظة: يمكن استخدام ذكور أو إناث الفئران. - رش الماوس بنسبة 75٪ إيثانول لتعقيمه.
- تشريح وجمع الوركين وعظم الفخذ والساق من الفأر15.
- لجمع نخاع العظم من عظم الفخذ والنقش ، قم بإزالة نهاية مفصل الركبة لكلا العظمتين15. استعادة نخاع العظم من الوركين عن طريق إزالة الحق.
- انقل العظام إلى أنبوب مخروطي سعة 50 مل مع 4 مل من وسائط BMDM المحفوظة على الجليد (DMEM مع نسبة عالية من الجلوكوز والجلوتامين المكمل ب 5٪ HI-FBS ، P / S ، و 10 mM HEPES).
ملاحظة: من المهم إبقاء العظام في الوسائط لتجنب جفاف نخاع العظم أثناء التشريح. - أضف 4 مل من PBS و 4 مل من وسائط BMDM الدافئة في بئرين مختلفين من لوحة 6 آبار.
- انقل العظام والوسائط من الأنبوب المخروطي سعة 50 مل إلى بئر فارغ من اللوحة المكونة من 6 آبار.
- باستخدام زوج من الملقط ، انقل العظام إلى PBS جيدا لغسلها.
- انقل العظام إلى البئر التي تحتوي على وسائط BMDM الدافئة.
- اصنع ثقبا بقطر 1-2 مم في قاع أنبوبين سعة 0.5 مل بالملقط وضعهما في أنبوب سعة 1.5 مل.
ملاحظة: ليس من الضروري إضافة وسائط إلى الأنبوب لهذه الخطوة السريعة. - في كل أنبوب سعة 0.5 مل ، ضع عظم الفخذ والساق والورك بحيث يواجه نخاع العظم للعظام المكشوفة الجزء السفلي من الأنابيب.
- أجهزة الطرد المركزي الأنابيب عند 13000 × غرام لمدة دقيقة واحدة في درجة حرارة الغرفة لجمع نخاع العظم والوسائط المتبقية من خلال فتحة الأنبوب 0.5 مل وفي أنبوب 1.5 مل. تخلص من أنابيب 0.5 مل مع العظام.
- أعد تعليق كريات نخاع العظم في وسائط BMDM وانقلها إلى أنبوب مخروطي سعة 15 مل.
- أضف وسائط BMDM حتى 10 مل.
- ضع مصفاة خلية 40 ميكرومتر على أنبوب مخروطي سعة 50 مل وقم بتصفية تعليق نخاع العظم من خلاله.
- أجهزة الطرد المركزي التعليق المصفى عند 300 × جم لمدة 5 دقائق في درجة حرارة الغرفة لاستعادة الخلايا السليمة وإزالة الحطام الصغير من تعليق الخلية.
- تحضير 70 مل من وسائط BMDM مكملة ب 50 نانوغرام / مل من عامل تحفيز مستعمرة البلاعم (M-CSF).
- أعد تعليق الحبيبات في 10 مل من وسائط BMDM المكملة ب M-CSF.
- أضف 9 مل من وسائط BMDM المكملة ب M-CSF إلى كل من أطباق بتري السبعة مقاس 10 سم.
- لوحة 1 مل من الخلايا (حوالي 1 × 107 خلايا) في كل من أطباق بتري السبعة 10 سم.
- تجانس تعليق الخلية في كل لوحة عن طريق سحب بعناية لأعلى ولأسفل على اللوحة ونقل الألواح إلى الحاضنة.
- بعد 3 أيام ، أضف 5 مل من وسائط BMDM الدافئة المكملة ب 50 نانوغرام / مل mL M-CSF إلى كل طبق.
- بعد 3 أيام (اليوم 6 ، بعد عزل نخاع العظم) ، تحقق من التصاق وتمايز BMDM عن طريق الفحص المجهري.
ملاحظة: في هذه المرحلة ، من الممكن المتابعة مباشرة إلى عزل الميتوكوندريا (الخطوة 3). بدلا من ذلك ، يمكن للمرء إعادة طلاء BMDM ، والذي يسمح بمعالجتها بالسيتوكينات والجزيئات الصغيرة. - فصل BMDMs
- نضح الوسائط من كل لوحة وأضف 7 مل من برنامج تلفزيوني بارد مكمل ب 5 مللي متر حمض إيثيلين ديامينيترايتيك (EDTA).
- احتضان الخلايا على حرارة 4 درجات مئوية لمدة 7-8 دقائق.
- افصل BMDMs عن طريق السحب بعناية لأعلى ولأسفل باستخدام ماصة سعة 10 مل.
- قم بتجميع BMDMs المعاد تعليقها من جميع الألواح السبع في أنبوب مخروطي واحد سعة 50 مل وأجهزة طرد مركزي عند 300 × جم لمدة 3 دقائق في درجة حرارة الغرفة.
- نضح المادة الطافية وإعادة تعليق الخلايا في 40 مل من وسائط BMDM الدافئة لعد الخلايا.
ملاحظة: بين 7-9 × 10 يتم الحصول على7 BMDMs لكل ماوس. يوصى بما لا يقل عن 6 × 107 BMDMs لعزل الميتوكوندريا للبروتينات. - إذا رغبت في ذلك ، لوحة ومعالجة BMDMs وفقا للهدف التجريبي. إذا لم يكن الأمر كذلك ، فانتقل مباشرة إلى الخطوة 3.3.
3. تحضير جزء الميتوكوندريا الخام عن طريق الطرد المركزي التفاضلي
ملاحظة: قم بإجراء جميع خطوات الطرد المركزي عند 4 درجات مئوية. مطلوب جهازي طرد مركزي ، أحدهما مزود بدوار متأرجح للخارج ومحولات للأنابيب المخروطية بقوة طرد مركزي نسبية لا تقل عن 300 × جم ، والآخر بقوة طرد مركزي نسبية لا تقل عن 21000 × جم مناسبة لأنابيب 1.5 مل. عند استخدام الخلايا الملتصقة ، استخدم مكشطة الخلايا.
- بالنسبة للخلايا الملتصقة ، قم بنضح الوسائط وإضافة 10 مل من PBS لكل لوحة 15 سم.
ملاحظة: كشط الخلايا في برنامج تلفزيوني يسمح للمرء بغسلها في نفس الوقت. إذا كانت الخلايا بالفعل في التعليق ، فانتقل مباشرة إلى الخطوة 3.3. - افصل الخلايا باستخدام مكشطة خلوية وقم بتجميعها في أنبوب مخروطي واحد سعة 50 مل. تجانس تعليق الخلية عن طريق سحب السحب لأعلى ولأسفل.
ملاحظة: يمكن فصل الخلايا باستخدام مكشطة الخلايا ، لأن هذا أسرع وسيتم تحليلها بعد فترة وجيزة. - لكل حالة تجريبية ، انقل 5٪ من حجم تعليق الخلية إلى أنبوب سعة 1.5 مل وطرده مركزيا عند 300 × جم لمدة 5 دقائق في درجة حرارة الغرفة.
ملاحظة: عند استخدام الخلايا المعلقة، تأكد من غسل الخلايا مرة واحدة باستخدام برنامج تلفزيوني من قبل، لإزالة الملوثات المحتملة من الوسائط مثل FBS. - تخلص من المادة الطافية واحتفظ بالحبيبات على الجليد.
ملاحظة: سيمثل هذا جزء "الخلية الكلية" للبروتينات. - أجهزة الطرد المركزي بقية العينات من الخطوة 3.1 أو 3.2 عند 300 × جم لمدة 5 دقائق في درجة حرارة الغرفة.
- نفذ جميع الخطوات التالية على الثلج واستخدام المخازن المؤقتة للثلج.
- نضح المادة الطافية وأعد تعليق حبيبات الخلية في 5 مل من محلول الميتوكوندريا المثلج (MB) (210 مللي مول مانيتول ، 70 مللي متر سكروز ، 10 مللي مول HEPES / NaOH [درجة الحموضة 7.4] ، و 1 مللي مول EDTA).
- استعادة الخلايا عن طريق الطرد المركزي عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- أعد تعليق حبيبات الخلية في 0.5 مل من MB البارد وانقلها إلى أنبوب سعة 1.5 مل.
ملاحظة: ينتج عن هذا الإجراء تركيز تقريبي للخلية يبلغ 1.5 × 10 8 خلايا BMDM / مل أو 3 × 108 خلايا RAW264.7 / مل. - باستخدام حقنة سعة 1 مل مزودة بإبرة 25 جم ، قم بتجانس تعليق الخلية بمقدار 30 ممرا عبر الإبرة (الشكل 1 أ).
- أضف 1 مل من MB البارد إلى الأنبوب واخلطه عن طريق الانقلاب. جهاز طرد مركزي تعليق الخلية المتجانسة عند 2000 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- انقل 1 مل من المادة الطافية إلى أنبوب جديد سعة 1.5 مل على الثلج دون إزعاج حبيبات الخلية. أعد تعليق حبيبات الخلية وقم بتجانسها مرة أخرى ، كما في الخطوة 3.7.
- قم بتجميع حبيبات الخلية المتجانسة والمادة الطافية من الخطوتين السابقتين في أنبوب واحد سعة 1.5 مل وطرده مركزيا عند 2000 × جم لمدة 5 دقائق عند 4 درجات مئوية.
ملاحظة: في هذه المرحلة ، تحتوي الحبيبات في الغالب على نوى وخلايا غير مكسورة ويتم التخلص منها. يحتوي الطافي على الحطام الخلوي والسيتوسول والعضيات ، بما في ذلك الميتوكوندريا (الشكل 1 ب). - قسم المادة الطافية على أربعة أنابيب سعة 1.5 مل.
ملاحظة: يؤدي تقسيم المادة الطافية بين أنابيب متعددة في هذه المرحلة إلى تحسين إزالة الملوثات في الخطوات التالية. - أضف MB لتكوين حجم نهائي قدره 1 mL في كل أنبوب من الأنابيب الأربعة. امزج الأنابيب عن طريق الانقلاب والطرد المركزي عند 13000 × جم لمدة 10 دقائق عند 4 درجات مئوية.
ملاحظة: بعد هذه الخطوة ، تظهر حبيبات بطبقتين. تحتوي الحبيبات السفلية الصلبة البنية على الميتوكوندريا ويتم الاحتفاظ بها لمزيد من التنقية (الشكل 1C). تحتوي الحبيبات العلوية والسائبة والبيضاء على هياكل خلوية أخرى ويمكن التخلص منها. - نفذ هذه الخطوة بعناية. قم بإزالة المادة الطافية بأكبر قدر ممكن من الحبيبات العلوية البيضاء. من خلال السحب برفق عليها ، من الممكن إعادة تعليق الحبيبات البيضاء ثم التخلص منها ، مع ترك حبيبات الميتوكوندريا البنية سليمة.
- احتفظ بأحد الأنابيب الأربعة مع حبيبات الميتوكوندريا على الجليد. هذا يمثل جزء "الميتوكوندريا الخام" للبروتينات.
- اجمع الكريات الثلاث الأخرى معا في أنبوب سعة 1.5 مل في حجم نهائي قدره 1 مل من البروميد.
4. تنقية الميتوكوندريا القائمة على الأجسام المضادة المغناطيسية الفائقة
ملاحظة: قم بتنفيذ جميع الخطوات التالية في غرفة باردة عند 4 درجات مئوية.
- انقل 1 مل من مستحضر الميتوكوندريا الخام من الخطوة 3.18 إلى أنبوب مخروطي سعة 15 مل وأضف 7 مل من MB المكمل ب 150 mM NaCl (MB + NaCl).
ملاحظة: تعمل إضافة كلوريد الصوديوم على تحسين ارتباط الأجسام المضادة وتقليل الارتباط غير المحدد للملوثات بالخرز والميتوكوندريا. - أضف 50 ميكرولتر من حبات Tomm22 إلى معلق الميتوكوندريا الخام سعة 8 مل (الشكل 1 د) واحتضن الأنبوب لمدة 15 دقيقة عند 4 درجات مئوية على عجلة دوارة بسرعة منخفضة.
ملاحظة: ترتبط حبات Tomm22 تساهميا بالأجسام المضادة أحادية النسيلة Tomm22 التي أثيرت في الماوس ، مقترنة بالخرز المغنطيسي الفائق. - في هذه الأثناء ، ضع عمودا على المغناطيس.
- قم بموازنة العمود مع 8 مل من MB + NaCl وتجاهل التدفق.
- بعد حضانة 15 دقيقة عند 4 درجات مئوية من العينة باستخدام حبات Tomm22 ، انقل العينة إلى العمود. تجاهل التدفق.
ملاحظة: ستبقى الميتوكوندريا متصلة بالحبيبات المغناطيسية في العمود (الشكل 1E). - اغسل العمود ثلاث مرات باستخدام 8 مل من MB + NaCl.
- أخرج العمود من المغناطيس وضعه في أنبوب مخروطي سعة 15 مل.
- قم بإزالة الميتوكوندريا عن طريق إضافة 1.5 مل من MB + NaCl إلى العمود وتطبيق مكبس على الفور لإذابة الميتوكوندريا المنقاة في الأنبوب.
- انقل الميتوكوندريا المستخلصة إلى أنبوب سعة 1.5 مل وطردها مركزيا عند 21000 × جم لمدة 10 دقائق عند 4 درجات مئوية.
ملاحظة: سوف تتشكل بيليه بنية. يحتوي هذا على الميتوكوندريا المعزولة وبعض الخرز المقترن بالأجسام المضادة (الشكل 1F). - قم بإزالة المادة الطافية بعناية من الحبيبات. تمثل الحبيبات جزء "الميتوكوندريا النقية" للبروتينات. يمكن تخزين هذه الحبيبات مع الكريات من الخطوتين 3.4 و 3.17 عند -20 درجة مئوية وتكون جاهزة للتطبيقات النهائية.
النتائج
يتم إنشاء ثلاث عينات بدرجات متزايدة من نقاء الميتوكوندريا في البروتوكول الحالي: الخلايا الكلية ، الميتوكوندريا الخام ("ميتو كرود") ، والميتوكوندريا النقية ("ميتو نقي") (الشكل 1). لقد تحققنا من صحة تنقية الميتوكوندريا من خط خلايا البلاعم RAW264.7 عن طريق تحميل كميات متساوية من البروتين من كل جزء على هلام ونشاف مناعي ، ووجدنا أن سينسيز سيترات الميتوكوندريا (Cs) تم إثراؤه في كل خطوة تنقية. وفي الوقت نفسه ، اختفت البروتينات من السيتوسول (GAPDH) ، وغشاء البلازما (Na / K ATPase) ، والنواة (Lamin B) ، والليزوزومات (Lamp1) ، والشبكة الإندوبلازمية (ER) (Pdi) تدريجيا (الشكل 2A). تم الحصول على نتائج مماثلة باستخدام BMDMs. لمزيد من التحقق من نقاء وسلامة الميتوكوندريا المعزولة ، تم إجراء المجهر الإلكتروني على جزء الميتوكوندريا النقي. لاحظنا الميتوكوندريا ذات الشكل البيضاوي الكلاسيكي وكريستا سليمة محاطة بجزيئات كثيفة الإلكترون تتوافق مع الخرزات المغلفة بالأجسام المضادة (الشكل 2 ب). لذلك ، يمكن الاستنتاج أن بروتوكولنا يثري الميتوكوندريا ، ويستنفد المكونات الخلوية الأخرى ، ويحافظ على السلامة الهيكلية للميتوكوندريا.
بعد ذلك ، تم إجراء تحليل بروتيني لكل جزء باستخدام اللوني السائل المقترن بقياس الطيف الكتلي (LC / MS). تم تحديد ما مجموعه 6,248 بروتينا في المستخلص من إجمالي الخلايا ، 907 منها تم شرحها سابقا على أنها ميتوكوندريا في مخزون MitoCarta3.05. بعد الترشيح للبروتينات ذات عتبة اثنين على الأقل من الببتيدات الفريدة ، قمنا بحساب درجة التخصيب لكل بروتين في كل عينة بناء على شدتها مقارنة بالخلايا الكلية. ثم قمنا بتخصيص البروتينات لسبع مقصورات رئيسية تحت خلوية: الميتوكوندريا ، ER ، الليزوزومات ، جهاز جولجي ، الهيكل الخلوي ، النواة ، والسيتوسول ، باستخدام علم الوجود الجيني (GO) 16،17 و MitoCarta3.05 كمرجع. الأهم من ذلك ، لوحظ متوسط تخصيب لبروتينات الميتوكوندريا بأكثر من 10 أضعاف وأكثر من 20 ضعفا في أجزاء الميتوكوندريا الخام والنقي ، على التوالي ، (الشكل 2C). في المقابل ، تم استنفاد مكونات المقصورات الخلوية الستة الأخرى التي تم تحليلها أثناء إجراء التنقية. وتجدر الإشارة بشكل خاص إلى أنه في جزء الميتوكوندريا الخام ، لاحظنا إثراء عابرا لبروتينات ER والليزوزومات ، وهما فئتان من البروتينات الملوثة كثيرا ما تظهران بعد بروتوكولات الطرد المركزيالتفاضلي 18. ربما كان هذا بسبب تفاعلات العضيات والعضيات ومعاملات الترسيب المماثلة ، خاصة بالنسبة للجسيمات الحالة ، والتي تكون وفيرة للغاية في البلاعم19. في حين أن كلاهما تم استنفادهما في الغالب بعد التقاط المناعة ، اكتشفنا إشارة صغيرة للبروتينات من مواقع اتصال ER-mitochondria في جزء ميتو النقي.
ثم قارنا مباشرة وفرة البروتين من إجمالي الخلايا ومن عينات ميتو بيور ولاحظنا مجموعتين متميزتين ، تقابلان بروتينات الميتوكوندريا وغير الميتوكوندريا (الشكل 2 د). في حين أن الغالبية العظمى من بروتينات MitoCarta تتجمع معا ، وجدنا عددا قليلا (<5٪) يتجمع مع بروتينات غير MitoCarta. قد تمثل هذه البروتينات (1) البروتينات المتفاعلة مع الميتوكوندريا الخلوية (فئة جديدة مشروحة في الإصدار 3.0 من MitoCarta) ، (2) بروتينات ثنائية المترجمة ، أو (3) بروتينات مشروحة بشكل خاطئ. على العكس من ذلك ، وجدنا حالات قليلة من البروتينات غير MitoCarta المتجمعة مع بروتينات الميتوكوندريا. في حين أن هذه البروتينات قد تمثل ملوثات لإجراء العزل ، إلا أنها قد تمثل أيضا بروتينات لم تصنف سابقا على أنها موجودة في الميتوكوندريا.
للتحقيق في هذه الفئة الجديدة من بروتينات الميتوكوندريا المحتملة ، تم استخدام البروتينات المطروحة ، وهو نهج أثبت فائدته لاكتشاف البروتينات العضوية ، بما في ذلك الميتوكوندريا6،12. تفترض البروتينات المطروحة أن الميتوكوندريا يجب أن تصبح غنية أثناء خطوات التنقية ، ويجب أن تنضب الملوثات6. على سبيل المثال ، في حين أن الملوثات قد تتراكم أثناء الطرد المركزي التفاضلي (على سبيل المثال ، بسبب خصائص الترسيب المماثلة) أو أثناء الالتقاط المناعي (على سبيل المثال ، بسبب ارتباط الأجسام المضادة غير المحددة) ، يجب أن تتراكم بروتينات الميتوكوندريا الحسنة النية فقط بشكل كبير في كليهما. وبالتالي من الممكن تصفية البروتينات التي تم العثور عليها في جزء الميتوكوندريا النقي ولكنها أظهرت أنماطا غير متسقة من التخصيب. في المثال الحالي مع خلايا RAW264.7 ، من خلال تحديد عتبة للببتيدات الفريدة من ≥1 لعينات ميتو الخام وميتو النقي ، وباستخدام عتبات صارمة للتخصيب ، تمكنا من تحسين قائمة بروتينات الميتوكوندريا المستعادة من 1127 بروتينا تم العثور عليها في البداية في جزء الميتوكوندريا الخام بعد الطرد المركزي التفاضلي ، وصولا إلى 481 بروتينا بعد الجولة الثانية من التنقية باستخدام الانتخاب المناعي Tomm22. يعكس انخفاض عدد البروتينات المشروحة MitoCarta في جزء mito-pure الصرامة العالية المطبقة على الاختيار. ومن المثير للاهتمام ، أن 70 من البروتينات الموجودة في جزء ميتو النقي لم تكن موجودة في مخزون MitoCarta3.0 (الشكل 3A ، B). قد تمثل هذه البروتينات الأخيرة بروتينات مرشحة جديدة محتملة للميتوكوندريا ، والتي لا يمكن التعبير عنها إلا في خط خلايا البلاعم RAW264.7 وفي الخلايا ذات الصلة ، والتي تستحق مزيدا من التحقيق.
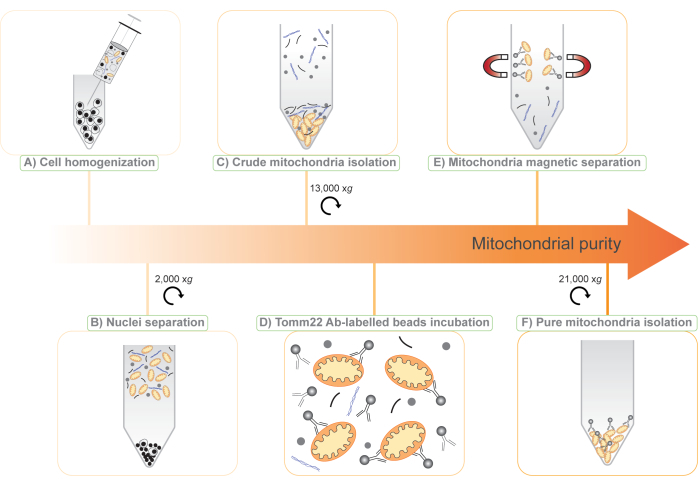
الشكل 1: رسم توضيحي لبروتوكول عزل الميتوكوندريا المكون من خطوتين والخالي من العلامات . (أ) يتعطل معلق خلوي من خلال إبرة مقدارها 25 G. (ب) تفصل النوى والخلايا الكاملة عن طريق الطرد المركزي عند 2000 × g ويتم حفظ المادة الطافية. (ج) يتم عزل الميتوكوندريا الخام عن طريق الطرد المركزي التفاضلي للطافي عند 13000 × جم (خام ميتو). (د) ثم يتم تحضين الميتوكوندريا الخام بالأجسام المضادة Tomm22 (Ab) المرتبطة تساهميا بالخرز المغنطيسي الفائق. (ه) معقد حبات الأجسام المضادة للميتوكوندريا-توم22 مفصولة عن الملوثات باستخدام أعمدة مغناطيسية وتنحرف. (F) يتم جمع الميتوكوندريا النقية وتركيزها عن طريق الطرد المركزي (ميتو نقي). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
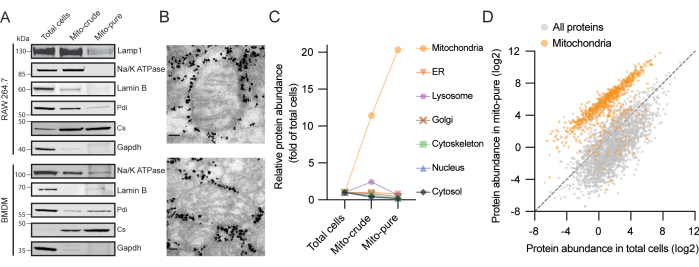
الشكل 2. النتائج التمثيلية لعزل الميتوكوندريا من مصدرين للبلاعم. (أ) تحليل اللطخة المناعية البروتينية لخلايا RAW264.7 (أعلى) وخلايا BMDM (أسفل) باستخدام الأجسام المضادة لسينسيز سترات الميتوكوندريا (Cs - الميتوكوندريا) ، غليسيرالدهيد 3-فوسفات ديهيدروجيناز (Gapdh - سيتوسول) ، مضخة الصوديوم والبوتاسيوم (Na / K ATPase - غشاء البلازما) ، Lamin B (Lamin B - النواة) ، البروتين الغشائي المرتبط بالليزوزوم 1 (Lamp1 - الليزوزوم) ، والبروتين ثاني كبريتيد إيزوميراز (Pdi - ER). ب: الفحص المجهري الإلكتروني للميتوكوندريا المنقاة من خلايا RAW264.7. تتوافق الجسيمات عالية الكثافة المحيطة بالميتوكوندريا مع حبات Tomm22 التي يتم حملها مع عينات ميتو نقية بعد الشطف من الأعمدة. قضبان الميزان: 80 نانومتر. (ج) درجات التخصيب عبر إجمالي الخلايا ، وخام الميتو ، والميتو النقي من سبع حجرات خلوية في خلايا RAW264.7. تم استخدام MitoCarta3.0 و GO للتعليق التوضيحي للبروتين ويتم تمثيل متوسط الدرجات. اختصار: ER = الشبكة الإندوبلازمية. (د) قيم وفرة البروتين (riBAQ) للبروتينات في الخلايا الكلية وعينات ميتو نقية من خلايا RAW264.7. تظهر بروتينات MitoCarta3.0 باللون البرتقالي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
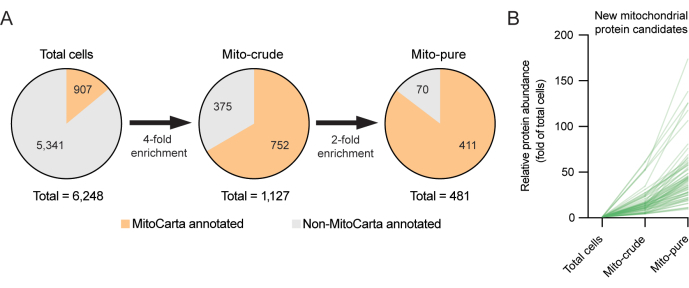
الشكل 3. اكتشاف بروتينات الميتوكوندريا الجديدة باستخدام البروتينات المطروحة. أ: استراتيجية البروتيوميات المطروحة لاكتشاف بروتينات الميتوكوندريا الجديدة. يتم تطبيق عتبات اختيار عالية (4x و 2x) لتقليل اختيار الإيجابيات الخاطئة. (ب) ينتج التخصيب (أضعاف الخلايا الكلية) من البروتينات المرشحة الجديدة للميتوكوندريا التي لم يتم شرحها مسبقا في مخزون MitoCarta3.0. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
لقد جمعنا بين الطرد المركزي التفاضلي والتقاط المناعة لتحقيق نقاء محسن لعزل الميتوكوندريا. يسمح الإجراء الخاص بنا بالوصول إلى المواد الأولية لتحديد وتوصيف بروتينات الميتوكوندريا الجديدة. البروتوكول واضح وقوي ، ويمكن تطبيقه على خطوط الخلايا والخلايا الأولية والأنسجة دون الحاجة إلى التعديل الجيني. لقد تحققنا من صحة بروتوكولنا من خلال تحليل المناعة والبروتينات على العينات المأخوذة في مراحل مختلفة طوال عملية التنقية.
بالمقارنة مع طرق العزل الفردية ، فإن الجمع بين خطوات التخصيب ذات الطبيعة المختلفة - هنا ، الطرد المركزي ووضع العلامات المناعية - يولد بروتوكولا أكثر قوة لعزل الميتوكوندريا. ويرجع ذلك إلى أنه في حين أن بروتينات الميتوكوندريا ستصبح غنية في كلا التنقية، فمن غير المرجح أن يتم إثراء الملوثات أيضا بعد خطوتي التخصيب. على الرغم من أنه يمكن أيضا تحقيق نقاء الميتوكوندريا العالي عن طريق الطرد المركزي الفائق التدرج الكثيف ، إلا أن هذا النهج يتطلب كمية كبيرة من مواد البدء والوصول إلى جهاز طرد مركزي فائق. أخيرا ، على عكس الطرق الحديثة القائمة على عزل الميتوكوندرياالقائم على العلامات 20 ، لا يتطلب نهجنا تعديلا وراثيا للعينة ، مما يجعلها مناسبة للمواد الأولية من أي مصدر.
يجب مراعاة بعض الاعتبارات التقنية والبيولوجية في التصميم التجريبي عند تطبيق بروتوكولنا. (1) كمية المواد الأولية أمر بالغ الأهمية من أجل الحصول على مواد كافية. حتما ، سيتم فقد عدد صغير من الميتوكوندريا أثناء التجانس (الخطوة 3.10) ، حيث لا يتم تحليل جميع الخلايا ، أو أثناء غسل الأعمدة الثلاثة (الخطوة 4.6). بينما يركز بروتوكولنا على النقاء على المحصول ، لم يتم قياس أو تحسين كفاءة عزل الميتوكوندريا ، وبالتالي إنتاجيتها. من المتوقع أن يؤدي استخدام المزيد من حبات Tomm22 والمزيد من الأعمدة إلى زيادة إنتاجية استعادة الميتوكوندريا. في الوقت نفسه ، يمكن أن يؤدي التحسين الشامل لخطوة التجانس أيضا إلى تحسين إنتاجية الميتوكوندريا. هذا البروتوكول وأرقام الخلايا الأولية التي نبلغها هنا لخلايا RAW264.7 و BMDMs كافية للبروتينات ويمكن تعديلها لتطبيقات أخرى. في حالة BMDMs الأولية ، وجدنا أن ماوس واحد كان كافيا لتكرار واحد. عند الضرورة ، يمكن توسيع نطاق الإجراء لعزل BMDMs من متعددة ، والتي يمكن بعد ذلك تجميعها للحصول على مواد كافية. يمكن تحسين رقم الخلية اعتمادا على نوع الخلية وحجمها ومحتواها من الميتوكوندريا. (2) يتم التعبير عن Tomm22 على الميتوكوندريا من جميع أنواع الخلايا والأنسجة21، ولكن قد يختلف مستوى تعبيره. لذلك ، عند تصميم تجربة لمقارنة الظروف المختلفة ، من المهم التأكد من أن مستويات التعبير في Tomm22 قابلة للمقارنة. علاوة على ذلك ، نظرا للتعبير المنتشر في كل مكان عن Tomm22 ، لا يمكن دراسة بروتينات الميتوكوندريا الخاصة بنوع الخلية داخل الأنسجة المعقدة. (3) الوقت اللازم لتوليد الميتوكوندريا النقية (حوالي 2.5 ساعة) لا يتوافق مع دراسة الأحداث العابرة ، مثل التغيرات في الملامح الأيضية. في هذه الحالة ، نوصي بالالتقاط المناعي المباشر المستند إلى العلامات9، والذي يسمح أيضا بدراسة الميتوكوندريا الخاصة بنوع الخلية in vivo20. (4) على الرغم من أن الدراسات التي أجريت على الميتوكوندريا المعزولة التي تم الحصول عليها باستخدام حبات Tomm22 الموسومة بالأجسام المضادة وحدها أظهرت نشاطا في المقايسات الوظيفية11، يبقى تحديد ما إذا كانت الميتوكوندريا المتولدة باستخدام بروتوكولنا متوافقة مع المقايسات القائمة على النشاط النهائي. ميتو تراكر أو تلطيخ ميثيل رودامين ميثيل إستر بيركلورات (TMRM) ، أو قياسات قياس التنفس ، هي طرق محتملة لقياس وظائف الميتوكوندريا المعزولة22. (5) بعد استخلاص عينة "ميتو نقية" من العمود ، ستكون بعض حبات Tomm22 موجودة في جزء الميتوكوندريا النقي (الشكل 2 ب). في حين أننا لم نلاحظ أي تداخل مع هضم التربسين ومطياف كتلة البروتين ، يجب أن يؤخذ وجود هذه الخرزات والغلوبولين المناعي في الاعتبار في التطبيقات النهائية الأخرى. الجسم المضاد Tomm22 هو جسم مضاد وحيد النسيلة ينتج في الفئران23، وبالتالي من المهم أن نضع في اعتبارنا أنه عند استخدام الأجسام المضادة الثانوية ضد الفئران في المناعية ، فإنه سيولد نطاقات غير محددة بحجم سلاسل الغلوبولين المناعي. (6) التجانس الكامل لتعليق الخلية هو مفتاح العزل الناجح للميتوكوندريا. هنا ، نستخدم حقنة بإبرة 25 جم لتحلل كل من خلايا RAW264.7 و BMDMs. ومع ذلك ، اعتمادا على نوع الخلية وحجمها ، قد تكون طرق التجانس الميكانيكية الأخرى ، مثل استخدام خالط Dounce ، أو الأساليب الأكثر تحكما مثل أجهزة خالط الخلايا ، أكثر ملاءمة. يمكن أيضا النظر في طرق التجانس غير الميكانيكية ، مثل صوتنة لطيفة. تمت مناقشة مناهج تجانس الأنسجة بشكل أكبر في دراسات أخرى24,25. (7) على الرغم من أن التحقق من الصحة عن طريق النشاف المناعي هو الطريقة الأكثر مباشرة وأرخص ، إلا أن نتائجه قد لا ترتبط دائما بالتغيرات على مستوى العضية بأكملها. هذا هو السبب في أننا نوصي باستخدام البروتينات للتحقق بشكل كامل من إثراء أو استنفاد الميتوكوندريا والعضيات الأخرى ، على التوالي.
سمح لنا بروتوكول تنقية الميتوكوندريا المكون من خطوتين الموصوف هنا بتوليد عينات متسلسلة مع زيادة نقاء الميتوكوندريا ، وقد مكننا ذلك من اكتشاف مرشحين جدد لبروتين الميتوكوندريا من خلال البروتينات المطروحة12. بالنسبة لتحليلنا ، نستخدم عتبات صارمة لاختيار بروتينات الميتوكوندريا المخصبة بشكل كبير ، وعلى الرغم من أن هذا قد يفشل في تحديد بعض بروتينات الميتوكوندريا المعروفة (الشكل 3 أ) ، فإن المعدل الإيجابي الكاذب لاكتشاف بروتين الميتوكوندريا الجديد ينخفض. ومع ذلك ، من المهم التأكيد على أن أي بروتينات مرشحة يكشف عنها بروتوكولنا يجب التحقق من صحتها من خلال مناهج متعامدة. نوصي بوضع علامات GFP على الكربوكسي الطرفي أو استخدام الأجسام المضادة ضد البروتين الداخلي للتحقق من الارتباط بالميتوكوندريا إما مجهريا أو عن طريق مقايسات حماية البروتياز.
يوفر التطبيق المباشر لطريقتنا في حالة الخلايا والأنسجة غير المعدلة أداة قوية للتحقيق في كيفية تغير الميتوكوندريا والتكيف مع بيئتها في الظروف الصحية والمرضية. قد يكون تطبيق بروتوكولنا على خطوط الخلايا ونماذج الأمراض الحيوانية والسوائل البشرية وحتى الخزعات من الجراحة مفيدا بشكل خاص لتعزيز فهمنا للميتوكوندريا والاضطرابات المرتبطة بها.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
نشكر مانفريدو كوادروني ، مرفق تحليل البروتين ، ومرفق المجهر الإلكتروني في جامعة لوزان على مساعدتهم. كما نشكر H.G. Sprenger و K. Maundrell وأعضاء مختبر Jourdain على المشورة والتعليقات على المخطوطة. تم دعم هذا العمل من قبل مؤسسة Pierre-Mercier pour la Science والمؤسسة الوطنية السويسرية للعلوم (منحة المشروع 310030_200796).
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | BD Plastipal | 309628 | |
| 25 G Needle | BD Microlance | 300400 | |
| 40 µm cell strainer | Corning | 352340 | |
| Anti-TOM22 Microbeads, mouse | Miltenyi Biotec | 130-127-693 | |
| Cell scraper | FisherScientific | 11577692 | |
| DMEM, high glucose, GlutaMAX | ThermoFisher | 31966 | |
| Ethylenediaminetetraacetic acid | FisherScientific | BP-120-1 | |
| Fetal bovine serum | Gibco | 10270 | |
| HEPES | BioConcept | 5-31F00-H | |
| LS columns and plungers | Miltenyi Biotec | 130-042-401 | |
| Macrophage colony-stimulating factor | Immunotools | 12343115 | |
| Mannitol | Sigma | M4125 | |
| Sodium chloride | Sigma | 71380 | |
| Sucrose | Sigma | S1888 | |
| Penicillin/Streptomycin | BioConcept | 4-01F00-H | |
| Petri dishes | Corning | BH93B-102 | |
| Phosphate-buffered saline 10X | Eurobio Scientific | CS3PBS01-01 | |
| QuadroMACS Separator | Miltenyi Biotec | 130-090-976 | |
| Vi-CELL BLU Cell Viability Analyzer | Beckman Coulter | C19196 |
References
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- West, A. P., Shadel, G. S., Ghosh, S. Mitochondria in innate immune responses. Nature Reviews Immunology. 11 (6), 389-402 (2011).
- Chakrabarty, R. P., Chandel, N. S. Mitochondria as signaling organelles control mammalian stem cell fate. Cell Stem Cell. 28 (3), 394-408 (2021).
- Morgenstern, M., et al. Quantitative high-confidence human mitochondrial proteome and its dynamics in cellular context. Cell Metabolism. 33 (12), 2464-2483 (2021).
- Rath, S., et al. MitoCarta3.0: an updated mitochondrial proteome now with sub-organelle localization and pathway annotations. Nucleic Acids Research. 49, D1541-D1547 (2021).
- Pagliarini, D. J., et al. A mitochondrial protein compendium elucidates complex I disease biology. Cell. 134 (1), 112-123 (2008).
- Diaz-Vegas, A., et al. Is mitochondrial dysfunction a common root of noncommunicable chronic diseases. Endocrine Reviews. 41 (3), 005 (2020).
- Bury, A. G., Vincent, A. E., Turnbull, D. M., Actis, P., Hudson, G. Mitochondrial isolation: when size matters. Wellcome Open Research. 5, 226 (2020).
- Chen, W. W., Freinkman, E., Sabatini, D. M. Rapid immunopurification of mitochondria for metabolite profiling and absolute quantification of matrix metabolites. Nature Protocols. 12 (10), 2215-2231 (2017).
- Daniele, J. R., Heydari, K., Arriaga, E. A., Dillin, A. Identification and characterization of mitochondrial subtypes in Caenorhabditis elegans via analysis of individual mitochondria by flow cytometry. Analytical Chemistry. 88 (12), 6309-6316 (2016).
- Franko, A., et al. Efficient isolation of pure and functional mitochondria from mouse tissues using automated tissue disruption and enrichment with anti-TOM22 magnetic beads. PLoS One. 8 (12), e82392 (2013).
- Yates, J. R., Gilchrist, A., Howell, K. E., Bergeron, J. J. M. Proteomics of organelles and large cellular structures. Nature Reviews Molecular Cell Biology. 6 (9), 702-714 (2005).
- Trouplin, V., et al. marrow-derived macrophage production. Journal of Visualized Experiments. (81), e50966 (2013).
- Ying, W., Cheruku, P. S., Bazer, F. W., Safe, S. H., Zhou, B. Investigation of macrophage polarization using bone marrow derived macrophages. Journal of Visualized Experiments. (76), e50323 (2013).
- Toda, G., Yamauchi, T., Kadowaki, T., Ueki, K. Preparation and culture of bone marrow-derived macrophages from mice for functional analysis. STAR Protocols. 2 (1), 100246 (2020).
- Gene Ontology Consortium. The Gene Ontology resource: enriching a GOld mine. Nucleic Acids Research. 49, D325-D334 (2021).
- Ashburner, M., et al. Gene ontology: tool for the unification of biology. The Gene Ontology Consortium. Nature Genetics. 25 (1), 25-29 (2000).
- Hartwig, S., et al. A critical comparison between two classical and a kit-based method for mitochondria isolation. Proteomics. 9 (11), 3209-3214 (2009).
- Delamarre, L., Pack, M., Chang, H., Mellman, I., Trombetta, E. S. Differential lysosomal proteolysis in antigen-presenting cells determines antigen fate. Science. 307 (5715), 1630-1634 (2005).
- Bayraktar, E. C., et al. MITO-Tag mice enable rapid isolation and multimodal profiling of mitochondria from specific cell types in vivo. Proceedings of the National Academy of Sciences. 116 (1), 303-312 (2019).
- Nusinow, D. P., et al. Quantitative proteomics of the cancer cell line encyclopedia. Cell. 180 (2), 387-402 (2020).
- Iuso, A., Repp, B., Biagosch, C., Terrile, C., Prokisch, H. Assessing mitochondrial bioenergetics in isolated mitochondria from various mouse tissues using seahorse XF96 analyzer. Methods in Molecular Biology. 1567, 217-230 (2017).
- Hornig-Do, H. T., et al. Isolation of functional pure mitochondria by superparamagnetic microbeads. Analytical Biochemistry. 389 (1), 1-5 (2009).
- Liao, P. C., Bergamini, C., Fato, R., Pon, L. A., Pallotti, F. Isolation of mitochondria from cells and tissues. Methods in Cell Biology. 155, 3-31 (2020).
- Lanza, I. R., Nair, K. S. Functional assessment of isolated mitochondria in vitro. Methods in Enzymology. 457, 349-372 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved