Method Article
タンパク質の発見と定量を改善するためのミトコンドリアの2段階タグフリー分離
要約
プロテオームスケールでのタンパク質の発見と定量に適合する高品質のミトコンドリア単離のための2段階プロトコルを提示します。私たちのプロトコルは遺伝子工学を必要としないため、あらゆる初代細胞や組織からのミトコンドリアの研究に適しています。
要約
中枢代謝から神経変性への免疫応答まで、ほとんどの生理学的および疾患プロセスは、ミトコンドリアを巻き込んでいます。ミトコンドリアプロテオームは1,000以上のタンパク質で構成されており、それぞれの存在量は、外部刺激に応答して、または疾患の進行中に動的に変化する可能性があります。ここでは、初代細胞および組織から高品質のミトコンドリアを単離するためのプロトコルについて説明します。2段階の手順には、(1)粗ミトコンドリアを分離するための機械的均質化と差動遠心分離、および(2)純粋な細胞小器官を分離して汚染物質を除去するためのミトコンドリアのタグフリー免疫捕捉が含まれます。各精製段階のミトコンドリアタンパク質を定量質量分析法で分析し、濃縮収率を計算することで、サブトラクティブプロテオミクスによる新規ミトコンドリアタンパク質の発見を可能にします。私たちのプロトコルは、細胞株、初代細胞、および組織のミトコンドリア含有量を研究するための高感度で包括的なアプローチを提供します。
概要
ミトコンドリアは、細胞の代謝ニーズを感知して適応することができる複雑で動的な細胞小器官です。細胞代謝の複雑さの中心であるミトコンドリアは、炭水化物、タンパク質、脂質、核酸、および補因子代謝反応が収束する代謝ハブとして機能します1。また、自然免疫応答の経路や、イオンや活性酸素種の変化に応答するシグナル伝達オルガネラとしても機能します2,3。現在までに、約1,100のタンパク質がミトコンドリア4,5,6にマッピングされていますが、特に特定の細胞型でのみ発現するタンパク質や特定の環境条件下で一過性に発現するタンパク質など、さらに多くのタンパク質が発見されていないと推測できます。関心のある代謝状態におけるミトコンドリア組成の変化を定量化するための新しいアプローチを開発することで、これらの細胞小器官に関する知識が深まり、ミトコンドリア機能障害を特徴とする障害の新しい治療手段が浮き彫りになります7。
現在、異なるミトコンドリア単離プロトコルが利用可能であり、異なる収量および純度レベル8を有する。遠心分離ベースのアプローチは、その単純さと低コストのために最も人気があります。ほとんどのアプリケーションに適していますが、示差遠心分離には、より複雑な密度勾配ベースのアプリケーションを使用する場合、ミトコンドリア純度が低くなり、大量の出発材料が必要になるという欠点があります。近年、タグベースの免疫捕捉(「MITO-IP」)9 や蛍光活性化オルガネラソーティング10など、ミトコンドリアを単離するための新しい方法が登場しています。どちらの手順でも高純度のサンプルを生成できますが、前者では、アフィニティー精製のためにミトコンドリアにタグを付けるための遺伝子工学が必要であり、プロトコルは未修飾生物またはヒトドナーからの一次資料と互換性がありません。一方、後者はフローサイトメトリーとソーティング機器へのアクセスに依存しています。異なる分離方法を組み合わせることで、より堅牢なプロトコルを生成し、純度を高めることができます。
ここでは、(1)粗ミトコンドリア画分を単離するための示差遠心分離法、および(2)ユビキタスなミトコンドリア外膜タンパク質であるミトコンドリア外膜22(Tomm22)11のトランスロカーゼに対する抗体に共有結合した超常磁性ビーズを用いたミトコンドリアのタグフリー免疫捕捉の2つの方法の組み合わせに基づくミトコンドリア単離の新しいプロトコルを提示します(図1).ここで説明する手順は、定量的タンパク質質量分析と互換性があり、タグフリーで遺伝子操作を必要としないため、細胞株から体液、動物組織全体まで、幅広い研究モデルに適用できます。さらに、プロトコルで2つのステップを使用することで、新しいミトコンドリアタンパク質の発見とその発現の研究のためのサブトラクティブプロテオミクス6,12の使用が可能になります。
プロトコル
手袋は常に着用し、細胞培養ステップは層流フードの下で実行する必要があります。細胞を5%CO2を含む37°Cのインキュベーター内で維持する。このプロトコルで提示された研究は、ローザンヌ大学とスイスの動物使用ガイドラインに準拠して承認および実施されました。
1. RAW264.7マクロファージ細胞株の培養
- 5%熱不活化ウシ胎児血清(HI-FBS)および100 IU / mLペニシリンおよび100 μg/mLストレプトマイシン(P / S)を添加した高グルコースおよびグルタミンを含むダルベッコ改変イーグル培地(DMEM)でマウスマクロファージRAW264.7細胞を増殖させます。
注:ミトコンドリアを単離するには、単一のコンフルエントな15 cmプレート(約70 x 10 7 RAW264.7細胞)で十分です。 - RAW264.7細胞を組織培養プレートで維持します。1 x 105 細胞/mLの初期播種密度は、3日でコンフルエントプレートにつながります。15 cmプレート用の培地に25 mLの細胞懸濁液を使用します。RAW264.7細胞は細胞分裂率が高く、ほとんどの細胞株よりも頻繁に分裂する必要があります。
- RAW264.7 セルの切り離し
- 培地を吸引し、リン酸緩衝生理食塩水(PBS)で細胞を1回洗浄します。
- 15 cmプレートに、8 mLの温かいRAW解離バッファー(270 mM塩化カリウム、30 mMクエン酸ナトリウム二水和物H2O中、滅菌ろ過)を加え、細胞を37°Cで5分間インキュベートします。
- 等量の培地をプレートに加え(解離バッファーの1:1希釈)、ピペットで細胞を剥離し、ホモジナイズします。
- 細胞懸濁液をコニカルチューブに移し、チューブを300 x g で室温で3分間遠心分離します。
- 上清を吸引し、細胞カウントのためにペレットを適切な量の培地(ステップ1.1で説明)に再懸濁します。
注:RAW264.7細胞を剥離するには、トリプシンやセルスクレーパーなどの他の方法を使用できます。ただし、これらの方法は細胞に対してより厳しく、剥離後の数日でM1様マクロファージへの分極につながる可能性があります。
2. 骨髄由来マクロファージ(BMDM)の単離と培養
メモ: ここで説明するプロトコルは 1 つのマウス用であり、複数のマウス用にスケールアップできます。BMDM単離および培養のための詳細なプロトコルは、他の場所に記載されている13、14。
- 高用量のCO2を含む8〜12週齢のC57BL / 6マウスを犠牲にします。
注:オスまたはメスのマウスのいずれかを使用できます。 - マウスに75%エタノールをスプレーして滅菌します。
- マウス15から腰、大腿骨、および脛骨を解剖して収集します。
- 大腿骨および脛骨から骨髄を採取するには、両骨15の膝関節端を除去する。寛骨臼を取り除くことによって腰から骨髄を回復します。
- 氷上に保持した4 mLのBMDM培地(5%HI-FBS、P/S、および10 mM HEPESを添加した高グルコースおよびグルタミンを含むDMEM)を含む50 mLのコニカルチューブに骨を移します。
注:解剖中の骨髄の乾燥を避けるために、骨を培地に入れておくことが重要です。 - 4 mLのPBSと4 mLの温かいBMDM培地を6ウェルプレートの2つの異なるウェルに加えます。
- 骨と培地を50 mLコニカルチューブから6ウェルプレートの空のウェルに移します。
- 鉗子を使用して、骨をPBSウェルに移して洗います。
- 温かいBMDM培地を含むウェルに骨を移します。
- 鉗子で2本の0.5 mLチューブの底に直径1〜2 mmの穴を開け、1.5 mLチューブに入れます。
注意: この簡単な手順のために、チューブにメディアを追加する必要はありません。 - 各0.5 mLチューブに、露出した骨の骨髄がチューブの底を向くように大腿骨、脛骨、および股関節を置きます。
- チューブを13,000 x g で室温で1分間遠心分離し、骨髄と残った培地を0.5 mLチューブの穴から1.5 mLチューブに集めます。骨の入った0.5mLチューブを廃棄します。
- 骨髄ペレットをBMDM培地に再懸濁し、15 mLのコニカルチューブに移します。
- 10 mLまでのBMDM培地を追加します。
- 40 μmのセルストレーナーを50 mLの円錐管に置き、骨髄懸濁液をろ過します。
- ろ過した懸濁液を300 x g で室温で5分間遠心分離して、無傷の細胞を回収し、細胞懸濁液から小さな破片を取り除きます。
- 50 ng/mLのマクロファージコロニー刺激因子(M-CSF)を添加した70 mLのBMDM培地を準備します。
- ペレットを10 mLのM-CSFを添加したBMDM培地に再懸濁します。
- 9 mLのM-CSFを添加したBMDM培地を7つの10 cmペトリ皿のそれぞれに追加します。
- 7つの10 cmペトリ皿のそれぞれに1 mLの細胞(約1 x 107 細胞)をプレートします。
- プレート上で慎重に上下にピペッティングして各プレートの細胞懸濁液をホモジナイズし、プレートをインキュベーターに移します。
- 3日後、50 ng/mL M-CSFを添加した5 mLの温かいBMDM培地を各プレートに追加します。
- 3日後(骨髄単離後6日目)、顕微鏡検査によりBMDMの接着と鑑別を確認します。
注:この時点で、ミトコンドリアの単離に直接進むことができます(ステップ3)。あるいは、BMDMを再プレートすることができ、これにより、サイトカインおよび小分子でそれらを治療することができる。 - BMDM の取り外し
- 各プレートから培地を吸引し、5 mMエチレンジアミン四酢酸(EDTA)を添加した7 mLの冷PBSを加えます。
- 細胞を4°Cで7〜8分間インキュベートします。
- 10 mLピペットを使用して慎重に上下にピペッティングして、BMDMSを取り外します。
- 7つのプレートすべてから再懸濁されたBMDMを単一の50 mLコニカルチューブに一緒にプールし、室温で3分間300 x g で遠心分離します。
- 上清を吸引し、細胞計数のために40 mLの温かいBMDM培地に細胞を再懸濁します。
注:マウスごとに7〜9 x 107 BMDM が得られます。プロテオミクスには、ミトコンドリアの単離に最低6 x 107 BMDMが推奨されます。 - 必要に応じて、実験目標に従ってBMDMMをプレートして処理します。そうでない場合は、手順3.3に直接進んでください。
3. 示差遠心分離による粗ミトコンドリア画分の調製
注意: すべての遠心分離ステップを4°Cで実行します。 2台の遠心分離機が必要で、1台は相対遠心力が300 x g以上の円錐管用スイングアウトローターとアダプターを備え、もう1台は1.5 mLチューブに適した相対遠心力が21,000 x g以上です。接着細胞を使用する場合は、セルスクレーパーを使用してください。
- 接着細胞の場合は、培地を吸引し、15 cmプレートあたり10 mLのPBSを追加します。
注:PBSで細胞をこすると、同時に細胞を洗浄できます。細胞がすでに懸濁液に入っている場合は、ステップ3.3に直接進んでください。 - セルスクレーパーを使用して細胞を剥離し、単一の50 mLコニカルチューブにプールします。細胞懸濁液を上下にピペッティングしてホモジナイズします。
注:細胞は、セルスクレーパーを使用して分離することができます、これはより速く、すぐに溶解されるためです。 - 各実験条件について、細胞懸濁液容量の5%を1.5 mLチューブに移し、室温で300 x g で5分間遠心分離します。
注意: 浮遊細胞を使用する場合は、FBSなどの媒体から可能性のある汚染物質を除去するために、必ず前にPBSで細胞を一度洗浄してください。 - 上清を捨て、ペレットを氷の上に保ちます。
注:これは、プロテオミクスの「全細胞」画分を表します。 - ステップ3.1または3.2の残りのサンプルを300 x g で室温で5分間遠心分離します。
- 氷上で、氷冷バッファーを使用して、以下のすべての手順を実行します。
- 上清を吸引し、細胞ペレットを5 mLの氷冷ミトコンドリアバッファー(MB)(210 mMマンニトール、70 mMスクロース、10 mM HEPES/NaOH [pH 7.4]、および1 mM EDTA)に再懸濁します。
- 300 x g で 4 °C で 5 分間遠心分離して細胞を回収します。
- 細胞ペレットを0.5 mLの冷たいMBに再懸濁し、1.5 mLチューブに移します。
注:この手順により、1.5 x 10 8BMDM 細胞/ mLまたは3 x 108 RAW264.7細胞/ mLのおおよその細胞濃度が得られます。 - 25 Gの針を取り付けた1 mLのシリンジを使用して、針を30回通過させて細胞懸濁液をホモジナイズします(図1A)。
- 1 mLの冷たいMBをチューブに加え、反転させて混合します。ホモジナイズした細胞懸濁液を2,000 x g で4°Cで5分間遠心分離します。
- 1 mLの上清を氷上で新しい1.5 mLチューブに移し、細胞ペレットを乱すことなく移します。細胞ペレットを再懸濁し、ステップ3.7のように再度ホモジナイズします。
- ホモジナイズした細胞ペレットと前の2つのステップの上清を1本の1.5 mLチューブにプールし、2,000 x g で4°Cで5分間遠心分離します。
注:この時点で、ペレットは主に核と壊れていない細胞を含み、廃棄されます。上清には、細胞破片、細胞質ゾル、およびミトコンドリアを含む細胞小器官が含まれています(図1B)。 - 上清を4本の1.5mLチューブに分けます。
注意: この段階で上清を複数のチューブに分割すると、次の手順での汚染物質の除去が改善されます。 - MBを加えて、4本のチューブのそれぞれに1 mLの最終容量を作ります。反転して混合し、チューブを13,000 x g で4°Cで10分間遠心分離します。
注:この手順の後、2つの層を持つペレットが表示されます。底のしっかりした茶色のペレットにはミトコンドリアが含まれており、さらなる精製のために保管されています(図1C)。上部の緩い白いペレットには他の細胞構造が含まれており、廃棄することができます。 - この手順は慎重に実行してください。できるだけ多くの白い上部ペレットで上清を取り除きます。その上で穏やかにピペッティングすることにより、白色ペレットを再懸濁してから廃棄し、茶色のミトコンドリアペレットをそのまま残すことができます。
- ミトコンドリアペレットを入れた4本のチューブのうちの1本を氷の上に置いてください。これは、プロテオミクスの「粗ミトコンドリア」画分を表します。
- 他の3つのペレットを1.5 mLチューブに一緒にプールし、最終容量1 mL MBにします。
4. 超常磁性抗体を用いたミトコンドリアの精製
注意: 次のすべての手順は、4°Cの冷蔵室で実行してください。
- ステップ3.18の粗ミトコンドリア製剤1 mLを15 mLのコニカルチューブに移し、150 mM NaCl(MB + NaCl)を添加した7 mLのMBを加えます。
注:NaClの添加により、抗体結合が改善され、ビーズおよびミトコンドリアへの汚染物質の非特異的結合が減少します。 - 50 μLのTomm22ビーズを8 mLの粗ミトコンドリア懸濁液(図1D)に加え、チューブを回転ホイール上で低速で4°Cで15分間インキュベートします。
注:Tomm22ビーズは、マウスで産生されたTomm22モノクローナル抗体に共有結合し、超常磁性ビーズに結合しています。 - その間、磁石の上に柱を置きます。
- カラムを 8 mL の MB + NaCl で平衡化し、フロースルーを廃棄します。
- サンプルとTomm22ビーズを4°Cで15分間インキュベートした後、サンプルをカラムに移します。フロースルーを破棄します。
注:ミトコンドリアはカラム内の磁気ビーズに付着したままになります(図1E)。 - カラムを 8 mL の MB + NaCl で 3 回洗浄します。
- カラムを磁石から取り外し、15 mLのコニカルチューブに入れます。
- 1.5 mLのMB + NaClをカラムに添加してミトコンドリアを溶出し、すぐにプランジャーを適用して精製ミトコンドリアをチューブに溶出します。
- 溶出したミトコンドリアを1.5 mLチューブに移し、21,000 x g で4°Cで10分間遠心分離します。
注:茶色のペレットが形成されます。これには、単離されたミトコンドリアといくつかの抗体結合ビーズが含まれています(図1F)。 - ペレットから上清を慎重に取り除きます。ペレットは、プロテオミクスの「純粋なミトコンドリア」画分を表します。このペレットは、ステップ3.4および3.17のペレットとともに、-20°Cで保存でき、下流の用途に使用できます。
結果
本プロトコルでは、ミトコンドリア純度が増加した3つのサンプル、すなわち全細胞、粗ミトコンドリア(「マイト原油」)、および純粋なミトコンドリア(「マイトピュア」)が生成されます(図1)。RAW264.7マクロファージ細胞株からのミトコンドリアの精製を、各画分の等量のタンパク質をゲルにロードし、イムノブロッティングにより検証し、各精製ステップでミトコンドリアクエン酸シンターゼ(Cs)が濃縮されることを発見しました。一方、細胞質ゾル(GAPDH)、原形質膜(Na/K ATPase)、核(ラミンB)、リソソーム(Lamp1)、および小胞体(ER)(Pdi)からのタンパク質は徐々に消失しました(図2A)。BMDMを用いても同様の結果が得られた。単離されたミトコンドリアの純度および完全性のさらなる検証のために、純粋なミトコンドリア画分に関する電子顕微鏡観察が実施された。抗体でコーティングされたビーズに対応する電子密度の高い粒子に囲まれた古典的な楕円形と無傷のクリステを持つミトコンドリアを観察しました(図2B)。したがって、私たちのプロトコルはミトコンドリアを豊かにし、他の細胞成分を枯渇させ、ミトコンドリアの構造的完全性を維持すると結論付けることができます。
次に、質量分析と組み合わせた液体クロマトグラフィー(LC/MS)を用いて各画分のプロテオーム解析を行った。全細胞からの抽出物中に合計6,248個のタンパク質が含まれ、そのうち907個はMitoCarta3.0インベントリ5でミトコンドリアとして以前にアノテーションされていました。少なくとも2つの固有のペプチドの閾値を持つタンパク質をフィルタリングした後、全細胞と比較した強度に基づいて、各サンプルの各タンパク質のエンリッチメントスコアを計算しました。次に、遺伝子オントロジー(GO)16,17およびMitoCarta3.05を参考にして、ミトコンドリア、ER、リソソーム、ゴルジ体、細胞骨格、核、細胞質ゾルの7つの主要な細胞内コンパートメントにタンパク質を割り付けました。重要なことに、粗および純粋なミトコンドリア画分において、それぞれ10倍以上および20倍を超えるミトコンドリアタンパク質の平均濃縮が観察された(図2C)。対照的に、分析された他の6つの細胞コンパートメントの成分は、精製手順中に枯渇した。特に注目すべきは、粗ミトコンドリア画分において、我々は、ERおよびリソソームタンパク質、異なる遠心分離プロトコルに従って頻繁に存在する2つのクラスの汚染物質タンパク質の一時的な濃縮を観察した18。これはおそらく、オルガネラ-オルガネラ相互作用および同様の沈降係数、特にマクロファージに豊富に存在するリソソームによるものでした19。どちらも免疫捕捉後にほとんど枯渇しましたが、マイト純粋画分中のER-ミトコンドリア接触部位からのタンパク質の小さなシグナルを検出しました。
次に、全細胞とマイトピュアサンプルからのタンパク質の存在量を直接比較し、ミトコンドリアタンパク質と非ミトコンドリアタンパク質に対応する2つの異なる集団を観察しました(図2D)。MitoCartaタンパク質の大部分は一緒にクラスター化していましたが、非MitoCartaタンパク質とクラスター化した数<(5%)が見つかりました。これらのタンパク質は、(1)細胞質ミトコンドリア相互作用タンパク質(MitoCartaのバージョン3.0で注釈が付けられた新しいカテゴリ)、(2)二重局在タンパク質、または(3)誤って注釈されたタンパク質を表す可能性があります。逆に、非MitoCartaタンパク質がミトコンドリアタンパク質とクラスター化している例がいくつか見つかりました。そのようなタンパク質は単離手順の夾雑物を表し得るが、それらはまた、ミトコンドリアに存在するものとして以前に分類されなかったタンパク質を表し得る。
この新しいクラスの潜在的なミトコンドリアタンパク質を調査するために、ミトコンドリア6,12を含むオルガネラプロテオームの発見に有用であることが証明されているアプローチであるサブトラクティブプロテオミクスが使用されました。サブトラクティブプロテオミクスは、精製ステップ中にミトコンドリアが濃縮され、汚染物質が枯渇すると仮定しています6。例えば、夾雑物は差動遠心分離中(例えば、同様の沈降特性のため)または免疫捕捉中(例えば、非特異的抗体結合のため)に蓄積する可能性があるが、真正なミトコンドリアタンパク質のみが両方に有意に蓄積するはずである。したがって、純粋なミトコンドリア画分で見つかったが、一貫性のない濃縮パターンを示したタンパク質を除外することが可能です。RAW264.7細胞を用いた本例では、マイト粗サンプルとマイトピュアサンプルのユニークなペプチドの閾値を≥1に設定し、濃縮の厳しい閾値を使用することにより、示差遠心分離後に粗ミトコンドリア画分に最初に見つかった1,127タンパク質から回収されたミトコンドリアプロテオームのリストを、Tomm22免疫選択を使用した2回目の精製後に481タンパク質に絞り込むことができました。マイト純粋画分中のMitoCartaアノテーションタンパク質の数の減少は、選択に適用される高いストリンジェンシーを反映しています。興味深いことに、マイトピュア画分に存在するタンパク質のうち70個は、MitoCarta3.0インベントリには存在していませんでした(図3A、B)。これらの後者のタンパク質は、RAW264.7マクロファージ細胞株および関連細胞でのみ発現する可能性のある新規ミトコンドリア候補タンパク質を表す可能性があり、さらなる調査に値する。
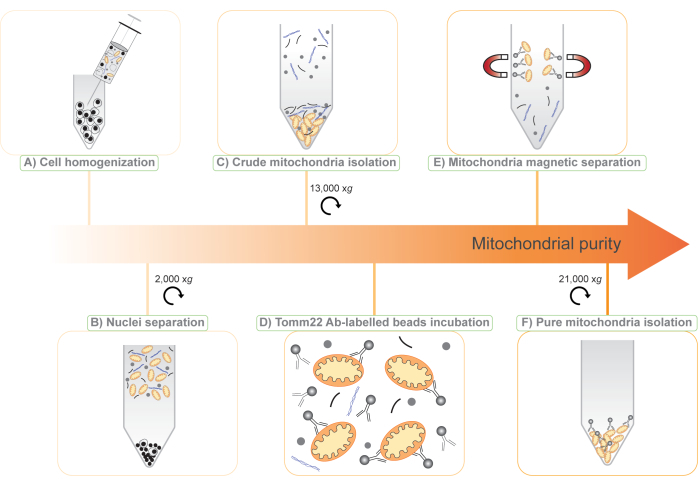
図1:2段階のタグフリーミトコンドリア分離プロトコルの図。 (A)細胞懸濁液を25G針で破壊する。(B)2,000 x gの遠心分離により核と全細胞を分離し、上清を保存します。(C)粗ミトコンドリアは、上清を13,000 x g(ミト原油)で示差遠心分離することにより単離されます。(D)次に、粗ミトコンドリアを、超常磁性ビーズに共有結合したTomm22抗体(Ab)とともにインキュベートします。(E)ミトコンドリア-Tomm22抗体ビーズ複合体を磁気カラムを用いて夾雑物から分離し、溶出する。(F)純粋なミトコンドリアを遠心分離により回収・濃縮する(mito-pure)。この図の拡大版を表示するには、ここをクリックしてください。
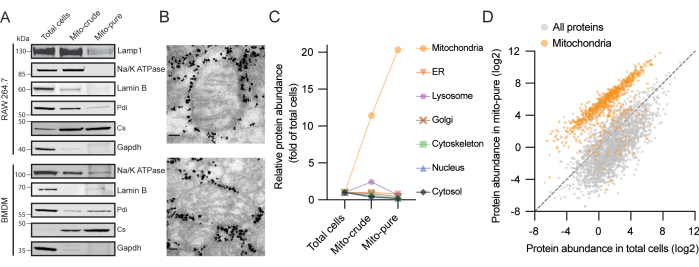
図 2.2つのマクロファージ源からのミトコンドリア単離の代表的な結果。 (A)ミトコンドリアクエン酸シンターゼ(Cs-ミトコンドリア)、グリセルアルデヒド3-リン酸デヒドロゲナーゼ(Gapdh-サイトゾル)、ナトリウム-カリウムポンプ(Na/K ATPase -原形質膜)、ラミンB(ラミンB-核)、リソソーム関連膜タンパク質1(Lamp1-リソソーム)、およびタンパク質ジスルフィドイソメラーゼ(Pdi-ER)に対する抗体を用いたRAW264.7(上)およびBMDM細胞(下)のタンパク質イムノブロット分析。(B)RAW264.7細胞からの精製ミトコンドリアの電子顕微鏡観察。ミトコンドリアを取り囲む高密度粒子は、カラムからの溶出後にマイト純粋なサンプルで運ばれるTomm22ビーズに対応します。スケールバー:80ナノメートル。(C)RAW264.7細胞の7つの細胞コンパートメントからの全細胞、マイト原油、およびマイトピュアにわたる濃縮スコア。MitoCarta3.0とGOをタンパク質アノテーションに使用し、平均スコアを示します。略語:ER =小胞体。(D)RAW264.7細胞からの総細胞およびマイトピュアサンプル中のタンパク質の存在量値(riBAQ)。MitoCarta3.0タンパク質はオレンジ色で示されています。 この図の拡大版を表示するには、ここをクリックしてください。
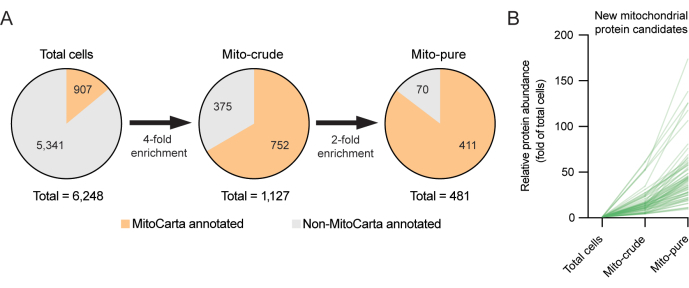
図 3.サブトラクティブプロテオミクスを用いた新規ミトコンドリアタンパク質の発見 (A)新規ミトコンドリアタンパク質の発見のためのサブトラクティブプロテオミクス戦略。誤検知の選択を最小限に抑えるために、高い選択しきい値 (4x および 2x) が適用されます。(B)MitoCarta3.0インベントリで以前にアノテーションされていない新しいミトコンドリア候補タンパク質の濃縮収率(全細胞の倍率)。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
示差遠心分離と免疫捕捉を組み合わせて、ミトコンドリア単離の純度を向上させました。私たちの手順は、新しいミトコンドリアタンパク質の同定と特性評価のための一次資料へのアクセスを可能にします。このプロトコルは簡単で堅牢であり、遺伝子組み換えを必要とせずに細胞株、初代細胞、および組織に適用できます。精製手順のさまざまな段階で採取したサンプルのイムノブロッティングおよびプロテオミクス分析により、プロトコルを検証しました。
単一の単離法と比較して、異なる性質の濃縮ステップ(ここでは遠心分離と免疫標識)の組み合わせにより、ミトコンドリアを単離するためのより堅牢なプロトコルが生成されます。これは、ミトコンドリアタンパク質は両方の精製で濃縮されますが、両方の濃縮ステップの後に汚染物質も濃縮される可能性は低いためです。高いミトコンドリア純度は密度勾配超遠心分離によっても達成できますが、このアプローチでは大量の出発物質と超遠心分離機へのアクセスが必要です。最後に、タグベースのミトコンドリア単離に基づく最近の方法とは対照的に20、私たちのアプローチはサンプルの遺伝子組み換えを必要としないため、あらゆるソースからの一次資料に適しています。
プロトコルを適用する際には、実験計画においていくつかの技術的および生物学的考慮事項を考慮する必要があります。(1)十分な材料を得るためには、出発物質の量が重要です。必然的に、すべての細胞が溶解されるわけではないため、ホモジナイズ中(ステップ3.10)、または3カラム洗浄中(ステップ4.6)に、少数のミトコンドリアが失われます。私たちのプロトコルは収量よりも純度に焦点を当てていますが、ミトコンドリア単離の効率、したがってそれらの収量は測定または最適化されていません。より多くのTomm22ビーズとより多くのカラムを使用することで、ミトコンドリア回収率が向上することが期待されます。同時に、均質化ステップの徹底的な最適化は、ミトコンドリア収量の向上にもつながります。このプロトコルと、RAW264.7細胞およびBMDMについてここで報告する初期細胞数は、プロテオミクスに適しており、他のアプリケーションに合わせて調整できます。初代BMDMMの場合、1回の複製には1匹のマウスで十分であることがわかりました。必要に応じて、手順を拡大してBMDMを複数の動物から分離し、それをプールして十分な材料を得ることができます。細胞数は、細胞の種類、サイズ、およびミトコンドリア含有量に応じて最適化できます。(2)Tomm22は、すべての細胞型および組織由来のミトコンドリアに発現している21、しかしその発現レベルは変わり得る。したがって、異なる条件を比較する実験を計画するときは、Tomm22の発現レベルが同等であることを確認することが重要です。さらに、Tomm22の遍在的発現のために、複雑な組織内の細胞型特異的ミトコンドリアタンパク質を研究することは不可能である。(3)純粋なミトコンドリアを生成するのに必要な時間(約2.5時間)は、代謝プロファイルの変化などの一時的なイベントの研究と両立しません。この場合、タグベースの直接免疫キャプチャをお勧めします9これはまた、細胞型特異的ミトコンドリアを研究することを可能にする in vivo20.(4)Tomm22抗体標識ビーズのみを用いて得られた単離されたミトコンドリアに関する研究は、機能アッセイにおいて活性を示しているが、11、私たちのプロトコルで生成されたミトコンドリアが下流の活動ベースのアッセイと互換性があるかどうかはまだ決定されていません。MitoTrackerまたはテトラメチルローダミン過塩素酸メチルエステル(TMRM)染色、または呼吸測定は、単離されたミトコンドリアの機能を定量化するための潜在的なアプローチです22.(5)カラムから「マイトピュア」サンプルを溶出した後、いくつかのTomm22ビーズが純粋なミトコンドリア画分(図 2B).トリプシン消化とタンパク質質量分析に干渉は見られませんでしたが、他のダウンストリームアプリケーションでは、これらのビーズと免疫グロブリンの存在を考慮する必要があります。Tomm22抗体は、マウスで産生されるモノクローナル抗体です23したがって、イムノブロッティングでマウスに対する二次抗体を使用する場合、免疫グロブリン鎖のサイズで非特異的バンドを生成することに留意することが重要です。(6)細胞懸濁液の完全な均質化は、ミトコンドリアの単離を成功させるための鍵です。ここでは、25 Gの針を備えたシリンジを使用して、RAW264.7細胞とBMDMSの両方を溶解します。ただし、細胞の種類とそのサイズによっては、ダウンスホモジナイザーの使用などの他の機械的均質化方法、または細胞ホモジナイザーデバイスなどのより制御されたアプローチがより適している場合があります。穏やかな超音波処理などの非機械的均質化方法も考慮することができる。組織均質化アプローチは、他の研究でさらに議論されています24,25.(7)イムノブロッティングによるバリデーションは最も簡単で安価な方法ですが、その結果は必ずしもオルガネラレベル全体の変化と相関しているとは限りません。そのため、プロテオミクスを使用して、ミトコンドリアと他の細胞小器官の濃縮または枯渇をそれぞれ完全に検証することをお勧めします。
ここで説明する2段階のミトコンドリア精製プロトコルにより、ミトコンドリア純度を高めた連続サンプルを生成することができ、これにより、サブトラクティブプロテオミクスを通じて新しいミトコンドリアタンパク質候補を発見することができました12。私たちの分析では、厳格な閾値を使用して、有意に濃縮されたミトコンドリアタンパク質を選択し、これはいくつかの既知のミトコンドリアタンパク質を特定できない可能性がありますが(図3A)、新しいミトコンドリアタンパク質発見の偽陽性率は低下します。それにもかかわらず、私たちのプロトコルによって明らかにされた候補タンパク質は、直交アプローチによって検証されなければならないことを強調することが重要です。顕微鏡またはプロテアーゼ保護アッセイによってミトコンドリアとの関連を検証するために、カルボキシ末端GFPタグまたは内因性タンパク質に対する抗体の使用をお勧めします。
改変されていない細胞や組織の場合に私たちの方法を直接適用することは、ミトコンドリアがどのように変化し、健康な状態や病気の状態でそれらの環境に適応するかを調べるための強力なツールを提供します。細胞株、動物疾患モデル、ヒト液、さらには手術による生検に私たちのプロトコルを適用することは、ミトコンドリアとそれに関連する障害の理解を深めるのに特に役立つ可能性があります。
開示事項
著者は開示するものは何もありません。
謝辞
Manfredo Quadroni、タンパク質分析施設、ローザンヌ大学の電子顕微鏡施設の支援に感謝します。また、H.G. Sprenger、K. Maundrell、およびJourdain研究室のメンバーにも、原稿に関するアドバイスとフィードバックを提供していただき、ありがとうございます。この研究は、Pierre-Mercier pour la Science財団とスイス国立科学財団(プロジェクト助成金310030_200796)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | BD Plastipal | 309628 | |
| 25 G Needle | BD Microlance | 300400 | |
| 40 µm cell strainer | Corning | 352340 | |
| Anti-TOM22 Microbeads, mouse | Miltenyi Biotec | 130-127-693 | |
| Cell scraper | FisherScientific | 11577692 | |
| DMEM, high glucose, GlutaMAX | ThermoFisher | 31966 | |
| Ethylenediaminetetraacetic acid | FisherScientific | BP-120-1 | |
| Fetal bovine serum | Gibco | 10270 | |
| HEPES | BioConcept | 5-31F00-H | |
| LS columns and plungers | Miltenyi Biotec | 130-042-401 | |
| Macrophage colony-stimulating factor | Immunotools | 12343115 | |
| Mannitol | Sigma | M4125 | |
| Sodium chloride | Sigma | 71380 | |
| Sucrose | Sigma | S1888 | |
| Penicillin/Streptomycin | BioConcept | 4-01F00-H | |
| Petri dishes | Corning | BH93B-102 | |
| Phosphate-buffered saline 10X | Eurobio Scientific | CS3PBS01-01 | |
| QuadroMACS Separator | Miltenyi Biotec | 130-090-976 | |
| Vi-CELL BLU Cell Viability Analyzer | Beckman Coulter | C19196 |
参考文献
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- West, A. P., Shadel, G. S., Ghosh, S. Mitochondria in innate immune responses. Nature Reviews Immunology. 11 (6), 389-402 (2011).
- Chakrabarty, R. P., Chandel, N. S. Mitochondria as signaling organelles control mammalian stem cell fate. Cell Stem Cell. 28 (3), 394-408 (2021).
- Morgenstern, M., et al. Quantitative high-confidence human mitochondrial proteome and its dynamics in cellular context. Cell Metabolism. 33 (12), 2464-2483 (2021).
- Rath, S., et al. MitoCarta3.0: an updated mitochondrial proteome now with sub-organelle localization and pathway annotations. Nucleic Acids Research. 49, D1541-D1547 (2021).
- Pagliarini, D. J., et al. A mitochondrial protein compendium elucidates complex I disease biology. Cell. 134 (1), 112-123 (2008).
- Diaz-Vegas, A., et al. Is mitochondrial dysfunction a common root of noncommunicable chronic diseases. Endocrine Reviews. 41 (3), 005 (2020).
- Bury, A. G., Vincent, A. E., Turnbull, D. M., Actis, P., Hudson, G. Mitochondrial isolation: when size matters. Wellcome Open Research. 5, 226 (2020).
- Chen, W. W., Freinkman, E., Sabatini, D. M. Rapid immunopurification of mitochondria for metabolite profiling and absolute quantification of matrix metabolites. Nature Protocols. 12 (10), 2215-2231 (2017).
- Daniele, J. R., Heydari, K., Arriaga, E. A., Dillin, A. Identification and characterization of mitochondrial subtypes in Caenorhabditis elegans via analysis of individual mitochondria by flow cytometry. Analytical Chemistry. 88 (12), 6309-6316 (2016).
- Franko, A., et al. Efficient isolation of pure and functional mitochondria from mouse tissues using automated tissue disruption and enrichment with anti-TOM22 magnetic beads. PLoS One. 8 (12), e82392 (2013).
- Yates, J. R., Gilchrist, A., Howell, K. E., Bergeron, J. J. M. Proteomics of organelles and large cellular structures. Nature Reviews Molecular Cell Biology. 6 (9), 702-714 (2005).
- Trouplin, V., et al. marrow-derived macrophage production. Journal of Visualized Experiments. (81), e50966 (2013).
- Ying, W., Cheruku, P. S., Bazer, F. W., Safe, S. H., Zhou, B. Investigation of macrophage polarization using bone marrow derived macrophages. Journal of Visualized Experiments. (76), e50323 (2013).
- Toda, G., Yamauchi, T., Kadowaki, T., Ueki, K. Preparation and culture of bone marrow-derived macrophages from mice for functional analysis. STAR Protocols. 2 (1), 100246 (2020).
- Gene Ontology Consortium. The Gene Ontology resource: enriching a GOld mine. Nucleic Acids Research. 49, D325-D334 (2021).
- Ashburner, M., et al. Gene ontology: tool for the unification of biology. The Gene Ontology Consortium. Nature Genetics. 25 (1), 25-29 (2000).
- Hartwig, S., et al. A critical comparison between two classical and a kit-based method for mitochondria isolation. Proteomics. 9 (11), 3209-3214 (2009).
- Delamarre, L., Pack, M., Chang, H., Mellman, I., Trombetta, E. S. Differential lysosomal proteolysis in antigen-presenting cells determines antigen fate. Science. 307 (5715), 1630-1634 (2005).
- Bayraktar, E. C., et al. MITO-Tag mice enable rapid isolation and multimodal profiling of mitochondria from specific cell types in vivo. Proceedings of the National Academy of Sciences. 116 (1), 303-312 (2019).
- Nusinow, D. P., et al. Quantitative proteomics of the cancer cell line encyclopedia. Cell. 180 (2), 387-402 (2020).
- Iuso, A., Repp, B., Biagosch, C., Terrile, C., Prokisch, H. Assessing mitochondrial bioenergetics in isolated mitochondria from various mouse tissues using seahorse XF96 analyzer. Methods in Molecular Biology. 1567, 217-230 (2017).
- Hornig-Do, H. T., et al. Isolation of functional pure mitochondria by superparamagnetic microbeads. Analytical Biochemistry. 389 (1), 1-5 (2009).
- Liao, P. C., Bergamini, C., Fato, R., Pon, L. A., Pallotti, F. Isolation of mitochondria from cells and tissues. Methods in Cell Biology. 155, 3-31 (2020).
- Lanza, I. R., Nair, K. S. Functional assessment of isolated mitochondria in vitro. Methods in Enzymology. 457, 349-372 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved