Method Article
إكس فيفو ثقافة التروية للأوعية الدموية الكبيرة في مفاعل حيوي مطبوع 3D
* These authors contributed equally
In This Article
Summary
يقدم هذا البروتوكول إعداد وتشغيل مفاعل حيوي مطبوع 3D تم تطويره حديثا للثقافة خارج الجسم الحي للأوعية الدموية في التروية. تم تصميم النظام ليتم اعتماده بسهولة من قبل المستخدمين الآخرين ، وعملي ، وبأسعار معقولة ، وقابل للتكيف مع التطبيقات التجريبية المختلفة ، مثل علم الأحياء الأساسي والدراسات الدوائية.
Abstract
تشكل أمراض الأوعية الدموية أساس معظم أمراض القلب والأوعية الدموية (CVDs) ، والتي لا تزال السبب الرئيسي للوفيات والمراضة في جميع أنحاء العالم. هناك حاجة ماسة إلى التدخلات الجراحية والدوائية الفعالة للوقاية من أمراض الأوعية الدموية وعلاجها. جزئيا ، يحد النقص في النماذج الانتقالية من فهم العمليات الخلوية والجزيئية التي تنطوي عليها أمراض الأوعية الدموية. توفر المفاعلات الحيوية لاستزراع التروية خارج الجسم الحي منصة مثالية لدراسة الأوعية الحيوانية الكبيرة (بما في ذلك البشر) في بيئة ديناميكية خاضعة للرقابة ، تجمع بين سهولة الزراعة في المختبر وتعقيد الأنسجة الحية. ومع ذلك ، فإن معظم المفاعلات الحيوية مصنعة حسب الطلب وبالتالي يصعب اعتمادها ، مما يحد من إمكانية استنساخ النتائج. تقدم هذه الورقة نظاما مطبوعا ثلاثي الأبعاد يمكن إنتاجه وتطبيقه بسهولة في أي مختبر بيولوجي ، ويوفر بروتوكولا مفصلا لإعداده ، مما يتيح تشغيل المستخدمين. يتيح نظام زراعة التروية المبتكر والقابل للتكرار زراعة الأوعية الدموية لمدة تصل إلى 7 أيام في الظروف الفسيولوجية. نتوقع أن اعتماد مفاعل حيوي موحد للتروية سيدعم فهما أفضل للعمليات الفسيولوجية والمرضية في الأوعية الدموية الحيوانية الكبيرة ويسرع اكتشاف علاجات جديدة.
Introduction
يوجد جدار الأوعية الدموية في حالة مستقرة تفاعلية ، مما يضمن كلا من الاستجابة للمنبهات الخارجية (أي تغيير الضغط ، مضيقات الأوعية) وسطح ثابت غير منشط يمنع تخثر الدم وتسلل الخلايا الالتهابية1. استجابة للمحفزات التي تعتمد على الشيخوخة ونمط الحياة وعند التلف المباشر ، ينشط جدار الأوعية الدموية عمليات إعادة البناء مثل عودة التضيق وتصلب الشرايين ، والتي من المساهمين المعروفين في أمراض القلب والأوعية الدموية الشائعة (CVDs) ، مثل السكتة الدماغية واحتشاء عضلة القلب2. في حين أن الأساليب التدخلية مثل إعادة التوعي عن طريق الجلد والدعامات متاحة لمعالجة المظاهر المتقدمة لأمراض الأوعية الدموية ، فمن المعروف أنها تثير المزيد من تلف الأوعية الدموية ، مما يؤدي في كثير من الأحيان إلى تكرارها. بالإضافة إلى ذلك ، لا تتوفر سوى حلول وقائية ومرحلة مبكرة محدودة. إن فهم الآليات التي تحافظ على توازن جدار الأوعية الدموية ودفع اختلاله الوظيفي هو في صميم تطوير علاجات جديدة3.
على الرغم من التطور المستمر والتقدم في البيولوجيا الجزيئية وهندسة الأنسجة ، تظل الدراسات على مكونا حاسما في دراسات بيولوجيا الأوعية الدموية. قدمت الدراسات على في الجسم الحي نظرة ثاقبة هائلة حول آليات التوازن الوعائي وعلم الأمراض. ومع ذلك ، فإن هذه الإجراءات مكلفة ، ولها إنتاجية منخفضة نسبيا ، وتطرح قضايا أخلاقية كبيرة. بالإضافة إلى ذلك ، فإن الصغيرة لا تمثل بشكل جيد فسيولوجيا الأوعية الدموية البشرية ، والتجارب على الأكبر حجما أغلى بكثير وتخلق المزيد من الاعتبارات الأخلاقية 4,5. مع تزايد الطلب على الحلول الصيدلانية والطبية لشيخوخة السكان بسرعة ، تتضخم الجوانب السلبية لاستخدام ، مما يؤثر على قابلية استنساخ النتائج وموثوقيتها وإمكانية نقلها إلى رعاية المرضى6.
توفر الأنظمة في المختبر منصة مبسطة لدراسة الآليات الأساسية ولكنها تفشل في تلخيص تعقيد الأنسجة بأكملها ، والتفاعلات بين الخلايا والمصفوفة خارج الخلية ، والقوى الميكانيكية ، والتي تعد محددات حاسمة في تطور أمراض الأوعية الدموية7.
تحاكي الدراسات خارج الجسم الحي التي أجريت على الأنسجة الكاملة المحفوظة في بيئات يتم التحكم فيها بشكل مصطنع التعقيد في الجسم الحي مع تمكين التحقيقات عالية الإنتاجيةنسبيا 8. نظرا للقدرة على التحكم عن كثب في ظروف الاستزراع والبيئة ، تسمح النماذج خارج الجسم الحي بمجموعة واسعة من الدراسات المعقدة وتوفر بديلا مناسبا لتقليل استخدام الإجراءات الحيوانية في بيولوجيا الأوعية الدموية. قدمت ثقافات الحلقة الوعائية الثابتة رؤى مثيرة للاهتمام ولكنها فشلت في دمج عنصر الدورة الدموية الحاسم9. في الواقع ، تطرح دراسة نظام الأوعية الدموية خارج الجسم الحي تحديات محددة تتعلق بالعديد من القوى الديناميكية التي تنطبق على الخلايا داخل جدار الأوعية الدموية. تؤثر المحفزات مثل التدفق اللمعي والاضطراب وإجهاد القص والضغط وتشوه الجدار بشكل كبير على الفيزيولوجيا المرضية للأنسجة10،11،12.
تعتبر المفاعلات الحيوية للتروية ضرورية لدراسة التوازن الوعائي وإعادة تشكيله استجابة للإصابة أو تغيرات الدورة الدموية13. علاوة على ذلك ، يمكن استخدام مزرعة التروية لتحسين نضج ومتانة الأوعية الدموية المهندسة بالأنسجة (TEBVs) ، مما يوفر بدائل مناسبة لترقيع الأوعية الدموية14.
المفاعلات الحيوية للتروية المتاحة تجاريا محدودة من حيث المرونة والقدرة على التكيف وهي مكلفة. بدلا من ذلك ، يصعب تكرار العديد من المفاعلات الحيوية المطورة داخليا في مختبرات أخرى ، بسبب الأوصاف المحدودة وعدم توفر المكوناتالمصنوعة خصيصا 7،8،9،10،11،12. للتغلب على هذه القيود ، قمنا مؤخرا بتطوير مفاعل حيوي جديد (EasyFlow) ، وهو اقتصادي في الإنتاج ، ويستوعب مجموعة من الأنسجة ، ويتيح تعديلات بسيطة نسبيا للتكيف مع متطلبات البحث المختلفة13. الملحق مطبوع 3D ويناسب كما هو الحال في غطاء أنبوب طرد مركزي قياسي سعة 50 مل. تصميمها المعياري وتصنيع الطباعة 3D يجعلها متاحة وقابلة للتكرار عبر مختبرات مختلفة ، وكذلك قابلة للتعديل بسهولة للتكيف مع الاحتياجات العلمية المختلفة. يصف هذا البروتوكول التجميع والتشغيل الأساسي لنظام المفاعل الحيوي في بيئة التروية الشريانية.
Protocol
يصف هذا البروتوكول تجميع واستخدام نظام يتكون من إدراجين EasyFlow (مفاعل حيوي): أحدهما يمثل غرفة التفاعل (C) ، التي تحتوي على عينة الشريان المثقوبة ، والآخر يعمل كخزان متوسط (R) (الشكل 1 والشكل 2A). تم الحصول على الشرايين السباتية من الخنازير الذكور والإناث البالغة من العمر 4-6 أسابيع (6-12 كجم) في معهد بيربرايت بالمملكة المتحدة. تم تنفيذ إجراءات بموجب قانون (الإجراءات العلمية) التابع لوزارة الداخلية (1986) (ASPA) ووافق عليه مجلس رعاية والمراجعة الأخلاقية (AWERB) في معهد بيربرايت. تم إيواء وفقا لمدونة قواعد الممارسة الخاصة بإسكان ورعاية التي تم تربيتها. تم تنفيذ جميع الإجراءات من قبل حاملي التراخيص الشخصية الذين تم تدريبهم وكفاءتهم بموجب ترخيص المشروع PPL70/8852. تم إعدام الخنازير وفقا للجدول الزمني طريقة واحدة تحت ASPA.
1. إدراج التصنيع
- قم بتصنيع الملحق بالطباعة ثلاثية الأبعاد ، باستخدام النموذج ثلاثي الأبعاد المقدم (الملف التكميلي 1).
ملاحظة: تتيح النمذجة ثلاثية الأبعاد (3D) إجراء تغييرات سهلة على التصميم للتكيف مع التطبيقات الجديدة. يمكن أيضا استخدام مواد بديلة وتقنيات تصنيع بديلة لإنتاج الإدخال. نظرا للهيكل الداخلي المعقد ، فإن التلبيد الانتقائي بالليزر والطباعة الحجرية المجسمة هي بدائل مناسبة15. يعتبر البولي أميد 12 (PA12 ؛ انظر جدول المواد) مرشحا جيدا للمواد نظرا لأدائه المتفوق من حيث احتباس السوائل ومقاومة دورات التعقيم الحراري المتكررة16. - تصنيع حشيات السيليكون وغسالات البولي كربونات عن طريق القطعبالليزر 17 ، باستخدام التصاميم الواردة في الملف التكميلي 2.
ملاحظة: يتم الاستعانة بمصادر خارجية للقطع بالليزر بسهولة وطريقة تصنيع رخيصة. يمكن تصنيع الغسالات من الفولاذ المقاوم للصدأ ، مما يوفر مكونا أكثر مقاومة للاستخدام المتكرر. جميع المكونات الأخرى هي عناصر متوفرة تجاريا. وترد في الجدول 1 قائمة كاملة بالمواد المطلوبة. يتم تضمين التفاصيل التجارية للعناصر في جدول المواد.
2. تعقيم الجهاز وتجميعه وفتيلته
- تعقيم جميع المكونات باتباع التعليمات الواردة في الجدول 1.
- في ظل ظروف التدفق الصفحي ، قم بتجميع إدخالين ملفقين (الخطوة 1) ، كما هو موضح في الشكل 1 أ.
- قم بتجميع نظام التروية كما في الشكل 2 ، باتباع الخطوات التالية:
- قم بتوصيل صمامين متصلين ثلاثي الاتجاهات بمنفذ R1 الخاص بالخزان (منفذ تبادل الوسائط).
- قم بتوصيل المخرج الناتج برأس المضخة التمعجية باستخدام أنبوب مزود بصمام أحادي الاتجاه (أنبوب صمام أحادي الاتجاه).
- قم بتوصيل رأس المضخة بمنفذ C4 في غرفة التفاعل باستخدام أنبوب نظام مزود بصمام أحادي الاتجاه.
ملاحظة: يمكن تجهيز هذا الفرع اختياريا بجهاز استشعار ضغط يتيح المراقبة المستمرة. - قم بتوصيل منفذ غرفة التفاعل C1 بأنابيب الجدار الناعمة ، وهذا بقناة المقاومة (القطر الداخلي الصغير).
ملاحظة: سيؤثر طول أنبوب المقاومة بشكل كبير على الضغط الموجود في النظام. يجب إجراء مزيد من التحقيق في هذا لضمان ظروف التروية المناسبة. - قم بتمديد قناة المقاومة باستخدام أنبوب النظام ، وإنشاء قناة عودة وإغلاق حلقة الدوران اللمعية عن طريق الاتصال بالخزان عند R5 (الشكل 2C).
- قم بإنشاء قناة فائض عن طريق توصيل غرفة التفاعل C3 بالخزان R3 بأنابيب النظام.
- قم بتوصيل مرشح تهوية من خلال R2.
- قم بإنشاء مخمد ضغط عن طريق توصيل حقنة تحتوي على الهواء والوسائط بغرفة التفاعل C6.
ملاحظة: ستعتمد نسبة الهواء إلى الوسائط الصحيحة على تخفيف الضغط المطلوب.
- قم بتجهيز النظام بوسط التروية (وسط النسر المعدل من Dulbecco [DMEM] + 10٪ [v / v] مصل بقري جنيني [FBS] + 1٪ [v / v] البنسلين - الستربتومايسين + 1٪ [v / v] الأمفوتريسين B + 30٪ [v / v] ديكستران ؛ انظر جدول المواد) من خلال منافذ تبادل الوسائط والخزان.
ملاحظة: يقلل تحضير النظام من خطر وجود فقاعات محاصرة في النظام ويحدد أي تسرب محتمل. حجم الوسائط الموصى به حوالي 100-120 مل. يعتمد الحجم المستخدم على الحجم الميت للأنبوب المستخدم في التجريب.
3. حصاد العينات وإعدادها
- جمع الشرايين السباتية المشتركة اليسرى واليمنى ، مما يقلل من المعالجة المباشرة للأنسجة الشريانية13.
- ضع الأنسجة في وسائط النقل البارد (DMEM + 20٪ [v / v] FBS + 2٪ [v / v] البنسلين - الستربتومايسين + 1٪ [v / v] الأمفوتريسين B ، انظر جدول المواد) للنقل.
- في خزانة التدفق الصفحي ، قم بإزالة النسيج الضام الزائد وتقليم نهايات الأنسجة باستخدام شفرة مشرط. اغسل المنديل مرتين في وسائط النقل الباردة.
- ضع المنديل على شاكر مداري في وسائط النقل لمدة 30 دقيقة على الأقل لغسله جيدا.
- قم بتوصيل جزء غير متفرع من الشريان بنظام المفاعل الحيوي باستخدام موصلين شائكين وتثبيته في مكانه باستخدام رابطة وعائية (روابط سيليكون وعائية ؛ الجدول 1).
ملاحظة: توفر رابطة الوعاء الشد والتراجع المناسبين لتأمين السفينة. القسم البيضاوي يمنع تلف الأنسجة. - تدفق الوسائط برفق عبر الشريان للتحقق من المباح.
- بعد تثبيت الشريان بالإدخال المصنع ، املأ مساحة التفاعل بوسائط التروية (الخطوة 2.4). أخيرا ، املأ حلقة الدوران اللمعية برفق بالوسائط للتخلص من أي هواء متبقي من النظام.
- قم بتوصيل مساحة التفاعل بنظام التروية الذي تم تجميعه مسبقا (القسم 2) ، واستكمال الدورة الدموية.
ملاحظة: يوصى بإجراء فحص الجودة عن طريق الكيمياء الهيستولوجية المناعية للأنسجة المصنعة. هذا يحدد أي ضرر بسبب الإفراط في التعامل أثناء التحضير.
4. ثقافة التروية وتغيير وسائل الإعلام
- ضع نظام التروية في حاضنة 37 درجة مئوية مع 5٪ CO2 ثم قم بتوصيله بمضخة تمعجية (انظر جدول المواد)
- قم بتوصيل أي أنظمة اكتساب إضافية (اختيارية) ، مثل مستشعرات الضغط (انظر جدول المواد).
- اترك النظام ليتوازن بين عشية وضحاها مع معدل تدفق وسائط منخفض ~ 10-15 مل / دقيقة.
ملاحظة: يلزم إجراء تجارب أولية لتحديد إعدادات المضخة وتدفق الوسائط وضغط النظام وإعدادات مخمدات الضغط / المشابك المثلى لضمان استيفاء الشروط المناسبة. - في اليوم التالي ، قم بزيادة التدفق بشكل تدريجي (+1 دورة في الدقيقة كل ساعة ، أي ما يعادل ~ 2.5 مل / دقيقة زيادة كل ساعة ، في النظام الحالي) حتى يتم تحقيق معدل التدفق النهائي (35 مل / دقيقة). مراقبة النظام بشكل دوري بحثا عن التسريبات.
ملاحظة: لحساب معدل التدفق الدقيق بناء على سرعة المضخة التمعجية ، يجب على المستخدمين أولا إجراء معايرة كافية للمضخة18. باستخدام الصيغة (1) ، يمكن حساب معدل التدفق الحجمي (Q) بناء على الحجم الذي تم الاستغناء عنه (V) خلال وقت معين (t). لحساب سرعة التدفق المقدرة () يمكننا استخدام معدل التدفق المحسوب مسبقا (Q) ومساحة المقطع العرضي للوعاء (A) ، الموضحة في المعادلة (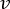 2).
2).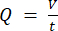 (1)
(1)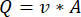 (2)
(2) - كل 3 أيام ، قم بتبادل 50٪ من الوسائط (~ 50 مل) عن طريق توصيل حقنة واحدة مملوءة بوسائط جديدة بمنفذ تبادل الوسائط الأقرب إلى المضخة وحقنة فارغة بالميناء الأقرب إلى الخزان لجمع الوسيط المستهلك (الشكل 2).
ملاحظة: إن استخدام صمامين ثلاثيين كمنافذ لتبادل الوسائط يسهل التشغيل المستمر للتروية أثناء التبادل الوسيط. - في نهاية التجربة ، قم بحصاد الأنسجة من غرفة التفاعل عن طريق تقليم الأطراف المتصلة بالمفاعل الحيوي باستخدام مقص جراحي معقم.
- تفكيك وتنظيف وتعقيم النظام لمزيد من الاستخدام.
5. تحليل العينات
- ثبت العينة المحصودة في 4٪ بارافورمالدهايد (PFA) طوال الليل عند 4 درجات مئوية.
- قم بتضمين الأنسجة في درجة حرارة القطع المثلى (OCT ؛ انظر جدول المواد) 19 وقم بتجميدها عن طريق الغمر في iso-pentane المبرد في النيتروجين السائل.
- احصل على مقاطع تبريد بسمك 3-5 مم باستخدام cryostat.
- إجراء الكيمياء الهيستولوجية المناعية (الهيماتوكسيلين ويوزين [H&E]) و / أو التألق المناعي. اتبع بروتوكول التألق المناعي النموذجي:
- قم بسد الشرائح لمدة 1 ساعة في درجة حرارة الغرفة باستخدام 20٪ [v / v] مصل الماعز في محلول ملحي مخزن بالفوسفات (PBS ؛ انظر جدول المواد).
- احتضان الشرائح طوال الليل عند 4 درجات مئوية مع الجسم المضاد الأولي للأرنب ضد CD31 المخفف 1:50 في PBS (انظر جدول المواد).
- اغسل ثلاث مرات مع برنامج تلفزيوني لمدة 5 دقائق.
- احتضان لمدة ساعة واحدة عند 37 درجة مئوية مع الجسم المضاد الثانوي المضاد للأرانب الفلوري المخفف 1: 200 في PBS وأكتين العضلات الملساء α (SMA) الجسم المضاد الفلوري المترافق مباشرة المخفف 1: 200 في PBS (انظر جدول المواد).
- اغسل ثلاث مرات مع برنامج تلفزيوني لمدة 5 دقائق.
- قم بتلطيخ النوى باستخدام DAPI المخفف 1: 1000 في برنامج تلفزيوني لمدة 10 دقائق في درجة حرارة الغرفة.
- احتضان مع 0.1٪ (وزن / حجم) أسود سوداني (انظر جدول المواد) في 70٪ (v / v) إيثانول لمدة 10 دقائق في درجة حرارة الغرفة لتقليل التألق الذاتي للأنسجة.
- اغسل الأنسجة بالماء منزوع الأيونات بكثرة. قم بتركيب الشرائح في وسط التركيب.
- صور العينات باستخدام مجهر المسح الضوئي بالليزر متحد البؤر.
النتائج
أنشأت هذه الدراسة نظام تروية متعدد الاستخدامات وبأسعار معقولة (EasyFlow)13. يسهل التصميم المطبوع 3D للنظام اعتماد النظام من قبل المختبرات الأخرى وبالتالي يشجع على التكاثر.
يتم وضع ملحق التروية المصنع في أنبوب طرد مركزي سعة 50 مل ، مما يخلق بيئة معزولة. باستخدام اثنين من إدراج التروية ، يمكن إنشاء حلقة نضح تحتوي على خزان وغرفة تفاعل ، حيث يتم تحضين العينة البيولوجية. ثم يتم توصيل نظام التروية بمضخة تمعجية وأنظمة اكتساب اختيارية ، مثل مستشعرات الضغط وأجهزة الموجات فوق الصوتية ، لمراقبة ظروف الاستزراع (الشكل 2).
تم جمع عينات الشريان السباتي الخنازير ومعالجتها قبل استزراعها في التروية لمدة 7 أيام. لضمان جودة الأنسجة قبل الاستزراع ، تم إجراء تجارب أولية حيث تم تثبيت العينات في وقت الاستئصال ، وبعد تحضير الأنسجة ، وبعد التروية. تم استخدام تلطيخ الفلورسنت لعلامات البطانة (CD31) والعضلات الملساء (αSMA) لتقييم الحفاظ على سلامة الأنسجة. يتم عرض أمثلة على الأنسجة المحفوظة جيدا والتالفة في الشكل 3 للمقارنة . تظهر الصور أهمية التعامل اللطيف مع الأنسجة في وقت الاستئصال ، حيث أن المعالجة غير الصحيحة (التمدد المفرط ، والسحق ، وما إلى ذلك) قد تؤدي إلى فقدان البطانة قبل الثقافة. تظهر النتائج أيضا أهمية الإنشاء التدريجي للتروية لتجنب تلف اللمعة.
تم إجراء تلطيخ H&E جنبا إلى جنب مع تلطيخ التألق المناعي (IF) لإظهار الحفاظ على التشكل والتوزيع العام للخلايا في جدار الوعاء الدموي بعد 7 أيام من المزرعة (الشكل 4). يضمن تطبيق ظروف الثقافة الفسيولوجية في الجهاز الحفاظ على التغطية البطانية للتجويف ، ومحاذاة خلايا العضلات الملساء في الوسائط ، والحفاظ على الأوعية الدموية في adventitia.
يسمح التصميم المدمج والمعياري لنظام المفاعل الحيوي أيضا بمجموعة واسعة من إعدادات النظام. يتكون الإعداد الأصغر من مفاعل حيوي واحد وهو مثالي للدراسات الدوائية وذات الحجم المنخفض (إعادة تدوير التروية20 ، الحجم الإجمالي 50-70 مل). لزيادة طول الثقافة وتقليل عدد التغييرات في الوسائط ، يعد نظام دوران خزان واحد ، مثل النظام الموصوف في هذا البروتوكول ، أو نظام التغذية الثابتة أكثر مثالية ، حيث يحتوي على حجم أكبر من الوسط في الدورة الدموية. يمكن إنشاء إعداد دورانمزدوج 21 لاستكشاف الإعدادات التجريبية حيث يكون توطين المحفزات أمرا بالغ الأهمية. يمكن أيضا دمج الجهاز الحالي مع أنظمة تحكم أكثر تطورا لتمكين التحكم الدقيق في التغذية المرتدة لمعلمات مثل الأس الهيدروجيني والأكسجين المذاب (الشكل 5).
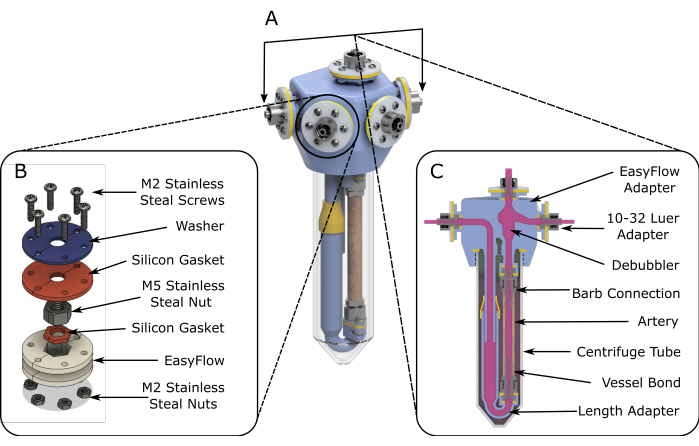
الشكل 1: مخططات تجميع EasyFlow. (أ) 3D قدمت المخططات التي تساعد على تجميع إدراج التروية. (ب) يتم توفير مخططات مفصلة لتسهيل تجميع مواقع التوصيل. (ج) يبرز عرض المقطع العرضي لحيز التفاعل المكونات الأساسية لملحق EasyFlow وتوصيل النسيج بالإدخال. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
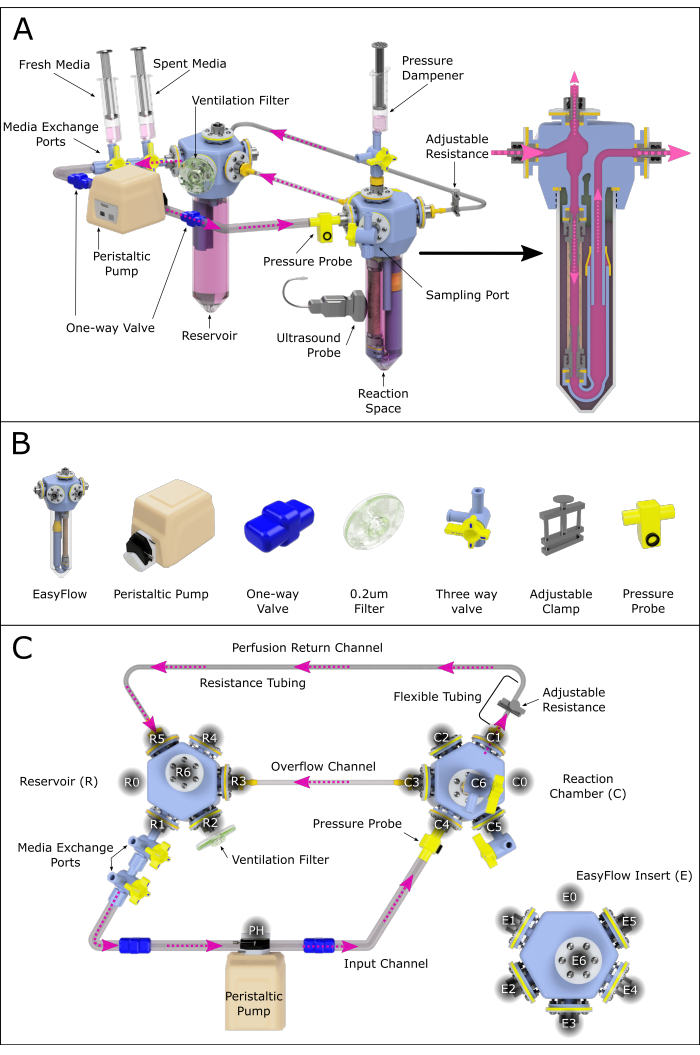
الشكل 2: تمثيل تخطيطي لتجميع نظام التروية. (أ) نظام التروية المجمع الذي يحتوي على جميع المكونات الهامة ، مع إبراز موقعها النسبي في بيئة 3D. ليست كل المكونات على نطاق واسع. (ب) يتم أيضا عرض مناظر متساوية القياس فردية للمكونات. (ج) يظهر منظر علوي لنظام التروية المجمع للمساعدة في تجميع المكونات المختلفة وتوصيلها. تم تسمية المنافذ وترقيمها عكس اتجاه عقارب الساعة للتنقل في مواقع الاتصال المختلفة عبر نظام التروية. تم تطبيق هذا المبدأ على الخزان (R) وغرفة التفاعل (C). كما خصصت أسماء لمختلف القنوات التي تربط بين المجلسين للرجوع إليها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
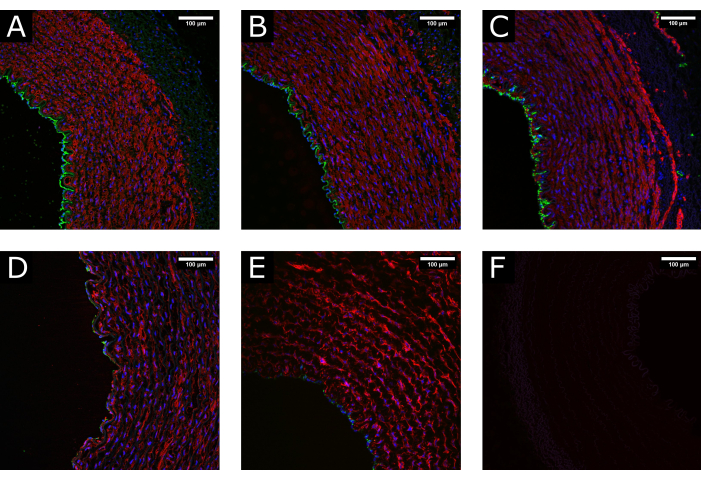
الشكل 3: صيانة الأنسجة أثناء المعالجة. (أ) تظهر الصور متحدة البؤر البنية الطبيعية للشريان في وقت الحصاد ، (ب) بعد التنظيف والمعالجة ، و (ج) بعد ثقافة التروية ، مما يدل على الحفاظ على مورفولوجيا محفوظة جيدا. (د) أمثلة على الأنسجة التالفة بسبب المناولة المفرطة أو غير الصحيحة أثناء المعالجة أو (ه) بسبب تطبيق ظروف الثقافة غير الفسيولوجية (أي البدء المفاجئ للتدفق العالي) تظهر استنفاد التغطية اللمعية وتعطيل الوسائط. (F) يشير التحكم السلبي إلى خصوصية التلطيخ. CD31: أخضر ؛ αSMA: أحمر. دابي: أزرق. قضبان المقياس: 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
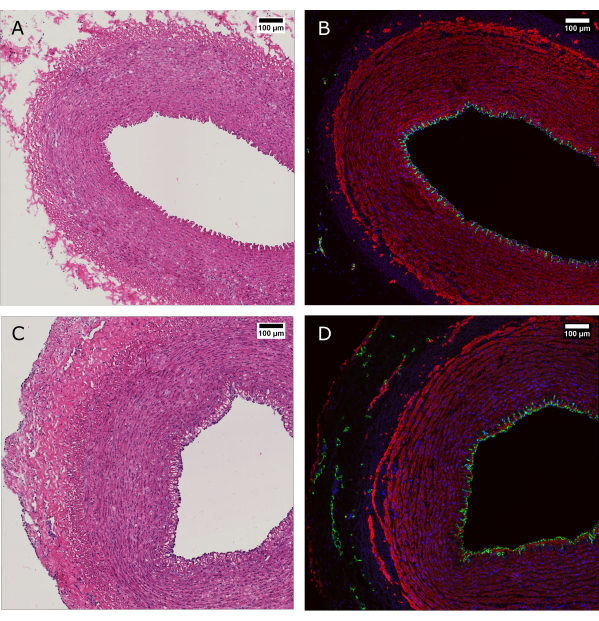
الشكل 4: التقييم النسيجي للأنسجة قبل زراعة التروية وبعدها. (أ و ب) تم تقييم الأنسجة الشريانية عن طريق الأنسجة في وقت الحصاد و (C و D) بعد 7 أيام من الزراعة بنظام المفاعل الحيوي. (أ وجيم) يكشف تلطيخ H&E عن الحفاظ على هيكل جدار الشرايين وتنظيمه. (ب ود) تلطيخ التألق المناعي لنفس الأنسجة يدل على التغطية البطانية ، ومحاذاة خلايا العضلات الملساء ، و vasa vasorum في adventitia. CD31: أخضر ؛ SMA: أحمر. دابي: أزرق. قضبان المقياس: 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
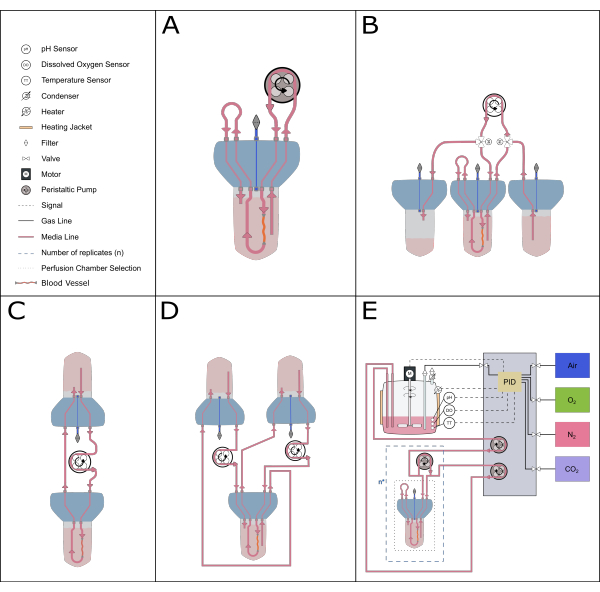
الشكل 5: تمثيل تخطيطي لإعدادات التروية المحتملة. يمكن استيعاب إعدادات بديلة مختلفة مع إدخال التروية لتمكين الدراسات التجريبية المختلفة. (أ) يقلل إعداد التروية المعاد تدويرها من حجم الوسط المطلوب. (ب) يوفر إعداد التغذية المستمر إمدادا ثابتا من الوسط للنسيج. (ج) يوفر دوران الخزان الفردي (كما هو موضح في هذه الورقة) حجما أكبر من الوسائط للحضانات طويلة الأجل ويتضمن منطقة عازلة لتبادل الهواء وتوازن الضغط. (د) يوفر إعداد الدوران المزدوج حلقتين متميزتين تغذي الدورتين الداخلية (داخل الشريان) والخارجية (مساحة التفاعل) بشكل مستقل. (ه) يتضمن إعداد التروية الديناميكي الغازات المستمرة والتحكم في الأس الهيدروجيني بواسطة وحدة تحكم مشتقة متناسبة (PID). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: مكونات لتصنيع الإدراجات. الرجاء الضغط هنا لتنزيل هذا الجدول.
الملف التكميلي 1: نموذج ثلاثي الأبعاد لإدراج EasyFlow لتصنيع الطباعة ثلاثية الأبعاد. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 2: مخططات التصميم للجهاز الذي تم إنشاؤه ، وعرض القسم ، والطباعة ، ومكونات الختم. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
تشكل أنظمة التروية الوعائية خارج الجسم الحي منصة فريدة لدراسة وظيفة وسلوك خلايا الأوعية الدموية داخل أنسجتها الأصلية في ظل ظروف خاضعة للرقابة ، مما يتيح تشريح العمليات المعقدة مثل إعادة تشكيل الأوعية الدموية بعد الإصابة22. ومع ذلك ، فإن معظم المفاعلات الحيوية المبلغ عنها هي أنظمة داخلية الصنع تعتمد على مكونات مصنوعة خصيصا وغالبا ما يصعب تكرارها من قبل الآخرين23. توجد حلول تجارية بديلة ، ولكنها تفتقر إلى المرونة في التصميم ويمكن أن تكون مكلفة نسبيا24.
لقد قمنا بتطوير نظام بديل يوفر منصة سهلة ورخيصة وقابلة للتكرار يمكن تصنيعها باستخدام تقنيات الطباعة ثلاثية الأبعاد مفتوحة المصدر13. توضح هذه المقالة إعداد النظام لتمكين التطبيقات القابلة للتكرار من قبل المستخدمين النهائيين. يتيح هذا الإعداد تطبيق الظروف الفسيولوجية والمرضية للضغط (40-180 مم زئبق) ، ومعدل التدفق (6-30 مل / دقيقة) ، وبالاقتران مع الوسائط التي تحاكي لزوجة الدم ، بدرجات متفاوتة من إجهاد القص.
تعد قابلية التكاثر جانبا أساسيا من العملية العلمية ، لأنها تسمح للباحثين بالتحقق من صحة نتائج الآخرين والبناء عليها للتقدم في فهمنا لأمراض الأوعية الدموية. علاوة على ذلك ، فإن الأدوات التي تمكن وتعزز التعاون بين المجموعات ضرورية للنهوض بالمعرفة العلمية. يمثل EasyFlow مثالا على هذه الحلول مفتوحة المصدر والتي يمكن الوصول إليها والتي يمكن إنتاجها واعتمادها بسهولة من قبل المختبرات التي تعمل في مجموعة واسعة من المشاريع في مجال علوم الأوعية الدموية وخارجها.
أبلغنا أن ثقافة الجهاز هذه تحافظ على صلاحية الأنسجة الشريانية لمدة 7 أيام على الأقل ، ويمكن استخدامها لنمذجة خطوات محددة لأمراض الأوعية الدموية. باستخدام هذا ، يمكن للمرء نمذجة معدلات التدفق الفسيولوجية وظروف الضغط13. الأهم من ذلك ، أن ثقافة التروية هذه فعالة من حيث التكلفة بسبب انخفاض تكاليف الإنتاج وانخفاض حجم الوسط اللازم لتشغيل النظام.
يمكن أيضا تكييف تصميم 3D مع التطبيقات الجديدة ، ويمكن اختبار مواد جديدة للطباعة. حتى في شكلها الحالي ، يمكن تكييف مساحة الإقامة النموذجية بسهولة مع عينات ذات أحجام مختلفة عن طريق تغيير طول التركيبات أو تجويف موصلات luer. من المهم ملاحظة أنه نظرا للطبيعة المعيارية للجهاز وأبعاده الصغيرة ، يمكن استخدام هذا المفاعل الحيوي في العديد من الإعدادات (الشكل 5) ويمكن تطبيقه على الثقافات المتعددة ، حيث يمكن أن تتعرض عدة عينات لظروف مختلفة في نفس الوقت في مفاعلات حيوية منفصلة.
من المتوقع أن يتم توسيع استخدام النظام في المستقبل لدعم زراعة الأوعية الدموية من أصول مختلفة (على سبيل المثال ، أنواع مختلفة) وذات طبيعة مختلفة (مثل الأوردة واللمفاوية) ، وربما يتم تطبيقها على زراعة الأنسجة المجوفة الأخرى (مثل القصبة الهوائية والأمعاء). على وجه الخصوص ، تظهر الأبحاث أن زراعة السقالات المهندسة بالأنسجة في التروية المستمرة يساعد على التوزيع المتجانس للخلايا داخل بناء ونضج الأنسجة الناتجة25,26. بالإضافة إلى ذلك ، يساهم زرع الطعوم الوعائية في التروية في تحقيق تجويف وعائي خلوي أكثر اتساقا ، مقارنة بالطرقالثابتة 27. لهذا السبب ، نتصور أن يتم تطبيق النظام على هندسة الأنسجة للمساعدة في مواجهة التحديات الحالية ، مما يسمح بالتطوير المستقبلي لبدائل الأوعية الدموية الاصطناعية القابلة للتكرار28.
يقدم البروتوكول الموصوف هنا بعض الخطوات المهمة الحاسمة لنجاح ثقافة التدفق. إن إنشاء ومراقبة ظروف التدفق المناسبة ليس بالأمر الهين ويجب إجراؤه على كل نظام عند إعداده لأول مرة ، للتأكد من أن ظروف الاستزراع فسيولوجية. تمت مراقبة التدفق والضغط باستخدام مستشعرات الضغط والتصوير بالموجات فوق الصوتية. نقطة أخرى حاسمة هي التأكد من أن الأنسجة قابلة للحياة وسليمة في بداية الثقافة. وهذا يتطلب مصدرا جديدا ومعالجة دقيقة ويمكن التحقق منه عن طريق التحليل النسيجي. بالإضافة إلى ذلك ، يجب إجراء استكشاف الأخطاء وإصلاحها في بداية كل تجربة لتحديد أي تلوث بكتيري محتمل أو مصدر تسرب الوسائط.
من المهم تسليط الضوء على أن نظام التروية الموصوف ، مع توفير الضغط الفسيولوجي وظروف التدفق ، غير قادر على تقليد أنماط موجة الضغط المعقدة المسجلة في الجسم الحي تماما. يعزى هذا القيد إلى استخدام مضخة تمعجية ويمكن حلها باستخدام معدات أكثر تخصصا لإعادة إنتاج ظروف الدورة الدموية المتقدمة. كما أن زراعة الأوعية الدموية في المفاعل الحيوي غير قادرة على معالجة الدراسات التي يكون فيها الجهاز المناعي أو التفاعل مع الأعضاء الأخرى أمرا بالغ الأهمية.
في الختام ، يتم تقديم نظام نضح مطبوع 3D بسيط يمكنه تقليد بيئة الدورة الدموية الفسيولوجية ، والتي من المتوقع أن تساهم في توحيد ثقافات الأوعية الدموية خارج الجسم الحي . إن قدرتها على التخصيص والتطبيق على الثقافة طويلة الأجل تجعلها أداة أساسية لتعزيز فهم هذه الأنظمة البيولوجية المعقدة في علم وظائف الأعضاء والحالات المرضية.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
يود المؤلفون أن يشكروا مركز علم الأمراض البيطرية في كلية الطب البيطري بجامعة ساري على خدمات علم الأنسجة. كما نشكر الدكتور ل. ديكسون ، أ. ريس ، و م. هينستوك من معهد بيربرايت (بيربرايت ، المملكة المتحدة) على دعمهم في شراء الأنسجة الحيوانية ، وقسم العلوم الكيميائية الحيوية في جامعة ساري ، وخاصة الفريق الفني ، على دعمهم المستمر. تم دعم RSM من خلال جائزة منحة كلية الدكتوراه (جامعة ساري) ، وتم دعم DM و PC من قبل المركز الوطني لاستبدال وصقل وتقليل في الأبحاث (أرقام المنح: NC / R001006 / 1 و NC / T001216 / 1).
Materials
| Name | Company | Catalog Number | Comments |
| EasyFlow | - | - | 3D printed by MultiJet Fusion by Protolabs |
| PA12 - 3D printing | Protolabs | - | - |
| Peristaltic pump | Heidolph | PD5201 | |
| Culture media components: | |||
| Amphotericin B solution, 250 mug/mL in deionized water | Sigma-Aldrich | A2942-20ML | |
| Dextran from Leuconostoc spp. | Sigma-Aldrich | D8802-25ML | |
| Dulbecco's Modified Eagle's Medium - high glucose, w/ 4500 mg/L glucose, L-glutamine, sodium pyruvate, and sodium bicarbonate | Sigma-Aldrich | D6429-6X500ML | |
| Fetal Bovine Serum | Sigma-Aldrich | F9665 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333-100ML | |
| Immunostaining materials: | |||
| Cryostat | LEICA | CM3050 S | |
| DAPI | Sigma-Aldrich | D9542-10MG | |
| Goat serum | Sigma-Aldrich | G9023-10ML | |
| Goat α-Rabbit Alexa Fluor 488 | Thermo Fisher Scientific | A11008 | |
| Invitrogen eBioscience Fluoromount G | Thermo Fisher Scientific | 50-187-88 | |
| MX35 Premier + Microtome Blade | Thermo Scientific | 3052835 | |
| Optimal Cooling Tempearure Compound - OCT | Agar Scientific | AGR1180 | |
| Rabbit α-CD31 antibody | Abcam | ab28364 | |
| Sudan Black B | Santa Cruz Biotechnology | SC-203760 | |
| X72 SuperFrost Plus Adhesion slide, 25x75x1mm, White, 90° Ground Edges, Frosted Area 20mm, 72/box | Fisher Scientific | J1800AMNZ | |
| α-Smooth Muscle Actin (SMA) Alexa Fluor® 647-conjugated antibody | R&D Systems | IC1420R | |
| Material for laser cutting of components: | |||
| Clear Plastic Sheet, 1250 mm x 610 mm x 1 mm (for laser cutting of washers) | RS Components | 258-6590 | |
| RS PRO Translucent Rubber Sponge Sheet, 600 mm x 600 mm x 1.5 mm (for laser cutting of silicone seals) | RS Components | 840-5541 | |
| Optional pressure monitors: | |||
| Pressure sensor | Parker Hannifin | 080-699PSX-3P-5 | |
| SciPres Pressure Monitor | Parker Hannifin | 206-200-M | |
| Pre-sterilized single use plasticware: | |||
| 0.2 um filter | Sarstedt | 70.1114.210 | |
| 20 mL Sterile syringe | IMS Euro | 40004 | |
| 50 mL Centrifuge Tube | Thermo Fisher Scientific | Sarstedt - 62.547.254 | |
| Small components: | |||
| Cable ties | - | - | |
| Masterflex Adapter Fittings, Female Luer to Hose Barb | Cole-Parmer | WZ-30800-10 | Barb Adaptor |
| Masterflex Polycarbonate Luer Fittings | Cole-Parmer | AU-45504-84 | |
| Nylon Miniature Check Valve | Cole-Parmer | 98553-00 | |
| RS PRO Translucent Rubber Sponge Sheet, 600 mm x 600 mm x 1.5 mm (for laser cutting of silicone seals) | RS Components | 840-5541 | |
| Stainless Steel M2 Hex Nuts | RS Components | 527-218 | |
| Stainless Steel M2 x 6 mm Screws | RS Components | 418-7426 | |
| Stainless Steel M5 Hex Nuts | RS Components | 189-585 | |
| Surgical vessel loop | Vascular Silicone Ties,International Medical Supplies | 10-1003 | |
| Three-way valves | IMS Euro | 91000 | |
| Surgical Equipment | |||
| Anatomical Forceps, GRAEFE, Curved, 10 cm SKU: BD-07 | International Medical Supplies | SKU: BD-07 | |
| Micro Forceps, Angled, 0.3 mm, 11 cm | International Medical Supplies | SKU: BD-361 | |
| Micro Scissors Noyes, Curved, 12 cm | International Medical Supplies | SKU: FD-12 | |
| Troge Surgical Scalpels - Size 23 - Box of 100 | International Medical Supplies | 63114 | |
| Tubing: | |||
| Eppendorf silicone tubing (I.D.1.6 mm, O.D.4.7 mm) | Eppendorf | M0740-2396 | System tubing |
| Masterflex PharMed BPT 3-Stop Tubing | ISMATEC | 95714-48 | Soft wall tubing (for clamp) |
| RS PRO Transparent Hose Pipe, 0.8 mm ID, Silicone | RS Components | 667-8432 | Resistance tubing (small inner diameter) |
| Tygon for food (I.D. 4.8 mm, W.T. 1.6 mm) | Heidolph | 525-30027-00-0 | One way valve tube |
| Verderflex Yellow Hose Pipe, 6.4 mm ID, Verderprene | RS Components | 125-4042 | Pump Tubing |
References
- Davies, P. F., Civelek, M., Fang, Y., Fleming, I. The atherosusceptible endothelium: Endothelial phenotypes in complex haemodynamic shear stress regions in vivo. Cardiovascular Research. 99 (2), 315-327 (2013).
- Gugliandolo, E., et al. Palmitoylethanolamide and Polydatin combination reduces inflammation and oxidative stress in vascular injury. Pharmacological Research. 123, 83-92 (2017).
- Anselmino, M., et al. Catheter ablation of atrial fibrillation in patients with left ventricular systolic dysfunction: A systematic review and meta-analysis. Circulation, Arrhythmia, and Electrophysiology. 7 (6), 1011-1018 (2014).
- Viola, M., et al. Subcutaneous delivery of monoclonal antibodies: How do we get there. Journal of Controlled Release. 286, 301-314 (2018).
- Kim, D. D. In vitro cellular models for nasal drug absorption studies. Drug Absorption Studies: In Situ, In Vitro and In Silico Models. , 216-234 (2008).
- Lewis, D. I. Animal experimentation: Implementation and application of the 3Rs. Emerging Topics in Life Sciences. 3 (6), 675-679 (2019).
- Rouwkema, J., et al. In vitro platforms for tissue engineering: Implications for basic research and clinical translation. Journal of Tissue Engineering and Regenerative Medicine. 5 (8), e164-167 (2011).
- Xu, Y., Shrestha, N., Préat, V., Beloqui, A. An overview of in vitro, ex vivo and in vivo models for studying the transport of drugs across intestinal barriers. Advanced Drug Delivery Reviews. 175, 113795 (2021).
- Vaghela, R., et al. Vessel grafts for tissue engineering revisited-Vessel segments show location-specific vascularization patterns in ex vivo ring assay. Microcirculation. 29 (2), e12742 (2022).
- Håkansson, J., et al. Individualized tissue-engineered veins as vascular grafts: A proof of concept study in pig. Journal of Tissue Engineering and Regenerative Medicine. 15 (10), 818-830 (2021).
- Saucy, F., et al. Ex vivo pulsatile perfusion of human saphenous veins induces intimal hyperplasia and increased levels of the plasminogen activator inhibitor 1. European Surgical Research. 45 (1), 50-59 (2010).
- Tosun, Z., McFetridge, P. S. Variation in cardiac pulse frequencies modulates vSMC phenotype switching during vascular remodeling. Cardiovascular Engineering and Technology. 6 (1), 59-70 (2015).
- Matos, R. S., Maselli, D., McVey, J. H., Heiss, C., Campagnolo, P. 3D printed bioreactor enabling the pulsatile culture of native and angioplastied large arteries. Frontiers in Cardiovascular Medicine. 9, 864580 (2022).
- Neff, L. P., et al. Vascular smooth muscle enhances functionality of tissue-engineered blood vessels in vivo. Journal of Vascular Surgery. 53 (2), 426-434 (2011).
- Boparai, K. S., Singh, R. Advances in Fused Deposition Modeling. In: Module. Refrence in Materials Science and Materials Engineering. , (2017).
- McKeen, L. W., McKeen, L. W. Chapter 6 - Polyamides (Nylons). The Effect of Creep and Other Time Related Factors on Plastics and Elastomers (Second Edition). , 197-262 (2012).
- Moradi, M., Mehrabi, O., Azdast, T., Benyounis, K. Y. Enhancement of low power CO2 laser cutting process for injection molded polycarbonate). Optics & Laser Technology. 96, 208-218 (2017).
- Ghasem, N. . Computer Methods in Chemical Engineering. , (2021).
- Lying, F., Gazi, F., Gardner, E. Preparation of tissues and cells for infrared and raman spectroscopy and imaging. Biomedical Applications of Synchrotron Infrared Microspectroscopy.RSC Analytical Spectroscopy Monographs. (11), 147-185 (2011).
- Sassi, L., et al. A perfusion bioreactor for longitudinal monitoring of bioengineered liver constructs. Nanomaterials. 11 (2), 275 (2021).
- Haykal, S., et al. Double-chamber rotating bioreactor for dynamic perfusion cell seeding of large-segment tracheal allografts: Comparison to conventional static methods. Tissue Engineering. Part C, Methods. 20 (8), 681-692 (2014).
- Kural, M. H., Dai, G., Niklason, L. E., Gui, L. An ex vivo vessel injury model to study remodeling. Cell Transplant. 27 (9), 1375-1389 (2018).
- Wong, M. M., Hong, X., Karamariti, E., Hu, Y., Xu, Q. Generation and grafting of tissue-engineered vessels in a mouse model. Journal of Visualized Experiments. (97), 52565 (2015).
- Alvino, V. V., et al. In vitro and in vivo preclinical testing of pericyte-engineered grafts for the correction of congenital heart defects. Journal of the American Heart Association. 9 (4), e014214 (2020).
- Nerurkar, N. L., Sen, S., Baker, B. M., Elliott, D. M., Mauck, R. L. Dynamic culture enhances stem cell infiltration and modulates extracellular matrix production on aligned electrospun nanofibrous scaffolds. Acta Biomaterialia. 7 (2), 485-491 (2011).
- Engebretson, B., Mussett, Z. R., Sikavitsas, V. I. The effects of varying frequency and duration of mechanical stimulation on a tissue-engineered tendon construct. Connective Tissue Research. 59 (2), 167-177 (2018).
- Saunders, S. K., et al. Evaluation of perfusion-driven cell seeding of small diameter engineered tissue vascular grafts with a custom-designed seed-and-culture bioreactor. PLoS One. 17 (6), e0269499 (2022).
- Stephenson, M., Grayson, W. Recent advances in bioreactors for cell-based therapies. F1000Research. 7, (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved