Method Article
Ex vivo Перфузионная культура крупных кровеносных сосудов в биореакторе, напечатанном на 3D-принтере
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол представляет собой настройку и работу недавно разработанного, напечатанного на 3D-принтере биореактора для культуры ex vivo кровеносных сосудов при перфузии. Система разработана таким образом, чтобы ее могли легко адаптировать другие пользователи, она практична, доступна по цене и адаптируется к различным экспериментальным приложениям, таким как фундаментальная биология и фармакологические исследования.
Аннотация
Сосудистые заболевания лежат в основе большинства сердечно-сосудистых заболеваний (ССЗ), которые остаются основной причиной смертности и заболеваемости во всем мире. Срочно необходимы эффективные хирургические и фармакологические вмешательства для профилактики и лечения сосудистых заболеваний. Отчасти нехватка трансляционных моделей ограничивает понимание клеточных и молекулярных процессов, участвующих в сосудистых заболеваниях. Биореакторы для перфузионных культур ex vivo обеспечивают идеальную платформу для изучения крупных сосудов животных (включая человека) в контролируемой динамической среде, сочетая в себе простоту культивирования in vitro и сложность живой ткани. Однако большинство биореакторов изготавливаются по индивидуальному заказу, и поэтому их трудно внедрить, что ограничивает воспроизводимость результатов. В этом документе представлена система, напечатанная на 3D-принтере, которая может быть легко изготовлена и применена в любой биологической лаборатории, а также представлен подробный протокол ее настройки, позволяющий пользователям работать. Эта инновационная и воспроизводимая система перфузионного культивирования ex vivo позволяет культивировать кровеносные сосуды до 7 дней в физиологических условиях. Мы ожидаем, что внедрение стандартизированного перфузионного биореактора будет способствовать лучшему пониманию физиологических и патологических процессов в крупных кровеносных сосудах животных и ускорит открытие новых терапевтических средств.
Введение
Сосудистая стенка находится в реактивном устойчивом состоянии, что обеспечивает как реакцию на внешние раздражители (например, изменение давления, вазоконстрикторы), так и постоянную неактивирующую поверхность, препятствующую свертыванию крови и воспалительной клеточной инфильтрации1. В ответ на раздражители, зависящие от старения и образа жизни, а также при прямом повреждении сосудистая стенка активирует процессы ремоделирования, такие как рестеноз и атеросклероз, которые, как известно, способствуют распространенным сердечно-сосудистым заболеваниям (ССЗ), таким как ишемический инсульт и инфаркт миокарда2. Несмотря на то, что интервенционные подходы, такие как чрескожная реваскуляризация и стентирование, доступны для борьбы с распространенными проявлениями сосудистых заболеваний, они, как известно, провоцируют дальнейшее повреждение сосудов, часто приводящее к рецидиву. Кроме того, доступны лишь ограниченные профилактические и ранние решения. Понимание механизмов, поддерживающих гомеостаз сосудистой стенки и управляющих ее дисфункцией, лежит в основе разработкиновых методов лечения.
Несмотря на постоянное развитие и прогресс в области молекулярной биологии и тканевой инженерии, исследования на животных остаются важнейшим компонентом исследований сосудистой биологии. Исследования на животных in vivo дали огромное представление о механизмах сосудистого гомеостаза и патологии; Однако эти процедуры являются дорогостоящими, имеют относительно низкую пропускную способность и создают существенные этические проблемы. Кроме того, мелкие животные плохо отражают сосудистую физиологию человека, а эксперименты на более крупных животных значительно дороже и создают дополнительные этическиесоображения. В связи с растущим спросом на фармацевтические и медицинские решения для быстро стареющего населения недостатки использования животных увеличиваются, влияя на воспроизводимость, надежность и переносимость результатов для оказания медицинской помощи пациентам6.
Системы in vitro представляют собой упрощенную платформу для изучения основных механизмов, но не позволяют повторить сложность всей ткани, взаимодействия между клетками и внеклеточным матриксом, а также механические силы, которые являются важнейшими детерминантами в развитии сосудистыхзаболеваний.
Исследования ex vivo, проводимые на целых тканях, содержащихся в искусственно контролируемых средах, имитируют сложность in vivo, обеспечивая при этом относительно высокую производительность исследований8. Учитывая возможность тщательного контроля условий культивирования и окружающей среды, модели ex vivo позволяют проводить широкий спектр комплексных исследований и представляют собой подходящую альтернативу для сокращения использования процедур на животных в сосудистой биологии. Статические сосудистые кольцевые культуры позволили получить интересные идеи, но не смогли включить важнейший гемодинамический элемент9. Действительно, изучение сосудистой системы ex vivo ставит специфические задачи, связанные со многими динамическими силами, действующими на клетки внутри стенки кровеносного сосуда. Такие стимулы, как просветный поток, турбулентность, напряжение сдвига, давление и деформация стенок, значительно влияют на патофизиологию тканей10,11,12.
Перфузионные биореакторы необходимы для изучения сосудистого гомеостаза и ремоделирования в ответ на травму или гемодинамические изменения13. Кроме того, перфузионная культура может быть использована для улучшения созревания и долговечности тканеинженерных кровеносных сосудов (TEBV), обеспечивая подходящую альтернативу сосудистым трансплантатам14.
Коммерчески доступные перфузионные биореакторы ограничены в гибкости и адаптируемости, а также являются дорогостоящими. Многие из существующих биореакторов собственной разработки трудно воспроизвести в других лабораториях из-за ограниченного описания и отсутствия специально изготовленных компонентов 7,8,9,10,11,12. Чтобы преодолеть эти ограничения, мы недавно разработали новый биореактор (EasyFlow), который экономичен в производстве, вмещает целый ряд тканей и позволяет относительно легко модифицировать его для адаптации к различным требованиям исследований13. Вкладыш напечатан на 3D-принтере и помещается как в крышку стандартной центрифужной пробирки объемом 50 мл. Его модульная конструкция и 3D-печать делают его доступным и воспроизводимым в различных лабораториях, а также легко модифицируемым для адаптации к различным научным потребностям. Этот протокол описывает сборку и базовую работу системы биореактора в условиях артериальной перфузии.
протокол
В этом протоколе описывается сборка и использование системы, состоящей из двух вставок EasyFlow (биореактор): одна представляет собой реакционную камеру (C), содержащую образец перфузионной артерии, а другая функционирует как резервуар среды (R) (Рисунок 1 и Рисунок 2A). Сонные артерии были получены от 4-6-недельных поросят мужского и женского пола (6-12 кг) в Институте Пирбрайта, Великобритания. Процедуры с животными проводились в соответствии с Законом Министерства внутренних дел о животных (научные процедуры) (1986 г.) (ASPA) и были одобрены Советом по благополучию и этике животных (AWERB) при Институте Пирбрайта. Животные содержались в соответствии с Кодексом правил содержания и ухода за животными. Все процедуры были проведены владельцами персональных лицензий, которые прошли обучение и компетентность в соответствии с проектной лицензией PPL70/8852. Выбраковка поросят производилась по первому графику в соответствии с ООРА.
1. Изготовление вставок
- Изготовьте вставку с помощью 3D-печати, используя предоставленную 3D-модель (дополнительный файл 1).
ПРИМЕЧАНИЕ: 3D-моделирование позволяет легко вносить изменения в конструкцию для адаптации к новым приложениям. Для изготовления вставки также могут использоваться альтернативные материалы и альтернативные технологии производства. Из-за сложной внутренней структуры селективное лазерное спекание и стереолитография являются подходящими альтернативами15. Полиамид 12 (PA12; см. Таблицу материалов) является хорошим материалом-кандидатом из-за его превосходных характеристик с точки зрения удержания жидкости и устойчивости к повторяющимся циклам термической стерилизации16. - Изготовьте силиконовые прокладки и поликарбонатные шайбы методом лазерной резки17, используя чертежи, приведенные в Дополнительном файле 2.
ПРИМЕЧАНИЕ: Лазерная резка легко передается на аутсорсинг и является дешевым методом производства. Шайбы могут быть изготовлены из нержавеющей стали, обеспечивая более прочный компонент для многократного использования. Все остальные компоненты являются коммерчески доступными товарами. Полный перечень необходимых материалов приведен в таблице 1. Коммерческие данные о товарах включены в Таблицу материалов.
2. Стерилизация, сборка и грунтовка устройства
- Простерилизуйте все компоненты, следуя инструкциям в таблице 1.
- В условиях ламинарного течения соберите две изготовленные вставки (шаг 1), как показано на рисунке 1A.
- Соберите перфузионную систему, как показано на рисунке 2, выполнив следующие действия:
- Прикрепите два соединенных трехходовых клапана к порту R1 резервуара (порт обмена средой).
- Соедините получившееся выходное отверстие с головкой перистальтического насоса с помощью трубки, оснащенной односторонним клапаном (односторонняя трубка клапана).
- Подсоедините головку насоса к порту C4 реакционной камеры с помощью системных трубок, оснащенных односторонним клапаном.
ПРИМЕЧАНИЕ: Этот филиал может быть дополнительно оснащен датчиком давления, обеспечивающим постоянный контроль. - Подсоедините отверстие C1 реакционной камеры к трубке с мягкими стенками, а затем к каналу сопротивления (малый внутренний диаметр).
ПРИМЕЧАНИЕ: Длина трубки сопротивления будет сильно влиять на давление, присутствующее в системе. Это должно быть дополнительно исследовано, чтобы обеспечить адекватные условия перфузии. - Удлините канал сопротивления с помощью системной трубки, создав обратный канал и замкнув контур циркуляции просвета, подключившись к резервуару на R5 (Рисунок 2C).
- Создайте переливной канал, соединив реакционную камеру C3 с резервуаром R3 с помощью системных трубок.
- Присоедините вентиляционный фильтр через R2.
- Создайте демпфер давления, подключив шприц с воздухом и средой к реакционной камере C6.
ПРИМЕЧАНИЕ: Правильное соотношение воздуха и среды будет зависеть от требуемого демпфирования давления.
- Заполните систему перфузионной средой (модифицированная орлиная среда Dulbecco [DMEM] + 10% [v/v] фетальная бычья сыворотка [FBS] + 1% [v/v] пенициллин-стрептомицин + 1% [v/v] амфотерицин B + 30% [v/v] декстран; см. таблицу материалов) через отверстия для обмена средами и резервуар.
ПРИМЕЧАНИЕ: Заполнение системы снижает риск образования пузырьков в системе и выявляет любые потенциальные утечки. Рекомендуемый объем среды около 100-120 мл. Используемый объем будет зависеть от мертвого объема трубки, используемой для эксперимента.
3. Отбор и подготовка проб
- Соберите левую и правую общие сонные артерии, сводя к минимуму непосредственное воздействие на артериальную ткань13.
- Поместите ткань в холодную транспортную среду (DMEM+ 20% [v/v] FBS + 2% [v/v] пенициллин-стрептомицин + 1% [v/v] амфотерицин B, см. Таблицу материалов) для переноса.
- В ламинарном шкафу удалите лишнюю соединительную ткань и обрежьте концы ткани с помощью лезвия скальпеля. Дважды постирайте салфетку в холодном транспортном средстве.
- Поместите салфетку на орбитальный шейкер в транспортную среду не менее чем на 30 минут для тщательной стирки.
- Соедините неразветвляющийся сегмент артерии с системой биореактора с помощью двух колючих коннекторов Люэра и зафиксируйте его на месте с помощью сосудистого соединения (сосудистые силиконовые стяжки; Таблица 1).
ПРИМЕЧАНИЕ: Соединение сосуда обеспечивает надлежащее натяжение и втягивание для фиксации сосуда. Овальное сечение предотвращает повреждение тканей. - Аккуратно пропустите среду через артерию, чтобы проверить проходимость.
- Закрепив артерию на изготовленном вкладыше, заполните реакционное пространство перфузионной средой (шаг 2.4). Наконец, аккуратно заполните контур циркуляции просвета средой, чтобы удалить оставшийся воздух из системы.
- Соедините реакционное пространство с ранее собранной перфузионной системой (секция 2), завершив циркуляцию.
ПРИМЕЧАНИЕ: Рекомендуется проводить проверку качества методом иммуногистохимии обрабатываемой ткани. Это позволяет выявить любые повреждения, вызванные чрезмерным обращением во время подготовки.
4. Изменение культуры перфузии и среды
- Поместите перфузионную систему в инкубатор с температурой 37 °C с 5%CO2 , а затем подключите ее к перистальтическому насосу (см. Таблицу материалов)
- Подключите любые дополнительные (факультативные) системы сбора, например, датчики давления (см. Таблицу материалов).
- Оставьте систему для выравнивания на ночь с низким расходом среды ~10-15 мл/мин.
ПРИМЕЧАНИЕ: Для обеспечения соблюдения надлежащих условий необходимы первоначальные эксперименты по определению настроек насоса, расхода среды, давления в системе и оптимальных настроек демпферов/зажимов давления. - На следующий день постепенно увеличивайте расход (+1 об/мин каждый час, что эквивалентно увеличению на ~2,5 мл/мин каждый час в текущей системе) до тех пор, пока не будет достигнут окончательный расход (35 мл/мин). Периодически проверяйте систему на наличие утечек.
ПРИМЕЧАНИЕ: Чтобы рассчитать точный расход на основе скорости перистальтического насоса, пользователи должны сначала выполнить соответствующую калибровку насоса18. Используя формулу (1), объемный расход (Q) может быть рассчитан на основе объема, выданного (V) за заданное время (t). Для расчета расчетной скорости потока () можно использовать ранее рассчитанный расход (Q) и площадь поперечного сечения сосуда (A), описанные в уравнении (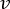 2).
2).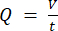 (1)
(1)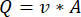 (2) См.
(2) См. - Каждые 3 дня заменяйте 50% среды (~50 мл), подключая один шприц, наполненный свежей средой, к порту для обмена среды ближе к насосу, а пустой шприц — к порту, расположенному ближе к резервуару, для сбора отработанной среды (рисунок 2).
ПРИМЕЧАНИЕ: Использование двух трехходовых клапанов в качестве портов для обмена средами обеспечивает непрерывную работу перфузии во время обмена средой. - В конце эксперимента извлеките ткань из реакционной камеры, обрезав концы, соединенные с биореактором, с помощью стерильных хирургических ножниц.
- Разберите, очистите и простерилизуйте систему для дальнейшего использования.
5. Анализ проб
- Зафиксируйте собранный образец в 4%-ном параформальдегиде (PFA) на ночь при температуре 4 °C.
- Поместите ткань в оптимальную температуру резки (OCT; см. таблицу материалов)19 и заморозьте, погрузив в изопентан, охлажденный жидким азотом.
- С помощью криостата получают криошлифы толщиной 3-5 мм.
- Провести иммуногистохимическое исследование (гематоксилин и эозин [H&E]) и/или иммунофлюоресценцию. Следуйте типичному протоколу иммунофлюоресценции:
- Заблокируйте ломтики на 1 ч при комнатной температуре 20%-ной [v/v] козьей сывороткой в фосфатно-солевом буфере (PBS; см. таблицу материалов).
- Инкубируют ломтики в течение ночи при 4 °C с первичными кроличьими антителами против CD31, разбавленными 1:50 в PBS (см. таблицу материалов).
- Трижды вымыть PBS в течение 5 минут.
- Инкубируют в течение 1 ч при 37 °C с флуоресцентно меченными козьими вторичными антителами против кроликов, разведенными 1:200 в PBS, и α-гладкомышечным актином (SMA), непосредственно конъюгированным флуоресцентным антителом, разбавленным 1:200 в PBS (см. таблицу материалов).
- Трижды вымыть PBS в течение 5 минут.
- Окрасьте ядра DAPI, разбавленным 1:1,000 в PBS, в течение 10 мин при комнатной температуре.
- Инкубируют с 0,1% (по массе/объему) суданского черного (см. таблицу материалов) в 70% (по объему) этаноле в течение 10 мин при комнатной температуре для уменьшения автофлуоресценции тканей.
- Вымойте салфетку обильным количеством деионизированной воды. Установите направляющие в монтажный носитель.
- Визуализируйте образцы с помощью конфокального лазерного сканирующего микроскопа.
Результаты
В результате этого исследования была создана универсальная и доступная система перфузии (EasyFlow)13. Напечатанная на 3D-принтере конструкция системы облегчает внедрение системы другими лабораториями и, следовательно, способствует воспроизводимости.
Изготовленная перфузионная вставка помещена в центрифужную пробирку объемом 50 мл, что создает изолированную среду. С помощью двух перфузионных вставок можно создать перфузионную петлю, содержащую резервуар и реакционную камеру, где инкубируется биологический образец. Затем перфузионная система подключается к перистальтическому насосу и дополнительным системам сбора данных, таким как датчики давления и ультразвуковые устройства, для мониторинга условий культивирования (рис. 2).
Образцы сонных артерий свиней собирали и обрабатывали перед культивированием в перфузии в течение 7 дней. Для обеспечения качества ткани перед культивированием были проведены предварительные эксперименты, где образцы фиксировались в момент иссечения, после подготовки ткани и после перфузии. Для оценки сохранения целостности тканей использовали флуоресцентное окрашивание эндотелиальных (CD31) и гладкомышечных (αSMA) маркеров. Примеры хорошо сохранившихся и поврежденных тканей представлены на рисунке 3 для сравнения. Снимки показывают важность бережного обращения с тканью во время иссечения, так как неправильная обработка (чрезмерное растяжение, раздавливание и т. д.) может привести к потере эндотелия перед посевом. Результаты также показывают важность постепенного установления перфузии во избежание повреждения просвета.
Окрашивание H&E проводили вместе с иммунофлуоресцентным (ИФ) окрашиванием, чтобы показать сохранение морфологии и общего распределения клеток в стенке сосуда после 7 дней культивирования (рис. 4). Применение физиологических условий культивирования в аппарате обеспечивает поддержание эндотелиального покрытия просвета, выравнивание гладкомышечных клеток в средах и сохранение vasa vasorum в адвентиции.
Компактная модульная конструкция системы биореактора также позволяет использовать широкий спектр системных установок. Меньшая установка состоит из одного биореактора и идеально подходит для фармакологических и малообъемных исследований (рециркуляционная перфузия20, общий объем 50-70 мл). Для увеличения длины культивирования и уменьшения количества смен сред более идеальной является система циркуляции с одним резервуаром, подобная той, что описана в этом протоколе, или система постоянной подачи, так как они имеют больший объем циркулирующей среды. Установка двойного кровообращения21 может быть установлена для изучения экспериментальных условий, где локализация стимулов имеет решающее значение. Данное устройство также можно комбинировать с более сложными системами управления, чтобы обеспечить точное управление такими параметрами, как pH и растворенный кислород (рис. 5).
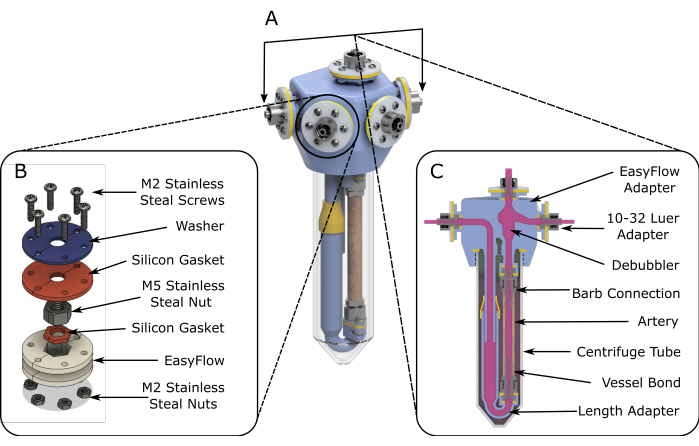
Рисунок 1: Схема сборки EasyFlow. (A) 3D-схемы, помогающие собрать перфузионную вставку. (B) Для облегчения монтажа узлов соединения предоставляются подробные схемы. (C) Изображение реакционного пространства в поперечном сечении выделяет основные компоненты вкладыша EasyFlow и соединение ткани с пластиной. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
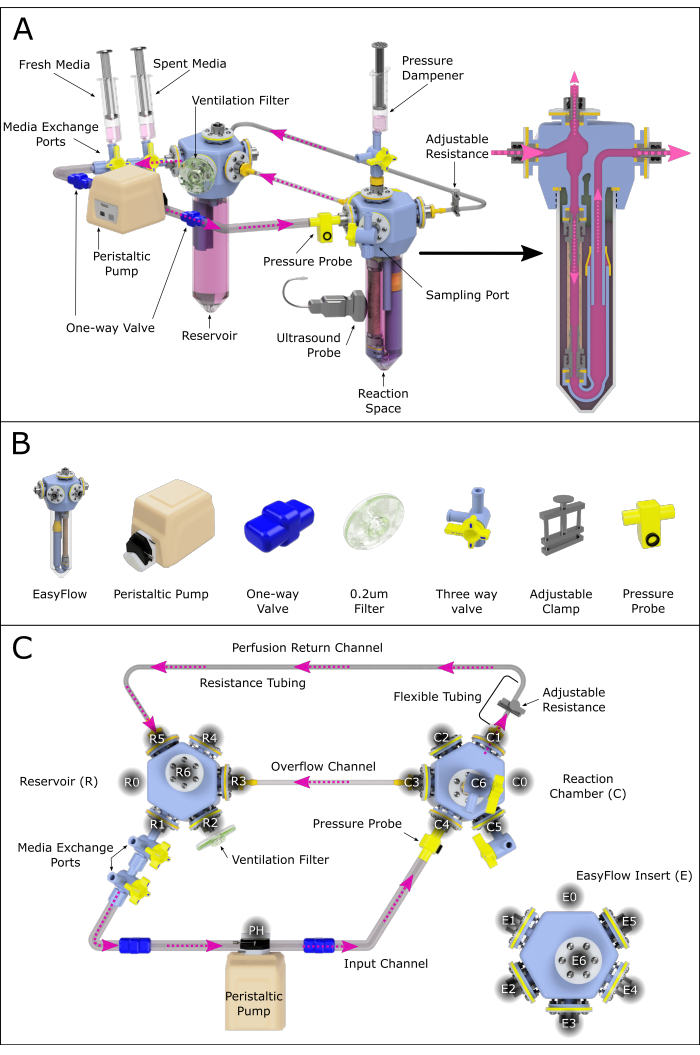
Рисунок 2: Схематическое изображение узла перфузионной системы. (A) Собранная перфузионная система, содержащая все важные компоненты, подчеркивающая их взаимное расположение в среде с 3D-рендерингом. Не все компоненты поддаются масштабированию. (B) Также представлены индивидуальные изометрические виды компонентов. (C) Показан вид сверху на собранную перфузионную систему, чтобы облегчить сборку и соединение различных компонентов. Порты были промаркированы и пронумерованы против часовой стрелки для навигации по различным точкам подключения в системе перфузии. Этот принцип был применен к резервуару (R) и реакционной камере (C). Различным каналам, соединяющим две камеры, также были присвоены названия для справки. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
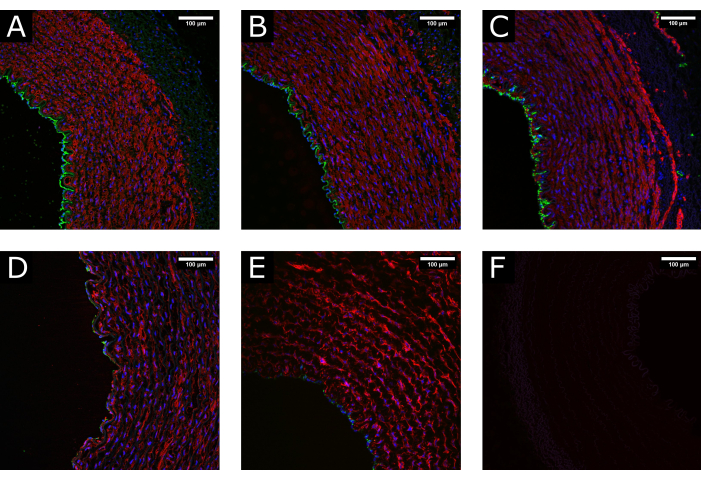
Рисунок 3: Сохранение тканей во время обработки. (А) Конфокальные изображения показывают нормальную структуру артерии во время забора, (Б) после очистки и обработки и (В) после перфузионной культуры, демонстрируя сохранение хорошо сохранившейся морфологии. (D) Примеры поврежденных тканей из-за чрезмерного или неправильного обращения во время обработки или (E) из-за применения нефизиологических условий культивирования (т.е. резкого инициирования высокого потока) показывают истощение просветного покрытия и разрушение среды. (F) Отрицательный контроль указывает на специфичность окрашивания. CD31: зеленый; αSMA: красный; DAPI: синий. Масштабные линейки: 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
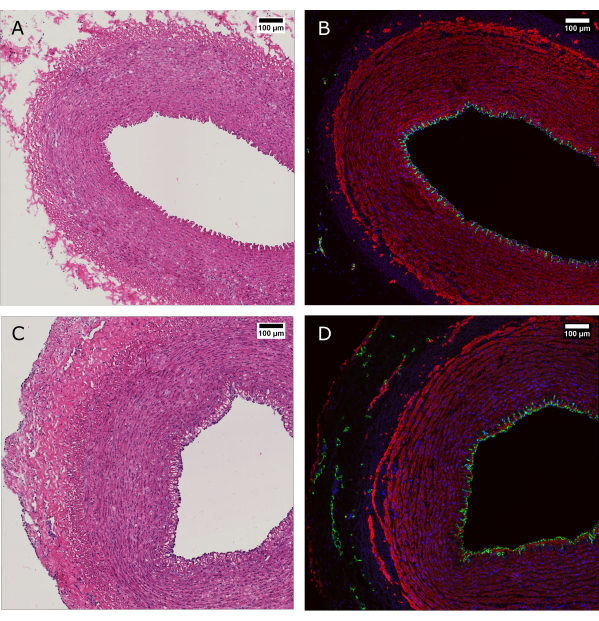
Рисунок 4: Гистологическая оценка ткани до и после перфузионной культуры. (А и Б) Артериальную ткань оценивали методом гистологии во время забора и (C и D) через 7 дней культивирования с помощью системы биореактора. (А и В) Окрашивание H&E выявляет сохранение структуры и организации артериальной стенки. (В и Г) Иммунофлуоресцентное окрашивание одной и той же ткани свидетельствует об эндотелиальном покрытии, выравнивании гладкомышечных клеток и vasa vasorum при адвентиции. CD31: зеленый; SMA: красная; DAPI: синий. Масштабные линейки: 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
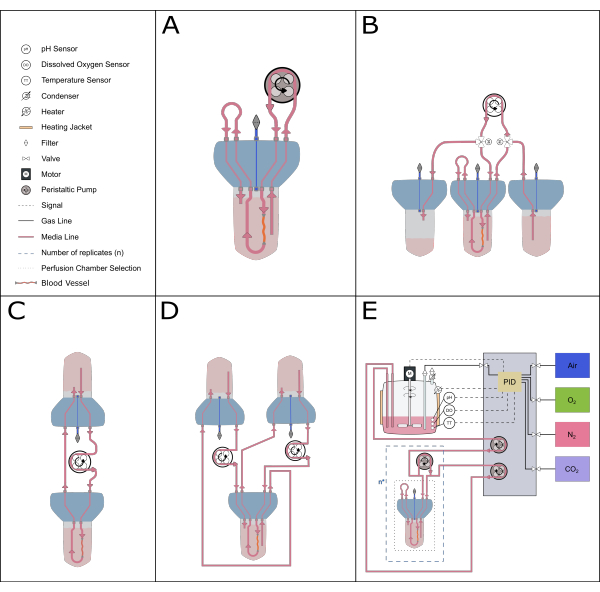
Рисунок 5: Схематическое изображение возможных перфузионных установок. С перфузионной вставкой могут быть установлены различные альтернативные установки для проведения различных экспериментальных исследований. (A) Рециркуляционная перфузионная установка сводит к минимуму объем необходимой среды. (B) Постоянная подача обеспечивает стабильную подачу среды к тканям. (C) Циркуляция в одном резервуаре (как описано в данной статье) обеспечивает больший объем среды для длительной инкубации и включает буферную зону для воздухообмена и уравновешивания давления. (D) Установка двойного кровообращения обеспечивает две различные петли, питающие внутреннее (внутри артерии) и внешнее (реакционное пространство) кровообращение независимо друг от друга. (E) Установка динамической перфузии включает в себя непрерывный контроль газов и pH с помощью пропорционально-интегрально-дидифференциального регулятора (ПИД). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Таблица 1: Компоненты для изготовления пластин. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительный файл 1: 3D-модель вкладыша EasyFlow для производства 3D-печати. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 2: Проектные схемы построенного устройства, вид сечения, распечатка и компоненты уплотнения. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
Системы сосудистой перфузии ex vivo представляют собой уникальную платформу для изучения функции и поведения сосудистых клеток в их нативных тканях в контролируемых условиях, что позволяет рассекать сложные процессы, такие как посттравматическое ремоделирование сосудов22. Тем не менее, большинство биореакторов, о которых сообщалось, представляют собой системы собственного производства, основанные на компонентах, изготовленных по индивидуальному заказу, и их часто трудно воспроизвести другими компаниями23. Альтернативные коммерческие решения существуют, но им не хватает гибкости в проектировании, и они могут быть относительнодорогостоящими.
Мы разработали альтернативную систему, которая обеспечивает простую, дешевую и воспроизводимую платформу, которую можно изготовить с использованием методов 3D-печати с открытым исходным кодом13. В настоящей статье описывается настройка системы для обеспечения воспроизводимости приложений конечными пользователями. Эта установка позволяет применять физиологические и патологические условия давления (40-180 мм рт. ст.), скорости потока (6-30 мл/мин), а также в сочетании со средами, имитирующими вязкость крови, с различной степенью напряжения сдвига.
Воспроизводимость является важным аспектом научного процесса, поскольку она позволяет исследователям подтверждать результаты других исследователей и опираться на них для прогресса в понимании сосудистых заболеваний. Кроме того, инструменты, обеспечивающие и способствующие сотрудничеству между группами, имеют важнейшее значение для развития научных знаний. EasyFlow представляет собой пример таких доступных решений с открытым исходным кодом, которые могут быть легко созданы и внедрены лабораториями, работающими над широким спектром проектов в области сосудистых наук и за ее пределами.
Мы сообщаем, что этот аппаратный культиватор поддерживает жизнеспособность артериальной ткани в течение не менее 7 дней и может быть использован для моделирования конкретных стадий сосудистых заболеваний. Используя это, можно моделировать физиологические скорости потока и условия давления13. Важно отметить, что эта перфузионная культура является экономически эффективной из-за низких производственных затрат и небольшого объема среды, необходимой для работы системы.
3D-дизайн также может быть адаптирован к новым приложениям, а новые материалы для печати могут быть протестированы. Даже в нынешнем формате пространство для размещения образцов может быть легко адаптировано к образцам разных размеров, изменяя длину фитингов или отверстие соединителей Люэра. Важно отметить, что, учитывая модульный характер устройства и его небольшие габариты, этот биореактор может использоваться в нескольких установках (рис. 5) и может применяться для мультиплексных культур, где несколько образцов могут подвергаться воздействию различных условий одновременно в отдельных биореакторах.
Предполагается, что в будущем использование системы будет расширено для поддержки культивирования кровеносных сосудов различного происхождения (например, разных видов) и различной природы (например, вен, лимфатических сосудов) и, возможно, применено для культивирования других полых тканей (например, трахеи, кишечника). В частности, исследования показывают, что культивирование тканеинженерных скаффолдов в условиях постоянной перфузии способствует однородному распределению клеток внутри конструкции и созреванию полученной ткани25,26. Кроме того, посев сосудистых трансплантатов при перфузии способствует достижению более равномерно ячеистого просвета сосудов по сравнению со статическими методами27. По этой причине мы предполагаем, что система будет применяться в тканевой инженерии, чтобы помочь решить текущие проблемы, что позволит в будущем разработать воспроизводимые синтетические заменители кровеносных сосудов28.
Протокол, описанный здесь, представляет собой несколько важных шагов, имеющих решающее значение для успеха культуры потока. Установление и контроль надлежащих условий потока является нетривиальной задачей и должно выполняться на каждой системе при ее первой настройке, чтобы убедиться, что условия культивирования являются физиологическими. Расход и давление контролировались с помощью датчиков давления и ультразвуковой визуализации. Еще одним важным моментом является обеспечение жизнеспособности и неповрежденности ткани в начале культивирования. Это требует свежего источника, осторожного обращения и может быть подтверждено гистологическим анализом. Кроме того, в начале каждого эксперимента необходимо выполнять поиск и устранение неисправностей для выявления любого потенциального бактериального загрязнения или источника утечки среды.
Важно подчеркнуть, что описанная перфузионная система, обеспечивая физиологические условия давления и потока, не может полностью имитировать сложные паттерны волн давления, зарегистрированные in vivo. Это ограничение связано с использованием перистальтического насоса и может быть устранено с помощью более специализированного оборудования для воспроизведения сложных гемодинамических состояний. Культивирование кровеносных сосудов в биореакторе также не может быть использовано в исследованиях, где иммунная система или взаимодействие с другими органами имеют решающее значение.
В заключение представлена простая напечатанная на 3D-принтере перфузионная система, которая может имитировать физиологическую гемодинамическую среду, которая, как ожидается, будет способствовать стандартизации культур кровеносных сосудов ex vivo . Его потенциал для адаптации и применения в долговременной культуре делает его важным инструментом для углубления понимания этих сложных биологических систем в физиологии и патологических состояниях.
Раскрытие информации
У авторов нет конфликта интересов, который они могли бы раскрыть.
Благодарности
Авторы выражают благодарность Центру ветеринарной патологии Школы ветеринарной медицины Университета Суррея за услуги по гистологии. Мы также благодарим докторов Л. Диксона, А. Рейса и М. Хенстока из Института Пирбрайта (Пирбрайт, Великобритания) за их поддержку в приобретении тканей животных, а также Департамент биохимических наук Университета Суррея, особенно техническую команду, за их постоянную поддержку. RSM был поддержан студенческой премией Doctoral College (Университет Суррея), DM и PC были поддержаны Национальным центром по замене, уточнению и сокращению животных в исследованиях (номера грантов: NC/R001006/1 и NC/T001216/1).
Материалы
| Name | Company | Catalog Number | Comments |
| EasyFlow | - | - | 3D printed by MultiJet Fusion by Protolabs |
| PA12 - 3D printing | Protolabs | - | - |
| Peristaltic pump | Heidolph | PD5201 | |
| Culture media components: | |||
| Amphotericin B solution, 250 mug/mL in deionized water | Sigma-Aldrich | A2942-20ML | |
| Dextran from Leuconostoc spp. | Sigma-Aldrich | D8802-25ML | |
| Dulbecco's Modified Eagle's Medium - high glucose, w/ 4500 mg/L glucose, L-glutamine, sodium pyruvate, and sodium bicarbonate | Sigma-Aldrich | D6429-6X500ML | |
| Fetal Bovine Serum | Sigma-Aldrich | F9665 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333-100ML | |
| Immunostaining materials: | |||
| Cryostat | LEICA | CM3050 S | |
| DAPI | Sigma-Aldrich | D9542-10MG | |
| Goat serum | Sigma-Aldrich | G9023-10ML | |
| Goat α-Rabbit Alexa Fluor 488 | Thermo Fisher Scientific | A11008 | |
| Invitrogen eBioscience Fluoromount G | Thermo Fisher Scientific | 50-187-88 | |
| MX35 Premier + Microtome Blade | Thermo Scientific | 3052835 | |
| Optimal Cooling Tempearure Compound - OCT | Agar Scientific | AGR1180 | |
| Rabbit α-CD31 antibody | Abcam | ab28364 | |
| Sudan Black B | Santa Cruz Biotechnology | SC-203760 | |
| X72 SuperFrost Plus Adhesion slide, 25x75x1mm, White, 90° Ground Edges, Frosted Area 20mm, 72/box | Fisher Scientific | J1800AMNZ | |
| α-Smooth Muscle Actin (SMA) Alexa Fluor® 647-conjugated antibody | R&D Systems | IC1420R | |
| Material for laser cutting of components: | |||
| Clear Plastic Sheet, 1250 mm x 610 mm x 1 mm (for laser cutting of washers) | RS Components | 258-6590 | |
| RS PRO Translucent Rubber Sponge Sheet, 600 mm x 600 mm x 1.5 mm (for laser cutting of silicone seals) | RS Components | 840-5541 | |
| Optional pressure monitors: | |||
| Pressure sensor | Parker Hannifin | 080-699PSX-3P-5 | |
| SciPres Pressure Monitor | Parker Hannifin | 206-200-M | |
| Pre-sterilized single use plasticware: | |||
| 0.2 um filter | Sarstedt | 70.1114.210 | |
| 20 mL Sterile syringe | IMS Euro | 40004 | |
| 50 mL Centrifuge Tube | Thermo Fisher Scientific | Sarstedt - 62.547.254 | |
| Small components: | |||
| Cable ties | - | - | |
| Masterflex Adapter Fittings, Female Luer to Hose Barb | Cole-Parmer | WZ-30800-10 | Barb Adaptor |
| Masterflex Polycarbonate Luer Fittings | Cole-Parmer | AU-45504-84 | |
| Nylon Miniature Check Valve | Cole-Parmer | 98553-00 | |
| RS PRO Translucent Rubber Sponge Sheet, 600 mm x 600 mm x 1.5 mm (for laser cutting of silicone seals) | RS Components | 840-5541 | |
| Stainless Steel M2 Hex Nuts | RS Components | 527-218 | |
| Stainless Steel M2 x 6 mm Screws | RS Components | 418-7426 | |
| Stainless Steel M5 Hex Nuts | RS Components | 189-585 | |
| Surgical vessel loop | Vascular Silicone Ties,International Medical Supplies | 10-1003 | |
| Three-way valves | IMS Euro | 91000 | |
| Surgical Equipment | |||
| Anatomical Forceps, GRAEFE, Curved, 10 cm SKU: BD-07 | International Medical Supplies | SKU: BD-07 | |
| Micro Forceps, Angled, 0.3 mm, 11 cm | International Medical Supplies | SKU: BD-361 | |
| Micro Scissors Noyes, Curved, 12 cm | International Medical Supplies | SKU: FD-12 | |
| Troge Surgical Scalpels - Size 23 - Box of 100 | International Medical Supplies | 63114 | |
| Tubing: | |||
| Eppendorf silicone tubing (I.D.1.6 mm, O.D.4.7 mm) | Eppendorf | M0740-2396 | System tubing |
| Masterflex PharMed BPT 3-Stop Tubing | ISMATEC | 95714-48 | Soft wall tubing (for clamp) |
| RS PRO Transparent Hose Pipe, 0.8 mm ID, Silicone | RS Components | 667-8432 | Resistance tubing (small inner diameter) |
| Tygon for food (I.D. 4.8 mm, W.T. 1.6 mm) | Heidolph | 525-30027-00-0 | One way valve tube |
| Verderflex Yellow Hose Pipe, 6.4 mm ID, Verderprene | RS Components | 125-4042 | Pump Tubing |
Ссылки
- Davies, P. F., Civelek, M., Fang, Y., Fleming, I. The atherosusceptible endothelium: Endothelial phenotypes in complex haemodynamic shear stress regions in vivo. Cardiovascular Research. 99 (2), 315-327 (2013).
- Gugliandolo, E., et al. Palmitoylethanolamide and Polydatin combination reduces inflammation and oxidative stress in vascular injury. Pharmacological Research. 123, 83-92 (2017).
- Anselmino, M., et al. Catheter ablation of atrial fibrillation in patients with left ventricular systolic dysfunction: A systematic review and meta-analysis. Circulation, Arrhythmia, and Electrophysiology. 7 (6), 1011-1018 (2014).
- Viola, M., et al. Subcutaneous delivery of monoclonal antibodies: How do we get there. Journal of Controlled Release. 286, 301-314 (2018).
- Kim, D. D. In vitro cellular models for nasal drug absorption studies. Drug Absorption Studies: In Situ, In Vitro and In Silico Models. , 216-234 (2008).
- Lewis, D. I. Animal experimentation: Implementation and application of the 3Rs. Emerging Topics in Life Sciences. 3 (6), 675-679 (2019).
- Rouwkema, J., et al. In vitro platforms for tissue engineering: Implications for basic research and clinical translation. Journal of Tissue Engineering and Regenerative Medicine. 5 (8), e164-167 (2011).
- Xu, Y., Shrestha, N., Préat, V., Beloqui, A. An overview of in vitro, ex vivo and in vivo models for studying the transport of drugs across intestinal barriers. Advanced Drug Delivery Reviews. 175, 113795 (2021).
- Vaghela, R., et al. Vessel grafts for tissue engineering revisited-Vessel segments show location-specific vascularization patterns in ex vivo ring assay. Microcirculation. 29 (2), e12742 (2022).
- Håkansson, J., et al. Individualized tissue-engineered veins as vascular grafts: A proof of concept study in pig. Journal of Tissue Engineering and Regenerative Medicine. 15 (10), 818-830 (2021).
- Saucy, F., et al. Ex vivo pulsatile perfusion of human saphenous veins induces intimal hyperplasia and increased levels of the plasminogen activator inhibitor 1. European Surgical Research. 45 (1), 50-59 (2010).
- Tosun, Z., McFetridge, P. S. Variation in cardiac pulse frequencies modulates vSMC phenotype switching during vascular remodeling. Cardiovascular Engineering and Technology. 6 (1), 59-70 (2015).
- Matos, R. S., Maselli, D., McVey, J. H., Heiss, C., Campagnolo, P. 3D printed bioreactor enabling the pulsatile culture of native and angioplastied large arteries. Frontiers in Cardiovascular Medicine. 9, 864580 (2022).
- Neff, L. P., et al. Vascular smooth muscle enhances functionality of tissue-engineered blood vessels in vivo. Journal of Vascular Surgery. 53 (2), 426-434 (2011).
- Boparai, K. S., Singh, R. Advances in Fused Deposition Modeling. In: Module. Refrence in Materials Science and Materials Engineering. , (2017).
- McKeen, L. W., McKeen, L. W. Chapter 6 - Polyamides (Nylons). The Effect of Creep and Other Time Related Factors on Plastics and Elastomers (Second Edition). , 197-262 (2012).
- Moradi, M., Mehrabi, O., Azdast, T., Benyounis, K. Y. Enhancement of low power CO2 laser cutting process for injection molded polycarbonate). Optics & Laser Technology. 96, 208-218 (2017).
- Ghasem, N. . Computer Methods in Chemical Engineering. , (2021).
- Lying, F., Gazi, F., Gardner, E. Preparation of tissues and cells for infrared and raman spectroscopy and imaging. Biomedical Applications of Synchrotron Infrared Microspectroscopy.RSC Analytical Spectroscopy Monographs. (11), 147-185 (2011).
- Sassi, L., et al. A perfusion bioreactor for longitudinal monitoring of bioengineered liver constructs. Nanomaterials. 11 (2), 275 (2021).
- Haykal, S., et al. Double-chamber rotating bioreactor for dynamic perfusion cell seeding of large-segment tracheal allografts: Comparison to conventional static methods. Tissue Engineering. Part C, Methods. 20 (8), 681-692 (2014).
- Kural, M. H., Dai, G., Niklason, L. E., Gui, L. An ex vivo vessel injury model to study remodeling. Cell Transplant. 27 (9), 1375-1389 (2018).
- Wong, M. M., Hong, X., Karamariti, E., Hu, Y., Xu, Q. Generation and grafting of tissue-engineered vessels in a mouse model. Journal of Visualized Experiments. (97), 52565 (2015).
- Alvino, V. V., et al. In vitro and in vivo preclinical testing of pericyte-engineered grafts for the correction of congenital heart defects. Journal of the American Heart Association. 9 (4), e014214 (2020).
- Nerurkar, N. L., Sen, S., Baker, B. M., Elliott, D. M., Mauck, R. L. Dynamic culture enhances stem cell infiltration and modulates extracellular matrix production on aligned electrospun nanofibrous scaffolds. Acta Biomaterialia. 7 (2), 485-491 (2011).
- Engebretson, B., Mussett, Z. R., Sikavitsas, V. I. The effects of varying frequency and duration of mechanical stimulation on a tissue-engineered tendon construct. Connective Tissue Research. 59 (2), 167-177 (2018).
- Saunders, S. K., et al. Evaluation of perfusion-driven cell seeding of small diameter engineered tissue vascular grafts with a custom-designed seed-and-culture bioreactor. PLoS One. 17 (6), e0269499 (2022).
- Stephenson, M., Grayson, W. Recent advances in bioreactors for cell-based therapies. F1000Research. 7, (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены