Method Article
Ex Vivo Cultivo de perfusión de grandes vasos sanguíneos en un biorreactor impreso en 3D
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo presenta la configuración y el funcionamiento de un biorreactor impreso en 3D recientemente desarrollado para el cultivo ex vivo de vasos sanguíneos en perfusión. El sistema está diseñado para ser fácilmente adoptado por otros usuarios, práctico, asequible y adaptable a diferentes aplicaciones experimentales, como biología básica y estudios farmacológicos.
Resumen
Las enfermedades vasculares constituyen la base de la mayoría de las enfermedades cardiovasculares (ECV), que siguen siendo la principal causa de mortalidad y morbilidad en todo el mundo. Se necesitan urgentemente intervenciones quirúrgicas y farmacológicas eficaces para prevenir y tratar la enfermedad vascular. En parte, la escasez de modelos traslacionales limita la comprensión de los procesos celulares y moleculares implicados en la enfermedad vascular. Los biorreactores de cultivo de perfusión ex vivo proporcionan una plataforma ideal para el estudio de grandes vasos animales (incluidos los seres humanos) en un entorno dinámico controlado, combinando la facilidad del cultivo in vitro y la complejidad del tejido vivo. Sin embargo, la mayoría de los biorreactores se fabrican a medida y, por lo tanto, son difíciles de adoptar, lo que limita la reproducibilidad de los resultados. Este artículo presenta un sistema impreso en 3D que se puede producir y aplicar fácilmente en cualquier laboratorio biológico, y proporciona un protocolo detallado para su configuración, lo que permite la operación de los usuarios. Este innovador y reproducible sistema de cultivo de perfusión ex vivo permite el cultivo de vasos sanguíneos durante un máximo de 7 días en condiciones fisiológicas. Esperamos que la adopción de un biorreactor de perfusión estandarizado apoye una mejor comprensión de los procesos fisiológicos y patológicos en los vasos sanguíneos de animales grandes y acelere el descubrimiento de nuevas terapias.
Introducción
La pared vascular existe en un estado estacionario reactivo, lo que asegura tanto la responsabilidad a los estímulos externos (i.e., cambio de presión, vasoconstrictores) como una superficie consistente no activadora que impide la coagulación de la sangre y la infiltración de células inflamatorias1. En respuesta a estímulos dependientes del envejecimiento y del estilo de vida y ante el daño directo, la pared vascular activa procesos de remodelación como la reestenosis y la aterosclerosis, que se sabe que contribuyen a las enfermedades cardiovasculares (ECV) comunes, como el accidente cerebrovascular isquémico y el infarto de miocardio2. Si bien existen enfoques intervencionistas como la revascularización percutánea y la colocación de stents para abordar las manifestaciones avanzadas de la enfermedad vascular, se sabe que provocan un daño vascular adicional, lo que a menudo conduce a la recurrencia. Además, solo se dispone de soluciones preventivas y de fase inicial limitadas. La comprensión de los mecanismos que mantienen la homeostasis de la pared vascular y conducen a su disfunción es fundamental para el desarrollo de nuevas curas3.
A pesar del constante desarrollo y los avances en biología molecular e ingeniería de tejidos, los estudios con animales siguen siendo un componente crucial de los estudios de biología vascular. Los estudios in vivo en animales han proporcionado una enorme comprensión de los mecanismos de la homeostasis vascular y la patología; Sin embargo, estos procedimientos son costosos, tienen un rendimiento relativamente bajo y plantean problemas éticos sustanciales. Además, los animales pequeños son poco representativos de la fisiología vascular humana, y los experimentos con animales más grandes son mucho más caros y crean más consideraciones éticas 4,5. Con la creciente demanda de soluciones farmacéuticas y médicas para una población que envejece rápidamente, las desventajas del uso de animales se magnifican, lo que afecta la reproducibilidad, confiabilidad y transferibilidad de los resultados a la atención del paciente6.
Los sistemas in vitro ofrecen una plataforma simplificada para estudiar los mecanismos básicos, pero no recapitulan la complejidad de todo el tejido, las interacciones entre las células y la matriz extracelular, y las fuerzas mecánicas, que son determinantes críticos en el desarrollo de enfermedades vasculares7.
Los estudios ex vivo realizados en tejidos enteros mantenidos en entornos controlados artificialmente imitan la complejidad in vivo al tiempo que permiten investigaciones de rendimiento relativamente alto8. Dada la capacidad de controlar de cerca las condiciones de cultivo y el entorno, los modelos ex vivo permiten una amplia gama de estudios complejos y proporcionan una alternativa adecuada para reducir el uso de procedimientos animales en biología vascular. Los cultivos estáticos de anillos vasculares ofrecieron información interesante, pero no incorporaron el elemento hemodinámico crucial9. De hecho, el estudio del sistema vascular ex vivo plantea desafíos específicos relacionados con las muchas fuerzas dinámicas que se aplican a las células dentro de la pared de los vasos sanguíneos. Estímulos como el flujo luminal, la turbulencia, el esfuerzo cortante, la presión y la deformación de la pared impactan significativamente en la fisiopatología tisular10,11,12.
Los biorreactores de perfusión son esenciales para el estudio de la homeostasis y la remodelación vascular en respuesta a lesiones o cambios hemodinámicos13. Además, el cultivo de perfusión se puede utilizar para mejorar la maduración y durabilidad de los vasos sanguíneos de ingeniería tisular (TEBV), proporcionando alternativas adecuadas para los injertos vasculares14.
Los biorreactores de perfusión disponibles en el mercado tienen una flexibilidad y adaptabilidad limitadas y son costosos. En cambio, muchos de los biorreactores desarrollados internamente existentes son difíciles de replicar en otros laboratorios, debido a las descripciones limitadas y la falta de disponibilidad de componentes especialmente fabricados 7,8,9,10,11,12. Para superar estas limitaciones, hemos desarrollado recientemente un nuevo biorreactor (EasyFlow), que es económico de producir, se adapta a una amplia gama de tejidos y permite modificaciones relativamente sencillas para adaptarse a diferentes demandas de investigación13. El inserto está impreso en 3D y encaja como en la tapa de un tubo de centrífuga estándar de 50 ml. Su diseño modular y su fabricación en impresión 3D lo hacen accesible y reproducible en diferentes laboratorios, así como fácilmente modificable para adaptarse a diferentes necesidades científicas. Este protocolo describe el montaje y el funcionamiento básico del sistema de biorreactor en un entorno de perfusión arterial.
Protocolo
Este protocolo describe el montaje y uso de un sistema compuesto por dos insertos EasyFlow (biorreactor): uno que representa la cámara de reacción (C), que contiene la muestra de arteria perfundida, y otro que funciona como un depósito de medio (R) (Figura 1 y Figura 2A). Las arterias carótidas se obtuvieron de lechones machos y hembras de 4-6 semanas de edad (6-12 kg) en el Instituto Pirbright, Reino Unido. Los procedimientos con animales se llevaron a cabo en virtud de la Ley de Animales (Procedimientos Científicos) del Ministerio del Interior (1986) (ASPA) y fueron aprobados por la Junta de Revisión de Ética y Bienestar Animal (AWERB) del Instituto Pirbright. Los animales fueron alojados de acuerdo con el Código de Prácticas para el Alojamiento y Cuidado de Animales de Raza. Todos los procedimientos fueron realizados por titulares de licencias personales que estaban capacitados y eran competentes bajo la licencia de proyecto PPL70/8852. Los lechones fueron sacrificados de acuerdo con el método de la lista uno bajo el ASPA.
1. Fabricación de insertos
- Fabrica el inserto mediante impresión 3D, utilizando el modelo 3D proporcionado (Archivo complementario 1).
NOTA: El modelado 3D permite realizar cambios sencillos en el diseño para adaptarse a nuevas aplicaciones. También se pueden utilizar materiales alternativos y técnicas de fabricación alternativas para producir el inserto. Debido a la compleja estructura interna, la sinterización selectiva por láser y la estereolitografía son alternativas apropiadas15. La poliamida 12 (PA12; ver Tabla de Materiales) es un buen candidato a material debido a su rendimiento superior en términos de retención de líquidos y resistencia a ciclos repetidos de esterilización por calor16. - Fabrica las juntas de silicona y las arandelas de policarbonato mediante corte láser17, utilizando los diseños proporcionados en el Archivo Suplementario 2.
NOTA: El corte por láser se subcontrata fácilmente y es un método de fabricación barato. Las arandelas se pueden fabricar en acero inoxidable, lo que proporciona un componente más resistente para un uso repetido. Todos los demás componentes son artículos disponibles en el mercado. En la Tabla 1 se proporciona una lista completa de los materiales necesarios. Los detalles comerciales de los artículos se incluyen en la Tabla de Materiales.
2. Esterilización, ensamblaje y cebado del dispositivo
- Esterilice todos los componentes siguiendo las instrucciones de la Tabla 1.
- En condiciones de flujo laminar, ensamble dos insertos fabricados (paso 1), como se muestra en la Figura 1A.
- Ensamble el sistema de perfusión como se muestra en la Figura 2, siguiendo los pasos a continuación:
- Conecte dos válvulas de tres vías conectadas al puerto R1 del depósito (puerto de intercambio de medios).
- Conecte la salida resultante al cabezal de la bomba peristáltica mediante un tubo equipado con una válvula unidireccional (tubo de válvula unidireccional).
- Conecte el cabezal de la bomba al puerto C4 de la cámara de reacción utilizando un tubo del sistema equipado con una válvula unidireccional.
NOTA: Esta rama puede equiparse opcionalmente con un sensor de presión que permite un monitoreo constante. - Conecte el puerto C1 de la cámara de reacción al tubo de pared blanda, y éste al canal de resistencia (diámetro interior pequeño).
NOTA: La longitud de la tubería de resistencia influirá en gran medida en la presión presente en el sistema. Esto debe investigarse más a fondo para garantizar unas condiciones de perfusión adecuadas. - Extienda el canal de resistencia con la tubería del sistema, creando un canal de retorno y cerrando el bucle de circulación luminal conectándolo al depósito en R5 (Figura 2C).
- Cree un canal de desbordamiento conectando la cámara de reacción C3 al depósito R3 con la tubería del sistema.
- Coloque un filtro de ventilación a través de R2.
- Cree un amortiguador de presión conectando una jeringa que contenga aire y medios a la cámara de reacción C6.
NOTA: La relación aire-medio correcta dependerá de la amortiguación de presión requerida.
- Prepare el sistema con medio de perfusión (medio de águila modificado de Dulbecco [DMEM] + 10% [v/v] de suero fetal bovino [FBS] + 1% [v/v] de penicilina-estreptomicina + 1% [v/v] de anfotericina B + 30% [v/v] de dextrano; ver Tabla de Materiales) a través de los puertos de intercambio de medios y el depósito.
NOTA: El cebado del sistema reduce el riesgo de burbujas atrapadas en el sistema e identifica cualquier fuga potencial. El volumen recomendado de medios es de aproximadamente 100-120 ml. El volumen utilizado dependerá del volumen muerto de la tubería utilizada para la experimentación.
3. Recolección y preparación de muestras
- Recolectar las arterias carótidas comunes izquierda y derecha, minimizando el manejo directo del tejido arterial13.
- Colocar el tejido en un medio de transporte frío (DMEM+ 20% [v/v] FBS + 2% [v/v] penicilina-estreptomicina + 1% [v/v] anfotericina B, ver Tabla de Materiales) para su transferencia.
- En una cabina de flujo laminar, retire el exceso de tejido conectivo y recorte los extremos del tejido con una hoja de bisturí. Lave el pañuelo dos veces en medios de transporte fríos.
- Coloque el pañuelo en un agitador orbital en medios de transporte durante al menos 30 minutos para un lavado completo.
- Conecte un segmento no ramificado de la arteria al sistema de biorreactor utilizando dos conectores Luer de púas y fíjelo en su lugar mediante una unión vascular (ligaduras vasculares de silicona; Tabla 1).
NOTA: La unión del vaso proporciona la tensión y la retracción adecuadas para asegurar el recipiente. La sección ovalada evita el daño tisular. - Haga fluir suavemente el medio a través de la arteria para verificar la permeabilidad.
- Después de asegurar la arteria al inserto fabricado, llene el espacio de reacción con medios de perfusión (paso 2.4). Finalmente, llene suavemente el circuito de circulación luminal con medios para eliminar cualquier resto de aire del sistema.
- Conectar el espacio de reacción con el sistema de perfusión previamente montado (sección 2), completando la circulación.
NOTA: Se recomienda realizar un control de calidad mediante inmunohistoquímica del tejido procesado. Esto identifica cualquier daño debido a una manipulación excesiva durante la preparación.
4. Cultura de perfusión y cambio de medios
- Coloque el sistema de perfusión en una incubadora a 37 °C con 5% de CO2 y luego conéctelo a una bomba peristáltica (ver Tabla de materiales)
- Conecte cualquier sistema de adquisición adicional (facultativo), como sensores de presión (consulte la tabla de materiales).
- Deje que el sistema se equilibre durante la noche con un bajo caudal de medios de ~10-15 ml/min.
NOTA: Se requieren experimentos iniciales para determinar la configuración de la bomba, el flujo del medio, la presión del sistema y la configuración óptima de los amortiguadores/abrazaderas de presión para garantizar que se cumplan las condiciones adecuadas. - Al día siguiente, aumente el caudal de forma incremental (+1 rpm cada hora, equivalente a un aumento de ~2,5 ml/min cada hora, en el sistema actual) hasta alcanzar el caudal final (35 ml/min). Monitoree el sistema periódicamente en busca de fugas.
NOTA: Para calcular el caudal exacto en función de la velocidad de la bomba peristáltica, los usuarios deben realizar primero una calibración adecuada de la bomba18. Utilizando la fórmula (1), el caudal volumétrico (Q) se puede calcular en función del volumen dispensado (V) en un tiempo determinado (t). Para calcular la velocidad de flujo estimada () podemos utilizar el caudal (Q) previamente calculado y el área de la sección transversal del recipiente (A), descritos en la ecuación (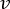 2).
2).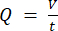 (1)
(1)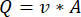 (2)
(2) - Cada 3 días, cambie el 50% del medio (~50 ml) conectando una jeringa llena de medios nuevos al puerto de intercambio de medios más cercano a la bomba y una jeringa vacía al puerto más cercano al depósito para recoger el medio gastado (Figura 2).
NOTA: El uso de dos válvulas de tres vías como puertos de intercambio de medios facilita el funcionamiento continuo de la perfusión durante el intercambio de medios. - Al final del experimento, recoja el tejido de la cámara de reacción recortando los extremos conectados al biorreactor con tijeras quirúrgicas estériles.
- Desmonte, limpie y esterilice el sistema para su uso posterior.
5. Análisis de la muestra
- Fijar la muestra recolectada en paraformaldehído (PFA) al 4% durante la noche a 4 °C.
- Incrustar el tejido a la temperatura óptima de corte (OCT; ver Tabla de Materiales)19 y congelar por inmersión en isopentano enfriado en nitrógeno líquido.
- Obtener secciones criogénicas de 3-5 mm de espesor utilizando un criostato.
- Realizar inmunohistoquímica (hematoxilina y eosina [H&E]) y/o inmunofluorescencia. Siga el protocolo típico de inmunofluorescencia:
- Bloquee las rodajas durante 1 h a temperatura ambiente con suero de cabra al 20% [v/v] en solución salina tamponada con fosfato (PBS; consulte la Tabla de materiales).
- Incubar las rodajas durante la noche a 4 °C con anticuerpo primario de conejo contra CD31 diluido 1:50 en PBS (ver Tabla de Materiales).
- Lavar tres veces con PBS durante 5 min.
- Incubar durante 1 h a 37 °C con anticuerpo secundario anti-conejo de cabra marcado con fluorescencia diluido 1:200 en PBS y anticuerpo fluorescente conjugado directamente conjugado con α músculo liso (AME) diluido 1:200 en PBS (ver Tabla de materiales).
- Lavar tres veces con PBS durante 5 min.
- Tiñir los núcleos con DAPI diluido 1:1.000 en PBS durante 10 min a temperatura ambiente.
- Incubar con negro de Sudán al 0,1 % (p/v) (ver Tabla de materiales) en etanol al 70 % (v/v) durante 10 min a temperatura ambiente para reducir la autofluorescencia tisular.
- Lavar el pañuelo con abundante agua desionizada. Monte las guías en el medio de montaje.
- Tome imágenes de las muestras con un microscopio de barrido láser confocal.
Resultados
Este estudio ha establecido un sistema de perfusión versátil y asequible (EasyFlow)13. El diseño impreso en 3D del sistema facilita la adopción del sistema por parte de otros laboratorios y, por lo tanto, fomenta la reproducibilidad.
El inserto de perfusión fabricado está alojado en un tubo de centrífuga de 50 ml, lo que crea un entorno aislado. Utilizando dos insertos de perfusión, se puede establecer un bucle de perfusión que contiene un depósito y una cámara de reacción, donde se incuba la muestra biológica. A continuación, el sistema de perfusión se conecta a una bomba peristáltica y a sistemas de adquisición opcionales, como sensores de presión y dispositivos de ultrasonido, para monitorizar las condiciones de cultivo (Figura 2).
Se recolectaron muestras de arteria carótida porcina y se procesaron antes de ser cultivadas en perfusión durante 7 días. Para asegurar la calidad del tejido antes del cultivo, se realizaron experimentos preliminares en los que las muestras se fijaron en el momento de la escisión, después de la preparación del tejido y después de la perfusión. Se utilizó la tinción fluorescente para marcadores endoteliales (CD31) y de músculo liso (αSMA) para evaluar el mantenimiento de la integridad tisular. En la Figura 3 se presentan ejemplos de tejidos bien conservados y dañados para su comparación. Las imágenes muestran la importancia de una manipulación cuidadosa del tejido en el momento de la escisión, ya que un procesamiento incorrecto (estiramiento excesivo, aplastamiento, etc.) puede provocar la pérdida del endotelio antes del cultivo. Los resultados también muestran la importancia del establecimiento gradual de la perfusión para evitar el daño luminal.
La tinción de H&E se realizó junto con la tinción de inmunofluorescencia (IF) para mostrar el mantenimiento de la morfología y la distribución general de las células en la pared del vaso después de 7 días de cultivo (Figura 4). La aplicación de condiciones fisiológicas de cultivo en el dispositivo asegura el mantenimiento de la cobertura endotelial de la luz, la alineación de las células musculares lisas en el medio y la preservación de los vasa vasorum en la adventicia.
El diseño compacto y modular del sistema de biorreactor también permite una amplia gama de configuraciones del sistema. La configuración más pequeña comprende un solo biorreactor y es ideal para estudios farmacológicos y de bajo volumen (perfusión recirculante20, volumen total de 50-70 ml). Para aumentar la duración del cultivo y reducir el número de cambios de medio, lo ideal es un sistema de circulación de un solo depósito, como el descrito en este protocolo, o un sistema de alimentación constante, ya que tienen un mayor volumen de medio en circulación. Se puede establecer una configuración de doble circulación21 para explorar entornos experimentales donde la localización de los estímulos es crítica. El dispositivo actual también se puede combinar con sistemas de control más sofisticados para permitir un control preciso de retroalimentación de parámetros como el pH y el oxígeno disuelto (Figura 5).
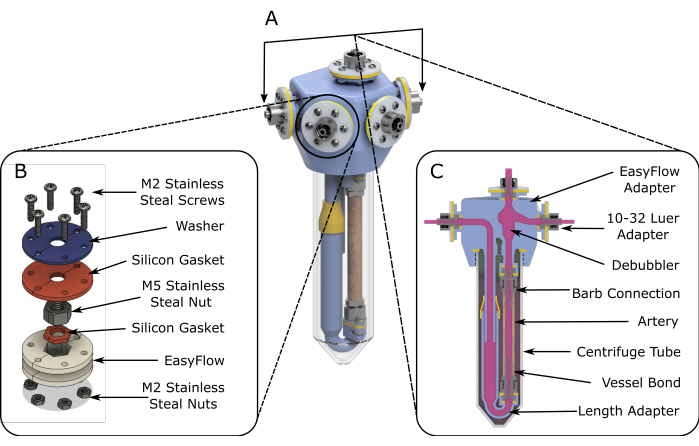
Figura 1: Esquemas de ensamblaje de EasyFlow. (A) Esquemas renderizados en 3D que ayudan al montaje del inserto de perfusión. (B) Se proporcionan esquemas detallados para facilitar el montaje de los sitios de conexión. (C) Una vista de la sección transversal del espacio de reacción resalta los componentes esenciales del inserto EasyFlow y la conexión del tejido al inserto. Haga clic aquí para ver una versión más grande de esta figura.
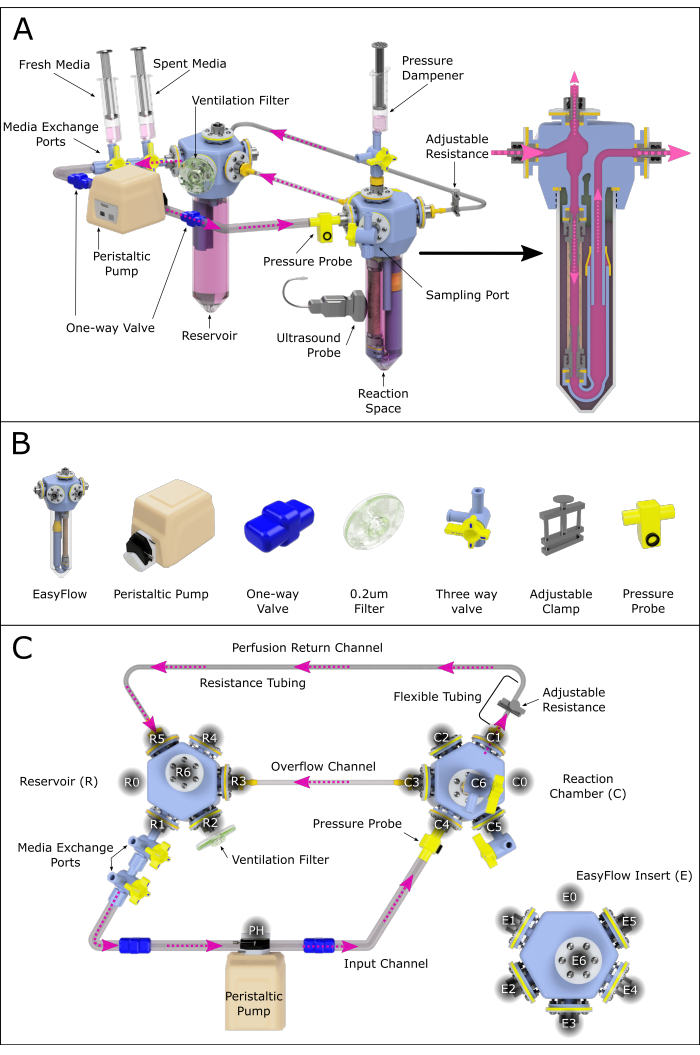
Figura 2: Representación esquemática del conjunto del sistema de perfusión. (A) Sistema de perfusión ensamblado que contiene todos los componentes importantes, destacando su posición relativa en un entorno renderizado en 3D. No todos los componentes están a escala. (B) También se presentan vistas isométricas individuales de los componentes. (C) Se muestra una vista superior del sistema de perfusión ensamblado para ayudar al ensamblaje y conexión de los diferentes componentes. Los puertos han sido etiquetados y numerados en sentido contrario a las agujas del reloj para navegar por los distintos sitios de conexión a través del sistema de perfusión. Este principio se ha aplicado al depósito (R) y a la cámara de reacción (C). A los diversos canales que conectan las dos cámaras también se les han asignado nombres como referencia. Haga clic aquí para ver una versión más grande de esta figura.
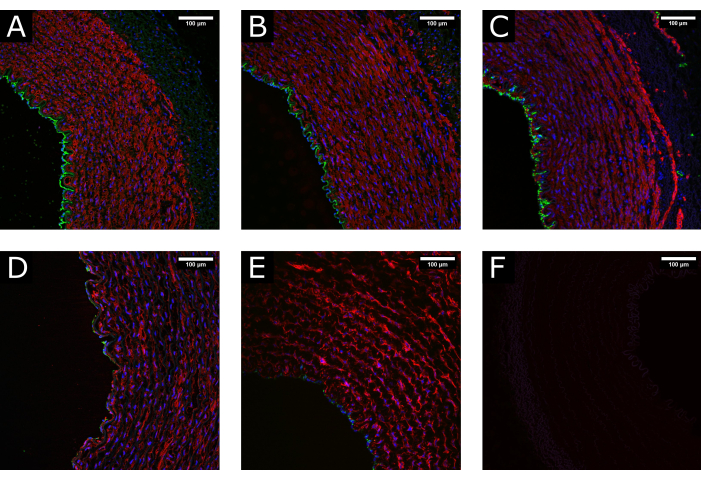
Figura 3: Mantenimiento de los tejidos durante el procesamiento. (A) Las imágenes confocales muestran la estructura normal de una arteria en el momento de la extracción, (B) después de la limpieza y el procesamiento, y (C) después del cultivo de perfusión, lo que demuestra el mantenimiento de una morfología bien conservada. (D) Ejemplos de tejido dañado debido a una manipulación excesiva o incorrecta durante el procesamiento o (E) debido a la aplicación de condiciones de cultivo no fisiológicas (es decir, inicio abrupto de alto flujo) muestran agotamiento de la cobertura luminal y alteración del medio. (F) El control negativo indica la especificidad de la tinción. CD31: verde; αSMA: rojo; DAPI: azul. Barras de escala: 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
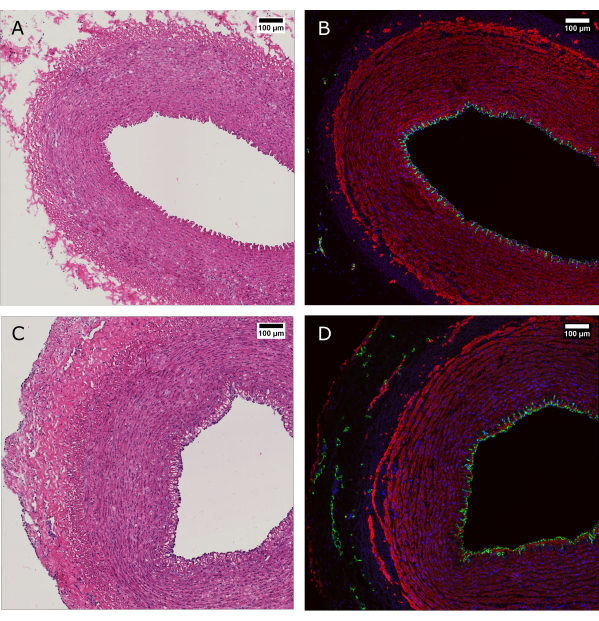
Figura 4: Evaluación histológica del tejido antes y después del cultivo de perfusión. (A y B) El tejido arterial fue evaluado por histología en el momento de la cosecha y (C y D) después de 7 días de cultivo con el sistema de biorreactor. (A y C) La tinción de H&E revela la preservación de la estructura y organización de la pared arterial. (B y D) La tinción por inmunofluorescencia del mismo tejido evidencia cobertura endotelial, alineación de células musculares lisas y vasa vasorum en la adventicia. CD31: verde; SMA: rojo; DAPI: azul. Barras de escala: 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
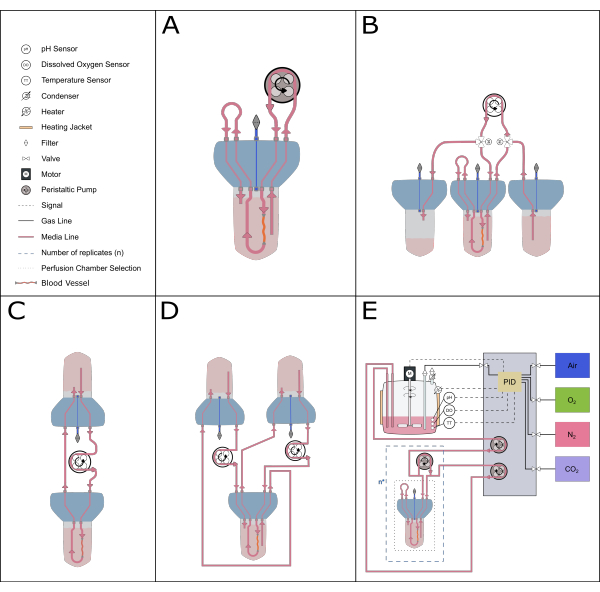
Figura 5: Representación esquemática de las posibles configuraciones de perfusión. Se pueden acomodar varias configuraciones alternativas con el inserto de perfusión para permitir diferentes estudios experimentales. (A) La configuración de perfusión de recirculación minimiza el volumen de medio requerido. (B) La configuración de alimentación constante proporciona un suministro constante de medio al tejido. (C) La circulación de un solo depósito (como se describe en este documento) proporciona un mayor volumen de medios para incubaciones a largo plazo e incluye una zona de amortiguación para el intercambio de aire y el equilibrio de presión. (D) La configuración de doble circulación proporciona dos bucles distintos que alimentan las circulaciones interna (dentro de la arteria) y externa (espacio de reacción) de forma independiente. (E) La configuración de perfusión dinámica incluye gases continuos y control de pH mediante un controlador proporcional-integral-derivativo (PID). Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Componentes para la fabricación de los insertos. Haga clic aquí para descargar esta tabla.
Archivo complementario 1: Modelo 3D del inserto EasyFlow para la fabricación de impresión 3D. Haga clic aquí para descargar este archivo.
Archivo complementario 2: Esquemas de diseño del dispositivo construido, vista en sección, impresión y componentes de sellado. Haga clic aquí para descargar este archivo.
Discusión
Los sistemas de perfusión vascular ex vivo constituyen una plataforma única para estudiar la función y el comportamiento de las células vasculares dentro de sus tejidos nativos en condiciones controladas, lo que permite la disección de procesos complejos como la remodelación vascular post-lesión22. Sin embargo, la mayoría de los biorreactores de los que se tiene noticia son sistemas de fabricación propia basados en componentes hechos a medida y, a menudo, son difíciles de replicar por otros23. Existen soluciones comerciales alternativas, pero carecen de flexibilidad en el diseño y pueden ser relativamente costosas24.
Hemos desarrollado un sistema alternativo que proporciona una plataforma fácil, barata y reproducible que se puede fabricar utilizando técnicas de impresión 3D de código abierto13. En el presente artículo se describe la configuración del sistema para permitir aplicaciones reproducibles por parte de los usuarios finales. Esta configuración permite la aplicación de condiciones fisiológicas y patológicas de presión (40-180 mmHg), caudal (6-30 mL/min) y en combinación con medios que imitan la viscosidad de la sangre, con diversos grados de tensión de cizallamiento.
La reproducibilidad es un aspecto esencial del proceso científico, ya que permite a los investigadores validar los hallazgos de otros y basarse en ellos para avanzar en nuestra comprensión de las enfermedades vasculares. Además, las herramientas que permiten y promueven la colaboración entre grupos son esenciales para avanzar en el conocimiento científico. EasyFlow representa un ejemplo de este tipo de soluciones accesibles y de código abierto que pueden ser fácilmente producidas y adoptadas por laboratorios que trabajan en una amplia gama de proyectos dentro del campo de las ciencias vasculares y más allá.
Informamos que este cultivo de dispositivos mantiene la viabilidad del tejido arterial durante al menos 7 días y se puede utilizar para modelar pasos específicos de la enfermedad vascular. Con esto, se podrían modelar los caudales fisiológicos y las condiciones de presión13. Es importante destacar que este cultivo de perfusión es rentable debido a los bajos costos de producción y al bajo volumen de medio necesario para operar el sistema.
El diseño 3D también se puede adaptar a nuevas aplicaciones y se pueden probar nuevos materiales para la impresión. Incluso en su formato actual, el espacio de alojamiento de muestras se puede adaptar fácilmente a muestras de diferentes tamaños cambiando la longitud de los accesorios o el orificio de los conectores luer. Es importante tener en cuenta que, dada la naturaleza modular del dispositivo y sus pequeñas dimensiones, este biorreactor se puede utilizar en varias configuraciones (Figura 5) y se puede aplicar a cultivos multiplex, donde varias muestras pueden exponerse a diferentes condiciones al mismo tiempo en biorreactores separados.
Se prevé que el uso del sistema se amplíe en el futuro para apoyar el cultivo de vasos sanguíneos de diferentes orígenes (por ejemplo, diferentes especies) y de diferentes naturalezas (por ejemplo, venas, linfáticos), y tal vez se aplique al cultivo de otros tejidos huecos (por ejemplo, tráquea, intestino). En particular, la investigación muestra que el cultivo de andamios de ingeniería tisular en perfusión constante ayuda a la distribución homogénea de las células dentro de la construcción y maduración del tejido resultante25,26. Además, la siembra de injertos vasculares en perfusión contribuye a lograr una luz vascular celularizada más uniforme, en comparación con los métodos estáticos27. Por esta razón, prevemos que el sistema se aplique a la ingeniería de tejidos para ayudar a abordar los desafíos actuales, lo que permitirá el desarrollo futuro de sustitutos sintéticos reproducibles de los vasos sanguíneos28.
El protocolo descrito aquí presenta algunos pasos importantes críticos para el éxito de la cultura de flujo. El establecimiento y monitoreo de las condiciones de flujo adecuadas no es trivial y debe realizarse en cada sistema cuando se configura por primera vez, para garantizar que las condiciones de cultivo sean fisiológicas. El caudal y la presión se monitorizaron mediante sensores de presión e imágenes de ultrasonido. Otro punto crítico es asegurarse de que el tejido sea viable e intacto al comienzo del cultivo. Esto requiere una fuente fresca, un manejo cuidadoso y puede verificarse mediante análisis histológicos. Además, la solución de problemas debe realizarse al comienzo de cada experimento para identificar cualquier posible contaminación bacteriana o fuente de fuga de medios.
Es importante destacar que el sistema de perfusión descrito, si bien proporciona condiciones fisiológicas de presión y flujo, no puede imitar completamente los complejos patrones de ondas de presión registrados in vivo. Esta limitación es atribuible al uso de una bomba peristáltica y puede ser resuelta utilizando equipos más especializados para reproducir condiciones hemodinámicas avanzadas. El cultivo de vasos sanguíneos en un biorreactor tampoco es capaz de abordar estudios en los que el sistema inmunitario o la interacción con otros órganos es crítico.
En conclusión, se presenta un sistema de perfusión simple impreso en 3D que puede imitar el entorno hemodinámico fisiológico, que se espera que contribuya a la estandarización de cultivos de vasos sanguíneos ex vivo . Su potencial de personalización y aplicación al cultivo a largo plazo lo convierte en una herramienta esencial para avanzar en la comprensión de estos complejos sistemas biológicos en fisiología y condiciones patológicas.
Divulgaciones
Los autores no tienen ningún conflicto de intereses que revelar.
Agradecimientos
Los autores desean agradecer al Centro de Patología Veterinaria de la Facultad de Medicina Veterinaria de la Universidad de Surrey por los servicios de histología. También agradecemos a los Dres. L. Dixon, A. Reis y M. Henstock del Instituto Pirbright (Pirbright, Reino Unido) por su apoyo en la obtención de los tejidos animales, y al Departamento de Ciencias Bioquímicas de la Universidad de Surrey, especialmente al equipo técnico, por su continuo apoyo. RSM fue apoyado por el premio de beca del Colegio de Doctorado (Universidad de Surrey), DM y PC fueron apoyados por el Centro Nacional para el Reemplazo, Refinamiento y Reducción de Animales en Investigación (números de subvención: NC/R001006/1 y NC/T001216/1).
Materiales
| Name | Company | Catalog Number | Comments |
| EasyFlow | - | - | 3D printed by MultiJet Fusion by Protolabs |
| PA12 - 3D printing | Protolabs | - | - |
| Peristaltic pump | Heidolph | PD5201 | |
| Culture media components: | |||
| Amphotericin B solution, 250 mug/mL in deionized water | Sigma-Aldrich | A2942-20ML | |
| Dextran from Leuconostoc spp. | Sigma-Aldrich | D8802-25ML | |
| Dulbecco's Modified Eagle's Medium - high glucose, w/ 4500 mg/L glucose, L-glutamine, sodium pyruvate, and sodium bicarbonate | Sigma-Aldrich | D6429-6X500ML | |
| Fetal Bovine Serum | Sigma-Aldrich | F9665 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333-100ML | |
| Immunostaining materials: | |||
| Cryostat | LEICA | CM3050 S | |
| DAPI | Sigma-Aldrich | D9542-10MG | |
| Goat serum | Sigma-Aldrich | G9023-10ML | |
| Goat α-Rabbit Alexa Fluor 488 | Thermo Fisher Scientific | A11008 | |
| Invitrogen eBioscience Fluoromount G | Thermo Fisher Scientific | 50-187-88 | |
| MX35 Premier + Microtome Blade | Thermo Scientific | 3052835 | |
| Optimal Cooling Tempearure Compound - OCT | Agar Scientific | AGR1180 | |
| Rabbit α-CD31 antibody | Abcam | ab28364 | |
| Sudan Black B | Santa Cruz Biotechnology | SC-203760 | |
| X72 SuperFrost Plus Adhesion slide, 25x75x1mm, White, 90° Ground Edges, Frosted Area 20mm, 72/box | Fisher Scientific | J1800AMNZ | |
| α-Smooth Muscle Actin (SMA) Alexa Fluor® 647-conjugated antibody | R&D Systems | IC1420R | |
| Material for laser cutting of components: | |||
| Clear Plastic Sheet, 1250 mm x 610 mm x 1 mm (for laser cutting of washers) | RS Components | 258-6590 | |
| RS PRO Translucent Rubber Sponge Sheet, 600 mm x 600 mm x 1.5 mm (for laser cutting of silicone seals) | RS Components | 840-5541 | |
| Optional pressure monitors: | |||
| Pressure sensor | Parker Hannifin | 080-699PSX-3P-5 | |
| SciPres Pressure Monitor | Parker Hannifin | 206-200-M | |
| Pre-sterilized single use plasticware: | |||
| 0.2 um filter | Sarstedt | 70.1114.210 | |
| 20 mL Sterile syringe | IMS Euro | 40004 | |
| 50 mL Centrifuge Tube | Thermo Fisher Scientific | Sarstedt - 62.547.254 | |
| Small components: | |||
| Cable ties | - | - | |
| Masterflex Adapter Fittings, Female Luer to Hose Barb | Cole-Parmer | WZ-30800-10 | Barb Adaptor |
| Masterflex Polycarbonate Luer Fittings | Cole-Parmer | AU-45504-84 | |
| Nylon Miniature Check Valve | Cole-Parmer | 98553-00 | |
| RS PRO Translucent Rubber Sponge Sheet, 600 mm x 600 mm x 1.5 mm (for laser cutting of silicone seals) | RS Components | 840-5541 | |
| Stainless Steel M2 Hex Nuts | RS Components | 527-218 | |
| Stainless Steel M2 x 6 mm Screws | RS Components | 418-7426 | |
| Stainless Steel M5 Hex Nuts | RS Components | 189-585 | |
| Surgical vessel loop | Vascular Silicone Ties,International Medical Supplies | 10-1003 | |
| Three-way valves | IMS Euro | 91000 | |
| Surgical Equipment | |||
| Anatomical Forceps, GRAEFE, Curved, 10 cm SKU: BD-07 | International Medical Supplies | SKU: BD-07 | |
| Micro Forceps, Angled, 0.3 mm, 11 cm | International Medical Supplies | SKU: BD-361 | |
| Micro Scissors Noyes, Curved, 12 cm | International Medical Supplies | SKU: FD-12 | |
| Troge Surgical Scalpels - Size 23 - Box of 100 | International Medical Supplies | 63114 | |
| Tubing: | |||
| Eppendorf silicone tubing (I.D.1.6 mm, O.D.4.7 mm) | Eppendorf | M0740-2396 | System tubing |
| Masterflex PharMed BPT 3-Stop Tubing | ISMATEC | 95714-48 | Soft wall tubing (for clamp) |
| RS PRO Transparent Hose Pipe, 0.8 mm ID, Silicone | RS Components | 667-8432 | Resistance tubing (small inner diameter) |
| Tygon for food (I.D. 4.8 mm, W.T. 1.6 mm) | Heidolph | 525-30027-00-0 | One way valve tube |
| Verderflex Yellow Hose Pipe, 6.4 mm ID, Verderprene | RS Components | 125-4042 | Pump Tubing |
Referencias
- Davies, P. F., Civelek, M., Fang, Y., Fleming, I. The atherosusceptible endothelium: Endothelial phenotypes in complex haemodynamic shear stress regions in vivo. Cardiovascular Research. 99 (2), 315-327 (2013).
- Gugliandolo, E., et al. Palmitoylethanolamide and Polydatin combination reduces inflammation and oxidative stress in vascular injury. Pharmacological Research. 123, 83-92 (2017).
- Anselmino, M., et al. Catheter ablation of atrial fibrillation in patients with left ventricular systolic dysfunction: A systematic review and meta-analysis. Circulation, Arrhythmia, and Electrophysiology. 7 (6), 1011-1018 (2014).
- Viola, M., et al. Subcutaneous delivery of monoclonal antibodies: How do we get there. Journal of Controlled Release. 286, 301-314 (2018).
- Kim, D. D. In vitro cellular models for nasal drug absorption studies. Drug Absorption Studies: In Situ, In Vitro and In Silico Models. , 216-234 (2008).
- Lewis, D. I. Animal experimentation: Implementation and application of the 3Rs. Emerging Topics in Life Sciences. 3 (6), 675-679 (2019).
- Rouwkema, J., et al. In vitro platforms for tissue engineering: Implications for basic research and clinical translation. Journal of Tissue Engineering and Regenerative Medicine. 5 (8), e164-167 (2011).
- Xu, Y., Shrestha, N., Préat, V., Beloqui, A. An overview of in vitro, ex vivo and in vivo models for studying the transport of drugs across intestinal barriers. Advanced Drug Delivery Reviews. 175, 113795 (2021).
- Vaghela, R., et al. Vessel grafts for tissue engineering revisited-Vessel segments show location-specific vascularization patterns in ex vivo ring assay. Microcirculation. 29 (2), e12742 (2022).
- Håkansson, J., et al. Individualized tissue-engineered veins as vascular grafts: A proof of concept study in pig. Journal of Tissue Engineering and Regenerative Medicine. 15 (10), 818-830 (2021).
- Saucy, F., et al. Ex vivo pulsatile perfusion of human saphenous veins induces intimal hyperplasia and increased levels of the plasminogen activator inhibitor 1. European Surgical Research. 45 (1), 50-59 (2010).
- Tosun, Z., McFetridge, P. S. Variation in cardiac pulse frequencies modulates vSMC phenotype switching during vascular remodeling. Cardiovascular Engineering and Technology. 6 (1), 59-70 (2015).
- Matos, R. S., Maselli, D., McVey, J. H., Heiss, C., Campagnolo, P. 3D printed bioreactor enabling the pulsatile culture of native and angioplastied large arteries. Frontiers in Cardiovascular Medicine. 9, 864580 (2022).
- Neff, L. P., et al. Vascular smooth muscle enhances functionality of tissue-engineered blood vessels in vivo. Journal of Vascular Surgery. 53 (2), 426-434 (2011).
- Boparai, K. S., Singh, R. Advances in Fused Deposition Modeling. In: Module. Refrence in Materials Science and Materials Engineering. , (2017).
- McKeen, L. W., McKeen, L. W. Chapter 6 - Polyamides (Nylons). The Effect of Creep and Other Time Related Factors on Plastics and Elastomers (Second Edition). , 197-262 (2012).
- Moradi, M., Mehrabi, O., Azdast, T., Benyounis, K. Y. Enhancement of low power CO2 laser cutting process for injection molded polycarbonate). Optics & Laser Technology. 96, 208-218 (2017).
- Ghasem, N. . Computer Methods in Chemical Engineering. , (2021).
- Lying, F., Gazi, F., Gardner, E. Preparation of tissues and cells for infrared and raman spectroscopy and imaging. Biomedical Applications of Synchrotron Infrared Microspectroscopy.RSC Analytical Spectroscopy Monographs. (11), 147-185 (2011).
- Sassi, L., et al. A perfusion bioreactor for longitudinal monitoring of bioengineered liver constructs. Nanomaterials. 11 (2), 275 (2021).
- Haykal, S., et al. Double-chamber rotating bioreactor for dynamic perfusion cell seeding of large-segment tracheal allografts: Comparison to conventional static methods. Tissue Engineering. Part C, Methods. 20 (8), 681-692 (2014).
- Kural, M. H., Dai, G., Niklason, L. E., Gui, L. An ex vivo vessel injury model to study remodeling. Cell Transplant. 27 (9), 1375-1389 (2018).
- Wong, M. M., Hong, X., Karamariti, E., Hu, Y., Xu, Q. Generation and grafting of tissue-engineered vessels in a mouse model. Journal of Visualized Experiments. (97), 52565 (2015).
- Alvino, V. V., et al. In vitro and in vivo preclinical testing of pericyte-engineered grafts for the correction of congenital heart defects. Journal of the American Heart Association. 9 (4), e014214 (2020).
- Nerurkar, N. L., Sen, S., Baker, B. M., Elliott, D. M., Mauck, R. L. Dynamic culture enhances stem cell infiltration and modulates extracellular matrix production on aligned electrospun nanofibrous scaffolds. Acta Biomaterialia. 7 (2), 485-491 (2011).
- Engebretson, B., Mussett, Z. R., Sikavitsas, V. I. The effects of varying frequency and duration of mechanical stimulation on a tissue-engineered tendon construct. Connective Tissue Research. 59 (2), 167-177 (2018).
- Saunders, S. K., et al. Evaluation of perfusion-driven cell seeding of small diameter engineered tissue vascular grafts with a custom-designed seed-and-culture bioreactor. PLoS One. 17 (6), e0269499 (2022).
- Stephenson, M., Grayson, W. Recent advances in bioreactors for cell-based therapies. F1000Research. 7, (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados