Method Article
Ex Vivo Perfusionskultur großer Blutgefäße in einem 3D-gedruckten Bioreaktor
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll stellt den Aufbau und Betrieb eines neu entwickelten, 3D-gedruckten Bioreaktors für die ex vivo Kultur von Blutgefäßen in Perfusion vor. Das System ist so konzipiert, dass es leicht von anderen Benutzern übernommen werden kann, praktisch, erschwinglich und an verschiedene experimentelle Anwendungen wie grundlegende biologische und pharmakologische Studien anpassbar ist.
Zusammenfassung
Gefäßerkrankungen bilden die Grundlage für die meisten Herz-Kreislauf-Erkrankungen (CVDs), die nach wie vor weltweit die Hauptursache für Mortalität und Morbidität sind. Wirksame chirurgische und pharmakologische Eingriffe zur Vorbeugung und Behandlung von Gefäßerkrankungen sind dringend erforderlich. Zum Teil schränkt der Mangel an translationalen Modellen das Verständnis der zellulären und molekularen Prozesse ein, die an Gefäßerkrankungen beteiligt sind. Ex-vivo-Perfusionskultur-Bioreaktoren bieten eine ideale Plattform für die Untersuchung großer Tiergefäße (einschließlich Menschen) in einer kontrollierten dynamischen Umgebung, die die Leichtigkeit der In-vitro-Kultur und die Komplexität des lebenden Gewebes kombiniert. Die meisten Bioreaktoren sind jedoch kundenspezifisch gefertigt und daher schwer zu übernehmen, was die Reproduzierbarkeit der Ergebnisse einschränkt. In diesem Artikel wird ein 3D-gedrucktes System vorgestellt, das leicht hergestellt und in jedem biologischen Labor angewendet werden kann, und es wird ein detailliertes Protokoll für seine Einrichtung bereitgestellt, das den Benutzern den Betrieb ermöglicht. Dieses innovative und reproduzierbareEx-vivo-Perfusionskultursystem ermöglicht die Kultivierung von Blutgefäßen für bis zu 7 Tage unter physiologischen Bedingungen. Wir gehen davon aus, dass die Einführung eines standardisierten Perfusionsbioreaktors zu einem besseren Verständnis der physiologischen und pathologischen Prozesse in den Blutgefäßen großer Tiere beitragen und die Entdeckung neuer Therapeutika beschleunigen wird.
Einleitung
Die Gefäßwand befindet sich in einem reaktiven stationären Zustand, der sowohl die Empfindlichkeit gegenüber äußeren Reizen (d. h. Druckänderungen, Vasokonstriktoren) als auch eine konsistente, nicht aktivierende Oberfläche gewährleistet, die die Blutgerinnung und die Infiltration von Entzündungszellen verhindert1. Als Reaktion auf alters- und lebensstilabhängige Reize und bei direkter Schädigung aktiviert die Gefäßwand Umbauprozesse wie Restenose und Atherosklerose, die bekanntermaßen zu häufigen kardiovaskulären Erkrankungen wie ischämischem Schlaganfall und Myokardinfarkt beitragen2. Während interventionelle Ansätze wie perkutane Revaskularisation und Stentimplantation zur Behandlung fortgeschrittener Manifestationen von Gefäßerkrankungen zur Verfügung stehen, ist bekannt, dass diese weitere Gefäßschäden hervorrufen, die oft zu einem Rezidiv führen. Darüber hinaus gibt es nur begrenzte präventive und frühzeitige Lösungen. Das Verständnis der Mechanismen, die die Homöostase der Gefäßwand aufrechterhalten und ihre Dysfunktion vorantreiben, steht im Mittelpunkt der Entwicklung neuer Heilmittel3.
Trotz der ständigen Entwicklung und der Fortschritte in der Molekularbiologie und dem Tissue Engineering bleiben Tierversuche ein entscheidender Bestandteil der gefäßbiologischen Studien. In-vivo-Tierstudien haben enorme Einblicke in die Mechanismen der vaskulären Homöostase und Pathologie geliefert. Diese Verfahren sind jedoch kostspielig, haben einen relativ geringen Durchsatz und werfen erhebliche ethische Fragen auf. Darüber hinaus sind Kleintiere für die menschliche Gefäßphysiologie nur unzureichend repräsentativ, und größere Tierversuche sind erheblich teurer und werfen weitere ethische Überlegungen auf 4,5. Mit der steigenden Nachfrage nach pharmazeutischen und medizinischen Lösungen für eine schnell alternde Bevölkerung werden die Nachteile der Verwendung von Tieren verstärkt, was sich auf die Reproduzierbarkeit, Zuverlässigkeit und Übertragbarkeit der Ergebnisse auf die Patientenversorgung auswirkt6.
In-vitro-Systeme bieten eine vereinfachte Plattform zur Untersuchung grundlegender Mechanismen, können aber nicht die Komplexität des gesamten Gewebes, die Wechselwirkungen zwischen Zellen und der extrazellulären Matrix sowie die mechanischen Kräfte rekapitulieren, die entscheidende Determinanten bei der Entwicklung von Gefäßerkrankungen sind7.
Ex-vivo-Studien, die an ganzen Geweben durchgeführt wurden, die in künstlich kontrollierten Umgebungen gehalten wurden, ahmen die In-vivo-Komplexität nachund ermöglichen gleichzeitig Untersuchungen mit relativ hohem Durchsatz 8. Aufgrund der Fähigkeit, die Kulturbedingungen und die Umgebung genau zu kontrollieren, ermöglichen Ex-vivo-Modelle ein breites Spektrum komplexer Studien und bieten eine geeignete Alternative, um den Einsatz von tierischen Verfahren in der Gefäßbiologie zu reduzieren. Statische vaskuläre Ringkulturen boten interessante Einblicke, konnten aber das entscheidende hämodynamische Element9 nicht integrieren. In der Tat stellt die Untersuchung des Gefäßsystems ex vivo besondere Herausforderungen dar, die mit den vielen dynamischen Kräften zusammenhängen, die auf die Zellen innerhalb der Blutgefäßwand wirken. Stimuli wie luminale Strömung, Turbulenz, Scherspannung, Druck und Wandverformung haben einen signifikanten Einfluss auf die Pathophysiologie des Gewebes10,11,12.
Perfusionsbioreaktoren sind unerlässlich für die Untersuchung der vaskulären Homöostase und des Umbaus als Reaktion auf Verletzungen oder hämodynamische Veränderungen13. Darüber hinaus kann die Perfusionskultur verwendet werden, um die Reifung und Haltbarkeit von Tissue-Engineering-Blutgefäßen (TEBVs) zu verbessern und geeignete Alternativen für Gefäßtransplantate zu bieten14.
Kommerziell erhältliche Perfusionsbioreaktoren sind in ihrer Flexibilität und Anpassungsfähigkeit eingeschränkt und kostspielig. Viele der existierenden, intern entwickelten Bioreaktoren sind jedoch aufgrund der begrenzten Beschreibungen und der Nichtverfügbarkeit speziell angefertigter Komponenten 7,8,9,10,11,12 nur schwer in anderen Labors zu replizieren. Um diese Einschränkungen zu überwinden, haben wir kürzlich einen neuen Bioreaktor (EasyFlow) entwickelt, der wirtschaftlich herzustellen ist, eine Reihe von Geweben aufnehmen kann und relativ einfache Modifikationen ermöglicht, um sich an unterschiedliche Forschungsanforderungen anzupassen13. Der Einsatz ist 3D-gedruckt und passt wie in einen Deckel eines Standard-50-ml-Zentrifugenröhrchens. Sein modularer Aufbau und die 3D-Druckfertigung machen es in verschiedenen Labors zugänglich und reproduzierbar sowie leicht modifizierbar, um sich an unterschiedliche wissenschaftliche Anforderungen anzupassen. Dieses Protokoll beschreibt den Aufbau und den grundlegenden Betrieb des Bioreaktorsystems in einer arteriellen Perfusionsumgebung.
Protokoll
Dieses Protokoll beschreibt den Aufbau und die Verwendung eines Systems, das aus zwei EasyFlow-Einsätzen (Bioreaktoren) besteht: einem, der die Reaktionskammer (C) darstellt, die die perfundierte Arterienprobe enthält, und einem, der als Mediumreservoir (R) fungiert (Abbildung 1 und Abbildung 2A). Die Halsschlagadern wurden von 4-6 Wochen alten männlichen und weiblichen Ferkeln (6-12 kg) am Pirbright Institute in Großbritannien gewonnen. Tierbehandlungen wurden gemäß dem Home Office Animals (Scientific Procedures) Act (1986) (ASPA) durchgeführt und vom Animal Welfare and Ethical Review Board (AWERB) am Pirbright Institute genehmigt. Die Unterbringung der Tiere erfolgte in Übereinstimmung mit dem Verhaltenskodex für die Unterbringung und Pflege von Zuchttieren. Alle Verfahren wurden von Inhabern einer persönlichen Lizenz durchgeführt, die im Rahmen der Projektlizenz PPL70/8852 geschult und kompetent waren. Die Ferkel wurden nach der Schedule-One-Methode im Rahmen des ASPA gekeult.
1. Herstellung von Einsätzen
- Fertigen Sie die Einlage im 3D-Druck unter Verwendung des bereitgestellten 3D-Modells (Zusatzdatei 1).
HINWEIS: Die 3D-Modellierung ermöglicht einfache Änderungen am Design, um sie an neue Anwendungen anzupassen. Für die Herstellung des Einsatzes können auch alternative Materialien und alternative Fertigungstechniken verwendet werden. Aufgrund der komplexen inneren Struktur sind selektives Lasersintern und Stereolithographie geeignete Alternativen15. Polyamid 12 (PA12; siehe Materialtabelle) ist aufgrund seiner überlegenen Leistung in Bezug auf Flüssigkeitsrückhaltung und Beständigkeit gegen wiederholte Hitzesterilisationszyklen ein guter Materialkandidat16. - Herstellung der Silikondichtungen und Polycarbonat-Unterlegscheiben durch Laserschneiden17 unter Verwendung der in der Zusatzdatei 2 bereitgestellten Designs.
HINWEIS: Das Laserschneiden ist leicht ausgelagert und eine billige Herstellungsmethode. Unterlegscheiben können aus Edelstahl hergestellt werden, was eine widerstandsfähigere Komponente für den wiederholten Gebrauch darstellt. Alle anderen Komponenten sind handelsübliche Artikel. Eine vollständige Liste der benötigten Materialien ist in Tabelle 1 enthalten. Die kaufmännischen Details der Artikel sind in der Materialtabelle enthalten.
2. Sterilisation, Montage und Grundierung von Geräten
- Sterilisieren Sie alle Komponenten gemäß den Anweisungen in Tabelle 1.
- Montieren Sie unter laminaren Strömungsbedingungen zwei gefertigte Einsätze (Schritt 1), wie in Abbildung 1A dargestellt.
- Montieren Sie das Perfusionssystem wie in Abbildung 2 dargestellt, indem Sie die folgenden Schritte ausführen:
- Schließen Sie zwei angeschlossene Dreiwegeventile an den R1-Anschluss (Medienwechselanschluss) des Behälters an.
- Verbinden Sie den so entstandenen Auslass mit dem Kopf der Schlauchpumpe über einen Schlauch, der mit einem Einwegventil (Einwegventilrohr) ausgestattet ist.
- Verbinden Sie den Pumpenkopf mit dem C4-Anschluss der Reaktionskammer über einen Systemschlauch, der mit einem Einwegventil ausgestattet ist.
HINWEIS: Dieser Zweig kann optional mit einem Drucksensor ausgestattet werden, der eine ständige Überwachung ermöglicht. - Verbinden Sie den Reaktionskammeranschluss C1 mit einem Weichwandschlauch und diesen mit dem Widerstandskanal (kleiner Innendurchmesser).
HINWEIS: Die Länge des Widerstandsschlauchs hat einen großen Einfluss auf den im System vorhandenen Druck. Dies sollte weiter untersucht werden, um angemessene Perfusionsbedingungen zu gewährleisten. - Verlängern Sie den Widerstandskanal mit dem Systemschlauch, wodurch ein Rückkanal entsteht und die luminale Zirkulationsschleife durch Anschließen an den Behälter bei R5 geschlossen wird (Abbildung 2C).
- Erzeugen Sie einen Überlaufkanal, indem Sie die Reaktionskammer C3 mit dem Reservoir R3 mit einem Systemschlauch verbinden.
- Bringen Sie einen Belüftungsfilter durch R2 an.
- Erzeugen Sie einen Druckdämpfer, indem Sie eine Spritze mit Luft und Medien an die Reaktionskammer C6 anschließen.
HINWEIS: Das richtige Luft-zu-Medien-Verhältnis hängt von der erforderlichen Druckdämpfung ab.
- Grundieren Sie das System mit Perfusionsmedium (Dulbeccos modifiziertes Eagle-Medium [DMEM] + 10 % [v/v] fötales Kälberserum [FBS] + 1 % [v/v] Penicillin-Streptomycin + 1 % [v/v] Amphotericin B + 30 % [v/v] Dextran; siehe Materialtabelle) durch die Medienaustauschanschlüsse und das Reservoir.
HINWEIS: Das Ansaugen des Systems reduziert das Risiko von eingeschlossenen Blasen im System und identifiziert potenzielle Leckagen. Das empfohlene Medienvolumen beträgt ca. 100-120 ml. Das verwendete Volumen hängt vom Totvolumen des Schlauchs ab, der für die Experimente verwendet wird.
3. Probenentnahme und -vorbereitung
- Sammeln Sie die linke und rechte gemeinsame Halsschlagader, um die direkte Handhabung des arteriellen Gewebes zu minimieren13.
- Legen Sie das Gewebe zum Transfer in kalte Transportmedien (DMEM+ 20% [v/v] FBS + 2% [v/v] Penicillin-Streptomycin + 1% [v/v] Amphotericin B, siehe Materialtabelle).
- Entfernen Sie in einem Laminar-Flow-Schrank das überschüssige Bindegewebe und schneiden Sie die Enden des Gewebes mit einer Skalpellklinge ab. Waschen Sie das Taschentuch zweimal in kalten Transportmedien.
- Legen Sie das Taschentuch für mindestens 30 Minuten auf einen Orbitalschüttler in Transportmedien und waschen Sie es gründlich aus.
- Verbinden Sie ein nicht verzweigtes Segment der Arterie mit zwei Luer-Konnektoren mit Widerhaken mit dem Bioreaktorsystem und fixieren Sie es mit einem Gefäßverbund (vaskuläre Silikonbänder; Tabelle 1).
HINWEIS: Die Behälterbindung sorgt für die richtige Spannung und den richtigen Rückzug, um das Gefäß zu sichern. Der ovale Schnitt beugt Gewebeschäden vor. - Fließen Sie das Medium vorsichtig durch die Arterie, um die Durchgängigkeit zu überprüfen.
- Nachdem Sie die Arterie an dem hergestellten Einsatz befestigt haben, füllen Sie den Reaktionsraum mit Perfusionsmedien (Schritt 2.4). Zum Schluss füllen Sie den luminalen Zirkulationskreislauf vorsichtig mit Medien, um die verbleibende Luft aus dem System zu entfernen.
- Verbinden Sie den Reaktionsraum mit dem zuvor montierten Perfusionssystem (Abschnitt 2) und vervollständigen Sie den Kreislauf.
HINWEIS: Es wird empfohlen, eine immunhistochemische Qualitätskontrolle des verarbeiteten Gewebes durchzuführen. Dadurch werden eventuelle Beschädigungen durch übermäßige Handhabung bei der Zubereitung identifiziert.
4. Perfusionskultur und Medienwandel
- Platzieren Sie das Perfusionssystem in einem 37 °C warmen Inkubator mit 5 % CO2 und schließen Sie es dann an eine Schlauchpumpe an (siehe Materialtabelle)
- Schließen Sie zusätzliche (fakultative) Erfassungssysteme, wie z. B. Drucksensoren, an (siehe Materialtabelle).
- Lassen Sie das System über Nacht mit einer niedrigen Mediendurchflussrate von ~10-15 ml/min ausgleichen.
HINWEIS: Erste Versuche zur Bestimmung der Pumpeneinstellungen, des Mediendurchflusses, des Systemdrucks und der optimalen Einstellungen der Druckdämpfer/-klemmen sind erforderlich, um sicherzustellen, dass die entsprechenden Bedingungen erfüllt sind. - Erhöhen Sie am nächsten Tag den Durchfluss schrittweise (+1 U/min pro Stunde, entspricht einer Erhöhung von ~2,5 ml/min pro Stunde im aktuellen System), bis die endgültige Durchflussrate (35 ml/min) erreicht ist. Überwachen Sie das System regelmäßig auf Leckagen.
HINWEIS: Um die genaue Durchflussrate basierend auf der Drehzahl der peristaltischen Pumpe zu berechnen, muss der Benutzer zunächst eine angemessene Pumpenkalibrierungdurchführen 18. Mit der Formel (1) kann der Volumenstrom (Q) auf der Grundlage des innerhalb einer bestimmten Zeit (t) abgegebenen Volumens (V) berechnet werden. Zur Berechnung der geschätzten Strömungsgeschwindigkeit () können wir die zuvor berechnete Durchflussmenge (Q) und die Fläche des Behälterquerschnitts (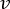 A) verwenden, die in Gleichung (2) beschrieben sind.
A) verwenden, die in Gleichung (2) beschrieben sind.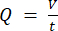 (1)
(1)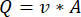 (2)
(2) - Tauschen Sie alle 3 Tage 50 % des Mediums (~50 ml) aus, indem Sie eine mit frischem Medium gefüllte Spritze an den Medienwechselanschluss näher an der Pumpe und eine leere Spritze an den Anschluss näher am Reservoir anschließen, um das verbrauchte Medium aufzufangen (Abbildung 2).
HINWEIS: Die Verwendung von zwei Dreiwegeventilen als Medienaustauschöffnungen erleichtert den kontinuierlichen Betrieb der Perfusion während des Medienwechsels. - Am Ende des Experiments wird das Gewebe aus der Reaktionskammer entnommen, indem die mit dem Bioreaktor verbundenen Enden mit einer sterilen chirurgischen Schere abgeschnitten werden.
- Zerlegen, reinigen und sterilisieren Sie das System für die weitere Verwendung.
5. Analyse der Proben
- Die entnommene Probe wird über Nacht bei 4 °C in 4%igem Paraformaldehyd (PFA) fixiert.
- Das Gewebe wird bei optimaler Schnitttemperatur (OCT; siehe Materialtabelle)19 eingebettet und durch Eintauchen in Iso-Pentan, das in flüssigem Stickstoff gekühlt wird, eingefroren.
- Kryoschnitte mit einer Dicke von 3-5 mm werden mit einem Kryostaten hergestellt.
- Durchführung von Immunhistochemie (Hämatoxylin und Eosin [H&E]) und/oder Immunfluoreszenz. Befolgen Sie das typische Immunfluoreszenzprotokoll:
- Die Scheiben für 1 h bei Raumtemperatur mit 20%igem [v/v] Ziegenserum in phosphatgepufferter Kochsalzlösung (PBS; siehe Materialtabelle) blockieren.
- Die Scheiben werden über Nacht bei 4 °C mit einem primären Kaninchen-Antikörper gegen CD31, der 1:50 in PBS verdünnt ist, inkubiert (siehe Materialtabelle).
- Dreimal 5 Minuten lang mit PBS waschen.
- 1 Stunde lang bei 37 °C mit fluoreszenzmarkiertem Ziegen-Anti-Kaninchen-Sekundärantikörper, der 1:200 in PBS verdünnt ist, und direkt konjugiertem Fluoreszenz-Antikörper aus α-glatter Muskulaturaktin (SMA), der 1:200 in PBS verdünnt ist (siehe Materialtabelle).
- Dreimal 5 Minuten lang mit PBS waschen.
- Färben Sie die Kerne mit DAPI verdünnt 1:1.000 in PBS für 10 min bei Raumtemperatur.
- Inkubieren Sie mit 0,1 % (w/v) Sudan Black (siehe Materialtabelle) in 70 % (v/v) Ethanol für 10 Minuten bei Raumtemperatur, um die Autofluoreszenz des Gewebes zu reduzieren.
- Waschen Sie das Gewebe mit reichlich deionisiertem Wasser. Montieren Sie die Objektträger im Eindeckmedium.
- Bilden Sie die Proben mit einem konfokalen Laser-Scanning-Mikroskop ab.
Ergebnisse
In dieser Studie wurde ein vielseitiges und erschwingliches Perfusionssystem (EasyFlow)13 entwickelt. Das 3D-gedruckte Design des Systems erleichtert die Einführung des Systems durch andere Labore und fördert somit die Reproduzierbarkeit.
Der hergestellte Perfusionseinsatz ist in einem 50-ml-Zentrifugenröhrchen untergebracht, wodurch eine isolierte Umgebung entsteht. Mit Hilfe von zwei Perfusionseinsätzen kann eine Perfusionsschleife aufgebaut werden, die ein Reservoir und eine Reaktionskammer enthält, in der die biologische Probe inkubiert wird. Das Perfusionssystem wird dann mit einer Peristaltikpumpe und optionalen Erfassungssystemen wie Drucksensoren und Ultraschallgeräten verbunden, um die Kulturbedingungen zu überwachen (Abbildung 2).
Proben der Halsschlagader des Schweins wurden gesammelt und verarbeitet, bevor sie 7 Tage lang in Perfusion kultiviert wurden. Um die Qualität des Gewebes vor der Kultur sicherzustellen, wurden Vorversuche durchgeführt, bei denen die Proben zum Zeitpunkt der Exzision, nach der Gewebepräparation und nach der Perfusion fixiert wurden. Die Fluoreszenzfärbung für Endothelmarker (CD31) und Marker für glatte Muskulatur (αSMA) wurde verwendet, um die Aufrechterhaltung der Gewebeintegrität zu beurteilen. Beispiele für gut erhaltenes und geschädigtes Gewebe sind in Abbildung 3 zum Vergleich dargestellt. Die Bilder zeigen, wie wichtig ein schonender Umgang mit dem Gewebe zum Zeitpunkt der Exzision ist, da eine falsche Verarbeitung (übermäßige Dehnung, Quetschung usw.) zum Verlust des Endothels vor der Kultur führen kann. Die Ergebnisse zeigen auch, wie wichtig die allmähliche Etablierung der Perfusion ist, um luminale Schäden zu vermeiden.
Die H&E-Färbung wurde zusammen mit der Immunfluoreszenzfärbung (IF) durchgeführt, um die Aufrechterhaltung der Morphologie und der Gesamtverteilung der Zellen in der Gefäßwand nach 7 Tagen Kultur zu zeigen (Abbildung 4). Die Anwendung physiologischer Kulturbedingungen im Gerät gewährleistet die Aufrechterhaltung der endothelialen Abdeckung des Lumens, die Ausrichtung der glatten Muskelzellen in den Medien und die Erhaltung der Vasa vasorum in den Adventitia.
Die kompakte und modulare Bauweise des Bioreaktorsystems ermöglicht zudem eine Vielzahl von Systemaufbauten. Der kleinere Aufbau besteht aus einem einzigen Bioreaktor und ist ideal für pharmakologische und kleinvolumige Studien (rezirkulierende Perfusion20, Gesamtvolumen von 50-70 ml). Um die Dauer der Kultur zu verlängern und die Anzahl der Medienwechsel zu reduzieren, ist ein Zirkulationssystem mit einem einzigen Reservoir, wie es in diesem Protokoll beschrieben wird, oder ein konstantes Fütterungssystem idealer, da sie ein größeres Volumen an Medium im Umlauf haben. Ein Doppelzirkulationsaufbau21 kann eingerichtet werden, um experimentelle Umgebungen zu untersuchen, in denen die Lokalisierung der Stimuli entscheidend ist. Das aktuelle Gerät kann auch mit ausgefeilteren Steuerungssystemen kombiniert werden, um eine präzise Rückkopplungssteuerung von Parametern wie pH-Wert und gelöstem Sauerstoff zu ermöglichen (Abbildung 5).
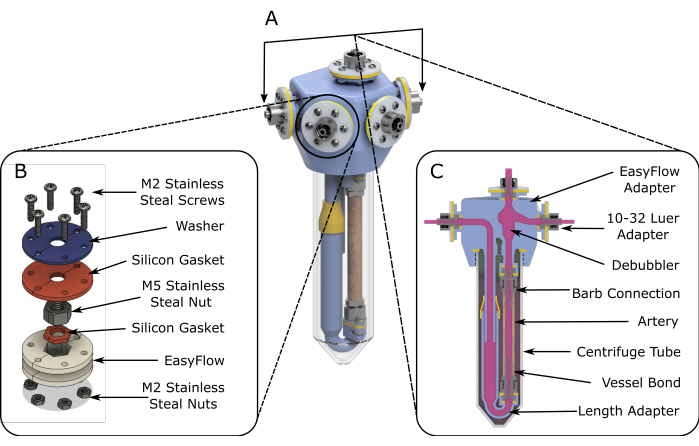
Abbildung 1: Schaltpläne der EasyFlow-Baugruppe. (A) 3D-gerenderte Schemata, die die Montage des Perfusionseinsatzes unterstützen. (B) Detaillierte Schaltpläne werden bereitgestellt, um die Montage der Anschlussstellen zu erleichtern. (C) Eine Querschnittsansicht des Reaktionsraums hebt die wesentlichen Bestandteile des EasyFlow-Inserts und die Verbindung des Gewebes mit dem Insert hervor. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
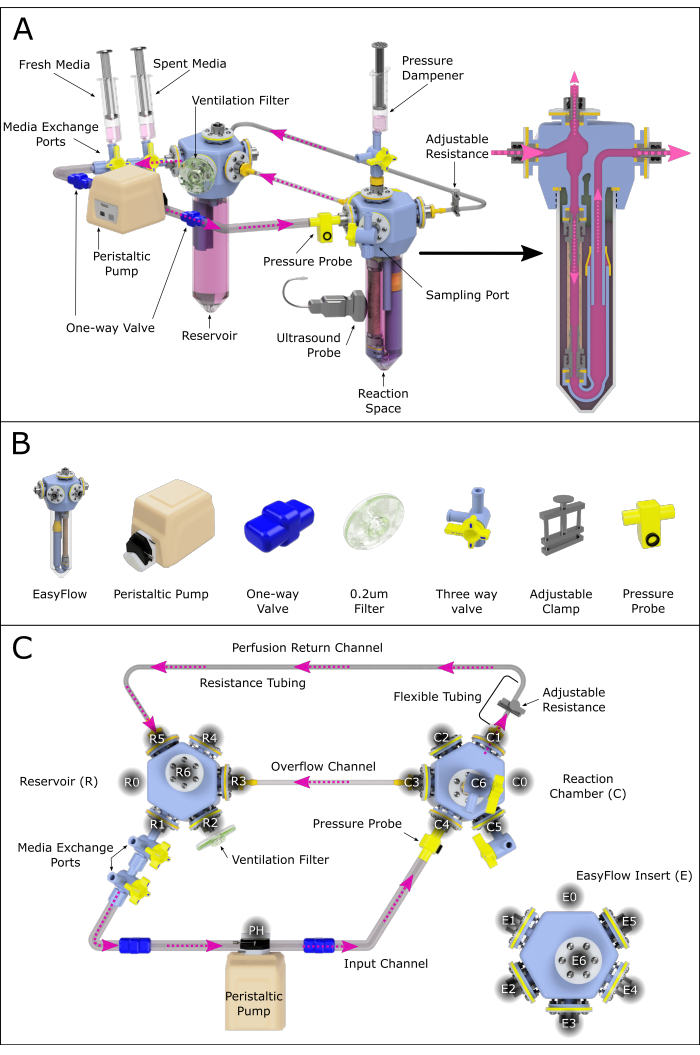
Abbildung 2: Schematische Darstellung des Perfusionssystems. (A) Montiertes Perfusionssystem, das alle wichtigen Komponenten enthält und ihre relative Position in einer 3D-gerenderten Umgebung hervorhebt. Nicht alle Komponenten sind maßstabsgetreu. (B) Einzelne isometrische Ansichten von Bauteilen werden ebenfalls dargestellt. (C) Es wird eine Draufsicht auf das zusammengebaute Perfusionssystem gezeigt, um die Montage und Verbindung der verschiedenen Komponenten zu erleichtern. Die Anschlüsse wurden gegen den Uhrzeigersinn beschriftet und nummeriert, um die verschiedenen Verbindungsstellen im Perfusionssystem zu navigieren. Dieses Prinzip wurde auf das Reservoir (R) und die Reaktionskammer (C) angewendet. Die verschiedenen Kanäle, die die beiden Kammern verbinden, wurden ebenfalls mit Namen versehen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
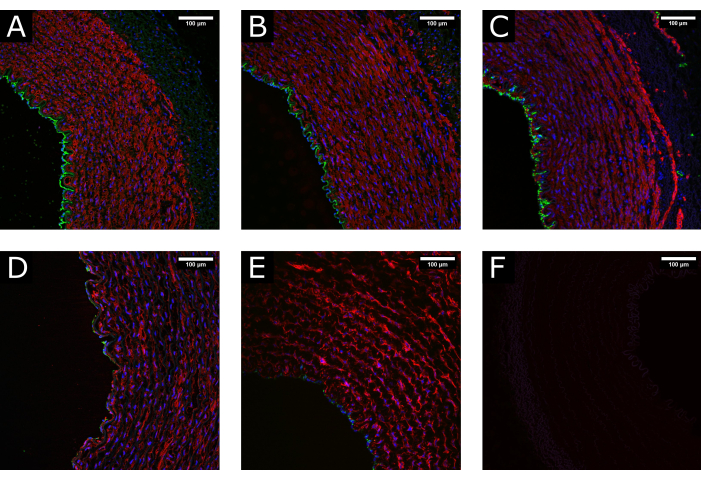
Abbildung 3: Gewebeerhaltung während der Verarbeitung. (A) Konfokale Bilder zeigen die normale Struktur einer Arterie zum Zeitpunkt der Entnahme, (B) nach der Reinigung und Verarbeitung und (C) nach der Perfusionskultur, was die Aufrechterhaltung einer gut erhaltenen Morphologie zeigt. (D) Beispiele für geschädigtes Gewebe aufgrund übermäßiger oder falscher Handhabung während der Verarbeitung oder (E) aufgrund der Anwendung nicht-physiologischer Kulturbedingungen (d. h. abrupte Initiierung eines hohen Flusses) zeigen eine Erschöpfung der luminalen Bedeckung und eine Störung des Mediums. (F) Die Negativkontrolle gibt die Spezifität der Färbung an. CD31: grün; αSMA: rot; DAPI: blau. Maßstabsleisten: 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
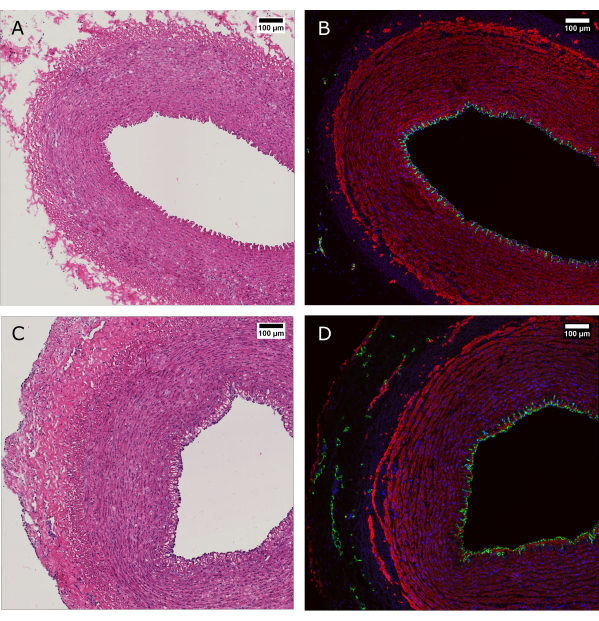
Abbildung 4: Histologische Beurteilung des Gewebes vor und nach der Perfusionskultur. (A und B) Das arterielle Gewebe wurde zum Zeitpunkt der Entnahme histologisch und (C und D) nach 7 Tagen Kultur mit dem Bioreaktorsystem untersucht. (A und C) Die H&E-Färbung zeigt die Erhaltung der Struktur und Organisation der Arterienwand. (B und D) Die Immunfluoreszenzfärbung desselben Gewebes zeigt eine endotheliale Bedeckung, die Ausrichtung glatter Muskelzellen und die Vasa vasorum in den Adventitien. CD31: grün; SMA: rot; DAPI: blau. Maßstabsleisten: 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
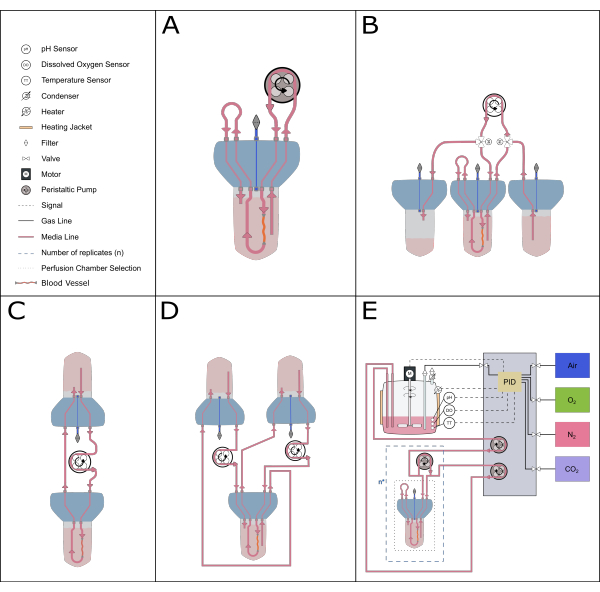
Abbildung 5: Schematische Darstellung möglicher Perfusionsaufbauten. Mit dem Perfusionseinsatz können verschiedene alternative Aufbauten untergebracht werden, um unterschiedliche experimentelle Untersuchungen zu ermöglichen. (A) Der rezirkulierende Perfusionsaufbau minimiert das erforderliche Mediumvolumen. (B) Die konstante Fütterung sorgt für eine stetige Versorgung des Gewebes mit Medium. (C) Die Zirkulation mit einem einzigen Reservoir (wie in diesem Artikel beschrieben) bietet ein größeres Medienvolumen für Langzeitinkubationen und umfasst eine Pufferzone für den Luftaustausch und den Druckausgleich. (D) Der Aufbau mit doppelter Zirkulation bietet zwei unterschiedliche Schleifen, die die innere (innerhalb der Arterie) und die äußere (Reaktionsraum) Zirkulation unabhängig voneinander speisen. (E) Der dynamische Perfusionsaufbau umfasst kontinuierliche Gase und pH-Kontrolle durch einen PID-Regler (Proportional-Integral-Derivative). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Komponenten für die Herstellung der Einsätze. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzungsdatei 1: 3D-Modell des EasyFlow-Einsatzes für die 3D-Druckfertigung. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 2: Konstruktionsschemata des konstruierten Geräts, Schnittansicht, Ausdruck und Dichtungskomponenten. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Ex-vivo-Gefäßperfusionssysteme stellen eine einzigartige Plattform dar, um die Funktion und das Verhalten von Gefäßzellen in ihren natürlichen Geweben unter kontrollierten Bedingungen zu untersuchen, was die Analyse komplexer Prozesse wie des Gefäßumbaus nach Verletzungen ermöglicht22. Bei den meisten Bioreaktoren handelt es sich jedoch um intern hergestellte Systeme, die auf maßgeschneiderten Komponenten basieren und oft nur schwer von anderen repliziert werdenkönnen 23. Es gibt alternative kommerzielle Lösungen, aber es fehlt ihnen an Flexibilität in der Gestaltung und sie können relativ kostspielig sein24.
Wir haben ein alternatives System entwickelt, das eine einfache, kostengünstige und reproduzierbare Plattform bietet, die mit Open-Source-3D-Drucktechniken hergestellt werden kann13. Der vorliegende Artikel beschreibt den Aufbau des Systems, um reproduzierbare Anwendungen durch Endbenutzer zu ermöglichen. Dieser Aufbau ermöglicht die Anwendung physiologischer und pathologischer Bedingungen wie Druck (40-180 mmHg), Flussrate (6-30 ml/min) und in Kombination mit Medien, die die Blutviskosität nachahmen, mit unterschiedlichen Scherspannungen.
Die Reproduzierbarkeit ist ein wesentlicher Aspekt des wissenschaftlichen Prozesses, da sie es den Forschern ermöglicht, die Ergebnisse anderer zu validieren und darauf aufzubauen, um unser Verständnis von Gefäßerkrankungen zu verbessern. Darüber hinaus sind Werkzeuge, die die Zusammenarbeit zwischen Gruppen ermöglichen und fördern, für den Fortschritt wissenschaftlicher Erkenntnisse unerlässlich. EasyFlow ist ein Beispiel für solche zugänglichen Open-Source-Lösungen, die von Laboren, die an einer Vielzahl von Projekten im Bereich der Gefäßwissenschaften und darüber hinaus arbeiten, leicht erstellt und übernommen werden können.
Wir berichten, dass diese Gerätekultur die Lebensfähigkeit des arteriellen Gewebes für mindestens 7 Tage aufrechterhält und verwendet werden kann, um bestimmte Schritte von Gefäßerkrankungen zu modellieren. Damit ließen sich physiologische Flussraten und Druckverhältnisse modellieren13. Wichtig ist, dass diese Perfusionskultur aufgrund der niedrigen Produktionskosten und der geringen Menge an Medium, die für den Betrieb des Systems erforderlich ist, kostengünstig ist.
Das 3D-Design kann auch an neue Anwendungen angepasst und neue Materialien für den Druck getestet werden. Auch im aktuellen Format kann der Probenraum leicht an Proben unterschiedlicher Größe angepasst werden, indem die Länge der Anschlüsse oder die Bohrung der Luer-Konnektoren geändert wird. Es ist wichtig zu beachten, dass dieser Bioreaktor aufgrund des modularen Charakters des Geräts und seiner geringen Abmessungen in mehreren Aufbauten verwendet werden kann (Abbildung 5) und auf Multiplexkulturen angewendet werden kann, bei denen mehrere Proben gleichzeitig in separaten Bioreaktoren unterschiedlichen Bedingungen ausgesetzt werden können.
Es ist vorgesehen, die Verwendung des Systems in Zukunft auszuweiten, um die Kultur von Blutgefäßen unterschiedlichen Ursprungs (z. B. verschiedene Spezies) und unterschiedlicher Art (z. B. Venen, Lymphgefäße) zu unterstützen und möglicherweise auf die Kultur anderer Hohlgewebe (z. B. Luftröhre, Darm) anzuwenden. Insbesondere zeigt die Forschung, dass die Kultivierung von Tissue-Engineering-Scaffolds in konstanter Perfusion die homogene Verteilung von Zellen innerhalb des Konstrukts und die Reifung des resultierenden Gewebes unterstützt25,26. Darüber hinaus trägt die Aussaat von Gefäßtransplantaten in Perfusion dazu bei, im Vergleich zu statischen Methoden ein gleichmäßigeres zellularisiertes Gefäßlumen zu erreichen27. Aus diesem Grund stellen wir uns vor, dass das System auf das Tissue Engineering angewendet wird, um die aktuellen Herausforderungen zu bewältigen und die zukünftige Entwicklung reproduzierbarer synthetischer Blutgefäßersatzstoffe zu ermöglichen28.
Das hier beschriebene Protokoll stellt einige wichtige Schritte vor, die für den Erfolg der Flow-Kultur entscheidend sind. Die Festlegung und Überwachung geeigneter Strömungsbedingungen ist nicht trivial und muss bei der erstmaligen Einrichtung jedes Systems durchgeführt werden, um sicherzustellen, dass die Kulturbedingungen physiologisch sind. Der Durchfluss und der Druck wurden mit Hilfe von Drucksensoren und Ultraschall überwacht. Ein weiterer kritischer Punkt ist die Sicherstellung, dass das Gewebe zu Beginn der Kultur lebensfähig und intakt ist. Dies erfordert eine frische Quelle, einen sorgfältigen Umgang und kann durch eine histologische Analyse nachgewiesen werden. Darüber hinaus muss zu Beginn jedes Experiments eine Fehlersuche durchgeführt werden, um potenzielle bakterielle Kontaminationen oder Medienleckquellen zu identifizieren.
Es ist wichtig hervorzuheben, dass das beschriebene Perfusionssystem zwar physiologische Druck- und Strömungsbedingungen liefert, aber nicht in der Lage ist, die komplexen Druckwellenmuster, die in vivo aufgezeichnet werden, vollständig nachzuahmen. Diese Einschränkung ist auf die Verwendung einer Peristaltikpumpe zurückzuführen und kann mit spezialisierteren Geräten zur Reproduktion fortgeschrittener hämodynamischer Bedingungen behoben werden. Die Kultur von Blutgefäßen in einem Bioreaktor ist auch nicht in der Lage, Studien zu behandeln, bei denen das Immunsystem oder die Interaktion mit anderen Organen entscheidend ist.
Abschließend wird ein einfaches 3D-gedrucktes Perfusionssystem vorgestellt, das die physiologische hämodynamische Umgebung nachahmen kann, von dem erwartet wird, dass es zur Standardisierung von ex vivo Blutgefäßkulturen beiträgt. Sein Potenzial für die Anpassung und Anwendung auf Langzeitkulturen macht es zu einem unverzichtbaren Werkzeug, um das Verständnis dieser komplexen biologischen Systeme in physiologischer und pathologischer Hinsicht zu verbessern.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Die Autoren danken dem Veterinary Pathology Centre der University of Surrey School of Veterinary Medicine für die histologischen Dienstleistungen. Wir danken auch Dr. L. Dixon, Dr. A. Reis und Dr. M. Henstock vom Pirbright Institute (Pirbright, UK) für ihre Unterstützung bei der Beschaffung der tierischen Gewebe und dem Department of Biochemical Sciences der University of Surrey, insbesondere dem technischen Team, für ihre anhaltende Unterstützung. RSM wurde durch den Doctoral College Studentship Award (University of Surrey) unterstützt, DM und PC wurden vom National Centre for the Replacement, Refinement & Reduction of Animals in Research unterstützt (Fördernummern: NC/R001006/1 und NC/T001216/1).
Materialien
| Name | Company | Catalog Number | Comments |
| EasyFlow | - | - | 3D printed by MultiJet Fusion by Protolabs |
| PA12 - 3D printing | Protolabs | - | - |
| Peristaltic pump | Heidolph | PD5201 | |
| Culture media components: | |||
| Amphotericin B solution, 250 mug/mL in deionized water | Sigma-Aldrich | A2942-20ML | |
| Dextran from Leuconostoc spp. | Sigma-Aldrich | D8802-25ML | |
| Dulbecco's Modified Eagle's Medium - high glucose, w/ 4500 mg/L glucose, L-glutamine, sodium pyruvate, and sodium bicarbonate | Sigma-Aldrich | D6429-6X500ML | |
| Fetal Bovine Serum | Sigma-Aldrich | F9665 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333-100ML | |
| Immunostaining materials: | |||
| Cryostat | LEICA | CM3050 S | |
| DAPI | Sigma-Aldrich | D9542-10MG | |
| Goat serum | Sigma-Aldrich | G9023-10ML | |
| Goat α-Rabbit Alexa Fluor 488 | Thermo Fisher Scientific | A11008 | |
| Invitrogen eBioscience Fluoromount G | Thermo Fisher Scientific | 50-187-88 | |
| MX35 Premier + Microtome Blade | Thermo Scientific | 3052835 | |
| Optimal Cooling Tempearure Compound - OCT | Agar Scientific | AGR1180 | |
| Rabbit α-CD31 antibody | Abcam | ab28364 | |
| Sudan Black B | Santa Cruz Biotechnology | SC-203760 | |
| X72 SuperFrost Plus Adhesion slide, 25x75x1mm, White, 90° Ground Edges, Frosted Area 20mm, 72/box | Fisher Scientific | J1800AMNZ | |
| α-Smooth Muscle Actin (SMA) Alexa Fluor® 647-conjugated antibody | R&D Systems | IC1420R | |
| Material for laser cutting of components: | |||
| Clear Plastic Sheet, 1250 mm x 610 mm x 1 mm (for laser cutting of washers) | RS Components | 258-6590 | |
| RS PRO Translucent Rubber Sponge Sheet, 600 mm x 600 mm x 1.5 mm (for laser cutting of silicone seals) | RS Components | 840-5541 | |
| Optional pressure monitors: | |||
| Pressure sensor | Parker Hannifin | 080-699PSX-3P-5 | |
| SciPres Pressure Monitor | Parker Hannifin | 206-200-M | |
| Pre-sterilized single use plasticware: | |||
| 0.2 um filter | Sarstedt | 70.1114.210 | |
| 20 mL Sterile syringe | IMS Euro | 40004 | |
| 50 mL Centrifuge Tube | Thermo Fisher Scientific | Sarstedt - 62.547.254 | |
| Small components: | |||
| Cable ties | - | - | |
| Masterflex Adapter Fittings, Female Luer to Hose Barb | Cole-Parmer | WZ-30800-10 | Barb Adaptor |
| Masterflex Polycarbonate Luer Fittings | Cole-Parmer | AU-45504-84 | |
| Nylon Miniature Check Valve | Cole-Parmer | 98553-00 | |
| RS PRO Translucent Rubber Sponge Sheet, 600 mm x 600 mm x 1.5 mm (for laser cutting of silicone seals) | RS Components | 840-5541 | |
| Stainless Steel M2 Hex Nuts | RS Components | 527-218 | |
| Stainless Steel M2 x 6 mm Screws | RS Components | 418-7426 | |
| Stainless Steel M5 Hex Nuts | RS Components | 189-585 | |
| Surgical vessel loop | Vascular Silicone Ties,International Medical Supplies | 10-1003 | |
| Three-way valves | IMS Euro | 91000 | |
| Surgical Equipment | |||
| Anatomical Forceps, GRAEFE, Curved, 10 cm SKU: BD-07 | International Medical Supplies | SKU: BD-07 | |
| Micro Forceps, Angled, 0.3 mm, 11 cm | International Medical Supplies | SKU: BD-361 | |
| Micro Scissors Noyes, Curved, 12 cm | International Medical Supplies | SKU: FD-12 | |
| Troge Surgical Scalpels - Size 23 - Box of 100 | International Medical Supplies | 63114 | |
| Tubing: | |||
| Eppendorf silicone tubing (I.D.1.6 mm, O.D.4.7 mm) | Eppendorf | M0740-2396 | System tubing |
| Masterflex PharMed BPT 3-Stop Tubing | ISMATEC | 95714-48 | Soft wall tubing (for clamp) |
| RS PRO Transparent Hose Pipe, 0.8 mm ID, Silicone | RS Components | 667-8432 | Resistance tubing (small inner diameter) |
| Tygon for food (I.D. 4.8 mm, W.T. 1.6 mm) | Heidolph | 525-30027-00-0 | One way valve tube |
| Verderflex Yellow Hose Pipe, 6.4 mm ID, Verderprene | RS Components | 125-4042 | Pump Tubing |
Referenzen
- Davies, P. F., Civelek, M., Fang, Y., Fleming, I. The atherosusceptible endothelium: Endothelial phenotypes in complex haemodynamic shear stress regions in vivo. Cardiovascular Research. 99 (2), 315-327 (2013).
- Gugliandolo, E., et al. Palmitoylethanolamide and Polydatin combination reduces inflammation and oxidative stress in vascular injury. Pharmacological Research. 123, 83-92 (2017).
- Anselmino, M., et al. Catheter ablation of atrial fibrillation in patients with left ventricular systolic dysfunction: A systematic review and meta-analysis. Circulation, Arrhythmia, and Electrophysiology. 7 (6), 1011-1018 (2014).
- Viola, M., et al. Subcutaneous delivery of monoclonal antibodies: How do we get there. Journal of Controlled Release. 286, 301-314 (2018).
- Kim, D. D. In vitro cellular models for nasal drug absorption studies. Drug Absorption Studies: In Situ, In Vitro and In Silico Models. , 216-234 (2008).
- Lewis, D. I. Animal experimentation: Implementation and application of the 3Rs. Emerging Topics in Life Sciences. 3 (6), 675-679 (2019).
- Rouwkema, J., et al. In vitro platforms for tissue engineering: Implications for basic research and clinical translation. Journal of Tissue Engineering and Regenerative Medicine. 5 (8), e164-167 (2011).
- Xu, Y., Shrestha, N., Préat, V., Beloqui, A. An overview of in vitro, ex vivo and in vivo models for studying the transport of drugs across intestinal barriers. Advanced Drug Delivery Reviews. 175, 113795 (2021).
- Vaghela, R., et al. Vessel grafts for tissue engineering revisited-Vessel segments show location-specific vascularization patterns in ex vivo ring assay. Microcirculation. 29 (2), e12742 (2022).
- Håkansson, J., et al. Individualized tissue-engineered veins as vascular grafts: A proof of concept study in pig. Journal of Tissue Engineering and Regenerative Medicine. 15 (10), 818-830 (2021).
- Saucy, F., et al. Ex vivo pulsatile perfusion of human saphenous veins induces intimal hyperplasia and increased levels of the plasminogen activator inhibitor 1. European Surgical Research. 45 (1), 50-59 (2010).
- Tosun, Z., McFetridge, P. S. Variation in cardiac pulse frequencies modulates vSMC phenotype switching during vascular remodeling. Cardiovascular Engineering and Technology. 6 (1), 59-70 (2015).
- Matos, R. S., Maselli, D., McVey, J. H., Heiss, C., Campagnolo, P. 3D printed bioreactor enabling the pulsatile culture of native and angioplastied large arteries. Frontiers in Cardiovascular Medicine. 9, 864580 (2022).
- Neff, L. P., et al. Vascular smooth muscle enhances functionality of tissue-engineered blood vessels in vivo. Journal of Vascular Surgery. 53 (2), 426-434 (2011).
- Boparai, K. S., Singh, R. Advances in Fused Deposition Modeling. In: Module. Refrence in Materials Science and Materials Engineering. , (2017).
- McKeen, L. W., McKeen, L. W. Chapter 6 - Polyamides (Nylons). The Effect of Creep and Other Time Related Factors on Plastics and Elastomers (Second Edition). , 197-262 (2012).
- Moradi, M., Mehrabi, O., Azdast, T., Benyounis, K. Y. Enhancement of low power CO2 laser cutting process for injection molded polycarbonate). Optics & Laser Technology. 96, 208-218 (2017).
- Ghasem, N. . Computer Methods in Chemical Engineering. , (2021).
- Lying, F., Gazi, F., Gardner, E. Preparation of tissues and cells for infrared and raman spectroscopy and imaging. Biomedical Applications of Synchrotron Infrared Microspectroscopy.RSC Analytical Spectroscopy Monographs. (11), 147-185 (2011).
- Sassi, L., et al. A perfusion bioreactor for longitudinal monitoring of bioengineered liver constructs. Nanomaterials. 11 (2), 275 (2021).
- Haykal, S., et al. Double-chamber rotating bioreactor for dynamic perfusion cell seeding of large-segment tracheal allografts: Comparison to conventional static methods. Tissue Engineering. Part C, Methods. 20 (8), 681-692 (2014).
- Kural, M. H., Dai, G., Niklason, L. E., Gui, L. An ex vivo vessel injury model to study remodeling. Cell Transplant. 27 (9), 1375-1389 (2018).
- Wong, M. M., Hong, X., Karamariti, E., Hu, Y., Xu, Q. Generation and grafting of tissue-engineered vessels in a mouse model. Journal of Visualized Experiments. (97), 52565 (2015).
- Alvino, V. V., et al. In vitro and in vivo preclinical testing of pericyte-engineered grafts for the correction of congenital heart defects. Journal of the American Heart Association. 9 (4), e014214 (2020).
- Nerurkar, N. L., Sen, S., Baker, B. M., Elliott, D. M., Mauck, R. L. Dynamic culture enhances stem cell infiltration and modulates extracellular matrix production on aligned electrospun nanofibrous scaffolds. Acta Biomaterialia. 7 (2), 485-491 (2011).
- Engebretson, B., Mussett, Z. R., Sikavitsas, V. I. The effects of varying frequency and duration of mechanical stimulation on a tissue-engineered tendon construct. Connective Tissue Research. 59 (2), 167-177 (2018).
- Saunders, S. K., et al. Evaluation of perfusion-driven cell seeding of small diameter engineered tissue vascular grafts with a custom-designed seed-and-culture bioreactor. PLoS One. 17 (6), e0269499 (2022).
- Stephenson, M., Grayson, W. Recent advances in bioreactors for cell-based therapies. F1000Research. 7, (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten