Method Article
Ex Vivo(エクス・ビボ )3Dプリントされたバイオリアクターでの大血管の灌流培養
* これらの著者は同等に貢献しました
要約
このプロトコルは、灌流中の血管の ex vivo 培養のために、新たに開発された3Dプリントされたバイオリアクターのセットアップと操作を示しています。このシステムは、他のユーザーが簡単に採用できるように設計されており、実用的で手頃な価格で、基礎生物学や薬理学的研究などのさまざまな実験アプリケーションに適応できます。
要約
血管疾患は、ほとんどの心血管疾患(CVD)の基礎を形成しており、世界中の死亡率と罹患率の主な原因であり続けています。血管疾患を予防および治療するための効果的な外科的および薬理学的介入が緊急に必要とされています。トランスレーショナルモデルの不足は、血管疾患に関与する細胞および分子プロセスの理解を制限している部分もあります。 Ex vivo 灌流培養バイオリアクターは、 in vitro 培養の容易さと生体組織の複雑さを兼ね備えた、制御された動的環境での大型動物血管(ヒトを含む)の研究に理想的なプラットフォームを提供します。しかし、ほとんどのバイオリアクターはカスタムメイドであるため、採用が難しく、結果の再現性が制限されます。この論文では、あらゆる生物学研究室で簡単に製造および適用できる3Dプリントシステムを紹介し、そのセットアップのための詳細なプロトコルを提供し、ユーザーの操作を可能にします。この革新的で再現性の高いex vivo 灌流培養システムは、生理学的条件で最大7日間の血管培養を可能にします。標準化された灌流バイオリアクターの採用により、大動物の血管における生理学的および病理学的プロセスの理解が深まり、新しい治療法の発見が加速することが期待されます。
概要
血管壁は反応性定常状態で存在し、外部刺激(すなわち、圧力の変化、血管収縮剤)に対する応答性と、血液凝固と炎症性細胞浸潤を防ぐ一貫した非活性化表面の両方を保証します1。血管壁は、加齢や生活習慣に依存する刺激や直接的な損傷に反応して、虚血性脳卒中や心筋梗塞などの一般的な心血管疾患(CVD)の一因として知られている再狭窄やアテローム性動脈硬化症などのリモデリングプロセスを活性化します2。血管疾患の進行した症状に対処するために、経皮的血行再建術やステント留置術などの介入的アプローチが利用可能ですが、これらはさらなる血管損傷を引き起こし、しばしば再発につながることが知られています。さらに、限られた予防的および初期段階のソリューションしか利用できません。血管壁の恒常性を維持し、その機能不全を促進するメカニズムを理解することは、新しい治療法の開発の中核です3。
分子生物学と組織工学の絶え間ない発展と進歩にもかかわらず、動物実験は依然として血管生物学研究の重要な要素です。in vivo動物実験は、血管の恒常性と病理学のメカニズムに関する膨大な洞察を提供してきました。しかし、これらの手順はコストがかかり、スループットが比較的低く、重大な倫理的問題を引き起こします。さらに、小動物はヒトの血管生理学をあまり代表しておらず、大規模な動物実験ははるかに費用がかかり、さらなる倫理的配慮が生じます4,5。急速に高齢化が進む人口に対する医薬品および医療ソリューションの需要が高まる中、動物使用のマイナス面が拡大し、結果の再現性、信頼性、および患者ケアへの転用可能性に影響を与えています6。
In vitro システムは、基本的なメカニズムを研究するための簡略化されたプラットフォームを提供しますが、組織全体の複雑さ、細胞と細胞外マトリックスの間の相互作用、および血管疾患の発症における重要な決定要因である機械的力を再現することはできません7。
人工的に制御された環境で維持された組織全体に対して実施されるEx vivo研究は、in vivoの複雑さを模倣しながら、比較的ハイスループットな研究を可能にします8。培養条件と環境を綿密に制御する能力を考えると、ex vivoモデルは幅広い複雑な研究を可能にし、血管生物学における動物実験の使用を減らすための適切な代替手段を提供します。静的血管リング培養は興味深い洞察をもたらしたが、重要な血行動態要素を組み込むことができなかった9。実際、ex vivoの血管系の研究は、血管壁内の細胞に適用される多くの動的力に関連する特定の課題を提起します。管腔流、乱流、せん断応力、圧力、壁の変形などの刺激は、組織の病態生理に大きな影響を与えます10,11,12。
灌流バイオリアクターは、血管の恒常性を研究し、損傷や血行動態の変化に応答してリモデリングするために不可欠です13。さらに、灌流培養は、組織工学的血管(TEBV)の成熟および耐久性を改善するために使用でき、血管移植片14の適切な代替手段を提供する。
市販の灌流バイオリアクターは、柔軟性と適応性に限界があり、コストがかかります。既存の自社開発バイオリアクターの多くは、説明が限られており、特別に作られたコンポーネントが入手できないため、他のラボで再現することは困難です7、8、9、10、11、12。これらの制限を克服するために、私たちは最近、経済的に製造でき、さまざまな組織に対応し、さまざまな研究要求に適応するための比較的簡単な変更を可能にする新しいバイオリアクター(EasyFlow)を開発しました13。インサートは3Dプリントされており、標準的な50 mL遠心チューブの蓋のようにフィットします。そのモジュール設計と3Dプリンティング製造により、さまざまなラボでアクセス可能で再現性があり、さまざまな科学的ニーズに適応するために簡単に変更できます。このプロトコルは、動脈灌流設定におけるバイオリアクターシステムの組み立てと基本的な操作について説明します。
プロトコル
このプロトコルでは、2つのEasyFlow(バイオリアクター)インサートで構成されるシステムの組み立てと使用について説明します:1つは灌流動脈サンプルを含む反応チャンバー(C)を表し、1つは媒体リザーバー(R)として機能します(図1 および 図2A)。頸動脈は、英国のピルブライト研究所で生後4〜6週齢の雄と雌の子豚(6〜12 kg)から採取されました。動物の処置は、1986年内務省動物(科学的手順)法(ASPA)に基づいて実施され、ピルブライト研究所の動物福祉倫理審査委員会(AWERB)によって承認されました。動物は、飼育された動物の飼育とケアに関する行動規範に従って収容されました。すべての手続きは、プロジェクトライセンスPPL70/8852の下で訓練を受け、有能な個人ライセンス所有者によって実施されました。子豚は、ASPAの下でスケジュール1の方法に従って淘汰されました。
1. インサート製造
- 付属の3Dモデル(補足ファイル1)を使用して、3Dプリントでインサートを製造します。
注:3Dモデリングにより、新しいアプリケーションに適応するために設計を簡単に変更できます。代替材料および代替製造技術を使用して、インサートを製造することもできます。内部構造が複雑なため、選択的レーザー焼結と光造形が適切な代替手段である15。ポリアミド12(PA12;材料表を参照)は、液体保持と繰り返しの加熱滅菌サイクルに対する耐性の点で優れた性能を発揮するため、優れた 材料候補です16。 - シリコンガスケットとポリカーボネートワッシャーを、補足ファイル2に提供された設計を使用して、レーザー切断17によって製造する。
注:レーザー切断は簡単に外注でき、安価な製造方法です。ワッシャーはステンレス鋼で製造できるため、繰り返し使用するためのより耐性のあるコンポーネントを提供します。その他の部品は全て市販品です。必要な材料の完全なリストを 表1に示します。品目の商業的な詳細は、 材料表に含まれています。
2. デバイスの滅菌、組み立て、プライミング
- 表1の指示に従ってすべてのコンポーネントを滅菌します。
- 層流条件下で、 図1Aに示すように、2つの製造インサートを組み立てます(ステップ1)。
- 以下の手順に従って、 図2のように灌流システムを組み立てます。
- 接続された2つの三方弁をリザーバーのR1ポート(メディア交換ポート)に取り付けます。
- 得られた出口を、一方向弁(一方向弁管)を備えたチューブを使用して、蠕動ポンプのヘッドに接続します。
- ポンプヘッドを反応チャンバーのC4ポートに、一方向バルブを備えたシステムチューブで接続します。
注意: このブランチには、オプションで圧力センサーを装備して、常時監視することができます。 - 反応チャンバーポートC1を軟壁チューブに接続し、これを抵抗チャネル(内径の小さい)に接続します。
注意: 抵抗チューブの長さは、システム内に存在する圧力に大きく影響します。これは、適切な ?? 流条件を確保するためにさらに調査する必要があります。. - システムチューブで抵抗チャネルを拡張し、リターンチャネルを作成し、R5でリザーバーに接続して管腔循環ループを閉じます(図2C)。
- 反応チャンバーC3をシステムチューブでリザーバーR3に接続してオーバーフローチャネルを作成します。
- R2に通気フィルターを取り付けます。
- 空気と媒体の入ったシリンジを反応室C6に接続して圧力減衰器を作成する。
注意: 正しい空気対媒体の比率は、必要な圧力減衰によって異なります。
- 培地交換ポートとリザーバーを介して、灌流培地(ダルベッコ改変イーグル培地[DMEM] + 10% [v/v]ウシ胎児血清[FBS] + 1% [v/v]ペニシリン-ストレプトマイシン + 1% [v/v]アムホテリシンB + 30% [v/v]デキストラン; 材料表を参照)でシステムをプライムします。
メモ: システムを呼び水処理すると、システムに気泡が閉じ込められるリスクが軽減され、漏れの可能性が特定されます。培地の推奨量は約100〜120mLです。使用される容量は、実験に使用するチューブのデッドボリュームによって異なります。
3. サンプルの採取と調製
- 左右の総頸動脈を採取し、動脈組織の直接的な取り扱いを最小限にする13。
- 組織を冷間輸送培地(DMEM + 20% [v/v] FBS + 2% [v/v]ペニシリン-ストレプトマイシン + 1% [v/v]アムホテリシンB、 材料表を参照)に入れて転写します。
- 層流キャビネットでは、余分な結合組織を取り除き、メスの刃を使用して組織の端を切り取ります。組織を低温輸送媒体で2回洗浄します。
- 組織を輸送媒体中のオービタルシェーカーに少なくとも30分間置き、完全に洗浄します。
- 2つの有刺鉄線ルアーコネクタを使用して動脈の非分岐セグメントをバイオリアクターシステムに接続し、血管ボンド(血管シリコンタイ; 表1)。
注意: ベッセルボンドは、ベッセルを固定するための適切な張力と収縮を提供します。楕円形の部分は、組織の損傷を防ぎます。 - 動脈に培地を静かに流し、開存性を確認します。
- 作製したインサートに動脈を固定した後、反応空間を灌流培地で満たします(ステップ2.4)。最後に、管腔循環ループを媒体で静かに満たして、システムから残っている空気を取り除きます。
- 反応空間を以前に組み立てた灌流システム(セクション2)に接続し、循環を完了します。
注:処理された組織の免疫組織化学による品質チェックを実行することをお勧めします。これにより、準備中の過度の取り扱いによる損傷が特定されます。
4. 灌流培養と培地の変化
- 灌流システムを 5% CO2 を含む 37 °C のインキュベーターに入れ、蠕動ポンプに接続します ( 材料表を参照)
- 圧力センサーなどの追加の(通性)取得システムを接続します( 材料表を参照)。
- システムを一晩放置し、10~15 mL/minの低い培地流量で平衡化します。
注意: ポンプの設定、媒体の流れ、システム圧力、および最適な圧力ダンパー/クランプの設定を決定するための最初の実験は、適切な条件が満たされていることを確認するために必要です。 - 翌日、最終流量(35 mL/分)に達するまで、流量を段階的に増やします(+1 rpm/1 rpm、現在のシステムでは1時間あたり~2.5 mL/分の増加に相当)。システムに漏れがないか定期的に監視します。
注意: 蠕動ポンプ速度に基づいて正確な流量を計算するには、ユーザーは最初に適切なポンプ校正18を実行する必要があります。式(1)を用いて、体積流量(Q)は、所与時間(t)内に吐出された量(V)に基づいて算出することができる。推定流速()を計算するには、式(2)で説明した、以前に計算した流量(Q)と容器断面積(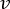 A)を使用できます。
A)を使用できます。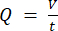 (1)
(1)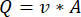 (2)
(2) - 3 日ごとに、新鮮な培地で満たされた 1 本のシリンジをポンプに近い培地交換ポートに接続し、空のシリンジをリザーバーに近いポートに接続して、使用済み培地を回収して、培地の 50%(~50 mL)を交換します(図 2)。
注:培地交換ポートとして2つの三方弁を使用すると、培地交換中の灌流の連続運転が容易になります。 - 実験の最後に、滅菌手術用ハサミを使用してバイオリアクターに接続されている端をトリミングすることにより、反応チャンバーから組織を採取します。
- さらに使用するために、システムを分解、洗浄、滅菌します。
5. サンプル分析
- 回収したサンプルを4%パラホルムアルデヒド(PFA)中で4°Cで一晩固定します。
- 組織を最適な切断温度(OCT; 材料表を参照)19 に包埋し、液体窒素で冷却したイソペンタンに浸漬して凍結します。
- クライオスタットを使用して厚さ3〜5mmのクライオ切片を取得します。
- 免疫組織化学(ヘマトキシリンおよびエオシン[H&E])および/または免疫蛍光法を実施します。典型的な免疫蛍光プロトコールに従ってください。
- リン酸緩衝生理食塩水(PBS; 材料表を参照)に浸した20% [v/v]ヤギ血清で、スライスを室温で1時間ブロックします。
- スライスをPBSで1:50に希釈したCD31に対する初代ウサギ抗体とともに、4°Cで一晩インキュベートします( 材料表を参照)。
- PBSで5分間3回洗浄します。
- PBSで1:200希釈した蛍光標識ヤギ抗ウサギ二次抗体およびPBSで1:200希釈したα平滑筋アクチン(SMA)直接標識蛍光抗体と37°Cで1時間インキュベートします( 材料表を参照)。
- PBSで5分間3回洗浄します。
- PBSで1:1,000に希釈したDAPIで室温で10分間核を染色します。
- 0.1%(w/v)スーダンブラック( 材料表を参照)を70%(v/v)エタノール中で室温で10分間インキュベートし、組織の自家蛍光を低減します。
- 豊富な脱イオン水で組織を洗います。スライドを封入剤に取り付けます。
- 共焦点レーザー走査型顕微鏡でサンプルを画像化します。
結果
この研究により、多用途で手頃な価格の灌流システム(EasyFlow)が確立されました13。システムの3Dプリント設計は、他のラボによるシステムの採用を容易にし、再現性を促進します。
製造された灌流インサートは、50 mLの遠心分離管に収納され、隔離された環境を作り出します。2つの灌流インサートを使用して、リザーバーと反応チャンバーを含む灌流ループを確立し、そこで生体サンプルをインキュベートすることができます。次に、灌流システムを蠕動ポンプと、圧力センサーや超音波装置などのオプションの取得システムに接続して、培養状態を監視します(図2)。
ブタ頸動脈サンプルを採取し、処理した後、7日間灌流で培養した。培養前の組織の品質を確保するために、切除時、組織調製後、および灌流後にサンプルを固定する予備実験を実施しました。内皮マーカー(CD31)および平滑筋マーカー(αSMA)の蛍光染色を使用して、組織の完全性の維持を評価しました。比較のために、保存状態の良い組織と損傷した組織の例を 図3 に示します。画像は、誤った処理(過度の伸張、押しつぶしなど)により、培養に先立って内皮が失われる可能性があるため、切除時に組織を優しく取り扱うことの重要性を示しています。結果はまた、管腔の損傷を避けるために灌流を徐々に確立することの重要性を示しています。
H&E染色は免疫蛍光染色(IF)と並行して行い、培養7日後の血管壁における細胞の形態および全体的な分布の維持を示しました(図4)。装置に生理学的培養条件を適用することで、内腔の内皮被覆の維持、培地中の平滑筋細胞のアライメント、および外膜における血管の保存が保証されます。
また、バイオリアクターシステムのコンパクトでモジュール式な設計により、幅広いシステムセットアップが可能です。小型のセットアップは単一のバイオリアクターで構成され、薬理学的および少量の研究(再循環灌流20、総容量50〜70 mL)に最適です。培養の長さを延ばし、培地の交換回数を減らすには、このプロトコルに記載されているような単一のリザーバー循環システム、または循環する培地の量が多いため、一定の供給システムがより理想的です。二重循環21 のセットアップは、刺激の局在化が重要な実験環境を探索するために確立することができる。また、現在のデバイスは、より高度な制御システムと組み合わせて、pHや溶存酸素などのパラメータの正確なフィードバック制御を可能にすることもできます(図5)。
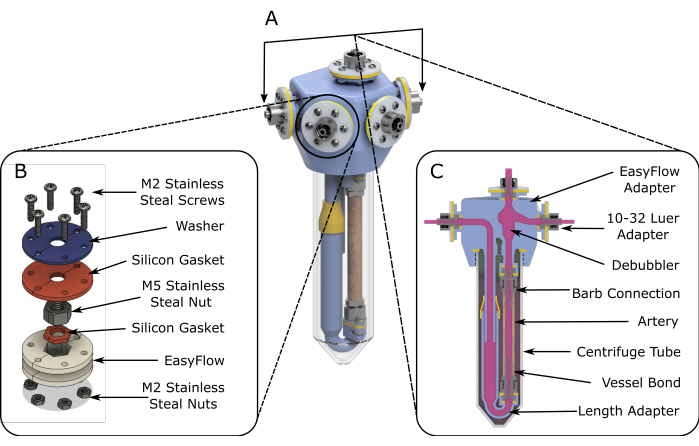
図1:EasyFlowアセンブリの回路図。 (A)灌流インサートの組み立てを支援する3Dレンダリング回路図。(B)接続サイトの組み立てを容易にするために、詳細な回路図が提供されています。(C)反応空間の断面図は、EasyFlowインサートの本質的な構成要素と、インサートへの組織の接続を強調しています。 この図の拡大版をご覧になるには、ここをクリックしてください。
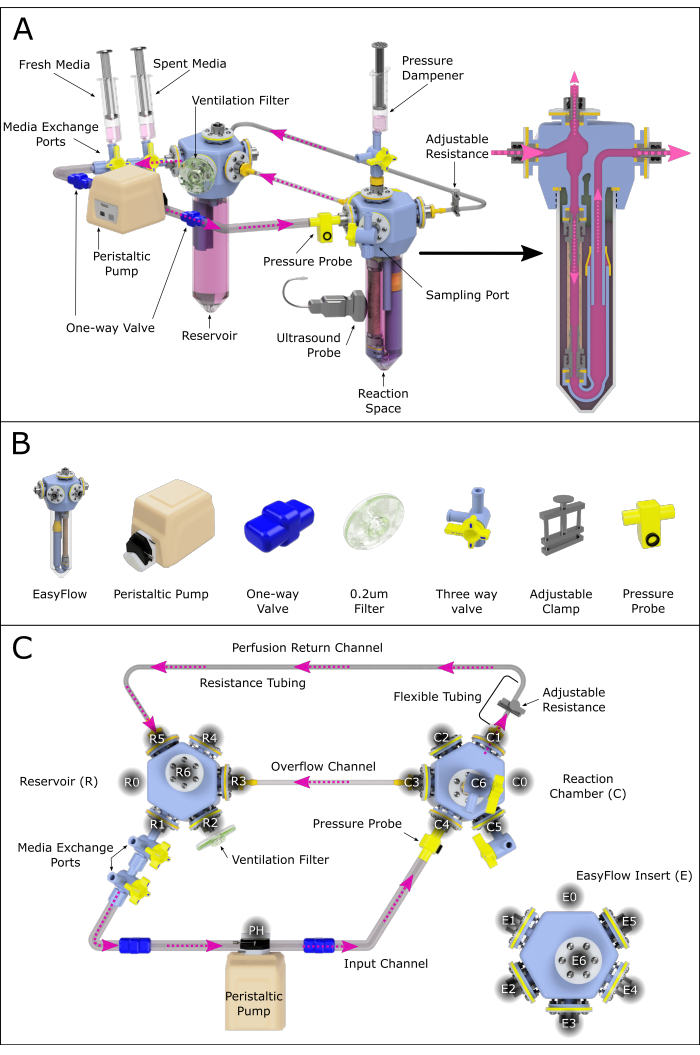
図2:灌流システムアセンブリの概略図。 (A)すべての重要なコンポーネントを含む組み立てられた灌流システムで、3Dレンダリング環境での相対的な位置を強調します。すべてのコンポーネントがスケーリングされるわけではありません。(B)コンポーネントの個々のアイソメトリックビューも表示されます。(c)組み立てられた灌流システムの上面図は、異なる構成要素の組み立ておよび接続を支援するために示されている。ポートには、灌流システム全体のさまざまな接続部位をナビゲートするために、反時計回りにラベルと番号が付けられています。この原理は、リザーバー(R)と反応チャンバー(C)に適用されています。2つのチャンバーをつなぐさまざまなチャネルにも、参照用の名前が割り当てられています。 この図の拡大版をご覧になるには、ここをクリックしてください。
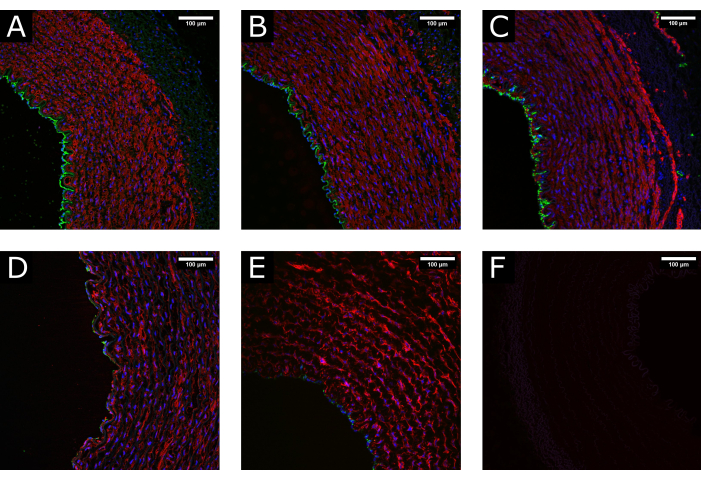
図3:処理中の組織のメンテナンス。 (A)共焦点画像は、採取時、(B)洗浄・処理後、(C)灌流培養後の動脈の正常な構造を示しており、保存状態の良い形態が維持されていることが分かります。(D)処理中の過度または不適切な取り扱い、または(E)非生理学的培養条件の適用(すなわち、高流量の突然の開始)による損傷組織の例は、管腔被覆の枯渇および培地の破壊を示す。(F)ネガティブコントロールは、染色の特異性を示します。CD31:緑;αSMA:赤;DAPI:青。スケールバー:100 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
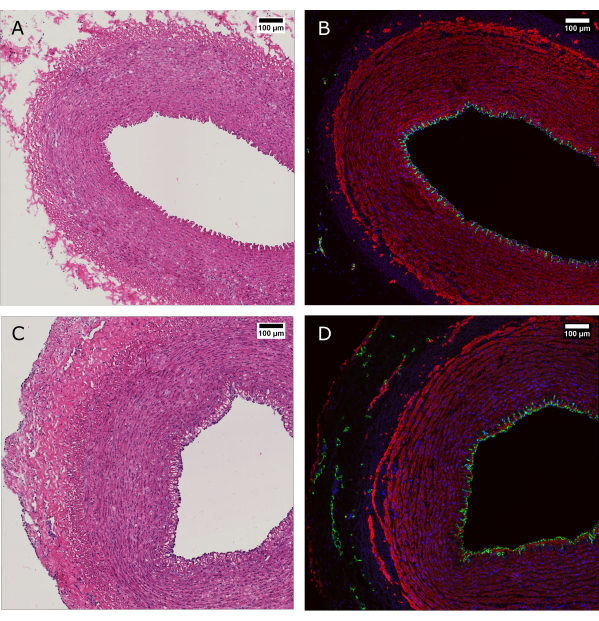
図4:灌流培養前後の組織の組織学的評価。 (AとB)動脈組織は、採取時およびバイオリアクターシステムによる培養の7日後の組織学によって評価されました。(AおよびC)H&E染色により、動脈壁の構造と組織の保存が明らかになります。(BおよびD)同じ組織の免疫蛍光染色により、外膜における内皮被覆、平滑筋細胞のアライメント、および血管血管の証拠となります。CD31:緑;SMA:赤;DAPI:青。スケールバー:100 μm。 この図の拡大版をご覧になるには、ここをクリックしてください。
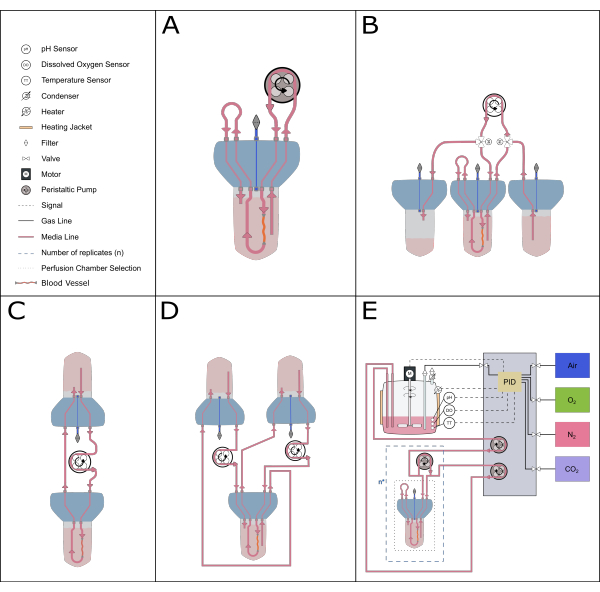
図5:可能な灌流セットアップの概略図。 灌流インサートには、さまざまな実験的研究を可能にするために、さまざまな代替セットアップを対応させることができます。(A)再循環灌流セットアップにより、必要な培地の量が最小限に抑えられます。(B)一定の給餌セットアップにより、組織に培地を安定的に供給します。(C)シングルリザーバー循環(本論文で説明)は、長期インキュベーションに大容量の培地を提供し、空気交換と圧力平衡のための緩衝地帯を含みます。(D)二重循環セットアップは、内側(動脈内)と外側(反応空間)の循環を独立して供給する2つの異なるループを提供します。(E)動的灌流セットアップには、比例-積分-微分(PID)コントローラーによる連続ガスとpH制御が含まれます。 この図の拡大版をご覧になるには、ここをクリックしてください。
表1:インサートを製造するためのコンポーネント。この表をダウンロードするには、ここをクリックしてください。
補足ファイル1:3Dプリンティング製造用のEasyFlowインサートの3Dモデル。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル2:構築した装置の設計図、断面図、印刷物、封止部品。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
Ex vivo 血管灌流システムは、制御された条件下で天然組織内の血管細胞の機能と挙動を研究するための独自のプラットフォームを構成し、損傷後の血管リモデリングなどの複雑なプロセスの解剖を可能にします22。しかし、報告されているバイオリアクターのほとんどは、カスタムメイドのコンポーネントをベースにした自社製のシステムであり、他の人が複製することはしばしば困難です23。代替の商用ソリューションが存在するが、設計の柔軟性に欠けており、比較的コストがかかる可能性がある24。
私たちは、オープンソースの3Dプリンティング技術を使用して製造できる、簡単で安価で再現性のあるプラットフォームを提供する代替システムを開発しました13。本稿では、エンドユーザーによる再現可能なアプリケーションを可能にするためのシステムの設定について説明します。このセットアップにより、圧力(40-180 mmHg)、流量(6-30 mL/min)、およびさまざまな程度のせん断応力で血液粘度を模倣する媒体と組み合わせて、生理学的および病理学的条件を適用することができます。
再現性は、研究者が他者の発見を検証し、それに基づいて血管疾患の理解を深めることができるため、科学的プロセスの重要な側面です。さらに、グループ間のコラボレーションを可能にし、促進するツールは、科学的知識を進歩させるために不可欠です。EasyFlowは、血管科学の分野やそれ以外の分野で幅広いプロジェクトに取り組むラボが簡単に作成し、採用できる、このようなオープンソースでアクセス可能なソリューションの一例です。
このデバイス培養により、動脈組織の生存率が少なくとも7日間維持され、血管疾患の特定のステップをモデル化するために使用できることを報告しています。これを用いて、生理学的流量と圧力条件をモデル化することができる13。重要なことに、この灌流培養は、製造コストが低く、システムの操作に必要な培地の量が少ないため、費用対効果が高いです。
また、3D設計は新しい用途にも適応させることができ、印刷用の新しい材料をテストすることができます。現在のフォーマットでも、継手の長さやルアーコネクタのボアを変更することで、サンプルの収容スペースをさまざまなサイズのサンプルに簡単に適合させることができます。このバイオリアクターは、装置のモジュール性とその小型サイズを考えると、複数のセットアップで使用でき(図5)、複数のサンプルを別々のバイオリアクターで同時に異なる条件に曝露できるマルチプレックス培養に適用できることに注意することが重要です。
将来的には、異なる起源(例えば、異なる種)および異なる性質(例えば、静脈、リンパ管)の血管の培養をサポートするために、このシステムの使用が拡大され、おそらく他の中空組織(例えば、気管、腸)の培養に適用されることが想定されています。特に、研究によると、組織工学スキャフォールドを一定の灌流で培養すると、結果として得られる組織の構造と成熟内の細胞の均一な分布が役立つことが示されています25,26。さらに、灌流における血管移植片の播種は、静的な方法と比較して、より均一に細胞化された血管内腔の達成に寄与する27。このため、我々は、このシステムを組織工学に適用して、現在の課題に対処し、再現性のある合成血管代替品の将来の開発を可能にすることを想定している28。
ここで説明するプロトコールは、フロー培養の成功に不可欠ないくつかの重要なステップを示しています。適切なフロー条件の確立とモニタリングは簡単ではなく、培養条件が生理学的であることを確認するために、初めてセットアップするときに各システムで実行する必要があります。流量と圧力は、圧力センサーと超音波画像を使用して監視されました。もう一つの重要なポイントは、培養の開始時に組織が生存可能で無傷であることを確認することです。これには、新鮮なソース、慎重な取り扱いが必要であり、組織学的分析によって検証できます。さらに、すべての実験の開始時にトラブルシューティングを実行して、潜在的な細菌汚染または培地漏出源を特定する必要があります。
ここで強調しておきたいのは、記載された灌流システムは、生理学的圧力と流動条件を提供する一方で、 生体内で記録された複雑な圧力波のパターンを完全に模倣することはできないということです。この制限は、蠕動ポンプの使用に起因しており、より特殊な機器を使用して高度な血行動態を再現することで解決できます。また、バイオリアクターでの血管培養は、免疫系や他の臓器との相互作用が重要な研究には対応できません。
結論として、生理学的血行動態環境を模倣できる単純な3Dプリント灌流システムを提示し、 生体外 血管培養の標準化に貢献することが期待されます。カスタマイズや長期培養への応用が可能なため、生理学や病理学的状態における複雑な生物学的システムの理解を深めるために不可欠なツールとなっています。
開示事項
著者らには、開示すべき利益相反はありません。
謝辞
著者らは、組織学サービスについて、サリー大学獣医学部の獣医病理学センターに感謝したい。また、動物組織の調達に協力してくださったPirbright Institute(英国、ピルブライト)のL. Dixon博士、A. Reis博士、M. Henstock博士、サリー大学生化学科学部、特に技術チームの継続的な支援に感謝します。RSMはDoctoral College studentship award(サリー大学)の支援を受け、DMとPCはNational Centre for the Replacement, Refinement & Reduction of Animals in Research(助成金番号:NC/R001006/1およびNC/T001216/1)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| EasyFlow | - | - | 3D printed by MultiJet Fusion by Protolabs |
| PA12 - 3D printing | Protolabs | - | - |
| Peristaltic pump | Heidolph | PD5201 | |
| Culture media components: | |||
| Amphotericin B solution, 250 mug/mL in deionized water | Sigma-Aldrich | A2942-20ML | |
| Dextran from Leuconostoc spp. | Sigma-Aldrich | D8802-25ML | |
| Dulbecco's Modified Eagle's Medium - high glucose, w/ 4500 mg/L glucose, L-glutamine, sodium pyruvate, and sodium bicarbonate | Sigma-Aldrich | D6429-6X500ML | |
| Fetal Bovine Serum | Sigma-Aldrich | F9665 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333-100ML | |
| Immunostaining materials: | |||
| Cryostat | LEICA | CM3050 S | |
| DAPI | Sigma-Aldrich | D9542-10MG | |
| Goat serum | Sigma-Aldrich | G9023-10ML | |
| Goat α-Rabbit Alexa Fluor 488 | Thermo Fisher Scientific | A11008 | |
| Invitrogen eBioscience Fluoromount G | Thermo Fisher Scientific | 50-187-88 | |
| MX35 Premier + Microtome Blade | Thermo Scientific | 3052835 | |
| Optimal Cooling Tempearure Compound - OCT | Agar Scientific | AGR1180 | |
| Rabbit α-CD31 antibody | Abcam | ab28364 | |
| Sudan Black B | Santa Cruz Biotechnology | SC-203760 | |
| X72 SuperFrost Plus Adhesion slide, 25x75x1mm, White, 90° Ground Edges, Frosted Area 20mm, 72/box | Fisher Scientific | J1800AMNZ | |
| α-Smooth Muscle Actin (SMA) Alexa Fluor® 647-conjugated antibody | R&D Systems | IC1420R | |
| Material for laser cutting of components: | |||
| Clear Plastic Sheet, 1250 mm x 610 mm x 1 mm (for laser cutting of washers) | RS Components | 258-6590 | |
| RS PRO Translucent Rubber Sponge Sheet, 600 mm x 600 mm x 1.5 mm (for laser cutting of silicone seals) | RS Components | 840-5541 | |
| Optional pressure monitors: | |||
| Pressure sensor | Parker Hannifin | 080-699PSX-3P-5 | |
| SciPres Pressure Monitor | Parker Hannifin | 206-200-M | |
| Pre-sterilized single use plasticware: | |||
| 0.2 um filter | Sarstedt | 70.1114.210 | |
| 20 mL Sterile syringe | IMS Euro | 40004 | |
| 50 mL Centrifuge Tube | Thermo Fisher Scientific | Sarstedt - 62.547.254 | |
| Small components: | |||
| Cable ties | - | - | |
| Masterflex Adapter Fittings, Female Luer to Hose Barb | Cole-Parmer | WZ-30800-10 | Barb Adaptor |
| Masterflex Polycarbonate Luer Fittings | Cole-Parmer | AU-45504-84 | |
| Nylon Miniature Check Valve | Cole-Parmer | 98553-00 | |
| RS PRO Translucent Rubber Sponge Sheet, 600 mm x 600 mm x 1.5 mm (for laser cutting of silicone seals) | RS Components | 840-5541 | |
| Stainless Steel M2 Hex Nuts | RS Components | 527-218 | |
| Stainless Steel M2 x 6 mm Screws | RS Components | 418-7426 | |
| Stainless Steel M5 Hex Nuts | RS Components | 189-585 | |
| Surgical vessel loop | Vascular Silicone Ties,International Medical Supplies | 10-1003 | |
| Three-way valves | IMS Euro | 91000 | |
| Surgical Equipment | |||
| Anatomical Forceps, GRAEFE, Curved, 10 cm SKU: BD-07 | International Medical Supplies | SKU: BD-07 | |
| Micro Forceps, Angled, 0.3 mm, 11 cm | International Medical Supplies | SKU: BD-361 | |
| Micro Scissors Noyes, Curved, 12 cm | International Medical Supplies | SKU: FD-12 | |
| Troge Surgical Scalpels - Size 23 - Box of 100 | International Medical Supplies | 63114 | |
| Tubing: | |||
| Eppendorf silicone tubing (I.D.1.6 mm, O.D.4.7 mm) | Eppendorf | M0740-2396 | System tubing |
| Masterflex PharMed BPT 3-Stop Tubing | ISMATEC | 95714-48 | Soft wall tubing (for clamp) |
| RS PRO Transparent Hose Pipe, 0.8 mm ID, Silicone | RS Components | 667-8432 | Resistance tubing (small inner diameter) |
| Tygon for food (I.D. 4.8 mm, W.T. 1.6 mm) | Heidolph | 525-30027-00-0 | One way valve tube |
| Verderflex Yellow Hose Pipe, 6.4 mm ID, Verderprene | RS Components | 125-4042 | Pump Tubing |
参考文献
- Davies, P. F., Civelek, M., Fang, Y., Fleming, I. The atherosusceptible endothelium: Endothelial phenotypes in complex haemodynamic shear stress regions in vivo. Cardiovascular Research. 99 (2), 315-327 (2013).
- Gugliandolo, E., et al. Palmitoylethanolamide and Polydatin combination reduces inflammation and oxidative stress in vascular injury. Pharmacological Research. 123, 83-92 (2017).
- Anselmino, M., et al. Catheter ablation of atrial fibrillation in patients with left ventricular systolic dysfunction: A systematic review and meta-analysis. Circulation, Arrhythmia, and Electrophysiology. 7 (6), 1011-1018 (2014).
- Viola, M., et al. Subcutaneous delivery of monoclonal antibodies: How do we get there. Journal of Controlled Release. 286, 301-314 (2018).
- Kim, D. D. In vitro cellular models for nasal drug absorption studies. Drug Absorption Studies: In Situ, In Vitro and In Silico Models. , 216-234 (2008).
- Lewis, D. I. Animal experimentation: Implementation and application of the 3Rs. Emerging Topics in Life Sciences. 3 (6), 675-679 (2019).
- Rouwkema, J., et al. In vitro platforms for tissue engineering: Implications for basic research and clinical translation. Journal of Tissue Engineering and Regenerative Medicine. 5 (8), e164-167 (2011).
- Xu, Y., Shrestha, N., Préat, V., Beloqui, A. An overview of in vitro, ex vivo and in vivo models for studying the transport of drugs across intestinal barriers. Advanced Drug Delivery Reviews. 175, 113795 (2021).
- Vaghela, R., et al. Vessel grafts for tissue engineering revisited-Vessel segments show location-specific vascularization patterns in ex vivo ring assay. Microcirculation. 29 (2), e12742 (2022).
- Håkansson, J., et al. Individualized tissue-engineered veins as vascular grafts: A proof of concept study in pig. Journal of Tissue Engineering and Regenerative Medicine. 15 (10), 818-830 (2021).
- Saucy, F., et al. Ex vivo pulsatile perfusion of human saphenous veins induces intimal hyperplasia and increased levels of the plasminogen activator inhibitor 1. European Surgical Research. 45 (1), 50-59 (2010).
- Tosun, Z., McFetridge, P. S. Variation in cardiac pulse frequencies modulates vSMC phenotype switching during vascular remodeling. Cardiovascular Engineering and Technology. 6 (1), 59-70 (2015).
- Matos, R. S., Maselli, D., McVey, J. H., Heiss, C., Campagnolo, P. 3D printed bioreactor enabling the pulsatile culture of native and angioplastied large arteries. Frontiers in Cardiovascular Medicine. 9, 864580 (2022).
- Neff, L. P., et al. Vascular smooth muscle enhances functionality of tissue-engineered blood vessels in vivo. Journal of Vascular Surgery. 53 (2), 426-434 (2011).
- Boparai, K. S., Singh, R. Advances in Fused Deposition Modeling. In: Module. Refrence in Materials Science and Materials Engineering. , (2017).
- McKeen, L. W., McKeen, L. W. Chapter 6 - Polyamides (Nylons). The Effect of Creep and Other Time Related Factors on Plastics and Elastomers (Second Edition). , 197-262 (2012).
- Moradi, M., Mehrabi, O., Azdast, T., Benyounis, K. Y. Enhancement of low power CO2 laser cutting process for injection molded polycarbonate). Optics & Laser Technology. 96, 208-218 (2017).
- Ghasem, N. . Computer Methods in Chemical Engineering. , (2021).
- Lying, F., Gazi, F., Gardner, E. Preparation of tissues and cells for infrared and raman spectroscopy and imaging. Biomedical Applications of Synchrotron Infrared Microspectroscopy.RSC Analytical Spectroscopy Monographs. (11), 147-185 (2011).
- Sassi, L., et al. A perfusion bioreactor for longitudinal monitoring of bioengineered liver constructs. Nanomaterials. 11 (2), 275 (2021).
- Haykal, S., et al. Double-chamber rotating bioreactor for dynamic perfusion cell seeding of large-segment tracheal allografts: Comparison to conventional static methods. Tissue Engineering. Part C, Methods. 20 (8), 681-692 (2014).
- Kural, M. H., Dai, G., Niklason, L. E., Gui, L. An ex vivo vessel injury model to study remodeling. Cell Transplant. 27 (9), 1375-1389 (2018).
- Wong, M. M., Hong, X., Karamariti, E., Hu, Y., Xu, Q. Generation and grafting of tissue-engineered vessels in a mouse model. Journal of Visualized Experiments. (97), 52565 (2015).
- Alvino, V. V., et al. In vitro and in vivo preclinical testing of pericyte-engineered grafts for the correction of congenital heart defects. Journal of the American Heart Association. 9 (4), e014214 (2020).
- Nerurkar, N. L., Sen, S., Baker, B. M., Elliott, D. M., Mauck, R. L. Dynamic culture enhances stem cell infiltration and modulates extracellular matrix production on aligned electrospun nanofibrous scaffolds. Acta Biomaterialia. 7 (2), 485-491 (2011).
- Engebretson, B., Mussett, Z. R., Sikavitsas, V. I. The effects of varying frequency and duration of mechanical stimulation on a tissue-engineered tendon construct. Connective Tissue Research. 59 (2), 167-177 (2018).
- Saunders, S. K., et al. Evaluation of perfusion-driven cell seeding of small diameter engineered tissue vascular grafts with a custom-designed seed-and-culture bioreactor. PLoS One. 17 (6), e0269499 (2022).
- Stephenson, M., Grayson, W. Recent advances in bioreactors for cell-based therapies. F1000Research. 7, (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved