Method Article
نموذج الإصابة بالتبريد لدراسة تجديد العضلات الهيكلية للسويقة الذيلية في الزرد البالغ
In This Article
Summary
يصف هذا البروتوكول نموذج الإصابة بالتبريد للحث على تلف عميق للعديد من الميومرات الذيلية في أسماك الزرد البالغة. توفر هذه الطريقة نهجا جديدا لدراسة تجديد العضلات والهيكل العظمي بعد الفقدان الشديد للأنسجة في الفقاريات غير الثديية.
Abstract
تخضع العضلات الهيكلية للتجديد والترميم بعد إصابة طفيفة من خلال تنشيط الخلايا الجذعية الشبيهة بالأقمار الصناعية. غالبا ما تؤدي الإصابات الشديدة في الجهاز العضلي إلى التليف عند البشر. بالمقارنة مع الثدييات ، تمتلك أسماك الزرد قدرة فطرية أعلى على تجديد الأعضاء ، مما يوفر نموذجا قويا لدراسة استعادة الأنسجة بعد الأضرار الجسيمة التي لحقت بالعضو. هنا ، تم وصف نموذج الإصابة بالتبريد لإحداث تلف عميق لأربعة عضل من السويقة الذيلية في الزرد البالغ. تم تصميم مسبار التبريد المصنوع خصيصا ليناسب شكل الجسم وإصابة العضلات الجانبية بشكل متكرر من الجلد إلى خط الوسط. الأهم من ذلك ، ظلت سلامة الجسم سليمة ، وواصلت الأسماك نشاط السباحة. تم تقييم التغييرات التي طرأت على العضلات الهيكلية عن طريق التلوين النسيجي وتلطيخ مضان البروتينات الساركومية على أقسام الأنسجة. ستفتح هذه الطريقة طرقا جديدة للبحث تهدف إلى فهم كيف يؤدي تنكس العضلات الهيكلية إلى استجابات تعويضية ، وبالتالي إعادة تنشيط البرنامج العضلي في الزرد البالغ.
Introduction
في الفقاريات ، تخضع الأجزاء التالفة من الأنسجة المختلفة لتجديد واستعادة الاستتباب خلال العمر. تعتمد هذه القدرة على التجديد والاستعادة عادة على وجود الخلايا الجذعية المختصة أو القدرة التكاثرية للخلايا الناضجة 1,2. تتكون العضلات الهيكلية من ألياف عضلية ما بعد الانقسام ، والتي ترتبط بالخلايا الجذعية المحلية ، تسمى الخلايا الساتلية3،4،5،6. وبالتالي ، يحتوي هذا النسيج على مصادر خلوية للإغلاق الفعال لمناطق الاستمرارية المتقطعة أو لإصلاح الجروح الطفيفة. ومع ذلك ، غالبا ما يتبع الخسائر الحجمية الأكبر في عضلات الهيكل العظمي للثدييات إصلاح غير متجدد ، مثل التليف7. يمكن أن توفر النماذج الحيوانية رؤى جديدة حول الآليات البيولوجية التي تعزز تجديد الأعضاء التالفة على نطاق واسع.
الزرد هو كائن نموذجي راسخ يتمتع بقدرة عالية على التجدد. يمكن لسمك الزرد البالغ تجديد جزء مبتور من الزعنفة الذيلية أو القمة المقطوعة للبطين القلبي8،9،10،11. بالإضافة إلى ذلك ، تم تطبيق طريقة الإصابة بالتبريد سابقا لدراسة تجديد الزعانف والقلب في الزرد12،13،14،15. في حالة الأعضاء الداخلية ، تتمتع طريقة الإصابة بالتبريد بميزة إحداث موت الخلايا دون تعطيل سلامة الأعضاء ، وبالتالي محاكاة الظروف الفسيولوجية16,17. يتم تفكيك بقايا الأنسجة عن طريق الإزالة الطبيعية أثناء التئام الجروح ، تليها عمليات التعويض. ومع ذلك ، لا يزال يتعين تحديد ما إذا كان يمكن تطبيق هذه الطريقة على العضلات الهيكلية.
في الأسماك ، تتيح العضلات الجانبية ثني الجذع من جانب إلى آخر أثناء السباحة18. يتم تنظيم عضلات الهيكل العظمي في وحدات metameric ، تسمى myomeres ، والتي يتم فصلها بواسطة النسيج الضام 5,19. يمكن لسمك الزرد تجديد عضلاته بعد اضطرابات طفيفة في الأنسجة ، مثل تلك الناجمة عن الاستئصال بالليزر أو جرح الطعنة20،21،22،23،24 ، ولكن ما إذا كان يمكن أن يتجدد عضل كامل بعد إصابة واسعة النطاق لا يزال غير معروف. ربما ترجع هذه الفجوة في المعرفة إلى عدم وجود نموذج مناسب للإصابة. يؤسس هذا البروتوكول نهجا جديدا للحث على إصابة واسعة النطاق للعضلات الهيكلية ، تمتد عبر عضلات متعددة. تعتمد طريقة الإصابة بالتبريد الموصوفة على التجميد السريع وذوبان الألياف العضلية باستخدام أداة من الفولاذ المقاوم للصدأ مبردة مسبقا. على الرغم من الأضرار الجسيمة ، لم تتأثر رفاهية الأسماك بشدة. يمكن استعادة الميوميرات بأكملها ، وبالتالي ، يوفر هذا العمل نظاما نموذجيا جديدا لدراسة آليات تجديد العضلات في الزرد البالغ.
Protocol
أجريت هذه الدراسة بالاتفاق مع جميع اللوائح الأخلاقية ذات الصلة. تم تربية الزرد وتربيته وصيانته وفقا لإرشادات الاتحاد الأوروبي لجمعيات علوم المختبر (FELASA)25. تمت الموافقة على سكن الحيوانات وجميع الإجراءات التجريبية من قبل المكتب البيطري في كانتون فريبورغ ، سويسرا.
1. المعدات والإعداد
- ترتيب إنتاج مسبار تبريد من الفولاذ المقاوم للصدأ في ورشة عمل فنية يمكنها تصنيع أدوات للبحث.
ملاحظة: قدم تصميما للأداة بأبعاد محددة (الشكل 1 أ). - لتجنب قضمة الصقيع أثناء التعامل مع المسبار أثناء الإجراء ، أدخل المقبض في طرف ماصة ، ولفه بشريط لاصق.
- قم بإعداد دورق لمحلول عمل التخدير ، وملعقة للتعامل مع الأسماك ، وإسفنجة رطبة ، وخزان به ماء نظام للسماح للأسماك بالتعافي بعد العملية.
- قم بإعداد حل العمل طازجا قبل كل تجربة. لتحضير محلول العمل، أضف 4 مل من محلول مرق التريكائين إلى 100 مل من ماء النظام في كأس زجاجية.
ملاحظة: يتكون محلول مخزون التخدير من 4 جم من تريكايين مذاب في 980 مل من الماء المقطر. بعد ضبط الرقم الهيدروجيني إلى 7 مع 1 M Tris-HCl ، الرقم الهيدروجيني 9 ، املأ المحلول إلى 1 لتر بالماء المقطر. محلول المرق حساس للضوء ويجب تخزينه عند 4 درجات مئوية في زجاجة كهرمانية.
2. إجراء الإصابة بالتبريد العضلي
- ابدأ الإجراء عن طريق غمر المسبار في النيتروجين السائل لمدة لا تقل عن 3 دقائق. بلل الاسفنجة في ماء النظام ، وضعها على سطح مستو.
- انقل سمكة زرد بالغة واحدة إلى محلول عمل Tricaine ، وتأكد من عدم استجابتها عن طريق لمس السمكة برفق بالملعقة بعد 1 دقيقة أو 2 دقيقة. إذا كانت السمكة لا تزال تفاعلية ، فانتظر لفترة أطول قليلا.
- ضع السمك المخدر على الإسفنجة المبللة. حدد موقع السويقة الذيلية الخلفية للزعنفة الشرجية والأمامية للزعنفة الذيلية.
- قم بإزالة المسبار بالتبريد من النيتروجين السائل. هز المسبار برفق لضمان عدم بقاء النيتروجين السائل المتبقي على الطرف.
- ضع حافة الملعقة بشكل عمودي على الجسم على السويقة الذيلية (الشكل 1 ج). احتفظ بالمسبار في هذا الوضع لمدة 6 ثوان دون الضغط (الشكل 1 د).
ملاحظة: وزن المسبار بالتبريد كاف لضمان التلامس بين الجهاز والأنسجة. - حرر المسبار بالتبريد من الأنسجة ، وانقل الأسماك إلى الخزان بماء النظام.
- راقب الأسماك أثناء استئنافها التنفس والسباحة بعد الاستيقاظ من التخدير. إذا لم تحدث حركات دائرية بعد 30 ثانية ، فقم بتحفيز الأسماك عن طريق سحب ماء النظام في الخياشيم حتى يبدأ الحيوان في التنفس بنفسه.
ملاحظة: يجب أن تستأنف الأسماك السباحة في غضون بضع دقائق في حوض الاسترداد.
ملاحظة: في الأيام التالية ، يمكن تصوير الأسماك لمراقبة نشاط السباحة (الفيديو 1 والفيديو 2). قبل تسجيل الفيديو ، انقل التحكم والأسماك المصابة إلى خزان تزاوج شفاف ، واتركها تعتاد لمدة 1 دقيقة على الأقل.
3. جمع السويقة الذيلية وتثبيتها
- تحضير 2 مل من 4٪ فورمالين أو مثبت آخر مناسب للمقايسات اللاحقة ، طبق بتري ، ملقط ، ومقص جراحي.
- القتل الرحيم للأسماك في نقطة زمنية محددة بعد الإصابة بالتبريد وفقا للإذن القانوني الممنوح من المكتب البيطري الإقليمي.
ملاحظة: يتم إجراء القتل الرحيم بجرعة زائدة من محلول التريكائين (300 مجم / لتر) لمدة 10 دقائق تقريبا. فقدان حركة الخياشيم ومنعكس قرصة زعنفة الذيل يؤكد الموت. يجب اختيار النقاط الزمنية للقتل الرحيم وفقا لمرحلة التجديد: على سبيل المثال ، من 1 يوم بعد الإصابة بالتبريد (dpci) إلى 3 dpci لإزالة الجرح ؛ من 3 dpci إلى 10 dpci لبدء تجديد العضلات ؛ من 10 dpci إلى 30 dpci لتقدم التجديد ؛ وبعد 30 dpci لاستكمال ترميم الأنسجة. وبالتالي ، لتقييم الخطوات المختلفة والعمليات البيولوجية لتنكس العضلات وتجديدها ، يجب القتل الرحيم لمجموعات الأسماك في نقاط زمنية مختلفة بعد الإصابة بالتبريد. - ضع السمك المقتل رحيما في طبق بتري يحتوي على ماء منزوع الأيونات. استخدم المقص لإجراء قطع عبر الجسم الأمامي والخلفي إلى السويقة الذيلية (الشكل 1E). دع الأنسجة تنزف في الماء منزوع الأيونات في طبق بتري.
- اجمع السويقة الذيلية ، وانقلها بالملقط إلى المحلول المثبت المحضر في أنبوب طرد مركزي دقيق.
ملاحظة: اقلب الأنابيب بعناية عدة مرات ، واحتفظ بها طوال الليل عند 4 درجات مئوية.
4. تركيب السويقة الذيلية
- اغسل المنديل الثابت في 1x PBS لمدة 10 دقائق على الروك. بعد ذلك ، قم بنقله إلى أنبوب طرد مركزي دقيق سعة 2 مل مع سكروز مبرد مسبقا بنسبة 30٪ في ماء منزوع الأيونات عند 4 درجات مئوية ، واقلب الأنبوب برفق عدة مرات. اترك أنابيب الطرد المركزي الدقيقة لمدة لا تقل عن 24 ساعة عند 4 درجات مئوية في وضع رأسي.
ملاحظة: تطفو السويقة الذيلية فوق محلول السكروز وتبدأ في الغرق مع جفاف الأنسجة. - املأ قالب التضمين بطبقة 5 مم من وسط تركيب O.C.T. . استخدم الملقط لضبط السويقة الذيلية في الوسط. ضعه في الجزء السفلي من القالب ، واضبط اتجاهه إما للأقسام المستعرضة أو الإكليلية (الشكل 1F).
- دع الوسط يتجمد في صندوق من الثلج الجاف. بمجرد استقرار الأنسجة في الموضع المطلوب ، املأ بقية القالب قبل أن يتجمد O.C.T. تماما. قم بتخزين القالب لمدة لا تقل عن 1 ساعة عند -80 درجة مئوية.
ملاحظة: في ظل هذه الظروف ، يمكن تخزين الأنسجة لعدة أشهر.
5. قطع المقاطع باستخدام cryostat
- قم بإعداد cryostat بسمك قطع 25 ميكرومتر. اضبط درجة حرارة الغرفة على -26 درجة مئوية ، ودرجة حرارة العينة إلى -24 درجة مئوية ، وزاوية القطع إلى 12 درجة.
- ضع الكتلة المجمدة مع العينة في cryostat ، وحدد اتجاهها من أجل القطع بالتوازي مع الجزء السفلي من الكتلة. اقطع حتى تصل إلى العينة ، ثم قم بقص الكتلة لتسهيل جمع العينات.
- إعداد ستة شرائح التصاق. قم بتسمية الشرائح بأرقام متتالية من أجل إعداد نسخ متماثلة من العينة.
- ابدأ بالقطع ، واجمع أقسام الأنسجة على شرائح الالتصاق المصنفة. رتب الأقسام على الشرائح وفقا للمتطلبات التجريبية الإضافية.
- دع الشرائح تجف لمدة 1 ساعة في درجة حرارة الغرفة. قم بتخزينها في صناديق مغلقة عند -20 درجة مئوية.
ملاحظة: يمكن تخزين الشرائح بأمان في هذه الحالة لمدة تصل إلى 1 سنة.
النتائج
مراقبة الأسماك بعد الإصابة بالتبريد
لتحديد تأثير الإصابة بالتبريد العضلي على الحيوانات ، تم إجراء تسجيل فيديو للأسماك الضابطة والمصابة بالتبريد في 1 أيام بعد الإصابة بالتبريد (dpci) و 5 dpci. احتوت كل مجموعة على خمسة أسماك. عند 1 نقطة في البوصة ، كانت الأسماك المصابة بالتبريد تسبح بشكل أقل نشاطا ، لكنها لم تظهر أي حركات غير طبيعية ، مثل الدوران أو الالتفاف أو انخفاض التوازن (الفيديو 1). في نظام التربية ، كان وضعهم في الخزان وتناول الطعام مشابها لمواقع الأسماك غير المصابة. استمر السلوك الطبيعي طوال الأيام التالية ، كما يتضح من الفيديو عند 5 dpci (الفيديو 2). في الختام ، لم يؤثر إجراء الإصابة بالتبريد للسويقة الذيلية بشدة على رفاهية الحيوانات.
التحليل النسيجي لأقسام السويقة الذيلية
لتقييم مدى الإصابة ، تم اختيار النقطة الزمنية 4 dpci ، حيث يتم امتصاص حطام الألياف العضلية بالكامل في الجرح. لتحليل آثار الإصابة بالتبريد على طول المحاور الظهرية البطنية والأمامية الخلفية للجسم ، تم استخدام مجموعتين من الأسماك (أي الأقسام الإكليلية والمستعرضة للسويقة الذيلية ، على التوالي) (الشكل 1F).
تم تحليل الأقسام بواسطة تلطيخ ثلاثي الألوان يتكون من أزرق الأنيلين وحمض الفوشين والبرتقالي G (AFOG). باستخدام هذا المزيج من الكواشف ، تم عرض العضلات السليمة باللون البرتقالي ، والحبل الشوكي باللون الأحمر الداكن ، والمصفوفة الكولاجينية باللون الأزرق. لتحديد عدد العضل التالف ، وهي الوحدات metameric من العضلات السمكية ، تم تحليل سلسلة من الأقسام (الشكل 2). تم تحديد حدود العضل ، التي تسمى myocommata ، عن طريق ترسب الكولاجين ، كما تم اكتشافه بواسطة اللون الأزرق. تم تحديد المناطق المتضررة من خلال عدم وجود تلطيخ برتقالي. وكشف الفحص الدقيق للعينات ذات الميوكوماتا الواضحة أن ما يقرب من أربعة ميومرات متتالية قد تضررت، كما يستدل عليه من عدم وجود تلطيخ برتقالي (n، عدد الأسماك = 4; الشكل 3 أ ، أ '). كان الجانب غير المصاب من نفس السمكة بمثابة المرجع الداخلي.
لفحص عمق الجرح عموديا على محور الجسم ، تم تحضير مقاطع مستعرضة باستخدام الزرد عند 4 dpci و 7 dpci. تتوافق النقطة الزمنية الأخيرة مع تنشيط البرنامج العضلي ، وبالتالي بداية تجديد العضلات. أظهر تلطيخ AFOG لهذه العينات نقصا كبيرا في تلطيخ اللون البرتقالي في الجناح المصاب بالتبريد من الجسم ، مما أدى إلى ترسيم منطقة العضلات الهيكلية المتدهورة (الشكل 3B ، C). عند 4 dpci و 7 dpci ، امتدت منطقة الجرح الأنسجة من الجلد نحو الحاجز العمودي. يوضح هذا أن طريقة الإصابة بالتبريد استهدفت بعمق نصفا جانبيا من السويقة الذيلية ، والتي ظلت خالية من العضلات الوظيفية لمدة 7 أيام بعد العملية. مجتمعة ، تضررت أربعة عضل عميق على جانب واحد من السويقة الذيلية.
تحليل التألق المناعي للمقاطع المستعرضة
لتقييم ديناميكيات تجديد العضلات ، تم القتل الرحيم لمجموعات تجريبية من الأسماك عند 4 dpci و 7 dpci و 10 dpci و 30 dpci. تم تمييز المقاطع المستعرضة للسويقة الذيلية بواسطة تلطيخ مضان متعدد الألوان باستخدام Phalloidin (الذي يرتبط بالأكتين الخيطي [F-actin]) ، والجسم المضاد Tropomyosin-1 ، الذي يكتشف بروتين القطعة العضلية ، و DAPI ، الذي يسمي النوى. في جميع النقاط الزمنية ، يوفر النصف غير المصاب من الجسم رقابة داخلية. تم اكتشاف كل من F-actin و Tropomyosin 1 بقوة في أجزاء التحكم غير المصابة ، مما يشير إلى الأنسجة غير التالفة (الشكل 4).
عند 4 dpci ، احتوى الجانب المصاب من السويقة الذيلية على خلايا إيجابية DAPI وفيرة ، ولكن لوحظ القليل من التألق المناعي F-actin و Tropomyosin 1 ، مما يشير إلى منطقة الجرح ذات العضلات المتدهورة (الشكل 4A-B). عند 7 نقطة في البوصة ، يمكن اكتشاف Tropomyosin 1 و F-actin في جزء من الجرح بالقرب من خط الوسط الرأسي للجسم (الشكل 4C-D '). يحدد نمط التعبير هذا الموضع الذي يبدأ فيه تكوين ألياف عضلية جديدة في السويقة الذيلية. عند 10 نقطة في البوصة ، توسعت كلتا علامتي العضلات نحو سطح الجسم ، مما يشير إلى تقدم تجديد العضلات الهيكلية (الشكل 4E-F). عند 30 نقطة في البوصة ، أظهر كلا جانبي الجسم توزيعا مشابها لتلطيخ F-actin (الشكل 4G-H '). تشير هذه النتيجة إلى أن العضلات الهيكلية قد تم استعادتها بكفاءة بعد الإصابة بالتبريد للسويقة الذيلية.
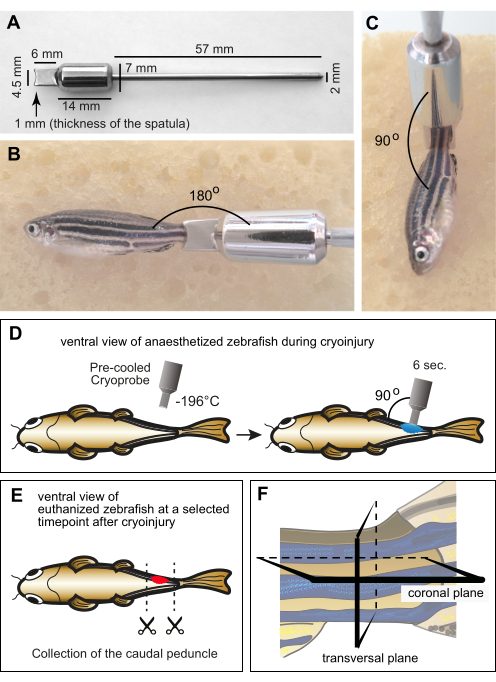
الشكل 1: الإعداد التجريبي للإصابة البردية للعضل . (أ) أبعاد مسبار التبريد المصنع خصيصا والمصنوع من الفولاذ المقاوم للصدأ. يتكون الجزء البعيد من الأداة من ملعقة ذات حافة مقعرة على عمق 1 مم لحساب انحناء جسم الزرد. يتكون الجزء الأوسط من الأداة من أسطوانة تعمل كوزن وخزان للحفاظ على درجة حرارة منخفضة للملعقة أثناء الإجراء. الطرف القريب من الأداة على شكل مقبض معدني رفيع. (ب، ج) تخدير الأسماك البالغة على اسفنجة رطبة مع cryoprobe على السويقة الذيلية. كان المسبار في درجة حرارة الغرفة. (ب) يوضع هامش المسبار أفقيا بالقرب من السويقة الذيلية لعرض الحجم النسبي بين السمكة والأداة. (ج) بالنسبة للإصابة بالتبريد، يوضع طرف الأداة عموديا على السمكة. (د) رسم تخطيطي لإجراء الإصابة بالتبريد من الجانب البطني للأسماك لإظهار التلاعب بطريقة شاملة. تم تبريد المسبار المبرد مسبقا في النيتروجين السائل ووضعه على الفور على جانب واحد من السمكة لمدة 6 ثوان. (ه) في نقطة زمنية محددة بعد الإصابة بالتبريد ، تم القتل الرحيم للأسماك ، وتم جمع ساقيها الذيلية للتثبيت. (F) تمت معالجة المادة الثابتة نسيجيا وتقسيمها على طول المستويات الإكليلية أو المستعرضة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
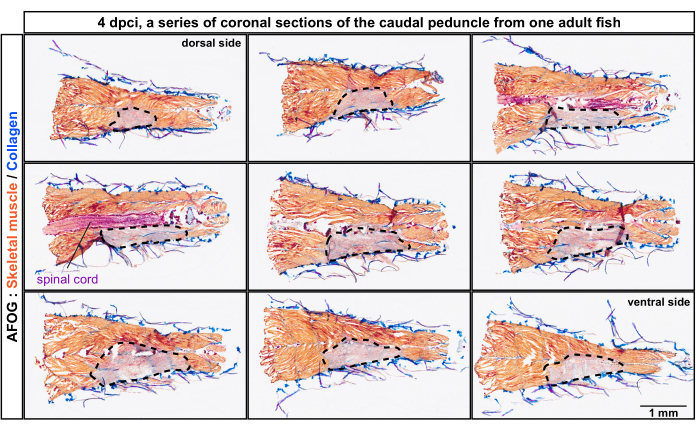
الشكل 2: التحليل النسيجي للعضل التالف في السويقة الذيلية من الموضع الظهري إلى الوضع البطني للجسم. تلطيخ AFOG لسلسلة من الأقسام الإكليلية في 4 أيام بعد الإصابة بالتبريد (dpci). الأقسام من الظهرية باتجاه الجانب البطني ، كما هو موضح في الجزء العلوي من اللوحة الأولى والأخيرة. الأقسام غير متجاورة ، مع فاصل زمني يبلغ حوالي 150 ميكرومتر بينهما. يتم الكشف عن العضلات غير المصابة عن طريق تلطيخ العضلات باللون البرتقالي ، في حين أن الأنسجة المصابة تفتقر إلى هذا التلوين وتبدو رمادية (منطقة محاطة بخط متقطع). الأنسجة المحتوية على الكولاجين ، مثل الجلد ، ملطخة باللون الأزرق. يظهر الحبل الشوكي كهيكل يشبه القضيب وملطخ باللون الأحمر. عدد الأسماك ، ن = 4. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
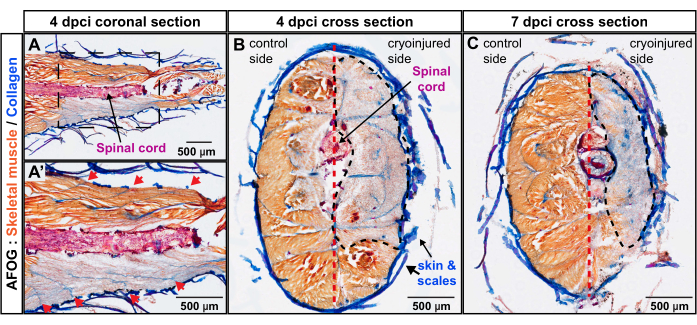
الشكل 3: تقييم عمق الإصابة في السويقة الذيلية باستخدام تلطيخ AFOG. (أ ، أ) القسم الإكليلي على مستوى الحبل الشوكي (قضيب أفقي مصبوغ باللون الأحمر). تظهر الصورة السفلية منطقة مكبرة محاطة بإطار في الصورة العلوية. تظهر حدود العضل المتسلسل كخطوط كولاجينية (زرقاء) موضوعة بشكل غير مباشر على الحبل الشوكي (أسهم حمراء في الصورة المكبرة A'). (ب، ج) تعرض المقاطع العرضية الجناح غير المصاب بعضلات ملطخة باللون البرتقالي والجناح المصاب بالتبريد مع تلطيخ رمادي. المنطقة المتضررة محاطة بخط أسود متقطع. يقسم الحاجز العمودي (الموضح بخط أحمر متقطع) الجسم إلى جوانب التحكم والإصابة بالتبريد. عدد الأسماك ، ن = 4 لكل نقطة زمنية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
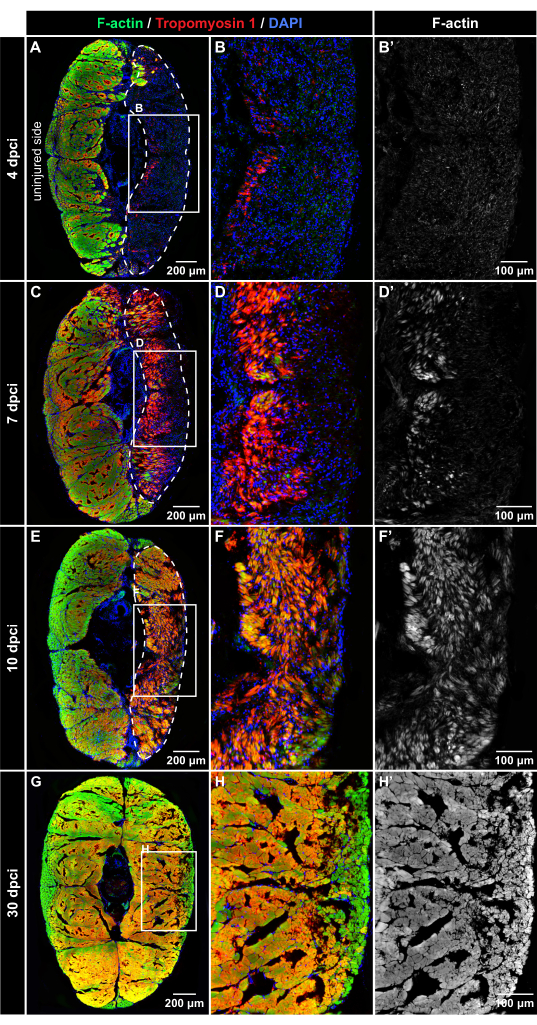
الشكل 4: الكشف المناعي عن البروتينات العضلية بعد الإصابة بالتبريد. تلطيخ مضان للمقاطع العرضية عند 4 dpci و 7 dpci و 10 dpci و 30 dpci ، كما هو موضح على الجانب الأيسر وأعلى الألواح (A-B'). عند 4 نقطة في البوصة ، يكون النسيج المصاب (المحاط بالخط المتقطع) إيجابيا ل DAPI (أزرق) ولكنه خال من تلطيخ Phalloidin (أخضر) أو النشاط المناعي Tropomyosin-1 (أحمر) ، مما يشير إلى تنكس ألياف العضلات بعد الإصابة بالتبريد. (C-D') عند 7 dpci ، تظهر كلتا علامتي العضلات تدريجيا في المنطقة المصابة ، مما يشير إلى عملية التجدد. يبدو التروبوميوسين -1 أكثر كثافة من F-actin في الألياف المشكلة حديثا. (إ-ف') عند 10 نقطة في البوصة ، تمتلئ منطقة الإصابة بألياف عضلية جديدة تظهر كثافة أعلى من النشاط المناعي للتروبوميوسين -1 مقارنة ب F-actin. (G-H') عند 30 نقطة في البوصة ، يتم الكشف عن نمط مماثل من الألياف العضلية في كلا جانبي الجسم. تشمل الإطارات في اللوحات A و C و E و H المساحات المكبرة في الصور المجاورة إلى اليمين. تم مسح القشور الجلدية ، المنبعثة من التألق خارج العضل ، من الصور باستخدام Adobe Photoshop. عدد الأسماك ، ن = 4 لكل نقطة زمنية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يوفر الزرد كائنا نموذجيا للفقاريات لدراسة آليات تجديد العضلات. معظم طرق الإصابة الحالية ، مثل الاستئصال بالليزر أو جرح الطعنات ، تؤدي إلى اضطراب بسيط نسبيا في الأنسجة20،21،22،23. تم إجراء عمليات استئصال رئيسية على العضلات خارج العين26. ومع ذلك ، من المحتمل أن يكون هذا النهج الجراحي أقل ملاءمة للعضلات الجانبية بسبب المخاطر الصحية لقطع جدار الجسم. لتجنب مثل هذه الإجراءات الغازية ، يصف هذا البروتوكول شكلا أكثر اعتدالا من الإصابة التي ، مع ذلك ، تؤدي إلى أضرار جسيمة للسويقة الذيلية. يعتمد هذا النهج على التلاعب السطحي الذي يسمح بالاستهداف الدقيق للغاية لعدد قليل من العضل على جانب واحد من الجسم. تكمن نقاط القوة في نموذج الإصابة بالتبريد في قابليته للتكاثر وقدرته على إنتاج تنكس عضلي واسع النطاق. بناء على نقاط القوة هذه ، يوفر هذا النموذج مسارا جديدا لدراسة كيفية تفاعل الجسم مع فقدان العضلات بشكل كبير.
يؤدي تطبيق البرد الشديد إلى صدمة حرارية تدمر غشاء البلازما والعضيات في الأنسجة العضلية المصابة27. نتيجة لذلك ، تخضع الألياف العضلية المصابة لموت الخلايا "العرضي"28. وبالتالي ، يمكن امتصاص الأنسجة التالفة بواسطة الآليات الطبيعية لإزالة الجرح. يتحمل الزرد إجراء الإصابة بالتبريد جيدا ، حيث كان معدل البقاء على قيد الحياة في هذه الدراسة ما يقرب من 100٪ ، نظرا لأن المسبار المبرد مسبقا تم وضعه بشكل صحيح على الجسم طوال المدة المحددة. ومع ذلك ، إذا كان الجرح واسعا جدا (على سبيل المثال ، إذا تم تطبيق الكثير من الضغط أو كانت مدة الإصابة بالتبريد طويلة جدا) ، فقد تظهر الأسماك حركات سباحة شاذة بعد فترة وجيزة من الإجراء ، ويجب القتل الرحيم للحيوان كنقطة نهاية إنسانية. بالنسبة لأنواع الأسماك الأخرى ، يجب ضبط وقت التعرض للمسبار بالتبريد وفقا لحجم الجسم.
بعد الإصابة بالتبريد ، يمكن للأسماك استئناف نشاط السباحة دون أي أعراض لحركة غير طبيعية. ومع ذلك ، فإن الأسماك المصابة بالتبريد تسبح بشكل أقل ديناميكية من الأسماك الضابطة ، مما يشير إلى بعض الإعاقات الخفيفة. سيكون من الضروري إجراء مزيد من القياس الكمي لسلوك الأسماك في نقاط زمنية مختلفة بعد الإصابة بالتبريد لتحديد التغيرات الزمنية في أداء السباحة.
لا يزال يتعين توضيح تأثير طريقة الإصابة بالتبريد على الأنسجة غير العضلية الأخرى للسويقة الذيلية. من الواضح أن الطبقة الخارجية من الجسم (أي الجلد) تالفة بسبب الإجراء. في هذا السياق ، يمكن أن توفر طريقة الإصابة بالتبريد استراتيجية جديدة لدراسة التئام الجروح وتجديد القشور واستعادة نمط التصبغ. علاوة على ذلك ، يمكن أن تتأثر الأوعية الدموية وتعصيب العضل أيضا بالإصابة بالتبريد ، وتتطلب هذه الموضوعات مزيدا من التحقيق.
تم استخدام نموذج الإصابة بالتبريد سابقا للتحقيق في تجديد قلب الزرد13،14،15،29. أظهرت هذه الطريقة بعض المزايا مقارنة بطريقة استئصال البطين10 بسبب الترسب العابر لندبة غنية بالكولاجين ، والتي تحاكي بشكل أفضل استجابة الشفاء من الاحتشاء لدى البشر30. بشكل ملحوظ ، يمكن لسمك الزرد تجديد قلبه بعد إصابات التبريدالمتعددة 31. ومن المثير للاهتمام ، تم تطبيق الإصابة بالتبريد أيضا على زعنفة الزرد ، مما أدى إلى عمليات تحلل الأنسجة12. على عكس بتر الزعنفة الكلاسيكي ، يحتوي الجذع المتبقي المصاب بالتبريد على هامش مشوه بمزيج من المواد الميتة والخلايا السليمة. كشفت الدراسات التي أجريت على كل من أعضاء الزرد ، القلب والزعنفة ، عن القدرة القوية لسمك الزرد على استعادة مكوناتها الوظيفية الأصلية حتى بعد تلف الأنسجة على نطاق واسع. ما إذا كانت العضلات الهيكلية المصابة بالتبريد تنشط التفاعل بين العمليات التعويضية والتجديدية تستدعي دراسات مستقبلية.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
نشكر V. Zimmermann على رعاية الأسماك ، وكذلك الدكتور توماس بيز ، والدكتورة كاثرين فيفرلي ، وليا جيجون على بدء هذا المشروع ونتائجهم الأولية. تم دعم هذا العمل من قبل المؤسسة الوطنية السويسرية للعلوم ، رقم المنحة 310030_208170.
Materials
| Name | Company | Catalog Number | Comments |
| Program | |||
| ImageJ | National Institutes of Health (NIH) | ||
| Photoshop Version 23.5.3 | Adobe | ||
| Material/ Equipment | |||
| 35/10 mm Petri Dish | Greiner Bio-one | Item No.: 627102 | |
| Camera | Sony | / | HDR-PJ410 |
| Cryostat | Histcom | HRA C50 | |
| Formaldehyde ~36% | Sigma-Aldrich | 47630 | |
| Macro 50 mm f/2.8 EX DG lens | Sigma | / | Discontinued lense |
| Peel-A-Way Embedding Truncated Molds T8 | Polyscience, Inc. | 18985 | |
| Slides Superfrost Plus | Fisher Scientific | 12-550-15 | |
| Sponge | any | any | flat sponge, c.a. 7cm x 3 cm x 1 cm |
| Stainless steel cryoprobe | Custom-made | / | specifics in the article |
| Sucrose | Sigma-Aldrich | 84100 | |
| Surgical scissors | Any | / | |
| TCS SP2 | Leica | / | Discontinoued product |
| Tissue-Tek O.C.T. compound | Sakura Finetek | 4583 | |
| Tricaine (Anestethic) | Sigma | E10521 | |
| Dyes and Antibodies | |||
| Dapi | Sigma | 10236276001 | Concentration: 1/2000 |
| Phalloidin-Atto-565 (F-actin) | Sigma | 94072 | Concentration: 1 / 500 |
| Tropomyosin (TPM1) | DHSB | CH1 | Concentration: 1 / 50 |
| Recipies/Solutions | |||
| 1x PBS | 123 mM NaCl | Sigma | |
| 2.7 mM KCl | Sigma | ||
| 10 mM Na2HPO4 | Sigma | ||
| 1.8 mM KH2PO4 | Sigma | ||
| AFOG solution | 3 g Fuchsin | Fisher Scientific | |
| 2 g Orange G | Sigma | ||
| 1 g Anilin blue | Fulka AG | ||
| 200 ml acifidied distilled H2O (pH 1.1) |
References
- Muneoka, K., Allan, C. H., Yang, X., Lee, J., Han, M. Mammalian regeneration and regenerative medicine. Birth Defects Research Part C: Embryo Today: Reviews. 84 (4), 265-280 (2008).
- Carlson, B. M. Some principles of regeneration in mammalian systems. Anatomical Record. Part B, New Anatomist. 287 (1), 4-13 (2005).
- Dumont, N. A., Bentzinger, C. F., Sincennes, M. -. C., Rudnicki, M. A. Satellite cells and skeletal muscle regeneration. Comprehensive Physiology. 5 (3), 1027-1059 (2015).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692 (2021).
- Tulenko, F. J., Currie, P., Cartner, S. C. Zebrafish myology. The Zebrafish in Biomedical Research. , 115-121 (2020).
- Siegel, A. L., Gurevich, D. B., Currie, P. D. A myogenic precursor cell that could contribute to regeneration in zebrafish and its similarity to the satellite cell. The FEBS Journal. 280 (17), 4074-4088 (2013).
- Corona, B. T., Wenke, J. C., Ward, C. L. Pathophysiology of volumetric muscle loss injury. Cells Tissues Organs. 202 (3-4), 180-188 (2016).
- Pfefferli, C., Jaźwińska, A. The art of fin regeneration in zebrafish. Regeneration. 2 (2), 72-83 (2015).
- Sehring, I. M., Weidinger, G. Recent advancements in understanding fin regeneration in zebrafish. WIREs Developmental Biology. 9 (1), 367 (2020).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298 (5601), 2188-2190 (2002).
- Sanz-Morejón, A., Mercader, N. Recent insights into zebrafish cardiac regeneration. Current Opinion in Genetics & Development. 64, 37-43 (2020).
- Chassot, B., Pury, D., Jaźwińska, A. Zebrafish fin regeneration after cryoinjury-induced tissue damage. Biology Open. 5 (6), 819-828 (2016).
- Chablais, F., Veit, J., Rainer, G., Jaźwińska, A. The zebrafish heart regenerates after cryoinjury-induced myocardial infarction. BMC Developmental Biology. 11, 21 (2011).
- Schnabel, K., Wu, C. C., Kurth, T., Weidinger, G. Regeneration of cryoinjury induced necrotic heart lesions in zebrafish is associated with epicardial activation and cardiomyocyte proliferation. PLoS One. 6 (4), e18503 (2011).
- Gonzalez-Rosa, J. M., Martin, V., Peralta, M., Torres, M., Mercader, N. Extensive scar formation and regression during heart regeneration after cryoinjury in zebrafish. Development. 138 (9), 1663-1674 (2011).
- Ryan, R., Moyse, B. R., Richardson, R. J. Zebrafish cardiac regeneration-Looking beyond cardiomyocytes to a complex microenvironment. Histochemistry and Cell Biology. 154 (5), 533-548 (2020).
- Jaźwińska, A., Sallin, P. Regeneration versus scarring in vertebrate appendages and heart. Journal of Pathology. 238 (2), 233-246 (2016).
- Alexander, R. The orientation of muscle fibres in the myomeres of fishes. Journal of the Marine Biological Association of the United Kingdom. 49, 163-290 (1969).
- Morin-Kensicki, E. M., Melancon, E., Eisen, J. S. Segmental relationship between somites and vertebral column in zebrafish. Development. 129 (16), 3851-3860 (2002).
- Berberoglu, M. A., et al. Satellite-like cells contribute to pax7-dependent skeletal muscle repair in adult zebrafish. Developmental Biology. 424 (2), 162-180 (2017).
- Montandon, M., Currie, P. D., Ruparelia, A. A. Examining muscle regeneration in zebrafish models of muscle disease. Journal of Visualized Experiments. (167), e62071 (2021).
- Pipalia, T. G., et al. Cellular dynamics of regeneration reveals role of two distinct Pax7 stem cell populations in larval zebrafish muscle repair. Disease Models & Mechanisms. 9 (6), 671-684 (2016).
- Ratnayake, D., et al. Macrophages provide a transient muscle stem cell niche via NAMPT secretion. Nature. 591 (7849), 281-287 (2021).
- Kaliya-Perumal, A. -. K., Ingham, P. W. Musculoskeletal regeneration: A zebrafish perspective. Biochimie. 196, 171-181 (2022).
- Aleström, P., et al. Zebrafish: Housing and husbandry recommendations. Laboratory Animals. 54 (3), 213-224 (2019).
- Saera-Vila, A., et al. Myocyte dedifferentiation drives extraocular muscle regeneration in adult zebrafish. Investigative Ophthalmology & Visual Science. 56 (8), 4977-4993 (2015).
- Baust, J. G., Gage, A. A. The molecular basis of cryosurgery. BJU International. 95 (9), 1187-1191 (2005).
- Galluzzi, L., et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death and Differentiation. 25 (3), 486-541 (2018).
- Chablais, F., Jaźwińska, A. Induction of myocardial infarction in adult zebrafish using cryoinjury. Journal of Visualized Experiments. (62), e3666 (2012).
- Chablais, F., Jaźwińska, A. The regenerative capacity of the zebrafish heart is dependent on TGFbeta signaling. Development. 139 (11), 1921-1930 (2012).
- Bise, T., Sallin, P., Pfefferli, C., Jaźwińska, A. Multiple cryoinjuries modulate the efficiency of zebrafish heart regeneration. Scientific Reports. 10 (1), 11551 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved