Method Article
Ein Kryoverletzungsmodell zur Untersuchung der Skelettmuskelregeneration des Schwanzstiels bei erwachsenen Zebrafischen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt ein Kryoverletzungsmodell, um eine tiefgreifende Schädigung mehrerer kaudaler Myomere in erwachsenen Zebrafischen zu induzieren. Diese Methode bietet einen neuen Ansatz zur Untersuchung der Skelettmuskelregeneration nach starkem Gewebeverlust bei Nicht-Säugetier-Wirbeltieren.
Zusammenfassung
Die Skelettmuskulatur wird nach kleineren Verletzungen durch die Aktivierung satellitenähnlicher Stammzellen erneuert und wiederhergestellt. Schwere Verletzungen der Muskulatur führen beim Menschen häufig zu einer Fibrose. Im Vergleich zu Säugetieren besitzen Zebrafische eine höhere angeborene Fähigkeit zur Organregeneration, was ein leistungsfähiges Modell für die Untersuchung der Gewebewiederherstellung nach einer ausgedehnten Schädigung des Organs darstellt. In dieser Arbeit wird ein Kryoverletzungsmodell beschrieben, das bei erwachsenen Zebrafischen eine tiefgreifende Schädigung von vier Myomeren des Schwanzstiels induziert. Eine speziell angefertigte Kryosonde wurde entwickelt, um sich der Körperform anzupassen und die seitliche Muskulatur von der Haut bis zur Mittellinie reproduzierbar zu verletzen. Wichtig ist, dass die Unversehrtheit des Körpers intakt blieb und die Fische ihre Schwimmaktivität fortsetzten. Veränderungen der Skelettmuskulatur wurden durch histologische Färbung und Fluoreszenzfärbung von Sarkomerproteinen auf Gewebeschnitten beurteilt. Diese Methode wird neue Wege der Forschung eröffnen, die darauf abzielen, zu verstehen, wie die Degeneration der Skelettmuskulatur reparative Reaktionen und damit die Reaktivierung des myogenen Programms im erwachsenen Zebrafisch induziert.
Einleitung
Bei Wirbeltieren werden geschädigte Teile verschiedener Gewebe im Laufe des Lebens homöostatisch erneuert und wiederhergestellt. Diese Fähigkeit zur Erneuerung und Wiederherstellung hängt typischerweise vom Vorhandensein kompetenter Stammzellen oder von der Proliferationsfähigkeit der reifen Zellen ab 1,2. Die Skelettmuskulatur besteht aus postmitotischen Myofasern, die mit lokalen Stammzellen, den Satellitenzellen 3,4,5,6, assoziiert sind. So enthält dieses Gewebe zelluläre Quellen für die effiziente Versiegelung von Bereichen mit unterbrochener Kontinuität oder für die Reparatur kleinerer Wunden. Auf größere volumetrische Verluste in der Skelettmuskulatur von Säugetieren folgt jedoch häufig eine nicht-regenerative Reparatur, wie z. B. Fibrose7. Tiermodelle könnten neue Einblicke in die biologischen Mechanismen liefern, die die Regeneration großflächig geschädigter Organe begünstigen.
Der Zebrafisch ist ein etablierter Modellorganismus mit hoher Regenerationsfähigkeit. Erwachsene Zebrafische können einen amputierten Teil ihrer Schwanzflosse oder die resezierte Spitze des Herzventrikels regenerieren 8,9,10,11. Darüber hinaus wurde bereits eine Kryoverletzungsmethode angewendet, um die Flossen- und Herzregeneration bei Zebrafischen zu untersuchen12,13,14,15. Bei inneren Organen hat die Kryoverletzungsmethode den Vorteil, dass sie den Zelltod induziert, ohne die Organintegrität zu stören, und so physiologische Bedingungen nachahmt16,17. Gewebetrümmer werden während der Wundheilung durch natürliche Räumung abgebaut, gefolgt von den Reparaturprozessen. Ob diese Methode jedoch auf die Skelettmuskulatur angewendet werden kann, muss noch geklärt werden.
Bei Fischen ermöglicht die seitliche Muskulatur die seitliche Beugung des Rüssels während des Schwimmens18. Die Skelettmuskulatur ist in metameren Einheiten, den sogenannten Myomeren, organisiert, die durch Bindegewebe getrennt sind 5,19. Zebrafische können ihren Muskel nach kleineren Gewebestörungen, wie sie durch Laserablation oder eine Stichwunde verursacht werden, regenerieren 20,21,22,23,24, aber ob sich ganze Myomere nach einer ausgedehnten Verletzung regenerieren können, ist unbekannt. Diese Wissenslücke ist wahrscheinlich auf das Fehlen eines geeigneten Verletzungsmodells zurückzuführen. Dieses Protokoll etabliert einen neuen Ansatz, um eine ausgedehnte Verletzung des Skelettmuskels zu induzieren, die sich über mehrere Myomere erstreckt. Die beschriebene Kryoverletzungsmethode basiert auf dem schnellen Einfrieren und Auftauen der Myofasern mit einem vorgekühlten Edelstahlinstrument. Trotz der umfangreichen Schäden wurde das Wohlbefinden der Fische nicht stark beeinträchtigt. Ganze Myomere konnten wiederhergestellt werden, so dass diese Arbeit ein neues Modellsystem zur Untersuchung der Mechanismen der Muskelregeneration im adulten Zebrafisch darstellt.
Protokoll
Diese Studie wurde in Übereinstimmung mit allen relevanten ethischen Vorschriften durchgeführt. Die Zebrafische wurden in Übereinstimmung mit den Richtlinien der Federation of European Laboratory Animal Science Associations (FELASA)25 gezüchtet, aufgezogen und gepflegt. Die Unterbringung und alle Versuchsverfahren wurden vom kantonalen Veterinäramt Freiburg bewilligt.
1. Ausstattung und Einrichtung
- Veranlassen Sie die Herstellung einer Kryosonde aus Edelstahl in einer technischen Werkstatt, in der Instrumente für die Forschung hergestellt werden können.
HINWEIS: Geben Sie einen Entwurf des Instruments mit den spezifischen Abmessungen an (Abbildung 1A). - Um Erfrierungen bei der Handhabung der Sonde während des Eingriffs zu vermeiden, führen Sie den Griff in eine Pipettenspitze ein und wickeln Sie ihn mit Klebeband ein.
- Bereiten Sie ein Becherglas für die Anästhesiearbeitslösung, einen Löffel für den Umgang mit dem Fisch, einen feuchten Schwamm und einen Tank mit Systemwasser vor, damit sich die Fische nach dem Eingriff erholen können.
- Bereiten Sie die Arbeitslösung vor jedem Experiment frisch zu. Zur Herstellung der Arbeitslösung werden 4 ml Tricain-Stammlösung zu 100 ml Systemwasser in ein Becherglas gegeben.
HINWEIS: Die Anästhesie-Stammlösung besteht aus 4 g Tricain, gelöst in 980 ml destilliertem Wasser. Nachdem Sie den pH-Wert mit 1 M Tris-HCl, pH 9 auf 7 eingestellt haben, füllen Sie die Lösung auf 1 l mit destilliertem Wasser auf. Die Stammlösung ist lichtempfindlich und sollte bei 4 °C in einer Braunflasche gelagert werden.
2. Verfahren zur Kryoverletzung von Muskeln
- Beginnen Sie den Vorgang, indem Sie die Sonde mindestens 3 Minuten lang in flüssigen Stickstoff tauchen. Befeuchten Sie den Schwamm mit Systemwasser und legen Sie ihn auf eine ebene Fläche.
- Übertragen Sie einen einzelnen erwachsenen Zebrafisch in die Tricain-Arbeitslösung und bestätigen Sie, dass er nicht reagiert, indem Sie den Fisch nach 1 oder 2 Minuten vorsichtig mit dem Löffel berühren. Wenn der Fisch immer noch reaktiv ist, warten Sie etwas länger.
- Legen Sie den betäubten Fisch auf den nassen Schwamm. Lokalisieren Sie den Schwanzstiel hinter der Afterflosse und vor der Schwanzflosse.
- Entfernen Sie die Kryosonde aus dem flüssigen Stickstoff. Schütteln Sie die Sonde vorsichtig, um sicherzustellen, dass kein flüssiger Stickstoffrest auf der Spitze verbleibt.
- Legen Sie den Rand des Spatels senkrecht zum Körper auf den Schwanzstiel (Abbildung 1C). Halten Sie die Sonde 6 s lang in dieser Position, ohne Druck auszuüben (Abbildung 1D).
Anmerkungen: Das Gewicht der Kryosonde reicht aus, um den Kontakt zwischen dem Instrument und dem Gewebe zu gewährleisten. - Lösen Sie die Kryosonde aus dem Gewebe und setzen Sie den Fisch mit Systemwasser in das Aquarium um.
- Beobachten Sie den Fisch, während er nach dem Aufwachen aus der Narkose wieder atmet und schwimmt. Wenn nach 30 s keine operativen Bewegungen auftreten, stimulieren Sie den Fisch, indem Sie Systemwasser in die Kiemen pipettieren, bis das Tier von selbst die Atmung einleitet.
Anmerkungen: Der Fisch sollte innerhalb weniger Minuten im Auffangbecken wieder schwimmen.
HINWEIS: In den folgenden Tagen können die Fische gefilmt werden, um ihre Schwimmaktivität zu überwachen (Video 1 und Video 2). Übertragen Sie vor der Videoaufzeichnung die Kontrolle und die verletzten Fische in ein durchscheinendes Paarungsbecken und lassen Sie sie mindestens 1 Minute lang eingewöhnen.
3. Schwanzstielentnahme und Fixierung
- Bereiten Sie 2 ml 4%iges Formalin oder ein anderes Fixiermittel, das für die nachfolgenden Assays geeignet ist, eine Petrischale, eine Pinzette und eine chirurgische Schere vor.
- Einschläfern Sie die Fische zu einem ausgewählten Zeitpunkt nach der Kryoverletzung gemäß der gesetzlichen Genehmigung des regionalen Veterinäramtes ein.
HINWEIS: Die Euthanasie wird durch eine Überdosierung von Tricainlösung (300 mg/L) für ca. 10 Minuten durchgeführt. Der Verlust der Kiemenbewegung und der Schwanzflossen-Quetschreflex bestätigen den Tod. Die Zeitpunkte der Euthanasie sollten entsprechend der Phase der Regeneration gewählt werden: z. B. von 1 Tag nach der Kryoverletzung (dpci) bis 3 dpci für die Wundbeseitigung; von 3 dpci bis 10 dpci für die Einleitung der Muskelregeneration; von 10 dpci bis 30 dpci für eine fortschreitende Regeneration; und nach 30 dpci für den Abschluss der Gewebewiederherstellung. Um die verschiedenen Schritte und biologischen Prozesse der Muskeldegeneration und -regeneration beurteilen zu können, müssen daher Gruppen von Fischen zu verschiedenen Zeitpunkten nach der Kryoverletzung eingeschläfert werden. - Legen Sie den eingeschläferten Fisch in eine Petrischale mit deionisiertem Wasser. Verwenden Sie eine Schere, um den Körper vor und hinter dem Schwanzstiel zu durchtrennen (Abbildung 1E). Lassen Sie das Gewebe im deionisierten Wasser der Petrischale ausbluten.
- Sammeln Sie den Schwanzstiel und übertragen Sie ihn mit einer Pinzette in die vorbereitete Fixierlösung in einem Mikrozentrifugenröhrchen.
Anmerkungen: Drehen Sie die Röhrchen mehrmals vorsichtig um und bewahren Sie sie über Nacht bei 4 °C auf.
4. Montage des Schwanzstiels
- Waschen Sie das fixierte Taschentuch in 1x PBS für 10 min auf einer Wippe. Übertragen Sie es dann in ein 2-ml-Mikrozentrifugenröhrchen mit vorgekühlter 30%iger Saccharose in deionisiertem Wasser bei 4 °C und drehen Sie das Röhrchen mehrmals vorsichtig um. Lassen Sie die Mikrozentrifugenröhrchen mindestens 24 h bei 4 °C in aufrechter Position.
Anmerkungen: Der Schwanzstiel schwimmt auf der Saccharoselösung und beginnt zu sinken, wenn das Gewebe austrocknet. - Füllen Sie eine Einbettform mit einer 5 mm dicken Schicht O.C.T.-Einbettmedium. Verwenden Sie eine Pinzette, um den Schwanzstiel im Medium zu justieren. Platzieren Sie es am unteren Rand der Form und passen Sie seine Ausrichtung für transversale oder koronale Abschnitte an (Abbildung 1F).
- Lassen Sie das Medium in einer Schachtel Trockeneis gefrieren. Sobald das Gewebe in der gewünschten Position stabilisiert ist, füllen Sie den Rest der Form auf, bevor der O.C.T. vollständig zufriert. Lagern Sie die Form mindestens 1 h bei −80 °C.
HINWEIS: Unter diesen Bedingungen können die Gewebe viele Monate gelagert werden.
5. Schneiden der Abschnitte mit einem Kryostaten
- Richten Sie einen Kryostaten mit einer Schnittdicke von 25 μm ein. Stellen Sie die Kammertemperatur auf −26 °C, die Probentemperatur auf −24 °C und den Schnittwinkel auf 12 °C ein.
- Legen Sie den gefrorenen Block mit der Probe in den Kryostaten und fixieren Sie seine Ausrichtung, um parallel zum Boden des Blocks zu schneiden. Schneiden Sie, bis Sie die Probe erreichen, und schneiden Sie dann den Block ab, um die Probenentnahme zu erleichtern.
- Bereiten Sie sechs Adhäsionsfolien vor. Beschriften Sie die Objektträger mit fortlaufenden Nummern, um Replikate der Probe herzustellen.
- Beginnen Sie mit dem Schneiden und sammeln Sie die Gewebeabschnitte auf den beschrifteten Objektträgern. Ordnen Sie die Abschnitte auf den Folien entsprechend den weiteren experimentellen Anforderungen an.
- Lassen Sie die Objektträger 1 h bei Raumtemperatur trocknen. Lagern Sie sie in geschlossenen Schachteln bei −20 °C.
HINWEIS: Die Objektträger können in diesem Zustand bis zu 1 Jahr sicher gelagert werden.
Ergebnisse
Überwachung der Fische nach Kryoverletzung
Um die Wirkung der Myomerkryoverletzung auf Tiere zu bestimmen, wurde eine Videoaufzeichnung von Kontroll- und kryoverletzten Fischen 1 Tag nach Kryoverletzung (dpci) und 5 dpci durchgeführt. Jede Gruppe enthielt fünf Fische. Bei 1 dpci schwammen die kryoverletzten Fische weniger aktiv, zeigten aber keine abnormalen Bewegungen wie Wirbeln, Faltungen oder Gleichgewichtsstörungen (Video 1). Im Haltungssystem ähnelten ihre Position im Becken und die Nahrungsaufnahme denen der unverletzten Fische. Das normale Verhalten hielt in den folgenden Tagen an, wie das Video bei 5 dpci (Video 2) zeigt. Zusammenfassend lässt sich sagen, dass die Kryoverletzung des Schwanzstiels das Wohlbefinden der Tiere nicht gravierend beeinträchtigte.
Histologische Analyse der kaudalen Stielschnitte
Um das Ausmaß der Verletzung zu beurteilen, wurde der Zeitpunkt von 4 dpci gewählt, da dies der Zeitpunkt ist, an dem die Myofasertrümmer vollständig in der Wunde resorbiert wurden. Um die Auswirkungen einer Kryoverletzung entlang der dorso-ventralen und der anterior-posterioren Körperachse zu analysieren, wurden zwei Gruppen von Fischen verwendet (d. h. koronale bzw. transversale Abschnitte des kaudalen Stiels) (Abbildung 1F).
Die Schnitte wurden mittels Trichrom-Färbung aus Anilinblau, saurem Fuchsin und Orange G (AFOG) analysiert. Mit dieser Kombination von Reagenzien wurden intakte Muskeln in Orange, das Rückenmark in Dunkelrot und die kollagene Matrix in Blau dargestellt. Um die Anzahl der geschädigten Myomere, die metameren Einheiten der Fischmuskulatur, zu bestimmen, wurde eine Reihe von Schnitten analysiert (Abbildung 2). Myomergrenzen, Myocomata genannt, wurden durch Kollagenablagerung identifiziert, was durch die Blaufärbung nachgewiesen wurde. Die beschädigten Stellen wurden durch das Fehlen einer orangefarbenen Färbung bestimmt. Eine genauere Untersuchung von Proben mit deutlichen Myokomata ergab, dass etwa vier aufeinanderfolgende Myomere geschädigt waren, was aus der fehlenden orangefarbenen Färbung geschlossen wurde (n, Anzahl der Fische = 4; Abbildung 3A,A'). Die unverletzte Seite desselben Fisches diente als interne Referenz.
Um die Tiefe der Wunde senkrecht zur Körperachse zu untersuchen, wurden Querschnitte mit Zebrafischen bei 4 dpci und 7 dpci präpariert. Letzterer Zeitpunkt entspricht der Aktivierung des myogenen Programms und damit dem Beginn der Muskelregeneration. Die AFOG-Färbung dieser Proben zeigte einen weitgehenden Mangel an orangefarbener Färbung in der kryoverletzten Flanke des Körpers, wodurch die Zone der degenerierten Skelettmuskulatur abgegrenzt wurde (Abbildung 3B,C). Bei 4 dpci und 7 dpci erstreckte sich der Wundbereich von der Haut in Richtung des vertikalen Septums. Dies zeigt, dass die Kryoverletzungsmethode tief auf eine laterale Hälfte des Schwanzstiels abzielte, die nach dem Eingriff 7 Tage lang ohne funktionelle Muskeln blieb. Insgesamt waren vier Myomere auf einer Seite des kaudalen Stiels stark geschädigt.
Immunfluoreszenzanalyse der Transversalschnitte
Um die Dynamik der Muskelregeneration zu beurteilen, wurden experimentelle Gruppen von Fischen bei 4 dpci, 7 dpci, 10 dpci und 30 dpci euthanasiert. Die transversalen Schnitte des Schwanzstiels wurden durch mehrfarbige Fluoreszenzfärbung mit Phalloidin (das an filamentöses Aktin [F-Aktin]), Tropomyosin-1-Antikörper, das ein Sarkomerprotein nachweist, und DAPI, das Zellkerne markiert, markiert. Zu allen Zeitpunkten sorgte die unverletzte Körperhälfte für eine innere Kontrolle; Sowohl F-Aktin als auch Tropomyosin 1 wurden in den unverletzten Kontrollteilen stark nachgewiesen, was auf ungeschädigtes Gewebe hindeutet (Abbildung 4).
Bei 4 dpci enthielt die verletzte Seite des kaudalen Stiels reichlich DAPI-positive Zellen, aber es wurde wenig bis gar keine Immunfluoreszenz von F-Aktin und Tropomyosin 1 beobachtet, was auf die Wundzone mit degenerierten Muskeln hindeutet (Abbildung 4A-B'). Bei 7 dpci konnten Tropomyosin 1 und F-Aktin in einem Teil der Wunde nahe der vertikalen Körpermittellinie nachgewiesen werden (Abbildung 4C-D'). Dieses Expressionsmuster markiert die Stelle, an der die Bildung neuer Myofasern im Schwanzstiel beginnt. Bei 10 dpci dehnten sich beide Muskelmarker in Richtung Körperoberfläche aus, was auf eine fortschreitende Regeneration der Skelettmuskulatur hindeutet (Abbildung 4E-F'). Bei 30 dpci zeigten beide Körperseiten eine ähnliche Verteilung der F-Aktin-Färbung (Abbildung 4G-H'). Dieser Befund deutet darauf hin, dass der Skelettmuskel nach der Kryoverletzung des Schwanzstiels effizient wiederhergestellt wurde.
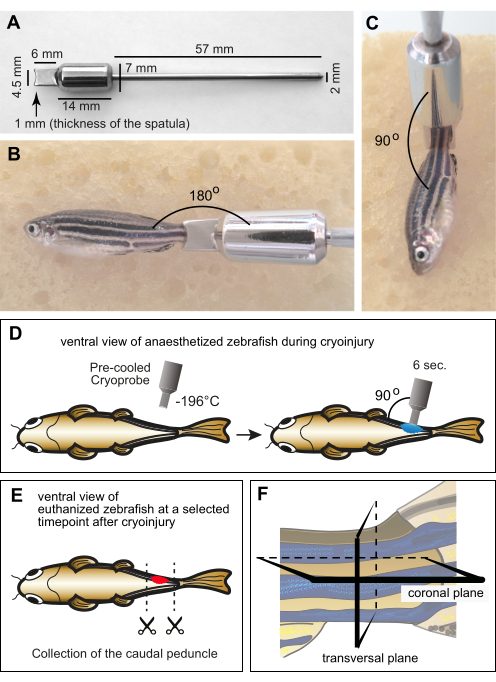
Abbildung 1: Versuchsaufbau für die Myomerkryoverletzung. (A) Abmessungen der speziell angefertigten Kryosonde aus Edelstahl. Der distale Teil des Instruments besteht aus einem Spatel mit einer konkaven Kante in der Tiefe von 1 mm, um der Krümmung des Zebrafischkörpers Rechnung zu tragen. Der mittlere Teil des Werkzeugs besteht aus einem Zylinder, der als Gewicht und Reservoir fungiert, um die niedrige Temperatur des Spatels während des Eingriffs aufrechtzuerhalten. Das proximale Ende des Instruments hat die Form eines dünnen Metallgriffs. (B,C) Betäubte erwachsene Fische auf einem feuchten Schwamm mit der Kryosonde am Schwanzstiel. Die Sonde hatte Raumtemperatur. (B) Der Rand der Sonde wird horizontal in der Nähe des Schwanzstiels platziert, um die relative Größe zwischen dem Fisch und dem Werkzeug anzuzeigen. (C) Bei Kryoverletzungen wird die Spitze des Werkzeugs senkrecht zum Fisch positioniert. (D) Schematische Darstellung des Kryoverletzungsverfahrens von der ventralen Seite des Fisches, um die Manipulationen umfassend zu zeigen. Die Kryosonde wurde in flüssigem Stickstoff vorgekühlt und sofort für 6 s auf eine Seite des Fisches gelegt. (E) Zu einem bestimmten Zeitpunkt nach der Kryoverletzung wurden die Fische eingeschläfert und ihre Schwanzstiele zur Fixierung gesammelt. (F) Das fixierte Material wurde histologisch aufbereitet und entlang der koronalen oder transversalen Ebene geschnitten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
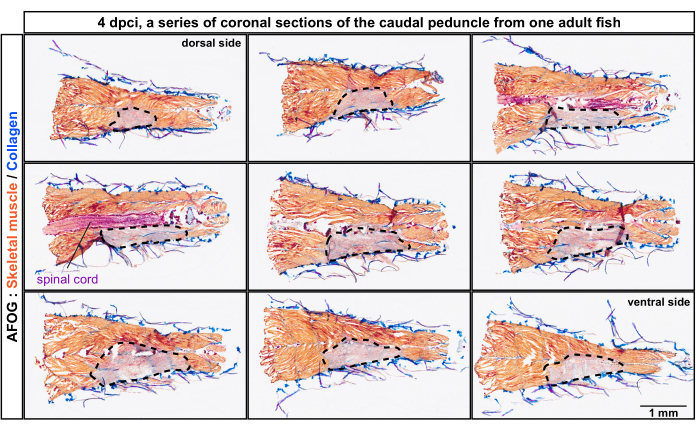
Abbildung 2: Histologische Analyse geschädigter Myomere im kaudalen Stiel von der dorsalen zur ventralen Position des Körpers. AFOG-Färbung einer Reihe von koronalen Schnitten 4 Tage nach Kryoverletzung (dpci). Die Abschnitte verlaufen von der dorsalen zur ventralen Seite, wie oben auf der ersten und letzten Tafel angegeben. Die Abschnitte sind nicht benachbart, mit einem Abstand von ca. 150 μm zwischen ihnen. Der unverletzte Muskel wird durch eine orangefarbene Färbung des Muskels erkannt, während das verletzte Gewebe diese Färbung nicht aufweist und gräulich erscheint (Bereich mit einer gestrichelten Linie). Kollagenhaltiges Gewebe, wie z. B. die Haut, wird blau gefärbt. Das Rückenmark erscheint als stäbchenartige Struktur und ist rot gefärbt. Anzahl der Fische, n = 4. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
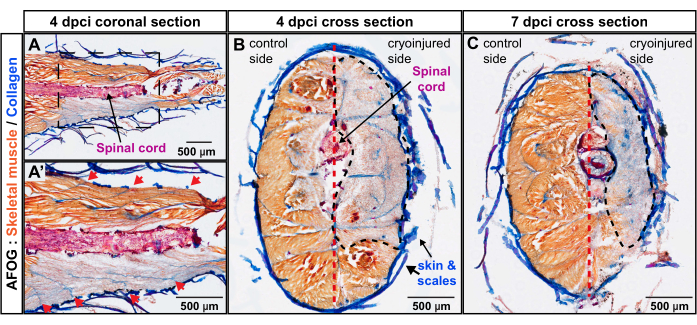
Abbildung 3: Beurteilung der Verletzungstiefe im Schwanzstiel mittels AFOG-Färbung. (A,A') Der koronale Schnitt befindet sich auf Höhe des Rückenmarks (ein rot gefärbter horizontaler Stab). Das untere Bild zeigt einen vergrößerten Bereich, der im oberen Bild von einem Rahmen umgeben ist. Die sequentiellen Myomergrenzen erscheinen als kollagene Streifen (blau), die schräg zum Rückenmark angeordnet sind (rote Pfeile im vergrößerten Bild A'). (B,C) Die Querschnitte zeigen die unverletzte Flanke mit orange gefärbten Muskeln und die kryoverletzte Flanke mit gräulicher Färbung. Der beschädigte Bereich ist von einer schwarzen gestrichelten Linie umgeben. Das vertikale Septum (dargestellt mit einer rot gestrichelten Linie) unterteilt den Körper in die Kontroll- und die Kryoverletztenseite. Anzahl der Fische, n = 4 pro Zeitpunkt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
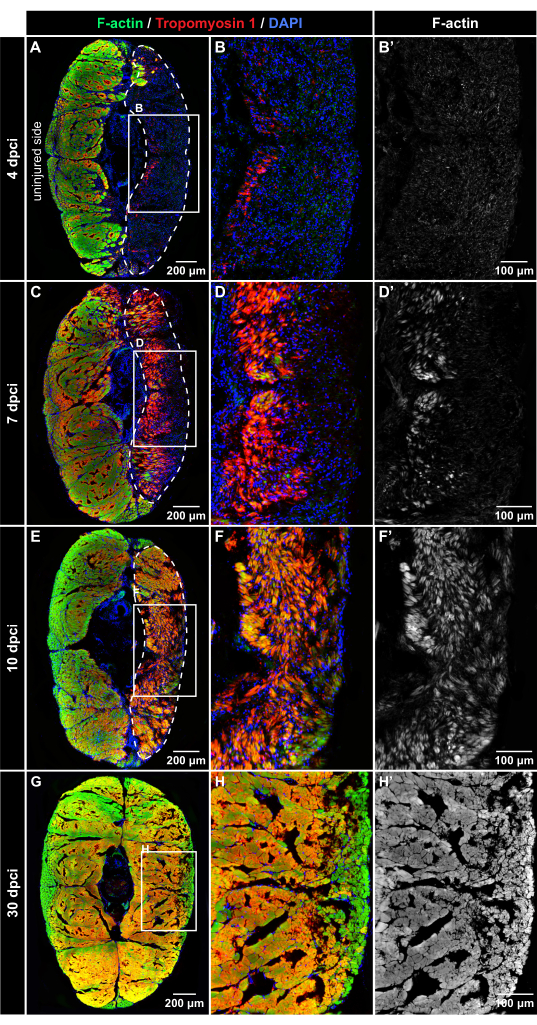
Abbildung 4: Immunfluoreszenznachweis von Muskelproteinen nach Kryoverletzung. Fluoreszenzfärbung von Querschnitten bei 4 dpci, 7 dpci, 10 dpci und 30 dpci, wie auf der linken Seite und der Oberseite der Paneele beschriftet (A-B'). Bei 4 dpci ist das verletzte Gewebe (umrandet von der gestrichelten Linie) DAPI-positiv (blau), aber frei von Phalloidin-Färbung (grün) oder Tropomyosin-1-Immunreaktivität (rot), was auf eine Degeneration der Muskelfasern nach Kryoverletzung hindeutet. (C-D') Bei 7 dpci treten beide Muskelmarker nach und nach im verwundeten Bereich auf, was auf den Regenerationsprozess hinweist. Tropomyosin-1 erscheint in den neu gebildeten Fasern intensiver als F-Aktin. (E-F') Bei 10 dpci ist die Verletzungszone mit neuen Myofasern gefüllt, die im Vergleich zu F-Aktin eine höhere Intensität der Tropomyosin-1-Immunreaktivität aufweisen. (G-H') Bei 30 dpci wird ein ähnliches Muster von Myofasern auf beiden Seiten des Körpers festgestellt. Die Rahmen in den Feldern A, C, E und H umfassen die Bereiche, die in den nebenstehenden Bildern rechts vergrößert sind. Hautschuppen, die außerhalb des Myoms fluoreszieren, wurden mit Adobe Photoshop aus den Bildern gelöscht. Anzahl der Fische, n = 4 pro Zeitpunkt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Der Zebrafisch ist ein Anamnioten-Wirbeltier-Modellorganismus, um die Mechanismen der Muskelregeneration zu untersuchen. Die meisten der existierenden Verletzungsmethoden, wie z. B. Laserablation oder Stichverletzungen, führen zu einer relativ geringen Gewebezerstörung20,21,22,23. Größere Resektionen wurden am extraokularen Muskel26 durchgeführt. Für die seitliche Muskulatur wäre dieser chirurgische Ansatz jedoch aufgrund der gesundheitlichen Gefahren durch das Durchtrennen der Körperwand wahrscheinlich weniger geeignet. Um solche invasiven Eingriffe zu vermeiden, beschreibt dieses Protokoll eine mildere Form der Verletzung, die jedoch zu einer tiefgreifenden Schädigung des Schwanzstiels führt. Dieser Ansatz beruht auf einer oberflächlichen Manipulation, die eine sehr präzise Ausrichtung auf einige Myomere auf einer Körperseite ermöglicht. Die Stärken des Kryoverletzungsmodells liegen in seiner Reproduzierbarkeit und seiner Fähigkeit, eine ausgedehnte Muskeldegeneration hervorzurufen; Basierend auf diesen Stärken bietet dieses Modell einen neuen Weg, um zu untersuchen, wie der Körper auf einen signifikanten Muskelabbau reagiert.
Die Anwendung extremer Kälte führt zu einem Temperaturschock, der die Plasmamembran und die Organellen im betroffenen Muskelgewebezerstört 27. Infolgedessen erleiden die verletzten Myofasern einen "zufälligen" Zelltod28. Folglich kann das geschädigte Gewebe durch natürliche Mechanismen der Wundbeseitigung resorbiert werden. Zebrafische vertragen das Kryoverletzungsverfahren gut, da die Überlebensrate in dieser Studie bei fast 100 % lag, wenn die vorgekühlte Sonde für die exakte Dauer korrekt am Körper positioniert war. Wenn die Wunde jedoch zu groß ist (z. B. wenn zu viel Druck ausgeübt wird oder die Dauer der Kryoverletzung zu lang ist), kann der Fisch kurz nach dem Eingriff abweichende Schwimmbewegungen zeigen, und das Tier sollte als humaner Endpunkt eingeschläfert werden. Bei anderen Fischarten sollte die Einwirkzeit auf der Kryosonde entsprechend der Körpergröße angepasst werden.
Nach einer Kryoverletzung können die Fische ihre Schwimmaktivität wieder aufnehmen, ohne dass Symptome einer abnormalen Bewegung auftreten. Kryoverletzte Fische schwimmen jedoch weniger dynamisch als Kontrollfische, was auf leichte Beeinträchtigungen hinweist. Eine weitere Quantifizierung des Verhaltens der Fische zu verschiedenen Zeitpunkten nach Kryoverletzung wird notwendig sein, um zeitliche Veränderungen in der Schwimmleistung zu bestimmen.
Die Wirkung der Kryoverletzungsmethode auf andere nicht-muskuläre Gewebe des kaudalen Stiels muss noch geklärt werden. Offensichtlich wird die äußerste Körperschicht (d.h. die Haut) durch den Eingriff geschädigt. In diesem Zusammenhang kann die Kryoverletzungsmethode eine neue Strategie zur Untersuchung der Wundheilung, der Schuppenregeneration und der Wiederherstellung des Pigmentierungsmusters bieten. Darüber hinaus könnten auch das Gefäßsystem und die Innervation der Myomere durch Kryoverletzungen beeinträchtigt werden, und diese Themen bedürfen weiterer Untersuchungen.
Das Kryoverletzungsmodell wurde bereits zur Untersuchung der Herzregeneration von Zebrafischen verwendet13,14,15,29. Diese Methode zeigte einige Vorteile gegenüber der ventrikulären Resektionsmethode10 aufgrund der vorübergehenden Ablagerung einer kollagenreichen Narbe, die die Infarktheilungsreaktion beim Menschen besser nachahmt30. Bemerkenswert ist, dass Zebrafische ihr Herz nach mehreren Kryoverletzungen regenerieren können31. Interessanterweise wurde die Kryoverletzung auch an der Zebrafischflosse angewendet, was zu histolytischen Prozessen führte12. Im Gegensatz zur klassischen Flossenamputation enthält der verbleibende kryoverletzte Stumpf einen verzerrten Rand mit einer Mischung aus totem Material und gesunden Zellen. Untersuchungen mit beiden Zebrafischorganen, dem Herzen und der Flosse, haben gezeigt, dass Zebrafische auch nach umfangreichen Gewebeschäden in der Lage sind, ihre ursprünglichen Funktionsbestandteile wiederherzustellen. Ob der kryoverletzte Skelettmuskel ein Wechselspiel zwischen reparativen und regenerativen Prozessen aktiviert, bedarf zukünftiger Studien.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken V. Zimmermann für die Fischpflege sowie Dr. Thomas Bise, Dr. Catherine Pfefferli und Lea Gigon für die Initiierung dieses Projekts und ihre vorläufigen Ergebnisse. Diese Arbeit wurde vom Schweizerischen Nationalfonds unterstützt, Förderkennzeichen 310030_208170.
Materialien
| Name | Company | Catalog Number | Comments |
| Program | |||
| ImageJ | National Institutes of Health (NIH) | ||
| Photoshop Version 23.5.3 | Adobe | ||
| Material/ Equipment | |||
| 35/10 mm Petri Dish | Greiner Bio-one | Item No.: 627102 | |
| Camera | Sony | / | HDR-PJ410 |
| Cryostat | Histcom | HRA C50 | |
| Formaldehyde ~36% | Sigma-Aldrich | 47630 | |
| Macro 50 mm f/2.8 EX DG lens | Sigma | / | Discontinued lense |
| Peel-A-Way Embedding Truncated Molds T8 | Polyscience, Inc. | 18985 | |
| Slides Superfrost Plus | Fisher Scientific | 12-550-15 | |
| Sponge | any | any | flat sponge, c.a. 7cm x 3 cm x 1 cm |
| Stainless steel cryoprobe | Custom-made | / | specifics in the article |
| Sucrose | Sigma-Aldrich | 84100 | |
| Surgical scissors | Any | / | |
| TCS SP2 | Leica | / | Discontinoued product |
| Tissue-Tek O.C.T. compound | Sakura Finetek | 4583 | |
| Tricaine (Anestethic) | Sigma | E10521 | |
| Dyes and Antibodies | |||
| Dapi | Sigma | 10236276001 | Concentration: 1/2000 |
| Phalloidin-Atto-565 (F-actin) | Sigma | 94072 | Concentration: 1 / 500 |
| Tropomyosin (TPM1) | DHSB | CH1 | Concentration: 1 / 50 |
| Recipies/Solutions | |||
| 1x PBS | 123 mM NaCl | Sigma | |
| 2.7 mM KCl | Sigma | ||
| 10 mM Na2HPO4 | Sigma | ||
| 1.8 mM KH2PO4 | Sigma | ||
| AFOG solution | 3 g Fuchsin | Fisher Scientific | |
| 2 g Orange G | Sigma | ||
| 1 g Anilin blue | Fulka AG | ||
| 200 ml acifidied distilled H2O (pH 1.1) |
Referenzen
- Muneoka, K., Allan, C. H., Yang, X., Lee, J., Han, M. Mammalian regeneration and regenerative medicine. Birth Defects Research Part C: Embryo Today: Reviews. 84 (4), 265-280 (2008).
- Carlson, B. M. Some principles of regeneration in mammalian systems. Anatomical Record. Part B, New Anatomist. 287 (1), 4-13 (2005).
- Dumont, N. A., Bentzinger, C. F., Sincennes, M. -. C., Rudnicki, M. A. Satellite cells and skeletal muscle regeneration. Comprehensive Physiology. 5 (3), 1027-1059 (2015).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692 (2021).
- Tulenko, F. J., Currie, P., Cartner, S. C. Zebrafish myology. The Zebrafish in Biomedical Research. , 115-121 (2020).
- Siegel, A. L., Gurevich, D. B., Currie, P. D. A myogenic precursor cell that could contribute to regeneration in zebrafish and its similarity to the satellite cell. The FEBS Journal. 280 (17), 4074-4088 (2013).
- Corona, B. T., Wenke, J. C., Ward, C. L. Pathophysiology of volumetric muscle loss injury. Cells Tissues Organs. 202 (3-4), 180-188 (2016).
- Pfefferli, C., Jaźwińska, A. The art of fin regeneration in zebrafish. Regeneration. 2 (2), 72-83 (2015).
- Sehring, I. M., Weidinger, G. Recent advancements in understanding fin regeneration in zebrafish. WIREs Developmental Biology. 9 (1), 367 (2020).
- Poss, K. D., Wilson, L. G., Keating, M. T. Heart regeneration in zebrafish. Science. 298 (5601), 2188-2190 (2002).
- Sanz-Morejón, A., Mercader, N. Recent insights into zebrafish cardiac regeneration. Current Opinion in Genetics & Development. 64, 37-43 (2020).
- Chassot, B., Pury, D., Jaźwińska, A. Zebrafish fin regeneration after cryoinjury-induced tissue damage. Biology Open. 5 (6), 819-828 (2016).
- Chablais, F., Veit, J., Rainer, G., Jaźwińska, A. The zebrafish heart regenerates after cryoinjury-induced myocardial infarction. BMC Developmental Biology. 11, 21 (2011).
- Schnabel, K., Wu, C. C., Kurth, T., Weidinger, G. Regeneration of cryoinjury induced necrotic heart lesions in zebrafish is associated with epicardial activation and cardiomyocyte proliferation. PLoS One. 6 (4), e18503 (2011).
- Gonzalez-Rosa, J. M., Martin, V., Peralta, M., Torres, M., Mercader, N. Extensive scar formation and regression during heart regeneration after cryoinjury in zebrafish. Development. 138 (9), 1663-1674 (2011).
- Ryan, R., Moyse, B. R., Richardson, R. J. Zebrafish cardiac regeneration-Looking beyond cardiomyocytes to a complex microenvironment. Histochemistry and Cell Biology. 154 (5), 533-548 (2020).
- Jaźwińska, A., Sallin, P. Regeneration versus scarring in vertebrate appendages and heart. Journal of Pathology. 238 (2), 233-246 (2016).
- Alexander, R. The orientation of muscle fibres in the myomeres of fishes. Journal of the Marine Biological Association of the United Kingdom. 49, 163-290 (1969).
- Morin-Kensicki, E. M., Melancon, E., Eisen, J. S. Segmental relationship between somites and vertebral column in zebrafish. Development. 129 (16), 3851-3860 (2002).
- Berberoglu, M. A., et al. Satellite-like cells contribute to pax7-dependent skeletal muscle repair in adult zebrafish. Developmental Biology. 424 (2), 162-180 (2017).
- Montandon, M., Currie, P. D., Ruparelia, A. A. Examining muscle regeneration in zebrafish models of muscle disease. Journal of Visualized Experiments. (167), e62071 (2021).
- Pipalia, T. G., et al. Cellular dynamics of regeneration reveals role of two distinct Pax7 stem cell populations in larval zebrafish muscle repair. Disease Models & Mechanisms. 9 (6), 671-684 (2016).
- Ratnayake, D., et al. Macrophages provide a transient muscle stem cell niche via NAMPT secretion. Nature. 591 (7849), 281-287 (2021).
- Kaliya-Perumal, A. -. K., Ingham, P. W. Musculoskeletal regeneration: A zebrafish perspective. Biochimie. 196, 171-181 (2022).
- Aleström, P., et al. Zebrafish: Housing and husbandry recommendations. Laboratory Animals. 54 (3), 213-224 (2019).
- Saera-Vila, A., et al. Myocyte dedifferentiation drives extraocular muscle regeneration in adult zebrafish. Investigative Ophthalmology & Visual Science. 56 (8), 4977-4993 (2015).
- Baust, J. G., Gage, A. A. The molecular basis of cryosurgery. BJU International. 95 (9), 1187-1191 (2005).
- Galluzzi, L., et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death and Differentiation. 25 (3), 486-541 (2018).
- Chablais, F., Jaźwińska, A. Induction of myocardial infarction in adult zebrafish using cryoinjury. Journal of Visualized Experiments. (62), e3666 (2012).
- Chablais, F., Jaźwińska, A. The regenerative capacity of the zebrafish heart is dependent on TGFbeta signaling. Development. 139 (11), 1921-1930 (2012).
- Bise, T., Sallin, P., Pfefferli, C., Jaźwińska, A. Multiple cryoinjuries modulate the efficiency of zebrafish heart regeneration. Scientific Reports. 10 (1), 11551 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten